Termodinámica
| Termodinámica |
|---|
 |
La termodinámica es una rama de la física que estudia el calor , el trabajo y la temperatura , y su relación con la energía , la entropía y las propiedades físicas de la materia y la radiación . El comportamiento de estas magnitudes se rige por las cuatro leyes de la termodinámica , que transmiten una descripción cuantitativa utilizando magnitudes físicas macroscópicas mensurables , pero que pueden explicarse en términos de constituyentes microscópicos mediante la mecánica estadística . La termodinámica se aplica a una amplia variedad de temas en ciencia e ingeniería , especialmente química física , bioquímica , ingeniería química e ingeniería mecánica , pero también en otros campos complejos como la meteorología .
Históricamente, la termodinámica se desarrolló a partir del deseo de aumentar la eficiencia de las primeras máquinas de vapor , en particular a través del trabajo del físico francés Sadi Carnot (1824), quien creía que la eficiencia de las máquinas era la clave que podría ayudar a Francia a ganar las guerras napoleónicas . [1] El físico escocés-irlandés Lord Kelvin fue el primero en formular una definición concisa de la termodinámica en 1854 [2] que establecía que "la termodinámica es el tema de la relación del calor con las fuerzas que actúan entre partes contiguas de los cuerpos, y la relación del calor con la acción eléctrica". El físico y matemático alemán Rudolf Clausius reiteró el principio de Carnot conocido como el ciclo de Carnot y dio a la teoría del calor una base más verdadera y sólida. Su artículo más importante, "Sobre la fuerza motriz del calor", [3] publicado en 1850, enunció por primera vez la segunda ley de la termodinámica . En 1865 introdujo el concepto de entropía. En 1870 introdujo el teorema virial , que se aplicó al calor. [4]
La aplicación inicial de la termodinámica a los motores térmicos mecánicos se extendió rápidamente al estudio de los compuestos químicos y las reacciones químicas. La termodinámica química estudia la naturaleza del papel de la entropía en el proceso de las reacciones químicas y ha proporcionado la mayor parte de la expansión y el conocimiento del campo. Surgieron otras formulaciones de la termodinámica. La termodinámica estadística , o mecánica estadística, se ocupa de las predicciones estadísticas del movimiento colectivo de partículas a partir de su comportamiento microscópico. En 1909, Constantin Carathéodory presentó un enfoque puramente matemático en una formulación axiomática , una descripción a menudo denominada termodinámica geométrica .
Introducción
La descripción de cualquier sistema termodinámico se basa en las cuatro leyes de la termodinámica , que forman una base axiomática. La primera ley especifica que la energía puede transferirse entre sistemas físicos como calor , como trabajo y con transferencia de materia. [5] La segunda ley define la existencia de una cantidad llamada entropía , que describe la dirección, termodinámicamente, en la que puede evolucionar un sistema y cuantifica el estado de orden de un sistema y que puede utilizarse para cuantificar el trabajo útil que puede extraerse del sistema. [6]
En termodinámica se estudian y categorizan las interacciones entre grandes conjuntos de objetos. En este sentido, son fundamentales los conceptos de sistema termodinámico y su entorno . Un sistema está compuesto de partículas, cuyos movimientos promedio definen sus propiedades, y esas propiedades están a su vez relacionadas entre sí a través de ecuaciones de estado . Las propiedades se pueden combinar para expresar energía interna y potenciales termodinámicos , que son útiles para determinar las condiciones de equilibrio y los procesos espontáneos .
Con estas herramientas, la termodinámica se puede utilizar para describir cómo responden los sistemas a los cambios en su entorno. Esto se puede aplicar a una amplia variedad de temas en ciencia e ingeniería , como motores , transiciones de fase , reacciones químicas , fenómenos de transporte e incluso agujeros negros . Los resultados de la termodinámica son esenciales para otros campos de la física y para la química , la ingeniería química , la ingeniería de corrosión , la ingeniería aeroespacial , la ingeniería mecánica , la biología celular , la ingeniería biomédica , la ciencia de los materiales y la economía , por nombrar algunos. [7] [8]
Este artículo se centra principalmente en la termodinámica clásica, que estudia principalmente los sistemas en equilibrio termodinámico . La termodinámica fuera del equilibrio suele considerarse una extensión del tratamiento clásico, pero la mecánica estadística ha aportado muchos avances en ese campo.
Historia

La historia de la termodinámica como disciplina científica comienza generalmente con Otto von Guericke , quien, en 1650, construyó y diseñó la primera bomba de vacío del mundo y demostró la existencia del vacío utilizando sus hemisferios de Magdeburgo . Guericke se vio obligado a crear el vacío para refutar la suposición sostenida durante mucho tiempo por Aristóteles de que «la naturaleza aborrece el vacío». Poco después de Guericke, el físico y químico angloirlandés Robert Boyle se enteró de los diseños de Guericke y, en 1656, en coordinación con el científico inglés Robert Hooke , construyó una bomba de aire. [10] Utilizando esta bomba, Boyle y Hooke notaron una correlación entre la presión , la temperatura y el volumen . Con el tiempo, se formuló la Ley de Boyle , que establece que la presión y el volumen son inversamente proporcionales . Luego, en 1679, basándose en estos conceptos, un colaborador de Boyle llamado Denis Papin construyó un digestor de vapor , que era un recipiente cerrado con una tapa hermética que confinaba el vapor hasta que se generaba una alta presión.
Los diseños posteriores incorporaron una válvula de escape de vapor que impedía que la máquina explotara. Al observar cómo la válvula subía y bajaba rítmicamente, Papin concibió la idea de un motor de pistón y cilindro. Sin embargo, no llevó a cabo su diseño. No obstante, en 1697, basándose en los diseños de Papin, el ingeniero Thomas Savery construyó el primer motor, seguido por Thomas Newcomen en 1712. Aunque estos primeros motores eran rudimentarios e ineficientes, atrajeron la atención de los científicos más destacados de la época.
Los conceptos fundamentales de capacidad térmica y calor latente , que fueron necesarios para el desarrollo de la termodinámica, fueron desarrollados por el profesor Joseph Black en la Universidad de Glasgow, donde James Watt trabajaba como fabricante de instrumentos. Black y Watt realizaron experimentos juntos, pero fue Watt quien concibió la idea del condensador externo que resultó en un gran aumento en la eficiencia de la máquina de vapor . [11] Basándose en todo el trabajo anterior llevó a Sadi Carnot , el "padre de la termodinámica", a publicar Reflexiones sobre la fuerza motriz del fuego (1824), un discurso sobre el calor, la potencia, la energía y la eficiencia de la máquina. El libro esbozaba las relaciones energéticas básicas entre la máquina de Carnot , el ciclo de Carnot y la fuerza motriz. Marcó el inicio de la termodinámica como ciencia moderna. [12]
El primer libro de texto de termodinámica fue escrito en 1859 por William Rankine , originalmente formado como físico y profesor de ingeniería civil y mecánica en la Universidad de Glasgow . [13] La primera y la segunda ley de la termodinámica surgieron simultáneamente en la década de 1850, principalmente a partir de los trabajos de William Rankine, Rudolf Clausius y William Thomson (Lord Kelvin). Los fundamentos de la termodinámica estadística fueron establecidos por físicos como James Clerk Maxwell , Ludwig Boltzmann , Max Planck , Rudolf Clausius y J. Willard Gibbs .
Clausius, quien enunció por primera vez las ideas básicas de la segunda ley en su artículo "Sobre la fuerza móvil del calor", [3] publicado en 1850, y es llamado "uno de los padres fundadores de la termodinámica", [14] introdujo el concepto de entropía en 1865.
Durante los años 1873-76 el físico matemático estadounidense Josiah Willard Gibbs publicó una serie de tres artículos, el más famoso de los cuales fue Sobre el equilibrio de sustancias heterogéneas , [15] en el que mostró cómo los procesos termodinámicos , incluidas las reacciones químicas , podían analizarse gráficamente, estudiando la energía , la entropía , el volumen , la temperatura y la presión del sistema termodinámico de tal manera que se pudiera determinar si un proceso ocurriría espontáneamente. [16] También Pierre Duhem en el siglo XIX escribió sobre termodinámica química. [17] A principios del siglo XX, químicos como Gilbert N. Lewis , Merle Randall , [18] y EA Guggenheim [19] [20] aplicaron los métodos matemáticos de Gibbs al análisis de procesos químicos.
Etimología
La termodinámica tiene una etimología compleja. [21]
Si analizamos la palabra a nivel superficial, podemos observar que se compone de dos partes que se remontan al griego antiguo. En primer lugar, la palabra thermo- ("de calor"; utilizada en palabras como termómetro ) se remonta a la raíz θέρμη therme , que significa "calor". En segundo lugar, la palabra dinámica ("ciencia de la fuerza [o poder]") [22] se remonta a la raíz δύναμις dynamis , que significa "poder". [23]
En 1849, William Thomson utiliza el adjetivo termodinámico . [24] [25]
En 1854, Thomson y William Rankine utilizan el sustantivo termodinámica para representar la ciencia de los motores térmicos generalizados. [25] [21]
Pierre Perrot afirma que el término termodinámica fue acuñado por James Joule en 1858 para designar la ciencia de las relaciones entre el calor y la energía, [12] sin embargo, Joule nunca utilizó ese término, sino que utilizó en su lugar el término motor termodinámico perfecto en referencia a la fraseología de Thomson de 1849 [24] . [21]
Ramas de la termodinámica
El estudio de los sistemas termodinámicos se ha desarrollado en varias ramas relacionadas, cada una de las cuales utiliza un modelo fundamental diferente como base teórica o experimental, o aplica los principios a distintos tipos de sistemas.
Termodinámica clásica
La termodinámica clásica es la descripción de los estados de los sistemas termodinámicos en condiciones cercanas al equilibrio, que utiliza propiedades macroscópicas y mensurables. Se utiliza para modelar los intercambios de energía, trabajo y calor basándose en las leyes de la termodinámica . El calificativo clásico refleja el hecho de que representa el primer nivel de comprensión del tema tal como se desarrolló en el siglo XIX y describe los cambios de un sistema en términos de parámetros empíricos macroscópicos (a gran escala y mensurables). Una interpretación microscópica de estos conceptos fue proporcionada posteriormente por el desarrollo de la mecánica estadística .
Mecánica estadística
La mecánica estadística , también conocida como termodinámica estadística, surgió con el desarrollo de las teorías atómicas y moleculares a finales del siglo XIX y principios del XX, y complementó la termodinámica clásica con una interpretación de las interacciones microscópicas entre partículas individuales o estados mecánico-cuánticos. Este campo relaciona las propiedades microscópicas de los átomos y moléculas individuales con las propiedades macroscópicas y en masa de los materiales que se pueden observar a escala humana, explicando así la termodinámica clásica como un resultado natural de la estadística, la mecánica clásica y la teoría cuántica a nivel microscópico.
Termodinámica química
La termodinámica química es el estudio de la interrelación de la energía con las reacciones químicas o con un cambio físico de estado dentro de los límites de las leyes de la termodinámica . El objetivo principal de la termodinámica química es determinar la espontaneidad de una transformación dada. [26]
Termodinámica del equilibrio
La termodinámica del equilibrio es el estudio de las transferencias de materia y energía en sistemas o cuerpos que, por acción de agentes de su entorno, pueden ser llevados de un estado de equilibrio termodinámico a otro. El término "equilibrio termodinámico" indica un estado de equilibrio en el que todos los flujos macroscópicos son cero; en el caso de los sistemas o cuerpos más simples, sus propiedades intensivas son homogéneas y sus presiones son perpendiculares a sus límites. En un estado de equilibrio no hay potenciales desequilibrados, o fuerzas impulsoras, entre partes macroscópicamente distintas del sistema. Un objetivo central de la termodinámica del equilibrio es: dado un sistema en un estado de equilibrio inicial bien definido, y dados sus alrededores, y dadas sus paredes constitutivas, calcular cuál será el estado de equilibrio final del sistema después de que una operación termodinámica específica haya cambiado sus paredes o alrededores.
Termodinámica del no equilibrio
La termodinámica del no equilibrio es una rama de la termodinámica que estudia los sistemas que no se encuentran en equilibrio termodinámico . La mayoría de los sistemas que se encuentran en la naturaleza no se encuentran en equilibrio termodinámico porque no están en estados estacionarios y están sujetos de forma continua y discontinua a flujos de materia y energía hacia y desde otros sistemas. El estudio termodinámico de los sistemas que no se encuentran en equilibrio requiere conceptos más generales que los que aborda la termodinámica del equilibrio. [27] Muchos sistemas naturales aún hoy siguen estando fuera del alcance de los métodos termodinámicos macroscópicos conocidos actualmente.
Leyes de la termodinámica
.jpg/440px-Carnot_engine_(hot_body_-_working_body_-_cold_body).jpg)
La termodinámica se basa principalmente en un conjunto de cuatro leyes que tienen validez universal cuando se aplican a sistemas que se encuentran dentro de las limitaciones implícitas en cada una de ellas. En las diversas descripciones teóricas de la termodinámica, estas leyes pueden expresarse de formas aparentemente diferentes, pero las formulaciones más destacadas son las siguientes.
Ley cero
La ley cero de la termodinámica establece: si dos sistemas están en equilibrio térmico con un tercero, también están en equilibrio térmico entre sí.
Esta afirmación implica que el equilibrio térmico es una relación de equivalencia en el conjunto de sistemas termodinámicos en consideración. Se dice que los sistemas están en equilibrio si los pequeños intercambios aleatorios entre ellos (por ejemplo, el movimiento browniano ) no conducen a un cambio neto en la energía. Esta ley se asume tácitamente en cada medición de temperatura. Por lo tanto, si uno busca decidir si dos cuerpos están a la misma temperatura , no es necesario ponerlos en contacto y medir cualquier cambio de sus propiedades observables en el tiempo. [28] La ley proporciona una definición empírica de la temperatura y una justificación para la construcción de termómetros prácticos.
La ley cero no fue reconocida inicialmente como una ley independiente de la termodinámica, ya que su base en el equilibrio termodinámico estaba implícita en las otras leyes. La primera, la segunda y la tercera leyes ya habían sido enunciadas explícitamente y encontraron aceptación común en la comunidad de físicos antes de que se comprendiera la importancia de la ley cero para la definición de la temperatura. Como no era práctico renumerar las otras leyes, se la denominó ley cero .
Primera ley

La primera ley de la termodinámica establece: En un proceso sin transferencia de materia, el cambio en la energía interna , , de un sistema termodinámico es igual a la energía ganada como calor, , menos el trabajo termodinámico, , realizado por el sistema sobre sus alrededores. [32] [nb 1]
- .
donde denota el cambio en la energía interna de un sistema cerrado (para el cual es posible el calor o el trabajo a través del límite del sistema, pero no es posible la transferencia de materia), denota la cantidad de energía suministrada al sistema como calor y denota la cantidad de trabajo termodinámico realizado por el sistema sobre su entorno. Una afirmación equivalente es que las máquinas de movimiento perpetuo del primer tipo son imposibles; el trabajo realizado por un sistema sobre su entorno requiere que la energía interna del sistema disminuya o se consuma, de modo que la cantidad de energía interna perdida por ese trabajo debe ser reabastecida como calor por una fuente de energía externa o como trabajo por una máquina externa que actúa sobre el sistema (de modo que se recupera) para hacer que el sistema funcione continuamente.
Para los procesos que incluyen transferencia de materia, se necesita una declaración adicional: Teniendo debidamente en cuenta los respectivos estados de referencia fiduciales de los sistemas, cuando dos sistemas, que pueden tener composiciones químicas diferentes, inicialmente separados solo por una pared impermeable y aislados de otro modo, se combinan en un nuevo sistema mediante la operación termodinámica de eliminación de la pared, entonces
- ,
donde U 0 denota la energía interna del sistema combinado, y U 1 y U 2 denotan las energías internas de los respectivos sistemas separados.
Adaptada a la termodinámica, esta ley es una expresión del principio de conservación de la energía , que establece que la energía puede transformarse (cambiarse de una forma a otra), pero no puede crearse ni destruirse. [33]
La energía interna es una propiedad principal del estado termodinámico , mientras que el calor y el trabajo son modos de transferencia de energía mediante los cuales un proceso puede cambiar este estado. Un cambio de energía interna de un sistema puede lograrse mediante cualquier combinación de calor agregado o eliminado y trabajo realizado sobre o por el sistema. Como función del estado , la energía interna no depende de la manera, o del camino a través de pasos intermedios, por el cual el sistema llegó a su estado.
Segunda ley
Una versión tradicional de la segunda ley de la termodinámica establece que el calor no fluye espontáneamente de un cuerpo más frío a uno más caliente.
La segunda ley se refiere a un sistema de materia y radiación, inicialmente con inhomogeneidades en temperatura, presión, potencial químico y otras propiedades intensivas , que se deben a 'restricciones' internas, o paredes rígidas impermeables, dentro de él, o a fuerzas impuestas externamente. La ley observa que, cuando el sistema está aislado del mundo exterior y de esas fuerzas, hay una cantidad termodinámica definida, su entropía , que aumenta a medida que se eliminan las restricciones, y finalmente alcanza un valor máximo en el equilibrio termodinámico, cuando las inhomogeneidades prácticamente desaparecen. Para los sistemas que están inicialmente lejos del equilibrio termodinámico, aunque se han propuesto varios, no se conoce ningún principio físico general que determine las tasas de aproximación al equilibrio termodinámico, y la termodinámica no se ocupa de tales tasas. Las muchas versiones de la segunda ley expresan todas la irreversibilidad general de las transiciones involucradas en los sistemas que se aproximan al equilibrio termodinámico.
En termodinámica macroscópica, la segunda ley es una observación básica aplicable a cualquier proceso termodinámico real; en termodinámica estadística, se postula que la segunda ley es una consecuencia del caos molecular.
Tercera ley
La tercera ley de la termodinámica establece: Cuando la temperatura de un sistema se acerca al cero absoluto, todos los procesos cesan y la entropía del sistema se acerca a un valor mínimo.
Esta ley de la termodinámica es una ley estadística de la naturaleza que se refiere a la entropía y a la imposibilidad de alcanzar el cero absoluto de temperatura. Esta ley proporciona un punto de referencia absoluto para la determinación de la entropía. La entropía determinada en relación con este punto es la entropía absoluta. Otras definiciones incluyen "la entropía de todos los sistemas y de todos los estados de un sistema es mínima en el cero absoluto" o, equivalentemente, "es imposible alcanzar el cero absoluto de temperatura mediante un número finito de procesos".
El cero absoluto, en el que se detendría toda actividad si fuera posible alcanzarlo, es -273,15 °C (grados Celsius), o -459,67 °F (grados Fahrenheit), o 0 K (kelvin), o 0° R (grados Rankine ).
Modelos de sistemas
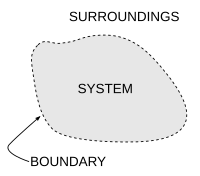
Un concepto importante en termodinámica es el de sistema termodinámico , que es una región del universo en estudio definida con precisión. Todo lo que hay en el universo excepto el sistema se denomina entorno . Un sistema está separado del resto del universo por un límite que puede ser físico o nocional, pero que sirve para confinar el sistema a un volumen finito. Los segmentos del límite se describen a menudo como paredes ; tienen respectivas "permeabilidades" definidas. Las transferencias de energía como trabajo , o como calor , o de materia , entre el sistema y el entorno, tienen lugar a través de las paredes, de acuerdo con sus respectivas permeabilidades.
La materia o energía que pasa a través del límite para producir un cambio en la energía interna del sistema debe tenerse en cuenta en la ecuación de balance de energía. El volumen contenido por las paredes puede ser la región que rodea a un solo átomo de energía resonante, como Max Planck definió en 1900; puede ser un cuerpo de vapor o aire en una máquina de vapor , como Sadi Carnot definió en 1824. El sistema también podría ser solo un nucleido (es decir, un sistema de quarks ) como se hipotetiza en la termodinámica cuántica . Cuando se adopta un punto de vista más flexible y se abandona el requisito del equilibrio termodinámico, el sistema puede ser el cuerpo de un ciclón tropical , como Kerry Emanuel teorizó en 1986 en el campo de la termodinámica atmosférica , o el horizonte de eventos de un agujero negro .
Los límites son de cuatro tipos: fijos, móviles, reales e imaginarios. Por ejemplo, en un motor, un límite fijo significa que el pistón está bloqueado en su posición, dentro de la cual podría ocurrir un proceso de volumen constante. Si se permite que el pistón se mueva, ese límite es móvil, mientras que los límites del cilindro y la culata son fijos. En los sistemas cerrados, los límites son reales, mientras que en los sistemas abiertos los límites suelen ser imaginarios. En el caso de un motor a reacción, se podría suponer un límite imaginario fijo en la entrada del motor, límites fijos a lo largo de la superficie de la carcasa y un segundo límite imaginario fijo a lo largo de la tobera de escape.
En general, la termodinámica distingue tres clases de sistemas, definidos en términos de lo que se permite que cruce sus límites:
| Tipo de sistema | Flujo de masa | Trabajar | Calor |
|---|---|---|---|
| Abierto |  Y Y |  Y Y |  Y Y |
| Cerrado |  N N |  Y Y |  Y Y |
| Aislado térmicamente |  N N |  Y Y |  N N |
| Aislado mecánicamente |  N N |  N N |  Y Y |
| Aislado |  N N |  N N |  N N |
A medida que pasa el tiempo en un sistema aislado, las diferencias internas de presión, densidad y temperatura tienden a equilibrarse. Se dice que un sistema en el que se han completado todos los procesos de igualación se encuentra en un estado de equilibrio termodinámico .
Una vez que se alcanza el equilibrio termodinámico, las propiedades de un sistema son, por definición, invariables en el tiempo. Los sistemas en equilibrio son mucho más simples y fáciles de entender que los sistemas que no lo están. A menudo, al analizar un proceso termodinámico dinámico, se parte del supuesto simplificador de que cada estado intermedio del proceso está en equilibrio, lo que produce procesos termodinámicos que se desarrollan tan lentamente que permiten que cada paso intermedio sea un estado de equilibrio y se dice que son procesos reversibles .
Estados y procesos
Cuando un sistema está en equilibrio bajo un conjunto dado de condiciones, se dice que está en un estado termodinámico definido . El estado del sistema puede describirse mediante una serie de magnitudes de estado que no dependen del proceso por el cual el sistema llegó a su estado. Se denominan variables intensivas o variables extensivas según cómo cambien cuando cambia el tamaño del sistema. Las propiedades del sistema pueden describirse mediante una ecuación de estado que especifica la relación entre estas variables. El estado puede considerarse como la descripción cuantitativa instantánea de un sistema con un número determinado de variables que se mantienen constantes.
Un proceso termodinámico puede definirse como la evolución energética de un sistema termodinámico que procede de un estado inicial a un estado final. Puede describirse mediante magnitudes de proceso . Normalmente, cada proceso termodinámico se distingue de otros procesos en su carácter energético según qué parámetros, como la temperatura, la presión o el volumen, etc., se mantienen fijos; además, es útil agrupar estos procesos en pares, en los que cada variable que se mantiene constante es un miembro de un par conjugado .
Algunos procesos termodinámicos comúnmente estudiados son:
- Proceso adiabático : ocurre sin pérdida ni ganancia de energía por calor.
- Proceso isentálpico : ocurre a una entalpía constante.
- Proceso isentrópico : un proceso adiabático reversible, que ocurre a una entropía constante.
- Proceso isobárico : ocurre a presión constante.
- Proceso isocórico : ocurre a volumen constante (también llamado isométrico/isovolumétrico)
- Proceso isotérmico : ocurre a temperatura constante.
- Proceso de estado estacionario : ocurre sin un cambio en la energía interna.
Instrumentación
Existen dos tipos de instrumentos termodinámicos : el medidor y el reservorio. Un medidor termodinámico es cualquier dispositivo que mide cualquier parámetro de un sistema termodinámico . En algunos casos, el parámetro termodinámico se define en términos de un instrumento de medición idealizado. Por ejemplo, la ley cero establece que si dos cuerpos están en equilibrio térmico con un tercer cuerpo, también están en equilibrio térmico entre sí. Este principio, como señaló James Maxwell en 1872, afirma que es posible medir la temperatura. Un termómetro idealizado es una muestra de un gas ideal a presión constante. A partir de la ley de los gases ideales pV=nRT , el volumen de dicha muestra se puede utilizar como indicador de temperatura; de esta manera define la temperatura. Aunque la presión se define mecánicamente, un dispositivo de medición de presión, llamado barómetro , también se puede construir a partir de una muestra de un gas ideal mantenido a una temperatura constante. Un calorímetro es un dispositivo que se utiliza para medir y definir la energía interna de un sistema.
Un depósito termodinámico es un sistema que es tan grande que sus parámetros de estado no se alteran apreciablemente cuando se pone en contacto con el sistema de interés. Cuando el depósito se pone en contacto con el sistema, el sistema se pone en equilibrio con el depósito. Por ejemplo, un depósito de presión es un sistema a una presión particular, que impone esa presión sobre el sistema al que está conectado mecánicamente. La atmósfera de la Tierra se utiliza a menudo como depósito de presión. El océano puede actuar como depósito de temperatura cuando se utiliza para enfriar plantas de energía.
Variables conjugadas
El concepto central de la termodinámica es el de energía , la capacidad de realizar trabajo . Según la primera ley , la energía total de un sistema y su entorno se conserva. La energía puede transferirse a un sistema mediante calentamiento, compresión o adición de materia, y extraerse de un sistema mediante enfriamiento, expansión o extracción de materia. En mecánica , por ejemplo, la transferencia de energía es igual al producto de la fuerza aplicada a un cuerpo y el desplazamiento resultante.
Las variables conjugadas son pares de conceptos termodinámicos, siendo el primero similar a una "fuerza" aplicada a un sistema termodinámico , el segundo similar al "desplazamiento" resultante y el producto de los dos igual a la cantidad de energía transferida. Las variables conjugadas comunes son:
- Presión - volumen (los parámetros mecánicos );
- Temperatura - entropía (parámetros térmicos);
- Potencial químico - número de partículas (parámetros del material).
Potenciales
Los potenciales termodinámicos son diferentes medidas cuantitativas de la energía almacenada en un sistema. Los potenciales se utilizan para medir los cambios de energía en los sistemas a medida que evolucionan desde un estado inicial a un estado final. El potencial utilizado depende de las restricciones del sistema, como la temperatura o la presión constantes. Por ejemplo, las energías de Helmholtz y Gibbs son las energías disponibles en un sistema para realizar trabajo útil cuando la temperatura y el volumen o la presión y la temperatura son fijos, respectivamente. Los potenciales termodinámicos no se pueden medir en laboratorios, pero se pueden calcular utilizando la termodinámica molecular. [34] [35]
Los cinco potenciales más conocidos son:
| Nombre | Símbolo | Fórmula | Variables naturales |
|---|---|---|---|
| Energía interna | |||
| Energía libre de Helmholtz | |||
| Entalpía | |||
| Energía libre de Gibbs | |||
| Potencial de Landau, o gran potencial | , |
donde es la temperatura , la entropía , la presión , el volumen , el potencial químico , el número de partículas en el sistema y es el recuento de tipos de partículas en el sistema.
Los potenciales termodinámicos se pueden derivar de la ecuación de balance de energía aplicada a un sistema termodinámico. También se pueden obtener otros potenciales termodinámicos mediante la transformación de Legendre .
Termodinámica axiomática
La termodinámica axiomática es una disciplina matemática que tiene como objetivo describir la termodinámica en términos de axiomas rigurosos , por ejemplo, encontrando una forma matemáticamente rigurosa de expresar las leyes familiares de la termodinámica .
El primer intento de una teoría axiomática de la termodinámica fue la obra de Constantin Carathéodory de 1909 Investigaciones sobre los fundamentos de la termodinámica , que hizo uso de los sistemas pfaffianos y el concepto de accesibilidad adiabática , una noción que fue introducida por el propio Carathéodory. [36] [37] En esta formulación, los conceptos termodinámicos como el calor , la entropía y la temperatura se derivan de cantidades que son más directamente mensurables. [38] Las teorías que vinieron después, diferían en el sentido de que hacían suposiciones sobre los procesos termodinámicos con estados iniciales y finales arbitrarios, en lugar de considerar solo los estados vecinos.
Campos aplicados
- Termodinámica atmosférica
- Termodinámica biológica
- Termodinámica de los agujeros negros
- Termodinámica química
- Termodinámica clásica
- Termodinámica del equilibrio
- Ecología industrial (re: Exergía )
- Termodinámica de máxima entropía
- Termodinámica del no equilibrio
- Filosofía de la física térmica y estadística
- Psicrometría
- Termodinámica cuántica
- Termodinámica estadística , es decir, mecánica estadística.
- Termoeconomía
- Química de polímeros
Véase también
Listas y cronogramas
- Lista de publicaciones importantes en termodinámica [ broken anchor ]
- Lista de libros de texto sobre termodinámica y mecánica estadística
- Lista de conductividades térmicas
- Lista de propiedades termodinámicas
- Tabla de ecuaciones termodinámicas
- Cronología de la termodinámica
- Ecuaciones termodinámicas
Notas
- ^ La convención de signos (Q es el calor suministrado al sistema, W es el trabajo realizado por el sistema) es la de Rudolf Clausius . La convención de signos opuesta es habitual en la termodinámica química.
Referencias
- ^ Clausius, Rudolf (1850). Sobre la fuerza motriz del calor y sobre las leyes que pueden deducirse de ella para la teoría del calor . Annalen der Physik de Poggendorff, LXXIX (reimpresión de Dover). ISBN 978-0-486-59065-3.
- ^ William Thomson, LL.DDCL, FRS (1882). Documentos matemáticos y físicos. Vol. 1. Londres, Cambridge: CJ Clay, MA & Son, Cambridge University Press. pág. 232. ISBN 978-0-598-96004-7Archivado del original el 18 de abril de 2021 . Consultado el 2 de noviembre de 2020 .
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ ab Clausius, R. (1867). La teoría mecánica del calor: con sus aplicaciones a la máquina de vapor y a las propiedades físicas de los cuerpos. Londres: John van Voorst . Consultado el 19 de junio de 2012.
ediciones:PwR_Sbkwa8IC.
Contiene traducciones al inglés de muchas de sus otras obras. - ^ Clausius, RJE (1870). "Sobre un teorema mecánico aplicable al calor". Revista filosófica . 4.ª serie. 40 : 122–127.
- ^ Van Ness, HC (1983) [1969]. Entendiendo la termodinámica . Dover Publications, Inc. ISBN 9780486632773.OCLC 8846081 .
- ^ Dugdale, JS (1998). Entropía y su significado físico . Taylor y Francis. ISBN 978-0-7484-0569-5.OCLC 36457809 .
- ^ Smith, JM; Van Ness, HC; Abbott, MM (2005). Introducción a la termodinámica en ingeniería química (PDF) . Vol. 27 (7.ª ed.). pág. 584. Código Bibliográfico :1950JChEd..27..584S. doi :10.1021/ed027p584.3. ISBN. 978-0-07-310445-4.OCLC 56491111 .
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Haynie, Donald T. (2001). Termodinámica biológica . Cambridge University Press. ISBN 978-0-521-79549-4.OCLC 43993556 .
- ^ Escuelas de termodinámica Archivado el 7 de diciembre de 2017 en Wayback Machine – EoHT.info.
- ^ Partington, JR (1989). Una breve historia de la química . Dover. OCLC 19353301.
- ^ El motor de Newcomen fue mejorado desde 1711 hasta el trabajo de Watt, por lo que la comparación de eficiencia está sujeta a reservas, pero el aumento con respecto a la versión de 1865 fue del orden del 100%.
- ^ ab Perrot, Pierre (1998). De la A a la Z de la termodinámica . Oxford University Press. ISBN 978-0-19-856552-9.OCLC 123283342 .
- ^ Cengel, Yunus A.; Boles, Michael A. (2005). Termodinámica: un enfoque de ingeniería . McGraw-Hill. ISBN 978-0-07-310768-4.
- ^ Cardwell, DSL (1971), De Watt a Clausius: El auge de la termodinámica en la era industrial temprana , Londres: Heinemann, ISBN 978-0-435-54150-7
- ^ Gibbs, Willard, J. (1874–1878). Transacciones de la Academia de Artes y Ciencias de Connecticut. Vol. III. New Haven. págs. 108–248, 343–524.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Gibbs, Willard (1993). Los artículos científicos de J. Willard Gibbs, volumen uno: Termodinámica . Ox Bow Press. ISBN 978-0-918024-77-0.OCLC 27974820 .
- ^ Duhem, PMM (1886). Le Potential Thermodynamique et ses Applications , Hermann, París.
- ^ Lewis, Gilbert N.; Randall, Merle (1923). Termodinámica y energía libre de sustancias químicas. McGraw-Hill Book Co. Inc.
- ^ Guggenheim, EA (1933). Termodinámica moderna según los métodos de J. W. Gibbs , Methuen, Londres.
- ^ Guggenheim, EA (1949/1967). Termodinámica. Un tratamiento avanzado para químicos y físicos , 1.ª edición, 1949, 5.ª edición, 1967, Holanda Septentrional, Ámsterdam.
- ^ abc «Termodinámica (etimología)». EoHT.info. Archivado desde el original el 29 de octubre de 2023. Consultado el 29 de octubre de 2023 .
- ^ Thompson, Silvanus (1910). La vida de William Thomson, barón Kelvin de Largs. Vol. 1. MacMillan and Co., Limited. p. 241.
El tema fundamental de la filosofía natural es la dinámica, o la
ciencia de la fuerza
... Todo fenómeno de la naturaleza es una manifestación de la fuerza.
- ^ Donald T. Haynie (2008). Termodinámica biológica (2.ª ed.). Cambridge University Press. pág. 26.
- ^ ab Kelvin, William T. (1849) "An Account of Carnot's Theory of the Motive Power of Heat – with Numerical Results Deduced from Regnault's Experiments on Steam" (Una explicación de la teoría de Carnot sobre la fuerza motriz del calor, con resultados numéricos deducidos de los experimentos de Regnault con vapor). Transactions of the Edinburg Royal Society, XVI. 2 de enero. Copia escaneada. Archivado el 24 de julio de 2017 en Wayback Machine.
- ^ ab Smith, Crosbie W. (1977). "William Thomson y la creación de la termodinámica: 1840-1855". Archivo de Historia de las Ciencias Exactas . 16 (3): 231–288. doi :10.1007/BF00328156. ISSN 0003-9519. JSTOR 41133471. S2CID 36609995.
- ^ Klotz, Irving (2008). Termodinámica química: teoría básica y métodos . Hoboken, Nueva Jersey: John Wiley & Sons, Inc., pág. 4. ISBN 978-0-471-78015-1.
- ^ Pokrovskii, Vladimir (2020). Termodinámica de sistemas complejos: principios y aplicaciones . IOP Publishing, Bristol, Reino Unido. Código Bibliográfico :2020tcsp.book.....P.
- ^ Moran, Michael J. y Howard N. Shapiro, 2008. Fundamentos de termodinámica en ingeniería . 6.ª ed. Wiley and Sons: 16.
- ^ "Vino espumoso, champán y compañía - Parte 2". Vino espumoso, champán y compañía . Chemistry Europe (chemistryviews.org). 17 de diciembre de 2010. Consultado el 17 de abril de 2023 .
- ^ Klaus Roth: Sekt, Champagner & Co. So prickelnd kann Chemie sein en Chemie unserer Zeit 8. Diciembre de 2009: vol. 43, Número 6, S. 418-432 doi:10.1002/ciuz.200900520
- ^ Klaus Roth: Chemische Köstlichkeiten , Wiley-VCH Verlag GmbH & Co. KGaA, 2010, ISBN 978-3527327522, pág.47
- ^ Bailyn, M. (1994). Un estudio de la termodinámica , Instituto Americano de Física, AIP Press, Woodbury NY, ISBN 0883187973 , pág. 79.
- ^ Callen, HB (1960/1985). Termodinámica y una introducción a la termoestadística , segunda edición, John Wiley & Sons, Hoboken NY, ISBN 9780471862567 , págs. 11–13.
- ^ Graben, HW; Ray, John R. (10 de diciembre de 1993). "Ocho sistemas físicos de termodinámica, mecánica estadística y simulaciones por computadora". Física molecular . 80 (5): 1183–1193. Código Bibliográfico :1993MolPh..80.1183G. doi :10.1080/00268979300102971. ISSN 0026-8976.
- ^ Nitzke, Isabel; Stephan, Simon; Vrabec, Jadran (3 de junio de 2024). "Topología de potenciales termodinámicos utilizando modelos físicos: Helmholtz, Gibbs, Grand y Null". The Journal of Chemical Physics . 160 (21). Bibcode :2024JChPh.160u4104N. doi :10.1063/5.0207592. ISSN 0021-9606. PMID 38828811.
- ^ Carathéodory, C. (1909). "Untersuchungen über die Grundlagen der Thermodynamik". Mathematische Annalen (en alemán). 67 (3): 355–386. doi :10.1007/BF01450409. ISSN 0025-5831. S2CID 118230148.
- ^ Frankel, Theodore (2004). La geometría de la física: una introducción (segunda edición). Cambridge University Press. ISBN 9780521539272.
- ^ Rastall, Peter (1 de octubre de 1970). "Termodinámica clásica simplificada". Journal of Mathematical Physics . 11 (10): 2955–2965. Bibcode :1970JMP....11.2955R. doi :10.1063/1.1665080. ISSN 0022-2488.
Lectura adicional
- Goldstein, Martin e Inge F. (1993). El refrigerador y el universo . Harvard University Press. ISBN 978-0-674-75325-9.OCLC 32826343 .Una introducción no técnica, buena en cuestiones históricas e interpretativas.
- Kazakov, Andrei; Muzny, Chris D.; Chirico, Robert D.; Diky, Vladimir V.; Frenkel, Michael (2008). "Web Thermo Tables – una versión en línea de las tablas termodinámicas TRC". Revista de investigación del Instituto Nacional de Normas y Tecnología . 113 (4): 209–220. doi :10.6028/jres.113.016. ISSN 1044-677X. PMC 4651616 . PMID 27096122.
- Gibbs JW (1928). Obras completas de J. Willard Gibbs Termodinámica . Nueva York: Longmans, Green and Co.Vol. 1, págs. 55–349.
- Guggenheim EA (1933). Termodinámica moderna según los métodos de Willard Gibbs . Londres: Methuen & co. ltd.
- Denbigh K. (1981). Los principios del equilibrio químico: con aplicaciones en química e ingeniería química . Londres: Cambridge University Press.
- Stull, DR, Westrum Jr., EF y Sinke, GC (1969). Termodinámica química de compuestos orgánicos . Londres: John Wiley and Sons, Inc.
{{cite book}}: CS1 maint: multiple names: authors list (link) - Bazarov IP (2010). Termodinámica: libro de texto . San Petersburgo: Editorial Lan. p. 384. ISBN 978-5-8114-1003-3.5ª ed. (en ruso)
- Bawendi Moungi G., Alberty Robert A. y Silbey Robert J. (2004). Química física . J. Wiley & Sons, Incorporated.
- Alberty Robert A. (2003). Termodinámica de reacciones bioquímicas . Wiley-Interscience.
- Alberty Robert A. (2006). Termodinámica bioquímica: aplicaciones de Mathematica . Vol. 48. John Wiley & Sons, Inc., págs. 1–458. ISBN 978-0-471-75798-6. Número de identificación personal 16878778.
{{cite book}}:|journal=ignorado ( ayuda ) - Dill Ken A., Bromberg Sarina (2011). Fuerzas impulsoras moleculares: termodinámica estadística en biología, química, física y nanociencia . Garland Science. ISBN 978-0-8153-4430-8.
- M. Scott Shell (2015). Termodinámica y mecánica estadística: un enfoque integrado . Cambridge University Press. ISBN 978-1107656789.
- Douglas E. Barrick (2018). Termodinámica biomolecular: de la teoría a las aplicaciones . CRC Press. ISBN 978-1-4398-0019-5.
Los siguientes títulos son más técnicos:
- Bejan, Adrian (2016). Termodinámica avanzada para ingeniería (4.ª edición). Wiley. ISBN 978-1-119-05209-8.
- Cengel, Yunus A., y Boles, Michael A. (2002). Termodinámica: un enfoque de ingeniería . McGraw Hill. ISBN 978-0-07-238332-4.OCLC 45791449 .
{{cite book}}: CS1 maint: multiple names: authors list (link) - Dunning-Davies, Jeremy (1997). Termodinámica concisa: principios y aplicaciones . Horwood Publishing. ISBN 978-1-8985-6315-0.OCLC 36025958 .
- Kroemer, Herbert y Kittel, Charles (1980). Física térmica . WH Freeman Company. ISBN 978-0-7167-1088-2.OCLC 32932988 .
Enlaces externos
- Callendar, Hugh Longbourne (1911). . Encyclopædia Britannica . Vol. 26 (11.ª ed.). Págs. 808–814.
- Sitios web de cálculo de propiedades y datos de termodinámica
- Sitios web educativos sobre termodinámica
- Bioquímica Termodinámica
- Termodinámica y mecánica estadística
- Termodinámica en ingeniería: un enfoque gráfico
- Termodinámica y mecánica estadística de Richard Fitzpatrick














































