Yodo
El yodo es un elemento químico de símbolo I y número atómico 53. Es el más pesado de los halógenos estables y existe en condiciones estándar como un sólido semibrillante, no metálico, que se funde para formar un líquido violeta intenso a 114 °C (237 °F) y hierve hasta convertirse en un gas violeta a 184 °C (363 °F). El elemento fue descubierto por el químico francés Bernard Courtois en 1811 y fue nombrado dos años después por Joseph Louis Gay-Lussac , en honor al griego antiguo Ιώδης , que significa "violeta".
El yodo se presenta en muchos estados de oxidación, incluidos el yoduro (I − ), el yodato ( IO−
3) y los diversos aniones peryodato . Como el nutriente mineral esencial más pesado , el yodo es necesario para la síntesis de hormonas tiroideas . [7] La deficiencia de yodo afecta a unos dos mil millones de personas y es la principal causa prevenible de discapacidades intelectuales . [8]
Los principales productores de yodo en la actualidad son Chile y Japón . Debido a su alto número atómico y a su fácil adhesión a compuestos orgánicos , también ha encontrado aceptación como material de contraste radiológico no tóxico . Debido a la especificidad de su absorción por el cuerpo humano, los isótopos radiactivos del yodo también se pueden utilizar para tratar el cáncer de tiroides . El yodo también se utiliza como catalizador en la producción industrial de ácido acético y algunos polímeros .
Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud . [9]
Historia

En 1811, el químico francés Bernard Courtois , [10] [11] que nació en una familia de fabricantes de salitre (un componente esencial de la pólvora ), descubrió el yodo . En la época de las guerras napoleónicas , el salitre tenía una gran demanda en Francia . El salitre producido a partir de lechos de nitro franceses requería carbonato de sodio , que podía aislarse de las algas recolectadas en las costas de Normandía y Bretaña . Para aislar el carbonato de sodio, se quemaban las algas y se lavaban las cenizas con agua. Los residuos restantes se destruían añadiendo ácido sulfúrico . Courtois añadió una vez ácido sulfúrico en exceso y se levantó una nube de vapor violeta. Observó que el vapor cristalizaba en superficies frías, formando cristales negros oscuros. [12] Courtois sospechaba que este material era un elemento nuevo, pero carecía de fondos para investigarlo más a fondo. [13]
Courtois dio muestras a sus amigos, Charles Bernard Desormes (1777-1838) y Nicolas Clément (1779-1841), para continuar la investigación. También dio parte de la sustancia al químico Joseph Louis Gay-Lussac (1778-1850) y al físico André-Marie Ampère (1775-1836). El 29 de noviembre de 1813, Desormes y Clément hicieron público el descubrimiento de Courtois al describir la sustancia en una reunión del Instituto Imperial de Francia . [14] El 6 de diciembre de 1813, Gay-Lussac descubrió y anunció que la nueva sustancia era un elemento o un compuesto de oxígeno y descubrió que era un elemento. [15] [16] [17] Gay-Lussac sugirió el nombre "yodo" ( anglicismo "yodo"), del griego antiguo Ιώδης ( iodēs , "violeta"), debido al color del vapor de yodo. [10] [15] Ampère había dado parte de su muestra al químico británico Humphry Davy (1778-1829), quien experimentó con la sustancia y notó su similitud con el cloro y también lo encontró como un elemento. [18] Davy envió una carta fechada el 10 de diciembre a la Royal Society de Londres indicando que había identificado un nuevo elemento llamado yodo. [19] Surgieron discusiones entre Davy y Gay-Lussac sobre quién identificó primero el yodo, pero ambos científicos descubrieron que ambos identificaron el yodo primero y también sabían que Courtois fue el primero en aislar el elemento. [13]
En 1873, el investigador médico francés Casimir Davaine (1812-1882) descubrió la acción antiséptica del yodo. [20] Antonio Grossich (1849-1926), un cirujano nacido en Istria, fue uno de los primeros en utilizar la esterilización del campo operatorio. En 1908, introdujo la tintura de yodo como una forma de esterilizar rápidamente la piel humana en el campo quirúrgico. [21]
En las primeras tablas periódicas , al yodo se le solía dar el símbolo J , por Jod , su nombre en alemán ; en los textos alemanes, J todavía se usa con frecuencia en lugar de I. [22]
Propiedades

El yodo es el cuarto halógeno , siendo miembro del grupo 17 en la tabla periódica, por debajo del flúor , cloro y bromo ; dado que el astato y el tenesino son radiactivos, el yodo es el halógeno estable más pesado. El yodo tiene una configuración electrónica de [Kr]4d 10 5s 2 5p 5 , y los siete electrones de la quinta y más externa capa son sus electrones de valencia . Al igual que los demás halógenos, le falta un electrón para completar un octeto y, por lo tanto, es un agente oxidante que reacciona con muchos elementos para completar su capa externa, aunque de acuerdo con las tendencias periódicas , es el agente oxidante más débil entre los halógenos estables: tiene la electronegatividad más baja entre ellos, solo 2,66 en la escala de Pauling (compárese el flúor, el cloro y el bromo con 3,98, 3,16 y 2,96 respectivamente; el astato continúa la tendencia con una electronegatividad de 2,2). El yodo elemental forma moléculas diatómicas con la fórmula química I 2 , donde dos átomos de yodo comparten un par de electrones para lograr cada uno un octeto estable para sí mismos; a altas temperaturas, estas moléculas diatómicas disocian reversiblemente un par de átomos de yodo. De manera similar, el anión yoduro, I − , es el agente reductor más fuerte entre los halógenos estables, siendo el más fácilmente oxidado de nuevo a I 2 diatómico . [23] (El astato va más allá, siendo de hecho inestable como At − y fácilmente oxidado a At 0 o At + .) [24]
Los halógenos se oscurecen a medida que el grupo desciende: el flúor es amarillo muy pálido, el cloro es amarillo verdoso, el bromo es marrón rojizo y el yodo es violeta.
El yodo elemental es ligeramente soluble en agua, un gramo se disuelve en 3450 mL a 20 °C y 1280 mL a 50 °C; se puede añadir yoduro de potasio para aumentar la solubilidad mediante la formación de iones triyoduro , entre otros poliyoduros. [25] Los disolventes no polares como el hexano y el tetracloruro de carbono proporcionan una mayor solubilidad. [26] Las soluciones polares, como las acuosas, son marrones, lo que refleja el papel de estos disolventes como bases de Lewis ; por otro lado, las soluciones no polares son violetas, el color del vapor de yodo. [25] Los complejos de transferencia de carga se forman cuando el yodo se disuelve en disolventes polares, por lo que cambia el color. El yodo es violeta cuando se disuelve en tetracloruro de carbono e hidrocarburos saturados, pero marrón oscuro en alcoholes y aminas , disolventes que forman aductos de transferencia de carga. [27]
Los puntos de fusión y ebullición del yodo son los más altos entre los halógenos, de acuerdo con la tendencia creciente hacia abajo en el grupo, ya que el yodo tiene la nube de electrones más grande entre ellos que es la más fácilmente polarizada, lo que resulta en que sus moléculas tengan las interacciones de Van der Waals más fuertes entre los halógenos. De manera similar, el yodo es el menos volátil de los halógenos, aunque aún se puede observar que el sólido emite vapor púrpura. [23] Debido a esta propiedad, el yodo se usa comúnmente para demostrar la sublimación directamente de sólido a gas , lo que da lugar a la idea errónea de que no se funde a presión atmosférica . [28] Debido a que tiene el radio atómico más grande entre los halógenos, el yodo tiene la energía de primera ionización más baja , la afinidad electrónica más baja , la electronegatividad más baja y la reactividad más baja de los halógenos. [23]
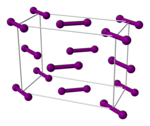
El enlace interhalogenado en el diyodo es el más débil de todos los halógenos. Como tal, el 1% de una muestra de yodo gaseoso a presión atmosférica se disocia en átomos de yodo a 575 °C. Se requieren temperaturas superiores a 750 °C para que el flúor, el cloro y el bromo se disocien en un grado similar. La mayoría de los enlaces con el yodo son más débiles que los enlaces análogos con los halógenos más ligeros. [23] El yodo gaseoso está compuesto de moléculas de I 2 con una longitud de enlace I–I de 266,6 pm. El enlace I–I es uno de los enlaces simples más largos conocidos. Es incluso más largo (271,5 pm) en el yodo cristalino ortorrómbico sólido , que tiene la misma estructura cristalina que el cloro y el bromo. (El récord lo ostenta el xenón, vecino del yodo : la longitud del enlace Xe–Xe es de 308,71 pm.) [29] Como tal, dentro de la molécula de yodo, ocurren interacciones electrónicas significativas con los dos vecinos más próximos de cada átomo, y estas interacciones dan lugar, en el yodo en masa, a un aspecto brillante y propiedades semiconductoras . [23] El yodo es un semiconductor bidimensional con un intervalo de banda de 1,3 eV (125 kJ/mol): es un semiconductor en el plano de sus capas cristalinas y un aislante en la dirección perpendicular. [23]
Isótopos
De los cuarenta isótopos conocidos del yodo , sólo uno se encuentra en la naturaleza, el yodo-127 . Los demás son radiactivos y tienen vidas medias demasiado cortas para ser primordiales . Como tal, el yodo es a la vez monoisotópico y mononucleídico y su peso atómico se conoce con gran precisión, ya que es una constante de la naturaleza. [23]
El isótopo radiactivo del yodo de vida más larga es el yodo-129 , que tiene una vida media de 15,7 millones de años, desintegrándose por desintegración beta en xenón -129 estable. [30] Algo de yodo-129 se formó junto con yodo-127 antes de la formación del Sistema Solar, pero ahora se ha desintegrado por completo, lo que lo convierte en un radionúclido extinto . Su presencia anterior puede determinarse a partir de un exceso de su hijo xenón-129, pero los primeros intentos [31] de usar esta característica para datar la fuente de supernova para elementos en el Sistema Solar se ven dificultados por procesos nucleares alternativos que dan yodo-129 y por la volatilidad del yodo a temperaturas más altas. [32] Debido a su movilidad en el medio ambiente, el yodo-129 se ha utilizado para datar aguas subterráneas muy antiguas. [33] [34] Hoy en día todavía existen trazas de yodo-129, ya que también es un nucleido cosmogénico , formado a partir de la espalación de rayos cósmicos del xenón atmosférico: estas trazas constituyen entre 10 −14 y 10 −10 de todo el yodo terrestre. También se produce a partir de pruebas nucleares al aire libre y no es peligroso debido a su vida media muy larga, la más larga de todos los productos de fisión. En el auge de las pruebas termonucleares en los años 1960 y 1970, el yodo-129 todavía constituía solo alrededor de 10 −7 de todo el yodo terrestre. [35] Los estados excitados del yodo-127 y el yodo-129 se utilizan a menudo en la espectroscopia Mössbauer . [23]
Los otros radioisótopos de yodo tienen vidas medias mucho más cortas, no más largas que días. [30] Algunos de ellos tienen aplicaciones médicas que involucran la glándula tiroides , donde el yodo que ingresa al cuerpo se almacena y se concentra. El yodo-123 tiene una vida media de trece horas y se desintegra por captura de electrones a telurio-123 , emitiendo radiación gamma ; se utiliza en imágenes de medicina nuclear , incluyendo tomografías computarizadas por emisión de fotón único (SPECT) y tomografías computarizadas de rayos X (TC de rayos X). [36] El yodo-125 tiene una vida media de cincuenta y nueve días, desintegrándose por captura de electrones a telurio-125 y emitiendo radiación gamma de baja energía; El segundo radioisótopo de yodo de vida más larga, tiene usos en ensayos biológicos , imágenes de medicina nuclear y en radioterapia como braquiterapia para tratar una serie de afecciones, incluido el cáncer de próstata , los melanomas uveales y los tumores cerebrales . [37] Finalmente, el yodo-131 , con una vida media de ocho días, se desintegra beta a un estado excitado de xenón-131 estable que luego se convierte al estado fundamental emitiendo radiación gamma. Es un producto de fisión común y, por lo tanto, está presente en altos niveles en la lluvia radiactiva . Luego puede absorberse a través de alimentos contaminados y también se acumulará en la tiroides. A medida que se desintegra, puede causar daño a la tiroides. El riesgo principal de la exposición a altos niveles de yodo-131 es la aparición casual de cáncer de tiroides radiogénico en etapas posteriores de la vida. Otros riesgos incluyen la posibilidad de crecimientos no cancerosos y tiroiditis . [38]
La protección que se suele emplear contra los efectos negativos del yodo-131 consiste en saturar la glándula tiroides con yodo-127 estable en forma de comprimidos de yoduro de potasio , que se toman diariamente para una profilaxis óptima. [39] Sin embargo, el yodo-131 también se puede utilizar con fines medicinales en radioterapia por esta misma razón, cuando se desea la destrucción del tejido después de la absorción de yodo por el tejido. [40] El yodo-131 también se utiliza como trazador radiactivo . [41] [42] [43] [44]
Química y compuestos
| incógnita | XX | HX | Caja 3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Es | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
El yodo es bastante reactivo, pero es mucho menos reactivo que los otros halógenos. Por ejemplo, mientras que el gas cloro halogenará monóxido de carbono , óxido nítrico y dióxido de azufre (a fosgeno , cloruro de nitrosilo y cloruro de sulfurilo respectivamente), el yodo no lo hará. Además, la yodación de metales tiende a dar como resultado estados de oxidación más bajos que la cloración o la bromación; por ejemplo, el metal renio reacciona con el cloro para formar hexacloruro de renio , pero con bromo forma solo pentabromuro de renio y el yodo puede lograr solo tetrayoduro de renio . [23] Sin embargo, por la misma razón, dado que el yodo tiene la energía de ionización más baja entre los halógenos y es el más fácilmente oxidado de ellos, tiene una química catiónica más significativa y sus estados de oxidación más altos son bastante más estables que los del bromo y el cloro, por ejemplo en el heptafluoruro de yodo . [25]
Complejos de transferencia de carga

La molécula de yodo, I 2 , se disuelve en CCl 4 e hidrocarburos alifáticos para dar soluciones de color violeta brillante. En estos disolventes, el máximo de la banda de absorción se produce en la región de 520 a 540 nm y se asigna a una transición de π * a σ * . Cuando el I 2 reacciona con bases de Lewis en estos disolventes, se observa un desplazamiento azul en el pico del I 2 y surge el nuevo pico (230 a 330 nm) que se debe a la formación de aductos, que se denominan complejos de transferencia de carga. [46]
Yoduro de hidrógeno
El compuesto más simple del yodo es el yoduro de hidrógeno , HI. Es un gas incoloro que reacciona con el oxígeno para dar agua y yodo. Aunque es útil en reacciones de yodación en el laboratorio, no tiene usos industriales a gran escala, a diferencia de los otros haluros de hidrógeno. Comercialmente, generalmente se fabrica haciendo reaccionar el yodo con sulfuro de hidrógeno o hidracina : [47]
A temperatura ambiente, es un gas incoloro, como todos los haluros de hidrógeno excepto el fluoruro de hidrógeno , ya que el hidrógeno no puede formar fuertes enlaces de hidrógeno con el átomo de yodo, grande y solo ligeramente electronegativo. Se funde a -51,0 °C (-59,8 °F) y hierve a -35,1 °C (-31,2 °F). Es un compuesto endotérmico que puede disociarse exotérmicamente a temperatura ambiente, aunque el proceso es muy lento a menos que esté presente un catalizador : la reacción entre el hidrógeno y el yodo a temperatura ambiente para dar yoduro de hidrógeno no se completa. La energía de disociación del enlace H-I es también la más pequeña de los haluros de hidrógeno, a 295 kJ/mol. [48]
El yoduro de hidrógeno acuoso se conoce como ácido yodhídrico , que es un ácido fuerte. El yoduro de hidrógeno es excepcionalmente soluble en agua: un litro de agua disolverá 425 litros de yoduro de hidrógeno, y la solución saturada tiene solo cuatro moléculas de agua por molécula de yoduro de hidrógeno. [49] El ácido yodhídrico comercial llamado "concentrado" generalmente contiene entre un 48 y un 57 % de HI en masa; la solución forma un azeótropo con un punto de ebullición de 126,7 °C (260,1 °F) a 56,7 g de HI por 100 g de solución. Por lo tanto, el ácido yodhídrico no se puede concentrar más allá de este punto por evaporación del agua. [48] A diferencia del yoduro de hidrógeno gaseoso, el ácido yodhídrico tiene un uso industrial importante en la fabricación de ácido acético mediante el proceso Cativa . [50] [51]
A diferencia del fluoruro de hidrógeno , el yoduro de hidrógeno líquido anhidro es difícil de trabajar como disolvente, porque su punto de ebullición es bajo, tiene un rango líquido pequeño, su permitividad es baja y no se disocia apreciablemente en H 2 I + y HI.−
2iones – estos últimos, en cualquier caso, son mucho menos estables que los iones bifluoruro ( HF−
2) debido al enlace de hidrógeno muy débil entre el hidrógeno y el yodo, aunque sus sales con cationes muy grandes y débilmente polarizantes como Cs + y NR+
4(R = Me , Et , Bu n ) aún se puede aislar. El yoduro de hidrógeno anhidro es un disolvente deficiente, capaz de disolver solo compuestos de pequeño peso molecular como el cloruro de nitrosilo y el fenol , o sales con energías reticulares muy bajas como los haluros de tetraalquilamonio. [48]
Otros compuestos binarios de yodo
Con excepción de los gases nobles , se sabe que casi todos los elementos de la tabla periódica hasta el einstenio ( se conoce al EsI 3 ) forman compuestos binarios con yodo. Hasta 1990, el triyoduro de nitrógeno [52] solo se conocía como un aducto de amoníaco. Se descubrió que el NI 3 libre de amoníaco se puede aislar a -196 °C, pero se descompone espontáneamente a 0 °C. [53] Por razones termodinámicas relacionadas con la electronegatividad de los elementos, los yoduros de azufre y selenio neutros que sean estables a temperatura ambiente también son inexistentes, aunque S 2 I 2 y SI 2 son estables hasta 183 y 9 K, respectivamente. A partir de 2022, no se ha identificado de forma inequívoca ningún yoduro de selenio binario neutro (a ninguna temperatura). [54] Se han preparado y caracterizado cristalográficamente cationes poliatómicos de azufre y selenio-yodo (por ejemplo, [S 2 I 4 2+ ][AsF 6 – ] 2 y [Se 2 I 4 2+ ][Sb 2 F 11 – ] 2 ). [55]
Dado el gran tamaño del anión yoduro y el débil poder oxidante del yodo, es difícil alcanzar altos estados de oxidación en yoduros binarios, siendo el máximo conocido en los pentaiyoduros de niobio , tántalo y protactinio . Los yoduros se pueden hacer por reacción de un elemento o su óxido, hidróxido o carbonato con ácido yodhídrico, y luego deshidratados por temperaturas ligeramente altas combinadas con baja presión o gas de yoduro de hidrógeno anhidro. Estos métodos funcionan mejor cuando el producto de yoduro es estable a la hidrólisis. Otras síntesis incluyen la yodación oxidativa a alta temperatura del elemento con yodo o yoduro de hidrógeno, la yodación a alta temperatura de un óxido metálico u otro haluro por yodo, un haluro metálico volátil, tetrayoduro de carbono o un yoduro orgánico. Por ejemplo, el óxido de molibdeno (IV) reacciona con yoduro de aluminio (III) a 230 °C para dar yoduro de molibdeno (II) . A continuación se ofrece un ejemplo que implica un intercambio de halógeno, que implica la reacción del cloruro de tántalo (V) con un exceso de yoduro de aluminio (III) a 400 °C para dar yoduro de tántalo (V) : [56]
Los yoduros inferiores se pueden producir mediante descomposición térmica o desproporción, o reduciendo el yoduro superior con hidrógeno o un metal, por ejemplo: [56]
La mayoría de los yoduros metálicos con el metal en estados de oxidación bajos (+1 a +3) son iónicos. Los no metales tienden a formar yoduros moleculares covalentes, al igual que los metales en estados de oxidación altos de +3 y superiores. Se conocen yoduros iónicos y covalentes para metales en estado de oxidación +3 (por ejemplo, el yoduro de escandio es principalmente iónico, pero el yoduro de aluminio no lo es). Los yoduros iónicos MI n tienden a tener los puntos de fusión y ebullición más bajos entre los haluros MX n del mismo elemento, porque las fuerzas electrostáticas de atracción entre los cationes y aniones son más débiles para el anión yoduro grande. Por el contrario, los yoduros covalentes tienden a tener los puntos de fusión y ebullición más altos entre los haluros del mismo elemento, ya que el yodo es el más polarizable de los halógenos y, al tener la mayor cantidad de electrones entre ellos, puede contribuir más a las fuerzas de van der Waals. Naturalmente, abundan las excepciones en los yoduros intermedios donde una tendencia da paso a la otra. De manera similar, las solubilidades en agua de los yoduros predominantemente iónicos (por ejemplo, potasio y calcio ) son las mayores entre los haluros iónicos de ese elemento, mientras que las de los yoduros covalentes (por ejemplo, plata ) son las más bajas de ese elemento. En particular, el yoduro de plata es muy insoluble en agua y su formación se utiliza a menudo como una prueba cualitativa para el yodo. [56]
Haluros de yodo
Los halógenos forman numerosos compuestos interhalogenados diamagnéticos binarios con estequiometrías XY, XY 3 , XY 5 y XY 7 (donde X es más pesado que Y), y el yodo no es una excepción. El yodo forma los tres posibles interhalogenados diatómicos, un trifluoruro y un tricloruro, así como un pentafluoruro y, excepcionalmente entre los halógenos, un heptafluoruro. También se caracterizan numerosos derivados catiónicos y aniónicos, como los compuestos de color rojo vino o naranja brillante del ICl.+
2y los compuestos de color marrón oscuro o negro violáceo de I 2 Cl + . Aparte de estos, también se conocen algunos pseudohaluros , como el yoduro de cianógeno (ICN), el tiocianato de yodo (ISCN) y la azida de yodo (IN 3 ). [57]

El monofluoruro de yodo (IF) es inestable a temperatura ambiente y se desproporciona muy fácilmente e irreversiblemente a yodo y pentafluoruro de yodo , por lo que no se puede obtener puro. Se puede sintetizar a partir de la reacción de yodo con gas flúor en triclorofluorometano a −45 °C, con trifluoruro de yodo en triclorofluorometano a −78 °C o con fluoruro de plata (I) a 0 °C. [57] El monocloruro de yodo (ICl) y el monobromuro de yodo (IBr), por otro lado, son moderadamente estables. El primero, un compuesto volátil de color marrón rojizo, fue descubierto independientemente por Joseph Louis Gay-Lussac y Humphry Davy en 1813-1814, poco después de los descubrimientos del cloro y el yodo, e imita tan bien al halógeno intermedio bromo que Justus von Liebig se equivocó al confundir el bromo (que había descubierto) con monocloruro de yodo. El monocloruro de yodo y el monobromuro de yodo pueden prepararse simplemente haciendo reaccionar el yodo con cloro o bromo a temperatura ambiente y purificarse por cristalización fraccionada . Ambos son bastante reactivos y atacan incluso al platino y al oro , aunque no al boro , el carbono , el cadmio , el plomo , el circonio , el niobio , el molibdeno y el tungsteno . Su reacción con compuestos orgánicos depende de las condiciones. El vapor de cloruro de yodo tiende a clorar el fenol y el ácido salicílico , ya que cuando el cloruro de yodo sufre fisión homolítica , se producen cloro y yodo y el primero es más reactivo. Sin embargo, el cloruro de yodo en solución de tetracloruro de carbono da como resultado que la yodación sea la reacción principal, ya que ahora ocurre la fisión heterolítica del enlace I-Cl y el I + ataca al fenol como electrófilo. Sin embargo, el monobromuro de yodo tiende a bromar el fenol incluso en solución de tetracloruro de carbono porque tiende a disociarse en sus elementos en solución, y el bromo es más reactivo que el yodo. [57] Cuando está líquido, el monocloruro de yodo y el monobromuro de yodo se disocian en I
2incógnita+
y IX−
2iones (X = Cl, Br); por lo tanto, son importantes conductores de electricidad y pueden utilizarse como disolventes ionizantes. [57]
El trifluoruro de yodo (IF3 ) es un sólido amarillo inestable que se descompone por encima de los −28 °C, por lo que es poco conocido. Es difícil de producir porque el gas flúor tendería a oxidar el yodo hasta el pentafluoruro; es necesaria la reacción a baja temperatura con difluoruro de xenón . El tricloruro de yodo , que existe en estado sólido como el dímero planar I2Cl6 , es un sólido amarillo brillante, sintetizado mediante la reacción del yodo con cloro líquido a −80 °C; es necesario tener cuidado durante la purificación porque se disocia fácilmente en monocloruro de yodo y cloro y, por lo tanto, puede actuar como un fuerte agente clorante. El tricloruro de yodo líquido conduce la electricidad, lo que posiblemente indique la disociación a ICl+
2y ICl−
4iones. [58]
El pentafluoruro de yodo (IF 5 ), un líquido incoloro y volátil, es el fluoruro de yodo más estable termodinámicamente y se puede obtener haciendo reaccionar el yodo con gas flúor a temperatura ambiente. Es un agente fluorante, pero es lo suficientemente suave como para almacenarlo en un aparato de vidrio. Nuevamente, hay una ligera conductividad eléctrica presente en el estado líquido debido a la disociación con IF+
4Y SI−
6El heptafluoruro de yodo bipiramidal pentagonal (IF 7 ) es un agente fluorante extremadamente poderoso, solo superado por el trifluoruro de cloro , el pentafluoruro de cloro y el pentafluoruro de bromo entre los interhalógenos: reacciona con casi todos los elementos incluso a bajas temperaturas, fluora el vidrio Pyrex para formar oxifluoruro de yodo (VII) (IOF 5 ), y prende fuego al monóxido de carbono . [59]
Óxidos de yodo y oxiácidos

Los óxidos de yodo son los más estables de todos los óxidos de halógeno, debido a los fuertes enlaces I-O resultantes de la gran diferencia de electronegatividad entre el yodo y el oxígeno, y son conocidos desde hace más tiempo. [27] El pentóxido de yodo (I 2 O 5 ) , estable, blanco e higroscópico , se conoce desde su formación en 1813 por Gay-Lussac y Davy. Se produce más fácilmente mediante la deshidratación del ácido yódico (HIO 3 ), del que es el anhídrido. Oxidará rápidamente el monóxido de carbono por completo a dióxido de carbono a temperatura ambiente y, por lo tanto, es un reactivo útil para determinar la concentración de monóxido de carbono. También oxida el óxido de nitrógeno , el etileno y el sulfuro de hidrógeno . Reacciona con trióxido de azufre y difluoruro de peroxidisulfurilo (S 2 O 6 F 2 ) para formar sales del catión yodilo, [IO 2 ] + , y se reduce con ácido sulfúrico concentrado a sales de yodosilo que involucran [IO] + . Puede ser fluorado por flúor , trifluoruro de bromo , tetrafluoruro de azufre o fluoruro de clorilo , dando como resultado pentafluoruro de yodo , que también reacciona con pentóxido de yodo , dando oxifluoruro de yodo (V), IOF 3 . Se conocen algunos otros óxidos menos estables, en particular I 4 O 9 y I 2 O 4 ; sus estructuras no se han determinado, pero las conjeturas razonables son I III (I V O 3 ) 3 y [IO] + [IO 3 ] − respectivamente. [60]
| E°(pareja) | a (H + ) = 1 (ácido) | E°(pareja) | a (OH − ) = 1 (base) |
|---|---|---|---|
| Yo 2 /Yo − | +0,535 | Yo 2 /Yo − | +0,535 |
| IHO/I − | +0,987 | Yo − /Yo − | +0,48 |
| 0 | 0 | IO− 3/yo − | +0,26 |
| IOH/I 2 | +1.439 | Yo − /Yo 2 | +0,42 |
| IO− 3/yo 2 | +1,195 | 0 | 0 |
| IO− 3/Hoi | +1.134 | IO− 3/IO − | +0,15 |
| IO− 4/ IO− 3 | +1.653 | 0 | 0 |
| H 5 IO 6 / IO− 3 | +1.601 | yo 3IO2− 6/ IO− 3 | +0,65 |
Los más importantes son los cuatro oxoácidos: ácido hipoyodoso (HIO), ácido yodoso (HIO 2 ), ácido yódico (HIO 3 ) y ácido peryódico (HIO 4 o H 5 IO 6 ). Cuando el yodo se disuelve en solución acuosa, ocurren las siguientes reacciones: [61]
| Yo 2 + H 2 O | ⇌ HIO + H + + I − | - | Yo 2 + 2 OH − | ⇌ IO − + H 2 O + I − | K alk = 30 mol 2 L −2 |
El ácido hipoyodoso es inestable a la desproporción. Los iones hipoyoditos así formados se desproporcionan inmediatamente para dar yoduro y yodato: [61]
3 K = 10 20
El ácido yodado y el yodito son aún menos estables y existen sólo como un intermediario fugaz en la oxidación del yoduro a yodato, si es que lo hacen. [61] Los yodatos son, con mucho, los más importantes de estos compuestos, que pueden formarse oxidando yoduros de metales alcalinos con oxígeno a 600 °C y alta presión, o oxidando yodo con cloratos . A diferencia de los cloratos, que se desproporcionan muy lentamente para formar cloruro y perclorato, los yodatos son estables a la desproporción tanto en soluciones ácidas como alcalinas. A partir de estos, se pueden obtener sales de la mayoría de los metales. El ácido yódico se forma más fácilmente mediante la oxidación de una suspensión acuosa de yodo por electrólisis o ácido nítrico fumante . El yodato tiene el poder oxidante más débil de los halatos, pero reacciona más rápidamente. [62]
Se conocen muchos peryodatos, incluido no solo el tetraédrico IO esperado−
4, pero también IO piramidal cuadrado3−
5, ortoperyodato octaédrico IO5−
6, [IO 3 (OH) 3 ] 2− , [I 2 O 8 (OH 2 )] 4− , y yo
2Oh4−
9Generalmente se fabrican oxidando yodato de sodio alcalino electroquímicamente (con óxido de plomo (IV) como ánodo) o con gas cloro: [63]
3+ 6OH − → IO5−
6+ 3 H2O + 2 e−
3+ 6OH − + Cl 2 → IO5−
6+ 2Cl − + 3 H2O
Son agentes oxidantes termodinámica y cinéticamente potentes, que oxidan rápidamente Mn 2+ a MnO.−
4, y escindiendo glicoles , α- dicetonas , α- cetoles , α- aminoalcoholes y α- diaminas . [63] El ortoperyodato estabiliza especialmente los altos estados de oxidación entre los metales debido a su carga negativa muy alta de −5. El ácido ortoperyodico , H 5 IO 6 , es estable y se deshidrata a 100 °C en vacío a ácido metaperyodico , HIO 4 . Intentar ir más allá no da como resultado el inexistente heptóxido de yodo (I 2 O 7 ), sino más bien pentóxido de yodo y oxígeno. El ácido peryódico puede ser protonado por ácido sulfúrico para dar el I(OH)+
6catión, isoelectrónico a Te(OH) 6 y Sb(OH)−
6, y dando sales con bisulfato y sulfato. [27]
Compuestos de poliyodo
Cuando el yodo se disuelve en ácidos fuertes, como el ácido sulfúrico fumante, se forma una solución paramagnética de color azul brillante que incluye I+
2Se forma una sal sólida del catión diyodo oxidando el yodo con pentafluoruro de antimonio : [27]
La sal I 2 Sb 2 F 11 es azul oscuro, y también se conoce el análogo azul del tantalio I 2 Ta 2 F 11. Mientras que la longitud del enlace I–I en I 2 es 267 pm, la del I+
2tiene solo 256 pm, ya que el electrón que falta en este último ha sido eliminado de un orbital antienlazante, lo que hace que el enlace sea más fuerte y, por lo tanto, más corto. En solución de ácido fluorosulfúrico , el azul profundo I+
2dimeriza reversiblemente por debajo de -60 °C, formando un I diamagnético rectangular rojo2+
4Otros cationes de poliyodo no están tan bien caracterizados, incluido el I de color marrón oscuro o negro doblado.+
3y centrosimétrico C 2 h verde o negro I+
5, conocido en la AsF−
6y AlCl−
4sales entre otros. [27] [64]
El único anión poliyoduro importante en solución acuosa es el triyoduro lineal , I−
3Su formación explica por qué la solubilidad del yodo en agua puede aumentarse mediante la adición de solución de yoduro de potasio: [27]
3( Keq = c. 700 a 20 °C)
Se pueden encontrar muchos otros poliyoduros cuando cristalizan soluciones que contienen yodo y yoduro, como el I−
5, I−
9, I2−
4, y yo2−
8, cuyas sales con cationes grandes y débilmente polarizantes como Cs + pueden aislarse. [27] [65]
Compuestos organoyodados

Los compuestos organoyodados han sido fundamentales en el desarrollo de la síntesis orgánica, como en la eliminación de aminas de Hofmann , [66] la síntesis de éteres de Williamson , [67] la reacción de acoplamiento de Wurtz , [68] y en los reactivos de Grignard . [69]
El enlace carbono -yodo es un grupo funcional común que forma parte de la química orgánica básica ; formalmente, estos compuestos pueden considerarse como derivados orgánicos del anión yoduro . Los compuestos organoyodados más simples , los yoduros de alquilo , pueden sintetizarse mediante la reacción de alcoholes con triyoduro de fósforo ; estos pueden usarse luego en reacciones de sustitución nucleofílica o para preparar reactivos de Grignard . El enlace C–I es el más débil de todos los enlaces carbono-halógeno debido a la minúscula diferencia de electronegatividad entre el carbono (2,55) y el yodo (2,66). Como tal, el yoduro es el mejor grupo saliente entre los halógenos, hasta tal punto que muchos compuestos organoyodados se vuelven amarillos cuando se almacenan con el tiempo debido a la descomposición en yodo elemental; como tal, se usan comúnmente en la síntesis orgánica , debido a la fácil formación y escisión del enlace C–I. [70] También son significativamente más densos que los otros compuestos organohalogenados gracias al alto peso atómico del yodo. [71] Algunos agentes oxidantes orgánicos como los yodanos contienen yodo en un estado de oxidación más alto que −1, como el ácido 2-yodoxibenzoico , un reactivo común para la oxidación de alcoholes a aldehídos , [72] y el dicloruro de yodobenceno (PhICl 2 ), utilizado para la cloración selectiva de alquenos y alquinos . [73] Uno de los usos más conocidos de los compuestos organoyodados es la llamada prueba del yodoformo , donde el yodoformo (CHI 3 ) se produce por la yodación exhaustiva de una metilcetona (u otro compuesto capaz de oxidarse a una metilcetona), de la siguiente manera: [74]
Algunas desventajas del uso de compuestos organoyodados en comparación con los compuestos organoclorados u organobromados es el mayor gasto y toxicidad de los derivados del yodo, ya que el yodo es caro y los compuestos organoyodados son agentes alquilantes más fuertes. [75] Por ejemplo, la yodoacetamida y el ácido yodoacético desnaturalizan las proteínas alquilando irreversiblemente los residuos de cisteína y evitando la reformación de enlaces disulfuro . [76]
El intercambio de halógeno para producir yodoalcanos mediante la reacción de Finkelstein es ligeramente complicado por el hecho de que el yoduro es un mejor grupo saliente que el cloruro o el bromuro. Sin embargo, la diferencia es lo suficientemente pequeña como para que la reacción pueda completarse explotando la solubilidad diferencial de las sales de haluro o utilizando un gran exceso de la sal de haluro. [74] En la reacción clásica de Finkelstein, un cloruro de alquilo o un bromuro de alquilo se convierte en un yoduro de alquilo mediante el tratamiento con una solución de yoduro de sodio en acetona . El yoduro de sodio es soluble en acetona y el cloruro de sodio y el bromuro de sodio no lo son. [77] La reacción se conduce hacia productos por acción de masas debido a la precipitación de la sal insoluble. [78] [79]
Ocurrencia y producción
El yodo es el menos abundante de los halógenos estables, comprendiendo sólo 0,46 partes por millón de las rocas de la corteza terrestre (comparar: flúor : 544 ppm, cloro : 126 ppm, bromo : 2,5 ppm) convirtiéndolo en el 60º elemento más abundante. [80] Los minerales de yodo son raros, y la mayoría de los depósitos que están lo suficientemente concentrados para una extracción económica son minerales de yodato. Los ejemplos incluyen lautarita , Ca(IO 3 ) 2 , y dietzeíta, 7Ca(IO 3 ) 2 ·8CaCrO 4 . [80] Estos son los minerales que se presentan como impurezas traza en el caliche , encontrado en Chile , cuyo principal producto es el nitrato de sodio . En total, pueden contener al menos 0,02% y como máximo 1% de yodo en masa. [81] El yodato de sodio se extrae del caliche y se reduce a yoduro mediante bisulfito de sodio . Esta solución se hace reaccionar luego con yodato recién extraído, lo que da como resultado una proporción de yodo, que puede filtrarse. [23]
El caliche fue la principal fuente de yodo en el siglo XIX y sigue siendo importante hoy en día, reemplazando a las algas marinas (que ya no son una fuente económicamente viable), [82] pero a fines del siglo XX surgieron las salmueras como una fuente comparable. El campo de gas japonés Minami Kantō al este de Tokio y el campo de gas estadounidense Anadarko Basin en el noroeste de Oklahoma son las dos fuentes más grandes de este tipo. La salmuera está a más de 60 °C desde la profundidad de la fuente. La salmuera primero se purifica y acidifica utilizando ácido sulfúrico , luego el yoduro presente se oxida a yodo con cloro. Se produce una solución de yodo, pero está diluida y debe concentrarse. Se sopla aire en la solución para evaporar el yodo, que pasa a una torre de absorción, donde el dióxido de azufre reduce el yodo. El yoduro de hidrógeno (HI) reacciona con cloro para precipitar el yodo. Después de filtrar y purificar, el yodo se empaqueta. [81] [83]
Estas fuentes aseguran que Chile y Japón sean los mayores productores de yodo en la actualidad. [80] Alternativamente, la salmuera puede tratarse con nitrato de plata para precipitar el yodo como yoduro de plata , que luego se descompone por reacción con hierro para formar plata metálica y una solución de yoduro de hierro (II) . Luego, el yodo se libera por desplazamiento con cloro . [84]
Aplicaciones
Aproximadamente la mitad de todo el yodo producido se destina a diversos compuestos organoyodados , otro 15% permanece como elemento puro, otro 15% se utiliza para formar yoduro de potasio y otro 15% para otros compuestos inorgánicos de yodo . [23] Entre los principales usos de los compuestos de yodo se encuentran los catalizadores , los suplementos alimenticios para animales, los estabilizadores, los tintes, colorantes y pigmentos, la industria farmacéutica, el saneamiento (a partir de la tintura de yodo ) y la fotografía; los usos menores incluyen la inhibición del smog , la siembra de nubes y varios usos en la química analítica . [23]
Análisis químico

Los aniones yoduro y yodato se utilizan a menudo para el análisis volumétrico cuantitativo, por ejemplo en yodometría . El yodo y el almidón forman un complejo azul, y esta reacción se utiliza a menudo para comprobar la presencia de almidón o yodo y como indicador en yodometría. La prueba del yodo para el almidón todavía se utiliza para detectar billetes falsos impresos en papel que contiene almidón. [85]
El índice de yodo es la masa de yodo en gramos que se consume en 100 gramos de una sustancia química, generalmente grasas o aceites. Los índices de yodo se utilizan a menudo para determinar la cantidad de insaturación en los ácidos grasos . Esta insaturación se presenta en forma de dobles enlaces , que reaccionan con los compuestos de yodo.
El tetrayodomercurato de potasio (II) , K 2 HgI 4 , también se conoce como reactivo de Nessler. A menudo se utiliza como una prueba de punto sensible para el amoníaco . De manera similar, el reactivo de Mayer (solución de tetrayodomercurato de potasio (II)) se utiliza como reactivo de precipitación para probar alcaloides . [86] La solución acuosa de yodo alcalino se utiliza en la prueba de yodoformo para metilcetonas . [74]
Espectroscopia
El espectro de la molécula de yodo, I 2 , consta (no exclusivamente) de decenas de miles de líneas espectrales nítidas en el rango de longitud de onda de 500 a 700 nm. Por lo tanto, es una referencia de longitud de onda de uso común (estándar secundario). Al medir con una técnica espectroscópica sin efecto Doppler mientras se enfoca una de estas líneas, se revela la estructura hiperfina de la molécula de yodo. Ahora, una línea se resuelve de tal manera que se pueden medir 15 componentes (de números cuánticos rotacionales pares, J even ) o 21 componentes (de números cuánticos rotacionales impares, J odd ). [87]
El yoduro de cesio y el yoduro de sodio dopado con talio se utilizan en centelleadores de cristal para la detección de rayos gamma. La eficiencia es alta y es posible la espectroscopia de energía dispersiva, pero la resolución es bastante pobre.
Propulsión de naves espaciales
Los sistemas de propulsión con propulsores iónicos que emplean yodo como masa de reacción pueden construirse de forma más compacta, con menos masa (y coste) y funcionar de forma más eficiente que los propulsores iónicos enrejados que se utilizaron para propulsar naves espaciales anteriores, como las sondas Hayabusa de Japón , el satélite GOCE de la ESA o la misión DART de la NASA, todas las cuales utilizaban xenón para este fin. El peso atómico del yodo es sólo un 3,3% inferior al del xenón, mientras que sus dos primeras energías de ionización tienen una media del 12% inferior; en conjunto, estas dos energías hacen de los iones de yodo un sustituto prometedor. [88] [89] Sin embargo, el yodo introduce problemas de reactividad química que no están presentes en los plasmas de xenón. [90]
El uso de yodo debería permitir una aplicación más generalizada de la tecnología de empuje iónico, en particular con vehículos espaciales de menor escala. [89] Según la Agencia Espacial Europea , "Esta innovación pequeña pero potencialmente disruptiva podría ayudar a limpiar los cielos de basura espacial , al permitir que pequeños satélites se autodestruyan de manera barata y fácil al final de sus misiones, dirigiéndose hacia la atmósfera donde se quemarían". [91]
A principios de 2021, el grupo francés ThrustMe realizó una demostración en órbita de un propulsor de iones alimentado eléctricamente para naves espaciales, donde se utilizó yodo en lugar de xenón como fuente de plasma , con el fin de generar empuje acelerando iones con un campo electrostático . [88]
Medicamento
El yodo elemental (I 2 ) se utiliza como antiséptico en medicina. [92] Varios compuestos solubles en agua, desde el triyoduro (I 3 − , generado in situ añadiendo yoduro a yodo elemental poco soluble en agua) hasta varios yodóforos , se descomponen lentamente para liberar I 2 cuando se aplican. [93]
Las sales de yoduro y yodato se utilizan en dosis bajas en la sal yodada . Una solución saturada de yoduro de potasio se utiliza para tratar la tirotoxicosis aguda . También se utiliza para bloquear la captación de yodo-131 en la glándula tiroides (véase la sección de isótopos más arriba), cuando este isótopo se utiliza como parte de radiofármacos (como el iobenguano ) que no están dirigidos a la tiroides o a los tejidos de tipo tiroideo. [94] [95]

Como elemento con alta densidad electrónica y número atómico, el yodo absorbe rayos X más débiles que 33,3 keV debido al efecto fotoeléctrico de los electrones más internos. [96] Los compuestos organoyodados se utilizan con inyección intravenosa como agentes de radiocontraste de rayos X. Esta aplicación se suele realizar en conjunción con técnicas avanzadas de rayos X como la angiografía y la tomografía computarizada . En la actualidad, todos los agentes de radiocontraste solubles en agua dependen de compuestos que contienen yodo .
Otros
La producción de dihidroyoduro de etilendiamina , que se proporciona como suplemento nutricional para el ganado, consume una gran parte del yodo disponible. Otro uso significativo es como catalizador para la producción de ácido acético mediante los procesos Monsanto y Cativa . En estas tecnologías, que respaldan la demanda mundial de ácido acético, el ácido yodhídrico convierte la materia prima de metanol en yoduro de metilo, que sufre carbonilación . La hidrólisis del yoduro de acetilo resultante regenera el ácido yodhídrico y da ácido acético. [97]
Los yoduros inorgánicos tienen usos especializados. El titanio , el circonio , el hafnio y el torio se purifican mediante el proceso Van Arkel-de Boer , que implica la formación reversible de tetrayoduros de estos elementos. El yoduro de plata es un ingrediente principal de la película fotográfica tradicional. Cada año se utilizan miles de kilogramos de yoduro de plata para sembrar nubes y provocar lluvia. [97]
El compuesto organoyodado eritrosina es un importante colorante alimentario. Los yoduros de perfluoroalquilo son precursores de importantes surfactantes, como el ácido perfluorooctanosulfónico . [97]
La reacción del reloj de yodo (en la que el yodo también sirve como prueba para el almidón, formando un complejo azul oscuro), [23] es un experimento de demostración educativa popular y un ejemplo de una reacción aparentemente oscilante (es solo la concentración de un producto intermedio la que oscila).
El 125 I se utiliza como radiomarcador para investigar qué ligandos van a qué receptores de reconocimiento de patrones (PRR) de las plantas. [98]
Se ha evaluado un ciclo termoquímico basado en yodo para la producción de hidrógeno utilizando energía del papel nuclear. [99] El ciclo tiene tres pasos. A 120 °C (248 °F), el yodo reacciona con dióxido de azufre y agua para producir yoduro de hidrógeno y ácido sulfúrico :
Después de una etapa de separación, a 830–850 °C (1530–1560 °F), el ácido sulfúrico se descompone en dióxido de azufre y oxígeno:
El yoduro de hidrógeno, a 300–320 °C (572–608 °F), produce hidrógeno y el elemento inicial, yodo:
El rendimiento del ciclo (relación entre el poder calorífico inferior del hidrógeno producido y la energía consumida para su producción) es de aproximadamente el 38%. A fecha de 2020 [actualizar], el ciclo no es un medio competitivo para producir hidrógeno. [99]
Papel biológico


El yodo es un elemento esencial para la vida y, con un número atómico Z = 53, es el elemento más pesado que necesitan comúnmente los organismos vivos. ( El lantano y otros lantánidos , así como el tungsteno con Z = 74 y el uranio con Z = 92, son utilizados por unos pocos microorganismos. [101] [102] [103] ) Es necesario para la síntesis de las hormonas tiroideas reguladoras del crecimiento tetrayodotironina y triyodotironina (T 4 y T 3 respectivamente, llamadas así por su número de átomos de yodo). Una deficiencia de yodo conduce a una disminución de la producción de T 3 y T 4 y a un agrandamiento concomitante del tejido tiroideo en un intento de obtener más yodo, causando la enfermedad bocio . La principal forma de hormona tiroidea en la sangre es la tetrayodotironina (T 4 ), que tiene una vida más larga que la triyodotironina (T 3 ). En los seres humanos, la proporción de T 4 a T 3 liberada en la sangre es de entre 14:1 y 20:1. La T 4 se convierte en la T 3 activa (tres a cuatro veces más potente que la T 4 ) dentro de las células por acción de las desyodasas (5'-yodasa). Estas se procesan posteriormente por descarboxilación y desyodación para producir yodotironamina (T 1 a) y tironamina (T 0 a'). Las tres isoformas de las desyodasas son enzimas que contienen selenio ; por lo tanto, el selenio metálico es necesario para la producción de triyodotironina y tetrayodotironina. [104]
El yodo representa el 65% del peso molecular de T 4 y el 59% de T 3 . De 15 a 20 mg de yodo se concentran en el tejido tiroideo y las hormonas, pero el 70% de todo el yodo en el cuerpo se encuentra en otros tejidos, incluyendo las glándulas mamarias, los ojos , la mucosa gástrica, el timo, el líquido cefalorraquídeo , el plexo coroideo, las arterias, el cuello uterino y las glándulas salivales. Durante el embarazo, la placenta es capaz de almacenar y acumular yodo. [105] [106] En las células de esos tejidos, el yodo entra directamente por el simportador de yoduro de sodio (NIS). La acción del yodo en los tejidos de los mamíferos está relacionada con el desarrollo fetal y neonatal, y en los demás tejidos, es conocida. [107]
Recomendaciones dietéticas y de ingesta
Los niveles diarios de ingesta recomendados por la Academia Nacional de Medicina de los Estados Unidos son entre 110 y 130 μg para bebés de hasta 12 meses, 90 μg para niños de hasta ocho años, 130 μg para niños de hasta 13 años, 150 μg para adultos, 220 μg para mujeres embarazadas y 290 μg para mujeres lactantes. [7] [108] El Nivel Máximo de Ingesta Tolerable (TUIL) para adultos es de 1.100 μg/día. [109] Este límite superior se evaluó analizando el efecto de la suplementación sobre la hormona estimulante de la tiroides . [107]
La Autoridad Europea de Seguridad Alimentaria (AESA) denomina al conjunto colectivo de información Valores Dietéticos de Referencia, con Ingesta de Referencia Poblacional (PRI) en lugar de RDA, y Requerimiento Promedio en lugar de EAR; AI y UL se definen de la misma manera que en los Estados Unidos. Para mujeres y hombres de 18 años o más, el PRI para el yodo se establece en 150 μg/día; el PRI durante el embarazo y la lactancia es de 200 μg/día. Para niños de 1 a 17 años, el PRI aumenta con la edad de 90 a 130 μg/día. Estos PRI son comparables a las RDA de los EE. UU. con la excepción de la de la lactancia. [110]
La glándula tiroides necesita 70 μg/día de yodo para sintetizar las cantidades diarias requeridas de T4 y T3. [7] Los niveles más altos de yodo recomendados diariamente parecen necesarios para el funcionamiento óptimo de varios sistemas corporales, incluidas las glándulas mamarias , la mucosa gástrica , las glándulas salivales , las células cerebrales , el plexo coroideo , el timo y las arterias . [7] [111] [112] [113]
Las fuentes naturales de yodo en los alimentos incluyen mariscos que contienen pescado , algas marinas , algas marinas , mariscos y otros alimentos que contienen productos lácteos , huevos , carnes , verduras , siempre que los animales coman abundantemente y las plantas crezcan en suelos ricos en yodo. [114] [115] La sal yodada está fortificada con yodato de potasio , una sal de yodo, potasio y oxígeno. [115] [116] [117]
En 2000, la ingesta media de yodo procedente de los alimentos en Estados Unidos era de 240 a 300 μg/día para los hombres y de 190 a 210 μg/día para las mujeres. [109] La población general de Estados Unidos tiene una nutrición adecuada de yodo, [118] [119] y las mujeres lactantes y embarazadas tienen un riesgo leve de deficiencia. [119] En Japón, el consumo se consideró mucho más alto, oscilando entre 5280 μg/día y 13 800 μg/día de wakame y kombu que se comen, [107] tanto en forma de kombu y wakame como de extractos umami de kombu y wakame para caldos y patatas fritas . Sin embargo, nuevos estudios sugieren que el consumo en Japón está más cerca de los 1000-3000 μg/día. [120] La UL para adultos en Japón se revisó por última vez a 3000 μg/día en 2015. [121]
Después de que se han llevado a cabo programas de fortificación con yodo, como la yodación de la sal , se han observado algunos casos de hipertiroidismo inducido por yodo (el llamado fenómeno de Jod-Basedow ). La afección se presenta principalmente en personas mayores de 40 años y el riesgo es mayor cuando la deficiencia de yodo es alta y el primer aumento en el consumo de yodo es alto. [122]
Deficiencia
En las zonas donde hay poco yodo en la dieta, [123] que son áreas remotas del interior y áreas montañosas lejanas donde no se comen alimentos ricos en yodo, la deficiencia de yodo da lugar al hipotiroidismo , cuyos síntomas son fatiga extrema , bocio , enlentecimiento mental , depresión , bajo aumento de peso y bajas temperaturas corporales basales . [124] La deficiencia de yodo es la principal causa de discapacidad intelectual prevenible , un resultado que ocurre principalmente cuando los bebés o niños pequeños se vuelven hipotiroideos por falta de yodo. La adición de yodo a la sal ha destruido en gran medida este problema en las áreas más ricas, pero la deficiencia de yodo sigue siendo un grave problema de salud pública en las áreas más pobres en la actualidad. [125] La deficiencia de yodo también es un problema en ciertas áreas de todos los continentes del mundo. El procesamiento de la información, las habilidades motoras finas y la resolución de problemas visuales se normalizan con la reposición de yodo en personas con deficiencia de yodo. [126]
Precauciones
Toxicidad
| Peligros | |
|---|---|
| Etiquetado SGA : | |
  | |
| Peligro | |
| H312 , H315 , H319 , H332 , H335 , H372 , H400 | |
| P261 , P273 , P280 , P305 , P314 , P338 , P351 [127] | |
| NFPA 704 (rombo cortafuegos) | |
El yodo elemental (I 2 ) es tóxico si se ingiere sin diluir. La dosis letal para un ser humano adulto es de 30 mg/kg, lo que equivale a unos 2,1–2,4 gramos para un ser humano que pesa entre 70 y 80 kg (aun cuando los experimentos con ratas demostraron que estos animales podían sobrevivir después de ingerir una dosis de 14.000 mg/kg y seguir vivos después de eso). El exceso de yodo es más citotóxico en presencia de deficiencia de selenio . [129] La suplementación con yodo en poblaciones con deficiencia de selenio es problemática por esta razón. [107] La toxicidad se deriva de sus propiedades oxidantes, a través de las cuales desnaturaliza las proteínas (incluidas las enzimas). [130]
El yodo elemental también es un irritante de la piel. El contacto directo con la piel puede causar daños, y los cristales de yodo sólido deben manipularse con cuidado. Las soluciones con una alta concentración de yodo elemental, como la tintura de yodo y la solución de Lugol , pueden causar daño tisular si se utilizan en la limpieza o antisepsia prolongada; de manera similar, la povidona yodada líquida (Betadine) atrapada en la piel provocó quemaduras químicas en algunos casos notificados. [131]
Exposición ocupacional
Las personas pueden estar expuestas al yodo en el lugar de trabajo por inhalación, ingestión, contacto con la piel y contacto con los ojos. La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite legal ( límite de exposición permisible ) para la exposición al yodo en el lugar de trabajo en 0,1 ppm (1 mg/m 3 ) durante una jornada laboral de 8 horas. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 0,1 ppm (1 mg/m 3 ) durante una jornada laboral de 8 horas. En niveles de 2 ppm, el yodo es inmediatamente peligroso para la vida y la salud . [132]
Reacciones alérgicas
Algunas personas desarrollan una hipersensibilidad a los productos y alimentos que contienen yodo. Las aplicaciones de tintura de yodo o Betadine pueden causar erupciones, a veces graves. [133] El uso parenteral de agentes de contraste a base de yodo (ver arriba) puede causar reacciones que van desde una erupción leve hasta una anafilaxia fatal . Tales reacciones han llevado a la idea errónea (ampliamente sostenida, incluso entre los médicos) de que algunas personas son alérgicas al yodo en sí; incluso las alergias a los alimentos ricos en yodo se han interpretado así. [134] De hecho, nunca ha habido un informe confirmado de una verdadera alergia al yodo, ya que una alergia al yodo o a las sales de yodo es biológicamente imposible. Las reacciones de hipersensibilidad a los productos y alimentos que contienen yodo aparentemente están relacionadas con sus otros componentes moleculares; [135] por lo tanto, una persona que ha demostrado una alergia a un alimento o producto que contiene yodo puede no tener una reacción alérgica a otro. Los pacientes con diversas alergias alimentarias (pescados, mariscos, huevos, leche, algas marinas, algas marinas, carnes, verduras, kombu, wakame) no tienen un mayor riesgo de hipersensibilidad al medio de contraste. [136] [135] Al igual que con todos los medicamentos, se debe preguntar y consultar el historial de alergias del paciente antes de administrar cualquier medicamento que contenga yodo. [137]
Estado de la Lista I de la DEA de EE. UU.
El fósforo reduce el yodo a ácido yodhídrico , que es un reactivo eficaz para reducir la efedrina y la pseudoefedrina a metanfetamina . [138] Por esta razón, la Administración de Control de Drogas de los Estados Unidos designó al yodo como un precursor químico de la Lista I según 21 CFR 1310.02 . [139]
Notas
- ^ La expansión térmica del yodo cristalino es anisotrópica : los parámetros (a 20 °C) para cada eje son α a = 86,5 × 10 −6 /K, α b = 126 × 10 −6 /K, α c = 12,3 × 10 −6 /K, y α promedio = α V /3 = 74,9 × 10 −6 /K. [3]
Referencias
- ^ "Pesos atómicos estándar: yodo". CIAAW . 1985.
- ^ Prohaska T, Irrgeher J, Benefield J, Böhlke JK, Chesson LA, Coplen TB, et al. (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster JW (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Se sabe que el I(II) existe en monóxido (IO); véase Nikitin IV (31 de agosto de 2008). "Halogen monoxides". Russian Chemical Reviews . 77 (8): 739–749. Bibcode :2008RuCRv..77..739N. doi :10.1070/RC2008v077n08ABEH003788. S2CID 250898175.
- ^ Susceptibilidad magnética de los elementos y compuestos inorgánicos, en Handbook of Chemistry and Physics 81.a edición, CRC press.
- ^ Weast R (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ abcd "Yodo". Centro de Información sobre Micronutrientes, Instituto Linus Pauling , Universidad Estatal de Oregón , Corvallis. 2015. Archivado desde el original el 17 de abril de 2015. Consultado el 20 de noviembre de 2017 .
- ^ McNeil Jr DG (16 de diciembre de 2006). "En el aumento del coeficiente intelectual del mundo, el secreto está en la sal". The New York Times . Archivado desde el original el 12 de julio de 2010. Consultado el 21 de julio de 2009 .
- ^ Organización Mundial de la Salud (2021). Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 22.ª lista (2021) . Ginebra: Organización Mundial de la Salud. hdl : 10665/345533 . OMS/MHP/HPS/EML/2021.02.
- ^ ab Courtois B (1813). "Découverte d'une sustancia nouvelle dans le Vareck" [Descubrimiento de una nueva sustancia en las algas]. Annales de chimie (en francés). 88 : 304–310.En francés, las algas que llegaban a la orilla se llamaban "varec", "varech" o "vareck", de ahí la palabra inglesa "wrack". Más tarde, "varec" también se refería a las cenizas de esas algas: las cenizas se utilizaban como fuente de yodo y sales de sodio y potasio.
- ^ Swain PA (2005). «Bernard Courtois (1777–1838), famoso por descubrir el yodo (1811), y su vida en París desde 1798» (PDF) . Boletín de Historia de la Química . 30 (2): 103. Archivado desde el original (PDF) el 14 de julio de 2010. Consultado el 2 de abril de 2009 .
- ^ Greenwood y Earnshaw, pág. 794
- ^ ab "53 Yodo". Elements.vanderkrogt.net. Archivado desde el original el 23 de enero de 2010. Consultado el 23 de octubre de 2016 .
- ↑ Desormes y Clément hicieron su anuncio en el Institut impérial de France el 29 de noviembre de 1813; un resumen de su anuncio apareció en la Gazette nationale ou Le Moniteur Universel del 2 de diciembre de 1813. Véase:
- (Staff) (2 de diciembre de 1813). «Institut Imperial de France». Le Moniteur Universel (en francés) (336): 1344. Archivado desde el original el 28 de noviembre de 2022 . Consultado el 2 de mayo de 2021 .
- Chattaway FD (23 de abril de 1909). "El descubrimiento del yodo". Chemical News and Journal of Industrial Science . 99 (2578): 193–195.
- ^ ab Gay-Lussac J (1813). "Sur un nouvel acide formé avec la sustancia décourverte par M. Courtois" [Sobre un nuevo ácido formado por la sustancia descubierta por el señor Courtois]. Annales de Chimie (en francés). 88 : 311–318. Archivado desde el original el 19 de marzo de 2024 . Consultado el 2 de mayo de 2021 .
- ^ Gay-Lussac J (1813). "Sur la combine de l'iode avec d'oxigène" [Sobre la combinación de yodo con oxígeno]. Annales de Chimie (en francés). 88 : 319–321. Archivado desde el original el 19 de marzo de 2024 . Consultado el 2 de mayo de 2021 .
- ^ Gay-Lussac J (1814). "Mémoire sur l'iode" [Memoria sobre el yodo]. Annales de Chimie (en francés). 91 : 5–160.
- ^ Davy H (1813). "Sur la nouvelle sustancia descubierta par M. Courtois, dans le sel de Vareck" [Sobre la nueva sustancia descubierta por el Sr. Courtois en la sal de las algas]. Annales de Chimie (en francés). 88 : 322–329. Archivado desde el original el 19 de marzo de 2024 . Consultado el 2 de mayo de 2021 .
- ^ Davy H (1 de enero de 1814). "Algunos experimentos y observaciones sobre una nueva sustancia que se convierte en un gas de color violeta por acción del calor". Philosophical Transactions of the Royal Society of London . 104 : 74–93. doi : 10.1098/rstl.1814.0007 .
- ^ Davaine C (1873). "Investigaciones relativas a la acción de las sustancias dites antiseptiques sur le virus charbonneux" [Investigaciones sobre la acción de las sustancias llamadas antisépticas sobre la bacteria del ántrax]. Comptes rendus hebdomadaires des séances de l'Académie des Sciences (en francés). 77 : 821–825. Archivado desde el original el 5 de mayo de 2021 . Consultado el 2 de mayo de 2021 .
- ^ Grossich A (31 de octubre de 1908). "Eine neue Sterilisierungsmethode der Haut bei Operationen" [Un nuevo método de esterilización de la piel para operaciones]. Zentralblatt für Chirurgie (en alemán). 35 (44): 1289-1292. Archivado desde el original el 5 de mayo de 2021 . Consultado el 2 de mayo de 2021 .
- ^ "La primera tabla periódica de Mendeleev". web.lemoyne.edu . Archivado desde el original el 10 de mayo de 2021 . Consultado el 25 de enero de 2019 .
- ^ abcdefghijklm Greenwood y Earnshaw, págs. 800–4
- ^ Kugler HK, Keller C (1985).'At, Astato', Sistema n.° 8a . Manual de química inorgánica y organometálica de Gmelin. Vol. 8 (8.ª ed.). Springer-Verlag. ISBN 978-3-540-93516-2.
- ^ abcd Greenwood y Earnshaw, págs. 804-9
- ^ Windholz, Martha, Budavari, Susan, Stroumtsos, Lorraine Y., Fertig, Margaret Noether, eds. (1976). Índice Merck de productos químicos y medicamentos (9ª ed.). Compañía JA Majors. ISBN 978-0-911910-26-1.
- ^ abcdefg King RB (1995). Química inorgánica de los elementos de los grupos principales . Wiley-VCH. págs. 173–98. ISBN 978-0-471-18602-1.
- ^ Stojanovska M, Petruševski VM, Šoptrajanov B (1 de marzo de 2012). "El concepto de sublimación - el yodo como ejemplo". Educación Química . 23 : 171-175. doi : 10.1016/S0187-893X(17)30149-0 . ISSN 0187-893X.
- ^ Li WK, Zhou GD, Mak TC (2008). Química inorgánica estructural avanzada . Oxford University Press. pág. 674. ISBN 978-0-19-921694-9.
- ^ ab Audi G, Bersillon O, Blachot J, Wapstra AH (2003), "La evaluación NUBASE de las propiedades nucleares y de desintegración", Nuclear Physics A , 729 : 3–128, Bibcode :2003NuPhA.729....3A, doi :10.1016/j.nuclphysa.2003.11.001
- ^ Reynolds JH (1 de enero de 1960). "Determinación de la edad de los elementos". Physical Review Letters . 4 (1): 8–10. Bibcode :1960PhRvL...4....8R. doi :10.1103/PhysRevLett.4.8. ISSN 0031-9007.
- ^ Manuel O (2002). "Origen de los elementos en el sistema solar". En Manuel O (ed.). Origen de los elementos en el sistema solar . Boston, MA: Springer US. págs. 589–643. doi :10.1007/0-306-46927-8_44. ISBN 978-0-306-46562-8.
- ^ Watson JT, Roe DK, Selenkow HA (septiembre de 1965). "Yodo-129 como trazador "no radiactivo". Radiation Research . 26 (1): 159–163. Bibcode :1965RadR...26..159W. doi :10.2307/3571805. JSTOR 3571805. PMID 4157487.
- ^ Snyder G, Fabryka-Martin J (2007). "I-129 y Cl-36 en aguas de hidrocarburos diluidos: fuentes marino-cosmogénicas, in situ y antropogénicas". Geoquímica Aplicada . 22 (3): 692–714. Bibcode :2007ApGC...22..692S. doi :10.1016/j.apgeochem.2006.12.011.
- ^ SCOPE 50 - Radioecología después de Chernóbil Archivado el 13 de mayo de 2014 en Wayback Machine , Comité Científico sobre Problemas del Medio Ambiente (SCOPE), 1993. Véase la tabla 1.9 en la Sección 1.4.5.2.
- ^ Hupf HB, Eldridge JS, Beaver JE (abril de 1968). "Producción de yodo-123 para aplicaciones médicas". Revista internacional de radiación aplicada e isótopos . 19 (4): 345–351. doi :10.1016/0020-708X(68)90178-6. PMID 5650883.
- ^ Harper, PV; Siemens, WD; Lathrop, KA; Brizel, HE; Harrison, RW Yodo-125. Actas de la Conferencia Japonesa sobre radioisótopos; vol.: 4 de enero de 1961
- ^ Rivkees SA, Sklar C, Freemark M (noviembre de 1998). "Revisión clínica 99: El tratamiento de la enfermedad de Graves en niños, con especial énfasis en el tratamiento con yodo radiactivo". Revista de endocrinología clínica y metabolismo . 83 (11): 3767–3776. doi : 10.1210/jcem.83.11.5239 . PMID 9814445.
- ^ Zanzonico PB, Becker DV (junio de 2000). "Efectos del tiempo de administración y los niveles de yodo en la dieta sobre el bloqueo del yoduro de potasio (KI) de la irradiación tiroidea por 131I de la lluvia radiactiva". Health Physics . 78 (6): 660–667. doi :10.1097/00004032-200006000-00008. PMID 10832925. S2CID 30989865.
- ^ "Los isótopos médicos son la causa probable de la radiación en los desechos de Ottawa". CBC News . 4 de febrero de 2009. Archivado desde el original el 19 de noviembre de 2021 . Consultado el 30 de septiembre de 2015 .
- ^ Moser H, Rauert W (2007). "Trazadores isotópicos para la obtención de parámetros hidrológicos". En Aggarwal PK, Gat JR, Froehlich KF (eds.). Isótopos en el ciclo del agua: pasado, presente y futuro de una ciencia en desarrollo . Dordrecht: Springer. p. 11. ISBN 978-1-4020-6671-9Archivado desde el original el 19 de marzo de 2024 . Consultado el 6 de mayo de 2012 .
- ^ Rao SM (2006). "Radioisótopos de interés hidrológico". Hidrología isotópica práctica . Nueva Delhi: New India Publishing Agency. págs. 12-13. ISBN 978-81-89422-33-2Archivado desde el original el 19 de marzo de 2024 . Consultado el 6 de mayo de 2012 .
- ^ "Investigación de fugas en presas y embalses" (PDF) . IAEA.org . Archivado desde el original (PDF) el 30 de julio de 2013 . Consultado el 6 de mayo de 2012 .
- ^ Araguás LA, Bedmar AP (2002). "Trazadores radiactivos artificiales". Detección y prevención de fugas en presas . Taylor & Francis. pp. 179–181. ISBN 978-90-5809-355-4Archivado desde el original el 19 de marzo de 2024 . Consultado el 6 de mayo de 2012 .
- ^ Housecroft CE, Sharpe AG (2008). Química inorgánica (3.ª ed.). Prentice Hall. pág. 541. ISBN 978-0-13-175553-6.
- ^ Greenwood y Earnshaw, págs. 806-07
- ^ Greenwood y Earnshaw, págs. 809–812
- ^ abc Greenwood y Earnshaw, págs. 812–819
- ^ Holleman AF, Wiberg E (2001). Química inorgánica . San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Jones JH (2000). "El proceso Cativa para la fabricación de ácido acético" (PDF) . Platinum Metals Review . 44 (3): 94–105. doi :10.1595/003214000X44394105. Archivado (PDF) del original el 24 de septiembre de 2015. Consultado el 26 de agosto de 2023 .
- ^ Sunley GJ, Watsonv DJ (2000). "Catálisis de carbonilación de metanol de alta productividad utilizando iridio: el proceso Cativa para la fabricación de ácido acético". Catalysis Today . 58 (4): 293–307. doi :10.1016/S0920-5861(00)00263-7.
- ^ El aducto de amoniaco NI 3 •NH 3 es más estable y puede aislarse a temperatura ambiente como un sólido negro notoriamente sensible a los golpes.
- ^ Tornieporth-Oetting I, Klapötke T (junio de 1990). «Triyoduro de nitrógeno». Angewandte Chemie . 29 (6) (edición internacional): 677–679. doi :10.1002/anie.199006771. ISSN 0570-0833. Archivado desde el original el 5 de marzo de 2023 . Consultado el 5 de marzo de 2023 .
- ^ Vilarrubias P (17 de noviembre de 2022). «Los elusivos diyodosulfanos y diyodoselenanos». Física molecular . 120 (22): e2129106. Código Bibliográfico :2022MolPh.12029106V. doi :10.1080/00268976.2022.2129106. ISSN 0026-8976. S2CID 252744393. Archivado desde el original el 19 de marzo de 2024 . Consultado el 5 de marzo de 2023 .
- ^ Klapoetke T, Passmore J (1 de julio de 1989). «Compuestos de azufre y selenio yoduro: de la inexistencia a la importancia». Accounts of Chemical Research . 22 (7): 234–240. doi :10.1021/ar00163a002. ISSN 0001-4842. Archivado desde el original el 15 de enero de 2023 . Consultado el 15 de enero de 2023 .
- ^ abc Greenwood y Earnshaw, págs. 821–4
- ^ abcd Greenwood y Earnshaw, págs. 824–828
- ^ Greenwood y Earnshaw, págs. 828–831
- ^ Greenwood y Earnshaw, págs. 832–835
- ^ Greenwood y Earnshaw, págs. 851–853
- ^ abcd Greenwood y Earnshaw, págs. 853–9
- ^ Greenwood y Earnshaw, págs. 863-4
- ^ ab Greenwood y Earnshaw, págs. 872-5
- ^ Greenwood y Earnshaw, págs. 842-4
- ^ Greenwood y Earnshaw, págs. 835-9
- ^ Hofmann AW (1851). "Beiträge zur Kenntniss der flüchtigen organischen Basen". Annalen der Chemie und Pharmacie . 78 (3): 253–286. doi :10.1002/jlac.18510780302. Archivado desde el original el 1 de diciembre de 2022 . Consultado el 30 de junio de 2019 .
- ^ Williamson A (1850). «Teoría de la eterificación». Revista filosófica . 37 (251): 350–356. Archivado desde el original el 9 de noviembre de 2022. Consultado el 29 de septiembre de 2020 .(Enlace al extracto. Archivado el 23 de abril de 2019 en Wayback Machine )
- ^ Wurtz A (1855). "Ueber eine neue Klasse organischer Radicale". Annalen der Chemie und Pharmacie . 96 (3): 364–375. doi :10.1002/jlac.18550960310. Archivado desde el original el 3 de febrero de 2023 . Consultado el 30 de junio de 2019 .
- ^ Grignard V (1900). "Sur quelques nouvelles combinaisons organométaliques du magnésium et leur application à des synthèses d'alcools et d'hidrocabures". Cuentas de resultados de la Academia de Ciencias . 130 : 1322–25. Archivado desde el original el 8 de agosto de 2019 . Consultado el 2 de octubre de 2016 .
- ^ Lyday PA. "Yodo y compuestos de yodo". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a14_381. ISBN 978-3527306732.
- ^ Blanksby SJ, Ellison GB (abril de 2003). «Bond disociation energys of organic molecule» (Energías de disociación de enlaces de moléculas orgánicas) (PDF) . Accounts of Chemical Research . 36 (4): 255–263. CiteSeerX 10.1.1.616.3043 . doi :10.1021/ar020230d. PMID 12693923. Archivado desde el original (PDF) el 6 de febrero de 2009. Consultado el 25 de octubre de 2017 .
- ^ Boeckman Jr RK, Shao P, Mullins JJ (2000). "Peryodinano de Dess-Martin: 1,1,1-triacetoxi-1,1-dihidro-1,2-benciodoxol-3(1H)-ona" (PDF) . Síntesis orgánicas . 77 : 141; Volúmenes recopilados , vol. 10, pág. 696.
- ^ Jung ME, Parker MH (octubre de 1997). "Síntesis de varios monoterpenos polihalogenados de origen natural de la clase Halomon(1)". The Journal of Organic Chemistry . 62 (21): 7094–7095. doi :10.1021/jo971371. PMID 11671809.
- ^ abc Smith, Michael B., March, Jerry (2007), Química orgánica avanzada: reacciones, mecanismos y estructura (6.ª ed.), Nueva York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ "Datos de seguridad del yodometano". Universidad de Oxford. Archivado desde el original el 10 de agosto de 2010. Consultado el 12 de diciembre de 2008 .
- ^ Polgár L (agosto de 1979). "Efectos de los isótopos de deuterio en la acilación de la papaína. Evidencia de la falta de catálisis básica general y de la interacción enzima-grupo saliente". Revista Europea de Bioquímica . 98 (2): 369–374. doi : 10.1111/j.1432-1033.1979.tb13196.x . PMID 488108.
- ^ Ervithayasuporn V, Ervithayasuporn V, Pornsamutsin N, Pornsamutsin N, Prangyoo P, Prangyoo P, et al. (octubre de 2013). "Síntesis en un solo recipiente de silsesquioxanos intercambiados con halógeno: octakis(3-bromopropil)octasilsesquioxano y octakis(3-yodopropil)octasilsesquioxano". Dalton Transactions . 42 (37): 13747–13753. doi :10.1039/C3DT51373D. PMID 23907310. S2CID 41232118.
- ^ Streitwieser A (1956). "Reacciones de desplazamiento solvolítico en átomos de carbono saturados". Chemical Reviews . 56 (4): 571–752. doi :10.1021/cr50010a001.
- ^ Bordwell FG, Brannen WT (1964). "El efecto del carbonilo y grupos relacionados en la reactividad de los haluros en reacciones S N 2 ". Revista de la Sociedad Química Americana . 86 (21): 4645–4650. doi :10.1021/ja01075a025.
- ^ abc Greenwood y Earnshaw, págs. 795–796.
- ^ ab Kogel JE, Trivedi NC, Barker JM, Krukowski ST, eds. (2006). Minerales y rocas industriales: productos básicos, mercados y usos. SME. págs. 541–552. ISBN 978-0-87335-233-8.
- ^ Stanford EC (1862). "Sobre las aplicaciones económicas de las algas marinas". Revista de la Sociedad de las Artes : 185–189.
- ^ Maekawa T, Igari SI, Kaneko N (2006). "Composiciones químicas e isotópicas de salmueras de campos de gas natural de tipo disuelto en agua en Chiba, Japón". Revista Geoquímica . 40 (5): 475. Código bibliográfico : 2006GeocJ..40..475M. doi : 10.2343/geochemj.40.475 .
- ^ Greenwood y Earnshaw, pág. 799.
- ^ Emsley J (2001). Nature's Building Blocks (Tapa dura, primera edición). Oxford University Press . Págs. 244-250. ISBN. 978-0-19-850340-8.
- ^ Szász G, Buda L (1971). "Contribución a la reacción de alcaloides con tetrayodomercurato de potasio". Zeitschrift für Analytische Chemie de Fresenius . 253 (5). Springer Science y Business Media LLC: 361–363. doi :10.1007/bf00426350. ISSN 0016-1152. S2CID 91439011.
- ^ Sansonetti CJ (agosto de 1997). «Medidas precisas de componentes hiperfinos en el espectro del yodo molecular». Journal of the Optical Society of America B. 14 ( 8): 1913–1920. doi :10.2172/464573. OSTI 464573. Archivado desde el original el 4 de junio de 2021. Consultado el 11 de enero de 2020 .
- ^ ab Rafalskyi D, Martínez JM, Habl L, Zorzoli Rossi E, Proynov P, Boré A, et al. (noviembre de 2021). "Demostración en órbita de un sistema de propulsión eléctrica de yodo". Nature . 599 (7885): 411–415. Bibcode :2021Natur.599..411R. doi :10.1038/s41586-021-04015-y. PMC 8599014 . PMID 34789903.
Los iones de yodo atómicos y moleculares se aceleran mediante rejillas de alto voltaje para generar empuje, y se puede producir un haz altamente colimado con una disociación sustancial del yodo.
- ^ ab Ravisetti M (18 de noviembre de 2021). "Por primera vez en el espacio, los científicos prueban propulsores iónicos alimentados por yodo". CNET . Red Ventures . Archivado desde el original el 27 de noviembre de 2021 . Consultado el 29 de noviembre de 2021 .
- ^ Rogers, James Daniel. Materiales de cátodo hueco en un entorno de plasma de yodo . Tesis doctoral. Universidad de Alabama, 2023.
- ^ "Se utiliza un propulsor de yodo para cambiar la órbita de un pequeño satélite por primera vez en la historia". www.esa.int . Agencia Espacial Europea. 22 de enero de 2021. Archivado desde el original el 29 de noviembre de 2021 . Consultado el 29 de noviembre de 2021 .
- ^ Organización Mundial de la Salud (2009). Stuart MC, Kouimtzi M, Hill SR (eds.). Formulario Modelo de la OMS 2008. Organización Mundial de la Salud. pág. 499. hdl : 10665/44053 . ISBN. 978-92-4-154765-9.
- ^ Block SS (2001). Desinfección, esterilización y conservación . Hagerstwon, MD: Lippincott Williams & Wilkins. pág. 159. ISBN 978-0-683-30740-5.
- ^ "Solubilidad del KI en agua". Hazard.com. 21 de abril de 1998. Archivado desde el original el 23 de abril de 2012. Consultado el 21 de enero de 2013 .
- ^ "Directrices de procedimiento de la EANM para la terapia con 131I-meta-yodobencilguanidina (131I-mIBG)" (PDF) . 17 de junio de 2009. Archivado desde el original (PDF) el 17 de junio de 2009.
- ^ Lancaster JL. "Capítulo 4: Determinantes físicos del contraste" (PDF) . Física de la radiografía médica . Centro de Ciencias de la Salud de la Universidad de Texas. Archivado desde el original (PDF) el 10 de octubre de 2015.
- ^ abc Lyday PA, Kaiho T (2015). "Yodo y compuestos de yodo". Ullmann's Encyclopedia of Industrial Chemistry . Vol. A14. Weinheim: Wiley-VCH. págs. 382–390. doi :10.1002/14356007.a14_381.pub2. ISBN 978-3-527-30673-2.
- ^ Boutrot F, Zipfel C (agosto de 2017). "Función, descubrimiento y explotación de los receptores de reconocimiento de patrones de plantas para la resistencia a enfermedades de amplio espectro". Revisión anual de fitopatología . 55 (1). Revisiones anuales : 257–286. doi : 10.1146/annurev-phyto-080614-120106 . PMID 28617654.
- ^ ab Corgnale C, Gorensek MB, Summers WA (noviembre de 2020). "Revisión de los procesos de descomposición del ácido sulfúrico para los ciclos de producción termoquímica de hidrógeno basados en azufre". Procesos . 8 (11): 1383. doi : 10.3390/pr8111383 . ISSN 2227-9717.
- ^ Mornex, 1987 y Le Guen et al., 2000, citado por Le Guen B, Hemidy PY, Gonin M, Bailloeuil C, Van Boxsom D, Renier S, et al. (2001). "Argumentos y retorno de la experiencia sobre la distribución de yodo estable autour des centrales nucléaires françaises". Radioprotección . 36 (4): 417–430. doi : 10.1051/radiopro:2001101 .
- ^ Pol A, Barends TR, Dietl A, Khadem AF, Eygensteyn J, Jetten MS, et al. (enero de 2014). "Rare earth metals are essential for methanotrophic life in volcanic mudpots" (PDF) . Microbiología ambiental . 16 (1): 255–264. Código bibliográfico :2014EnvMi..16..255P. doi :10.1111/1462-2920.12249. PMID 24034209. Archivado (PDF) desde el original el 17 de enero de 2024 . Consultado el 17 de enero de 2024 .
- ^ Johnson JL, Rajagopalan KV, Mukund S, Adams MW. (5 de marzo de 1993). "Identificación de molibdopterina como el componente orgánico del cofactor de tungsteno en cuatro enzimas de Archaea hipertermófilas". Journal of Biological Chemistry . 268 (7): 4848–52. doi : 10.1016/S0021-9258(18)53474-8 . PMID 8444863.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Koribanics NM, Tuorto SJ, Lopez-Chiaffarelli N, McGuinness LR, Häggblom MM, Williams KH, et al. (2015). "Distribución espacial de una betaproteobacteria que respira uranio en el sitio de investigación de campo de Rifle, CO". MÁS UNO . 10 (4): e0123378. Código Bib : 2015PLoSO..1023378K. doi : 10.1371/journal.pone.0123378 . PMC 4395306 . PMID 25874721.
- ^ Irizarry L (23 de abril de 2014). "Toxicidad de la hormona tiroidea". Medscape . WedMD LLC. Archivado desde el original el 31 de octubre de 2021 . Consultado el 2 de mayo de 2014 .
- ^ Burns R, O'Herlihy C, Smyth PP (mayo de 2011). "La placenta como órgano compensatorio de almacenamiento de yodo". Tiroides . 21 (5): 541–6. doi :10.1089/thy.2010.0203. PMID 21417918.
- ^ Neven KY, Marien C, Janssen BG, Roels HA, Waegeneers N, Nawrot TS, et al. (13 de enero de 2020). "Variabilidad de las concentraciones de yodo en la placenta humana". Scientific Reports . 10 (1): 161. Bibcode :2020NatSR..10..161N. doi :10.1038/s41598-019-56775-3. PMC 6957482 . PMID 31932629.
- ^ abcd Patrick L (junio de 2008). "Yodo: deficiencia y consideraciones terapéuticas" (PDF) . Alternative Medicine Review . 13 (2): 116–127. PMID 18590348. Archivado desde el original (PDF) el 31 de mayo de 2013.
- ^ "Ingestas dietéticas de referencia (IDR): ingestas recomendadas para individuos, vitaminas". Instituto de Medicina . 2004. Archivado desde el original el 30 de octubre de 2009. Consultado el 9 de junio de 2010 .
- ^ ab Consejo Nacional de Investigación de los Estados Unidos (2000). Ingesta dietética de referencia para vitamina A, vitamina K, arsénico, boro, cromo, cobre, yodo, hierro, manganeso, molibdeno, níquel, silicio, vanadio y zinc. National Academies Press. págs. 258-259. doi :10.17226/10026. ISBN. 978-0-309-07279-3. PMID 25057538. Archivado desde el original el 25 de julio de 2015 . Consultado el 9 de marzo de 2008 .
- ^ "Resumen de los valores de referencia dietéticos para la población de la UE elaborados por el Panel de Productos Dietéticos, Nutrición y Alergias de la EFSA" (PDF) . 2017. Archivado (PDF) del original el 28 de agosto de 2017 . Consultado el 3 de diciembre de 2023 .
- ^ Venturi S, Venturi M (septiembre de 2009). "Yodo, timo e inmunidad". Nutrition . 25 (9): 977–979. doi :10.1016/j.nut.2009.06.002. PMID 19647627.
- ^ Ullberg S, Ewaldsson B (febrero de 1964). "Distribución de radioyodo estudiada mediante autorradiografía de cuerpo entero". Acta Radiologica . 2 : 24–32. doi :10.3109/02841866409134127. PMID 14153759.
- ^ Venturi S (2014). "Yodo, PUFAs y yodolípidos en la salud y la enfermedad: una perspectiva evolutiva". Evolución humana . 29 (1–3): 185–205. ISSN 0393-9375.
- ^ "¿De dónde obtenemos el yodo?". Iodine Global Network. Archivado desde el original el 13 de agosto de 2015.
- ^ ab "Yodo en la dieta". Enciclopedia Médica MedlinePlus . Archivado desde el original el 5 de julio de 2016. Consultado el 7 de abril de 2016 .
- ^ "Asociación Estadounidense de la Tiroides". thyroid.org . Asociación Estadounidense de la Tiroides. Archivado desde el original el 3 de agosto de 2023 . Consultado el 4 de abril de 2014 .
- ^ "Sal de mesa yodada Cerebos". Waitrose . 2023. Archivado desde el original el 28 de marzo de 2023 . Consultado el 30 de mayo de 2023 .
- ^ Caldwell KL, Makhmudov A, Ely E, Jones RL, Wang RY (abril de 2011). "Estado de yodo de la población estadounidense, Encuesta nacional de examen de salud y nutrición, 2005-2006 y 2007-2008". Tiroides . 21 (4): 419–427. doi :10.1089/thy.2010.0077. PMID 21323596. Archivado desde el original el 2 de diciembre de 2022 . Consultado el 29 de septiembre de 2020 .
- ^ ab Leung AM, Braverman LE, Pearce EN (noviembre de 2012). "Historia de la fortificación y suplementación con yodo en EE. UU." Nutrients . 4 (11): 1740–1746. doi : 10.3390/nu4111740 . PMC 3509517 . PMID 23201844.
- ^ Zava TT, Zava DT (octubre de 2011). "Evaluación de la ingesta de yodo en Japón basada en el consumo de algas marinas en Japón: un análisis basado en la literatura". Thyroid Research . 4 : 14. doi : 10.1186/1756-6614-4-14 . PMC 3204293 . PMID 21975053.
- ^ "Resumen de las ingestas dietéticas de referencia para los japoneses (2015)" (PDF) . Ministro de Salud, Trabajo y Bienestar Social, Japón. Archivado (PDF) del original el 23 de abril de 2021 . Consultado el 14 de marzo de 2022 .
- ^ Wu T, Liu GJ, Li P, Clar C (2002). Wu T (ed.). "Sal yodada para la prevención de trastornos por deficiencia de yodo". Base de datos Cochrane de revisiones sistemáticas . 2010 (3): CD003204. doi :10.1002/14651858.CD003204. PMC 9006116. PMID 12137681 .
- ^ Dissanayake CB, Chandrajith R, Tobschall HJ (1999). "El ciclo del yodo en el ambiente tropical: implicaciones en los trastornos por deficiencia de yodo". Revista Internacional de Estudios Ambientales . 56 (3): 357. Bibcode :1999IJEnS..56..357D. doi :10.1080/00207239908711210.
- ^ Felig P, Frohman LA (2001). "Bocio endémico". Endocrinología y metabolismo . McGraw-Hill Professional. ISBN 978-0-07-022001-0Archivado desde el original el 12 de enero de 2023 . Consultado el 29 de septiembre de 2020 .
- ^ "Deficiencia de micronutrientes: trastornos por carencia de yodo". OMS. Archivado desde el original el 30 de septiembre de 2006.
- ^ Zimmermann MB, Connolly K, Bozo M, Bridson J, Rohner F, Grimci L (enero de 2006). "La suplementación con yodo mejora la cognición en niños con deficiencia de yodo en Albania: un estudio aleatorizado, controlado y doble ciego". The American Journal of Clinical Nutrition . 83 (1): 108–114. doi : 10.1093/ajcn/83.1.108 . PMID 16400058.
- ^ "Yodo 207772". I2 . Archivado desde el original el 19 de marzo de 2024 . Consultado el 2 de octubre de 2018 .
- ^ Datos técnicos del yodo Archivado el 20 de mayo de 2023 en Wayback Machine . periodictable.com
- ^ Smyth PP (2003). "El papel del yodo en la defensa antioxidante en enfermedades de la tiroides y de la mama". BioFactors . 19 (3–4): 121–130. doi :10.1002/biof.5520190304. PMID 14757962. S2CID 7803619.
- ^ Yerkes C (2007). "Conferencia 29: Estructura y desnaturalización de proteínas". chem.uiuc.edu . Universidad de Illinois. Archivado desde el original el 31 de marzo de 2022 . Consultado el 23 de octubre de 2016 .
- ^ Lowe DO, Knowles SR, Weber EA, Railton CJ, Shear NH (noviembre de 2006). "Quemaduras inducidas por povidona yodada: informe de caso y revisión de la literatura". Farmacoterapia . 26 (11): 1641–1645. doi :10.1592/phco.26.11.1641. PMID 17064209. S2CID 25708713.
- ^ "Guía de bolsillo de los CDC y NIOSH sobre los peligros químicos: el yodo". cdc.gov . Archivado desde el original el 29 de noviembre de 2022 . Consultado el 6 de noviembre de 2015 .
- ^ DermNet New Zealand Trust, Yodo Archivado el 7 de julio de 2016 en Wayback Machine.
- ^ Boehm I (agosto de 2008). "Alergia a los mariscos y medios de contraste radiológico: ¿están los médicos propagando un mito?". The American Journal of Medicine . 121 (8): e19. doi : 10.1016/j.amjmed.2008.03.035 . PMID 18691465.
- ^ ab Departamento de Radiología e Imágenes Biomédicas de la UCSF, Alergia al Yodo y Administración de Contraste Archivado el 9 de abril de 2021 en Wayback Machine
- ^ Lombardo P, Nairz K, Boehm I (julio de 2019). "Seguridad de los pacientes y "alergia al yodo": ¿cómo debemos tratar a los pacientes con alergia al yodo antes de que reciban un medio de contraste yodado?". Revista Europea de Radiología . 116 (7): 150–151. doi :10.1016/j.ejrad.2019.05.002. PMID 31153557. S2CID 164898934.
- ^ Katelaris C (2009). "La etiqueta 'Alergia al yodo' es engañosa". Australian Prescriber . 32 (5): 125–128. doi : 10.18773/austprescr.2009.061 .
- ^ Skinner HF (1990). "Síntesis de metanfetamina mediante reducción de efedrina con ácido yodhídrico/fósforo rojo". Forensic Science International . 48 (2): 123–134. doi :10.1016/0379-0738(90)90104-7.
- ^ "PARTE 1310 - Sección 1310.02 Sustancias contempladas". Archivado desde el original el 17 de octubre de 2017 . Consultado el 5 de diciembre de 2019 .
Bibliografía
- Greenwood NN , Earnshaw A (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.





![{\displaystyle {\ce {TaI5{}+Ta->[{\text{gradiente térmico}}][{\ce {630^{\circ }C\ ->\ 575^{\circ }C}}] Ta6I14}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2bccb303062c4ab95661541d583e04d60a434c25)