Ácido

Un ácido es una molécula o ion capaz de donar un protón (es decir, ion hidrógeno, H + ), conocido como ácido de Brønsted-Lowry , o formar un enlace covalente con un par de electrones , conocido como ácido de Lewis . [1]
La primera categoría de ácidos son los donantes de protones, o ácidos de Brønsted-Lowry . En el caso especial de las soluciones acuosas , los donantes de protones forman el ion hidronio H 3 O + y se conocen como ácidos de Arrhenius . Brønsted y Lowry generalizaron la teoría de Arrhenius para incluir disolventes no acuosos . Un ácido de Brønsted o de Arrhenius suele contener un átomo de hidrógeno unido a una estructura química que sigue siendo energéticamente favorable después de la pérdida de H + .
Los ácidos de Arrhenius acuosos tienen propiedades características que proporcionan una descripción práctica de un ácido. [2] Los ácidos forman soluciones acuosas con un sabor agrio, pueden volver rojo el tornasol azul y reaccionan con bases y ciertos metales (como el calcio ) para formar sales . La palabra ácido se deriva del latín acidus , que significa 'agrio'. [3] Una solución acuosa de un ácido tiene un pH menor a 7 y coloquialmente también se conoce como "ácido" (como en "disuelto en ácido"), mientras que la definición estricta se refiere solo al soluto . [1] Un pH más bajo significa una acidez más alta y, por lo tanto, una mayor concentración de iones de hidrógeno positivos en la solución. Los productos químicos o sustancias que tienen la propiedad de un ácido se dice que son ácidos .
Los ácidos acuosos comunes incluyen ácido clorhídrico (una solución de cloruro de hidrógeno que se encuentra en el ácido gástrico en el estómago y activa las enzimas digestivas ), ácido acético (el vinagre es una solución acuosa diluida de este líquido), ácido sulfúrico (usado en baterías de automóviles ) y ácido cítrico (que se encuentra en frutas cítricas). Como muestran estos ejemplos, los ácidos (en el sentido coloquial) pueden ser soluciones o sustancias puras, y pueden derivar de ácidos (en el sentido estricto [1] ) que son sólidos, líquidos o gases. Los ácidos fuertes y algunos ácidos débiles concentrados son corrosivos , pero hay excepciones como los carboranos y el ácido bórico .
La segunda categoría de ácidos son los ácidos de Lewis , que forman un enlace covalente con un par de electrones. Un ejemplo es el trifluoruro de boro (BF 3 ), cuyo átomo de boro tiene un orbital vacante que puede formar un enlace covalente al compartir un par solitario de electrones en un átomo de una base, por ejemplo el átomo de nitrógeno en amoníaco (NH 3 ). Lewis consideró esto como una generalización de la definición de Brønsted, de modo que un ácido es una especie química que acepta pares de electrones ya sea directamente o liberando protones (H + ) en la solución, que luego aceptan pares de electrones. Sin embargo, el cloruro de hidrógeno, el ácido acético y la mayoría de los demás ácidos de Brønsted-Lowry no pueden formar un enlace covalente con un par de electrones y, por lo tanto, no son ácidos de Lewis. [4] Por el contrario, muchos ácidos de Lewis no son ácidos de Arrhenius o Brønsted-Lowry. En la terminología moderna, un ácido es implícitamente un ácido de Brønsted y no un ácido de Lewis, ya que los químicos casi siempre se refieren a un ácido de Lewis explícitamente como tal. [4]
Definiciones y conceptos
Las definiciones modernas se ocupan de las reacciones químicas fundamentales comunes a todos los ácidos.
La mayoría de los ácidos que encontramos en la vida cotidiana son soluciones acuosas o pueden disolverse en agua, por lo que las definiciones de Arrhenius y Brønsted–Lowry son las más relevantes.
La definición de Brønsted-Lowry es la más utilizada; a menos que se especifique lo contrario, se supone que las reacciones ácido-base implican la transferencia de un protón (H + ) de un ácido a una base.
Los iones hidronio son ácidos según las tres definiciones. Aunque los alcoholes y las aminas pueden ser ácidos de Brønsted-Lowry, también pueden funcionar como bases de Lewis debido a los pares de electrones solitarios en sus átomos de oxígeno y nitrógeno.
Ácidos de Arrhenius

En 1884, Svante Arrhenius atribuyó las propiedades de la acidez a los iones de hidrógeno (H + ), posteriormente descritos como protones o hidrones . Un ácido de Arrhenius es una sustancia que, cuando se añade al agua, aumenta la concentración de iones H + en el agua. [4] [5] Los químicos a menudo escriben H + ( aq ) y se refieren al ion hidrógeno cuando describen reacciones ácido-base, pero el núcleo de hidrógeno libre, un protón , no existe solo en el agua, existe como ion hidronio (H3O + ) u otras formas (H5O2 + , H9O4 + ) . Por tanto, un ácido de Arrhenius también puede describirse como una sustancia que aumenta la concentración de iones hidronio cuando se añade al agua. Los ejemplos incluyen sustancias moleculares como el cloruro de hidrógeno y el ácido acético.
Por otro lado, una base de Arrhenius es una sustancia que aumenta la concentración de iones hidróxido (OH − ) cuando se disuelve en agua. Esto disminuye la concentración de hidronio porque los iones reaccionan para formar moléculas de H 2 O:
- H3O+
(ac)+ OH−
(ac)⇌ H 2 O (líquido) + H 2 O (líquido)
Debido a este equilibrio, cualquier aumento en la concentración de hidronio va acompañado de una disminución en la concentración de hidróxido. Así, también se podría decir que un ácido de Arrhenius es aquel que disminuye la concentración de hidróxido, mientras que una base de Arrhenius la aumenta.
En una solución ácida, la concentración de iones hidronio es mayor que 10 −7 moles por litro. Como el pH se define como el logaritmo negativo de la concentración de iones hidronio, las soluciones ácidas tienen un pH menor que 7.
Ácidos de Brønsted-Lowry

Si bien el concepto de Arrhenius es útil para describir muchas reacciones, también es bastante limitado en su alcance. En 1923, los químicos Johannes Nicolaus Brønsted y Thomas Martin Lowry reconocieron de forma independiente que las reacciones ácido-base implican la transferencia de un protón. Un ácido de Brønsted-Lowry (o simplemente ácido de Brønsted) es una especie que dona un protón a una base de Brønsted-Lowry. [5] La teoría ácido-base de Brønsted-Lowry tiene varias ventajas sobre la teoría de Arrhenius. Considere las siguientes reacciones del ácido acético ( CH3COOH ), el ácido orgánico que le da al vinagre su sabor característico:
- CH3COOH + H2O ⇌ CH3COO − + H3O +
- CH 3 COOH + NH 3 ⇌ CH 3 COO − + NH+4
Ambas teorías describen fácilmente la primera reacción: el CH 3 COOH actúa como un ácido de Arrhenius porque actúa como una fuente de H 3 O + cuando se disuelve en agua, y actúa como un ácido de Brønsted al donar un protón al agua. En el segundo ejemplo, el CH 3 COOH sufre la misma transformación, en este caso donando un protón al amoniaco (NH 3 ), pero no se relaciona con la definición de ácido de Arrhenius porque la reacción no produce hidronio. Sin embargo, el CH 3 COOH es tanto un ácido de Arrhenius como un ácido de Brønsted-Lowry.
La teoría de Brønsted-Lowry se puede utilizar para describir las reacciones de compuestos moleculares en solución no acuosa o en fase gaseosa. El cloruro de hidrógeno (HCl) y el amoníaco se combinan en varias condiciones diferentes para formar cloruro de amonio , NH 4 Cl. En solución acuosa, el HCl se comporta como ácido clorhídrico y existe como iones hidronio y cloruro. Las siguientes reacciones ilustran las limitaciones de la definición de Arrhenius:
- H3O+
(ac)+Cl−
(ac)+NH3 → Cl−
(ac)+ Nueva Hampshire+
4( ac ) + H2O - HCl (benceno) + NH 3 (benceno) → NH 4 Cl (s)
- HCl (g) + NH3 (g) → NH4Cl ( s )
Al igual que con las reacciones del ácido acético, ambas definiciones funcionan para el primer ejemplo, donde el agua es el disolvente y el ion hidronio se forma a partir del soluto HCl. Las dos reacciones siguientes no implican la formación de iones, sino que siguen siendo reacciones de transferencia de protones. En la segunda reacción, el cloruro de hidrógeno y el amoníaco (disuelto en benceno ) reaccionan para formar cloruro de amonio sólido en un disolvente de benceno y, en la tercera, el HCl gaseoso y el NH3 se combinan para formar el sólido.
Ácidos de Lewis
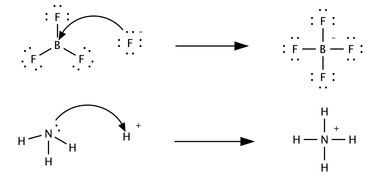
Un tercer concepto, sólo marginalmente relacionado, fue propuesto en 1923 por Gilbert N. Lewis , que incluye reacciones con características ácido-base que no implican una transferencia de protones. Un ácido de Lewis es una especie que acepta un par de electrones de otra especie; en otras palabras, es un aceptor de pares de electrones. [5] Las reacciones ácido-base de Brønsted son reacciones de transferencia de protones, mientras que las reacciones ácido-base de Lewis son transferencias de pares de electrones. Muchos ácidos de Lewis no son ácidos de Brønsted-Lowry. Compare cómo se describen las siguientes reacciones en términos de la química ácido-base:
En la primera reacción, un ion fluoruro , F − , cede un par de electrones al trifluoruro de boro para formar el producto tetrafluoroborato . El fluoruro "pierde" un par de electrones de valencia porque los electrones compartidos en el enlace B—F están ubicados en la región del espacio entre los dos núcleos atómicos y, por lo tanto, están más distantes del núcleo de fluoruro que en el ion fluoruro solitario. BF 3 es un ácido de Lewis porque acepta el par de electrones del fluoruro. Esta reacción no se puede describir en términos de la teoría de Brønsted porque no hay transferencia de protones.
La segunda reacción se puede describir utilizando cualquiera de las dos teorías. Se transfiere un protón de un ácido de Brønsted no especificado al amoníaco, una base de Brønsted; alternativamente, el amoníaco actúa como una base de Lewis y transfiere un par de electrones solitarios para formar un enlace con un ion hidrógeno. La especie que gana el par de electrones es el ácido de Lewis; por ejemplo, el átomo de oxígeno en H 3 O + gana un par de electrones cuando uno de los enlaces H—O se rompe y los electrones compartidos en el enlace se localizan en el oxígeno.
Dependiendo del contexto, un ácido de Lewis también puede describirse como un oxidante o un electrófilo . Los ácidos orgánicos de Brønsted, como el ácido acético, cítrico u oxálico, no son ácidos de Lewis. [4] Se disocian en agua para producir un ácido de Lewis, H + , pero al mismo tiempo, también producen una cantidad igual de una base de Lewis (acetato, citrato u oxalato, respectivamente, para los ácidos mencionados). Este artículo trata principalmente de los ácidos de Brønsted en lugar de los ácidos de Lewis.
Disociación y equilibrio
Las reacciones de los ácidos suelen generalizarse en la forma HA ⇌ H + + A − , donde HA representa el ácido y A − es la base conjugada . Esta reacción se denomina protólisis . La forma protonada (HA) de un ácido también se denomina a veces ácido libre . [6]
Los pares conjugados ácido-base difieren en un protón y pueden interconvertirse mediante la adición o eliminación de un protón ( protonación y desprotonación , respectivamente). El ácido puede ser la especie cargada y la base conjugada puede ser neutra, en cuyo caso el esquema de reacción generalizado podría escribirse como HA + ⇌ H + + A . En solución existe un equilibrio entre el ácido y su base conjugada. La constante de equilibrio K es una expresión de las concentraciones de equilibrio de las moléculas o los iones en solución. Los corchetes indican la concentración, de modo que [H 2 O] significa la concentración de H 2 O . La constante de disociación ácida K a se utiliza generalmente en el contexto de las reacciones ácido-base. El valor numérico de K a es igual al producto (multiplicación) de las concentraciones de los productos dividido por la concentración de los reactivos, donde el reactivo es el ácido (HA) y los productos son la base conjugada y H + .
El más fuerte de dos ácidos tendrá un valor de K a más alto que el ácido más débil; la relación de iones de hidrógeno con el ácido será mayor para el ácido más fuerte, ya que este último tiene una mayor tendencia a perder su protón. Debido a que el rango de valores posibles para K a abarca muchos órdenes de magnitud, se utiliza con más frecuencia una constante más manejable, p K a , donde p K a = −log 10 K a . Los ácidos más fuertes tienen un valor de p K a más bajo que los ácidos más débiles. Los valores de p K a determinados experimentalmente a 25 °C en solución acuosa se citan a menudo en libros de texto y material de referencia.
Nomenclatura
Los ácidos de Arrhenius se nombran según sus aniones . En el sistema de nomenclatura clásico, el sufijo iónico se elimina y se reemplaza por un nuevo sufijo, de acuerdo con la siguiente tabla. El prefijo "hidro-" se utiliza cuando el ácido está formado únicamente por hidrógeno y otro elemento. Por ejemplo, el HCl tiene cloruro como anión, por lo que se utiliza el prefijo hidro-, y el sufijo -uro hace que el nombre adopte la forma ácido clorhídrico .
Sistema de nombres clásico:
| Prefijo anión | Sufijo anión | Prefijo ácido | Sufijo ácido | Ejemplo |
|---|---|---|---|---|
| por | comió | por | ácido ico | ácido perclórico (HClO 4 ) |
| ácido clórico (HClO 3 ) | ||||
| eso | ácido osífero | ácido cloroso (HClO 2 ) | ||
| hipo | eso | hipo | ácido osífero | ácido hipocloroso (HClO) |
| idea | hidro | ácido ico | ácido clorhídrico (HCl) |
En el sistema de nomenclatura de la IUPAC , simplemente se añade "acuoso" al nombre del compuesto iónico. Por lo tanto, para el cloruro de hidrógeno, como solución ácida, el nombre de la IUPAC es cloruro de hidrógeno acuoso.
Fuerza del ácido
La fuerza de un ácido se refiere a su capacidad o tendencia a perder un protón. Un ácido fuerte es aquel que se disocia completamente en agua; en otras palabras, un mol de un ácido fuerte HA se disuelve en agua produciendo un mol de H + y un mol de la base conjugada, A − , y nada del ácido protonado HA. Por el contrario, un ácido débil solo se disocia parcialmente y en el equilibrio tanto el ácido como la base conjugada están en solución. Ejemplos de ácidos fuertes son el ácido clorhídrico (HCl), el ácido yodhídrico (HI), el ácido bromhídrico (HBr), el ácido perclórico (HClO 4 ), el ácido nítrico (HNO 3 ) y el ácido sulfúrico (H 2 SO 4 ). En el agua, cada uno de estos se ioniza esencialmente al 100%. Cuanto más fuerte es un ácido, más fácilmente pierde un protón, H + . Dos factores clave que contribuyen a la facilidad de desprotonación son la polaridad del enlace H—A y el tamaño del átomo A, que determina la fuerza del enlace H—A. La fuerza de los ácidos también suele analizarse en términos de la estabilidad de la base conjugada.
Los ácidos más fuertes tienen una constante de disociación ácida mayor , K a y una p K a menor que los ácidos más débiles.
Los ácidos sulfónicos , que son oxiácidos orgánicos, son una clase de ácidos fuertes. Un ejemplo común es el ácido toluenosulfónico (ácido tosílico). A diferencia del propio ácido sulfúrico, los ácidos sulfónicos pueden ser sólidos. De hecho, el poliestireno funcionalizado en sulfonato de poliestireno es un plástico sólido fuertemente ácido que se puede filtrar.
Los superácidos son ácidos más fuertes que el ácido sulfúrico al 100%. Algunos ejemplos de superácidos son el ácido fluoroantimónico , el ácido mágico y el ácido perclórico . El ácido más fuerte conocido es el ion hidruro de helio , [7] con una afinidad protónica de 177,8 kJ/mol. [8] Los superácidos pueden protonar permanentemente el agua para dar "sales" de hidronio cristalinas iónicas . También pueden estabilizar cuantitativamente los carbocationes .
Mientras que la K a mide la fuerza de un compuesto ácido, la fuerza de una solución ácida acuosa se mide por el pH, que es una indicación de la concentración de hidronio en la solución. El pH de una solución simple de un compuesto ácido en agua se determina por la dilución del compuesto y la K a del compuesto .
Fuerza del ácido de Lewis en soluciones no acuosas
Los ácidos de Lewis se han clasificado en el modelo ECW y se ha demostrado que no existe un orden único de fortalezas de los ácidos. [9] La fortaleza aceptora relativa de los ácidos de Lewis hacia una serie de bases, en comparación con otros ácidos de Lewis, se puede ilustrar mediante gráficos CB . [10] [11] Se ha demostrado que para definir el orden de fortaleza de los ácidos de Lewis se deben considerar al menos dos propiedades. Para la teoría HSAB cualitativa de Pearson, las dos propiedades son dureza y fortaleza, mientras que para el modelo ECW cuantitativo de Drago , las dos propiedades son electrostática y covalente.
Caracteristicas quimicas
Ácidos monopróticos
Los ácidos monopróticos, también conocidos como ácidos monobásicos, son aquellos ácidos que son capaces de donar un protón por molécula durante el proceso de disociación (a veces llamado ionización) como se muestra a continuación (simbolizado por HA):
- HA (aq) + H 2 O (l) ⇌ H 3 O + (aq) + A − (aq) K a
Ejemplos comunes de ácidos monopróticos en ácidos minerales incluyen ácido clorhídrico (HCl) y ácido nítrico (HNO3 ) . Por otro lado, para los ácidos orgánicos el término indica principalmente la presencia de un grupo ácido carboxílico y a veces estos ácidos se conocen como ácido monocarboxílico . Ejemplos de ácidos orgánicos incluyen ácido fórmico (HCOOH), ácido acético (CH3COOH ) y ácido benzoico (C6H5COOH ) .
Ácidos polipróticos
Los ácidos polipróticos, también conocidos como ácidos polibásicos, pueden donar más de un protón por molécula de ácido, a diferencia de los ácidos monopróticos que solo donan un protón por molécula. Los tipos específicos de ácidos polipróticos tienen nombres más específicos, como ácido diprótico (o dibásico) (dos protones potenciales para donar) y ácido triprótico (o tribásico) (tres protones potenciales para donar). Algunas macromoléculas, como las proteínas y los ácidos nucleicos, pueden tener una gran cantidad de protones ácidos. [12]
Un ácido diprótico (aquí simbolizado por H 2 A) puede sufrir una o dos disociaciones dependiendo del pH. Cada disociación tiene su propia constante de disociación, K a1 y K a2 .
- H 2 A (ac) + H 2 O (l) ⇌ H 3 O + (ac) + HA − (ac) K a1
- HA − (aq) + H 2 O (l) ⇌ H 3 O + (aq) + A 2− (aq) K a2
La primera constante de disociación suele ser mayor que la segunda (es decir, K a1 > K a2 ). Por ejemplo, el ácido sulfúrico (H 2 SO 4 ) puede donar un protón para formar el anión bisulfato (HSO−
4), para el cual K a1 es muy grande; entonces puede donar un segundo protón para formar el anión sulfato (SO2−
4), donde la K a2 es de fuerza intermedia. La gran K a1 para la primera disociación hace que el sulfúrico sea un ácido fuerte. De manera similar, el ácido carbónico débil e inestable (H 2 CO 3 ) puede perder un protón para formar el anión bicarbonato (HCO−
3) y pierden un segundo para formar el anión carbonato (CO2−
3). Ambos valores de K a son pequeños, pero K a1 > K a2 .
Un ácido triprótico (H 3 A) puede sufrir una, dos o tres disociaciones y tiene tres constantes de disociación, donde K a1 > K a2 > K a3 .
- H 3 A (ac) + H 2 O (l) ⇌ H 3 O + (ac) + H 2 A − (ac) K a1
- H 2 A − (aq) + H 2 O (l) ⇌ H 3 O + (aq) + HA 2− (aq) K a2
- HA 2− (aq) + H 2 O (l) ⇌ H 3 O + (aq) + A 3− (aq) K a3
Un ejemplo inorgánico de ácido triprótico es el ácido ortofosfórico (H 3 PO 4 ), normalmente llamado simplemente ácido fosfórico . Los tres protones pueden perderse sucesivamente para producir H 2 PO−
4, luego HPO2−
4, y finalmente PO3−
4, el ion ortofosfato, normalmente llamado simplemente fosfato . Aunque las posiciones de los tres protones en la molécula original de ácido fosfórico son equivalentes, los valores sucesivos de K a difieren ya que es energéticamente menos favorable perder un protón si la base conjugada tiene una carga más negativa. Un ejemplo orgánico de un ácido triprótico es el ácido cítrico , que puede perder sucesivamente tres protones para finalmente formar el ion citrato .
Aunque la pérdida posterior de cada ion hidrógeno es menos favorable, todas las bases conjugadas están presentes en la solución. Se puede calcular la concentración fraccionaria, α (alfa), para cada especie. Por ejemplo, un ácido diprótico genérico generará 3 especies en solución: H 2 A, HA − y A 2− . Las concentraciones fraccionarias se pueden calcular de la siguiente manera cuando se da el pH (que se puede convertir a [H + ]) o las concentraciones del ácido con todas sus bases conjugadas:
Un gráfico de estas concentraciones fraccionarias en función del pH, para valores dados de K 1 y K 2 , se conoce como gráfico de Bjerrum . Se observa un patrón en las ecuaciones anteriores y se puede ampliar al ácido n -prótico general que se ha desprotonado i veces:
donde K 0 = 1 y los otros términos K son las constantes de disociación del ácido.
Neutralización

La neutralización es la reacción entre un ácido y una base, produciendo una sal y una base neutralizada; por ejemplo, el ácido clorhídrico y el hidróxido de sodio forman cloruro de sodio y agua:
- HCl (acuoso) + NaOH (acuoso) → H 2 O (l) + NaCl (acuoso)
La neutralización es la base de la titulación , en la que un indicador de pH muestra el punto de equivalencia cuando se ha añadido el número equivalente de moles de una base a un ácido. A menudo se supone erróneamente que la neutralización debería dar como resultado una solución con un pH de 7,0, lo que solo ocurre con concentraciones de ácido y base similares durante una reacción.
La neutralización con una base más débil que el ácido da como resultado una sal débilmente ácida. Un ejemplo es el cloruro de amonio débilmente ácido , que se produce a partir del ácido fuerte cloruro de hidrógeno y la base débil amoníaco . Por el contrario, la neutralización de un ácido débil con una base fuerte da como resultado una sal débilmente básica (por ejemplo, fluoruro de sodio a partir de fluoruro de hidrógeno e hidróxido de sodio ).
Equilibrio ácido débil-base débil
Para que un ácido protonado pierda un protón, el pH del sistema debe aumentar por encima del p K a del ácido. La concentración reducida de H + en esa solución básica desplaza el equilibrio hacia la forma de base conjugada (la forma desprotonada del ácido). En soluciones con un pH más bajo (más ácidas), hay una concentración de H + suficientemente alta en la solución como para hacer que el ácido permanezca en su forma protonada.
Las soluciones de ácidos débiles y sales de sus bases conjugadas forman soluciones tampón .
Valoración
Para determinar la concentración de un ácido en una solución acuosa, se realiza comúnmente una titulación ácido-base. Se agrega una solución de base fuerte con una concentración conocida, generalmente NaOH o KOH, para neutralizar la solución ácida de acuerdo con el cambio de color del indicador con la cantidad de base agregada. [13] La curva de titulación de un ácido titulado por una base tiene dos ejes, con el volumen de la base en el eje x y el valor de pH de la solución en el eje y. El pH de la solución siempre aumenta a medida que se agrega la base a la solución.
Ejemplo: Ácido diprótico

Para cada curva de titulación de ácido diprótico, de izquierda a derecha, hay dos puntos medios, dos puntos de equivalencia y dos regiones de amortiguación. [15]
Puntos de equivalencia
Debido a los sucesivos procesos de disociación, hay dos puntos de equivalencia en la curva de titulación de un ácido diprótico. [16] El primer punto de equivalencia ocurre cuando se titulan todos los primeros iones de hidrógeno de la primera ionización. [17] En otras palabras, la cantidad de OH − añadido es igual a la cantidad original de H 2 A en el primer punto de equivalencia. El segundo punto de equivalencia ocurre cuando se titulan todos los iones de hidrógeno. Por lo tanto, la cantidad de OH − añadido es igual al doble de la cantidad de H 2 A en este momento. Para un ácido diprótico débil titulado por una base fuerte, el segundo punto de equivalencia debe ocurrir a un pH superior a 7 debido a la hidrólisis de las sales resultantes en la solución. [17] En cualquiera de los puntos de equivalencia, añadir una gota de base provocará el aumento más pronunciado del valor de pH en el sistema.
Regiones intermedias y puntos medios
Una curva de titulación para un ácido diprótico contiene dos puntos medios donde pH=pK a . Como hay dos valores diferentes de K a , el primer punto medio ocurre a pH=pK a1 y el segundo ocurre a pH=pK a2 . [18] Cada segmento de la curva que contiene un punto medio en su centro se denomina región tampón. Debido a que las regiones tampón consisten en el ácido y su base conjugada, puede resistir cambios de pH cuando se agrega la base hasta los siguientes puntos equivalentes. [5]
Aplicaciones de los ácidos
En la industria
Los ácidos son reactivos fundamentales en el tratamiento de casi todos los procesos de la industria moderna. El ácido sulfúrico, un ácido diprótico, es el ácido más utilizado en la industria y también es el químico industrial más producido en el mundo. Se utiliza principalmente en la producción de fertilizantes, detergentes, baterías y tintes, así como en el procesamiento de muchos productos como la eliminación de impurezas. [19] Según los datos estadísticos en 2011, la producción anual de ácido sulfúrico fue de alrededor de 200 millones de toneladas en el mundo. [20] Por ejemplo, los minerales de fosfato reaccionan con ácido sulfúrico para producir ácido fosfórico para la producción de fertilizantes de fosfato, y el zinc se produce disolviendo óxido de zinc en ácido sulfúrico, purificando la solución y electroobteniéndolo.
En la industria química, los ácidos reaccionan en reacciones de neutralización para producir sales. Por ejemplo, el ácido nítrico reacciona con el amoníaco para producir nitrato de amonio , un fertilizante. Además, los ácidos carboxílicos pueden esterificarse con alcoholes para producir ésteres .
Los ácidos se utilizan a menudo para eliminar el óxido y otros tipos de corrosión de los metales en un proceso conocido como decapado . Pueden utilizarse como electrolito en una batería de celda húmeda , como el ácido sulfúrico en una batería de automóvil .
En la comida

El ácido tartárico es un componente importante de algunos alimentos de uso común, como los mangos verdes y el tamarindo. Las frutas y verduras naturales también contienen ácidos. El ácido cítrico está presente en las naranjas, los limones y otras frutas cítricas. El ácido oxálico está presente en los tomates, las espinacas y, especialmente, en la carambola y el ruibarbo ; las hojas de ruibarbo y las carambolas verdes son tóxicas debido a las altas concentraciones de ácido oxálico. El ácido ascórbico (vitamina C) es una vitamina esencial para el cuerpo humano y está presente en alimentos como la amla ( grosella espinosa india ), el limón, las frutas cítricas y la guayaba.
En diversos tipos de alimentos se pueden encontrar muchos ácidos como aditivos, ya que alteran su sabor y sirven como conservantes. El ácido fosfórico , por ejemplo, es un componente de las bebidas de cola . El ácido acético se utiliza en la vida cotidiana en forma de vinagre. El ácido cítrico se utiliza como conservante en salsas y encurtidos.
El ácido carbónico es uno de los aditivos ácidos más comunes que se añaden a los refrescos . Durante el proceso de fabricación, el CO2 suele presurizarse para que se disuelva en estas bebidas y genere ácido carbónico. El ácido carbónico es muy inestable y tiende a descomponerse en agua y CO2 a temperatura y presión ambiente. Por lo tanto, cuando se abren las botellas o latas de este tipo de refrescos, estos burbujean y burbujean a medida que salen burbujas de CO2. [ 21]
Ciertos ácidos se utilizan como fármacos. El ácido acetilsalicílico (aspirina) se utiliza como analgésico y para bajar la fiebre.
En los cuerpos humanos
Los ácidos desempeñan papeles importantes en el cuerpo humano. El ácido clorhídrico presente en el estómago ayuda a la digestión al descomponer las moléculas grandes y complejas de los alimentos. Los aminoácidos son necesarios para la síntesis de proteínas necesarias para el crecimiento y la reparación de los tejidos corporales. Los ácidos grasos también son necesarios para el crecimiento y la reparación de los tejidos corporales. Los ácidos nucleicos son importantes para la fabricación de ADN y ARN y la transmisión de rasgos a la descendencia a través de los genes. El ácido carbónico es importante para el mantenimiento del equilibrio del pH en el cuerpo.
El cuerpo humano contiene una variedad de compuestos orgánicos e inorgánicos, entre los que los ácidos dicarboxílicos desempeñan un papel esencial en muchos comportamientos biológicos. Muchos de estos ácidos son aminoácidos , que sirven principalmente como materiales para la síntesis de proteínas. [22] Otros ácidos débiles sirven como amortiguadores con sus bases conjugadas para evitar que el pH del cuerpo sufra cambios a gran escala que serían perjudiciales para las células. [23] El resto de los ácidos dicarboxílicos también participan en la síntesis de varios compuestos biológicamente importantes en el cuerpo humano.
Catálisis ácida
Los ácidos se utilizan como catalizadores en la química industrial y orgánica; por ejemplo, el ácido sulfúrico se utiliza en cantidades muy grandes en el proceso de alquilación para producir gasolina. Algunos ácidos, como el sulfúrico, el fosfórico y el clorhídrico, también efectúan reacciones de deshidratación y condensación . En bioquímica, muchas enzimas emplean la catálisis ácida. [24]
Ocurrencia biológica
Muchas moléculas biológicamente importantes son ácidos. Los ácidos nucleicos , que contienen grupos fosfato ácidos , incluyen el ADN y el ARN . Los ácidos nucleicos contienen el código genético que determina muchas de las características de un organismo y se transmite de padres a hijos. El ADN contiene el modelo químico para la síntesis de proteínas , que están formadas por subunidades de aminoácidos . Las membranas celulares contienen ésteres de ácidos grasos como los fosfolípidos .
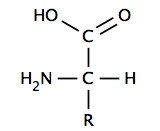
Un α-aminoácido tiene un carbono central (el carbono α o alfa ) que está unido covalentemente a un grupo carboxilo (por lo tanto son ácidos carboxílicos ), un grupo amino , un átomo de hidrógeno y un grupo variable. El grupo variable, también llamado grupo R o cadena lateral, determina la identidad y muchas de las propiedades de un aminoácido específico. En la glicina , el aminoácido más simple, el grupo R es un átomo de hidrógeno, pero en todos los demás aminoácidos contiene uno o más átomos de carbono unidos a hidrógenos, y puede contener otros elementos como azufre, oxígeno o nitrógeno. Con la excepción de la glicina, los aminoácidos naturales son quirales y casi invariablemente se presentan en la configuración L. El peptidoglicano , que se encuentra en algunas paredes celulares bacterianas , contiene algunos aminoácidos D. A un pH fisiológico, típicamente alrededor de 7, los aminoácidos libres existen en una forma cargada, donde el grupo carboxilo ácido (-COOH) pierde un protón (-COO − ) y el grupo amino básico (-NH 2 ) gana un protón (-NH+
3). La molécula entera tiene una carga neta neutra y es un zwitterión , con excepción de los aminoácidos con cadenas laterales básicas o ácidas. El ácido aspártico , por ejemplo, posee una amina protonada y dos grupos carboxilo desprotonados, para una carga neta de −1 a pH fisiológico.
Los ácidos grasos y los derivados de los ácidos grasos son otro grupo de ácidos carboxílicos que desempeñan un papel importante en la biología. Estos contienen largas cadenas de hidrocarburos y un grupo de ácido carboxílico en un extremo. La membrana celular de casi todos los organismos está formada principalmente por una bicapa de fosfolípidos , una micela de ésteres de ácidos grasos hidrófobos con grupos de "cabeza" de fosfato polares e hidrófilos . Las membranas contienen componentes adicionales, algunos de los cuales pueden participar en reacciones ácido-base.
En los seres humanos y en muchos otros animales, el ácido clorhídrico forma parte del ácido gástrico secretado en el estómago para ayudar a hidrolizar las proteínas y los polisacáridos , así como para convertir la proenzima inactiva pepsinógeno en la enzima pepsina . Algunos organismos producen ácidos para defenderse; por ejemplo, las hormigas producen ácido fórmico .
El equilibrio ácido-base desempeña un papel fundamental en la regulación de la respiración de los mamíferos . El gas oxígeno (O 2 ) impulsa la respiración celular , el proceso por el cual los animales liberan la energía potencial química almacenada en los alimentos, produciendo dióxido de carbono (CO 2 ) como subproducto. El oxígeno y el dióxido de carbono se intercambian en los pulmones , y el cuerpo responde a las cambiantes demandas de energía ajustando la tasa de ventilación . Por ejemplo, durante los períodos de esfuerzo, el cuerpo descompone rápidamente los carbohidratos y la grasa almacenados, liberando CO 2 en el torrente sanguíneo. En soluciones acuosas como la sangre, el CO 2 existe en equilibrio con el ácido carbónico y el ion bicarbonato .
- CO 2 + H 2 O ⇌ H 2 CO 3 ⇌ H + + HCO−3
Es la disminución del pH lo que envía señales al cerebro para que respire más rápido y más profundamente, expulsando el exceso de CO 2 y reabasteciendo las células con O 2 .

Las membranas celulares son generalmente impermeables a las moléculas cargadas o grandes y polares debido a las cadenas de acilo graso lipofílicas que comprenden su interior. Muchas moléculas biológicamente importantes, incluidos varios agentes farmacéuticos, son ácidos orgánicos débiles que pueden atravesar la membrana en su forma protonada y sin carga, pero no en su forma cargada (es decir, como base conjugada). Por esta razón, la actividad de muchos fármacos puede mejorarse o inhibirse mediante el uso de antiácidos o alimentos ácidos. Sin embargo, la forma cargada suele ser más soluble en la sangre y el citosol , ambos entornos acuosos. Cuando el entorno extracelular es más ácido que el pH neutro dentro de la célula, ciertos ácidos existirán en su forma neutra y serán solubles en la membrana, lo que les permitirá atravesar la bicapa de fosfolípidos. Los ácidos que pierden un protón en el pH intracelular existirán en su forma soluble y cargada y, por lo tanto, podrán difundirse a través del citosol hasta su objetivo. El ibuprofeno , la aspirina y la penicilina son ejemplos de fármacos que son ácidos débiles.
Ácidos comunes
Ácidos minerales (ácidos inorgánicos)
- Haluros de hidrógeno y sus soluciones: ácido fluorhídrico (HF), ácido clorhídrico (HCl), ácido bromhídrico (HBr), ácido yodhídrico (HI)
- Oxoácidos halogenados: ácido hipocloroso (HClO), ácido cloroso (HClO 2 ), ácido clórico (HClO 3 ), ácido perclórico (HClO 4 ) y análogos correspondientes para bromo y yodo.
- Ácido hipofluoroso (HFO), el único oxoácido conocido para el flúor.
- Ácido sulfúrico ( H2SO4 )
- Ácido fluorosulfúrico (HSO 3 F)
- Ácido nítrico (HNO 3 )
- Ácido fosfórico (H 3 PO 4 )
- Ácido fluoroantimónico (HSbF 6 )
- Ácido fluorobórico (HBF 4 )
- Ácido hexafluorofosfórico (HPF 6 )
- Ácido crómico (H 2 CrO 4 )
- Ácido bórico ( H3BO3 )
Ácidos sulfónicos
Un ácido sulfónico tiene la fórmula general RS(=O) 2 –OH, donde R es un radical orgánico.
- Ácido metanosulfónico (o ácido mesílico, CH 3 SO 3 H)
- Ácido etanosulfónico (o ácido esílico, CH 3 CH 2 SO 3 H)
- Ácido bencenosulfónico (o ácido besílico, C 6 H 5 SO 3 H)
- Ácido p-toluenosulfónico (o ácido tosílico, CH 3 C 6 H 4 SO 3 H)
- Ácido trifluorometanosulfónico (o ácido tríflico, CF 3 SO 3 H)
- Ácido poliestirenosulfónico ( poliestireno sulfonado , [ CH2CH ( C6H4 ) SO3H ] n )
Ácidos carboxílicos
Un ácido carboxílico tiene la fórmula general RC(O)OH, donde R es un radical orgánico. El grupo carboxilo -C(O)OH contiene un grupo carbonilo , C=O, y un grupo hidroxilo , OH.
- Ácido acético ( CH3COOH )
- Ácido cítrico (C 6 H 8 O 7 )
- Ácido fórmico (HCOOH)
- Ácido glucónico HOCH 2 -(CHOH) 4 -COOH
- Ácido láctico (CH3 - CHOH-COOH)
- Ácido oxálico (HOOC-COOH)
- Ácido tartárico (HOOC-CHOH-CHOH-COOH)
Ácidos carboxílicos halogenados
La halogenación en la posición alfa aumenta la fuerza del ácido, de modo que los ácidos siguientes son todos más fuertes que el ácido acético.
- Ácido fluoroacético
- Ácido trifluoroacético
- Ácido cloroacético
- Ácido dicloroacético
- Ácido tricloroacético
Ácidos carboxílicos vinílicos
Los ácidos carboxílicos normales son la unión directa de un grupo carbonilo y un grupo hidroxilo. En los ácidos carboxílicos vinílicos , un doble enlace carbono-carbono separa los grupos carbonilo e hidroxilo.
Ácidos nucleicos
- Ácido desoxirribonucleico (ADN)
- Ácido ribonucleico (ARN)
Referencias
- ^ abc Libro de Oro de la IUPAC - ácido
- ^ Petrucci, RH; Harwood, RS; Herring, FG (2002). Química general: principios y aplicaciones modernas (8.ª ed.). Prentice Hall. pág. 146. ISBN 0-13-014329-4.
- ^ Diccionario en línea Merriam-Webster: ácido
- ^ abcd Otoxby, DW; Gillis, HP; Butler, LJ (2015). Principios de la química moderna (8.ª ed.). Brooks Cole. pág. 617. ISBN 978-1305079113.
- ^ abcd Ebbing, Darrell; Gammon, Steven D. (1 de enero de 2016). Química general (11.ª ed.). Cengage Learning. ISBN 9781305887299.
- ^ Stahl PH, Nakamo M (2008). "Aspectos farmacéuticos de la forma de sal". En Stahl PH, Warmth CG (eds.). Manual de sales farmacéuticas: propiedades, selección y uso . Weinheim: Wiley-VCH. págs. 92–94. ISBN 978-3-906390-58-1.
- ^ "Hidridohelio (CHEBI:33689)". Entidades químicas de interés biológico (ChEBI) . Instituto Europeo de Bioinformática.
- ^ Lias, SG; Liebman, JF; Levin, RD (1984). "Evaluación de las basicidades en fase gaseosa y afinidades protónicas de las moléculas; calores de formación de moléculas protonadas". Journal of Physical and Chemical Reference Data . 13 (3): 695. Bibcode :1984JPCRD..13..695L. doi :10.1063/1.555719.
- ^ Vogel GC; Drago, RS (1996). "El modelo ECW". Revista de educación química . 73 (8): 701–707. Código Bibliográfico :1996JChEd..73..701V. doi :10.1021/ed073p701.
- ^ Laurence, C. y Gal, JF. Escalas de afinidad y basicidad de Lewis, Datos y medición (Wiley 2010), págs. 50-51 ISBN 978-0-470-74957-9
- ^ Cramer, RE; Bopp, TT (1977). "Visualización gráfica de las entalpías de formación de aductos para ácidos y bases de Lewis". Journal of Chemical Education . 54 : 612–613. doi :10.1021/ed054p612.Los gráficos que se muestran en este artículo utilizan parámetros más antiguos. Los parámetros E&C mejorados se enumeran en el modelo ECW .
- ^ Wyman, Jeffries; Tileston Edsall, John. "Capítulo 9: Ácidos polibásicos, bases y anfolitos, incluidas las proteínas". Química biofísica - Volumen 1 . pág. 477.
- ^ de Levie, Robert (1999). Equilibrios ácido-base acuosos y titulaciones . Nueva York: Oxford University Press.
- ^ Jameson, Reginald F. (1978). "Asignación de las constantes de asociación de protones para 3-(3,4-dihidroxifenil)alanina (L-dopa)". Journal of the Chemical Society, Dalton Transactions (1): 43–45. doi :10.1039/DT9780000043.
- ^ Helfferich, Friedrich G. (1 de enero de 1962). Intercambio iónico. Courier Corporation. ISBN 9780486687841.
- ^ "Titulación de ácido diprótico". dwb.unl.edu . Archivado desde el original el 7 de febrero de 2016 . Consultado el 24 de enero de 2016 .
- ^ ab Kotz, John C.; Treichel, Paul M.; Townsend, John; Treichel, David (24 de enero de 2014). Química y reactividad química. Cengage Learning. ISBN 9781305176461.
- ^ Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (1 de enero de 2005). Principios de bioquímica de Lehninger. Macmillan. ISBN 9780716743392.
- ^ "Los 10 principales productos químicos industriales - Para Dummies". dummies.com . Consultado el 5 de febrero de 2016 .
- ^ "Ácido sulfúrico". essentialchemicalindustry.org . Consultado el 6 de febrero de 2016 .
- ^ McMillin, John R.; Tracy, Gene A.; Harvill, William A.; Credle, William S. Jr. (8 de diciembre de 1981), Método y aparato para preparar y dispensar una bebida carbonatada utilizando gas propulsor de dióxido de carbono para carbonatar , consultado el 6 de febrero de 2016
- ^ Barrett, GC; Elmore, DT (junio de 2012). 8 - Funciones biológicas de los aminoácidos y los péptidos - University Publishing Online. doi :10.1017/CBO9781139163828. ISBN 9780521462921Archivado desde el original el 2 de marzo de 2016.
- ^ Graham, Timur (2006). "Acid Buffering". Tutorial en línea sobre la relación ácido-base . Universidad de Connecticut. Archivado desde el original el 13 de febrero de 2016. Consultado el 6 de febrero de 2016 .
- ^ Voet, Judith G.; Voet, Donald (2004). Bioquímica . Nueva York: J. Wiley & Sons. págs. 496–500. ISBN 978-0-471-19350-0.
- Listado de concentraciones de ácidos y bases comunes
- Zumdahl, Steven S. (1997). Química (4.ª ed.). Boston: Houghton Mifflin. ISBN 9780669417944.
- Pavia, DL; Lampman, GM; Kriz, GS (2004). Química orgánica, volumen I. Mason, OH: Cengage Learning. ISBN 0759347271.
Enlaces externos
- Curtipot: Diagramas de equilibrio ácido-base, cálculo de pH y simulación y análisis de curvas de titulación – freeware

![{\displaystyle K_{a}={\frac {{\ce {[H+] [A^{-}]}}}{{\ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ad1f54a70a45ea863263baa691826f3ee6cfb58)
![{\displaystyle {\begin{aligned}\alpha _{{\ce {H2A}}}&={\frac {{\ce {[H+]^2}}}{{\ce {[H+]^2} }+[{\ce {H+}}]K_{1}+K_{1}K_{2}}}={\frac {{\ce {[H2A]}}}{{\ce {{[H2A] }}}+[HA^{-}]+[A^{2-}]}}\\\alpha _{{\ce {HA^-}}}&={\frac {[{\ce {H+ }}]K_{1}}{{\ce {[H+]^2}}+[{\ce {H+}}]K_{1}+K_{1}K_{2}}}={\frac { {\ce {[HA^-]}}}{{\ce {[H2A]}}+{[HA^{-}]}+{[A^{2-}]}}}\\\alfa _{{\ce {A^{2-}}}}&= {\frac {K_{1}K_{2}}{{\ce {[H+]^2}}+[{\ce {H+}}]K_{1}+K_{1}K_{2}}} ={\frac {{\ce {[A^{2-}]}}}{{\ce {{[H2A]}}}+{[HA^{-}]}+{[A^{2- }]}}}\end{alineado}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e09f46996e12e5d2c821158e6bc6f70f54edbe7)
![{\displaystyle \alpha _{{\ce {H}}_{ni}A^{i-}}={{[{\ce {H+}}]^{ni}\displaystyle \prod _{j=0}^{i}K_{j}} \sobre {\displaystyle \sum _{i=0}^{n}{\Big [}[{\ce {H+}}]^{ni}\displaystyle \prod _{j=0}^{i}K_{j}}{\Big ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a82c39009cacb7d891f1f06a46a6558c3c91e76)