Cesio
El cesio ( en la IUPAC , también escrito cesium en inglés americano ) es un elemento químico ; su símbolo es Cs y su número atómico es 55. Es un metal alcalino blando, de color plateado-dorado , con un punto de fusión de 28,5 °C (83,3 °F; 301,6 K), lo que lo convierte en uno de los cinco metales elementales que son líquidos a temperatura ambiente o cerca de ella . El cesio tiene propiedades físicas y químicas similares a las del rubidio y el potasio . Es pirofórico y reacciona con el agua incluso a -116 °C (-177 °F). Es el elemento estable menos electronegativo , con un valor de 0,79 en la escala de Pauling . Tiene un solo isótopo estable , el cesio-133 . El cesio se extrae principalmente de la polucita . El cesio-137 , un producto de fisión , se extrae de los desechos producidos por los reactores nucleares . Tiene el radio atómico más grande de todos los elementos cuyos radios han sido medidos o calculados, aproximadamente 260 picómetros .
El químico alemán Robert Bunsen y el físico Gustav Kirchhoff descubrieron el cesio en 1860 mediante el método recientemente desarrollado de espectroscopia de llama . Las primeras aplicaciones a pequeña escala del cesio fueron como " captador " en tubos de vacío y en células fotoeléctricas . El cesio se utiliza ampliamente en relojes atómicos de alta precisión . En 1967, el Sistema Internacional de Unidades comenzó a utilizar una transición hiperfina específica de átomos neutros de cesio-133 para definir la unidad básica de tiempo, el segundo .
Desde la década de 1990, la mayor aplicación del elemento ha sido como formiato de cesio para fluidos de perforación , pero tiene una variedad de aplicaciones en la producción de electricidad, en electrónica y en química. El isótopo radiactivo cesio-137 tiene una vida media de aproximadamente 30 años y se utiliza en aplicaciones médicas, medidores industriales e hidrología. Los compuestos de cesio no radiactivos son solo levemente tóxicos , pero la tendencia del metal puro a reaccionar explosivamente con el agua significa que el cesio se considera un material peligroso y los radioisótopos presentan un riesgo significativo para la salud y el medio ambiente.
Ortografía
Cesio es la ortografía recomendada por la Unión Internacional de Química Pura y Aplicada (IUPAC). [10] La Sociedad Química Estadounidense (ACS) ha utilizado la ortografía cesio desde 1921, [11] [12] siguiendo el Nuevo Diccionario Internacional de Webster . El elemento recibió su nombre de la palabra latina caesius , que significa "gris azulado". [13] En los escritos medievales y modernos tempranos, caesius se escribía con la ligadura æ como cæsius ; por lo tanto, una ortografía alternativa pero ahora anticuada es cæsium . Más explicaciones de ortografía en ae/oe vs e .
Características
Propiedades físicas

De todos los elementos que son sólidos a temperatura ambiente, el cesio es el más blando: tiene una dureza de 0,2 Mohs . Es un metal muy dúctil , pálido, que se oscurece en presencia de trazas de oxígeno . [14] [15] [16] Cuando está en presencia de aceite mineral (donde se conserva mejor durante el transporte), pierde su brillo metálico y adquiere un aspecto más opaco y gris. Tiene un punto de fusión de 28,5 °C (83,3 °F), lo que lo convierte en uno de los pocos metales elementales que son líquidos cerca de la temperatura ambiente . Los otros son el rubidio (39 °C [102 °F]), el francio (estimado en 27 °C [81 °F]), el mercurio (−39 °C [−38 °F]) y el galio (30 °C [86 °F]); El bromo también es líquido a temperatura ambiente (se funde a -7,2 °C [19,0 °F]), pero es un halógeno y no un metal. El mercurio es el único metal elemental estable con un punto de fusión conocido inferior al del cesio. [17] Además, el metal tiene un punto de ebullición bastante bajo , 641 °C (1186 °F), el más bajo de todos los metales estables distintos del mercurio. [18] Se ha predicho que el copernicio y el flerovio tienen puntos de ebullición más bajos que el mercurio y el cesio, pero son extremadamente radiactivos y no es seguro que sean metales. [19] [20]

El cesio forma aleaciones con otros metales alcalinos, oro y mercurio ( amalgamas ). A temperaturas inferiores a 650 °C (1202 °F), no se alea con cobalto , hierro , molibdeno , níquel , platino , tantalio o tungsteno . Forma compuestos intermetálicos bien definidos con antimonio , galio , indio y torio , que son fotosensibles . [14] Se mezcla con todos los demás metales alcalinos (excepto el litio); la aleación con una distribución molar de 41% de cesio, 47% de potasio y 12% de sodio tiene el punto de fusión más bajo de cualquier aleación de metal conocida, a −78 °C (−108 °F). [17] [21] Se han estudiado algunas amalgamas: CsHg
2es negro con un brillo metálico púrpura , mientras que CsHg es de color dorado, también con un brillo metálico. [22]
El color dorado del cesio proviene de la frecuencia decreciente de la luz requerida para excitar los electrones de los metales alcalinos a medida que el grupo desciende. Para el litio hasta el rubidio esta frecuencia está en el ultravioleta, pero para el cesio entra en el extremo azul-violeta del espectro; en otras palabras, la frecuencia plasmónica de los metales alcalinos se vuelve más baja del litio al cesio. Por lo tanto, el cesio transmite y absorbe parcialmente la luz violeta preferentemente, mientras que otros colores (que tienen una frecuencia más baja) se reflejan; por lo tanto, parece amarillento. [23] Sus compuestos arden con un color azul [24] [25] o violeta [25] .
Alótropos
El cesio existe en forma de diferentes alótropos , uno de ellos un dímero llamado dicaesio. [26]
Propiedades químicas
El metal cesio es altamente reactivo y pirofórico . Se enciende espontáneamente en el aire y reacciona explosivamente con el agua incluso a bajas temperaturas, más que los otros metales alcalinos . [14] Reacciona con el hielo a temperaturas tan bajas como −116 °C (−177 °F). [17] Debido a esta alta reactividad, el metal cesio está clasificado como un material peligroso . Se almacena y se envía en hidrocarburos secos y saturados como aceite mineral . Solo se puede manipular bajo gas inerte , como argón . Sin embargo, una explosión de cesio-agua suele ser menos potente que una explosión de sodio -agua con una cantidad similar de sodio. Esto se debe a que el cesio explota instantáneamente al entrar en contacto con el agua, dejando poco tiempo para que se acumule el hidrógeno . [27] El cesio se puede almacenar en ampollas de vidrio de borosilicato selladas al vacío . En cantidades superiores a unos 100 gramos (3,5 oz), el cesio se envía en contenedores de acero inoxidable herméticamente sellados. [14]
La química del cesio es similar a la de otros metales alcalinos, en particular el rubidio , el elemento que se encuentra por encima del cesio en la tabla periódica. [28] Como se esperaba para un metal alcalino, el único estado de oxidación común es +1. Se diferencia de este valor en los cesídos, que contienen el anión Cs − y, por lo tanto, tienen al cesio en el estado de oxidación −1. [5] En condiciones de presión extrema (superior a 30 GPa ), los estudios teóricos indican que los electrones 5p internos podrían formar enlaces químicos, donde el cesio se comportaría como el séptimo elemento 5p, lo que sugiere que podrían existir fluoruros de cesio superiores con cesio en estados de oxidación de +2 a +6 en tales condiciones. [29] [30] Algunas ligeras diferencias surgen del hecho de que tiene una masa atómica superior y es más electropositivo que otros metales alcalinos (no radiactivos). [31] El cesio es el elemento químico más electropositivo. [17] El ion cesio también es más grande y menos "duro" que los de los metales alcalinos más ligeros .
Compuestos
La mayoría de los compuestos de cesio contienen el elemento como catión Cs.+
, que se une iónicamente a una amplia variedad de aniones . Una excepción notable es el anión cesídico ( Cs−
), [5] y otros son los diversos subóxidos (ver la sección sobre óxidos a continuación). Más recientemente, se predice que el cesio se comporta como un elemento del bloque p y es capaz de formar fluoruros superiores con estados de oxidación más altos (es decir, CsF n con n > 1) bajo alta presión. [32] Esta predicción necesita ser validada por experimentos adicionales. [33]
Las sales de Cs + suelen ser incoloras, a menos que el propio anión esté coloreado. Muchas de las sales simples son higroscópicas , pero menos que las sales correspondientes de metales alcalinos más ligeros. Las sales de fosfato , [34] acetato , carbonato , haluros , óxido , nitrato y sulfato son solubles en agua. Sus sales dobles suelen ser menos solubles, y la baja solubilidad del sulfato de cesio y aluminio se aprovecha para refinar Cs a partir de minerales. Las sales dobles con antimonio (como CsSbCl
4), el bismuto , el cadmio , el cobre , el hierro y el plomo también son poco solubles . [14]
El hidróxido de cesio (CsOH) es higroscópico y fuertemente básico . [28] Graba rápidamente la superficie de semiconductores como el silicio . [35] Los químicos han considerado anteriormente al CsOH como la "base más fuerte", lo que refleja la atracción relativamente débil entre el gran ion Cs + y el OH − ; [24] es de hecho la base de Arrhenius más fuerte ; sin embargo, varios compuestos como el n -butillitio , la amida de sodio , el hidruro de sodio , el hidruro de cesio , etc., que no se pueden disolver en agua porque reaccionan violentamente con ella, sino que solo se usan en algunos disolventes apróticos polares anhidros , son mucho más básicos sobre la base de la teoría ácido-base de Brønsted-Lowry . [28]
Una mezcla estequiométrica de cesio y oro reaccionará para formar aururo de cesio amarillo (Cs + Au − ) al calentarse. El anión aururo aquí se comporta como un pseudohalógeno . El compuesto reacciona violentamente con agua, produciendo hidróxido de cesio , oro metálico y gas hidrógeno; en amoníaco líquido se puede hacer reaccionar con una resina de intercambio iónico específica para cesio para producir aururo de tetrametilamonio . El compuesto de platino análogo , el platinuro de cesio rojo ( Cs 2 Pt ), contiene el ion platinuro que se comporta como un pseudocalcógeno . [ 36]
Complejos
Como todos los cationes metálicos, el Cs + forma complejos con bases de Lewis en solución. Debido a su gran tamaño, el Cs + suele adoptar números de coordinación mayores que 6, el número típico de los cationes de metales alcalinos más pequeños. Esta diferencia es evidente en la coordinación 8 del CsCl. Este alto número de coordinación y la suavidad (tendencia a formar enlaces covalentes) son propiedades que se aprovechan para separar el Cs + de otros cationes en la remediación de desechos nucleares, donde el Cs + debe separarse de grandes cantidades de K + no radiactivo . [37]
Haluros

El fluoruro de cesio (CsF) es un sólido blanco higroscópico que se usa ampliamente en la química de organofluorados como fuente de aniones fluoruro . [39] El fluoruro de cesio tiene la estructura de halita, lo que significa que el Cs + y el F − se empaquetan en una matriz cúbica más compacta, como lo hacen el Na + y el Cl − en el cloruro de sodio . [28] En particular, el cesio y el flúor tienen las electronegatividades más bajas y más altas , respectivamente, entre todos los elementos conocidos.
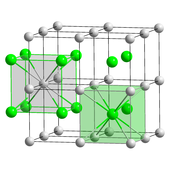
El cloruro de cesio (CsCl) cristaliza en el sistema cristalino cúbico simple . También llamado "estructura de cloruro de cesio", [31] este motivo estructural está compuesto por una red cúbica primitiva con una base de dos átomos, cada uno con una coordinación óctuple ; los átomos de cloruro se encuentran sobre los puntos de la red en los bordes del cubo, mientras que los átomos de cesio se encuentran en los agujeros en el centro de los cubos. Esta estructura es compartida con CsBr y CsI , y muchos otros compuestos que no contienen Cs. En contraste, la mayoría de los otros haluros alcalinos tienen la estructura de cloruro de sodio (NaCl). [31] La estructura CsCl es preferida porque Cs + tiene un radio iónico de 174 pm y Cl−
181 horas. [40]
Óxidos

11Oh
3grupo
Más que los demás metales alcalinos, el cesio forma numerosos compuestos binarios con el oxígeno . Cuando el cesio se quema en el aire, se forma el superóxido CsO
2es el producto principal. [41] El óxido de cesio "normal" ( Cs
2O ) forma cristales hexagonales de color amarillo anaranjado , [42] y es el único óxido del anti- CdCl
2tipo. [43] Se vaporiza a 250 °C (482 °F) y se descompone en cesio metálico y peróxido Cs.
2Oh
2a temperaturas superiores a 400 °C (752 °F). Además del superóxido y el ozónido CsO
3, [44] [45] También se han estudiado varios subóxidos de colores brillantes . [46] Estos incluyen Cs
7O , Cs
4O , Cs
11Oh
3, Cs
3O (verde oscuro [47] ), CsO, Cs
3Oh
2, [48] así como Cs
7Oh
2. [49] [50] Este último puede calentarse al vacío para generar Cs
2O. [43] También existen compuestos binarios con azufre , selenio y telurio . [14]
Isótopos
El cesio tiene 41 isótopos conocidos , cuyo número másico (es decir, el número de nucleones en el núcleo) varía de 112 a 152. Varios de estos se sintetizan a partir de elementos más ligeros mediante el proceso de captura lenta de neutrones ( proceso S ) dentro de estrellas viejas [51] y mediante el proceso R en explosiones de supernovas . [52] El único isótopo estable del cesio es el 133 Cs, con 78 neutrones . Aunque tiene un gran espín nuclear (7/2 +), los estudios de resonancia magnética nuclear pueden utilizar este isótopo a una frecuencia de resonancia de 11,7 MHz . [53]

El 135 Cs radiactivo tiene una vida media muy larga de unos 2,3 millones de años, la más larga de todos los isótopos radiactivos del cesio. El 137 Cs y el 134 Cs tienen vidas medias de 30 y dos años, respectivamente. El 137 Cs se descompone en un 137m Ba de vida corta por desintegración beta , y luego en bario no radiactivo, mientras que el 134 Cs se transforma en 134 Ba directamente. Los isótopos con números másicos de 129, 131, 132 y 136 tienen vidas medias de entre un día y dos semanas, mientras que la mayoría de los demás isótopos tienen vidas medias de unos pocos segundos a fracciones de segundo. Existen al menos 21 isómeros nucleares metaestables . Aparte del 134m Cs (con una vida media de poco menos de 3 horas), todos son muy inestables y se desintegran con vidas medias de unos pocos minutos o menos. [54] [55]
El isótopo 135 Cs es uno de los productos de fisión de larga duración del uranio producido en reactores nucleares . [56] Sin embargo, este rendimiento del producto de fisión se reduce en la mayoría de los reactores porque el predecesor, 135 Xe , es un potente veneno de neutrones y con frecuencia se transmuta en 136 Xe estable antes de que pueda desintegrarse en 135 Cs. [57] [58]
La desintegración beta de 137 Cs a 137m Ba produce radiación gamma a medida que el 137m Ba se relaja al estado fundamental 137 Ba, y los fotones emitidos tienen una energía de 0,6617 MeV. [59] 137 Cs y 90 Sr son los principales productos de vida media de la fisión nuclear y las principales fuentes de radiactividad del combustible nuclear gastado después de varios años de enfriamiento, que duran varios cientos de años. [60] Esos dos isótopos son la mayor fuente de radiactividad residual en el área del desastre de Chernóbil . [61] Debido a la baja tasa de captura, la eliminación de 137 Cs a través de la captura de neutrones no es factible y la única solución actual es permitir que se descomponga con el tiempo. [62]
Casi todo el cesio producido a partir de la fisión nuclear proviene de la desintegración beta de productos de fisión originalmente más ricos en neutrones, pasando a través de varios isótopos de yodo y xenón . [63] Debido a que el yodo y el xenón son volátiles y pueden difundirse a través del combustible nuclear o el aire, el cesio radiactivo a menudo se crea lejos del sitio original de la fisión. [64] Con las pruebas de armas nucleares entre los años 1950 y 1980, se liberó 137 Cs a la atmósfera y regresó a la superficie de la tierra como un componente de la lluvia radiactiva . Es un marcador fácil del movimiento del suelo y los sedimentos de esos tiempos. [14]
Aparición

El cesio es un elemento relativamente raro, con una concentración estimada en un promedio de 3 partes por millón en la corteza terrestre . [65] Es el 45.º elemento más abundante y el 36.º entre los metales. [66] El cesio es 30 veces menos abundante que el rubidio , con el que está estrechamente asociado, químicamente. [14]
Debido a su gran radio iónico , el cesio es uno de los " elementos incompatibles ". [67] Durante la cristalización del magma , el cesio se concentra en la fase líquida y cristaliza al final. Por lo tanto, los depósitos más grandes de cesio son los cuerpos de mineral de pegmatita zonal formados por este proceso de enriquecimiento. Debido a que el cesio no sustituye al potasio tan fácilmente como lo hace el rubidio, los minerales de evaporita alcalina silvita (KCl) y carnalita ( KMgCl
3·6H
2O ) puede contener solo un 0,002% de cesio. Por lo tanto, el cesio se encuentra en pocos minerales. Se pueden encontrar cantidades porcentuales de cesio en el berilo ( Be
3Alabama
2(SiO
3)
6) y avogadrita ( (K,Cs)BF
4), hasta un 15 % en peso de Cs 2 O en el mineral estrechamente relacionado pezzottaíta ( Cs(Be
2Li)Al
2Si
6Oh
18), hasta 8,4 % en peso de Cs 2 O en el raro mineral londonita ( (Cs,K)Al
4Ser
4(B,Ser)
12Oh
28), y menos en la rodizita más extendida . [14] El único mineral económicamente importante para el cesio es la polucita Cs(AlSi
2Oh
6) , que se encuentra en algunos lugares del mundo en pegmatitas zonificadas, asociadas con los minerales de litio de mayor importancia comercial, la lepidolita y la petalita . Dentro de las pegmatitas, el gran tamaño de grano y la fuerte separación de los minerales dan como resultado un mineral de alta calidad para la minería. [68]
La fuente más importante y rica de cesio conocida en el mundo es la mina Tanco en el lago Bernic en Manitoba , Canadá, que se estima que contiene 350.000 toneladas métricas de mineral de polucita, lo que representa más de dos tercios de la base de reservas del mundo. [68] [69] Aunque el contenido estequiométrico de cesio en la polucita es del 42,6%, las muestras de polucita pura de este depósito contienen solo alrededor del 34% de cesio, mientras que el contenido promedio es del 24% en peso. [69] La polucita comercial contiene más del 19% de cesio. [70] El depósito de pegmatita Bikita en Zimbabue se extrae por su petalita, pero también contiene una cantidad significativa de polucita. Otra fuente notable de polucita se encuentra en el desierto de Karibib , Namibia . [69] Al ritmo actual de producción minera mundial de 5 a 10 toneladas métricas por año, las reservas durarán miles de años. [14]
Producción
La extracción y refinación del mineral de polucita es un proceso selectivo y se lleva a cabo en menor escala que la de la mayoría de los demás metales. El mineral se tritura, se clasifica a mano, pero no suele concentrarse, y luego se muele. Luego, el cesio se extrae de la polucita principalmente mediante tres métodos: digestión ácida, descomposición alcalina y reducción directa. [14] [71]
En la digestión ácida, la roca polucita de silicato se disuelve con ácidos fuertes, como el clorhídrico (HCl), el sulfúrico ( H
2ENTONCES
4), bromhídrico (HBr) o fluorhídrico (HF). Con el ácido clorhídrico se produce una mezcla de cloruros solubles y las sales dobles de cloruro de cesio insolubles se precipitan como cloruro de cesio y antimonio ( Cs
4SbCl
7), cloruro de yodo y cesio ( Cs
2ICl ), o hexaclorocerato de cesio ( Cs
2(CeCl
6) ). Después de la separación, la sal doble precipitada pura se descompone y el CsCl puro se precipita evaporando el agua.
El método del ácido sulfúrico produce directamente la sal doble insoluble como alumbre de cesio ( CsAl(SO
4)
2·12H
2O ). El componente de sulfato de aluminio se convierte en óxido de aluminio insoluble tostando el alumbre con carbón , y el producto resultante se lixivia con agua para producir un Cs
2ENTONCES
4solución. [14]
La tostación de polucita con carbonato de calcio y cloruro de calcio produce silicatos de calcio insolubles y cloruro de cesio soluble. La lixiviación con agua o amoníaco diluido ( NH
4El OH ) produce una solución de cloruro diluido (CsCl). Esta solución se puede evaporar para producir cloruro de cesio o transformar en alumbre de cesio o carbonato de cesio. Aunque no es comercialmente factible, el mineral se puede reducir directamente con potasio, sodio o calcio al vacío para producir cesio metálico directamente. [14]
La mayor parte del cesio extraído (en forma de sales) se convierte directamente en formato de cesio (HCOO − Cs + ) para aplicaciones como la perforación petrolera . Para abastecer al mercado en desarrollo, Cabot Corporation construyó una planta de producción en 1997 en la mina Tanco cerca del lago Bernic en Manitoba , con una capacidad de 12.000 barriles (1.900 m 3 ) por año de solución de formato de cesio. [72] Los principales compuestos comerciales de cesio a menor escala son el cloruro y el nitrato de cesio . [73]
Alternativamente, el cesio metálico puede obtenerse a partir de compuestos purificados derivados del mineral. El cloruro de cesio y los demás haluros de cesio pueden reducirse a 700 a 800 °C (1292 a 1472 °F) con calcio o bario , y el cesio metálico puede destilarse a partir del resultado. De la misma manera, el aluminato, carbonato o hidróxido pueden reducirse con magnesio . [14]
El metal también se puede aislar mediante electrólisis de cianuro de cesio fundido (CsCN). Se puede producir cesio excepcionalmente puro y libre de gases mediante descomposición térmica a 390 °C (734 °F) de azida de cesio CsN
3, que se puede producir a partir de sulfato de cesio acuoso y azida de bario . [71] En aplicaciones de vacío, el dicromato de cesio se puede hacer reaccionar con circonio para producir cesio metálico puro sin otros productos gaseosos. [73]
- Cs
2Cr
2Oh
7+ 2Zr → 2Cs + 2ZrO
2+ Cr
2Oh
3
En 2009, el precio del cesio puro al 99,8% (base metálica) era de unos 10 dólares por gramo (280 dólares la onza), pero los compuestos son significativamente más baratos. [69]
Historia

En 1860, Robert Bunsen y Gustav Kirchhoff descubrieron el cesio en el agua mineral de Dürkheim , Alemania. Debido a las líneas azules brillantes en el espectro de emisión , derivaron el nombre de la palabra latina caesius , que significa ' gris azulado ' . [nota 1] [74] [75] [76] El cesio fue el primer elemento que se descubrió con un espectroscopio , que había sido inventado por Bunsen y Kirchhoff solo un año antes. [17]
Para obtener una muestra pura de cesio, se tuvieron que evaporar 44.000 litros (9.700 imp gal; 12.000 US gal) de agua mineral para producir 240 kilogramos (530 lb) de solución de sal concentrada. Los metales alcalinotérreos se precipitaron como sulfatos u oxalatos , dejando el metal alcalino en la solución. Después de la conversión a nitratos y la extracción con etanol , se obtuvo una mezcla libre de sodio. De esta mezcla, el litio se precipitó mediante carbonato de amonio . El potasio, el rubidio y el cesio forman sales insolubles con ácido cloroplatínico , pero estas sales muestran una ligera diferencia de solubilidad en agua caliente, y el hexacloroplatinato de cesio y rubidio menos soluble ( (Cs,Rb) 2 PtCl 6 ) se obtuvieron mediante cristalización fraccionada . Después de la reducción del hexacloroplatinato con hidrógeno , el cesio y el rubidio se separaron por la diferencia de solubilidad de sus carbonatos en alcohol. El proceso produjo 9,2 gramos (0,32 oz) de cloruro de rubidio y 7,3 gramos (0,26 oz) de cloruro de cesio a partir de los 44.000 litros iniciales de agua mineral. [75]
A partir del cloruro de cesio, los dos científicos estimaron el peso atómico del nuevo elemento en 123,35 (en comparación con el actualmente aceptado de 132,9). [75] Intentaron generar cesio elemental por electrólisis del cloruro de cesio fundido, pero en lugar de un metal, obtuvieron una sustancia homogénea azul que "ni a simple vista ni bajo el microscopio mostraba el más mínimo rastro de sustancia metálica"; como resultado, lo asignaron como un subcloruro ( Cs
2Cl ). En realidad, el producto era probablemente una mezcla coloidal del metal y cloruro de cesio. [77] La electrólisis de la solución acuosa de cloruro con un cátodo de mercurio produjo una amalgama de cesio que se descompuso fácilmente en condiciones acuosas. [75] El metal puro fue finalmente aislado por el químico sueco Carl Setterberg mientras trabajaba en su doctorado con Kekulé y Bunsen. [76] En 1882, produjo cesio metálico mediante la electrolisis del cianuro de cesio , evitando los problemas con el cloruro. [78]
Históricamente, el uso más importante del cesio ha sido en investigación y desarrollo, principalmente en los campos químico y eléctrico. Existieron muy pocas aplicaciones para el cesio hasta la década de 1920, cuando comenzó a usarse en tubos de vacío de radio , donde tenía dos funciones; como captador , eliminaba el exceso de oxígeno después de la fabricación, y como recubrimiento en el cátodo calentado , aumentaba la conductividad eléctrica . El cesio no fue reconocido como un metal industrial de alto rendimiento hasta la década de 1950. [79] Las aplicaciones para el cesio no radiactivo incluyeron células fotoeléctricas , tubos fotomultiplicadores , componentes ópticos de espectrofotómetros infrarrojos , catalizadores para varias reacciones orgánicas, cristales para contadores de centelleo y en generadores de energía magnetohidrodinámicos . [14] El cesio también se utiliza como fuente de iones positivos en la espectrometría de masas de iones secundarios (SIMS).
Desde 1967, el Sistema Internacional de Medidas ha basado la unidad primaria de tiempo, el segundo, en las propiedades del cesio. El Sistema Internacional de Unidades (SI) define el segundo como la duración de 9.192.631.770 ciclos en la frecuencia de microondas de la línea espectral correspondiente a la transición entre dos niveles de energía hiperfina del estado fundamental del cesio-133 . [80] La 13.ª Conferencia General de Pesos y Medidas de 1967 definió un segundo como: "la duración de 9.192.631.770 ciclos de luz de microondas absorbida o emitida por la transición hiperfina de los átomos de cesio-133 en su estado fundamental no perturbado por campos externos".
Aplicaciones
Exploración petrolera
El mayor uso actual del cesio no radiactivo es en fluidos de perforación de formiato de cesio para la industria petrolera extractiva . [14] Las soluciones acuosas de formiato de cesio (HCOO − Cs + )—elaboradas mediante la reacción de hidróxido de cesio con ácido fórmico —se desarrollaron a mediados de la década de 1990 para su uso como fluidos de perforación y terminación de pozos petroleros . La función de un fluido de perforación es lubricar las brocas, llevar los recortes de roca a la superficie y mantener la presión en la formación durante la perforación del pozo. Los fluidos de terminación ayudan a la colocación del hardware de control después de la perforación pero antes de la producción al mantener la presión. [14]
La alta densidad de la salmuera de formiato de cesio (hasta 2,3 g/cm 3 , o 19,2 libras por galón), [81] junto con la naturaleza relativamente benigna de la mayoría de los compuestos de cesio, reduce el requerimiento de sólidos suspendidos tóxicos de alta densidad en el fluido de perforación, una importante ventaja tecnológica, de ingeniería y ambiental. A diferencia de los componentes de muchos otros líquidos pesados, el formiato de cesio es relativamente ecológico. [81] La salmuera de formiato de cesio se puede mezclar con formiatos de potasio y sodio para disminuir la densidad de los fluidos a la del agua (1,0 g/cm 3 , o 8,3 libras por galón). Además, es biodegradable y puede reciclarse, lo que es importante en vista de su alto costo (alrededor de $4000 por barril en 2001). [82] Los formiatos alcalinos son seguros de manipular y no dañan la formación productora ni los metales del fondo del pozo como alternativa corrosiva, salmueras de alta densidad (como el bromuro de zinc ZnBr
2Las soluciones a veces lo hacen; también requieren menos limpieza y reducen los costos de eliminación. [14]
Relojes atómicos

Los relojes atómicos basados en cesio utilizan las transiciones electromagnéticas en la estructura hiperfina de los átomos de cesio-133 como punto de referencia. El primer reloj de cesio preciso fue construido por Louis Essen en 1955 en el Laboratorio Nacional de Física del Reino Unido. [83] Los relojes de cesio han mejorado durante el último medio siglo y se consideran "la realización más precisa de una unidad que la humanidad ha logrado hasta ahora". [80] Estos relojes miden la frecuencia con un error de 2 a 3 partes en 10 14 , lo que corresponde a una precisión de 2 nanosegundos por día, o un segundo en 1,4 millones de años. Las últimas versiones son más precisas que 1 parte en 10 15 , aproximadamente 1 segundo en 20 millones de años. [14] El estándar de cesio es el estándar principal para mediciones de tiempo y frecuencia que cumplen con los estándares. [84] Los relojes de cesio regulan la sincronización de las redes de telefonía celular e Internet. [85]
Definición del segundo
El segundo, símbolo s , es la unidad de tiempo del SI. El BIPM reiteró su definición en su 26.ª conferencia en 2018: "[El segundo] se define tomando el valor numérico fijo de la frecuencia del cesio Δ ν Cs , la frecuencia de transición hiperfina del estado fundamental no perturbado del átomo de cesio-133, como9 192 631 770 cuando se expresa en la unidad Hz , que es igual a s −1 ." [86]
Energía eléctrica y electrónica
Los generadores termoiónicos de vapor de cesio son dispositivos de bajo consumo que convierten la energía térmica en energía eléctrica. En el convertidor de tubo de vacío de dos electrodos , el cesio neutraliza la carga espacial cerca del cátodo y mejora el flujo de corriente. [87]
El cesio también es importante por sus propiedades fotoemisivas , que convierten la luz en flujo de electrones. Se utiliza en células fotoeléctricas porque los cátodos a base de cesio, como el compuesto intermetálico K
2El CsSb tiene un umbral de voltaje bajo para la emisión de electrones . [88] La gama de dispositivos fotoemisores que utilizan cesio incluye dispositivos de reconocimiento óptico de caracteres , tubos fotomultiplicadores y tubos de cámaras de vídeo . [89] [90] Sin embargo, el germanio , el rubidio, el selenio, el silicio, el telurio y varios otros elementos pueden sustituir al cesio en materiales fotosensibles. [14]
Los cristales de yoduro de cesio (CsI), bromuro (CsBr) y fluoruro (CsF) se emplean en los centelleadores de los contadores de centelleo, ampliamente utilizados en la exploración de minerales y en la investigación de la física de partículas para detectar la radiación gamma y de rayos X. Al ser un elemento pesado, el cesio proporciona un buen poder de detención con una mejor detección. Los compuestos de cesio pueden proporcionar una respuesta más rápida (CsF) y ser menos higroscópicos (CsI).
El vapor de cesio se utiliza en muchos magnetómetros comunes . [91]
El elemento se utiliza como estándar interno en espectrofotometría . [92] Al igual que otros metales alcalinos , el cesio tiene una gran afinidad por el oxígeno y se utiliza como " captador " en tubos de vacío . [93] Otros usos del metal incluyen láseres de alta energía , lámparas de vapor y rectificadores de vapor . [14]
Fluidos de centrifugación
La alta densidad del ion cesio produce soluciones de cloruro de cesio, sulfato de cesio y trifluoroacetato de cesio ( Cs(O
2CCF
3) ) útil en biología molecular para la ultracentrifugación en gradiente de densidad . [94] Esta tecnología se utiliza principalmente en el aislamiento de partículas virales , orgánulos y fracciones subcelulares y ácidos nucleicos de muestras biológicas. [95]
Uso químico y médico

Relativamente pocas aplicaciones químicas utilizan cesio. [96] El dopaje con compuestos de cesio mejora la eficacia de varios catalizadores de iones metálicos para la síntesis química, como el ácido acrílico , la antraquinona , el óxido de etileno , el metanol , el anhídrido ftálico , el estireno , los monómeros de metacrilato de metilo y varias olefinas . También se utiliza en la conversión catalítica de dióxido de azufre en trióxido de azufre en la producción de ácido sulfúrico . [14]
El fluoruro de cesio disfruta de un uso de nicho en la química orgánica como base [28] y como fuente anhidra de iones fluoruro . [97] Las sales de cesio a veces reemplazan a las sales de potasio o sodio en la síntesis orgánica , como la ciclización , la esterificación y la polimerización . El cesio también se ha utilizado en la dosimetría de radiación termoluminiscente (TLD) : cuando se expone a la radiación, adquiere defectos cristalinos que, cuando se calientan, revierten con la emisión de luz proporcional a la dosis recibida. Por lo tanto, la medición del pulso de luz con un tubo fotomultiplicador puede permitir cuantificar la dosis de radiación acumulada.
Aplicaciones nucleares e isotópicas
El cesio-137 es un radioisótopo que se utiliza comúnmente como emisor de rayos gamma en aplicaciones industriales. Sus ventajas incluyen una vida media de aproximadamente 30 años, su disponibilidad en el ciclo del combustible nuclear y tener 137 Ba como producto final estable. La alta solubilidad en agua es una desventaja que lo hace incompatible con los grandes irradiadores de piscinas para alimentos y suministros médicos. [98] Se ha utilizado en la agricultura, el tratamiento del cáncer y la esterilización de alimentos, lodos de depuradora y equipo quirúrgico. [14] [99] Los isótopos radiactivos del cesio en dispositivos de radiación se utilizaron en el campo médico para tratar ciertos tipos de cáncer, [100] pero la aparición de mejores alternativas y el uso de cloruro de cesio soluble en agua en las fuentes, que podría crear una contaminación de amplio alcance, gradualmente pusieron fuera de uso algunas de estas fuentes de cesio. [101] [102] El cesio-137 se ha empleado en una variedad de medidores de medición industriales, incluidos medidores de humedad, densidad, nivelación y espesor. [103] También se ha utilizado en dispositivos de registro de pozos para medir la densidad electrónica de las formaciones rocosas, que es análoga a la densidad aparente de las formaciones. [104]
El cesio-137 se ha utilizado en estudios hidrológicos análogos a los del tritio . Como producto secundario de las pruebas de bombas de fisión realizadas entre los años 1950 y mediados de los años 1980, el cesio-137 se liberó a la atmósfera, donde se absorbió fácilmente en solución. La variación conocida de un año a otro dentro de ese período permite la correlación con las capas de suelo y sedimento. El cesio-134, y en menor medida el cesio-135, también se han utilizado en hidrología para medir la producción de cesio de la industria de la energía nuclear. Si bien son menos frecuentes que el cesio-133 o el cesio-137, estos isótopos de referencia se producen únicamente a partir de fuentes antropogénicas. [105]
Otros usos

El cesio y el mercurio se utilizaron como propulsores en los primeros motores iónicos diseñados para la propulsión de naves espaciales en misiones interplanetarias o extraplanetarias muy largas. El combustible se ionizaba por contacto con un electrodo de tungsteno cargado . Pero la corrosión por cesio en los componentes de la nave espacial ha impulsado el desarrollo en la dirección de los propulsores de gas inerte, como el xenón , que son más fáciles de manejar en pruebas terrestres y causan menos daños potenciales a la nave espacial. [14] El xenón se utilizó en la nave espacial experimental Deep Space 1 lanzada en 1998. [106] [107] Sin embargo, se han construido propulsores de propulsión eléctrica de emisión de campo que aceleran iones metálicos líquidos como el cesio. [108]
El nitrato de cesio se utiliza como oxidante y colorante pirotécnico para quemar silicio en bengalas infrarrojas , [109] como la bengala LUU-19, [110] porque emite gran parte de su luz en el espectro infrarrojo cercano . [111] Los compuestos de cesio pueden haber sido utilizados como aditivos de combustible para reducir la firma de radar de las columnas de escape en el avión de reconocimiento Lockheed A-12 de la CIA . [112] El cesio y el rubidio se han añadido como carbonato al vidrio porque reducen la conductividad eléctrica y mejoran la estabilidad y durabilidad de las fibras ópticas y los dispositivos de visión nocturna . El fluoruro de cesio o el fluoruro de cesio y aluminio se utilizan en fundentes formulados para soldar aleaciones de aluminio que contienen magnesio . [14]
Se investigaron sistemas de generación de energía magnetohidrodinámicos (MHD) , pero no lograron una aceptación generalizada. [113] El metal cesio también se ha considerado como el fluido de trabajo en generadores turboeléctricos de ciclo Rankine de alta temperatura. [114]
Las sales de cesio se han evaluado como reactivos antichoque después de la administración de fármacos arsenicales . Sin embargo, debido a su efecto sobre el ritmo cardíaco, es menos probable que se utilicen que las sales de potasio o rubidio. También se han utilizado para tratar la epilepsia . [14]
El cesio-133 se puede enfriar con láser y utilizar para investigar problemas fundamentales y tecnológicos en física cuántica . Tiene un espectro de Feshbach particularmente conveniente para permitir estudios de átomos ultrafríos que requieren interacciones ajustables. [115]
Riesgos para la salud y la seguridad
| Peligros | |
|---|---|
| Etiquetado SGA : [116] | |
  | |
| Peligro | |
| H260 , H314 | |
| P223 , P231+P232 , P280 , P305+P351+P338 , P370+P378 , P422 | |
| NFPA 704 (rombo cortafuegos) | |

Los compuestos de cesio no radiactivos son sólo levemente tóxicos y el cesio no radiactivo no constituye un peligro ambiental significativo. Debido a que los procesos bioquímicos pueden confundir y sustituir el cesio por potasio , el exceso de cesio puede provocar hipocalemia , arritmia y paro cardíaco agudo , pero dichas cantidades no se encontrarían normalmente en fuentes naturales. [118] [119]
La dosis letal media (LD50 ) de cloruro de cesio en ratones es de 2,3 g por kilogramo, lo que es comparable a los valores de LD50 del cloruro de potasio y del cloruro de sodio . [120] El uso principal del cesio no radiactivo es como formato de cesio en fluidos de perforación de petróleo porque es mucho menos tóxico que las alternativas, aunque es más costoso. [81]
El cesio es uno de los elementos más reactivos y es altamente explosivo en presencia de agua. El gas hidrógeno producido por la reacción se calienta por la energía térmica liberada al mismo tiempo, lo que provoca la ignición y una explosión violenta. Esto puede ocurrir con otros metales alcalinos, pero el cesio es tan potente que esta reacción explosiva puede desencadenarse incluso con agua fría. [14]
Es altamente pirofórico : la temperatura de autoignición del cesio es de -116 °C (-177 °F) y se enciende explosivamente en el aire para formar hidróxido de cesio y varios óxidos. El hidróxido de cesio es una base muy fuerte y corroe rápidamente el vidrio. [18]
Los isótopos 134 y 137 están presentes en la biosfera en pequeñas cantidades debido a las actividades humanas, que difieren según la ubicación. El cesio radiactivo no se acumula en el cuerpo tan fácilmente como otros productos de fisión (como el yodo radiactivo y el estroncio radiactivo). Alrededor del 10% del cesio radiactivo absorbido se elimina del cuerpo con relativa rapidez en el sudor y la orina. El 90% restante tiene una vida media biológica de entre 50 y 150 días. [121] El cesio radiactivo sigue al potasio y tiende a acumularse en los tejidos vegetales, incluidas las frutas y verduras. [122] [123] [124] Las plantas varían ampliamente en la absorción de cesio, a veces mostrando una gran resistencia a él. También está bien documentado que los hongos de los bosques contaminados acumulan cesio radiactivo (cesio-137) en los esporocarpos de los hongos . [125] La acumulación de cesio-137 en los lagos ha sido una gran preocupación después del desastre de Chernóbil . [126] [127] Experimentos con perros mostraron que una dosis única de 3,8 milicurios (140 MBq , 4,1 μg de cesio-137) por kilogramo es letal en tres semanas; [128] cantidades menores pueden causar infertilidad y cáncer. [129] La Agencia Internacional de Energía Atómica y otras fuentes han advertido que materiales radiactivos, como el cesio-137, podrían usarse en dispositivos de dispersión radiológica, o " bombas sucias ". [130]
Véase también
- Cesio-137 § Incidentes y accidentes
- Accidente de Acerinox , accidente de contaminación por cesio-137 en 1998
- Accidente de Goiânia , un importante incidente de contaminación radiactiva ocurrido en 1987 con cesio-137
- Accidente radiológico de Kramatorsk , un incidente de pérdida de fuente de 137 Cs ocurrido entre 1980 y 1989
Notas
- ^ Bunsen cita Aulus Gellius Noctes Atticae II, 26 de Nigidius Figulus : Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.
Referencias
- ^ "Pesos atómicos estándar: cesio". CIAAW . 2013.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ Haynes, William M., ed. (2011). Manual de química y física del CRC (92.ª edición). Boca Raton, FL: CRC Press . pág. 4.121. ISBN. 1-4398-5511-0.
- ^ abc Dye, JL (1979). "Compuestos de aniones de metales alcalinos". Angewandte Chemie International Edition . 18 (8): 587–598. doi :10.1002/anie.197905871.
- ^ "Susceptibilidad magnética de los elementos y compuestos inorgánicos". Manual de química y física (PDF) (87.ª ed.). CRC press. ISBN 0-8493-0487-3. Recuperado el 26 de septiembre de 2010 .
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ "Medidas de vida media de radionúclidos del NIST". NIST . Consultado el 13 de marzo de 2011 .
- ^ "Tabla periódica de elementos de la IUPAC". Unión Internacional de Química Pura y Aplicada. Archivado desde el original el 10 de abril de 2016. Consultado el 2 de febrero de 2018 .
- ^ Unión Internacional de Química Pura y Aplicada (2005). Nomenclatura de la química inorgánica (Recomendaciones de la IUPAC 2005). Cambridge (Reino Unido): RSC – IUPAC . ISBN 0-85404-438-8 . pp. 248–49. Versión electrónica.
- ^ Coghill, Anne M.; Garson, Lorrin R., eds. (2006). Guía de estilo de la ACS: comunicación eficaz de la información científica (3.ª ed.). Washington, DC: American Chemical Society. pág. 127. ISBN 978-0-8412-3999-9.
- ^ Coplen, TB; Peiser, HS (1998). "Historia de los valores de peso atómico recomendados desde 1882 hasta 1997: una comparación de las diferencias entre los valores actuales y las incertidumbres estimadas de los valores anteriores" (PDF) . Pure Appl. Chem . 70 (1): 237–257. doi :10.1351/pac199870010237. S2CID 96729044. Archivado (PDF) desde el original el 21 de mayo de 2011.
- ^ Entrada del OED para "cesio" Archivado el 5 de marzo de 2024 en Wayback Machine . Segunda edición, 1989; versión en línea, junio de 2012. Consultado el 7 de septiembre de 2012. Versión anterior publicada por primera vez en New English Dictionary , 1888.
- ^ abcdefghijklmnopqrstu vwxyz aa Butterman, William C.; Brooks, William E.; Reese, Robert G. Jr. (2004). "Mineral Commodity Profile: Cesium" (PDF) . Servicio Geológico de los Estados Unidos. Archivado desde el original (PDF) el 7 de febrero de 2007 . Consultado el 27 de diciembre de 2009 .
- ^ Heiserman, David L. (1992). Exploración de elementos químicos y sus compuestos . McGraw-Hill. págs. 201–203. ISBN 978-0-8306-3015-8.
- ^ Addison, CC (1984). La química de los metales alcalinos líquidos. Wiley. ISBN 978-0-471-90508-0Archivado desde el original el 8 de septiembre de 2021 . Consultado el 28 de septiembre de 2012 .
- ^ abcde Kaner, Richard (2003). «C&EN: It's Elemental: The Periodic Table – Cesium». Sociedad Química Estadounidense. Archivado desde el original el 18 de junio de 2015. Consultado el 25 de febrero de 2010 .
- ^ ab «Datos químicos – Cesio – Cs». Royal Society of Chemistry. Archivado desde el original el 23 de noviembre de 2021. Consultado el 27 de septiembre de 2010 .
- ^ Mewes, J.-M.; Smits, Oregón; Kresse, G.; Schwerdtfeger, P. (2019). "El copernicio es un líquido noble relativista". Edición internacional Angewandte Chemie . doi :10.1002/anie.201906966. PMC 6916354 .
- ^ Mewes, Jan-Michael; Schwerdtfeger, Peter (11 de febrero de 2021). "Exclusivamente relativista: tendencias periódicas en los puntos de fusión y ebullición del grupo 12". Química aplicada . 60 (14): 7703–7709. doi :10.1002/anie.202100486. PMC 8048430 . PMID 33576164.
- ^ Taova, TM; et al. (22 de junio de 2003). Densidad de fundidos de metales alcalinos y sus sistemas ternarios Na-K-Cs y Na-K-Rb (PDF) . Decimoquinto simposio sobre propiedades termofísicas, Boulder, Colorado, Estados Unidos. Archivado desde el original (PDF) el 9 de octubre de 2006. Consultado el 26 de septiembre de 2010 .
- ^ Deiseroth, HJ (1997). "Amalgamaciones de metales alcalinos, un grupo de aleaciones inusuales". Progreso en química del estado sólido . 25 (1–2): 73–123. doi :10.1016/S0079-6786(97)81004-7.
- ^ Addison, CC (1984). La química de los metales alcalinos líquidos . Wiley. pág. 7. ISBN 9780471905080.
- ^ ab Lynch, Charles T. (1974). Manual de ciencia de materiales del CRC. CRC Press. pág. 13. ISBN 978-0-8493-2321-8Archivado desde el original el 5 de marzo de 2024 . Consultado el 8 de mayo de 2021 .
- ^ ab Clark, Jim (2005). "Flame Tests". chemguide . Archivado desde el original el 4 de diciembre de 2017 . Consultado el 29 de enero de 2012 .
- ^ CA, Onate (18 de marzo de 2021). "Energías ro-vibratorias del dímero de cesio y el dímero de litio con potencial de atracción molecular". Scientific Reports . 11 (1): 6198. doi :10.1038/s41598-021-85761-x. PMC 7973739 . PMID 33737625.
- ^ Gray, Theodore (2012) Los elementos , Black Dog & Leventhal Publishers, pág. 131, ISBN 1-57912-895-5 .
- ^ abcde Greenwood, NN; Earnshaw, A. (1984). Química de los elementos . Oxford, Reino Unido: Pergamon Press. ISBN 978-0-08-022057-4.
- ^ Miao, Maosheng; Sun, Yuanhui; Zurek, Eva; Lin, Haiqing (2020). "Química bajo alta presión". Nature Reviews Chemistry . 4 (10): 508–527. doi :10.1038/s41570-020-0213-0. ISSN 2397-3358.
- ^ Moskowitz, Clara. «Los cálculos demuestran que una regla básica de la química se puede romper». Scientific American . Archivado desde el original el 22 de noviembre de 2013. Consultado el 22 de noviembre de 2013 .
- ^ abc Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Vergleichende Übersicht über die Gruppe der Alkalimetalle". Lehrbuch der Anorganischen Chemie (en alemán) (91-100 ed.). Walter de Gruyter. págs. 953–955. ISBN 978-3-11-007511-3.
- ^ Miao, Mao-sheng (2013). "Cesio en estados de oxidación altos y como elemento del bloque p". Nature Chemistry . 5 (10): 846–852. arXiv : 1212.6290 . Bibcode :2013NatCh...5..846M. doi :10.1038/nchem.1754. ISSN 1755-4349. PMID 24056341. S2CID 38839337. Archivado desde el original el 9 de julio de 2023 . Consultado el 29 de julio de 2022 .
- ^ Sneed, D.; Pravica, M.; Kim, E.; Chen, N.; Park, C.; White, M. (1 de octubre de 2017). "Forzando el cesio a estados de oxidación más altos utilizando química inducida por rayos X duros útiles bajo alta presión". Journal of Physics: Conference Series . 950 (11, 2017): 042055. Bibcode :2017JPhCS.950d2055S. doi : 10.1088/1742-6596/950/4/042055 . ISSN 1742-6588. OSTI 1409108. S2CID 102912809.
- ^ Hogan, CM (2011). «Fosfato». Archivado desde el original el 25 de octubre de 2012. Consultado el 17 de junio de 2012 .En Enciclopedia de la Tierra . Jorgensen, A. y Cleveland, CJ (eds.). Consejo Nacional para la Ciencia y el Medio Ambiente. Washington DC.
- ^ Köhler, Michael J. (1999). Grabado en tecnología de microsistemas. Wiley-VCH. pág. 90. ISBN 978-3-527-29561-6.[ enlace muerto permanente ]
- ^ Jansen, Martin (30 de noviembre de 2005). "Efectos del movimiento relativista de los electrones en la química del oro y el platino". Solid State Sciences . 7 (12): 1464–1474. Bibcode :2005SSSci...7.1464J. doi : 10.1016/j.solidstatesciences.2005.06.015 .
- ^ Moyer, Bruce A.; Birdwell, Joseph F.; Bonnesen, Peter V.; Delmau, Laetitia H. (2005). Uso de macrociclos en la limpieza de desechos nucleares: una aplicación real de una corona de calix en la tecnología de separación de cesio . págs. 383–405. doi :10.1007/1-4020-3687-6_24. ISBN 978-1-4020-3364-3.
{{cite book}}:|journal=ignorado ( ayuda ) . - ^ Senga, Ryosuke; Suenaga, Kazu (2015). "Espectroscopia de pérdida de energía de electrones de un solo átomo de elementos ligeros". Nature Communications . 6 : 7943. Bibcode :2015NatCo...6.7943S. doi :10.1038/ncomms8943. PMC 4532884 . PMID 26228378.
- ^ Evans, FW; Litt, MH; Weidler-Kubanek, AM; Avonda, FP (1968). "Reacciones catalizadas por fluoruro de potasio. 111. La reacción de Knoevenagel". Revista de química orgánica . 33 (5): 1837–1839. doi :10.1021/jo01269a028.
- ^ Wells, AF (1984). Química inorgánica estructural (5.ª ed.). Oxford Science Publications. ISBN 978-0-19-855370-0.
- ^ Algodón, F. Albert; Wilkinson, G. (1962). Química inorgánica avanzada . John Wiley & Sons, Inc., pág. 318. ISBN 978-0-471-84997-1.
- ^ Lide, David R., ed. (2006). Manual de química y física del CRC (87.ª edición). Boca Raton, FL: CRC Press . pp. 451, 514. ISBN 0-8493-0487-3.
- ^ ab Tsai, Khi-Ruey; Harris, PM; Lassettre, EN (1956). "La estructura cristalina del monóxido de cesio". Journal of Physical Chemistry . 60 (3): 338–344. doi :10.1021/j150537a022. Archivado desde el original el 24 de septiembre de 2017.
- ^ Vol'nov, II; Matveev, VV (1963). "Síntesis de ozónido de cesio a través de superóxido de cesio". Boletín de la Academia de Ciencias, División de Ciencias Químicas de la URSS . 12 (6): 1040–1043. doi :10.1007/BF00845494.
- ^ Tokareva, SA (1971). "Ozónidos de metales alcalinos y alcalinotérreos". Russian Chemical Reviews . 40 (2): 165–174. Código Bibliográfico :1971RuCRv..40..165T. doi :10.1070/RC1971v040n02ABEH001903. S2CID 250883291.
- ^ Simon, A. (1997). "Subóxidos y subnitruros de los grupos 1 y 2: metales con agujeros y túneles de tamaño atómico". Coordination Chemistry Reviews . 163 : 253–270. doi :10.1016/S0010-8545(97)00013-1.
- ^ Tsai, Khi-Ruey; Harris, PM; Lassettre, EN (1956). "La estructura cristalina del monóxido de tricesio". Revista de química física . 60 (3): 345–347. doi :10.1021/j150537a023.
- ^ Okamoto, H. (2009). "Cs-O (cesio-oxígeno)". Revista de equilibrios de fases y difusión . 31 : 86–87. doi :10.1007/s11669-009-9636-5. S2CID : 96084147.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004). "Caracterización de óxidos de cesio". The Journal of Physical Chemistry B. 108 ( 33): 12360–12367. doi :10.1021/jp036432o.
- ^ Brauer, G. (1947). "Untersuchungen ber das System Csium-Sauerstoff". Zeitschrift für Anorganische Chemie . 255 (1–3): 101–124. doi :10.1002/zaac.19472550110.
- ^ Busso, M.; Gallino, R.; Wasserburg, GJ (1999). "Nucleosíntesis en estrellas de la rama asintótica gigante: relevancia para el enriquecimiento galáctico y la formación del sistema solar" (PDF) . Revista anual de astronomía y astrofísica . 37 : 239–309. Código Bibliográfico :1999ARA&A..37..239B. doi :10.1146/annurev.astro.37.1.239. Archivado (PDF) desde el original el 10 de octubre de 2022 . Consultado el 20 de febrero de 2010 .
- ^ Arnett, David (1996). Supernovas y nucleosíntesis: una investigación de la historia de la materia, desde el Big Bang hasta el presente . Princeton University Press. pág. 527. ISBN 978-0-691-01147-9.
- ^ Goff, C.; Matchette, Michael A.; Shabestary, Nahid; Khazaeli, Sadegh (1996). "Complejación de cationes de cesio y rubidio con éteres corona en N,N-dimetilformamida". Polyhedron . 15 (21): 3897–3903. doi :10.1016/0277-5387(96)00018-6.
- ^ Brown, F.; Hall, GR; Walter, AJ (1955). "La vida media del Cs137". Revista de química inorgánica y nuclear . 1 (4–5): 241–247. Bibcode :1955PhRv...99..188W. doi :10.1016/0022-1902(55)80027-9.
- ^ Sonzogni, Alejandro. «Gráfico interactivo de nucleidos». Centro Nacional de Datos Nucleares: Laboratorio Nacional de Brookhaven. Archivado desde el original el 22 de mayo de 2008. Consultado el 6 de junio de 2008 .
- ^ Ohki, Shigeo; Takaki, Naoyuki (14–16 de octubre de 2002). Transmutación de cesio-135 con reactores rápidos (PDF) . Séptima reunión de intercambio de información sobre partición y transmutación de actínidos y productos de fisión. Jeju, Corea. Archivado desde el original (PDF) el 28 de septiembre de 2011. Consultado el 26 de septiembre de 2010 .
- ^ "20 Xenón: un veneno producido por la fisión" (PDF) . Fundamentos de CANDU (informe). CANDU Owners Group Inc. Archivado desde el original (PDF) el 23 de julio de 2011. Consultado el 15 de septiembre de 2010 .
- ^ Taylor, VF; Evans, RD; Cornett, RJ (2008). "Evaluación preliminar de 135 Cs/ 137 Cs como herramienta forense para identificar la fuente de contaminación radiactiva". Journal of Environmental Radioactivity . 99 (1): 109–118. doi :10.1016/j.jenvrad.2007.07.006. PMID 17869392.
- ^ "Cesio | Protección radiológica". Agencia de Protección Ambiental de Estados Unidos. 28 de junio de 2006. Archivado desde el original el 15 de marzo de 2011. Consultado el 15 de febrero de 2010 .
- ^ Zerriffi, Hisham (24 de mayo de 2000). Informe del IEER: Transmutación: la apuesta de la alquimia nuclear (informe). Instituto de Investigación Energética y Ambiental. Archivado desde el original el 30 de mayo de 2011. Consultado el 15 de febrero de 2010 .
- ^ El legado de Chernóbil: impactos sanitarios, ambientales y socioeconómicos y recomendaciones a los gobiernos de Belarús, la Federación de Rusia y Ucrania (PDF) (Informe). Organismo Internacional de Energía Atómica. Archivado desde el original (PDF) el 15 de febrero de 2010. Consultado el 18 de febrero de 2010 .
- ^ Kase, Takeshi; Konashi, Kenji; Takahashi, Hiroshi; Hirao, Yasuo (1993). "Transmutación de cesio-137 utilizando un acelerador de protones". Revista de ciencia y tecnología nuclear . 30 (9): 911–918. doi : 10.3327/jnst.30.911 .
- ^ Knief, Ronald Allen (1992). "Fragmentos de fisión". Ingeniería nuclear: teoría y tecnología de la energía nuclear comercial . Taylor & Francis. pág. 42. ISBN 978-1-56032-088-3Archivado desde el original el 5 de marzo de 2024 . Consultado el 8 de mayo de 2021 .
- ^ Ishiwatari, N.; Nagai, H. "Liberación de xenón-137 y yodo-137 de pellets de UO2 mediante irradiación de neutrones pulsados en NSRR". Nippon Genshiryoku Gakkaishi . 23 (11): 843–850. OSTI 5714707.
- ^ Turekian, KK; Wedepohl, KH (1961). "Distribución de los elementos en algunas unidades principales de la corteza terrestre". Boletín de la Sociedad Geológica de América . 72 (2): 175–192. Código Bibliográfico :1961GSAB...72..175T. doi : 10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2 . ISSN 0016-7606.
- ^ Kloprogge, J. Theo; Ponce, Concepcion P.; Loomis, Tom (18 de noviembre de 2020). La tabla periódica: los componentes básicos de la naturaleza: una introducción a los elementos naturales, sus orígenes y sus usos. Elsevier. ISBN 978-0-12-821538-8Archivado desde el original el 16 de mayo de 2024 . Consultado el 16 de mayo de 2024 .
- ^ Rowland, Simon (4 de julio de 1998). «El cesio como materia prima: aparición y usos». Artemis Society International. Archivado desde el original el 8 de julio de 2021. Consultado el 15 de febrero de 2010 .
- ^ ab Černý, Petr ; Simpson, FM (1978). "La pegmatita de Tanco en el lago Bernic, Manitoba: X. Pollucite" (PDF) . Mineralogista canadiense . 16 : 325–333. Archivado (PDF) desde el original el 10 de octubre de 2022 . Consultado el 26 de septiembre de 2010 .
- ^ abcd Polyak, Désirée E. "Cesium" (PDF) . Servicio Geológico de Estados Unidos. Archivado (PDF) desde el original el 8 de mayo de 2009. Consultado el 17 de octubre de 2009 .
- ^ Norton, JJ (1973). «Litio, cesio y rubidio: los metales alcalinos raros». En Brobst, DA; Pratt, WP (eds.). Recursos minerales de los Estados Unidos . Vol. Documento 820. US Geological Survey Professional. págs. 365–378. Archivado desde el original el 21 de julio de 2010. Consultado el 26 de septiembre de 2010 .
- ^ ab Burt, RO (1993). "Cesio y compuestos de cesio". Enciclopedia Kirk-Othmer de tecnología química . Vol. 5 (4.ª ed.). Nueva York: John Wiley & Sons, Inc., págs. 749–764. ISBN 978-0-471-48494-3.
- ^ Benton, William; Turner, Jim (2000). "El fluido de formato de cesio tiene éxito en los ensayos de campo de alta presión y alta temperatura del Mar del Norte" (PDF) . Drilling Contractor (mayo/junio): 38–41. Archivado (PDF) desde el original el 6 de julio de 2001. Consultado el 26 de septiembre de 2010 .
- ^ ab Eagleson, Mary, ed. (1994). Enciclopedia concisa de química. Eagleson, Mary. Berlín: de Gruyter. p. 198. ISBN 978-3-11-011451-5Archivado desde el original el 5 de marzo de 2024 . Consultado el 8 de mayo de 2021 .
- ^ Diccionario Oxford de inglés , 2.ª edición
- ^ abcd Kirchhoff, G .; Bunsen, R. (1861). "Chemische Analyse durch Spectralbeobachtungen" (PDF) . Annalen der Physik und Chemie . 189 (7): 337–381. Código bibliográfico : 1861AnP...189..337K. doi : 10.1002/andp.18611890702. hdl :2027/hvd.32044080591324. Archivado (PDF) desde el original el 2 de marzo de 2016.
- ^ ab Weeks, Mary Elvira (1932). "El descubrimiento de los elementos. XIII. Algunos descubrimientos espectroscópicos". Revista de Educación Química . 9 (8): 1413–1434. Código Bibliográfico :1932JChEd...9.1413W. doi :10.1021/ed009p1413.
- ^ Zsigmondy, Richard (2007). Coloides y el ultramicroscopio. Leer libros. p. 69. ISBN 978-1-4067-5938-9Archivado desde el original el 5 de marzo de 2024 . Consultado el 11 de octubre de 2015 .
- ^ Setterberg, Carl (1882). "Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst". Los Annalen der Chemie de Justus Liebig . 211 : 100-116. doi :10.1002/jlac.18822110105. Archivado desde el original el 27 de abril de 2021 . Consultado el 25 de agosto de 2019 .
- ^ Strod, AJ (1957). "Cesio: un nuevo metal industrial". American Ceramic Bulletin . 36 (6): 212–213.
- ^ ab "Átomos de cesio en acción". Time Service Department—US Naval Observatory—Department of the Navy. Archivado desde el original el 23 de febrero de 2015. Consultado el 20 de diciembre de 2009 .
- ^ abc Downs, JD; Blaszczynski, M.; Turner, J.; Harris, M. (febrero de 2006). Perforación y terminación de pozos difíciles de alta y alta presión con la ayuda de salmueras de formiato de cesio: una revisión del desempeño. Conferencia de perforación de la IADC/SPE. Miami, Florida, EE. UU. Sociedad de Ingenieros Petroleros. doi :10.2118/99068-MS. Archivado desde el original el 12 de octubre de 2007.
- ^ Flatern, Rick (2001). "Mantenerse fresco en el entorno HPHT". Offshore Engineer (febrero): 33–37.
- ^ Essen, L.; Parry, JVL (1955). "Un patrón atómico de frecuencia e intervalo de tiempo: un resonador de cesio". Nature . 176 (4476): 280–282. Código Bibliográfico :1955Natur.176..280E. doi :10.1038/176280a0. S2CID 4191481.
- ^ Markowitz, W.; Hall, R.; Essen, L.; Parry, J. (1958). "Frecuencia del cesio en función del tiempo de efemérides". Physical Review Letters . 1 (3): 105–107. Código Bibliográfico :1958PhRvL...1..105M. doi :10.1103/PhysRevLett.1.105.
- ^ Reel, Monte (22 de julio de 2003). "Donde el timing lo es todo". The Washington Post . p. B1. Archivado desde el original el 29 de abril de 2013 . Consultado el 26 de enero de 2010 .
- ↑ «Resolución 1 de la 26ª CGPM» (en francés e inglés). París: Bureau International des Poids et Mesures. 2018. págs. 472 de la publicación oficial en francés. Archivado desde el original el 4 de febrero de 2021. Consultado el 29 de diciembre de 2019 .
- ^ Rasor, Ned S.; Warner, Charles (septiembre de 1964). "Correlación de los procesos de emisión para películas de álcali adsorbidas en superficies metálicas". Journal of Applied Physics . 35 (9): 2589–2600. Bibcode :1964JAP....35.2589R. doi :10.1063/1.1713806.
- ^ "Proveedor de cesio e información técnica". American Elements. Archivado desde el original el 7 de octubre de 2023. Consultado el 25 de enero de 2010 .
- ^ Smedley, John; Rao, Triveni; Wang, Erdong (2009). " Desarrollo de cátodos de K 2 CsSb". Actas de la conferencia AIP . 1149 (1): 1062–1066. Código Bibliográfico :2009AIPC.1149.1062S. doi :10.1063/1.3215593.
- ^ Görlich, P. (1936). "Über zusammengesetzte, durchsichtige Photokathoden". Zeitschrift für Physik . 101 (5–6): 335–342. Código Bib : 1936ZPhy..101..335G. doi :10.1007/BF01342330. S2CID 121613539.
- ^ Groeger, S.; Pazgalev, AS; Weis, A. (2005). "Comparación de magnetómetros de cesio bombeados por láser y lámparas de descarga". Applied Physics B . 80 (6): 645–654. arXiv : physics/0412011 . Código Bibliográfico :2005ApPhB..80..645G. doi :10.1007/s00340-005-1773-x. S2CID 36065775.
- ^ Haven, Mary C.; Tetrault, Gregory A.; Schenken, Jerald R. (1994). "Estándares internos". Instrumentación de laboratorio . Nueva York: John Wiley and Sons. pág. 108. ISBN 978-0-471-28572-4Archivado desde el original el 5 de marzo de 2024 . Consultado el 8 de mayo de 2021 .
- ^ McGee, James D. (1969). Dispositivos de imagen fotoelectrónica: actas del cuarto simposio celebrado en el Imperial College, Londres, del 16 al 20 de septiembre de 1968. Vol. 1. Academic Press. pág. 391. ISBN 978-0-12-014528-7Archivado desde el original el 5 de marzo de 2024 . Consultado el 8 de mayo de 2021 .
- ^ Manfred Bick, Horst Prinz, "Cesio y compuestos de cesio" en Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi :10.1002/14356007.a06_153.
- ^ Desai, Mohamed A., ed. (2000). "Gradient Materials". Métodos de procesamiento posteriores . Totowa, NJ: Humana Press. pp. 61–62. ISBN 978-0-89603-564-5Archivado desde el original el 5 de marzo de 2024 . Consultado el 8 de mayo de 2021 .
- ^ Burt, RO (1993). "Cesio y compuestos de cesio". Enciclopedia Kirk-Othmer de tecnología química . Vol. 5 (4.ª ed.). Nueva York: John Wiley & Sons. pág. 759. ISBN 978-0-471-15158-6.
- ^ Friestad, Gregory K.; Branchaud, Bruce P.; Navarrini, Walter y Sansotera, Maurizio (2007) "Fluoruro de cesio" en Enciclopedia de reactivos para síntesis orgánica , John Wiley & Sons. doi :10.1002/047084289X.rc050.pub2
- ^ Okumura, Takeshi (21 de octubre de 2003). «El flujo de material de cesio-137 radiactivo en los Estados Unidos en 2000» (PDF) . Agencia de Protección Ambiental de los Estados Unidos. Archivado desde el original (PDF) el 20 de julio de 2011. Consultado el 20 de diciembre de 2009 .
- ^ Jensen, NL (1985). "Cesio". Datos y problemas minerales . Vol. Boletín 675. Oficina de Minas de los Estados Unidos. Págs. 133-138.
- ^ "El isótopo médico de cesio-131 de IsoRay se utiliza en un procedimiento clave para tratar el cáncer de ojos en el Centro Médico Tufts-New England". Medical News Today . 17 de diciembre de 2007. Archivado desde el original el 29 de abril de 2021 . Consultado el 15 de febrero de 2010 .
- ^ Bentel, Gunilla Carleson (1996). "Máquinas de cesio-137". Planificación de la radioterapia . McGraw-Hill Professional. págs. 22-23. ISBN 978-0-07-005115-7Archivado desde el original el 5 de marzo de 2024 . Consultado el 26 de septiembre de 2010 .
- ^ Consejo Nacional de Investigación (EE. UU.). Comité sobre el uso y reemplazo de fuentes de radiación (2008). Uso y reemplazo de fuentes de radiación: versión abreviada. National Academies Press. ISBN 978-0-309-11014-3Archivado desde el original el 5 de marzo de 2024 . Consultado el 11 de octubre de 2015 .
- ^ Loxton, R.; Pope, P., eds. (1995). "Medición de nivel y densidad utilizando medidores nucleares sin contacto". Instrumentation : A Reader . Londres: Chapman & Hall. págs. 82–85. ISBN 978-0-412-53400-3Archivado desde el original el 5 de marzo de 2024 . Consultado el 8 de mayo de 2021 .
- ^ Timur, A.; Toksoz, MN (1985). "Registro geofísico de fondo de pozo". Revista anual de ciencias terrestres y planetarias . 13 : 315–344. Código Bibliográfico :1985AREPS..13..315T. doi :10.1146/annurev.ea.13.050185.001531.
- ^ Kendall, Carol . «Isotope Tracers Project – Resources on Isotopes – Cesium» (Proyecto de trazadores de isótopos: recursos sobre isótopos de cesio). Programa Nacional de Investigación – Servicio Geológico de Estados Unidos. Archivado desde el original el 8 de julio de 2021. Consultado el 25 de enero de 2010 .
- ^ Marcucci, MG; Polk, JE (2000). "Propulsor de iones de xenón NSTAR en Deep Space 1: pruebas en tierra y en vuelo (invitado)". Review of Scientific Instruments . 71 (3): 1389–1400. Bibcode :2000RScI...71.1389M. doi :10.1063/1.1150468.
- ^ Sovey, James S.; Rawlin, Vincent K.; Patterson, Michael J. "Una sinopsis de los proyectos de desarrollo de propulsión iónica en los Estados Unidos: desde SERT I hasta Deep Space I" (PDF) . NASA. Archivado desde el original (PDF) el 29 de junio de 2009 . Consultado el 12 de diciembre de 2009 .
- ^ Marrese, C.; Polk, J.; Mueller, J.; Owens, A.; Tajmar, M.; Fink, R. y Spindt, C. (octubre de 2001). Neutralización de haces de iones de propulsores In-FEEP con cátodos termoiónicos y de emisión de campo. 27.ª Conferencia Internacional de Propulsión Eléctrica. Pasadena, California. págs. 1–15. Archivado desde el original (PDF) el 27 de mayo de 2010. Consultado el 25 de enero de 2010 .
- ^ "Composiciones de iluminación infrarroja y artículos que las contienen". Patente de Estados Unidos 6230628 . Freepatentsonline.com. Archivado desde el original el 8 de julio de 2021 . Consultado el 25 de enero de 2010 .
- ^ "LUU-19 Flare". Federación de Científicos Americanos. 23 de abril de 2000. Archivado desde el original el 6 de agosto de 2010. Consultado el 12 de diciembre de 2009 .
- ^ Charrier, E.; Charsley, EL; Laye, PG; Markham, HM; Berger, B.; Griffiths, TT (2006). "Determinación de la temperatura y la entalpía de la transición de fase sólido-sólido del nitrato de cesio mediante calorimetría diferencial de barrido". Thermochimica Acta . 445 (1): 36–39. Bibcode :2006TcAc..445...36C. doi :10.1016/j.tca.2006.04.002.
- ^ Crickmore, Paul F. (2000). Lockheed SR-71: las misiones secretas expuestas . Osprey. pág. 47. ISBN 978-1-84176-098-8.
- ^ Consejo Nacional de Investigación (EE. UU.) (2001). Investigación energética en el DOE: ¿Valió la pena?. National Academy Press. págs. 190-194. doi :10.17226/10165. ISBN 978-0-309-07448-3Archivado desde el original el 23 de marzo de 2016 . Consultado el 26 de septiembre de 2010 .
- ^ Roskill Information Services (1984). Economía del cesio y el rubidio (Informes sobre metales y minerales) . Londres, Reino Unido: Roskill Information Services. pág. 51. ISBN. 978-0-86214-250-6.
- ^ Chin, Cheng; Grimm, Rudolf; Julienne, Paul; Tiesinga, Eite (29 de abril de 2010). "Resonancias de Feshbach en gases ultrafríos". Reseñas de Física Moderna . 82 (2): 1225–1286. arXiv : 0812.1496 . Código Bibliográfico :2010RvMP...82.1225C. doi :10.1103/RevModPhys.82.1225. S2CID 118340314.
- ^ "Cesio 239240". Sigma-Aldrich. 26 de septiembre de 2021. Archivado desde el original el 30 de octubre de 2020. Consultado el 21 de diciembre de 2021 .
- ^ Datos de The Radiochemical Manual y Wilson, BJ (1966) The Radiochemical Manual (2.ª ed.).
- ^ Melnikov, P.; Zanoni, LZ (junio de 2010). "Efectos clínicos de la ingesta de cesio". Biological Trace Element Research . 135 (1–3): 1–9. Bibcode :2010BTER..135....1M. doi :10.1007/s12011-009-8486-7. PMID 19655100. S2CID 19186683.
- ^ Pinsky, Carl; Bose, Ranjan; Taylor, JR; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). "Cesio en mamíferos: toxicidad aguda, cambios en los órganos y acumulación en los tejidos". Journal of Environmental Science and Health, Parte A . 16 (5): 549–567. Bibcode :1981JESHA..16..549P. doi :10.1080/10934528109375003.
- ^ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). "Toxicidad aguda de los compuestos de cesio y rubidio". Toxicología y farmacología aplicada . 32 (2): 239–245. Bibcode :1975ToxAP..32..239J. doi :10.1016/0041-008X(75)90216-1. PMID 1154391.
- ^ Rundo, J. (1964). "Un estudio del metabolismo del cesio en el hombre". Revista británica de radiología . 37 (434): 108-114. doi :10.1259/0007-1285-37-434-108. PMID 14120787.
- ^ Nishita, H.; Dixon, D.; Larson, KH (1962). "Acumulación de Cs y K y crecimiento de plantas de frijol en solución nutritiva y suelos". Planta y suelo . 17 (2): 221–242. Código Bibliográfico :1962PlSoi..17..221N. doi :10.1007/BF01376226. S2CID 10293954.
- ^ Avery, S. (1996). "Destino del cesio en el medio ambiente: distribución entre los componentes abióticos y bióticos de los ecosistemas acuáticos y terrestres". Journal of Environmental Radioactivity . 30 (2): 139–171. Bibcode :1996JEnvR..30..139A. doi :10.1016/0265-931X(96)89276-9.
- ^ Salbu, Brit; Østby, Georg; Garmo, Torstein H.; Hove, Knut (1992). "Disponibilidad de isótopos de cesio en la vegetación estimada a partir de experimentos de incubación y extracción". Analyst . 117 (3): 487–491. Bibcode :1992Ana...117..487S. doi :10.1039/AN9921700487. PMID 1580386.
- ^ Vinichuk, M. (2010). "Acumulación de potasio, rubidio y cesio (133Cs y 137Cs) en varias fracciones de suelo y hongos en un bosque sueco". Science of the Total Environment . 408 (12): 2543–2548. Bibcode :2010ScTEn.408.2543V. doi :10.1016/j.scitotenv.2010.02.024. PMID 20334900. Archivado desde el original el 4 de abril de 2023. Consultado el 30 de octubre de 2017 .
- ^ Smith, Jim T.; Beresford, Nicholas A. (2005). Chernóbil: catástrofe y consecuencias . Berlín: Springer. ISBN 978-3-540-23866-9.
- ^ Eremeev, VN; Chudinovskikh, TV; Batrakov, GF; Ivanova, TM (1991). "Isótopos radiactivos de cesio en las aguas y la capa atmosférica cercana al agua del Mar Negro". Oceanografía física . 2 (1): 57–64. doi :10.1007/BF02197418. S2CID 127482742.
- ^ Redman, HC; McClellan, RO; Jones, RK; Boecker, BB; Chiffelle, TL; Pickrell, JA; Rypka, EW (1972). "Toxicidad del 137-CsCl en el Beagle. Efectos biológicos tempranos". Radiation Research . 50 (3): 629–648. Bibcode :1972RadR...50..629R. doi :10.2307/3573559. JSTOR 3573559. PMID 5030090.
- ^ "Los chinos 'encuentran' una bola radiactiva". BBC News. 27 de marzo de 2009. Archivado desde el original el 10 de octubre de 2021. Consultado el 25 de enero de 2010 .
- ^ Charbonneau, Louis (12 de marzo de 2003). «El director del OIEA advierte del riesgo de una «bomba sucia»». The Washington Post . Reuters. pág. A15. Archivado desde el original el 5 de diciembre de 2008. Consultado el 28 de abril de 2010 .
Enlaces externos
- Cesio o Cesio en la Tabla Periódica de Videos (Universidad de Nottingham)
- Vea la reacción del cesio (el metal más reactivo en la tabla periódica) con el flúor (el no metal más reactivo) cortesía de The Royal Institution.
- Rogachev, Andrey Yu.; Miao, Mao-Sheng; Merino, Gabriel; Hoffmann, Roald (2015). "CsF5 y CsF2+ moleculares". Angewandte Chemie . 127 (28): 8393–8396. Código Bib : 2015AngCh.127.8393R. doi : 10.1002/ange.201500402.








