Tantalio
El tantalio es un elemento químico ; su símbolo es Ta y su número atómico es 73. Anteriormente conocido como tantalio , [ cita requerida ] recibe su nombre de Tántalo , una figura de la mitología griega. [8] El tantalio es un metal de transición muy duro, dúctil , brillante y de color gris azulado que es altamente resistente a la corrosión. Es parte del grupo de los metales refractarios , que se utilizan ampliamente como componentes de aleaciones fuertes de alto punto de fusión . Es un elemento del grupo 5 , junto con el vanadio y el niobio , y siempre se presenta en fuentes geológicas junto con el niobio, químicamente similar, principalmente en los grupos minerales tantalita , columbita y coltán .
La inercia química y el punto de fusión muy alto del tantalio lo hacen valioso para equipos de laboratorio e industriales, como recipientes de reacción y hornos de vacío . Se utiliza en condensadores de tantalio para equipos electrónicos , como computadoras . [9] Se está investigando su uso como material para resonadores superconductores de alta calidad en procesadores cuánticos. [10] [11] La Comisión Europea considera que el tantalio es un elemento crítico para la tecnología . [12]
Historia
El tantalio fue descubierto en Suecia en 1802 por Anders Ekeberg , en dos muestras minerales: una de Suecia y la otra de Finlandia. [13] [14] Un año antes, Charles Hatchett había descubierto el columbio (ahora niobio). [15] En 1809, el químico inglés William Hyde Wollaston comparó los óxidos de columbio y tantalio, columbita y tantalita . Aunque los dos óxidos tenían diferentes densidades medidas de 5,918 g/cm 3 y 7,935 g/cm 3 , concluyó que eran idénticos y mantuvo el nombre de tantalio. [16] Después de que Friedrich Wöhler confirmara estos resultados, se pensó que el columbio y el tantalio eran el mismo elemento. Esta conclusión fue cuestionada en 1846 por el químico alemán Heinrich Rose , quien argumentó que había dos elementos adicionales en la muestra de tantalita, y los nombró en honor a los hijos de Tántalo : niobio (de Niobe , la diosa de las lágrimas) y pelopio (de Pélope ). [17] [18] El supuesto elemento "pelopium" fue identificado más tarde como una mezcla de tantalio y niobio, y se descubrió que el niobio era idéntico al columbio ya descubierto en 1801 por Hatchett. [ cita requerida ]
Las diferencias entre el tántalo y el niobio fueron demostradas inequívocamente en 1864 por Christian Wilhelm Blomstrand , [19] y Henri Etienne Sainte-Claire Deville , así como por Louis J. Troost , quien determinó las fórmulas empíricas de algunos de sus compuestos en 1865. [19] [20] Una confirmación adicional vino del químico suizo Jean Charles Galissard de Marignac , [21] en 1866, quien demostró que solo había dos elementos. Estos descubrimientos no impidieron que los científicos publicaran artículos sobre el llamado ilmenio hasta 1871. [22] De Marignac fue el primero en producir la forma metálica del tántalo en 1864, cuando redujo el cloruro de tántalo calentándolo en una atmósfera de hidrógeno . [23] Los primeros investigadores sólo habían sido capaces de producir tantalio impuro, y el primer metal dúctil relativamente puro fue producido por Werner von Bolton en Charlottenburg en 1903. Los cables hechos con tantalio metálico se utilizaron para filamentos de bombillas hasta que el tungsteno lo reemplazó en su uso generalizado. [24]
El nombre de tantalio se deriva del nombre del mitológico Tántalo, el padre de Níobe en la mitología griega . En la historia, había sido castigado después de la muerte condenándolo a permanecer de pie hasta las rodillas en agua con frutas perfectas creciendo sobre su cabeza, las cuales lo atormentaban eternamente . (Si se inclinaba para beber el agua, se escurría por debajo del nivel que podía alcanzar, y si extendía la mano para alcanzar la fruta, las ramas se movían fuera de su alcance.) [25] Anders Ekeberg escribió: "A este metal lo llamo tantalio ... en parte en alusión a su incapacidad, cuando se sumerge en ácido, de absorber cualquier cantidad y saturarse". [26]
Durante décadas, la tecnología comercial para separar el tantalio del niobio implicó la cristalización fraccionada de heptafluorotantalato de potasio a partir de oxipentafluoroniobato de potasio monohidrato, un proceso que fue descubierto por Jean Charles Galissard de Marignac en 1866. Este método ha sido reemplazado por la extracción con solventes a partir de soluciones de tantalio que contienen fluoruro. [20]
Características
Propiedades físicas
El tantalio es oscuro (gris azulado), [27] denso, dúctil, muy duro, fácil de fabricar y muy conductor de calor y electricidad. El metal es muy resistente a la corrosión por ácidos : a temperaturas inferiores a 150 ° C, el tantalio es casi completamente inmune al ataque del normalmente agresivo agua regia . Se puede disolver con ácido fluorhídrico o soluciones ácidas que contengan el ion fluoruro y trióxido de azufre , así como con hidróxido de potasio fundido . El alto punto de fusión del tantalio de 3017 °C (punto de ebullición 5458 °C) es superado entre los elementos solo por el tungsteno , el renio y el osmio para los metales, y el carbono .
El tantalio existe en dos fases cristalinas, alfa y beta. La fase alfa es estable a todas las temperaturas hasta el punto de fusión y tiene una estructura cúbica centrada en el cuerpo con una constante reticular a = 0,33029 nm a 20 °C. [3] Es relativamente dúctil , tiene una dureza Knoop de 200-400 HN y una resistividad eléctrica de 15-60 μΩ⋅cm. La fase beta es dura y quebradiza; su simetría cristalina es tetragonal (grupo espacial P42/mnm , a = 1,0194 nm, c = 0,5313 nm), la dureza Knoop es de 1000-1300 HN y la resistividad eléctrica es relativamente alta a 170-210 μΩ⋅cm. La fase beta es metaestable y se convierte en la fase alfa al calentarla a 750-775 °C. El tantalio a granel está compuesto casi en su totalidad por fase alfa, y la fase beta suele existir en forma de películas delgadas [28] obtenidas por pulverización catódica con magnetrón , deposición química en fase de vapor o deposición electroquímica a partir de una solución eutéctica de sal fundida. [29]
Isótopos
El tantalio natural consta de dos isótopos estables : 180m Ta (0,012 %) y 181 Ta (99,988 %). Se predice que el 180m Ta ( m denota un estado metaestable) se desintegra de tres maneras: transición isomérica al estado fundamental de 180 Ta, desintegración beta a 180 W o captura de electrones a 180 Hf . Sin embargo, nunca se ha observado radiactividad de este isómero nuclear , y solo se conoce un límite inferior en su vida media de 2,9 × 10 Se ha establecido un período de 17 años. [30] El estado fundamental del 180 Ta tiene una vida media de solo 8 horas. El 180m Ta es el único isómero nuclear natural(excluyendo los nucleidos radiogénicos y cosmogénicos de vida corta). También es el isótopo primordial más raro del Universo, teniendo en cuenta la abundancia elemental del tantalio y la abundancia isotópica del 180m Ta en la mezcla natural de isótopos (y nuevamente excluyendo los nucleidos radiogénicos y cosmogénicos de vida corta). [31]
El tantalio se ha estudiado teóricamente como material de " salación " para armas nucleares ( el cobalto es el material de salificación hipotético más conocido). Una capa externa de 181 Ta sería irradiada por el intenso flujo de neutrones de alta energía de una hipotética arma nuclear en explosión. Esto transmutaría el tantalio en el isótopo radiactivo 182 Ta, que tiene una vida media de 114,4 días y produce rayos gamma con aproximadamente 1,12 millones de electronvoltios (MeV) de energía cada uno, lo que aumentaría significativamente la radiactividad de la lluvia radiactiva de la explosión durante varios meses. Tales armas "saladas" nunca se han construido ni probado, hasta donde se sabe públicamente, y ciertamente nunca se han utilizado como armas. [32]
El tantalio se puede utilizar como material objetivo para haces de protones acelerados para la producción de varios isótopos de vida corta, incluidos 8 Li, 80 Rb y 160 Yb. [33]
Compuestos químicos
El tantalio forma compuestos en estados de oxidación −III a +V. Los más comunes son los óxidos de Ta(V), que incluyen todos los minerales. Las propiedades químicas de Ta y Nb son muy similares. En medios acuosos, Ta solo exhibe el estado de oxidación +V. Al igual que el niobio, el tantalio es apenas soluble en soluciones diluidas de ácidos clorhídrico , sulfúrico , nítrico y fosfórico debido a la precipitación del óxido de Ta(V) hidratado. [34] En medios básicos, Ta puede solubilizarse debido a la formación de especies de polioxotantalato. [35]
Óxidos, nitruros, carburos, sulfuros
El pentóxido de tantalio (Ta 2 O 5 ) es el compuesto más importante desde el punto de vista de las aplicaciones. Los óxidos de tantalio en estados de oxidación más bajos son numerosos, incluidas muchas estructuras defectuosas , y están poco estudiados o pobremente caracterizados. [36]
Los tantalatos, compuestos que contienen [TaO 4 ] 3− o [TaO 3 ] −, son numerosos. El tantalato de litio (LiTaO 3 ) adopta una estructura de perovskita. El tantalato de lantano (LaTaO 4 ) contiene TaO aislado3−
4tetraedros. [37]
Al igual que en el caso de otros metales refractarios , los compuestos más duros conocidos del tántalo son los nitruros y carburos. El carburo de tántalo , TaC, al igual que el carburo de tungsteno , más comúnmente utilizado , es una cerámica dura que se utiliza en herramientas de corte. El nitruro de tántalo (III) se utiliza como aislante de película fina en algunos procesos de fabricación microelectrónica. [38]
El calcogenuro mejor estudiado es el sulfuro de tantalio (TaS 2 ), un semiconductor en capas , como se observa en otros dicalcogenuros de metales de transición . Una aleación de tantalio y telurio forma cuasicristales . [37]
Haluros
Los haluros de tantalio abarcan los estados de oxidación +5, +4 y +3. El pentafluoruro de tantalio (TaF 5 ) es un sólido blanco con un punto de fusión de 97,0 °C. El anión [TaF 7 ] 2- se utiliza para su separación del niobio. [39] El cloruro TaCl
5, que existe como dímero, es el principal reactivo en la síntesis de nuevos compuestos de Ta. Se hidroliza fácilmente a oxicloruro . Los haluros inferiores TaX
4y Impuestos
3, cuentan con bonos Ta-Ta. [37] [34]
Compuestos de organotantalio
Los compuestos de organotantalio incluyen pentametiltantalio , cloruros de alquiltantalio mixtos, hidruros de alquiltantalio, complejos de alquilideno, así como derivados de ciclopentadienilo de los mismos. [40] [41] Se conocen diversas sales y derivados sustituidos para el hexacarbonilo [Ta(CO) 6 ] − y los isocianuros relacionados .

Aparición

Se estima que el tantalio constituye alrededor de 1 ppm [42] o 2 ppm [34] de la corteza terrestre en peso . Hay muchas especies de minerales de tantalio, de las cuales solo algunas se utilizan hasta ahora en la industria como materias primas: tantalita (una serie que consiste en tantalita-(Fe), tantalita-(Mn) y tantalita-(Mg)), microlita (ahora un nombre de grupo), wodginita , euxenita (en realidad euxenita-(Y)) y policrasa ( en realidad policrasa-(Y)). [43] La tantalita ( Fe , Mn ) Ta2O6 es el mineral más importante para la extracción de tantalio. La tantalita tiene la misma estructura mineral que la columbita ( Fe , Mn ) (Ta, Nb ) 2O6 ; cuando hay más tantalio que niobio se llama tantalita y cuando hay más niobio que tantalio se llama columbita ( o niobita ) . La alta densidad de tantalita y otros minerales que contienen tantalio hace que el uso de la separación gravitacional sea el mejor método. Otros minerales incluyen samarskita y fergusonita .
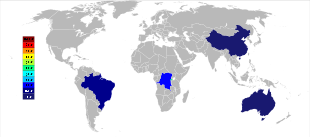
Australia fue el principal productor de tantalio antes de la década de 2010, siendo Global Advanced Metals (anteriormente conocida como Talison Minerals ) la mayor empresa minera de tantalio en ese país. Operan dos minas en Australia Occidental, Greenbushes en el suroeste y Wodgina en la región de Pilbara . La mina de Wodgina fue reabierta en enero de 2011 después de que la minería en el sitio se suspendiera a fines de 2008 debido a la crisis financiera mundial . [44] Menos de un año después de su reapertura, Global Advanced Metals anunció que debido a una vez más "... una menor demanda de tantalio...", y otros factores, las operaciones de extracción de tantalio cesarían a fines de febrero de 2012. [45] Wodgina produce un concentrado primario de tantalio que se mejora aún más en la operación de Greenbushes antes de venderse a los clientes. [46] Mientras que los productores a gran escala de niobio están en Brasil y Canadá , el mineral allí también produce un pequeño porcentaje de tantalio. Otros países, como China , Etiopía y Mozambique , extraen minerales con un porcentaje mayor de tantalio y producen un porcentaje significativo de la producción mundial de este mineral. El tantalio también se produce en Tailandia y Malasia como subproducto de la minería de estaño en esos países. Durante la separación gravitacional de los minerales de los depósitos de placer, no solo se encuentra casiterita (SnO 2 ), sino que también se incluye un pequeño porcentaje de tantalita. La escoria de las fundiciones de estaño contiene entonces cantidades económicamente útiles de tantalio, que se lixivia de la escoria. [20] [47]
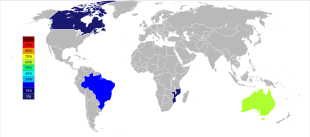
La producción mundial de minas de tantalio ha experimentado un importante cambio geográfico desde principios del siglo XXI, cuando la producción provenía predominantemente de Australia y Brasil. A partir de 2007 y hasta 2014, las principales fuentes de producción de tantalio de las minas se trasladaron drásticamente a la República Democrática del Congo , Ruanda y algunos otros países africanos. [48] Se están explorando futuras fuentes de suministro de tantalio, en orden de tamaño estimado, en Arabia Saudita , Egipto , Groenlandia , China, Mozambique, Canadá, Australia, Estados Unidos , Finlandia y Brasil. [49] [50]
Condición de recurso en conflicto
El tantalio se considera un recurso de conflicto . El coltán , el nombre industrial de un mineral de columbita - tantalita del que se extraen el niobio y el tantalio, [51] también se puede encontrar en África Central , por lo que el tantalio se relaciona con la guerra en la República Democrática del Congo (antes Zaire ). Según un informe de las Naciones Unidas del 23 de octubre de 2003, [52] el contrabando y la exportación de coltán ha ayudado a alimentar la guerra en el Congo, una crisis que ha resultado en aproximadamente 5,4 millones de muertes desde 1998 [53] , lo que lo convierte en el conflicto documentado más mortífero del mundo desde la Segunda Guerra Mundial . Se han planteado cuestiones éticas sobre el comportamiento corporativo responsable, los derechos humanos y la puesta en peligro de la vida silvestre, debido a la explotación de recursos como el coltán en las regiones de conflicto armado de la cuenca del Congo . [54] [55] [56] [57] El Servicio Geológico de los Estados Unidos informa en su anuario que esta región produjo un poco menos del 1% de la producción mundial de tantalio en 2002-2006, alcanzando un máximo del 10% en 2000 y 2008. [47] Los datos del USGS publicados en enero de 2021 indicaron que cerca del 40% de la producción mundial de minas de tantalio provino de la República Democrática del Congo, y otro 18% provino de los vecinos Ruanda y Burundi . [58]
Producción y fabricación

En la extracción de tantalio a partir de tantalita se realizan varios pasos. En primer lugar, el mineral se tritura y se concentra mediante separación por gravedad . Esto se lleva a cabo generalmente cerca del sitio de la mina .
Refinando
El refinado del tantalio a partir de sus menas es uno de los procesos de separación más exigentes en la metalurgia industrial. El principal problema es que las menas de tantalio contienen cantidades significativas de niobio , que tiene propiedades químicas casi idénticas a las del Ta. Se han desarrollado numerosos procedimientos para abordar este desafío.
En la actualidad, la separación se logra mediante hidrometalurgia . [60] La extracción comienza con la lixiviación del mineral con ácido fluorhídrico junto con ácido sulfúrico o ácido clorhídrico . Este paso permite separar el tantalio y el niobio de las diversas impurezas no metálicas de la roca. Aunque el Ta se presenta como varios minerales, se representa convenientemente como el pentóxido, ya que la mayoría de los óxidos de tantalio (V) se comportan de manera similar en estas condiciones. Una ecuación simplificada para su extracción es la siguiente:
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
Para el componente niobio se producen reacciones completamente análogas, pero el hexafluoruro suele ser predominante en las condiciones de extracción.
- Nb 2 O 5 + 12 HF → 2 H[NbF 6 ] + 5 H 2 O
Estas ecuaciones se simplifican: se sospecha que el bisulfato (HSO 4 − ) y el cloruro compiten como ligandos por los iones Nb(V) y Ta(V), cuando se utilizan ácidos sulfúrico y clorhídrico, respectivamente. [60] Los complejos de fluoruro de tántalo y niobio se eliminan luego de la solución acuosa mediante extracción líquido-líquido en disolventes orgánicos , como ciclohexanona , octanol y metil isobutil cetona . Este procedimiento simple permite la eliminación de la mayoría de las impurezas que contienen metales (por ejemplo, hierro, manganeso, titanio, circonio), que permanecen en la fase acuosa en forma de sus fluoruros y otros complejos.
La separación del tantalio del niobio se logra luego reduciendo la fuerza iónica de la mezcla ácida, lo que hace que el niobio se disuelva en la fase acuosa. Se propone que el oxifluoruro H 2 [NbOF 5 ] se forma en estas condiciones. Después de la eliminación del niobio, la solución de H 2 purificado [TaF 7 ] se neutraliza con amoníaco acuoso para precipitar el óxido de tantalio hidratado como un sólido, que se puede calcinar a pentóxido de tantalio (Ta 2 O 5 ). [61]
En lugar de hidrólisis, el H 2 [TaF 7 ] se puede tratar con fluoruro de potasio para producir heptafluorotantalato de potasio :
- H 2 [TaF 7 ] + 2 KF → K 2 [TaF 7 ] + 2 HF
A diferencia del H 2 [TaF 7 ], la sal de potasio se cristaliza fácilmente y se manipula como un sólido.
El K 2 [TaF 7 ] se puede convertir en tantalio metálico mediante reducción con sodio , a aproximadamente 800 °C en sal fundida . [62]
- K 2 [TaF 7 ] + 5 Na → Ta + 5 NaF + 2 KF
En un método más antiguo, llamado proceso Marignac , la mezcla de H 2 [TaF 7 ] y H 2 [NbOF 5 ] se convertía en una mezcla de K 2 [TaF 7 ] y K 2 [NbOF 5 ], que luego se separaba mediante cristalización fraccionada , aprovechando sus diferentes solubilidades en agua.
Electrólisis
El tantalio también se puede refinar por electrólisis, utilizando una versión modificada del proceso Hall-Héroult . En lugar de requerir que el óxido de entrada y el metal de salida estén en forma líquida, la electrólisis del tantalio opera con óxidos en polvo no líquidos. El descubrimiento inicial se produjo en 1997 cuando investigadores de la Universidad de Cambridge sumergieron pequeñas muestras de ciertos óxidos en baños de sal fundida y redujeron el óxido con corriente eléctrica. El cátodo utiliza óxido metálico en polvo. El ánodo está hecho de carbono. La sal fundida a 1000 °C (1830 °F) es el electrolito. La primera refinería tiene capacidad suficiente para abastecer entre el 3 y el 4 % de la demanda mundial anual. [63]
Fabricación y metalistería
Toda soldadura de tántalo debe realizarse en una atmósfera inerte de argón o helio para protegerlo de la contaminación con gases atmosféricos. El tántalo no es soldable . El molido del tántalo es difícil, especialmente en el caso del tántalo recocido . En estado recocido, el tántalo es extremadamente dúctil y se puede moldear fácilmente en láminas de metal. [64]
Aplicaciones
Electrónica

El principal uso del tantalio, como polvo metálico, es en la producción de componentes electrónicos, principalmente condensadores y algunas resistencias de alta potencia . Los condensadores electrolíticos de tantalio explotan la tendencia del tantalio a formar una capa protectora de óxido en la superficie, utilizando polvo de tantalio, prensado en forma de gránulo, como una "placa" del condensador, el óxido como dieléctrico y una solución electrolítica o un sólido conductor como la otra "placa". Debido a que la capa dieléctrica puede ser muy delgada (más delgada que la capa similar en, por ejemplo, un condensador electrolítico de aluminio), se puede lograr una alta capacitancia en un volumen pequeño. Debido a las ventajas de tamaño y peso, los condensadores de tantalio son atractivos para teléfonos portátiles , computadoras personales , electrónica automotriz y cámaras . [65]
Aleaciones
El tantalio también se utiliza para producir una variedad de aleaciones que tienen altos puntos de fusión, resistencia y ductilidad. Aleado con otros metales, también se utiliza en la fabricación de herramientas de carburo para equipos de metalurgia y en la producción de superaleaciones para componentes de motores a reacción, equipos de procesos químicos, reactores nucleares , piezas de misiles, intercambiadores de calor, tanques y recipientes. [66] [65] [67] Debido a su ductilidad, el tantalio se puede estirar en alambres finos o filamentos, que se utilizan para evaporar metales como el aluminio . Dado que resiste el ataque de los fluidos corporales y no es irritante, el tantalio se usa ampliamente en la fabricación de instrumentos quirúrgicos e implantes. Por ejemplo, los recubrimientos porosos de tantalio se utilizan en la construcción de implantes ortopédicos debido a la capacidad del tantalio para formar un enlace directo al tejido duro. [68]
El tantalio es inerte frente a la mayoría de los ácidos, excepto el ácido fluorhídrico y el ácido sulfúrico caliente , y las soluciones alcalinas calientes también provocan corrosión por el tantalio. Esta propiedad lo convierte en un metal útil para recipientes de reacción química y tuberías para líquidos corrosivos. Las bobinas de intercambio de calor para el calentamiento con vapor del ácido clorhídrico están hechas de tantalio. [69] El tantalio se utilizó ampliamente en la producción de tubos electrónicos de frecuencia ultraalta para transmisores de radio. El tantalio es capaz de capturar oxígeno y nitrógeno mediante la formación de nitruros y óxidos y, por lo tanto, ayudó a mantener el alto vacío necesario para los tubos cuando se usaba para piezas internas como rejillas y placas. [39] [69]
Otros usos

La NASA utilizó tantalio para proteger de la radiación los componentes de naves espaciales, como la Voyager 1 y la Voyager 2. [70] El alto punto de fusión y la resistencia a la oxidación llevaron al uso del metal en la producción de piezas de hornos de vacío . El tantalio es extremadamente inerte y, por lo tanto, se forma en una variedad de piezas resistentes a la corrosión, como termopozos , cuerpos de válvulas y sujetadores de tantalio. Debido a su alta densidad, se han construido cargas moldeadas y revestimientos de penetradores formados explosivamente a partir de tantalio. [71] El tantalio aumenta en gran medida las capacidades de penetración de blindaje de una carga moldeada debido a su alta densidad y alto punto de fusión. [72] [73]
También se utiliza ocasionalmente en relojes preciosos , por ejemplo, de Audemars Piguet , FP Journe , Hublot , Montblanc , Omega y Panerai . El investigador médico Gerald L. Burke observó por primera vez en 1940 que el tantalio también es altamente bioinerte y podría usarse de manera segura como material de implante ortopédico. [74] La alta rigidez del tantalio hace que sea necesario usarlo como espuma altamente porosa o andamio con menor rigidez para implantes de reemplazo de cadera para evitar el blindaje contra el estrés . [75] Debido a que el tantalio es un metal no ferroso y no magnético, estos implantes se consideran aceptables para pacientes sometidos a procedimientos de resonancia magnética. [76] El óxido se utiliza para fabricar vidrio especial de alto índice de refracción para lentes de cámara . [77] El polvo de tantalio esférico, producido atomizando tantalio fundido usando gas o líquido, se usa comúnmente en la fabricación aditiva debido a su forma uniforme, excelente fluidez y alto punto de fusión. [78] [79]
Cuestiones medioambientales
El tantalio recibe mucha menos atención en el campo ambiental que en otras geociencias. La concentración de corteza superior (UCC) y la relación Nb/Ta en la corteza superior y en los minerales están disponibles porque estas mediciones son útiles como herramienta geoquímica. [80] El último valor para la concentración de corteza superior es 0,92 ppm, y la relación Nb/Ta (w/w) es 12,7. [81]
Hay pocos datos disponibles sobre las concentraciones de tantalio en los diferentes compartimentos ambientales, especialmente en aguas naturales donde ni siquiera se han producido estimaciones fiables de las concentraciones de tantalio "disuelto" en agua de mar y agua dulce. [82] Se han publicado algunos valores sobre las concentraciones disueltas en los océanos, pero son contradictorios. Los valores en agua dulce no son mucho mejores, pero, en todos los casos, probablemente estén por debajo de 1 ng L −1 , ya que las concentraciones "disueltas" en aguas naturales están muy por debajo de la mayoría de las capacidades analíticas actuales. [83] El análisis requiere procedimientos de preconcentración que, por el momento, no dan resultados consistentes. Y, en cualquier caso, el tantalio parece estar presente en aguas naturales principalmente como materia particulada en lugar de disuelto. [82]
Los valores de las concentraciones en suelos, sedimentos del lecho y aerosoles atmosféricos son más fáciles de obtener. [82] Los valores en suelos están cerca de 1 ppm y, por lo tanto, de los valores UCC. Esto indica un origen detrítico. Para los aerosoles atmosféricos, los valores disponibles son dispersos y limitados. Cuando se observa un enriquecimiento de tantalio, probablemente se deba a la pérdida de más elementos solubles en agua en los aerosoles de las nubes. [84]
No se ha detectado contaminación vinculada al uso humano del elemento. [85] El tantalio parece ser un elemento muy conservador en términos biogeoquímicos, pero su ciclo y reactividad aún no se comprenden completamente.
Precauciones
En el laboratorio rara vez se encuentran compuestos que contengan tantalio. El metal es altamente biocompatible [74] y se utiliza para implantes y recubrimientos corporales , por lo que la atención puede centrarse en otros elementos o en la naturaleza física del compuesto químico . [86]
Las personas pueden estar expuestas al tantalio en el lugar de trabajo al respirarlo, por contacto con la piel o con los ojos. La Administración de Seguridad y Salud Ocupacional (OSHA) ha establecido el límite legal ( límite de exposición permisible ) para la exposición al tantalio en el lugar de trabajo en 5 mg/m 3 durante una jornada laboral de 8 horas. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 5 mg/m 3 durante una jornada laboral de 8 horas y un límite a corto plazo de 10 mg/m 3 . A niveles de 2500 mg/m 3 , el polvo de tantalio es inmediatamente peligroso para la vida y la salud . [87]
Referencias
- ^ "Pesos atómicos estándar: tantalio". CIAAW . 2005.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abcd Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcd Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ Lide, DR, ed. (2005). "Susceptibilidad magnética de los elementos y compuestos inorgánicos". Manual de química y física del CRC (PDF) (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ Eurípides , Orestes
- ^ "Tantalio (Ta) | AMERICAN ELEMENTS ®". American Elements: The Materials Science Company . Consultado el 23 de agosto de 2024 .
- ^ McLellan, RA (2023). "Perfiles químicos de los óxidos de tantalio en circuitos superconductores de última generación". Advanced Science . 10 (21): e2300921. arXiv : 2301.04567 . doi :10.1002/advs.202300921. PMC 10375100 . PMID 37166044.
- ^ Crowley, Kevin D.; McLellan, Russell A.; Dutta, Aveek; Shumiya, Nana; Place, Alexander PM; Le, Xuan Hoang; Gang, Youqi; Madhavan, Trisha; Bland, Matthew P.; Chang, Ray; Khedkar, Nishaad; Feng, Yiming Cady; Umbarkar, Esha A.; Gui, Xin; Rodgers, Lila VH; Jia, Yichen; Feldman, Mayer M.; Lyon, Stephen A.; Liu, Mingzhao; Cava, Robert J.; Houck, Andrew A. ; de Leon, Nathalie P. (2023-10-06). "Desenredando pérdidas en circuitos superconductores de tantalio". Physical Review X . 13 (4): 041005. arXiv : 2301.07848 . Código Bibliográfico :2023PhRvX..13d1005C. doi :10.1103/PhysRevX.13.041005.
- ^ "Comisión Europea (2010). Materias primas críticas para la UE. Informe del Grupo de trabajo ad hoc sobre la definición de materias primas críticas". Comisión Europea . 29 de abril de 2015.
- ^ Ekeberg, Anders (1802). "De las propiedades de la tierra itria, comparadas con las de la glucina; de los fósiles que contenían la primera de estas tierras; y del descubrimiento de una naturaleza metálica (tantalio)". Revista de filosofía natural, química y artes . 3 : 251–255.
- ^ Ekeberg, Anders (1802). "Uplysning om Ytterjorden egenskaper, i synnerhet i aemforelse med Berylljorden:om de Fossilier, havari förstnemnde jord innehales, samt om en ny uptäckt kropp af metallik natur". Kungliga Svenska Vetenskapsakademiens Handlingar . 23 : 68–83.
- ^ Griffith, William P.; Morris, Peter JT (2003). "Charles Hatchett FRS (1765–1847), químico y descubridor del niobio". Notas y registros de la Royal Society de Londres . 57 (3): 299–316. doi :10.1098/rsnr.2003.0216. JSTOR 3557720. S2CID 144857368.
- ^ Wollaston, William Hyde (1809). "Sobre la identidad del columbio y el tantalio". Philosophical Transactions of the Royal Society of London . 99 : 246–252. doi :10.1098/rstl.1809.0017. JSTOR 107264. S2CID 110567235.
- ^ Rosa, Heinrich (1844). "Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall". Annalen der Physik (en alemán). 139 (10): 317–341. Código bibliográfico : 1844AnP...139..317R. doi : 10.1002/andp.18441391006.
- ^ Rosa, Heinrich (1847). "Ueber die Säure im Columbit von Nordamérika". Annalen der Physik (en alemán). 146 (4): 572–577. Código bibliográfico : 1847AnP...146..572R. doi : 10.1002/andp.18471460410.
- ^ ab Marignac, Blomstrand; H. Deville; L. Troost y R. Hermann (1866). "Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure". Revista de química analítica de Fresenius . 5 (1): 384–389. doi :10.1007/BF01302537. S2CID 97246260.
- ^ abc Gupta, CK; Suri, AK (1994). Metalurgia extractiva del niobio . CRC Press. ISBN 978-0-8493-6071-8.
- ^ Marignac, MC (1866). "Búsquedas sobre las combinaciones del niobio". Annales de Chimie et de Physique (en francés). 4 (8): 7–75.
- ^ Hermann, R. (1871). "Fortgesetzte Untersuchungen über die Verbindungen von Ilmenium und Niobium, sowie über die Zusammensetzung der Niobmineralien (Más investigaciones sobre los compuestos de ilmenio y niobio, así como la composición de los minerales de niobio)". Journal für Praktische Chemie (en alemán). 3 (1): 373–427. doi :10.1002/prac.18710030137.
- ^ "Niobio". Universidad de Coimbra. Archivado desde el original el 10 de diciembre de 2007 . Consultado el 5 de septiembre de 2008 .
- ^ Bowers, B. (2001). "Escaneando nuestro pasado desde Londres. La lámpara de filamento y los nuevos materiales". Actas del IEEE . 89 (3): 413. doi :10.1109/5.915382. S2CID 28155048.
- ^ Lempriere, John (1887). Diccionario clásico de Lempriere. pág. 659.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 1138. ISBN 978-0-08-037941-8.
- ^ Colakis, Marianthe; Masello, Mary Joan (30 de junio de 2007). "Tantalum". Mitología clásica y más: un libro de trabajo para el lector . Bolchazy-Carducci Publishers. ISBN 978-0-86516-573-1.
- ^ Magnuson, M.; Greczynski, G.; Eriksson, F.; Hultman, L.; Hogberg, H. (2019). "Estructura electrónica de películas de β-Ta a partir de espectroscopia de fotoelectrones de rayos X y cálculos de primeros principios". Applied Surface Science . 470 : 607–612. Bibcode :2019ApSS..470..607M. doi :10.1016/j.apsusc.2018.11.096. S2CID 54079998.
- ^ Lee, S.; Doxbeck, M.; Mueller, J.; Cipollo, M.; Cote, P. (2004). "Textura, estructura y transformación de fase en recubrimientos de beta tantalio por pulverización catódica". Tecnología de superficies y recubrimientos . 177–178: 44. doi :10.1016/j.surfcoat.2003.06.008.
- ^ Colaboración Majorana (11 de octubre de 2023). "Restricciones en la desintegración de 180 m Ta". Physical Review Letters . 131 (15): 152501. arXiv : 2306.01965 . doi :10.1103/PhysRevLett.131.152501. ISSN 0031-9007.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "La evaluación NUBASE de las propiedades nucleares y de desintegración", Nuclear Physics A , 729 : 3–128, Bibcode :2003NuPhA.729....3A, doi :10.1016/j.nuclphysa.2003.11. 001
- ^ Win, David Tin; Al Masum, Mohammed (2003). "Armas de destrucción masiva" (PDF) . Revista de tecnología de la Universidad de Asunción . 6 (4): 199–219.
- ^ "Rendimiento de objetivos de tantalio - Base de datos de rendimiento ISAC - TRIUMF: Laboratorio Nacional de Física Nuclear y de Partículas de Canadá". mis.triumf.ca .
- ^ abc Agulyansky, Anatoly (2004). La química de los compuestos de fluoruro de tantalio y niobio. Elsevier. ISBN 978-0-444-51604-6. Consultado el 2 de septiembre de 2008 .
- ^ Deblonde, Gauthier J.-P.; Chagnes, Alexandre; Bélair, Sarah; Cote, Gérard (1 de julio de 2015). "Solubilidad de niobio (V) y tantalio (V) en condiciones alcalinas suaves". Hidrometalurgia . 156 : 99-106. Código Bib : 2015HydMe.156...99D. doi :10.1016/j.hidromet.2015.05.015. ISSN 0304-386X.
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ abc Holleman, AF; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (en alemán) (102ª ed.). de Gruyter. ISBN 978-3-11-017770-1.
- ^ Tsukimoto, S.; Moriyama, M.; Murakami, Masanori (1961). "Microestructura de películas delgadas de nitruro de tantalio amorfo". Thin Solid Films . 460 (1–2): 222–226. Bibcode :2004TSF...460..222T. doi :10.1016/j.tsf.2004.01.073.
- ^ ab Soisson, Donald J.; McLafferty, JJ; Pierret, James A. (1961). "Informe de colaboración entre el personal y la industria: tantalio y niobio". Ing. de Indiana. química . 53 (11): 861–868. doi :10.1021/ie50623a016.
- ^ Schrock, Richard R. (1979-03-01). "Complejos de alquilideno de niobio y tantalio". Accounts of Chemical Research . 12 (3): 98–104. doi :10.1021/ar50135a004. ISSN 0001-4842.
- ^ Morse, PM; et al. (2008). "Complejos de etileno de los metales de transición tempranos: estructuras cristalinas de [HfEt
4(DO
2yo
4)2−
] y las especies de estado de oxidación negativo [TaHEt(C
2yo
4)3−
3] y [WH(C
2yo
4)3−
4] ". Organometálicos . 27 (5): 984. doi :10.1021/om701189e. - ^ Emsley, John (2001). "Tantalum". Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos . Oxford, Inglaterra, Reino Unido: Oxford University Press. pág. 420. ISBN 978-0-19-850340-8.
- ^ "Minas, minerales y más". Mindat.org.
- ^ "Talison Tantalum prevé reiniciar Wodgina a mediados de 2011 2010-06-09". Reuters . 2010-06-09. Archivado desde el original el 2011-01-19 . Consultado el 2010-08-27 .
- ^ Emery, Kate (24 de enero de 2012). "GAM cierra la mina de tantalio de Wodgina". The West Australian . Archivado desde el original el 4 de diciembre de 2012. Consultado el 20 de marzo de 2012.
La disminución de la demanda mundial de tantalio y las demoras en recibir la aprobación gubernamental para la instalación del equipo de trituración necesario se encuentran entre los factores que contribuyen a esta decisión.
- ^ "Operaciones en Wodgina". Global Advanced Metals. 2008. Archivado desde el original el 6 de octubre de 2016. Consultado el 28 de marzo de 2011 .
- ^ ab Papp, John F. (2006). "2006 Minerals Yearbook Nb & Ta". Servicio Geológico de Estados Unidos . Consultado el 3 de junio de 2008 .
- ^ Bleiwas, Donald I.; Papp, John F.; Yager, Thomas R. (2015). "Cambio en la producción mundial de minas de tantalio, 2000-2014" (PDF) . Servicio Geológico de Estados Unidos.
- ^ MJ (noviembre de 2007). "Suplemento de tantalio" (PDF) . Mining Journal . Archivado desde el original (PDF) el 2008-09-10 . Consultado el 2008-06-03 .
- ^ "Recursos internacionales de tantalio: exploración y explotación minera" (PDF) . Boletín de recursos minerales de la GSWA . 22 (10). Archivado desde el original (PDF) el 26 de septiembre de 2007.
- ^ Centro de estudios internacionales de tantalio y niobio: Coltan Archivado el 14 de enero de 2016 en Wayback Machine. Consultado el 27 de enero de 2008.
- ^ "S/2003/1027". 26 de octubre de 2003. Consultado el 19 de abril de 2008 .
- ^ "Informe especial: Congo". Comité Internacional de Rescate. Archivado desde el original el 5 de marzo de 2012. Consultado el 19 de abril de 2008 .
- ^ Hayes, Karen; Burge, Richard (2003). La minería de coltán en la República Democrática del Congo: cómo las industrias que utilizan tantalio pueden comprometerse con la reconstrucción de la República Democrática del Congo . pp. 1–64. ISBN 978-1-903703-10-6.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Dizolele, Mvemba Phezo (6 de enero de 2011). "El coltán sangriento del Congo". Pulitzer Center on Crisis Reporting . Consultado el 8 de agosto de 2009 .
- ^ "La guerra del Congo y el papel del coltán". Archivado desde el original el 13 de julio de 2009. Consultado el 8 de agosto de 2009 .
- ^ "La minería de coltán en la cuenca del río Congo". Archivado desde el original el 30 de marzo de 2009. Consultado el 8 de agosto de 2009 .
- ^ Servicio Geológico de los Estados Unidos (enero de 2021). «Resumen de productos minerales del USGS: tantalio» (PDF) . Consultado el 22 de abril de 2021 .
- ^ "Programa de Recursos Minerales". minerals.usgs.gov . Archivado desde el original el 4 de junio de 2013.
- ^ ab Zhu, Zhaowu; Cheng, Chu Yong (2011). "Tecnología de extracción por solventes para la separación y purificación de niobio y tantalio: una revisión". Hidrometalurgia . 107 (1–2): 1–12. Código Bibliográfico :2011HydMe.107....1Z. doi :10.1016/j.hydromet.2010.12.015.
- ^ Agulyanski, Anatoly (2004). Química de los compuestos de fluoruro de tantalio y niobio (1.ª ed.). Burlington: Elsevier. ISBN 9780080529028.
- ^ Okabe, Toru H.; Sadoway, Donald R. (1998). "Reducción metalotérmica como una reacción mediada electrónicamente". Revista de investigación de materiales . 13 (12): 3372–3377. Bibcode :1998JMatR..13.3372O. doi :10.1557/JMR.1998.0459. S2CID 98753880.
- ^ "Fabricación de metales: una perspectiva tentadora". The Economist . 16 de febrero de 2013 . Consultado el 17 de abril de 2013 .
- ^ "NFPA 484 – Norma para metales combustibles, polvos metálicos y polvos metálicos – Edición 2002" (PDF) . Asociación Nacional de Protección contra Incendios . NFPA. 2002-08-13. Archivado desde el original (PDF) el 2023-08-12 . Consultado el 2016-02-12 .
- ^ ab "Informe sobre productos básicos 2008: Tantalio" (PDF) . Servicio Geológico de los Estados Unidos . Consultado el 24 de octubre de 2008 .
- ^ "Productos de tantalio: láminas y placas de tantalio | Admat Inc". Admat Inc. Archivado desde el original el 2018-08-29 . Consultado el 2018-08-28 .
- ^ Buckman, RW Jr. (2000). "Nuevas aplicaciones para el tantalio y sus aleaciones". JOM: Journal of the Minerals, Metals and Materials Society . 52 (3): 40. Bibcode :2000JOM....52c..40B. doi :10.1007/s11837-000-0100-6. S2CID 136550744.
- ^ Cohen, R.; Della Valle, CJ; Jacobs, JJ (2006). "Aplicaciones del tantalio poroso en la artroplastia total de cadera". Revista de la Academia Estadounidense de Cirujanos Ortopédicos . 14 (12): 646–55. doi :10.5435/00124635-200611000-00008. PMID 17077337.
- ^ ab Balke, Clarence W. (1935). "Columbio y tantalio". Química industrial e ingeniería . 20 (10): 1166. doi :10.1021/ie50310a022.
- ^ Bell, Jim (2015). La era interestelar: la historia de los hombres y mujeres de la NASA que volaron durante cuarenta años en la misión Voyager . Nueva York: Dutton. p. 110. ISBN 978-0-525-95432-3.
- ^ Nemat-Nasser, Sia; Isaacs, Jon B.; Liu, Mingqi (1998). "Microestructura de tantalio deformado de alta deformación y alta velocidad de deformación". Acta Materialia . 46 (4): 1307. Código bibliográfico : 1998AcMat..46.1307N. doi :10.1016/S1359-6454(97)00746-5.
- ^ Walters, William; Cooch, William; Burkins, Matthew; Burkins, Matthew (2001). "La resistencia a la penetración de una aleación de titanio contra chorros de revestimientos de carga con forma de tantalio". Revista internacional de ingeniería de impacto . 26 (1–10): 823. Bibcode :2001IJIE...26..823W. doi :10.1016/S0734-743X(01)00135-X. S2CID 92307431.
- ^ Russell, Alan M.; Lee, Kok Loong (2005). Relaciones estructura-propiedad en metales no ferrosos. Hoboken, Nueva Jersey: Wiley-Interscience. p. 218. ISBN 978-0-471-64952-6.
- ^ ab Burke, Gerald L. (agosto de 1940). "La corrosión de los metales en los tejidos; y una introducción al tantalio". Revista de la Asociación Médica Canadiense . 43 (2): 125–128. PMC 538079 . PMID 20321780.
- ^ Black, J. (1994). "Rendimiento biológico del tantalio". Materiales clínicos . 16 (3): 167–173. doi :10.1016/0267-6605(94)90113-9. PMID 10172264.
- ^ Paganias, Christos G.; Tsakotos, George A.; Koutsostathis, Stephanos D.; Macheras, George A. (2012). "Integración ósea en implantes de tantalio poroso". Revista india de ortopedia . 46 (5): 505–13. doi : 10.4103/0019-5413.101032 . ISSN 0019-5413. PMC 3491782 . PMID 23162141.
- ^ Musikant, Solomon (1985). "Composición del vidrio óptico". Materiales ópticos: Introducción a la selección y aplicación . CRC Press. pág. 28. ISBN 978-0-8247-7309-0.
- ^ "Polvo de tantalio esférico para impresión 3D". Advanced Refractory Metals . 30 de mayo de 2023 . Consultado el 22 de septiembre de 2024 .
- ^ Li, Qiqi; Zhang, Baicheng; Wen, Yaojie (2022). "Un estudio exhaustivo de la preparación de polvo de tantalio para la fabricación aditiva". Spplied Surface Science . 593 : 153357. Bibcode :2022ApSS..59353357L. doi :10.1016/j.apsusc.2022.153357.
- ^ Green, TH. (1995). "Significado de Nb/Ta como indicador de procesos geoquímicos en el sistema corteza-manto". Geología química . 120 (3–4): 347–359. Código Bibliográfico :1995ChGeo.120..347G. doi :10.1016/0009-2541(94)00145-X.
- ^ Hu, Z.; Gao, S. (2008). "Abundancias de elementos traza en la corteza superior: una revisión y actualización". Chemical Geology . 253 (3–4): 205. Bibcode :2008ChGeo.253..205H. doi :10.1016/j.chemgeo.2008.05.010.
- ^ abc Filella, M. (2017). "Tantalio en el medio ambiente". Earth-Science Reviews . 173 : 122–140. Código Bibliográfico :2017ESRv..173..122F. doi :10.1016/j.earscirev.2017.07.002.
- ^ Filella, M.; Rodushkin, I. (2018). "Una guía concisa para la determinación de elementos críticos para la tecnología menos estudiados (Nb, Ta, Ga, In, Ge, Te) mediante espectrometría de masas con plasma acoplado inductivamente en muestras ambientales". Spectrochimica Acta Part B . 141 : 80–84. Bibcode :2018AcSpB.141...80F. doi :10.1016/j.sab.2018.01.004.
- ^ Vlastelic, I.; Suchorski, K.; Sellegri, K.; Colomb, A.; Nauret, F.; Bouvier, L.; Piro, JL. (2015). "El presupuesto de elementos de alta intensidad de campo de los aerosoles atmosféricos (puy de Dôme, Francia)". Geochimica et Cosmochimica Acta . 167 : 253–268. Código Bib : 2015GeCoA.167..253V. doi :10.1016/j.gca.2015.07.006.
- ^ Filella, M.; Rodríguez-Murillo, JC. (2017). "TCE menos estudiado: ¿están aumentando sus concentraciones ambientales debido a su uso en nuevas tecnologías?". Chemosphere . 182 : 605–616. Bibcode :2017Chmsp.182..605F. doi :10.1016/j.chemosphere.2017.05.024. PMID 28525874.
- ^ Matsuno, H.; Yokoyama, A.; Watari, F.; Uo, M.; Kawasaki, T. (2001). "Biocompatibilidad y osteogénesis de implantes metálicos refractarios, titanio, hafnio, niobio, tantalio y renio. Biocompatibilidad del tantalio". Biomateriales . 22 (11): 1253–1262. doi :10.1016/S0142-9612(00)00275-1. PMID 11336297.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Tantalum (metal and oxide powder, as Ta)" (Guía de bolsillo de los CDC y NIOSH sobre peligros químicos: tantalio (polvo de metal y óxido, como Ta)). www.cdc.gov . Consultado el 24 de noviembre de 2015 .
Enlaces externos
- Centro de estudios internacionales de tantalio y niobio
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos





