Cloruro de tantalio (V)
 | |
| Nombres | |
|---|---|
| Nombres IUPAC Cloruro de tantalio (V) Pentacloruro de tantalio | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química |
|
| Tarjeta informativa de la ECHA | 100.028.869 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| TaCl5 | |
| Masa molar | 358,213 g/mol |
| Apariencia | cristales monoclínicos blancos [1] |
| Densidad | 3,68 g/ cm3 |
| Punto de fusión | 216 °C (421 °F; 489 K) |
| Punto de ebullición | 239,4 °C (462,9 °F; 512,5 K) (se descompone) |
| reacciona | |
| Solubilidad | cloroformo , CCl 4 |
| +140,0 × 10 −6 cm3 / mol | |
| Estructura | |
| Monoclínico , mS72 | |
| C2/m, n.º 12 | |
| Termoquímica | |
Entropía molar estándar ( S ⦵ 298 ) | 221,75 J·K −1 mol −1 |
Entalpía estándar de formación (Δ f H ⦵ 298 ) | -858,98 kJ/mol |
| Peligros | |
| Etiquetado SGA : | |
  | |
| Peligro | |
| H302 , H314 | |
| P280 , P305+P351+P338 , P310 | |
| NFPA 704 (rombo cortafuegos) | |
| punto de inflamabilidad | Ininflamable |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 1900 mg/kg (oral, rata) |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
| Compuestos relacionados | |
Otros aniones | Fluoruro de tantalio (V) Bromuro de tantalio (V) Yoduro de tantalio (V) |
Otros cationes | Cloruro de vanadio (IV) Cloruro de niobio (V) |
Compuestos relacionados | Cloruro de tantalio (III) , Cloruro de tantalio (IV) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El cloruro de tantalio (V) , también conocido como pentacloruro de tantalio , es un compuesto inorgánico con la fórmula TaCl 5 . Tiene la forma de un polvo blanco y se utiliza comúnmente como material de partida en la química del tantalio . Se hidroliza fácilmente para formar oxicloruro de tantalio (V) (TaOCl 3 ) y, finalmente, pentóxido de tantalio (Ta 2 O 5 ); esto requiere que se sintetice y manipule en condiciones anhidras , utilizando técnicas sin aire .
Estructura
El TaCl 5 cristaliza en el grupo espacial monoclínico C 2/ m . [2] Los diez átomos de cloro definen un par de octaedros que comparten un borde común. Los átomos de tántalo ocupan los centros de los octaedros y están unidos por dos ligandos puente de cloro . La estructura dimérica se conserva en disolventes no complejantes y en gran medida en estado fundido. En estado de vapor, sin embargo, el TaCl 5 es monomérico . Este monómero adopta una estructura bipiramidal trigonal , como la del PCl 5 . [3]
Propiedades físicas
La solubilidad del pentacloruro de tantalio aumenta ligeramente para las siguientes series de hidrocarburos aromáticos :
- benceno < tolueno < m -xileno < mesitileno
Esto se refleja en la intensificación del color de las soluciones, que pasan del amarillo pálido al naranja. El pentacloruro de tantalio es menos soluble en ciclohexano y tetracloruro de carbono que en los hidrocarburos aromáticos. También se sabe que estas soluciones de pentacloruro de tantalio son malos conductores de electricidad, lo que indica una baja ionización. El TaCl 5 se purifica por sublimación para dar lugar a agujas blancas.
Síntesis
El pentacloruro de tantalio se puede preparar haciendo reaccionar tantalio metálico en polvo con gas cloro a una temperatura entre 170 y 250 °C. Esta reacción también se puede realizar utilizando HCl a 400 °C. [4]
- 2Ta + 5Cl2 → 2TaCl5
- 2 Ta + 10 HCl → 2 TaCl 5 + 5 H 2
También se puede preparar mediante una reacción entre pentóxido de tantalio y cloruro de tionilo a 240 °C.
- Ta 2 O 5 + 5 SOCl 2 → 2 TaCl 5 + 5 SO 2
El pentacloruro de tantalio está disponible comercialmente, sin embargo las muestras pueden estar contaminadas con oxicloruro de tantalio (V) (TaOCl 3 ), formado por hidrólisis.
Reacciones
El TaCl 5 es electrofílico y se comporta como un catalizador de Friedel-Crafts , similar al AlCl 3 . Forma aductos con una variedad de bases de Lewis . [5]
Aductos simples
TaCl 5 forma complejos estables con éteres :
- TaCl 5 + R 2 O → TaCl 5 (OR 2 ) (R = Me, Et)
El TaCl 5 también reacciona con el pentacloruro de fósforo y el oxicloruro de fósforo , el primero como donante de cloruro y el segundo sirve como ligando, uniéndose a través del oxígeno:
- TaCl5 + PCl5 → [ PCl5+
4][ TaCl−
6] - TaCl 5 + OPCl 3 → [TaCl 5 (OPCl 3 )]
El pentacloruro de tantalio reacciona con aminas terciarias para formar aductos cristalinos.
- TaCl 5 + 2 R 3 N → [TaCl 5 (NR 3 )]
Reacciones de desplazamiento de cloruro
El pentacloruro de tantalio reacciona a temperatura ambiente con un exceso de óxido de trifenilfosfina para dar oxicloruros:
- TaCl 5 + 3 OPPh 3 → [TaOCl 3 (OPPh 3 )] x ...
La presunta formación inicial de aductos entre TaCl 5 y compuestos hidroxílicos como alcoholes , fenoles y ácidos carboxílicos es seguida inmediatamente por la eliminación de cloruro de hidrógeno y la formación de enlaces Ta–O:
- TaCl 5 + 3 HOEt → TaCl 2 (OEt) 3 + 3 HCl
En presencia de amoniaco como aceptor de HCl , los cinco ligandos de cloruro se desplazan con la formación de Ta(OEt) 5 . De manera similar, el TaCl 5 reacciona con metóxido de litio en metanol anhidro para formar derivados metoxi relacionados:
- TaCl 5 + 4 LiOMe → Ta(OMe) 4 Cl + 4 LiCl
Amonolisis y alcoholisis y reacciones relacionadas
El amoníaco desplazará la mayoría de los ligandos de cloruro del TaCl 5 para formar un grupo. El cloruro es desplazado más lentamente por aminas primarias o secundarias , pero la sustitución de los cinco centros de cloruro por grupos amido se ha logrado mediante el uso de dialquilamidas de litio, como lo ilustra la síntesis de pentakis(dimetilamido)tántalo :
- TaCl 5 + 5 LiNMe 2 → Ta(NMe 2 ) 5
Con los alcoholes, el pentacloruro reacciona para formar alcóxidos . Como se muestra en la preparación del etóxido de tantalio (V) , estas reacciones suelen llevarse a cabo en presencia de una base:
- 10 EtOH + Ta 2 Cl 10 + 10 NH 3 → Ta 2 (OEt) 10 + 10 NH 4 Cl
El pentacloruro de tantalio se reduce mediante heterociclos de nitrógeno como la piridina .
Reducción
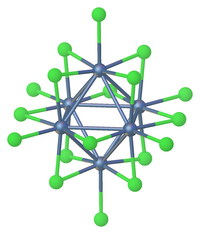
La reducción del cloruro de tantalio (V) produce grupos aniónicos y neutros que incluyen [Ta 6 Cl 18 ] 4− y [Ta 6 Cl 14 ](H 2 O) 4 . [6]
Referencias
- ^ Lide, David R., ed. (2006). Manual de química y física del CRC (87.ª edición). Boca Raton, FL: CRC Press . ISBN 0-8493-0487-3.
- ^ Rabe, Susanne; Müller, Ulrich (2000). "Estructura cristalina del pentacloruro de tantalio, (TaCl5)2". Z. Kristallogr. - New Cryst. Struct. 215 (1): 1–2. doi : 10.1515/ncrs-2000-0102 .
- ^ F. Fairbrother (1967). La química del niobio y el tantalio . Elsevier.
- ^ Young, Ralph C.; Brubaker, Carl H. (1952). "Reacción del tantalio con cloruro de hidrógeno, bromuro de hidrógeno y pentacloruro de tantalio; acción del hidrógeno sobre el pentacloruro de tantalio". Journal of the American Chemical Society . 74 (19): 4967. doi :10.1021/ja01139a524.
- ^ FA Cotton , G. Wilkinson , Química inorgánica avanzada (4.ª ed.), Wiley, Nueva York, 1980 .
- ^ Duraisamy, Thirumalai; Hay, Daniel NT; Messerle, Louis (2014). "Clústeres de haluros de hexatantalio octaédricos". Síntesis inorgánica: volumen 36. Vol. 36. págs. 1–8. doi :10.1002/9781118744994.ch1. ISBN 9781118744994.
- ^ Thaxton, CB; Jacobson, RA (1971). "La estructura cristalina de H 2 (Ta 6 Cl 18 )(H 2 O) 6 ". Química inorgánica . 10 : 1460–1463. doi :10.1021/ic50101a029.
Lectura adicional
- Ozin, GA; Walton, RA (1970). "Espectros vibracionales y estructuras de los complejos 1:1 de niobio y tantalio, pentacloruros y pentabromuro de tantalio con aceto-, perdeuterioaceto- y propionitrilos en los estados sólido y en solución y un análisis vibracional de las especies MX 5 , NC·CY 3 (Y = H o D)". J. Chem. Soc. A : 2236–2239. doi :10.1039/j19700002236.
- Bullock, JI; Parrett, FW; Taylor, NJ (1973). "Algunos complejos de haluro metálico-haluro de fósforo-haluro de alquilo. Parte II. Reacciones con pentacloruros de niobio y tantalio y hexacloruro de tungsteno". J. Chem. Soc., Dalton Trans. (5): 522–524. doi :10.1039/DT9730000522.
- Đorđević, C.; Katović, V. (1970). "Complejos de coordinación de niobio y tantalio. Parte VIII. Complejos de niobio(IV), niobio(V) y tantalio(V) con ligandos mixtos oxo, halógeno, alcoxi y 2,2'-bipiridilos". J. Chem. Soc. A : 3382–3386. doi :10.1039/j19700003382.
- Cowley, A.; Fairbrother, F.; Scott, N. (1958). "Los haluros de niobio (columbio) y tantalio. Parte V. Complejos de éter dietílico de pentacloruros y pentabromuros; la solubilidad del pentaiyoduro de tantalio en éter". J. Chem. Soc. : 3133–3137. doi :10.1039/JR9580003133.
Enlaces externos
- Base de datos de referencia estándar del NIST




