Fluoruro de hidrógeno
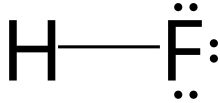 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Otros nombres Fluorano | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.028.759 | ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1052 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| alta frecuencia | |||
| Masa molar | 20,006 g·mol −1 | ||
| Apariencia | gas incoloro o líquido incoloro (por debajo de 19,5 °C) | ||
| Olor | desagradable | ||
| Densidad | 1,15 g/L, gas (25 °C) 0,99 g/mL, líquido (19,5 °C) 1,663 g/mL, sólido (–125 °C) | ||
| Punto de fusión | -83,6 °C (-118,5 °F; 189,6 K) | ||
| Punto de ebullición | 19,5 °C (67,1 °F; 292,6 K) | ||
| miscible (líquido) | |||
| Presión de vapor | 783 mmHg (20 °C) [1] | ||
| Acidez (p K a ) | 3,17 (en agua), 15 (en DMSO) [2] | ||
| Ácido conjugado | Fluornio | ||
| Base conjugada | Fluoruro | ||
Índice de refracción ( n D ) | 1.00001 | ||
| Estructura | |||
| Lineal | |||
| 1,86 D | |||
| Termoquímica | |||
Entropía molar estándar ( S ⦵ 298 ) | 8,687 J/g K (gas) | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −13,66 kJ/g (gas) −14,99 kJ/g (líquido) | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Altamente tóxico, corrosivo, irritante. | ||
| Etiquetado SGA : | |||
   | |||
| Peligro | |||
| H300+H310+H330 , H314 | |||
| P260 , P262 , P264 , P270 , P271 , P280 , P284 , P301+P310 , P301+P330+P331 , P302+P350 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P320 , P321 , P322 , P330 , P361 , P363 , P403+P233 , P405 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | ninguno | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 17 ppm (rata, oral) | ||
LC 50 ( concentración media ) | 1276 ppm (rata, 1 hora) 1774 ppm (mono, 1 hora) 4327 ppm (conejillo de indias, 15 min) [3] | ||
LC Lo ( valor más bajo publicado ) | 313 ppm (conejo, 7 h) [3] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | Valor límite de exposición profesional (TWA) 3 ppm [1] | ||
REL (recomendado) | TWA 3 ppm (2,5 mg/m 3 ) C 6 ppm (5 mg/m 3 ) [15 minutos] [1] | ||
IDLH (Peligro inmediato) | 30 ppm [1] | ||
| Compuestos relacionados | |||
Otros aniones | Cloruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno Astaturo de hidrógeno | ||
Otros cationes | Fluoruro de sodio Fluoruro de potasio Fluoruro de rubidio Fluoruro de cesio | ||
Compuestos relacionados | Agua Amoniaco | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El fluoruro de hidrógeno (flurano) es un compuesto inorgánico con fórmula química H F . Es un gas o líquido incoloro muy venenoso que se disuelve en agua para producir ácido fluorhídrico . Es la principal fuente industrial de flúor , a menudo en forma de ácido fluorhídrico, y es una materia prima importante en la preparación de muchos compuestos importantes, incluidos productos farmacéuticos y polímeros como el politetrafluoroetileno (PTFE). El HF también se usa ampliamente en la industria petroquímica como componente de superácidos . Debido a la fuerte y extensa unión de hidrógeno , hierve a temperatura cercana a la ambiente, que es una temperatura mucho más alta que otros haluros de hidrógeno .
El fluoruro de hidrógeno es un gas extremadamente peligroso que, al entrar en contacto con la humedad , forma ácido fluorhídrico corrosivo y penetrante . El gas también puede causar ceguera por destrucción rápida de las córneas .
Historia
En 1771 Carl Wilhelm Scheele preparó la solución acuosa de ácido fluorhídrico en grandes cantidades, aunque este compuesto ya se conocía en la industria del vidrio antes de esa fecha. Al químico francés Edmond Frémy (1814-1894) se le atribuye el descubrimiento del fluoruro de hidrógeno (HF) mientras intentaba aislar el flúor .
Estructura y reacciones

El HF es diatómico en fase gaseosa. En estado líquido, el HF forma enlaces de hidrógeno relativamente fuertes , de ahí su punto de ebullición relativamente alto. El HF sólido está formado por cadenas en zigzag de moléculas de HF. Las moléculas de HF, con un enlace covalente H–F corto de 95 pm de longitud, están unidas a las moléculas vecinas por distancias intermoleculares H–F de 155 pm. [4] El HF líquido también está formado por cadenas de moléculas de HF, pero las cadenas son más cortas y constan de una media de tan solo cinco o seis moléculas. [5]
Comparación con otros haluros de hidrógeno
El fluoruro de hidrógeno no hierve hasta los 20 °C, a diferencia de los haluros de hidrógeno más pesados, que hierven entre −85 °C (−120 °F) y −35 °C (−30 °F). [6] [7] [8] Este enlace de hidrógeno entre las moléculas de HF da lugar a una alta viscosidad en la fase líquida y a una presión inferior a la esperada en la fase gaseosa.
Soluciones acuosas
El HF es miscible con agua (se disuelve en cualquier proporción). Por el contrario, los demás haluros de hidrógeno presentan solubilidades limitantes en agua. El fluoruro de hidrógeno forma un monohidrato HF . H 2 O con un punto de fusión de −40 °C (−40 °F), que es 44 °C (79 °F) superior al punto de fusión del HF puro. [9]
| Similitudes entre HF y H2O | |
 |  |
| Puntos de ebullición de los haluros de hidrógeno (azul) y calcogenuros de hidrógeno (rojo): HF y H 2 O rompen tendencias. | Punto de congelación de mezclas de HF/H2O : las flechas indican compuestos en estado sólido. |
Las soluciones acuosas de HF se denominan ácido fluorhídrico . Cuando está diluido, el ácido fluorhídrico se comporta como un ácido débil, a diferencia de los otros ácidos hidrohalogenados, debido a la formación de pares de iones unidos por enlaces de hidrógeno [ H 3 O + ·F − ]. Sin embargo, las soluciones concentradas son ácidos fuertes, porque predominan los aniones bifluoruro , en lugar de los pares de iones. En el HF anhidro líquido, se produce la autoionización : [10] [11]
- 3HF ⇌ H2F ++ HF−2
que forma un líquido extremadamente ácido ( H 0 = −15,1 ).
Reacciones con ácidos de Lewis
Al igual que el agua, el HF puede actuar como una base débil, reaccionando con ácidos de Lewis para dar superácidos . Se obtiene una función de acidez de Hammett ( H 0 ) de −21 con pentafluoruro de antimonio (SbF 5 ), formando ácido fluoroantimónico . [12] [13]
Producción
El fluoruro de hidrógeno se produce típicamente mediante la reacción entre el ácido sulfúrico y grados puros del mineral fluorita : [14]
- CaF 2 + H 2 SO 4 → 2 HF + CaSO 4
Alrededor del 20% del HF fabricado es un subproducto de la producción de fertilizantes, que genera ácido hexafluorosilícico . Este ácido puede degradarse para liberar HF térmicamente y por hidrólisis:
- H2SiF6 → 2HF + SiF4
- SiF4 + 2 H2O → 4 HF + SiO2
Usar
En general, el fluoruro de hidrógeno anhidro es más común en la industria que su solución acuosa, el ácido fluorhídrico . Sus principales usos, en términos de tonelaje, son como precursor de compuestos organofluorados y precursor de criolita para la electrólisis del aluminio. [14]
Precursor de compuestos organofluorados
El HF reacciona con los clorocarbonos para formar fluorocarbonos. Una aplicación importante de esta reacción es la producción de tetrafluoroetileno (TFE), precursor del teflón . El cloroformo es fluorado por el HF para producir clorodifluorometano (R-22): [14]
- CHCl3 + 2HF → CHClF2 + 2HCl
La pirólisis del clorodifluorometano (a 550-750 °C) produce TFE.
El HF es un disolvente reactivo en la fluoración electroquímica de compuestos orgánicos. En este enfoque, el HF se oxida en presencia de un hidrocarburo y el flúor reemplaza los enlaces C–H por enlaces C–F . De esta manera se producen ácidos carboxílicos perfluorados y ácidos sulfónicos . [15]
El 1,1-difluoroetano se produce añadiendo HF al acetileno utilizando mercurio como catalizador. [15]
- HC≡CH + 2HF → CH3CHF2
El intermedio en este proceso es el fluoruro de vinilo o fluoroetileno, el precursor monomérico del fluoruro de polivinilo .
Precursor de fluoruros metálicos y flúor.
La electroextracción de aluminio se basa en la electrólisis del fluoruro de aluminio en criolita fundida. Se consumen varios kilogramos de HF por cada tonelada de aluminio producida. Se producen otros fluoruros metálicos utilizando HF, incluido el tetrafluoruro de uranio . [14]
El HF es el precursor del flúor elemental , F 2 , mediante la electrólisis de una solución de HF y bifluoruro de potasio . El bifluoruro de potasio es necesario porque el HF anhidro no conduce la electricidad. Anualmente se producen varios miles de toneladas de F 2 . [16]
Catalizador
El HF actúa como catalizador en los procesos de alquilación en las refinerías. Se utiliza en la mayoría de las instalaciones de producción de benceno de alquilo lineal instaladas en el mundo. El proceso implica la deshidrogenación de n -parafinas a olefinas y la posterior reacción con benceno utilizando HF como catalizador. Por ejemplo, en las refinerías de petróleo, el "alquilato", un componente de la gasolina de alto octanaje , se genera en unidades de alquilación, que combinan olefinas C3 y C4 e isobutano . [ 14]
Solvente
El fluoruro de hidrógeno es un excelente disolvente. Debido a la capacidad del HF para participar en la formación de puentes de hidrógeno, incluso las proteínas y los carbohidratos se disuelven en HF y pueden recuperarse de él. Por el contrario, la mayoría de los productos químicos inorgánicos que no contienen flúor reaccionan con el HF en lugar de disolverse. [17]
Efectos sobre la salud

El fluoruro de hidrógeno es altamente corrosivo y un potente veneno por contacto. La exposición requiere atención médica inmediata. [18] Puede causar ceguera por destrucción rápida de las córneas . La inhalación de fluoruro de hidrógeno en niveles altos o en combinación con el contacto con la piel puede causar la muerte por un ritmo cardíaco irregular o por edema pulmonar (acumulación de líquido en los pulmones). [18]
Referencias
- ^ abcd Guía de bolsillo del NIOSH sobre peligros químicos. "#0334". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Evans, DA "pKa's of Inorganic and Oxo-Acids" (PDF) . Consultado el 19 de junio de 2020 .
- ^ ab "Fluoruro de hidrógeno". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ Johnson, MW; Sandor, E.; Arzi, E. (1975). "La estructura cristalina del fluoruro de deuterio". Acta Cristalográfica . B31 (8): 1998–2003. doi :10.1107/S0567740875006711.
- ^ McLain, Sylvia E.; Benmore, CJ; Siewenie, JE; Urquidi, J.; Turner, JF (2004). "Sobre la estructura del fluoruro de hidrógeno líquido". Edición internacional Angewandte Chemie . 43 (15): 1952–55. doi :10.1002/anie.200353289. PMID 15065271.
- ^ Pauling, Linus A. (1960). La naturaleza del enlace químico y la estructura de las moléculas y los cristales: Introducción a la química estructural moderna . Cornell University Press. pp. 454–464. ISBN 978-0-8014-0333-0.
- ^ Atkins, Peter; Jones, Loretta (2008). Principios químicos: la búsqueda de conocimiento. WH Freeman & Co., págs. 184-185. ISBN 978-1097774678.
- ^ Emsley, John (1981). «La fuerza oculta del hidrógeno». New Scientist . 91 (1264): 291–292. Archivado desde el original el 22 de julio de 2023. Consultado el 25 de diciembre de 2012 .
- ^ Greenwood, NN; Earnshaw, A. (1998). Química de los elementos (2.ª ed.). Oxford: Butterworth Heinemann. págs. 812–816. ISBN 0-7506-3365-4.
- ^ C. E. Housecroft y A. G. Sharpe Química inorgánica , pág. 221.
- ^ F. A. Cotton y G. Wilkinson Química inorgánica avanzada , pág. 111.
- ^ W. L. Jolly "Química inorgánica moderna" (McGraw-Hill 1984), pág. 203. ISBN 0-07-032768-8 .
- ^ FA Cotton y G. Wilkinson, Química inorgánica avanzada (5.ª ed.) John Wiley and Sons: Nueva York, 1988. ISBN 0-471-84997-9 . pág. 109.
- ^ abcde J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, JP Cuer (2000). "Compuestos de flúor inorgánicos". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a11_307. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ ab G. Siegemund, W. Schwertfeger, A. Feiring, B. Smart, F. Behr, H. Vogel, B. McKusick (2005). "Compuestos de flúor orgánicos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a11_349. ISBN 978-3527306732.
{{cite encyclopedia}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ M. Jaccaud, R. Faron, D. Devilliers, R. Romano (2005). "Flúor". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a11_293. ISBN . 978-3527306732.
{{cite encyclopedia}}: CS1 maint: varios nombres: lista de autores ( enlace ). - ^ Greenwood y Earnshaw, "Química de los elementos", págs. 816–819.
- ^ ab Datos sobre el fluoruro de hidrógeno (ácido fluorhídrico)
Enlaces externos
- Fluoruros, fluoruro de hidrógeno y flúor en ATSDR . Consultado el 30 de septiembre de 2019.
- CDC - Guía de bolsillo de NIOSH sobre peligros químicos
- Hoja informativa sobre fluoruro de hidrógeno [ enlace roto ] en Toxics Use Reduction Institute






