- Niveles de noretisterona y etinilestradiol durante 24 horas después de una dosis oral única de 10 mg de acetato de noretisterona en mujeres posmenopáusicas. [47]
- Niveles de noretisterona y etinilestradiol durante 8 semanas después de una única inyección intramuscular de 200 mg de enantato de noretisterona en mujeres premenopáusicas. [94]
Noretisterona
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Norlutin, otros |
| Otros nombres | NET; Noretindrona; NSC-9564; LG-202; Etinilestrosterona; Norpregneninolona; Anhidrohidroxi-norprogesterona; Etinilestrenolona; 17α-Etinil-19-nortestosterona; 17α-Etinilestra-4-en-17β-ol-3-ona; 17α-Hidroxi-19-norpregn-4-en-20-yn-3-ona |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a604034 |
| Datos de licencia |
|
| Vías de administración | Por la boca |
| Clase de droga | Progestina |
| Código ATC | |
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 47–73% (media 64%) [9] [10] |
| Unión de proteínas | 97%: [11] Albúmina : 61%; [11] SHBGInformación sobre herramientas Globulina transportadora de hormonas sexuales:36% [11] |
| Metabolismo | Principalmente CYP3A4 ( hígado ); [12] también 5α- / 5β-reductasa , 3α-Descripción de herramienta 3α-hidroxiesteroide deshidrogenasa/ 3β-HSDDescripción de herramienta 3β-hidroxiesteroide deshidrogenasa, y aromatasa |
| Vida media de eliminación | 5,2–12,8 horas (media 8,0 horas) [9] |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.000.619 |
| Datos químicos y físicos | |
| Fórmula | C20H26O2 |
| Masa molar | 298,426 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| Punto de fusión | 203 a 204 °C (397 a 399 °F) |
| |
| (verificar) | |
La noretisterona , también conocida como noretisterona y vendida bajo la marca Norlutin entre otras, es un medicamento progestágeno utilizado en píldoras anticonceptivas , terapia hormonal menopáusica y para el tratamiento de trastornos ginecológicos . [11] [13] El medicamento está disponible en formulaciones de dosis baja y dosis alta y tanto solo como en combinación con un estrógeno . [13] [14] Se usa por vía oral o, como enantato de noretisterona , mediante inyección en el músculo . [11] [13] [15]
Los efectos secundarios de la noretisterona incluyen irregularidades menstruales , dolores de cabeza , náuseas , sensibilidad en los senos , cambios de humor , acné , aumento del crecimiento del cabello . [16] [17] La noretisterona es una progestina, o un progestágeno sintético , y por lo tanto es un agonista del receptor de progesterona , el objetivo biológico de los progestágenos como la progesterona . [11] [13] Tiene una actividad androgénica y estrogénica débil , principalmente en dosis altas, y ninguna otra actividad hormonal importante. [11] [18]
La noretisterona se descubrió en 1951 y fue una de las primeras progestinas en desarrollarse. [19] [20] [21] Se introdujo por primera vez para uso médico por sí sola en 1957 y se introdujo en combinación con un estrógeno para su uso como píldora anticonceptiva en 1963. [21] [22] A veces se la denomina progestina de "primera generación". [23] [24] Al igual que el desogestrel y el norgestrel , la noretisterona está disponible como una "minipíldora" de solo progestágeno para el control de la natalidad. [25] [26] [27] La noretisterona se comercializa ampliamente en todo el mundo. [28] Está disponible como medicamento genérico . [29] En 2022, fue el 135.º medicamento más recetado en los Estados Unidos, con más de 4 millones de recetas. [30] [31] Está en la Lista de medicamentos esenciales de la Organización Mundial de la Salud . [32]
Usos médicos
La noretisterona se utiliza como anticonceptivo hormonal en combinación con un estrógeno (generalmente etinilestradiol (EE)) en píldoras anticonceptivas orales combinadas y sola en píldoras que contienen solo progestágeno .
Otro uso médico de la noretisterona es aliviar el dolor relacionado con la endometriosis . De hecho, el 50% de las pacientes que recibieron tratamiento médico o quirúrgico para el dolor pélvico relacionado con la endometriosis se han beneficiado de la terapia con progestina . Esto podría deberse al hecho de que la noretisterona induce la proliferación endometrial durante la fase secretora, lo que ha demostrado aliviar las molestias de dolor endometrial. Otra forma en que la noretisterona puede actuar para reducir el dolor endometrial es a través de la inhibición de la ovulación . El dolor y las molestias de la endometriosis empeoran durante la ovulación. [33]
| Composición | Dosis | Nombres de marca | Usar |
|---|---|---|---|
| Sólo NET | Bajo (p. ej., 0,35 mg) | Múltiple [a] | Anticonceptivo oral que contiene solo progestágeno |
| Solo NET o NETA | Alto (por ejemplo, 5 mg, 10 mg) | Múltiple [b] | Trastornos ginecológicos y otros usos |
| Solo NETE | Inyección (p. ej., 200 mg) | Múltiple [c] | Anticonceptivo inyectable que contiene solo progestágeno |
| NET o NETA con etinilestradiol | Bajo (p. ej., 0,4 mg, 0,5 mg, 0,75 mg, 1 mg, 1,5 mg) | Múltiple [d] | Anticonceptivo oral combinado |
| NET con mestranol | Bajo (por ejemplo, 1 mg, 2 mg) | Múltiple [e] | Anticonceptivo oral combinado |
| NETA con estradiol | Bajo (p. ej., 0,1 mg, 0,5 mg) | Múltiple [f] | Terapia hormonal combinada para la menopausia |
| NETE con valerato de estradiol | Inyección (p. ej., 50 mg) | Múltiple [g] | Anticonceptivo inyectable combinado |
| Abreviaturas: NET = Noretisterona. NETA = Acetato de noretisterona . NETE = Enantato de noretisterona . Fuentes: [34] [35] [36] [37] Notas:
| |||
Contraindicaciones
La noretisterona en dosis altas (10 mg/día) se ha asociado con enfermedad venooclusiva hepática y, debido a este efecto adverso, no se debe administrar noretisterona a pacientes sometidos a trasplante alogénico de médula ósea , ya que se ha asociado con una supervivencia a un año sustancialmente menor después del trasplante. [38] [39]
Efectos secundarios
En dosis anticonceptivas y de reemplazo hormonal (0,35 a 1 mg/día), la noretisterona tiene esencialmente solo efectos secundarios progestágenos . En la mayoría de los estudios clínicos de noretisterona para anticoncepción o terapia hormonal menopáusica, el fármaco se ha combinado con un estrógeno y, por esta razón, es difícil determinar cuáles de los efectos secundarios fueron causados por la noretisterona y cuáles por el estrógeno en dicha investigación. Sin embargo, el enantato de noretisterona , un profármaco de noretisterona administrado por vía intramuscular que se usa como anticonceptivo de acción prolongada, se usa sin un estrógeno y, por lo tanto, se puede emplear como sustituto de la noretisterona en términos de comprender sus efectos y tolerabilidad . En estudios clínicos, el efecto secundario más común con el enantato de noretisterona ha sido alteraciones menstruales , incluyendo sangrado o manchado prolongado y amenorrea . [38] : 253 Otros efectos secundarios han incluido distensión abdominal periódica y dolor en los senos , ambos se cree que se deben a la retención de agua y se pueden aliviar con diuréticos . [38] : 253 No ha habido asociación con el aumento de peso , y la presión arterial , la coagulación sanguínea y la tolerancia a la glucosa se han mantenido normales. [38] : 253 Sin embargo, se ha observado una disminución del colesterol HDL . [38] : 253
En dosis altas (5 a 60 mg/día), por ejemplo las utilizadas en el tratamiento de trastornos ginecológicos, la noretisterona puede causar hipogonadismo debido a sus efectos antigonadotrópicos y puede tener efectos secundarios estrogénicos y androgénicos débiles.
Las dosis altas de acetato de noretisterona (10 mg/día) se han asociado con pruebas de función hepática anormales , incluyendo elevaciones significativas de las enzimas hepáticas . [40] [41] [42] Estas enzimas hepáticas incluían la lactato deshidrogenasa y la glutamato piruvato transaminasa . [42] Aunque se describió que no tenían relevancia clínica, [42] las enzimas hepáticas elevadas asociadas con el acetato de noretisterona pueden haber impedido su desarrollo posterior para la anticoncepción hormonal masculina. [40] [41]
Androgénico
Debido a su débil actividad androgénica, la noretisterona puede producir efectos secundarios androgénicos como acné , hirsutismo y cambios de voz de leve gravedad en algunas mujeres en dosis altas (p. ej., 10 a 40 mg/día). [17] Sin embargo, esto no es así con los anticonceptivos orales combinados que contienen noretisterona y EE. [18] Estas formulaciones contienen dosis bajas de noretisterona (0,35 a 1 mg/día) [18] en combinación con estrógeno y, de hecho, se asocian con una mejoría de los síntomas del acné. [43] [44] De acuerdo con esto, de hecho están aprobados por la FDA.Información sobre herramientas de la Administración de Alimentos y Medicamentospara el tratamiento del acné en mujeres en los Estados Unidos. [43] [44] Se cree que la mejora de los síntomas del acné se debe a un aumento de 2 a 3 veces en los niveles de globulina transportadora de hormonas sexuales (SHBG) y una disminución consecuente en los niveles de testosterona libre causada por EE, lo que resulta en una disminución general de la señalización androgénica en el cuerpo. [45]
Las glándulas sebáceas son altamente sensibles a los andrógenos y su tamaño y actividad son marcadores potenciales del efecto androgénico. [46] Se ha descubierto que una dosis alta de 20 mg/día de noretisterona o acetato de noretisterona estimula significativamente las glándulas sebáceas, mientras que dosis más bajas de 5 mg/día y 2,5 mg/día de noretisterona y acetato de noretisterona, respectivamente, no estimularon significativamente la producción de sebo y, en consecuencia, se consideraron carentes de androgenicidad significativa. [46] Por el contrario, se ha descubierto que dosis de noretisterona de 0,5 a 3 mg/día disminuyen de forma dependiente de la dosis los niveles de SHBG (y, por lo tanto, suprimen la producción hepática de SHBG), que es otro marcador altamente sensible de la androgenicidad. [47]
Un estudio clínico a gran escala de dosis orales altas a muy altas de noretisterona (10 a 40 mg/día) administradas durante períodos prolongados de tiempo (4 a 35 semanas) para prevenir abortos espontáneos en mujeres embarazadas encontró que el 5,5% de las mujeres experimentaron efectos secundarios androgénicos leves, como cambios leves en la voz ( ronquera ), acné e hirsutismo , y que el 18,3% de las niñas nacidas de madres mostraron, en la mayoría de los casos solo una leve virilización de los genitales . [17] Los síntomas androgénicos maternos ocurrieron con mayor frecuencia en mujeres que recibieron una dosis de noretisterona de 30 mg/día o más durante un período de 15 semanas o más. [17] En las niñas que experimentaron virilización de los genitales, la única manifestación en el 86,7% de los casos fue un agrandamiento variado pero casi siempre leve del clítoris. [17] En el 13,3% restante de los casos afectados se produjo un marcado agrandamiento del clítoris y una fusión parcial de los pliegues labioescrotales . [17] Las dosis utilizadas en estos casos fueron de 20 a 40 mg/día. [17]
En una carta al editor sobre el tema de la virilización causada por altas dosis de acetato de noretisterona en mujeres, un médico expresó que no habían observado la "más mínima evidencia de virilización" y que "ciertamente no había habido hirsutismo ni cambios en la voz" en 55 mujeres con cáncer de mama avanzado que habían tratado con 30 a 60 mg/día de noretisterona durante hasta seis meses. [48]
La noretisterona en dosis altas se ha utilizado para suprimir la menstruación en mujeres con discapacidad intelectual grave que eran incapaces de controlar sus propias menstruaciones. [49] [50] Un estudio de 118 mujeres nulíparas tratadas con 5 mg/día de noretisterona durante un período de 2 a 30 meses encontró que el fármaco era eficaz para producir amenorrea en el 86% de las mujeres, y que se producía sangrado intermenstrual en el 14% restante. [49] Los efectos secundarios, como aumento de peso , hirsutismo , acné , dolor de cabeza , náuseas y vómitos , no parecieron aumentar en incidencia y no se observaron "efectos secundarios perturbadores" en ninguna de las mujeres. [49] [50] Otro estudio de 5 mg/día de noretisterona en 132 mujeres tampoco mencionó los efectos secundarios androgénicos. [51] Estos hallazgos sugieren poco o ningún riesgo de efectos secundarios androgénicos con noretisterona en una dosis de 5 mg/día. [49] [50] Un estudio de 194 mujeres tratadas con 5 a 15 mg/día de acetato de noretisterona durante una duración media de terapia de 13 meses para suprimir los síntomas de la endometriosis no observó efectos secundarios en el 55,2% de las pacientes, aumento de peso en el 16,1%, acné en el 9,9%, labilidad del estado de ánimo en el 8,9%, sofocos en el 8,3% y profundización de la voz en dos mujeres (1,0%). [52]
Estrogénico
La noretisterona es débilmente estrogénica (a través de la conversión en su metabolito EE), y por esta razón, se ha encontrado que en dosis altas está asociada con altas tasas de efectos secundarios estrogénicos como agrandamiento de los senos en mujeres y ginecomastia en hombres, pero también con mejoría de los síntomas menopáusicos en mujeres posmenopáusicas. [53] Se ha sugerido que dosis muy altas (p. ej., 40 mg/día, que a veces se usan en la práctica clínica para diversas indicaciones) de acetato de noretisterona (y por extensión noretisterona) pueden resultar en un mayor riesgo de tromboembolia venosa (TEV) de manera análoga a dosis altas (por encima de 50 μg/día) de EE, y que incluso dosis de acetato de noretisterona de 10 a 20 mg, que corresponden a dosis de EE de aproximadamente 20 a 30 μg/día, pueden en ciertas mujeres estar asociadas con un mayor riesgo. [54] [55] Un estudio también encontró que el etinilestradiol y la noretisterona tenían una mayor influencia en los factores de coagulación cuando la dosis de noretisterona era de 3 o 4 mg que cuando era de 1 mg. [56] Esto podría haberse debido al etinilestradiol adicional generado por dosis más altas de noretisterona. [56]
Sobredosis
No se han notificado efectos secundarios graves por sobredosis de noretisterona, ni siquiera en niños pequeños. [8] Por lo tanto, la sobredosis generalmente no requiere tratamiento. [8] Se han estudiado dosis altas de hasta 60 mg/día de noretisterona durante tratamientos prolongados sin que se hayan descrito efectos adversos graves. [48]
Interacciones
La 5α-reductasa desempeña un papel importante en el metabolismo de la noretisterona, y los inhibidores de la 5α-reductasa como la finasterida y la dutasterida pueden inhibir su metabolismo. [ cita requerida ] La noretisterona se metaboliza parcialmente a través de la hidroxilación por CYP3A4 , y los inhibidores e inductores de CYP3A4 pueden alterar significativamente los niveles circulantes de noretisterona. [12] Por ejemplo, se ha descubierto que los inductores de CYP3A4 rifampicina y bosentán disminuyen la exposición a la noretisterona en un 42% y un 23%, respectivamente, y también se ha descubierto que los inductores de CYP3A4 carbamazepina y la hierba de San Juan aceleran la depuración de la noretisterona. [12]
Farmacología
Farmacodinamia
La noretisterona es un potente progestágeno y un débil andrógeno y estrógeno . [11] Es decir, es un potente agonista del receptor de progesterona (PR) y un débil agonista del receptor de andrógenos (AR) y del receptor de estrógenos (ER). [11] La noretisterona en sí tiene una afinidad insignificante por el ER; su actividad estrogénica proviene de un metabolito activo que se forma en cantidades muy pequeñas, el etinilestradiol (EE), que es un estrógeno muy potente. [11] La noretisterona y sus metabolitos tienen una afinidad insignificante por el receptor de glucocorticoides (GR) y el receptor de mineralocorticoides (MR) y, por lo tanto, no tienen actividad glucocorticoide , antiglucocorticoide , mineralocorticoide o antimineralocorticoide . [11]
| Compuesto | Escribe a | Relaciones públicasInformación sobre herramientas Receptor de progesterona | ArkansasReceptor de andrógenos | ESReceptor de estrógeno | GRAMOInformación sobre herramientas Receptor de glucocorticoides | SEÑORInformación sobre herramientas Receptor de mineralocorticoides | SHBGInformación sobre herramientas Globulina transportadora de hormonas sexuales | CBGGlobulina transportadora de corticosteroides |
|---|---|---|---|---|---|---|---|---|
| Noretisterona | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-Dihidronoretisterona | Metabolito | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α,5α-tetrahidronoretisterona | Metabolito | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α,5β-tetrahidronoretisterona | Metabolito | ? | 0 | 0 | ? | ? | ? | ? |
| 3β,5α-tetrahidronoretisterona | Metabolito | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| Etinilestradiol | Metabolito | 15–25 | 1–3 | 112 | 1–3 | 0 | 0,18 | 0 |
| Acetato de noretisterona | Profármaco | 20 | 5 | 1 | 0 | 0 | ? | ? |
| Enantato de noretisterona | Profármaco | ? | ? | ? | ? | ? | ? | ? |
| Noretinodrel | Profármaco | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| Etinodiol | Profármaco | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| Diacetato de etinodiol | Profármaco | 1 | 0 | 0 | 0 | 0 | ? | ? |
| Linestrenol | Profármaco | 1 | 1 | 3 | 0 | 0 | ? | ? |
| Notas: Los valores son porcentajes (%). Los ligandos de referencia (100%) fueron promegestona para el PR.Información sobre herramientas sobre el receptor de progesterona, metribolona para la ARReceptor de andrógenos con información sobre herramientas, estradiol para el ERReceptor de estrógeno con información sobre herramientas, dexametasona para el GRReceptor de glucocorticoides con información sobre herramientas, aldosterona para el MRInformación sobre herramientas sobre el receptor de mineralocorticoides, dihidrotestosterona para SHBGInformación sobre herramientas sobre la globulina transportadora de hormonas sexuales, y cortisol para CBGGlobulina transportadora de corticosteroidesNotas al pie: a = metabolito activo o inactivo , profármaco o ninguno de los dos. Fuentes: Ver plantilla. | ||||||||
Actividad progestágena
La noretisterona es un potente progestágeno y se une al PR con aproximadamente el 150% de la afinidad de la progesterona . [11] En contraste, sus compuestos parentales, testosterona , nandrolona (19-nortestosterona) y etisterona (17α-etiniltestosterona), tienen el 2%, 22% y 44% de la afinidad de unión relativa de la progesterona por el PR. [57] A diferencia de la noretisterona, se ha descubierto que su principal metabolito activo, la 5α-dihidronoretisterona (5α-DHNET), que se forma por transformación a través de la 5α-reductasa , posee actividad progestágena y antiprogestágena marcada , [58] aunque su afinidad por el PR se reduce en gran medida en relación con la noretisterona, a solo el 25% de la de la progesterona. [11] La noretisterona produce cambios similares en el endometrio y la vagina , como la transformación endometrial , y es igualmente antigonadotrópica , inhibidora de la ovulación y termogénica en las mujeres en comparación con la progesterona, lo que está de acuerdo con su actividad progestágena. [59] [57] [60]
Actividad androgénica
La noretisterona tiene aproximadamente el 15% de la afinidad del esteroide anabólico-androgénico (AAS) metribolona (R-1881) por el AR y, en consecuencia, es débilmente androgénica. [11] A diferencia de la noretisterona, 5α-DHNET, el principal metabolito de la noretisterona, muestra una mayor afinidad por el AR, con aproximadamente el 27% de la afinidad de la metribolona. [11] Sin embargo, aunque 5α-DHNET tiene una mayor afinidad por el AR que la noretisterona, ha disminuido significativamente y, de hecho, casi abolido la potencia androgénica en comparación con la noretisterona en bioensayos con roedores . [61] [62] Se observaron hallazgos similares para la etisterona (17α-etiniltestosterona) y su metabolito 5α-reducido, mientras que la 5α-reducción mejoró tanto la afinidad AR como la potencia androgénica de la testosterona y la nandrolona (19-nortestosterona) en bioensayos con roedores. [62] Como tal, parece que el grupo etinil de la noretisterona en la posición C17α es responsable de su pérdida de androgenicidad tras la 5α-reducción. [62]
Se ha descubierto que la noretisterona (0,5 a 3 mg/día) disminuye de forma dependiente de la dosis los niveles circulantes de SHBG, lo que es una propiedad común de los andrógenos y se debe a la supresión mediada por AR de la producción hepática de SHBG. [47] El fármaco también tiene actividad estrogénica, y se sabe que los estrógenos aumentan la producción hepática de SHBG y los niveles circulantes, por lo que parecería que la actividad androgénica de la noretisterona supera su actividad estrogénica en este sentido. [47]
La noretisterona se une en gran medida (36%) a la SHBG en circulación. [11] Aunque tiene una menor afinidad por la SHBG que los andrógenos y estrógenos endógenos, [63] la noretisterona puede desplazar la testosterona de la SHBG y, por lo tanto, aumentar los niveles de testosterona libre, y esta acción puede contribuir a sus débiles efectos androgénicos. [64]
Actividad estrogénica

La noretisterona se une a los ER, el ERα y el ERβ , con 0,07% y 0,01% de la afinidad de unión relativa del estradiol . [65] Debido a estas afinidades relativas muy bajas, es esencialmente inactiva por sí misma como ligando de los ER en concentraciones clínicas. [11] Sin embargo, se ha descubierto que la noretisterona es un sustrato de la aromatasa y se convierte en el hígado en una pequeña medida (0,35%) en el estrógeno altamente potente etinilestradiol (EE), y por esta razón, a diferencia de la mayoría de las otras progestinas, la noretisterona tiene cierta actividad estrogénica. [11] Sin embargo, con las dosis típicas de noretisterona utilizadas en los anticonceptivos orales (0,5 a 1 mg), los niveles de EE producidos son bajos y se ha dicho que probablemente no tienen relevancia clínica. [11] Por el contrario, dosis de 5 y 10 mg de noretisterona, que se utilizan en el tratamiento de trastornos ginecológicos , se convierten a tasas de 0,7% y 1,0% y producen niveles de EE que corresponden a los producidos por dosis de 30 y 60 μg de EE, respectivamente. [9] [11] Los niveles de EE formados por 0,5 y 1 mg de noretisterona se han estimado basándose en dosis más altas como correspondientes a dosis de 2 y 10 μg de EE, respectivamente. [9] En dosis altas, la noretisterona puede aumentar el riesgo de tromboembolismo venoso debido al metabolismo en EE. [66]
Actividad de los neuroesteroides
Al igual que la progesterona y la testosterona , la noretisterona se metaboliza en metabolitos 3,5-tetrahidro . [67] Si estos metabolitos de la noretisterona interactúan con el receptor GABA A de manera similar a los metabolitos 3,5-tetrahidro de la progesterona y la testosterona como la alopregnanolona y el 3α-androstanodiol , respectivamente, es un tema que no parece haber sido estudiado y, por lo tanto, requiere aclaración. [67]
Inhibición de la esteroidogénesis
La noretisterona es un sustrato y se sabe que es un inhibidor de la 5α-reductasa , con un 4,4% y un 20,1% de inhibición a 0,1 y 1 μM, respectivamente. [11] Sin embargo, las concentraciones terapéuticas de noretisterona están en el rango nanomolar bajo , por lo que esta acción puede no ser clínicamente relevante en dosis típicas. [11]
Se ha descubierto que la noretisterona y su principal metabolito activo 5α-DHNET actúan como inhibidores irreversibles de la aromatasa (K i = 1,7 μM y 9,0 μM, respectivamente). [68] Sin embargo, como en el caso de la 5α-reductasa, las concentraciones requeridas son probablemente demasiado altas para ser clínicamente relevantes en dosis típicas. [11] Se ha evaluado específicamente la 5α-DHNET y se ha descubierto que es selectiva en su inhibición de la aromatasa y no afecta a la enzima de escisión de la cadena lateral del colesterol (P450scc), la 17α-hidroxilasa / 17,20-liasa , la 21-hidroxilasa o la 11β-hidroxilasa . [68] Dado que no está aromatizado (y por lo tanto no se puede transformar en un metabolito estrogénico), a diferencia de la noretisterona, se ha propuesto que el 5α-DHNET sea un posible agente terapéutico en el tratamiento del cáncer de mama ER-positivo . [68]
Otras actividades
La noretisterona es un inhibidor muy débil de CYP2C9 y CYP3A4 ( IC 50 = 46 μM y 51 μM, respectivamente), pero estas acciones requieren concentraciones muy altas de noretisterona que están muy por encima de los niveles circulantes terapéuticos (que están en el rango nanomolar) y, por lo tanto, probablemente no sean clínicamente relevantes. [11]
Se ha descubierto que la noretisterona y algunos de sus metabolitos 5α-reducidos producen efectos vasodilatadores en animales que son independientes de los receptores de esteroides sexuales y, por lo tanto, parecen tener un mecanismo no genómico. [69]
La noretisterona estimula la proliferación de células de cáncer de mama MCF-7 in vitro , una acción que es independiente de los PR clásicos y que, en cambio, está mediada por el componente de membrana del receptor de progesterona-1 (PGRMC1). [70] Algunas otras progestinas actúan de manera similar en este ensayo, mientras que la progesterona actúa de manera neutral. [70] No está claro si estos hallazgos pueden explicar los diferentes riesgos de cáncer de mama observados con progesterona y progestinas en estudios clínicos . [71]
Efectos antigonadotrópicos
Debido a su actividad progestágena, la noretisterona suprime el eje hipotálamo-hipofisario-gonadal (eje HPG) y, por lo tanto, tiene efectos antigonadotrópicos . [11] [57] También se esperaría que la actividad estrogénica de la noretisterona en dosis altas contribuya a sus efectos antigonadotrópicos. [72] Debido a sus efectos antigonadotrópicos, la noretisterona suprime la producción de hormonas sexuales gonadales , inhibe la ovulación en las mujeres y suprime la espermatogénesis en los hombres. [11] [57] [73]
La dosis inhibidora de la ovulación tanto de noretisterona oral como de acetato de noretisterona oral es de aproximadamente 0,5 mg/día en mujeres. [11] [74] [75] Sin embargo, existen algunos datos contradictorios que sugieren que podrían ser necesarias dosis más altas para la inhibición total de la ovulación. [76] Se ha descubierto que una inyección intramuscular de 200 mg de enantato de noretisterona previene la ovulación y suprime los niveles de estradiol , progesterona , hormona luteinizante (LH) y hormona folículo estimulante (FSH) en mujeres. [77] [78] [79] [80]
Los primeros estudios de noretisterona oral en hombres que emplearon dosis de 20 a 50 mg/día observaron supresión de la excreción de 17-cetosteroides , aumento de la excreción de estrógenos (debido a la conversión en etinilestradiol ), supresión de la espermatogénesis, la libido y la función eréctil , e incidencia de ginecomastia . [81] [82] [83] [53] [84] Se ha informado que una dosis de noretisterona oral de 25 mg/día durante 3 semanas en hombres suprime los niveles de testosterona en aproximadamente un 70%, a 100 a 200 ng/dL, dentro de 4 o 5 días, así como suprime el recuento de espermatozoides y no tiene efecto sobre la libido o la función eréctil durante este corto período de tiempo. [85] [86] En hombres jóvenes sanos, el acetato de noretisterona solo en una dosis de 5 a 10 mg/día por vía oral durante 2 semanas suprimió los niveles de testosterona de ~527 ng/dL a ~231 ng/dL (–56%). [87]

Se ha descubierto que una única inyección intramuscular de 200 mg de enantato de noretisterona solo o en combinación con 2 mg de valerato de estradiol produce una disminución rápida, fuerte y sostenida de los niveles de gonadotropina y testosterona durante hasta un mes en los hombres. [73] [89] [90] También se ha descubierto que las inyecciones intramusculares de 200 mg de enantato de noretisterona una vez cada 3 semanas suprimen la espermatogénesis en los hombres. [81] [91] De manera similar, se ha descubierto que una única inyección intramuscular de 50 mg de enantato de noretisterona en combinación con 5 mg de valerato de estradiol suprime fuertemente los niveles de testosterona en los hombres. [88] Los niveles de testosterona disminuyeron de ~503 ng/dL al inicio a ~30 ng/dL en el punto más bajo (–94%) que ocurrió el día 7 después de la inyección. [88]
Farmacocinética
Se ha revisado la farmacocinética de la noretisterona. [11] [92]
Absorción
La biodisponibilidad oral de la noretisterona es de entre el 47 y el 73%, con una biodisponibilidad oral media del 64%. [9] [10] Se ha descubierto que la micronización mejora significativamente la biodisponibilidad oral de la noretisterona al aumentar la absorción intestinal y reducir el metabolismo intestinal . [11] [93] Se ha descubierto que una dosis oral única de 2 mg de noretisterona da como resultado niveles circulantes máximos del fármaco de 12 ng/ml (40 nmol/l), mientras que una dosis oral única de 1 mg de noretisterona en combinación con 2 mg de estradiol dio como resultado niveles máximos de noretisterona de 8,5 ng/ml (29 nmol/l) una hora después de la administración. [11]
Distribución
La unión de la noretisterona a las proteínas plasmáticas es del 97%. [11] Se une en un 61% a la albúmina y en un 36% a la SHBG. [11]
Metabolismo
Metabolismo de la noretisterona y sus profármacos en humanos Las vías metabólicas implicadas en el metabolismo de la noretisterona en humanos. El acetato de noretisterona , el enantato de noretisterona , el etinodiol , el diacetato de etinodiol , el linestrenol , el noretinodrel , el quingestanol y el acetato de quingestanol son todos profármacos de la noretisterona. El etinilestradiol es un metabolito estrogénico de la noretisterona formado por las enzimas del citocromo P450 . Los dos isómeros de la dihidronoretisterona y los cuatro isómeros de la tetrahidronoretisterona están formados por las 5α- y 5β-reductasas y las 3α- y 3β-hidroxiesteroide deshidrogenasas y tienen una actividad disminuida o nula. La noretisterona y sus metabolitos también sufren hidroxilación a través de las enzimas del citocromo P450 y conjugación a través de glucuronidación y sulfatación en los grupos hidroxilo (–OH) disponibles . Fuentes : [95] [96] [97] [98] [99] [100] [15] [57] [11] [101] [102] |
La noretisterona tiene una vida media de eliminación de 5,2 a 12,8 horas, con una vida media de eliminación media de 8,0 horas. [9] El metabolismo de la noretisterona es muy similar al de la testosterona (y la nandrolona) y se produce principalmente a través de la reducción del doble enlace Δ 4 a 5α- y 5β-dihidronoretisterona, a la que sigue la reducción del grupo ceto C3 a los cuatro isómeros de 3,5-tetrahidronoretisterona. [11] Estas transformaciones son catalizadas por la 5α- y 5β-reductasa y la 3α- y 3β-hidroxiesteroide deshidrogenasa tanto en el hígado como en los tejidos extrahepáticos como la glándula pituitaria , el útero , la próstata , la vagina y la mama . [103] Con la excepción de 3α,5α- y 3β,5α-tetrahidronoretisterona, que tienen una afinidad significativa por el ER y son estrogénicos hasta cierto punto, los metabolitos 3,5-tetrahidro de la noretisterona son inactivos en términos de afinidad por los receptores de esteroides sexuales (específicamente, el PR, AR y ER). [104] [105] [106] Una pequeña cantidad de noretisterona también es convertida por la aromatasa en EE. [9] [11] [54] La noretisterona también se metaboliza en el hígado a través de hidroxilación , principalmente por CYP3A4 . [12] Alguna conjugación (incluyendo glucuronidación y sulfatación ) [103] [107] de la noretisterona y sus metabolitos ocurre a pesar del impedimento estérico por el grupo etinilo en C17α. [11] El grupo etinilo de la noretisterona se conserva en aproximadamente el 90% de todos sus metabolitos. [11]
La noretisterona se utiliza en las píldoras anticonceptivas, a diferencia de la progesterona, porque no se metaboliza tan rápidamente como la progesterona cuando se consume por vía oral. Cuando la progesterona se consume por vía oral, se metaboliza rápidamente en el tracto gastrointestinal y el hígado, y se descompone en muchos metabolitos diferentes. En cambio, la noretisterona no se metaboliza tan rápidamente, lo que permite que esté presente en mayores cantidades, lo que le permite competir de manera más efectiva por los sitios de unión del receptor de progesterona. [11]
Eliminación
La noretisterona se elimina del 33 al 81% en la orina y del 35 al 43% en las heces . [108]
Química
La noretisterona, también conocida como 17α-etinil-19-nortestosterona o como 17α-etinilestra-4-en-17β-ol-3-ona, es un esteroide sintético estrano y un derivado de la testosterona . [109] [36] Es específicamente un derivado de la testosterona en el que se ha añadido un grupo etinilo en la posición C17α y se ha eliminado el grupo metilo en la posición C19; por lo tanto, es un derivado combinado de etisterona (17α-etiniltestosterona) y nandrolona (19-nortestosterona). [109] [36] Estas modificaciones dan como resultado una mayor actividad progestágena y biodisponibilidad oral , así como una menor actividad androgénica / anabólica . [110]
Derivados
La noretisterona (NET) es el compuesto original de un gran grupo de progestinas que incluye la mayoría de las progestinas conocidas como derivados de la 19-nortestosterona. [111] Este grupo se divide por estructura química en los estranos (derivados de la noretisterona) y los gonanes (18-metilgonanos o 13β-etilestranos; derivados del levonorgestrel ) e incluye los siguientes medicamentos comercializados: [112]
|
|
Varios de estos actúan como profármacos de la noretisterona, incluidos el acetato de noretisterona , el enantato de noretisterona , el diacetato de etinodiol , el linestrenol y el acetato de quingestanol . [113] [114] [115] El noretinodrel también puede ser un profármaco de la noretisterona. [11] [9] El acetato de noretisterona se toma por vía oral de manera similar a la noretisterona, mientras que el enantato de noretisterona se administra mediante inyección en el músculo . [18]
No-17α-etinilado
Las progestinas 19-nortestosterona (19-NT) que técnicamente no son derivadas de la noretisterona (ya que no tienen un grupo etinilo C17α ) pero aún están estrechamente relacionadas (con otras sustituciones en las posiciones C17α y/o C16β) incluyen los siguientes medicamentos comercializados: [109] [36]
- Los derivados de vinilo (etenilo) C17α norgesterona (17α-vinil-δ 5(10) -19-NT) y norvinisterona (17α-vinil-19-NT)
- Los derivados alílicos C17α alilestrenol (3-deketo-17α-alil-19-NT) y altrenogest (17α-alil-δ 9,11 -19-NT)
- El derivado de alquilo C17α normetandrona (17α-metil-19-NT)
- El derivado cianometilado C17α dienogest (17α-cianometil-δ 9 -19-NT)
- El derivado etílico C16β oxendolona (16β-etil-19-NT)
Muchos esteroides anabólicos de la familia 19-nortestosterona, como la noretandrolona y el etilestrenol , también son progestágenos potentes, pero nunca se comercializaron como tales.
Síntesis
Se han publicado síntesis químicas de noretisterona. [109] [92]
Síntesis 1

El éter 3-metílico de estradiol ( 1 , EME) se reduce parcialmente al 1,5-dieno ( 2 ) como también ocurre en el primer paso de la síntesis de nandrolona. La oxidación de Oppenauer transforma entonces el grupo hidroxilo C17β en una funcionalidad cetona ( 3 ). Esto se hace reaccionar entonces con acetiluro metálico en el compuesto etinilo C17α correspondiente ( 4 ). La hidrólisis del éter enólico en condiciones suaves conduce directamente a ( 5 ), [116] que parece ser noretinodrel (aunque Lednicer afirma que es "etinodrel" en su libro (que puede ser un sinónimo etinodiol ); el etinodrel tiene un átomo de cloro unido), una progestina activa por vía oral. Este es el componente progestágeno del primer anticonceptivo oral que se ofrece a la venta (es decir, Enovid). El tratamiento del éter etinil enólico con un ácido fuerte conduce a la noretisterona ( 6 ). [19]
En la práctica, estos y todos los demás anticonceptivos orales combinados son mezclas de 1 a 2% de EE o mestranol y una progestina oral . Se ha especulado que el descubrimiento de la necesidad de estrógeno además de progestina para la eficacia anticonceptiva se debe a la presencia de una pequeña cantidad de EME no reducida ( 1 ) en los primeros lotes de 2. Esto, cuando se somete a oxidación y etinilación , por supuesto conduciría al mestranol ( 3 ). En cualquier caso, la necesidad de la presencia de estrógeno en la mezcla ahora está bien establecida experimentalmente.
Síntesis 2
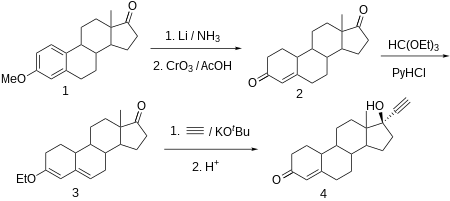
La noretisterona se obtiene a partir de estr-4-eno-3,17-diona (bolandiona), que a su vez se sintetiza mediante la reducción parcial de la región aromática del éter 3-O-metílico de la estrona con litio en amoníaco líquido, y simultáneamente del grupo ceto en C17α a un grupo hidroxilo, que luego se oxida de nuevo a un grupo ceto mediante trióxido de cromo en ácido acético . La olefina C4-C5 conjugada y el grupo carbonilo en C3 se transforman luego en éter etílico de dienol utilizando ortoformiato de etilo . El producto obtenido se etinila con acetileno en presencia de terc-butóxido de potasio . Después de la hidrólisis con clorhidrato del derivado de O-potasio formado, durante la cual también se hidroliza el éter enólico y se desplaza el doble enlace restante, se obtiene la noretisterona deseada.
Historia
La noretisterona fue sintetizada por primera vez por los químicos Luis Miramontes , Carl Djerassi y George Rosenkranz en Syntex en la Ciudad de México en 1951. [19] Se derivó de la etisterona y se encontró que poseía una potencia aproximadamente 20 veces mayor como progestágeno en comparación. [ cita requerida ] La noretisterona fue el primer progestágeno oral altamente activo en ser sintetizado, y fue precedido (como progestágeno) por la progesterona (1934), la etisterona (1938), la 19-norprogesterona (1944) y la 17α-metilprogesterona (1949), así como por la nandrolona (1950), mientras que el noretinodrel (1952) y la noretandrolona (1953) siguieron a la síntesis de la noretisterona. [20] [21] El fármaco se introdujo como Norlutin en los Estados Unidos en 1957. [22] La noretisterona se combinó posteriormente con mestranol y se comercializó como Ortho-Novum en los Estados Unidos en 1963. Fue la segunda progestina, después del noretinodrel en 1960, en usarse en un anticonceptivo oral . [21] En 1964, se comercializaron en los Estados Unidos preparaciones anticonceptivas adicionales que contenían noretisterona en combinación con mestranol o EE, como Norlestrin y Norinyl. [21]
Sociedad y cultura
Nombres genéricos
La noretisterona es la DCITooltip Nombre común internacionaly PROHIBIRDescripción emergente Nombre aprobado en Gran Bretañadel fármaco mientras que la noretindrona es su USANDescripción emergente Nombre adoptado por Estados Unidos. [109] [36]
Nombres de marca
La noretisterona está disponible en Bangladesh como Menogia (ACI), Normens (Renata), etc. La noretisterona (NET), que incluye el acetato de noretisterona y el enantato de noretisterona, se ha comercializado bajo muchas marcas en todo el mundo. [36] [28]
Disponibilidad
Estados Unidos
Anteriormente, la noretisterona estaba disponible sola en comprimidos de 5 mg bajo la marca Norlutin en los Estados Unidos, pero desde entonces esta formulación se ha descontinuado. [35] Sin embargo, el acetato de noretisterona sigue estando disponible solo en comprimidos de 5 mg bajo la marca Aygestin en los Estados Unidos. [35] Es una de las únicas formulaciones de fármacos no anticonceptivos a base de progestágeno únicamente que sigue estando disponible en los Estados Unidos. [35] Las otras incluyen progesterona , acetato de medroxiprogesterona , acetato de megestrol y caproato de hidroxiprogesterona , así como el agente atípico danazol . [35]
Tanto la noretisterona como el acetato de noretisterona también están disponibles en los Estados Unidos como anticonceptivos. [35] La noretisterona está disponible sola (nombres comerciales Camila, Errin, Heather, Micronor, Nor-QD, otros) y en combinación con EE (Norinyl, Ortho-Novum, otros) o mestranol (Norinyl, Ortho-Novum, otros), mientras que el acetato de noretisterona está disponible solo en combinación con EE (Norlestrin, otros). [35] El enantato de noretisterona no está disponible en los Estados Unidos en ninguna forma. [35] [122] [123]
Investigación
Se ha estudiado la noretisterona, como acetato de noretisterona y enantato de noretisterona, para su uso como posible anticonceptivo hormonal masculino en combinación con testosterona en hombres. [124] [125]
Se han estudiado microesferas de noretisterona de acción prolongada para inyección intramuscular para su posible uso en el control de la natalidad. [126]
Referencias
- ^ "Actualizaciones de seguridad de la marca en la monografía de productos". Health Canada . 6 de junio de 2024. Archivado desde el original el 29 de marzo de 2024 . Consultado el 8 de junio de 2024 .
- ^ "Camila-comprimido de noretindrona". DailyMed . 1 de abril de 2024 . Consultado el 29 de septiembre de 2024 .
- ^ "Emzahh-comprimido de noretindrona". DailyMed . 10 de abril de 2023 . Consultado el 29 de septiembre de 2024 .
- ^ "Errin-noretindrona comprimido". DailyMed . 1 de marzo de 2024 . Consultado el 29 de septiembre de 2024 .
- ^ "Heather - comprimido de noretindrona". DailyMed . 31 de agosto de 2021 . Consultado el 29 de septiembre de 2024 .
- ^ "Incassia-comprimido de noretindrona". DailyMed . 14 de septiembre de 2021 . Consultado el 29 de septiembre de 2024 .
- ^ "Comprimido de jenciclanoretindrona". DailyMed . 13 de diciembre de 2023 . Consultado el 29 de septiembre de 2024 .
- ^ abc "Micronor-noretindrona comprimido". DailyMed . 1 de abril de 2011 . Consultado el 29 de septiembre de 2024 .
- ^ abcdefgh Stanczyk FZ (septiembre de 2002). "Farmacocinética y potencia de las progestinas utilizadas para la terapia de reemplazo hormonal y la anticoncepción". Reseñas en Endocrine & Metabolic Disorders . 3 (3): 211–24. doi :10.1023/A:1020072325818. PMID 12215716. S2CID 27018468.
- ^ ab Fotherby K (agosto de 1996). "Biodisponibilidad de esteroides sexuales administrados por vía oral utilizados en la anticoncepción oral y la terapia de reemplazo hormonal". Anticoncepción . 54 (2): 59–69. doi :10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an Kuhl H (agosto de 2005). "Farmacología de los estrógenos y progestágenos: influencia de diferentes vías de administración" (PDF) . Climaterio . 8 (Supl 1): 3–63. doi :10.1080/13697130500148875. PMID 16112947. S2CID 24616324. Archivado (PDF) del original el 22 de agosto de 2016 . Consultado el 6 de septiembre de 2018 .
- ^ abcd Korhonen T, Turpeinen M, Tolonen A, Laine K, Pelkonen O (mayo de 2008). "Identificación de las enzimas del citocromo P450 humano implicadas en la biotransformación in vitro de linestrenol y noretindrona". The Journal of Steroid Biochemistry and Molecular Biology . 110 (1–2): 56–66. doi :10.1016/j.jsbmb.2007.09.025. PMID 18356043. S2CID 10809537.
- ^ abcd Taitel HF, Kafrissen ME (1995). "Noretindrona: una revisión de aplicaciones terapéuticas". Revista internacional de estudios sobre fertilidad y menopausia . 40 (4): 207–23. PMID 8520623.
- ^ Alden KR, Lowdermilk DL, Cashion MC, Perry SE (2013). Atención de la salud de la mujer y la maternidad – Libro electrónico. Elsevier Health Sciences. pp. 135–. ISBN 978-0-323-29368-6Archivado desde el original el 9 de marzo de 2023 . Consultado el 8 de enero de 2018 .
- ^ ab Kuhl H (septiembre de 1990). "Farmacocinética de estrógenos y progestágenos". Maturitas . 12 (3): 171–97. doi :10.1016/0378-5122(90)90003-o. PMID 2170822.
- ^ "Aygestin (comprimidos de acetato de noretindrona, USP)" (PDF) . Archivado (PDF) del original el 10 de febrero de 2017 . Consultado el 11 de julio de 2024 .
- ^ abcdefg Jacobson BD (octubre de 1962). "Riesgos de la terapia con noretindrona durante el embarazo". Revista estadounidense de obstetricia y ginecología . 84 (7): 962–68. doi :10.1016/0002-9378(62)90075-3. PMID 14450719.
- ^ abcd Grupo de trabajo del IARC sobre la evaluación de los riesgos carcinógenos para los seres humanos, Organización Mundial de la Salud, Agencia Internacional para la Investigación sobre el Cáncer (2007). Anticonceptivos combinados de estrógeno y progestágeno y terapia combinada de estrógeno y progestágeno para la menopausia. Organización Mundial de la Salud. pp. 417–. ISBN 978-92-832-1291-1. Archivado desde el original el 10 de enero de 2023 . Consultado el 12 de octubre de 2016 .
La noretisterona y sus ésteres de acetato y enantato son progestágenos que tienen propiedades estrogénicas y androgénicas débiles.
- ^ abcd Djerassi C, Miramontes L, Rosenkranz G, Sondheimer F, Longo LD (enero de 2006). "Esteroides LIV. Síntesis de 19-nor-17alfa-etiniltestosterona y 19-nor-17alfa-metiltestosterona. 1954". Revista estadounidense de obstetricia y ginecología . 194 (1): 289; discusión 290. doi :10.1021/ja01645a010. PMID 16389045.
- ^ ab Shoupe D (2007). Manual de anticoncepción: una guía para el manejo práctico. Springer Science & Business Media. pp. 15–. ISBN 978-1-59745-150-5.
- ^ abcde Marks L (2010). Química sexual: una historia de la píldora anticonceptiva. Yale University Press. pp. 74, 76. ISBN 978-0-300-16791-7.
- ^ de William Andrew Publishing (2013). Enciclopedia de fabricación farmacéutica (3.ª ed.). Elsevier. págs. 2935–. ISBN 978-0-8155-1856-3.
- ^ Hatcher RA, Nelson AL (2007). Tecnología anticonceptiva. Ardent Media. pp. 195–. ISBN 978-1-59708-001-9Archivado desde el original el 10 de enero de 2023 . Consultado el 8 de enero de 2018 .
- ^ Gunasheela S (2011). Manejo práctico de problemas ginecológicos. JP Medical Ltd. págs. 31–. ISBN 978-93-5025-240-6Archivado desde el original el 9 de marzo de 2023 . Consultado el 8 de enero de 2018 .
- ^ Grimes DA, Lopez LM, O'Brien PA, Raymond EG (noviembre de 2013). "Píldoras de progestina sola para anticoncepción". Base de datos Cochrane de revisiones sistemáticas (11): CD007541. doi :10.1002/14651858.CD007541.pub3. PMID 24226383.
- ^ Hussain SF (febrero de 2004). "Píldoras de progestágeno solo y presión arterial alta: ¿existe una asociación? Una revisión de la literatura". Anticoncepción . 69 (2): 89–97. doi :10.1016/j.contraception.2003.09.002. PMID 14759612.
- ^ "Opill: prospecto/información de prescripción". Drugs.com . Consultado el 30 de septiembre de 2024 .
- ^ ab "Noretisterona". Archivado desde el original el 15 de septiembre de 2018 . Consultado el 8 de enero de 2018 .
- ^ "Disponibilidad de aygestin genérico". Archivado desde el original el 24 de agosto de 2018. Consultado el 8 de enero de 2018 .
- ^ "Los 300 mejores de 2022". ClinCalc . Archivado desde el original el 30 de agosto de 2024 . Consultado el 30 de agosto de 2024 .
- ^ "Estadísticas de uso del fármaco noretisterona, Estados Unidos, 2013-2022". ClinCalc . Consultado el 30 de agosto de 2024 .
- ^ Organización Mundial de la Salud (2023). Selección y uso de medicamentos esenciales 2023: anexo web A: Lista modelo de medicamentos esenciales de la Organización Mundial de la Salud: 23.ª lista . Ginebra: Organización Mundial de la Salud. hdl : 10665/371090 . OMS/MHP/HPS/EML/2023.02.
- ^ Kim JJ, Kurita T, Bulun SE (febrero de 2013). "Acción de la progesterona en el cáncer de endometrio, la endometriosis, los fibromas uterinos y el cáncer de mama". Endocrine Reviews . 34 (1): 130–62. doi :10.1210/er.2012-1043. PMC 3565104 . PMID 23303565.
- ^ "Noretisterona". Drugs.com .
- ^ abcdefgh «Drugs@FDA: Productos farmacéuticos aprobados por la FDA». Administración de Alimentos y Medicamentos de los Estados Unidos. Archivado desde el original el 16 de noviembre de 2016. Consultado el 27 de noviembre de 2016 .
- ^ abcdef Index Nominum 2000: Directorio internacional de medicamentos. Taylor y Francisco. Enero de 2000. págs. 749–. ISBN 978-3-88763-075-1. Error de cita: La referencia nombrada "IndexNominum2000" fue definida varias veces con contenido diferente (ver la página de ayuda ).
- ^ Grupo de trabajo del IARC sobre la evaluación de los riesgos carcinógenos para los seres humanos, Agencia Internacional para la Investigación sobre el Cáncer (1 de enero de 1999). Anticoncepción hormonal y terapia hormonal posmenopáusica (PDF) . IARC. pág. 65. ISBN 978-92-832-1272-0.
- ^ abcde Aronson JK (2009). Efectos secundarios de los fármacos endocrinos y metabólicos de Meyler. Elsevier. págs. 217, 253, 275 [217]. ISBN 978-0-08-093292-7.
- ^ Hägglund H, Remberger M, Klaesson S, Lönnqvist B, Ljungman P, Ringdén O (diciembre de 1998). "Tratamiento con noretisterona, un importante factor de riesgo de enfermedad venooclusiva en el hígado después de un trasplante alogénico de médula ósea". Blood . 92 (12): 4568–72. doi :10.1182/blood.V92.12.4568. PMID 9845522.
- ^ ab Cornia PB, Anawalt BD (noviembre de 2004). "Anticoncepción hormonal masculina". Opinión de expertos sobre fármacos emergentes . 9 (2): 335–44. doi :10.1517/14728214.9.2.335. PMID 15571489. S2CID 26886374.
- ^ ab Cornia PB, Anawalt BD (2005). "Anticonceptivos hormonales masculinos: un producto potencialmente patentable y rentable". Opinión de expertos sobre patentes terapéuticas . 15 (12): 1727–37. doi :10.1517/13543776.15.12.1727. ISSN 1354-3776. S2CID 83941717.
- ^ abc Kamischke A, Heuermann T, Krüger K, von Eckardstein S, Schellschmidt I, Rübig A, et al. (febrero de 2002). "Un anticonceptivo hormonal masculino eficaz que utiliza undecanoato de testosterona con preparaciones orales o inyectables de noretisterona". The Journal of Clinical Endocrinology and Metabolism . 87 (2): 530–39. doi : 10.1210/jcem.87.2.8218 . PMID 11836281.
- ^ ab Junkins-Hopkins JM (marzo de 2010). "Terapia hormonal para el acné". Revista de la Academia Estadounidense de Dermatología . 62 (3): 486–88. doi :10.1016/j.jaad.2009.12.002. PMID 20159314.
- ^ ab Arowojolu AO, Gallo MF, Lopez LM, Grimes DA (julio de 2012). Arowojolu AO (ed.). "Píldoras anticonceptivas orales combinadas para el tratamiento del acné". Base de datos Cochrane de revisiones sistemáticas (7): CD004425. doi :10.1002/14651858.CD004425.pub6. PMC 11437354. PMID 22786490 .
- ^ van Vloten WA, Sigurdsson V (2004). "Selección de un agente anticonceptivo oral para el tratamiento del acné en mujeres". American Journal of Clinical Dermatology . 5 (6): 435–41. doi :10.2165/00128071-200405060-00008. PMID 15663340. S2CID 9947402.
- ^ ab Pochi PE, Strauss JS (diciembre de 1965). "Falta de efecto androgénico en las glándulas sebáceas humanas con noretindrona en dosis bajas". American Journal of Obstetrics and Gynecology . 93 (7): 1002–04. doi :10.1016/0002-9378(65)90162-6. PMID 5843402.
- ^ abcd Kuhnz W, Heuner A, Hümpel M, Seifert W, Michaelis K (diciembre de 1997). "Conversión in vivo de noretisterona y acetato de noretisterona a etinilestradiol en mujeres posmenopáusicas". Anticoncepción . 56 (6): 379–85. doi :10.1016/s0010-7824(97)00174-1. PMID 9494772.
- ^ ab Curwen S (1962). "Virilización con noretisterona". BMJ . 1 (5289): 1415. doi :10.1136/bmj.1.5289.1415-a. ISSN 0959-8138. PMC 1958463 .
- ^ abcd Roxburgh DR, West MJ (agosto de 1973). "El uso de noretisterona para suprimir la menstruación en mujeres con retraso mental grave". The Medical Journal of Australia . 2 (7): 310–13. doi :10.5694/j.1326-5377.1973.tb128175.x. PMID 4746398. S2CID 204094551. Archivado desde el original el 20 de diciembre de 2016 . Consultado el 6 de diciembre de 2016 .
- ^ abc Roxburgh DR, West MJ (agosto de 1973). "El uso de noretisterona para suprimir la menstruación en mujeres con retraso mental grave". The Medical Journal of Australia . 2 (7): 310–13. doi :10.1097/00006254-197408000-00021. PMID 4746398.
- ^ Board JA (abril de 1965). "Evaluación clínica del uso de anticonceptivos orales de noretindrona 5 mg más mestranol 0,075 mg". Revista de la Asociación Médica Canadiense . 92 (15): 814–17. PMC 1927985 . PMID 14272499.
- ^ Kaser DJ, Missmer SA, Berry KF, Laufer MR (abril de 2012). "Uso de acetato de noretindrona solo para la supresión posoperatoria de los síntomas de la endometriosis". Revista de ginecología pediátrica y adolescente . 25 (2): 105–08. doi :10.1016/j.jpag.2011.09.013. PMID 22154396.
- ^ ab Paulsen CA, Leach RB, Lanman J, Goldston N, Maddock WO, Heller CG (octubre de 1962). "Estrogenicidad inherente de la noretindrona y el noretinodrel: comparación con otras progestinas sintéticas y progesterona". The Journal of Clinical Endocrinology and Metabolism . 22 (10): 1033–39. doi :10.1210/jcem-22-10-1033. PMID 13942007.
- ^ ab Chu MC, Zhang X, Gentzschein E, Stanczyk FZ, Lobo RA (junio de 2007). "Formación de etinilestradiol en mujeres durante el tratamiento con acetato de noretindrona". La Revista de Endocrinología Clínica y Metabolismo . 92 (6): 2205–07. doi : 10.1210/jc.2007-0044 . PMID 17341557.
- ^ Connolly A, Britton AG (2017). Salud de la mujer en atención primaria. Cambridge University Press. pp. 153–. ISBN 978-1-108-16595-2.
- ^ ab Farris M, Bastianelli C, Rosato E, Brosens I, Benagiano G (octubre de 2017). "Farmacodinámica de los anticonceptivos orales combinados de estrógeno y progestina: 2. Efectos sobre la hemostasia". Revisión experta de farmacología clínica . 10 (10): 1129–44. doi :10.1080/17512433.2017.1356718. PMID 28712325. S2CID 205931204.
- ^ abcde Kuhl H (2011). "Farmacología de los progestágenos" (PDF) . J Reproduktionsmed Endokrinol . 8 (1): 157–77. Archivado (PDF) desde el original el 11 de octubre de 2016. Consultado el 10 de octubre de 2016 .
- ^ Chu YH, Li QA, Zhao ZF, Zhou YP, Cao DC (junio de 1985). "[Acción antiprogestacional de la 5 alfa-dihidronoretisterona]". Zhongguo Yao Li Xue Bao = Acta Pharmacologica Sinica (en chino). 6 (2): 125–29. PMID 2934946.
- ^ McCuistion LE, Kee JL, Hayes ER (2014). Farmacología: un enfoque de proceso de enfermería centrado en el paciente. Elsevier Health Sciences. pp. 846–. ISBN 978-0-323-29348-8.
- ^ Greenblatt RB (julio de 1956). "La actividad progestacional de la 17-alfa-etinil-19-nortestosterona". Revista de endocrinología clínica y metabolismo . 16 (7): 869–75. doi :10.1210/jcem-16-7-869. PMID 13332050.
- ^ Fragkaki AG, Angelis YS, Koupparis M, Tsantili-Kakoulidou A, Kokotos G, Georgakopoulos C (febrero de 2009). "Características estructurales de los esteroides anabólicos androgénicos que contribuyen a la unión al receptor de andrógenos y a sus actividades anabólicas y androgénicas. Modificaciones aplicadas en la estructura esteroidal". Esteroides . 74 (2): 172–97. doi :10.1016/j.steroids.2008.10.016. PMID 19028512. S2CID 41356223.
Muchos esteroides sintéticos con alta actividad miotrófica presentan disociación miotrófica-androgénica, ya que, debido a los cambios introducidos en la estructura del anillo A, probablemente no serán sustratos para las 5α-reductasas [85]. La 5α-reducción no siempre amplifica la potencia androgénica a pesar de la alta concentración de andrógenos en el AR. Este es el caso de la noretisterona (Fig. 1, 34), un derivado sintético de la testosterona 19-nor-17α-etinil, que también sufre una 5α-reducción mediada por enzimas y ejerce potentes efectos androgénicos en los órganos diana. La noretisterona 5α-reducida muestra una mayor unión al AR, pero muestra una potencia androgénica significativamente menor que la noretisterona inalterada [102, 103].
- ^ abc Lemus AE, Enríquez J, García GA, Grillasca I, Pérez-Palacios G (enero de 1997). "La reducción de 5alfa de noretisterona mejora su afinidad de unión por los receptores de andrógenos pero disminuye su potencia androgénica". La Revista de Bioquímica de Esteroides y Biología Molecular . 60 (1–2): 121–29. doi :10.1016/s0960-0760(96)00172-0. PMID 9182866. S2CID 33771349.
- ^ Filshie M, Guillebaud J (2013). Anticoncepción: ciencia y práctica. Elsevier Science. pp. 26–. ISBN 978-1-4831-6366-6
La noretisterona se une a la SHBG con menos afinidad que los andrógenos y estrógenos endógenos [...
] - ^ Azziz R (2007). Trastornos por exceso de andrógenos en mujeres. Springer Science & Business Media. pp. 124–. ISBN 978-1-59745-179-6.
- ^ Kuiper GG, Carlsson B, Grandien K, Enmark E, Häggblad J, Nilsson S, et al. (marzo de 1997). "Comparación de la especificidad de unión del ligando y la distribución tisular de la transcripción de los receptores de estrógeno alfa y beta". Endocrinología . 138 (3): 863–70. doi : 10.1210/endo.138.3.4979 . PMID 9048584.
- ^ Wiegratz I, Kuhl H (septiembre de 2006). "Efectos metabólicos y clínicos de los progestágenos". Revista Europea de Contracepción y Salud Reproductiva . 11 (3): 153–61. doi :10.1080/13625180600772741. PMID 17056444. S2CID 27088428.
- ^ ab Giatti S, Melcangi RC, Pesaresi M (agosto de 2016). "El otro lado de las progestinas: efectos en el cerebro". Journal of Molecular Endocrinology . 57 (2): R109–26. doi : 10.1530/JME-16-0061 . PMID 27339142.
- ^ abc Yamamoto T, Tamura T, Kitawaki J, Osawa Y, Okada H (junio de 1994). "Inactivación suicida de la aromatasa en placenta humana y leiomioma uterino por 5 alfa-dihidronoretindrona, un metabolito de la noretindrona, y su efecto sobre las enzimas productoras de esteroides". Revista europea de endocrinología . 130 (6): 634–40. doi :10.1530/eje.0.1300634. PMID 8205267.
- ^ Perusquía M, Villalón CM, Navarrete E, García GA, Pérez-Palacios G, Lemus AE (agosto de 2003). "Efecto vasodilatador de la noretisterona y sus 5 metabolitos alfa: una nueva acción no genómica". Revista europea de farmacología . 475 (1–3): 161–69. doi :10.1016/s0014-2999(03)02106-x. PMID 12954372.
- ^ ab Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H, et al. (octubre de 2013). "Posible función de PGRMC1 en el desarrollo del cáncer de mama". Climaterio . 16 (5): 509–13. doi :10.3109/13697137.2013.800038. PMID 23758160. S2CID 29808177.
{{cite journal}}: CS1 maint: overridden setting (link) - ^ Trabert B, Sherman ME, Kannan N, Stanczyk FZ (abril de 2020). "Progesterona y cáncer de mama". Endocrine Reviews . 41 (2): 320–44. doi : 10.1210/endrev/bnz001 . PMC 7156851 . PMID 31512725.
- ^ Anderson RA, Baird DT (diciembre de 2002). «Male contraception» (PDF) . Endocrine Reviews . 23 (6): 735–62. doi : 10.1210/er.2002-0002 . PMID 12466187. Archivado (PDF) del original el 28 de agosto de 2021 . Consultado el 11 de diciembre de 2019 .
- ^ ab Kamischke A, Nieschlag E (enero de 2004). "Progreso hacia la anticoncepción hormonal masculina". Tendencias en ciencias farmacológicas . 25 (1): 49–57. doi :10.1016/j.tips.2003.11.009. PMID 14723979.
- ^ Rudel HW (septiembre de 1968). "Farmacología de los anticonceptivos orales". Obstetricia y ginecología clínica . 11 (3): 632–44. doi :10.1097/00003081-196811030-00002. PMID 4878826.
- ^ Stanczyk FZ (noviembre de 2003). "No todas las progestinas son iguales". Esteroides . 68 (10–13): 879–90. doi :10.1016/j.steroids.2003.08.003. PMID 14667980. S2CID 44601264.
- ^ Endrikat J, Gerlinger C, Richard S, Rosenbaum P, Düsterberg B (diciembre de 2011). "Dosis de progestinas para la inhibición de la ovulación: una revisión sistemática de la literatura disponible y de las preparaciones comercializadas en todo el mundo". Anticoncepción . 84 (6): 549–57. doi :10.1016/j.contraception.2011.04.009. PMID 22078182.
- ^ Shoupe D (1993). "Anticonceptivos inyectables y anillos vaginales anticonceptivos". Anticoncepción . Perspectivas clínicas en obstetricia y ginecología. Springer. págs. 144–57. doi :10.1007/978-1-4612-2730-4_13. ISBN 978-1-4612-7645-6. ISSN 0178-0328.
- ^ Weiner E, Johansson ED (abril de 1975). "Niveles plasmáticos de noretindrona después de una inyección intramuscular de 200 mg de enantato de noretindrona". Anticoncepción . 11 (4): 419–25. doi :10.1016/0010-7824(75)90004-9. PMID 1122756.
- ^ Fotherby K, Howard G, Shrimanker K, Elder M, Bye PG (diciembre de 1977). "Efecto del enantato de noretisterona en los niveles séricos de gonadotropina". Anticoncepción . 16 (6): 591–604. doi :10.1016/0010-7824(77)90060-9. PMID 606499.
- ^ Goebelsmann U, Stanczyk FZ, Brenner PF, Goebelsmann AE, Gentzschein EK, Mishell DR (marzo de 1979). "Concentraciones séricas de noretindrona (NET) tras la inyección intramuscular de enantato de NET. Efecto sobre la LH sérica, la FSH, el estradiol y la progesterona". Anticoncepción . 19 (3): 283–313. doi :10.1016/0010-7824(79)90022-2. PMID 572279.
- ^ ab Neumann F, Diallo FA, Hasan SH, Schenck B, Traore I (1976). "La influencia de los compuestos farmacéuticos en la fertilidad masculina". Andrologia . 8 (3): 203–35. doi : 10.1111/j.1439-0272.1976.tb02137.x . PMID 793446. S2CID 24859886.
- ^ Heller CG, Laidlaw WM, Harvey HT, Nelson WO (julio de 1958). "Efectos de los compuestos progestacionales en los procesos reproductivos del varón humano". Anales de la Academia de Ciencias de Nueva York . 71 (5): 649–65. doi :10.1111/j.1749-6632.1958.tb54641.x. PMID 13583821. S2CID 32637425.
- ^ Heller CG, Moore DJ, Paulsen CA, Nelson WO, Laidlaw WM (diciembre de 1959). «Efectos de la progesterona y las progestinas sintéticas en la fisiología reproductiva de los hombres normales». Actas de la Federación . 18 : 1057–65. PMID 14400846. Archivado desde el original el 18 de diciembre de 2018. Consultado el 11 de diciembre de 2019 .
- ^ Paulsen CA (marzo de 1965). "Metabolismo de la progestina: referencia especial a las vías estrogénicas". Metabolismo . 14 (3): SUPPL:313–19. doi :10.1016/0026-0495(65)90018-1. PMID 14261416.
- ^ Moudgal NR, Suresh R (1995). "Algunas reflexiones sobre el desarrollo de anticonceptivos masculinos de base química" (PDF) . Current Science (Bangalore) . 68 (4): 470–74. ISSN 0011-3891. Archivado desde el original (PDF) el 11 de diciembre de 2019. Consultado el 11 de diciembre de 2019 .
- ^ Johonsson ED, Nygren KG (1973). "Depresión de los niveles plasmáticos de testosterona en hombres con noretindrona". Anticoncepción . 8 (3): 219–26. doi :10.1016/0010-7824(73)90032-2. ISSN 0010-7824.
- ^ Zitzmann M, Rohayem J, Raidt J, Kliesch S, Kumar N, Sitruk-Ware R, et al. (mayo de 2017). "Impacto de varias progestinas con o sin testosterona transdérmica en los niveles de gonadotropina para la anticoncepción hormonal masculina no invasiva: un ensayo clínico aleatorizado". Andrology . 5 (3): 516–26. doi : 10.1111/andr.12328 . PMID 28189123. S2CID 41502711.
- ^ abcd Álvarez BD (11 de mayo de 2011). Efecto de una Dosis de 50 mg de Enantato de Noretisterona y 5 mg de Valerato de Estradiol en los Niveles de Testosterona Total en Hombres Mexicanos Sanos Hombres Mexicanos Saludables ] (Maestría). Instituto Politécnico Nacional de México. Archivado desde el original el 16 de septiembre de 2022 . Consultado el 12 de septiembre de 2022 .
- ^ Amory JK (2003). "Andrógenos y anticoncepción masculina". Andrógenos en la salud y la enfermedad . Endocrinología contemporánea. Humana Press. págs. 405-17. doi :10.1007/978-1-59259-388-0_21. ISBN 978-1-61737-314-5.
- ^ Kamischke A, Diebäcker J, Nieschlag E (septiembre de 2000). "Potencial del enantato de noretisterona para la anticoncepción masculina: farmacocinética y supresión de la función pituitaria y gonadal". Endocrinología clínica . 53 (3): 351–58. doi :10.1046/j.1365-2265.2000.01097.x. PMID 10971453. S2CID 70515136.
- ^ Petry R, Mauss J, Senge T, Rausch-Stroomann JG (1970). "Influencia del acetato de ciproterona, enantato de noretisterona y capronato de gestonorona en el eje hipofisario-gónadal en el hombre". Über den Einfluß von Cyproteronacetat, Noretisteronönanthat und Gestonoroncapronat auf die Hypophysen-Gonadenachse beim Mann [ Influencia del acetato de ciproterona, enantato de noretisterona y capronato de gestonorona en el eje hipofisario-gónadal en el hombre ]. Simposio der Deutschen Gesellschaft für Endokrinologie en Ulm del 26 al 28 de febrero de 1970. Springer. págs. 428–30. doi :10.1007/978-3-642-80591-2_118. ISBN 9783642805912.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ ab Die Gestagene. Springer-Verlag. 2013, págs. 13–14, 283–84. ISBN 978-3-642-99941-3Archivado desde el original el 10 de enero de 2023 . Consultado el 19 de septiembre de 2018 .
- ^ Saperstein S, Edgren RA, Jung D, Mroszczak EJ, Lee GJ, Dorr A, et al. (Diciembre de 1989). "Farmacocinética de la noretindrona: efecto del tamaño de partícula". Anticoncepción . 40 (6): 731–40. doi :10.1016/0010-7824(89)90075-9. PMID 2620531.
- ^ Friedrich C, Berse M, Klein S, Rohde B, Höchel J (junio de 2018). "Formación in vivo de etinilestradiol después de la administración intramuscular de enantato de noretisterona". Revista de farmacología clínica . 58 (6): 781–89. doi :10.1002/jcph.1079. PMID 29522253. S2CID 3813229.
- ^ Thijssen JH (1972). "Metabolismo de compuestos progestacionales sintéticos activos por vía oral". En Tausk M (ed.). Farmacología del sistema endocrino y fármacos relacionados: progesterona, fármacos progestacionales y agentes antifertilidad. Vol. II. Pergamon Press. págs. 217–73. ISBN 978-0080168128.OCLC 278011135 .
- ^ Okada H (2010). "Receptores y mecanismo de acción de los progestágenos sintéticos". Revista de obstetricia y ginecología de Asia y Oceanía . 7 (1): 15–27. doi :10.1111/j.1447-0756.1981.tb00511.x. ISSN 0389-2328.
- ^ Briggs MH (1980). "Farmacodinámica y farmacocinética comparativas de esteroides anticonceptivos en animales y en el hombre: una revisión selectiva". Farmacología clínica y terapéutica . Palgrave Macmillan, Reino Unido. págs. 493–518. doi :10.1007/978-1-349-05952-2_57. ISBN . 978-1-349-05954-6.
- ^ Thomas JA, Keenan EJ (1986). "Progestinas y anticonceptivos orales". Principios de farmacología endocrina . Springer. págs. 167–96. doi :10.1007/978-1-4684-5036-1_8. ISBN 978-1-4684-5036-1.
- ^ Orme ML, Back DJ, Breckenridge AM (1983). "Farmacocinética clínica de los esteroides anticonceptivos orales". Farmacocinética clínica . 8 (2): 95–136. doi :10.2165/00003088-198308020-00001. PMID 6342899. S2CID 43298472.
- ^ Fotherby K (1974). "Metabolismo de esteroides sintéticos por animales y humanos". Acta Endocrinologica. Suplemento . 185 : 119–47. doi :10.1530/acta.0.075s119. PMID 4206183.
- ^ Kuhl H, Wiegratz I (agosto de 2007). "¿Pueden los derivados de la 19-nortestosterona aromatizarse en el hígado de adultos humanos? ¿Existen implicaciones clínicas?". Climaterio . 10 (4): 344–53. doi :10.1080/13697130701380434. PMID 17653961. S2CID 20759583.
- ^ Stanczyk FZ, Roy S (julio de 1990). "Metabolismo del levonorgestrel, la noretindrona y esteroides anticonceptivos estructuralmente relacionados". Anticoncepción . 42 (1): 67–96. doi :10.1016/0010-7824(90)90093-B. PMID 2143719.
- ^ ab Schoonen WG, Deckers GH, de Gooijer ME, de Ries R, Kloosterboer HJ (noviembre de 2000). "Propiedades hormonales de la noretisterona, 7alfa-metil-noretisterona y sus derivados". The Journal of Steroid Biochemistry and Molecular Biology . 74 (4): 213–22. doi :10.1016/s0960-0760(00)00125-4. PMID 11162927. S2CID 19797254.
[...] Se han detectado varios metabolitos mono- y disulfatados, así como mono- y diglucuronidados de NET en la orina de mujeres tratadas con NET [16,17]. En forma no conjugada, estos metabolitos de NET (o MeNET) están representados por NET 5α- y 5β-reducido (5α-NET o 5β-NET) y por 5α-NET y 5β-NET 3α- y 3β-hidrogenados, dando lugar a 3α,5α-NET, 3β,5α-NET, 3α,5β-NET y 3β,5β-NET o sus correspondientes metabolitos MeNET (Figs. 1 y 2). Estas conversiones de esteroides de NET o MeNET pueden tener lugar en el hígado, pero también en la hipófisis, el endometrio, la próstata, la vagina y la mama. Las enzimas implicadas en estos procesos metabólicos son la 5α- y la 5β-reductasa, así como la 3α- y la 3β-hidroxiesteroide deshidrogenasa (HSD).
- ^ Chávez BA, Vilchis F, Pérez AE, García GA, Grillasca I, Pérez-Palacios G (enero de 1985). "Estereoespecificidad de la unión intracelular de noretisterona y sus metabolitos reducidos en el anillo A". Revista de bioquímica de esteroides . 22 (1): 121–26. doi : 10.1016/0022-4731(85)90151-7 . PMID 3871879.
- ^ Garza-Flores J, Vilchis F, García GA, Menjívar M, Pérez-Palacios G (junio de 1986). "La reducción del anillo A mejora la potencia antigonadotrópica de la noretisterona". Acta Endocrinológica . 112 (2): 278–83. doi :10.1530/acta.0.1120278. PMID 3090814.
- ^ Lemus AE, Enríquez J, Hernández A, Santillán R, Pérez-Palacios G (febrero de 2009). "Bioconversión de noretisterona, un agonista del receptor de progesterona en agonistas del receptor de estrógeno en células osteoblásticas". La Revista de Endocrinología . 200 (2): 199–206. doi : 10.1677/JOE-08-0166 . PMID 19008332.
- ^ Scarsi KK, Darin KM, Chappell CA, Nitz SM, Lamorde M (noviembre de 2016). "Interacciones fármaco-fármaco, eficacia y seguridad de los anticonceptivos hormonales en mujeres que viven con VIH". Seguridad de los medicamentos . 39 (11): 1053–72. doi :10.1007/s40264-016-0452-7. PMC 5048570 . PMID 27562873.
- ^ DeGroot LJ (2001). Endocrinología. WB Saunders Co. pág. 2617.ISBN 978-0-7216-7843-6.
- ^ abcde Elks J (2014). Diccionario de fármacos: datos químicos: datos químicos, estructuras y bibliografías. Springer. págs. 886–. ISBN 978-1-4757-2085-3Archivado desde el original el 10 de enero de 2023 . Consultado el 5 de octubre de 2016 .
- ^ Chwalisz K, Surrey E, Stanczyk FZ (junio de 2012). "El perfil hormonal del acetato de noretindrona: fundamentos para la terapia complementaria con agonistas de la hormona liberadora de gonadotropina en mujeres con endometriosis". Ciencias reproductivas . 19 (6): 563–71. doi :10.1177/1933719112438061. PMID 22457429. S2CID 2882899.
- ^ Shoupe D, Haseltine FP (2012). Anticoncepción. Springer Science & Business Media. pp. 112–. ISBN 978-1-4612-2730-4.
- ^ Ryan KJ (1999). Ginecología y salud de la mujer de Kistner. Mosby. pág. 292. ISBN 978-0-323-00201-1.
- ^ Hammerstein J (diciembre de 1990). "Profármacos: ¿ventaja o desventaja?". American Journal of Obstetrics and Gynecology . 163 (6 Pt 2): 2198–203. doi :10.1016/0002-9378(90)90561-K. PMID 2256526.
- ^ Edelman AB, Cherala G, Stanczyk FZ (octubre de 2010). "Metabolismo y farmacocinética de los esteroides anticonceptivos en mujeres obesas: una revisión". Anticoncepción . 82 (4): 314–23. doi :10.1016/j.contraception.2010.04.016. PMID 20851224.
- ^ Raynaud JP, Ojasoo T (noviembre de 1986). "El diseño y uso de antagonistas de esteroides sexuales". Journal of Steroid Biochemistry . 25 (5B): 811–33. doi :10.1016/0022-4731(86)90313-4. PMID 3543501.
Un potencial androgénico similar es inherente a la noretisterona y sus profármacos (acetato de noretisterona, diacetato de etinodiol, linestrenol, noretinodrel, quingestanol [acetato]).
- ^ de Frank B. Colton, patente estadounidense 2.655.518 (1952 de Searle & Co).
- ^ Ringold HJ, Rosenkranz G, Sondheimer F (1956). "Esteroides. LXXX.11-Metil-19-nortestosterona y 1-Metil-17α-etinil-19-nortestosterona". Revista de la Sociedad Química Americana . 78 (11): 2477–79. doi :10.1021/ja01592a037.
- ^ Ueberwasser H, Heusler K, Kalvoda J, Meystre C, Wieland P, Anner G, et al. (1963). "19-Norsteroide II. Ein einfaches Herstellungsverfahren für 19-Norandrostan-Derivate. über Steroide, 193. Mitteilung". Helvetica Chimica Acta . 46 : 344–52. doi :10.1002/hlca.19630460135.
- ^ Onken D, Heublein D (enero de 1970). "[Esteroides etinilados]". Die Pharmazie . 25 (1): 3–9. PMID 4914401.
- ^ Patente estadounidense 2.744.122
- ^ Patente estadounidense 2.774.777
- ^ Bullough VL (2001). Enciclopedia de control de la natalidad. ABC-CLIO. pp. 145–. ISBN 978-1-57607-181-6Archivado desde el original el 10 de enero de 2023 . Consultado el 27 de noviembre de 2016 .
- ^ Moskowitz EH, Jennings B (1996). ¿Anticoncepción forzada?: desafíos morales y políticos de la anticoncepción de acción prolongada. Georgetown University Press. pp. 40–. ISBN 978-1-58901-807-5.
- ^ Nieschlag E (noviembre de 2010). «Ensayos clínicos sobre anticoncepción hormonal masculina» (PDF) . Anticoncepción . 82 (5): 457–70. doi :10.1016/j.contraception.2010.03.020. PMID 20933120. Archivado (PDF) del original el 5 de diciembre de 2020. Consultado el 28 de diciembre de 2018 .
- ^ Nieschlag E, Behre HM, Nieschlag E, Behre HM, Nieschlag S (2012). Nieschlag E, Behre HM, Nieschlag S (eds.). "El papel esencial de la testosterona en la anticoncepción hormonal masculina". Testosterona : 470–93. doi :10.1017/CBO9781139003353.023. ISBN 9781139003353.
- ^ Benagiano G, Primiero FM (junio de 1983). "Anticonceptivos de acción prolongada. Estado actual". Drugs . 25 (6): 570–609. doi :10.2165/00003495-198325060-00003. PMID 6223801. S2CID 45898359.
Lectura adicional
- Brogden RN, Speight TM, Avery GS (1973). "Anticonceptivos orales que contienen solo progestágeno: un informe preliminar de la acción y el uso clínico del norgestrel y la noretisterona". Drugs . 6 (3): 169–81. doi :10.2165/00003495-197306030-00004. PMID 4130566. S2CID 42295736.
- "Noretisterona y acetato de noretisterona". Monografías del IARC sobre la evaluación del riesgo carcinogénico de las sustancias químicas para los seres humanos . 21 : 441–60. Diciembre de 1979. PMID 120838.
- Stanczyk FZ, Roy S (julio de 1990). "Metabolismo del levonorgestrel, la noretindrona y esteroides anticonceptivos estructuralmente relacionados". Anticoncepción . 42 (1): 67–96. doi :10.1016/0010-7824(90)90093-b. PMID 2143719.
- Wiseman LR, McTavish D (marzo de 1994). "Estradiol/noretisterona transdérmico. Una revisión de sus propiedades farmacológicas y uso clínico en mujeres posmenopáusicas". Drugs & Aging . 4 (3): 238–56. doi :10.2165/00002512-199404030-00006. PMID 8199397. S2CID 68007924.
- Taitel HF, Kafrissen ME (1995). "Noretindrona: una revisión de aplicaciones terapéuticas". Revista internacional de estudios sobre fertilidad y menopausia . 40 (4): 207–23. PMID 8520623.
- Maier WE, Herman JR (agosto de 2001). "Farmacología y toxicología del etinilestradiol y el acetato de noretindrona en animales de experimentación". Toxicología y farmacología regulatorias . 34 (1): 53–61. doi :10.1006/rtph.2001.1483. PMID 11502156.
- Riis BJ, Lehmann HJ, Christiansen C (octubre de 2002). "Acetato de noretisterona en combinación con estrógeno: efectos sobre el esqueleto y otros órganos. Una revisión". Revista estadounidense de obstetricia y ginecología . 187 (4): 1101–16. doi :10.1067/mob.2002.122852. PMID 12389012.
- Draper BH, Morroni C, Hoffman M, Smit J, Beksinska M, Hapgood J, et al. (julio de 2006). "Medroxiprogesterona de depósito versus enantato de noretisterona para la anticoncepción progestogénica de acción prolongada". Base de Datos Cochrane de Revisiones Sistemáticas . 2012 (3): CD005214. doi :10.1002/14651858.CD005214.pub2. PMC 11491191. PMID 16856087 .
- Kuhl H, Wiegratz I (agosto de 2007). "¿Pueden los derivados de la 19-nortestosterona aromatizarse en el hígado de adultos humanos? ¿Existen implicaciones clínicas?". Climaterio . 10 (4): 344–53. doi :10.1080/13697130701380434. PMID 17653961. S2CID 20759583.
- Casey CL, Murray CA (2008). "Actualización de la terapia de combinación con acetato de noretindrona y estradiol: un punto de atención". Intervenciones clínicas en el envejecimiento . 3 (1): 9–16. doi : 10.2147/cia.s1663 . PMC 2544373 . PMID 18488874.
- Paulen ME, Curtis KM (octubre de 2009). "¿Cuándo puede una mujer recibir inyecciones repetidas de progestágeno solo: acetato de medroxiprogesterona de depósito o enantato de noretisterona?". Anticoncepción . 80 (4): 391–408. doi :10.1016/j.contraception.2009.03.023. PMID 19751863.
- Chwalisz K, Surrey E, Stanczyk FZ (junio de 2012). "El perfil hormonal del acetato de noretindrona: fundamentos para la terapia complementaria con agonistas de la hormona liberadora de gonadotropina en mujeres con endometriosis". Ciencias reproductivas . 19 (6): 563–71. doi :10.1177/1933719112438061. PMID 22457429. S2CID 2882899.

![Niveles de noretisterona y etinilestradiol durante 24 horas después de una dosis oral única de 10 mg de acetato de noretisterona en mujeres posmenopáusicas.[47]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e5/Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_oral_dose_of_10_mg_norethisterone_acetate_in_postmenopausal_women.png)
![Niveles de noretisterona y etinilestradiol durante 8 semanas después de una única inyección intramuscular de 200 mg de enantato de noretisterona en mujeres premenopáusicas.[94]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/df/Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png/450px-Norethisterone_and_ethinylestradiol_levels_after_a_single_intramuscular_injection_of_200_mg_norethisterone_enanthate_in_premenopausal_women.png)

