CYP17A1
| Esteroide 17-alfa-hidroxilasa/17,20 liasa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| N.º CE | 1.14.14.19 | ||||||||
| N.º CAS | 9029-67-8 | ||||||||
| Nombres alternativos | P450c17, CYP17A1, esteroide 17-alfa-hidroxilasa/17,20 liasa, CYPXVII, citocromo P450 17A1, citocromo p450 XVIIA1, citocromo P450-C17, citocromo P450, familia 17, subfamilia A, polipéptido 1, esteroide 17-alfa-monooxigenasa, citocromo P450c17, 4.1.2.30, 17-alfa-hidroxiprogesterona aldolasa, citocromo P450, subfamilia XVII (esteroide 17-alfa-hidroxilasa), esteroide 17 alfa-hidroxilasa/17,20 liasa, IPR033282 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| |||||||||
| CYP17A1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | CYP17A1 , CPT7, CYP17, P450C17, S17AH, miembro 1 de la subfamilia A de la familia 17 del citocromo P450 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 609300; MGI : 88586; HomoloGene : 73875; Tarjetas genéticas : CYP17A1; OMA :CYP17A1 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CE | 1.14.14.32 1.14.14.19, 1.14.14.32 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
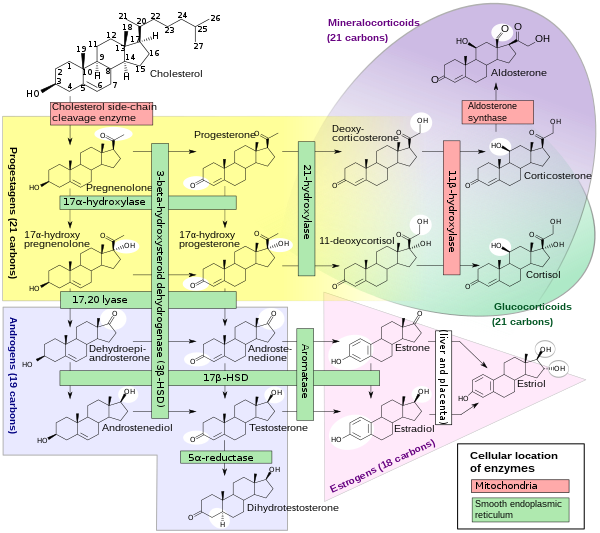
El citocromo P450 17A1 ( esteroide 17α-monooxigenasa , 17α-hidroxilasa , 17-alfa-hidroxilasa , 17,20-liasa , 17,20-desmolasa ) es una enzima del tipo hidroxilasa que en los humanos está codificada por el gen CYP17A1 en el cromosoma 10. [5] Se expresa de forma ubicua en muchos tejidos y tipos de células, incluida la zona reticular y la zona fasciculada (pero no la zona glomerulosa ) de la corteza suprarrenal , así como en los tejidos gonadales . [6] [7] Tiene actividades tanto de 17α-hidroxilasa como de 17,20-liasa, y es una enzima clave en la vía esteroidogénica que produce progestinas , mineralocorticoides , glucocorticoides , andrógenos y estrógenos . Más específicamente, la enzima actúa sobre la pregnenolona y la progesterona para agregar un grupo hidroxilo (-OH) en la posición de carbono 17 (C17) del anillo D del esteroide (actividad 17α-hidroxilasa, EC 1.14.14.19), o actúa sobre la 17α-hidroxiprogesterona y la 17α-hidroxipregnenolona para separar la cadena lateral del núcleo esteroide (actividad 17,20- liasa , EC 1.14.14.32). [7]
Estructura
Gene
El gen CYP17A1 reside en el cromosoma 10 en la banda 10q24.3 y contiene 8 exones . [5] El ADNc de este gen abarca una longitud de 1527 pb . [8] Este gen codifica un miembro de la superfamilia de enzimas del citocromo P450 . Las proteínas del citocromo P450 generalmente se consideran monooxigenasas que catalizan muchas reacciones involucradas en el metabolismo de fármacos y la síntesis de colesterol , esteroides y otros lípidos , incluida la notable escisión del enlace carbono-carbono catalizada por esta enzima.
El gen CYP17A1 también puede contener variantes asociadas con un mayor riesgo de enfermedad de la arteria coronaria . [9] [ se necesita una fuente no primaria ]
Proteína
CYP17A1 es una proteína de 57,4 kDa que pertenece a la familia del citocromo P450. [10] [11] La proteína codificada por su ADNc está compuesta por 508 residuos de aminoácidos . Como enzima, CYP17A1 posee un sitio activo que se asocia con un grupo prostético hemo para catalizar reacciones biosintéticas. [8] Con base en sus estructuras conocidas mientras está unida a dos inhibidores esteroides , abiraterona y galeterona , CYP17A1 posee el pliegue canónico del citocromo P450 presente en otras enzimas P450 complejas que participan en la esteroidogénesis o el metabolismo del colesterol , aunque orienta los ligandos esteroides hacia las hélices F y G, perpendiculares al grupo hemo, en lugar de la lámina β1. [12] [13]
Expresión
La expresión de CYP17A1 se ha encontrado en todos los tejidos esteroidogénicos tradicionales excepto la placenta , incluyendo la zona reticularis y la zona fasciculada de la corteza suprarrenal , las células de Leydig de los testículos , las células tecales de los ovarios y, más recientemente, en las células de la granulosa luteinizadas en los folículos ováricos . [14] Además del tejido esteroidogénico clásico, CYP17A1 también se ha detectado en el corazón , el riñón y el tejido adiposo . [14] En el feto , CYP17A1 se ha informado en el riñón, el timo y el bazo . [14]
Función
CYP17A1 es un miembro de la superfamilia de enzimas del citocromo P450 localizadas en el retículo endoplasmático . Las proteínas de esta familia son monooxigenasas que catalizan la síntesis de colesterol , esteroides y otros lípidos y están involucradas en el metabolismo de fármacos. [5] CYP17A1 tiene actividad de 17α-hidroxilasa ( EC 1.14.14.19) y actividad de 17,20-liasa ( EC 1.14.14.32). La actividad de 17α-hidroxilasa de CYP17A1 es necesaria para la generación de glucocorticoides como el cortisol, pero tanto la actividad de hidroxilasa como la de 17,20-liasa de CYP17A1 son necesarias para la producción de esteroides sexuales androgénicos y estrogénicos al convertir 17α-hidroxipregnenolona en deshidroepiandrosterona (DHEA) . [15] Las mutaciones en este gen están asociadas con deficiencia aislada de esteroide-17α-hidroxilasa, deficiencia de 17α-hidroxilasa/17,20-liasa, pseudohermafroditismo e hiperplasia suprarrenal . [5]
Además, la actividad de la 17,20-liasa depende de la citocromo P450 oxidorreductasa (POR), el citocromo b5 (CYB5) y la fosforilación . [16] [17] [18] El citocromo b5 actúa como un facilitador de la actividad de la 17,20-liasa de CYP17A1 y puede donar un segundo electrón a algunos P450. En los seres humanos, la producción de testosterona a través de pregnenolona a 17-OHPreg y DHEA por el CYP17A1 requiere POR. [19] [20] La proteína CYP17A1 humana es fosforilada en residuos de serina y treonina por una proteína quinasa dependiente de AMPc . La fosforilación de la proteína aumenta la actividad de la 17,20-liasa, mientras que la desfosforilación prácticamente elimina esta actividad. [18]
Importancia clínica
Las mutaciones en este gen están asociadas con formas raras de hiperplasia suprarrenal congénita , específicamente deficiencia de 17α-hidroxilasa/deficiencia de 17,20-liasa y deficiencia aislada de 17,20-liasa . [21]
En los seres humanos, el gen CYP17A1 se asocia en gran medida con los efectos endocrinos y el metabolismo de las hormonas esteroides. [22] [23] [24] Además, las mutaciones en el gen CYP17A1 se asocian con formas raras de hiperplasia suprarrenal congénita , en particular la deficiencia de 17α-hidroxilasa/deficiencia de 17,20-liasa y la deficiencia aislada de 17,20-liasa. En general, CYP17A1 es un objetivo importante para la inhibición en el tratamiento del cáncer de próstata porque produce andrógenos que son necesarios para el crecimiento de las células tumorales. [25] [26] La actividad enzimática disminuida de CYP17A1 está relacionada con la infertilidad debido al hipogonadismo hipogonadotrópico. En las mujeres, se detiene la foliculogénesis, mientras que en los hombres, se produce atrofia testicular con proliferación de células intersticiales y se detiene la espermatogénesis. Aunque generalmente es anovulatoria, hay algunos informes de casos de mujeres con deficiencia de 17α-hidroxilasa que experimentaron menarquia espontánea con menstruaciones cíclicas. [27]
Marcador clínico
Un estudio de puntuación de riesgo genético multilocus basado en una combinación de 27 loci, incluido el gen CYP17A1, identificó a individuos con mayor riesgo de eventos de enfermedad arterial coronaria incidentes y recurrentes, así como un mayor beneficio clínico de la terapia con estatinas. El estudio se basó en un estudio de cohorte comunitaria (el estudio Malmo Diet and Cancer) y cuatro ensayos controlados aleatorizados adicionales de cohortes de prevención primaria (JUPITER y ASCOT) y cohortes de prevención secundaria (CARE y PROVE IT-TIMI 22). [9]
Como objetivo farmacológico
Inhibidores del CYP17A1
Actualmente, [ ¿ cuándo? ] la FDA ha aprobado sólo un inhibidor de CYP17A1, la abiraterona, que contiene un armazón esteroide similar a los sustratos endógenos de CYP17A1. La abiraterona es estructuralmente similar a los sustratos de otras enzimas del citocromo P450 involucradas en la esteroidogénesis, y la interferencia puede suponer una desventaja en términos de efectos secundarios. Se espera que el uso de armazones no esteroides permita el diseño de compuestos que interactúen de forma más selectiva con CYP17A1. [26] Los inhibidores potentes de la enzima CYP17A1 proporcionan una defensa de última línea contra la androgénesis ectópica en el cáncer de próstata avanzado. [28]
El acetato de abiraterona , un fármaco utilizado para tratar el cáncer de próstata resistente a la castración , bloquea la biosíntesis de andrógenos al inhibir la enzima CYP17A1. El acetato de abiraterona se une al sitio activo de la enzima [29] y coordina el hierro del hemo a través de su nitrógeno piridínico, imitando al sustrato. [30]
Desde 2014, la galeterona se encuentra en ensayos clínicos de fase III para el cáncer de próstata resistente a la castración . [31]
El ketoconazol es un inhibidor más antiguo del CYP17A1 que ahora se utiliza poco. Sin embargo, el ketoconazol inhibe competitivamente el CYP17A1, por lo que su eficacia dependerá de la concentración de ketoconazol. Esto contrasta con el acetato de abiraterona , que inhibe permanentemente (en lugar de hacerlo competitivamente) el CYP17A1 una vez que se une a él.
Seviteronel (VT-464) es un nuevo inhibidor del CYP17A1 que tiene como objetivo evitar la administración concomitante de terapia con glucocorticoides. [32] En la década de 2010, se sometió a varias fases de estudios clínicos y modelos preclínicos como fármaco contra el cáncer de próstata o el cáncer de mama. [33] [34]
Esteroidogénesis
 |
Imágenes adicionales
- Numeración de esteroides
Véase también
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000148795 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000003555 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia PubMed de ratón:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU . .
- ^ abcd «CYP17A1 citocromo P450 familia 17 subfamilia A miembro 1 [Homo sapiens (humano)] - Gen - NCBI». www.ncbi.nlm.nih.gov . Archivado desde el original el 23 de junio de 2015 . Consultado el 27 de septiembre de 2016 .
- ^ "BioGPS - su sistema de portal genético". biogps.org . Archivado desde el original el 20 de agosto de 2011 . Consultado el 11 de octubre de 2016 .
- ^ ab Boulpaep EL, Boron, WF (2005). Fisiología médica: un enfoque celular y molecular . St. Louis, Mo: Elsevier Saunders. pág. 1180. ISBN 1-4160-2328-3.
- ^ ab Vasaitis TS, Bruno RD, Njar VC (mayo de 2011). "Inhibidores de CYP17 para la terapia del cáncer de próstata". Revista de bioquímica de esteroides y biología molecular . 125 (1–2): 23–31. doi :10.1016/j.jsbmb.2010.11.005. PMC 3047603. PMID 21092758 .
- ^ ab Mega JL, Stitziel NO, Smith JG, Chasman DI, Caulfield M, Devlin JJ, et al. (junio de 2015). "Riesgo genético, eventos de enfermedad coronaria y beneficio clínico de la terapia con estatinas: un análisis de ensayos de prevención primaria y secundaria". Lancet . 385 (9984): 2264–2271. doi :10.1016/S0140-6736(14)61730-X. PMC 4608367 . PMID 25748612.
- ^ "CYP17A1 - Esteroide 17-alfa-hidroxilasa/17,20 liasa - Homo sapiens (humano) - Gen y proteína CYP17A1". www.uniprot.org . Archivado desde el original el 2016-10-12 . Consultado el 2016-10-11 .
- ^ Estrada DF, Laurence JS, Scott EE (febrero de 2016). "Interacciones del citocromo P450 17A1 con el dominio FMN de su reductasa caracterizadas por RMN". The Journal of Biological Chemistry . 291 (8): 3990–4003. doi : 10.1074/jbc.M115.677294 . PMC 4759177 . PMID 26719338.
- ^ DeVore NM, Scott EE (enero de 2012). "Estructuras del citocromo P450 17A1 con fármacos contra el cáncer de próstata como abiraterona y TOK-001". Nature . 482 (7383): 116–119. Bibcode :2012Natur.482..116D. doi :10.1038/nature10743. PMC 3271139 . PMID 22266943.
- ^ Petrunak EM, DeVore NM, Porubsky PR, Scott EE (noviembre de 2014). "Estructuras del citocromo P450 17A1 esteroidogénico humano con sustratos". The Journal of Biological Chemistry . 289 (47): 32952–32964. doi : 10.1074/jbc.M114.610998 . PMC 4239641 . PMID 25301938.
- ^ abc Storbeck KH, Swart P, Africander D, Conradie R, Louw R, Swart AC (abril de 2011). "16α-hidroxiprogesterona: origen, biosíntesis e interacción del receptor". Endocrinología Molecular y Celular . 336 (1–2): 92–101. doi :10.1016/j.mce.2010.11.016. PMID 21095220. S2CID 5503049.
- ^ DeVore NM, Scott EE (enero de 2012). "Estructuras del citocromo P450 17A1 con fármacos contra el cáncer de próstata como abiraterona y TOK-001". Nature . 482 (7383): 116–119. Bibcode :2012Natur.482..116D. doi :10.1038/nature10743. PMC 3271139 . PMID 22266943.
- ^ Udhane SS, Dick B, Hu Q, Hartmann RW, Pandey AV (septiembre de 2016). "Especificidad de los inhibidores del CYP17A1 contra el cáncer de próstata en la biosíntesis de andrógenos". Comunicaciones de investigación bioquímica y biofísica . 477 (4): 1005-1010. doi : 10.1016/j.bbrc.2016.07.019 . PMID 27395338.
- ^ Pandey AV, Miller WL (abril de 2005). "Regulación de la actividad de la 17,20 liasa por el citocromo b5 y por la fosforilación de serina de P450c17". The Journal of Biological Chemistry . 280 (14): 13265–13271. doi : 10.1074/jbc.M414673200 . PMID 15687493.
- ^ ab Zhang LH, Rodriguez H, Ohno S, Miller WL (noviembre de 1995). "La fosforilación de serina de P450c17 humana aumenta la actividad de la 17,20-liasa: implicaciones para la adrenarquia y el síndrome de ovario poliquístico". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 92 (23): 10619–10623. Bibcode :1995PNAS...9210619Z. doi : 10.1073/pnas.92.23.10619 . PMC 40663 . PMID 7479852.
- ^ Fukami M, Homma K, Hasegawa T, Ogata T (abril de 2013). "Vía de puerta trasera para la biosíntesis de dihidrotestosterona: implicaciones para el desarrollo sexual humano normal y anormal". Dinámica del desarrollo . 242 (4): 320–329. doi : 10.1002/dvdy.23892 . PMID 23073980. S2CID 44702659.
- ^ Masiutin M, Yadav M (2023). "Vías alternativas de andrógenos". WikiRevista de Medicina . 10 : X.doi : 10.15347 /WJM/2023.003 . S2CID 257943362.
- ^ "Gen Entrez: CYP17A1 citocromo P450, familia 17, subfamilia A, polipéptido 1". Archivado desde el original el 7 de marzo de 2010. Consultado el 30 de agosto de 2017 .
- ^ Ma YN, Cao CY, Wang QW, Gui WJ, Zhu GN (octubre de 2016). "Efectos de la azociclotina en la transcripción génica y el metaboloma esteroide del eje hipotálamo-hipofisario-gónada, y sus consecuencias en la reproducción en el pez cebra (Danio rerio)". Toxicología acuática . 179 : 55–64. doi :10.1016/j.aquatox.2016.08.006. PMID 27571716.
- ^ Legendre A, Elie C, Ramambason C, Manens L, Souidi M, Froment P, et al. (agosto de 2016). "Efectos endocrinos de la exposición de por vida a uranio empobrecido en dosis bajas sobre las funciones testiculares en ratas adultas" (PDF) . Toxicología . 368–369: 58–68. Bibcode :2016Toxgy.368...58L. doi : 10.1016/j.tox.2016.08.014 . PMID 27544493. Archivado (PDF) desde el original el 2 de febrero de 2024 . Consultado el 2 de febrero de 2024 .
- ^ Yadav R, Petrunak EM, Estrada DF, Scott EE (febrero de 2017). "Información estructural sobre la función del citocromo P450 17A1 esteroidogénico". Endocrinología molecular y celular . 441 : 68–75. doi :10.1016/j.mce.2016.08.035. PMC 5235955. PMID 27566228 .
- ^ Kostin VA, Zolottsev VA, Kuzikov AV, Masamrekh RA, Shumyantseva VV, Veselovsky AV, et al. (noviembre de 2016). "Derivados de oxazolinilo de [17 (20) E] -21-norpregneno que se diferencian en la estructura de los anillos A y B. Síntesis fácil e inhibición de la actividad catalítica de CYP17A1". Esteroides . 115 : 114-122. doi : 10.1016/j.steroids.2016.06.002. PMID 27505042. S2CID 205256638.
- ^ ab Bonomo S, Hansen CH, Petrunak EM, Scott EE, Styrishave B, Jørgensen FS, et al. (julio de 2016). "Herramientas prometedoras en la investigación del cáncer de próstata: inhibidores selectivos no esteroides del citocromo P450 17A1". Scientific Reports . 6 : 29468. Bibcode :2016NatSR...629468B. doi :10.1038/srep29468. PMC 4942611 . PMID 27406023.
- ^ Acién P, Acién M (noviembre de 2020). «Trastornos del desarrollo sexual: clasificación, revisión e impacto en la fertilidad». Revista de medicina clínica . 9 (11): 3555. doi : 10.3390/jcm9113555 . PMC 7694247 . PMID 33158283.
- ^ Bordeau BM, Ciulla DA, Callahan BP (septiembre de 2016). "Las proteínas Hedgehog consumen antagonistas esteroides del CYP17A1: posible importancia terapéutica en el cáncer de próstata avanzado". ChemMedChem . 11 (18): 1983–1986. doi :10.1002/cmdc.201600238. PMC 5588864 . PMID 27435344.
- ^ Fernández-Cancio M, Camats N, Flück CE, Zalewski A, Dick B, Frey BM, et al. (abril de 2018). "Mecanismo de las actividades duales del CYP17A1 humano y la unión al fármaco contra el cáncer de próstata abiraterona revelado por una nueva mutación V366M que causa deficiencia de 17,20 liasa". Productos farmacéuticos . 11 (2): 37. doi : 10.3390/ph11020037 . PMC 6027421 . PMID 29710837.
- ^ PDB : 3ruk ; DeVore NM, Scott EE (enero de 2012). "Estructuras del citocromo P450 17A1 con fármacos contra el cáncer de próstata abiraterona y TOK-001". Nature . 482 (7383): 116–119. Bibcode :2012Natur.482..116D. doi :10.1038/nature10743. PMC 3271139 . PMID 22266943.
- ^ "La galeterona reformulada de Tokai Pharmaceuticals demuestra una reducción importante del PSA en pacientes con cáncer de próstata avanzado" (nota de prensa). Tokai Pharmaceuticals. 29 de enero de 2014.[ enlace muerto permanente ]
- ^ Bird IM, Abbott DH (octubre de 2016). "La búsqueda de un inhibidor selectivo de la 17,20 liasa; lecciones de la naturaleza". The Journal of Steroid Biochemistry and Molecular Biology . 163 : 136–146. doi :10.1016/j.jsbmb.2016.04.021. PMC 5046225 . PMID 27154414.
VT464 es otro compuesto desarrollado recientemente que se propone que actúe como un inhibidor selectivo de la liasa, y hay datos más completos disponibles en el dominio público que respaldan esta afirmación. Una revisión de los datos preliminares publicados sugiere que la CI50 para la actividad de la liasa CYP17 humana es diez veces menor que para la hidroxilasa 15 y en primates no humanos VT464 fue capaz de suprimir la testosterona circulante con la misma eficacia que la abiraterona, pero con un cortisol mínimamente deprimido (permaneciendo en un 82% de control en comparación con solo el 9% con abiraterona), y sin aumentos asociados en pregnenolona, progesterona y mineralocorticoides observados de otra manera con abiraterona. Al igual que la galaterona, VT464 también se utiliza en ensayos clínicos sin coadministración de prednisona. Junto con la clara falta de supresión del cortisol circulante en primates no humanos, estos datos sostienen que VT464 puede ser de hecho un inhibidor selectivo de la 17,20 liasa.
- ^ Madan RA, Schmidt KT, Karzai F, Peer CJ, Cordes LM, Chau CH, et al. (agosto de 2020). "Estudio de fase 2 de seviteronel (INO-464) en pacientes con cáncer de próstata metastásico resistente a la castración después del tratamiento con enzalutamida". Cáncer genitourinario clínico . 18 (4): 258–267.e1. doi : 10.1016/j.clgc.2019.11.002. PMC 7415516. PMID 32327394.
- ^ Peer CJ, Schmidt KT, Kindrick JD, Eisner JR, Brown VV, Baskin-Bey E, et al. (octubre de 2019). "Un análisis farmacocinético poblacional de la liasa CYP17 oral y el inhibidor del receptor de andrógenos seviteronel en pacientes con cáncer de próstata avanzado/metastásico resistente a la castración o cáncer de mama". Quimioterapia y farmacología del cáncer . 84 (4): 759–770. doi :10.1007/s00280-019-03908-0. PMC 8132106 . PMID 31367790. S2CID 199056344.
Lectura adicional
- Miura K, Yasuda K, Yanase T, Yamakita N, Sasano H, Nawata H, et al. (octubre de 1996). "Mutación del gen alfa del citocromo P-45017 (CYP17) en un paciente japonés que previamente se había informado de hiperaldosteronismo sensible a los glucocorticoides: con una revisión de pacientes japoneses con mutaciones del CYP17". The Journal of Clinical Endocrinology and Metabolism . 81 (10): 3797–3801. doi : 10.1210/jcem.81.10.8855840 . PMID 8855840.
- Miller WL, Geller DH, Auchus RJ (1999). "La base molecular de la deficiencia aislada de 17,20 liasa". Endocrine Research . 24 (3–4): 817–825. doi :10.3109/07435809809032692. PMID 9888582.
- Strauss JF (noviembre de 2003). "Algunas nuevas ideas sobre la fisiopatología y la genética del síndrome de ovario poliquístico". Anales de la Academia de Ciencias de Nueva York . 997 (1): 42–48. Bibcode :2003NYASA.997...42S. doi :10.1196/annals.1290.005. PMID 14644808. S2CID 23559461.
- Haider SM, Patel JS, Poojari CS, Neidle S (julio de 2010). "Modelado molecular de complejos inhibidores y dinámica del sitio activo del citocromo P450 C17, un objetivo para la terapia del cáncer de próstata". Journal of Molecular Biology . 400 (5): 1078–1098. doi :10.1016/j.jmb.2010.05.069. PMID 20595043.
Enlaces externos
- CYP17A1+protein,+human en los Encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Página de detalles del gen CYP17A1 y ubicación del genoma humano en el navegador de genoma UCSC .