Virus
| Virus | |
|---|---|
 | |
| SARS-CoV-2 , miembro de la subfamilia Coronavirinae | |
| Clasificación de virus | |
| (sin clasificar): | Virus |
| Reinos | |
Un virus es un agente infeccioso submicroscópico que se replica solo dentro de las células vivas de un organismo . [1] Los virus infectan todas las formas de vida , desde animales y plantas hasta microorganismos , incluidas bacterias y arqueas . [2] [3] Los virus se encuentran en casi todos los ecosistemas de la Tierra y son el tipo de entidad biológica más numeroso. [4] [5] Desde el artículo de Dmitri Ivanovsky de 1892 que describe un patógeno no bacteriano que infecta las plantas de tabaco y el descubrimiento del virus del mosaico del tabaco por Martinus Beijerinck en 1898, [6] : 4 más de 11.000 de los millones de especies de virus han sido descritas en detalle. [7] [8] El estudio de los virus se conoce como virología , una subespecialidad de la microbiología .
Cuando una célula huésped se infecta, a menudo se ve obligada a producir rápidamente miles de copias del virus original. Cuando no están dentro de una célula infectada o en el proceso de infectar una célula, los virus existen en forma de partículas virales independientes, o viriones , que consisten en (i) material genético , es decir, moléculas largas de ADN o ARN que codifican la estructura de las proteínas mediante las cuales actúa el virus; (ii) una capa proteica , la cápside , que rodea y protege el material genético; y en algunos casos (iii) una envoltura externa de lípidos . Las formas de estas partículas virales varían desde formas helicoidales e icosaédricas simples hasta estructuras más complejas. La mayoría de las especies de virus tienen viriones demasiado pequeños para ser vistos con un microscopio óptico y son una centésima parte del tamaño de la mayoría de las bacterias.
Los orígenes de los virus en la historia evolutiva de la vida aún no están claros. Algunos virus pueden haber evolucionado a partir de plásmidos , que son fragmentos de ADN que pueden moverse entre células. Otros virus pueden haber evolucionado a partir de bacterias. En la evolución, los virus son un medio importante de transferencia horizontal de genes , que aumenta la diversidad genética de una manera análoga a la reproducción sexual . [9] Algunos biólogos consideran que los virus son una forma de vida, porque llevan material genético, se reproducen y evolucionan a través de la selección natural , aunque carecen de algunas características clave, como la estructura celular, que generalmente se consideran criterios necesarios para definir la vida. Debido a que poseen algunas de esas cualidades, pero no todas, los virus han sido descritos como "organismos al borde de la vida" [10] y como replicadores . [11]
Los virus se propagan de muchas maneras. Una vía de transmisión es a través de organismos portadores de enfermedades conocidos como vectores : por ejemplo, los virus a menudo se transmiten de planta a planta por insectos que se alimentan de la savia de las plantas , como los pulgones ; y los virus en animales pueden ser transportados por insectos chupadores de sangre . Muchos virus se propagan en el aire al toser y estornudar, incluidos los virus de la gripe , el SARS-CoV-2 , la varicela , la viruela y el sarampión . El norovirus y el rotavirus , causas comunes de gastroenteritis viral , se transmiten por la vía fecal-oral , a través del contacto mano-boca o en los alimentos o el agua. La dosis infecciosa de norovirus necesaria para producir infección en humanos es inferior a 100 partículas. [12] El VIH es uno de varios virus que se transmiten a través del contacto sexual y por exposición a sangre infectada. La variedad de células hospedadoras que un virus puede infectar se denomina rango de hospedadores : este rango es estrecho para los virus especializados en infectar solo unas pocas especies, o amplio para los virus capaces de infectar a muchas. [13] : 123–124
Las infecciones virales en animales provocan una respuesta inmunitaria que generalmente elimina el virus infectante. Las respuestas inmunitarias también pueden producirse mediante vacunas , que confieren una inmunidad adquirida artificialmente a la infección viral específica. Algunos virus, incluidos los que causan el VIH/SIDA , la infección por VPH y la hepatitis viral , evaden estas respuestas inmunitarias y dan lugar a infecciones crónicas . Se han desarrollado varias clases de medicamentos antivirales .
Etimología
La palabra inglesa «virus» proviene del latín vīrus , que se refiere a veneno y otros líquidos nocivos. Vīrus proviene de la misma raíz indoeuropea que el sánscrito viṣa , el avéstico vīša y el griego antiguo ἰός ( iós ), que significan «veneno». El primer uso atestiguado de «virus» en inglés apareció en 1398 en la traducción de John Trevisa de De Proprietatibus Rerum de Bartholomeus Anglicus . [14] [15] Virulento , del latín virulentus ('venenoso'), data de alrededor de 1400 . [16] [17] El significado de 'agente que causa enfermedad infecciosa' se registró por primera vez en 1728, [15] mucho antes del descubrimiento de los virus por Dmitri Ivanovsky en 1892. El plural en inglés es viruses (a veces también vira ), [18] mientras que la palabra latina es un sustantivo colectivo , que no tiene un plural atestiguado clásicamente ( vīra se usa en neolatín [19] ). El adjetivo viral data de 1948. [20] El término virión (plural viriones ), que data de 1959, [21] también se usa para referirse a una única partícula viral que se libera de la célula y es capaz de infectar otras células del mismo tipo. [22]
Orígenes
Los virus se encuentran dondequiera que haya vida y probablemente han existido desde que las células vivas evolucionaron por primera vez . [23] El origen de los virus no está claro porque no forman fósiles, por lo que se utilizan técnicas moleculares para inferir cómo surgieron. [24] Además, el material genético viral ocasionalmente se integra en la línea germinal de los organismos hospedadores, por lo que pueden transmitirse verticalmente a la descendencia del hospedador durante muchas generaciones. Esto proporciona una fuente de información invaluable para que los paleovirólogos rastreen virus antiguos que existieron hace millones de años.
Hay tres hipótesis principales que pretenden explicar el origen de los virus: [25]
- Hipótesis regresiva
- Los virus pueden haber sido en el pasado pequeñas células que parasitaban a células más grandes. Con el tiempo, se perdieron genes que no eran necesarios para su parasitismo. Las bacterias rickettsia y clamidia son células vivas que, al igual que los virus, sólo pueden reproducirse dentro de las células huésped. Estas bacterias respaldan esta hipótesis, ya que es probable que su dependencia del parasitismo haya causado la pérdida de genes que les permitían sobrevivir fuera de una célula. Esto también se denomina "hipótesis de la degeneración", [6] : 16 [26] : 11 o "hipótesis de la reducción". [27] : 24
- Hipótesis del origen celular
- Algunos virus pueden haber evolucionado a partir de fragmentos de ADN o ARN que "escaparon" de los genes de un organismo más grande. El ADN escapado podría haber provenido de plásmidos (fragmentos de ADN desnudo que pueden moverse entre células) o transposones (moléculas de ADN que se replican y se mueven a diferentes posiciones dentro de los genes de la célula). [13] : 810 Los transposones, que antes se llamaban "genes saltarines", son ejemplos de elementos genéticos móviles y podrían ser el origen de algunos virus. Fueron descubiertos en el maíz por Barbara McClintock en 1950. [28] A esto a veces se le llama la "hipótesis de la vagancia", [6] : 16 [26] : 11–12 o la "hipótesis del escape". [27] : 24
- Hipótesis de coevolución
- Esto también se llama la "hipótesis del virus primero" [27] : 24 y propone que los virus pueden haber evolucionado a partir de moléculas complejas de proteína y ácido nucleico al mismo tiempo que las células aparecieron por primera vez en la Tierra y habrían dependido de la vida celular durante miles de millones de años. Los viroides son moléculas de ARN que no se clasifican como virus porque carecen de una capa de proteína. Tienen características que son comunes a varios virus y a menudo se denominan agentes subvirales . [6] : 55 Los viroides son patógenos importantes de las plantas. [13] : 791 No codifican proteínas, pero interactúan con la célula huésped y utilizan la maquinaria del huésped para su replicación. [29] El virus de la hepatitis delta de los humanos tiene un genoma de ARN similar a los viroides, pero tiene una capa de proteína derivada del virus de la hepatitis B y no puede producir una propia. Es, por tanto, un virus defectuoso. Aunque el genoma del virus de la hepatitis delta puede replicarse de forma independiente una vez dentro de una célula huésped, requiere la ayuda del virus de la hepatitis B para proporcionar una capa de proteína para que pueda transmitirse a nuevas células. [13] : 460 De manera similar, el virófago sputnik depende de mimivirus , que infecta al protozoo Acanthamoeba castellanii . [30] Estos virus, que dependen de la presencia de otras especies de virus en la célula huésped, se denominan " satélites " y pueden representar intermediarios evolutivos de viroides y virus. [26] : 777 > [6] : 55–57
En el pasado, todas estas hipótesis planteaban problemas: la hipótesis regresiva no explicaba por qué incluso los parásitos celulares más pequeños no se parecen en nada a los virus. La hipótesis del escape no explicaba las complejas cápsides y otras estructuras de las partículas virales. La hipótesis del virus primero contradecía la definición de virus en el sentido de que requieren células hospedadoras. [27] : 24 Ahora se reconoce que los virus son antiguos y que tienen orígenes anteriores a la divergencia de la vida en los tres dominios . [27] : 28 Este descubrimiento ha llevado a los virólogos modernos a reconsiderar y reevaluar estas tres hipótesis clásicas. [27] : 28
La evidencia de un mundo ancestral de células de ARN [27] : 26 y el análisis informático de secuencias de ADN viral y del huésped proporcionan una mejor comprensión de las relaciones evolutivas entre diferentes virus y pueden ayudar a identificar a los ancestros de los virus modernos. Hasta la fecha, dichos análisis no han demostrado cuál de estas hipótesis es correcta. [27] : 26 Parece poco probable que todos los virus conocidos actualmente tengan un ancestro común, y es probable que los virus hayan surgido numerosas veces en el pasado mediante uno o más mecanismos. [31]
Microbiología
Descubrimiento
La primera evidencia de la existencia de virus provino de experimentos con filtros que tenían poros lo suficientemente pequeños como para retener bacterias. En 1892, Dmitri Ivanovsky utilizó uno de estos filtros para demostrar que la savia de una planta de tabaco enferma seguía siendo infecciosa para las plantas de tabaco sanas a pesar de haber sido filtrada. Martinus Beijerinck llamó a la sustancia infecciosa filtrada un "virus" y este descubrimiento se considera el comienzo de la virología. El posterior descubrimiento y caracterización parcial de los bacteriófagos por Frederick Twort y Félix d'Herelle catalizaron aún más el campo, y a principios del siglo XX se habían descubierto muchos virus. En 1926, Thomas Milton Rivers definió los virus como parásitos obligados. Wendell Meredith Stanley demostró que los virus eran partículas, en lugar de un fluido, y la invención del microscopio electrónico en 1931 permitió visualizar sus complejas estructuras. [32]
Propiedades de la vida
Las opiniones científicas difieren sobre si los virus son una forma de vida o estructuras orgánicas que interactúan con organismos vivos. [11] Se les ha descrito como "organismos al borde de la vida", [10] ya que se parecen a los organismos en que poseen genes , evolucionan por selección natural , [33] y se reproducen creando múltiples copias de sí mismos a través del autoensamblaje. Aunque tienen genes, no tienen una estructura celular, que a menudo se considera la unidad básica de la vida. Los virus no tienen su propio metabolismo y requieren una célula huésped para fabricar nuevos productos. Por lo tanto, no pueden reproducirse naturalmente fuera de una célula huésped [34] —aunque algunas bacterias como la rickettsia y la clamidia se consideran organismos vivos a pesar de la misma limitación. [35] [36] Las formas de vida aceptadas utilizan la división celular para reproducirse, mientras que los virus se ensamblan espontáneamente dentro de las células. Se diferencian del crecimiento autónomo de los cristales ya que heredan mutaciones genéticas mientras están sujetos a la selección natural. El autoensamblaje de virus dentro de las células huésped tiene implicaciones para el estudio del origen de la vida , ya que da más credibilidad a la hipótesis de que la vida podría haber comenzado como moléculas orgánicas autoensambladas . [2] El modelo de virocélula propuesto por primera vez por Patrick Forterre considera que la célula infectada es la "forma viva" de los virus y que las partículas virales (viriones) son análogas a las esporas . [37] Aunque el debate sobre lo vivo versus lo no vivo continúa, el modelo de virocélula ha ganado cierta aceptación. [38]
Estructura
Los virus muestran una amplia diversidad de tamaños y formas, llamadas " morfologías ". En general, los virus son mucho más pequeños que las bacterias y más de mil virus bacteriófagos cabrían dentro de la célula de una bacteria Escherichia coli . [39] : 98 Muchos virus que se han estudiado son esféricos y tienen un diámetro entre 20 y 300 nanómetros . Algunos filovirus , que son filamentos, tienen una longitud total de hasta 1400 nm; sus diámetros son solo de unos 80 nm. [26] : 33–55 La mayoría de los virus no se pueden ver con un microscopio óptico , por lo que se utilizan microscopios electrónicos de barrido y transmisión para visualizarlos. [26] : 33–37 Para aumentar el contraste entre los virus y el fondo, se utilizan "tinciones" electrodensas. Estas son soluciones de sales de metales pesados, como el tungsteno , que dispersan los electrones de las regiones cubiertas con la tinción. Cuando los viriones están recubiertos con una tinción (tinción positiva), los detalles finos se oscurecen. La tinción negativa soluciona este problema al teñir solo el fondo. [40]
Una partícula viral completa, conocida como virión , consiste en ácido nucleico rodeado por una capa protectora de proteína llamada cápside . Estas se forman a partir de subunidades proteicas llamadas capsómeros . [26] : 40 Los virus pueden tener una "envoltura" lipídica derivada de la membrana de la célula huésped . La cápside está hecha de proteínas codificadas por el genoma viral y su forma sirve como base para la distinción morfológica. [41] [42] Las subunidades proteicas codificadas por el virus se autoensamblan para formar una cápside, lo que en general requiere la presencia del genoma del virus. Los virus complejos codifican proteínas que ayudan en la construcción de su cápside. Las proteínas asociadas con el ácido nucleico se conocen como nucleoproteínas , y la asociación de las proteínas de la cápside viral con el ácido nucleico viral se llama nucleocápside. La cápside y la estructura completa del virus se pueden sondear mecánicamente (físicamente) a través de microscopía de fuerza atómica . [43] [44] En general, hay cinco tipos principales de virus morfológicos:
- Helicoidal
- Estos virus están compuestos por un único tipo de capsómero apilado alrededor de un eje central para formar una estructura helicoidal , que puede tener una cavidad central o tubo. Esta disposición da como resultado viriones que pueden ser varillas cortas y muy rígidas, o filamentos largos y muy flexibles. El material genético (normalmente ARN monocatenario, pero ADN monocatenario en algunos casos) está unido a la hélice de la proteína mediante interacciones entre el ácido nucleico cargado negativamente y las cargas positivas de la proteína. En general, la longitud de una cápside helicoidal está relacionada con la longitud del ácido nucleico contenido en ella, y el diámetro depende del tamaño y la disposición de los capsómeros. El virus del mosaico del tabaco, muy estudiado [26] : 37 y el inovirus [45] son ejemplos de virus helicoidales.
- Icosaédrica
- La mayoría de los virus animales son icosaédricos o casi esféricos con simetría icosaédrica quiral . Un icosaedro regular es la forma óptima de formar una capa cerrada a partir de subunidades idénticas. El número mínimo de capsómeros necesarios para cada cara triangular es 3, lo que da 60 para el icosaedro. Muchos virus, como el rotavirus, tienen más de 60 capsómeros y parecen esféricos, pero conservan esta simetría. Para lograr esto, los capsómeros en los vértices están rodeados por otros cinco capsómeros y se denominan pentones. Los capsómeros en las caras triangulares están rodeados por otros seis y se denominan hexones . [26] : 40, 42 Los hexones son en esencia planos y los pentones, que forman los 12 vértices, son curvos. La misma proteína puede actuar como subunidad de los pentámeros y hexámeros o pueden estar compuestos de diferentes proteínas. [46]
- Prolapso
- Se trata de un icosaedro alargado a lo largo del eje quíntuple y es una disposición común de las cabezas de los bacteriófagos. Esta estructura está compuesta por un cilindro con una tapa en cada extremo. [47]
- Envuelto
- Algunas especies de virus se envuelven en una forma modificada de una de las membranas celulares , ya sea la membrana externa que rodea a una célula huésped infectada o membranas internas como una membrana nuclear o retículo endoplasmático , obteniendo así una bicapa lipídica externa conocida como envoltura viral . Esta membrana está repleta de proteínas codificadas por el genoma viral y el genoma del huésped; la propia membrana lipídica y cualquier carbohidrato presente se originan completamente en el huésped. El virus de la influenza , el VIH (que causa el SIDA ) y el coronavirus 2 del síndrome respiratorio agudo severo (que causa COVID-19 ) [48] utilizan esta estrategia. La mayoría de los virus con envoltura dependen de la envoltura para su infectividad. [26] : 42–43
- Complejo
- Estos virus poseen una cápside que no es ni puramente helicoidal ni puramente icosaédrica, y que puede poseer estructuras adicionales como colas proteicas o una pared externa compleja. Algunos bacteriófagos, como el fago T4 de Enterobacteria , tienen una estructura compleja que consiste en una cabeza icosaédrica unida a una cola helicoidal, que puede tener una placa de base hexagonal con fibras proteicas de cola que sobresalen. Esta estructura de cola actúa como una jeringa molecular, adhiriéndose al huésped bacteriano y luego inyectando el genoma viral en la célula. [49]
Los poxvirus son virus grandes y complejos que tienen una morfología inusual. El genoma viral está asociado con proteínas dentro de una estructura de disco central conocida como nucleoide . El nucleoide está rodeado por una membrana y dos cuerpos laterales de función desconocida. El virus tiene una envoltura externa con una capa gruesa de proteína tachonada sobre su superficie. Todo el virión es ligeramente pleomórfico , con una forma que va desde ovoide hasta ladrillo. [50]
Virus gigantes
El Mimivirus es uno de los virus más grandes que se han caracterizado, con un diámetro de cápside de 400 nm. Los filamentos de proteína que miden 100 nm se proyectan desde la superficie. La cápside parece hexagonal bajo un microscopio electrónico, por lo tanto, la cápside es probablemente icosaédrica. [51] En 2011, los investigadores descubrieron el virus más grande conocido hasta entonces en muestras de agua recolectadas del fondo del océano frente a la costa de Las Cruces, Chile. Nombrado provisionalmente Megavirus chilensis , se puede ver con un microscopio óptico básico. [52] En 2013, se descubrió el género Pandoravirus en Chile y Australia, y tiene genomas aproximadamente el doble de grandes que Megavirus y Mimivirus. [53] Todos los virus gigantes tienen genomas de dsADN y se clasifican en varias familias: Mimiviridae , Pithoviridae, Pandoraviridae , Phycodnaviridae y el género Mollivirus . [54]
Algunos virus que infectan a las arqueas tienen estructuras complejas que no tienen relación con ninguna otra forma de virus, con una amplia variedad de formas inusuales, que van desde estructuras fusiformes hasta virus que se parecen a bastones con forma de gancho, lágrimas o incluso botellas. Otros virus arqueas se parecen a los bacteriófagos con cola y pueden tener múltiples estructuras en la cola. [55]
Genoma
| Propiedad | Parámetros |
|---|---|
| Ácido nucleico |
|
| Forma |
|
| Varamiento |
|
| Sentido |
|
Se puede observar una enorme variedad de estructuras genómicas entre las especies virales ; como grupo, contienen más diversidad genómica estructural que las plantas, los animales, las arqueas o las bacterias. Hay millones de tipos diferentes de virus, [8] aunque se han descrito en detalle menos de 7000 tipos. [6] : 49 A enero de 2021, la base de datos del genoma del virus del NCBI tiene más de 193 000 secuencias genómicas completas, [56] pero sin duda hay muchas más por descubrir. [57] [58]
Un virus tiene un genoma de ADN o de ARN y se denomina virus de ADN o de ARN , respectivamente. La mayoría de los virus tienen genomas de ARN. Los virus de plantas tienden a tener genomas de ARN monocatenario y los bacteriófagos tienden a tener genomas de ADN bicatenario. [26] : 96–99
Los genomas virales son circulares, como en los poliomavirus , o lineales, como en los adenovirus . El tipo de ácido nucleico es irrelevante para la forma del genoma. Entre los virus de ARN y ciertos virus de ADN, el genoma a menudo se divide en partes separadas, en cuyo caso se llama segmentado. Para los virus de ARN, cada segmento a menudo codifica solo una proteína y generalmente se encuentran juntos en una cápside. No se requiere que todos los segmentos estén en el mismo virión para que el virus sea infeccioso, como lo demuestra el virus del mosaico del bromo y varios otros virus de plantas. [26] : 33–35
Un genoma viral, independientemente del tipo de ácido nucleico, es casi siempre monocatenario (ss) o bicatenario (ds). Los genomas monocatenarios consisten en un ácido nucleico no apareado, análogo a la mitad de una escalera dividida por la mitad. Los genomas bicatenarios consisten en dos ácidos nucleicos complementarios apareados, análogos a una escalera. Las partículas virales de algunas familias de virus, como las que pertenecen a Hepadnaviridae , contienen un genoma que es parcialmente bicatenario y parcialmente monocatenario. [26] : 96–99
En la mayoría de los virus con genomas de ARN y algunos con genomas de ADN monocatenario (ssDNA), se dice que las hebras simples son de sentido positivo (llamadas "hebra positiva") o de sentido negativo (llamadas "hebra negativa"), dependiendo de si son complementarias al ARN mensajero viral (ARNm). El ARN viral de sentido positivo tiene el mismo sentido que el ARNm viral y, por lo tanto, al menos una parte de él puede ser traducido inmediatamente por la célula huésped. El ARN viral de sentido negativo es complementario al ARNm y, por lo tanto, debe convertirse en ARN de sentido positivo mediante una ARN polimerasa dependiente de ARN antes de la traducción. La nomenclatura del ADN para los virus con ssDNA genómico es similar a la nomenclatura del ARN, en que el ssDNA viral de hebra positiva es idéntico en secuencia al ARNm viral y, por lo tanto, es una hebra codificante, mientras que el ssDNA viral de sentido negativo es complementario al ARNm viral y, por lo tanto, es una hebra molde. [26] : 96–99 Varios tipos de virus ssDNA y ssRNA tienen genomas que son ambisentidos en el sentido de que la transcripción puede ocurrir fuera de ambas cadenas en un intermediario replicativo de doble cadena. Los ejemplos incluyen geminivirus , que son virus de plantas ssDNA y arenavirus , que son virus ssRNA de animales. [59]
Tamaño del genoma
El tamaño del genoma varía mucho entre especies. Los más pequeños (los circovirus ssDNA, familia Circoviridae ) codifican solo dos proteínas y tienen un tamaño de genoma de solo dos kilobases; [60] los más grandes (los pandoravirus) tienen tamaños de genoma de alrededor de dos megabases que codifican alrededor de 2500 proteínas. [53] Los genes de los virus rara vez tienen intrones y a menudo están dispuestos en el genoma de manera que se superponen . [61]
En general, los virus de ARN tienen genomas más pequeños que los virus de ADN debido a una mayor tasa de error al replicarse, y tienen un límite de tamaño máximo superior. [24] Más allá de esto, los errores al replicarse hacen que el virus sea inútil o no competitivo. Para compensar, los virus de ARN a menudo tienen genomas segmentados (el genoma se divide en moléculas más pequeñas), lo que reduce la posibilidad de que un error en un genoma de un solo componente incapacite a todo el genoma. En contraste, los virus de ADN generalmente tienen genomas más grandes debido a la alta fidelidad de sus enzimas de replicación. [62] Los virus de ADN de cadena sencilla son una excepción a esta regla, ya que las tasas de mutación de estos genomas pueden acercarse al extremo del caso del virus de ARN monocatenario. [63]
Mutación genética y recombinación

Los virus sufren cambios genéticos por varios mecanismos. Estos incluyen un proceso llamado deriva antigénica donde bases individuales en el ADN o ARN mutan a otras bases. La mayoría de estas mutaciones puntuales son "silenciosas" (no cambian la proteína que el gen codifica), pero otras pueden conferir ventajas evolutivas como la resistencia a los medicamentos antivirales . [64] [65] El cambio antigénico ocurre cuando hay un cambio importante en el genoma del virus. Esto puede ser el resultado de la recombinación o reordenamiento . El virus de la influenza A es muy propenso al reordenamiento; ocasionalmente esto ha dado lugar a nuevas cepas que han causado pandemias . [66] Los virus de ARN a menudo existen como cuasiespecies o enjambres de virus de la misma especie pero con secuencias de nucleósidos genómicos ligeramente diferentes. Estas cuasiespecies son un objetivo principal para la selección natural. [67]
Los genomas segmentados confieren ventajas evolutivas; diferentes cepas de un virus con un genoma segmentado pueden mezclar y combinar genes y producir virus descendientes que tienen características únicas. Esto se denomina reordenamiento o "sexo viral". [68]
La recombinación genética es un proceso por el cual una hebra de ADN (o ARN) se rompe y luego se une al extremo de una molécula de ADN (o ARN) diferente. Esto puede ocurrir cuando los virus infectan células simultáneamente y los estudios de evolución viral han demostrado que la recombinación ha sido rampante en las especies estudiadas. [69] La recombinación es común tanto a los virus de ARN como a los de ADN. [70] [71]
Los coronavirus tienen un genoma de ARN monocatenario de sentido positivo . La replicación del genoma está catalizada por una ARN polimerasa dependiente de ARN . El mecanismo de recombinación utilizado por los coronavirus probablemente implica un cambio de plantilla por parte de la polimerasa durante la replicación del genoma. [72] Este proceso parece ser una adaptación para hacer frente al daño del genoma. [73]
Ciclo de replicación


Las poblaciones virales no crecen por división celular, porque son acelulares. En cambio, utilizan la maquinaria y el metabolismo de una célula huésped para producir múltiples copias de sí mismas, y se reúnen en la célula. [74] Cuando se infecta, la célula huésped se ve obligada a producir rápidamente miles de copias del virus original. [75]
Su ciclo de vida difiere mucho entre especies, pero hay seis etapas básicas en su ciclo de vida: [26] : 75–91
La unión es una unión específica entre las proteínas de la cápside viral y receptores específicos en la superficie celular del huésped. Esta especificidad determina el rango de hospedadores y el tipo de célula huésped de un virus. Por ejemplo, el VIH infecta un rango limitado de leucocitos humanos . Esto se debe a que su proteína de superficie, gp120 , interactúa específicamente con la molécula CD4 (un receptor de quimiocina ), que se encuentra más comúnmente en la superficie de las células T CD4+ . Este mecanismo ha evolucionado para favorecer a aquellos virus que infectan solo células en las que son capaces de replicarse. La unión al receptor puede inducir a la proteína de la envoltura viral a sufrir cambios que resultan en la fusión de las membranas virales y celulares, o cambios de las proteínas de superficie del virus sin envoltura que permiten que el virus entre. [76]
La penetración o entrada viral sigue a la unión: los viriones ingresan a la célula huésped a través de endocitosis mediada por receptores o fusión de membranas . La infección de células vegetales y fúngicas es diferente a la de las células animales. Las plantas tienen una pared celular rígida hecha de celulosa y los hongos una de quitina, por lo que la mayoría de los virus pueden ingresar a estas células solo después de un traumatismo en la pared celular. [6] : 70 Casi todos los virus vegetales (como el virus del mosaico del tabaco) también pueden moverse directamente de una célula a otra, en forma de complejos de nucleoproteínas monocatenarias, a través de poros llamados plasmodesmos . [77] Las bacterias, como las plantas, tienen paredes celulares fuertes que un virus debe atravesar para infectar la célula. Dado que las paredes celulares bacterianas son mucho más delgadas que las paredes celulares vegetales debido a su tamaño mucho más pequeño, algunos virus han desarrollado mecanismos que inyectan su genoma en la célula bacteriana a través de la pared celular, mientras que la cápside viral permanece afuera. [6] : 71
La desprotección es un proceso en el cual se elimina la cápside viral: esto puede ser por degradación por enzimas virales o enzimas del huésped o por simple disociación; el resultado final es la liberación del ácido nucleico genómico viral. [78]
La replicación de los virus implica principalmente la multiplicación del genoma. La replicación implica la síntesis del ARN mensajero viral (ARNm) a partir de genes "tempranos" (con excepción de los virus de ARN de sentido positivo), la síntesis de proteínas virales , el posible ensamblaje de proteínas virales y luego la replicación del genoma viral mediada por la expresión de proteínas tempranas o reguladoras. Esto puede ser seguido, para virus complejos con genomas más grandes, por una o más rondas adicionales de síntesis de ARNm: la expresión génica "tardía" es, en general, de proteínas estructurales o virionales. [79]
Ensamblaje – Después del autoensamblaje mediado por la estructura de las partículas virales, a menudo se produce alguna modificación de las proteínas. En virus como el VIH, esta modificación (a veces llamada maduración) ocurre después de que el virus se haya liberado de la célula huésped. [80]
Liberación – Los virus pueden liberarse de la célula huésped por lisis , un proceso que mata la célula al estallar su membrana y pared celular si está presente: esta es una característica de muchos virus bacterianos y algunos animales. Algunos virus experimentan un ciclo lisogénico donde el genoma viral se incorpora por recombinación genética en un lugar específico en el cromosoma del huésped. El genoma viral se conoce entonces como un " provirus " o, en el caso de los bacteriófagos, un " profago ". [13] : 836 Siempre que el huésped se divide, el genoma viral también se replica. El genoma viral es mayormente silencioso dentro del huésped. En algún momento, el provirus o el profago pueden dar lugar al virus activo, que puede lisar las células huésped. [6] : 243–259 Los virus envueltos (por ejemplo, el VIH) generalmente se liberan de la célula huésped por gemación . Durante este proceso, el virus adquiere su envoltura, que es una pieza modificada del plasma del huésped u otra membrana interna. [6] : 185–187
Replicación del genoma
El material genético dentro de las partículas virales y el método mediante el cual se replica dicho material varían considerablemente entre los diferentes tipos de virus.
- Virus de ADN
- La replicación del genoma de la mayoría de los virus de ADN tiene lugar en el núcleo de la célula . Si la célula tiene el receptor apropiado en su superficie, estos virus entran en la célula ya sea por fusión directa con la membrana celular (por ejemplo, los herpesvirus) o, más habitualmente, por endocitosis mediada por el receptor. La mayoría de los virus de ADN dependen completamente de la maquinaria de síntesis de ADN y ARN y de la maquinaria de procesamiento de ARN de la célula huésped. Los virus con genomas más grandes pueden codificar gran parte de esta maquinaria por sí mismos. En los eucariotas, el genoma viral debe atravesar la membrana nuclear de la célula para acceder a esta maquinaria, mientras que en las bacterias solo necesita entrar en la célula. [13] : 118 [26] : 78
- Virus de ARN
- La replicación de los virus ARN se produce normalmente en el citoplasma . Los virus ARN pueden clasificarse en cuatro grupos diferentes según sus modos de replicación. La polaridad (si puede o no ser utilizada directamente por los ribosomas para fabricar proteínas) de los virus ARN monocatenarios determina en gran medida el mecanismo de replicación; el otro criterio principal es si el material genético es monocatenario o bicatenario. Todos los virus ARN utilizan sus propias enzimas replicasas de ARN para crear copias de sus genomas. [26] : 79
- Virus de transcripción inversa
- Los virus de transcripción inversa tienen ssRNA ( Retroviridae , Metaviridae , Pseudoviridae ) o dsDNA ( Caulimoviridae y Hepadnaviridae ) en sus partículas. Los virus de transcripción inversa con genomas de ARN ( retrovirus ) utilizan un intermediario de ADN para replicarse, mientras que aquellos con genomas de ADN ( pararetrovirus ) utilizan un intermediario de ARN durante la replicación del genoma. Ambos tipos utilizan una transcriptasa inversa , o enzima ADN polimerasa dependiente de ARN, para llevar a cabo la conversión de ácido nucleico. Los retrovirus integran el ADN producido por transcripción inversa en el genoma del huésped como un provirus como parte del proceso de replicación; los pararetrovirus no lo hacen, aunque las copias del genoma integrado de pararetrovirus especialmente de plantas pueden dar lugar a virus infecciosos. [81] Son susceptibles a los fármacos antivirales que inhiben la enzima transcriptasa inversa, por ejemplo, zidovudina y lamivudina . Un ejemplo del primer tipo es el VIH, que es un retrovirus. Ejemplos del segundo tipo son los Hepadnaviridae , que incluyen el virus de la hepatitis B. [26] : 88–89
Efectos citopáticos sobre la célula huésped
La gama de efectos estructurales y bioquímicos que los virus tienen sobre la célula huésped es extensa. [26] : 115–146 Estos se llaman ' efectos citopáticos '. [26] : 115 La mayoría de las infecciones virales finalmente resultan en la muerte de la célula huésped. Las causas de muerte incluyen lisis celular, alteraciones en la membrana superficial de la célula y apoptosis . [82] A menudo, la muerte celular es causada por el cese de sus actividades normales debido a la supresión por proteínas específicas del virus, no todas las cuales son componentes de la partícula viral. [83] La distinción entre citopático e inofensivo es gradual. Algunos virus, como el virus de Epstein-Barr , pueden hacer que las células proliferen sin causar malignidad, [84] mientras que otros, como los virus del papiloma , son causas establecidas de cáncer. [85]
Infecciones latentes y latentes
Algunos virus no provocan cambios aparentes en la célula infectada. Las células en las que el virus está latente e inactivo muestran pocos signos de infección y suelen funcionar con normalidad. [86] Esto provoca infecciones persistentes y el virus suele permanecer inactivo durante muchos meses o años. Este suele ser el caso de los virus del herpes . [87] [88]
Rango de hospedadores
Los virus son, con mucho, las entidades biológicas más abundantes en la Tierra y superan en número a todas las demás juntas. [89] Infectan todos los tipos de vida celular, incluidos animales, plantas, bacterias y hongos . [6] : 49 Los diferentes tipos de virus pueden infectar solo un rango limitado de huéspedes y muchos son específicos de la especie. Algunos, como el virus de la viruela , por ejemplo, pueden infectar solo una especie, en este caso los humanos, [13] : 643 y se dice que tienen un rango estrecho de huéspedes . Otros virus, como el virus de la rabia, pueden infectar diferentes especies de mamíferos y se dice que tienen un rango amplio. [13] : 631 Los virus que infectan plantas son inofensivos para los animales, y la mayoría de los virus que infectan a otros animales son inofensivos para los humanos. [6] : 272 El rango de huéspedes de algunos bacteriófagos está limitado a una sola cepa de bacterias y se pueden usar para rastrear la fuente de brotes de infecciones mediante un método llamado tipificación de fagos . [90] El conjunto completo de virus en un organismo o hábitat se llama viroma ; por ejemplo, todos los virus humanos constituyen el viroma humano . [91]
Virus nuevos
Un virus nuevo es aquel que no ha sido registrado previamente. Puede ser un virus que se aísla de su reservorio natural o que se aísla como resultado de la propagación a un huésped animal o humano donde el virus no había sido identificado antes. Puede ser un virus emergente , uno que representa un virus nuevo, pero también puede ser un virus existente que no ha sido identificado previamente . [92] El coronavirus SARS-CoV-2 que causó la pandemia de COVID-19 es un ejemplo de un virus nuevo. [93]
Clasificación
La clasificación busca describir la diversidad de virus nombrándolos y agrupándolos sobre la base de similitudes. En 1962, André Lwoff , Robert Horne y Paul Tournier fueron los primeros en desarrollar un medio de clasificación de virus, basado en el sistema jerárquico de Linneo . [94] Este sistema basaba la clasificación en filo , clase , orden , familia , género y especie . Los virus se agrupaban según sus propiedades compartidas (no las de sus huéspedes) y el tipo de ácido nucleico que formaba sus genomas. [95] En 1966, se formó el Comité Internacional de Taxonomía de Virus (ICTV). El sistema propuesto por Lwoff, Horne y Tournier inicialmente no fue aceptado por el ICTV porque el pequeño tamaño del genoma de los virus y su alta tasa de mutación dificultaban determinar su ascendencia más allá del orden. Como tal, el sistema de clasificación de Baltimore ha llegado a utilizarse para complementar la jerarquía más tradicional. [96] A partir de 2018, el ICTV comenzó a reconocer relaciones evolutivas más profundas entre los virus que se han descubierto con el tiempo y adoptó un sistema de clasificación de 15 rangos que van desde el reino hasta la especie. [97] Además, algunas especies dentro del mismo género se agrupan en un genogrupo . [98] [99]
Clasificación ICTV
El ICTV desarrolló el sistema de clasificación actual y redactó pautas que dan mayor importancia a ciertas propiedades de los virus para mantener la uniformidad familiar. Se ha establecido una taxonomía unificada (un sistema universal para clasificar los virus). [100] Solo se ha estudiado una pequeña parte de la diversidad total de virus. [101] En 2022, el ICTV ha definido 6 reinos, 10 reinos, 17 filos, 2 subfilos, 40 clases, 72 órdenes, 8 subórdenes, 264 familias, 182 subfamilias , 2818 géneros, 84 subgéneros y 11 273 especies de virus. [7]
A continuación se muestra la estructura taxonómica general de los rangos de taxones y los sufijos utilizados en los nombres taxonómicos. A partir de 2022, los rangos de subreino, subreino y subclase no se utilizan, mientras que todos los demás rangos están en uso. [7]
- Reino ( -viria )
Clasificación de Baltimore

El biólogo ganador del Premio Nobel David Baltimore ideó el sistema de clasificación de Baltimore . [102] [103] El sistema de clasificación ICTV se utiliza junto con el sistema de clasificación de Baltimore en la clasificación moderna de virus. [104] [105] [106]
La clasificación de Baltimore de los virus se basa en el mecanismo de producción del ARNm . Los virus deben generar ARNm a partir de sus genomas para producir proteínas y replicarse, pero se utilizan diferentes mecanismos para lograrlo en cada familia de virus. Los genomas virales pueden ser monocatenarios (ss) o bicatenarios (ds), de ARN o ADN, y pueden utilizar o no la transcriptasa inversa (RT). Además, los virus ssRNA pueden ser sentido (+) o antisentido (−). Esta clasificación coloca a los virus en siete grupos:
- I: virus dsADN (por ejemplo , adenovirus , herpesvirus , poxvirus )
- II: Virus ssDNA (ADN de cadena continua o "sentido") (p. ej . Parvovirus )
- III: Virus dsRNA (por ejemplo, reovirus )
- IV: (+)virus ssRNA (+ cadena o sentido) ARN (p. ej. , coronavirus , picornavirus , togavirus )
- V: Virus (−)ssRNA (de cadena − o antisentido) ARN (p. ej., ortomixovirus , rabdovirus )
- VI: Virus ssRNA-RT (+ cadena o sentido) ARN con ADN intermedio en el ciclo de vida (p. ej. Retrovirus )
- VII: Virus dsDNA-RT ADN con ARN intermedio en el ciclo de vida (p. ej. Hepadnavirus )
Papel en las enfermedades humanas

Entre los ejemplos de enfermedades humanas comunes causadas por virus se incluyen el resfriado común , la gripe , la varicela y el herpes labial . Muchas enfermedades graves, como la rabia , la enfermedad del virus del Ébola , el SIDA (VIH) , la gripe aviar y el SARS , son causadas por virus. La capacidad relativa de los virus para causar enfermedades se describe en términos de virulencia . Se están investigando otras enfermedades para descubrir si tienen un virus como agente causal, como la posible conexión entre el herpesvirus humano 6 (HHV6) y enfermedades neurológicas como la esclerosis múltiple y el síndrome de fatiga crónica . [108] Existe controversia sobre si el bornavirus , que anteriormente se creía que causaba enfermedades neurológicas en caballos, podría ser responsable de enfermedades psiquiátricas en humanos. [109]
Los virus tienen diferentes mecanismos por los cuales producen enfermedades en un organismo, lo que depende en gran medida de la especie viral. Los mecanismos a nivel celular incluyen principalmente la lisis celular, la ruptura y posterior muerte de la célula. En los organismos multicelulares , si mueren suficientes células, todo el organismo comenzará a sufrir los efectos. Aunque los virus causan la alteración de la homeostasis saludable , lo que resulta en enfermedad, pueden existir relativamente inofensivamente dentro de un organismo. Un ejemplo incluiría la capacidad del virus del herpes simple , que causa herpes labial, de permanecer en un estado latente dentro del cuerpo humano. Esto se llama latencia [110] y es una característica de los virus del herpes, incluido el virus de Epstein-Barr, que causa fiebre glandular, y el virus de la varicela zóster , que causa varicela y herpes zóster . La mayoría de las personas han sido infectadas con al menos uno de estos tipos de virus del herpes. [111] Estos virus latentes a veces pueden ser beneficiosos, ya que la presencia del virus puede aumentar la inmunidad contra patógenos bacterianos, como Yersinia pestis . [112]
Algunos virus pueden causar infecciones crónicas o de por vida , en las que los virus continúan replicándose en el cuerpo a pesar de los mecanismos de defensa del huésped. [113] Esto es común en las infecciones por el virus de la hepatitis B y el virus de la hepatitis C. Las personas infectadas crónicamente se conocen como portadores, ya que sirven como reservorios del virus infeccioso. [114] En poblaciones con una alta proporción de portadores, se dice que la enfermedad es endémica . [115]
Epidemiología
La epidemiología viral es la rama de la ciencia médica que estudia la transmisión y el control de las infecciones virales en los seres humanos. La transmisión de los virus puede ser vertical, es decir, de madre a hijo, u horizontal, es decir, de persona a persona. Entre los ejemplos de transmisión vertical se incluyen el virus de la hepatitis B y el VIH, en los que el bebé nace ya infectado con el virus. [116] Otro ejemplo, más raro, es el virus de la varicela zóster , que, aunque causa infecciones relativamente leves en niños y adultos, puede ser mortal para el feto y el recién nacido. [117]
La transmisión horizontal es el mecanismo más común de propagación de virus en poblaciones. [118] La transmisión horizontal puede ocurrir cuando se intercambian fluidos corporales durante la actividad sexual, por intercambio de saliva o cuando se ingieren alimentos o agua contaminados. También puede ocurrir cuando se inhalan aerosoles que contienen virus o por vectores de insectos , como cuando los mosquitos infectados penetran la piel de un huésped. [118] La mayoría de los tipos de virus se limitan a solo uno o dos de estos mecanismos y se los conoce como "virus respiratorios" o "virus entéricos", etc. La tasa o velocidad de transmisión de infecciones virales depende de factores que incluyen la densidad de población, el número de individuos susceptibles (es decir, aquellos que no son inmunes), [119] la calidad de la atención médica y el clima. [120]
La epidemiología se utiliza para romper la cadena de infección en las poblaciones durante los brotes de enfermedades virales . [13] : 264 Se utilizan medidas de control que se basan en el conocimiento de cómo se transmite el virus. Es importante encontrar la fuente o las fuentes del brote e identificar el virus. Una vez que se ha identificado el virus, la cadena de transmisión a veces se puede romper con vacunas. Cuando las vacunas no están disponibles, el saneamiento y la desinfección pueden ser eficaces. A menudo, las personas infectadas se aíslan del resto de la comunidad, y las que han estado expuestas al virus se ponen en cuarentena . [13] : 894 Para controlar el brote de fiebre aftosa en el ganado en Gran Bretaña en 2001, se sacrificaron miles de cabezas de ganado. [121] La mayoría de las infecciones virales de humanos y otros animales tienen períodos de incubación durante los cuales la infección no causa signos ni síntomas. [13] : 170 Los períodos de incubación de las enfermedades virales varían de unos pocos días a semanas, pero se conocen para la mayoría de las infecciones. [13] : 170–172 Un período de transmisibilidad, que se superpone un poco, pero que se produce principalmente después del período de incubación, es decir, un período en el que un individuo o animal infectado es contagioso y puede infectar a otra persona o animal. [13] : 170–172 Esto también se conoce en el caso de muchas infecciones virales, y el conocimiento de la duración de ambos períodos es importante para controlar los brotes. [13] : 272 Cuando los brotes causan una proporción inusualmente alta de casos en una población, comunidad o región, se denominan epidemias. Si los brotes se propagan por todo el mundo, se denominan pandemias . [13] : 891
Epidemias y pandemias

Una pandemia es una epidemia mundial . La pandemia de gripe de 1918 , que duró hasta 1919, fue una pandemia de influenza de categoría 5 causada por un virus de influenza A inusualmente grave y mortal. Las víctimas fueron a menudo adultos jóvenes sanos, en contraste con la mayoría de los brotes de influenza, que afectan predominantemente a pacientes jóvenes, ancianos o debilitados de otra manera. [26] : 409–415 Estimaciones más antiguas dicen que mató a 40-50 millones de personas, [122] mientras que investigaciones más recientes sugieren que puede haber matado hasta 100 millones de personas, o el 5% de la población mundial en 1918. [123]
Aunque las pandemias virales son eventos raros, el VIH, que evolucionó a partir de virus encontrados en monos y chimpancés, ha sido una pandemia desde al menos la década de 1980. [124] Durante el siglo XX hubo cuatro pandemias causadas por el virus de la influenza y las que ocurrieron en 1918, 1957 y 1968 fueron graves. [125] La mayoría de los investigadores creen que el VIH se originó en África subsahariana durante el siglo XX; [126] ahora es una pandemia, con un estimado de 37,9 millones de personas viviendo ahora con la enfermedad en todo el mundo. [127] Hubo alrededor de 770.000 muertes por SIDA en 2018. [128] El Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA (ONUSIDA) y la Organización Mundial de la Salud (OMS) estiman que el SIDA ha matado a más de 25 millones de personas desde que fue reconocido por primera vez el 5 de junio de 1981, lo que lo convierte en una de las epidemias más destructivas de la historia registrada. [129] En 2007 hubo 2,7 millones de nuevas infecciones por VIH y 2 millones de muertes relacionadas con el VIH. [130]
Varios patógenos virales altamente letales son miembros de Filoviridae . Los filovirus son virus similares a filamentos que causan fiebre hemorrágica viral , e incluyen ebolavirus y marburgvirus . El virus de Marburgo , descubierto por primera vez en 1967, atrajo la atención generalizada de la prensa en abril de 2005 por un brote en Angola . [131] La enfermedad del virus del Ébola también ha causado brotes intermitentes con altas tasas de mortalidad desde 1976, cuando se identificó por primera vez. El peor y más reciente es la epidemia de África occidental de 2013-2016 . [132]
A excepción de la viruela, la mayoría de las pandemias son causadas por virus de reciente evolución. Estos virus "emergentes" suelen ser mutantes de virus menos dañinos que han circulado previamente en humanos o en otros animales. [133]
El síndrome respiratorio agudo severo ( SARS ) y el síndrome respiratorio de Oriente Medio (MERS) son causados por nuevos tipos de coronavirus . Se sabe que otros coronavirus causan infecciones leves en humanos, [134] por lo que la virulencia y la rápida propagación de las infecciones por SARS (que en julio de 2003 habían causado alrededor de 8000 casos y 800 muertes) fue inesperada y la mayoría de los países no estaban preparados. [135]
Un coronavirus relacionado, el coronavirus 2 del síndrome respiratorio agudo severo (SARS-Cov-2) , que se cree que se originó en murciélagos, surgió en Wuhan , China, en noviembre de 2019 y se propagó rápidamente por todo el mundo. Las infecciones con el virus causaron la pandemia de COVID-19 que comenzó en 2020. [93] [136] [137] Se impusieron restricciones sin precedentes en tiempos de paz a los viajes internacionales, [138] y se impusieron toques de queda en varias ciudades importantes del mundo en respuesta a la pandemia. [139]
Cáncer
Los virus son una causa establecida de cáncer en humanos y otras especies. Los cánceres virales ocurren solo en una minoría de personas infectadas (o animales). Los virus del cáncer provienen de una variedad de familias de virus, incluidos los virus de ARN y ADN, y por lo tanto no hay un solo tipo de " oncovirus " (un término obsoleto utilizado originalmente para retrovirus de transformación aguda). El desarrollo del cáncer está determinado por una variedad de factores como la inmunidad del huésped [140] y mutaciones en el huésped. [141] Los virus aceptados como causantes de cánceres humanos incluyen algunos genotipos del virus del papiloma humano , el virus de la hepatitis B , el virus de la hepatitis C , el virus de Epstein-Barr , el herpesvirus asociado al sarcoma de Kaposi y el virus linfotrópico T humano . El virus del cáncer humano descubierto más recientemente es un poliomavirus ( poliomavirus de células de Merkel ) que causa la mayoría de los casos de una forma rara de cáncer de piel llamado carcinoma de células de Merkel . [142] Los virus de la hepatitis pueden convertirse en una infección viral crónica que conduce al cáncer de hígado . [143] [144] La infección por el virus linfotrópico T humano puede provocar paraparesia espástica tropical y leucemia de células T adultas . [145] Los virus del papiloma humano son una causa establecida de cánceres de cuello uterino , piel, ano y pene . [146] Dentro de Herpesviridae , el herpesvirus asociado al sarcoma de Kaposi causa el sarcoma de Kaposi y el linfoma de cavidad corporal , y el virus de Epstein-Barr causa el linfoma de Burkitt , el linfoma de Hodgkin , el trastorno linfoproliferativo B y el carcinoma nasofaríngeo . [147] El poliomavirus de células de Merkel está estrechamente relacionado con el SV40 y los poliomavirus de ratón que se han utilizado como modelos animales para virus del cáncer durante más de 50 años. [148]
Mecanismos de defensa del huésped
La primera línea de defensa del organismo contra los virus es el sistema inmunitario innato , que está formado por células y otros mecanismos que defienden al huésped de las infecciones de forma no específica. Esto significa que las células del sistema innato reconocen y responden a los patógenos de forma genérica, pero, a diferencia del sistema inmunitario adaptativo , no confieren inmunidad duradera o protectora al huésped. [149]
La interferencia del ARN es una importante defensa innata contra los virus. [150] Muchos virus tienen una estrategia de replicación que implica ARN de doble cadena (dsRNA). Cuando un virus de este tipo infecta una célula, libera su molécula o moléculas de ARN, que se unen inmediatamente a un complejo proteico llamado dicer que corta el ARN en pedazos más pequeños. Se activa una vía bioquímica (el complejo RISC ), que asegura la supervivencia celular al degradar el ARNm viral. Los rotavirus han evolucionado para evitar este mecanismo de defensa al no desenvolverse completamente dentro de la célula y liberar el ARNm recién producido a través de poros en la cápside interna de la partícula. Su dsRNA genómico permanece protegido dentro del núcleo del virión. [151] [152]
Cuando el sistema inmunitario adaptativo de un vertebrado se encuentra con un virus, produce anticuerpos específicos que se unen al virus y, a menudo, lo vuelven no infeccioso. Esto se llama inmunidad humoral . Hay dos tipos de anticuerpos importantes. El primero, llamado IgM , es muy eficaz para neutralizar los virus, pero las células del sistema inmunitario lo producen solo durante unas pocas semanas. El segundo, llamado IgG , se produce indefinidamente. La presencia de IgM en la sangre del huésped se utiliza para detectar una infección aguda, mientras que la IgG indica una infección en algún momento del pasado. [153] El anticuerpo IgG se mide cuando se realizan pruebas de inmunidad . [154]
Los anticuerpos pueden seguir siendo un mecanismo de defensa eficaz incluso después de que los virus hayan logrado entrar en la célula huésped. Una proteína presente en las células, llamada TRIM21 , puede unirse a los anticuerpos en la superficie de la partícula viral. Esto prepara la posterior destrucción del virus por las enzimas del sistema proteosomal de la célula. [155]

Una segunda defensa de los vertebrados contra los virus se denomina inmunidad mediada por células e implica a las células inmunes conocidas como células T. Las células del cuerpo muestran constantemente fragmentos cortos de sus proteínas en la superficie celular y, si una célula T reconoce un fragmento viral sospechoso allí, la célula huésped es destruida por las células "T asesinas" y las células T específicas del virus proliferan. Células como el macrófago son especialistas en esta presentación de antígenos . [156] La producción de interferón es un importante mecanismo de defensa del huésped. Se trata de una hormona producida por el cuerpo cuando hay virus. Su papel en la inmunidad es complejo; finalmente detiene la reproducción de los virus al matar la célula infectada y sus vecinas cercanas. [157]
No todas las infecciones virales producen una respuesta inmunitaria protectora de esta manera. El VIH evade el sistema inmunitario cambiando constantemente la secuencia de aminoácidos de las proteínas en la superficie del virión. Esto se conoce como "mutación de escape", ya que los epítopos virales escapan al reconocimiento por parte de la respuesta inmunitaria del huésped. Estos virus persistentes evaden el control inmunitario mediante secuestro, bloqueo de la presentación de antígenos , resistencia a las citocinas , evasión de las actividades de las células asesinas naturales , escape de la apoptosis y cambio antigénico . [158] Otros virus, llamados " virus neurotrópicos ", se diseminan por propagación neuronal donde el sistema inmunitario puede ser incapaz de alcanzarlos debido al privilegio inmunológico . [159]
Prevención y tratamiento
Dado que los virus utilizan vías metabólicas vitales dentro de las células huésped para replicarse, es difícil eliminarlos sin el uso de medicamentos que causan efectos tóxicos a las células huésped en general. Los enfoques médicos más eficaces para las enfermedades virales son las vacunas para proporcionar inmunidad a la infección y los medicamentos antivirales que interfieren selectivamente con la replicación viral.
Vacunas
La vacunación es una forma barata y eficaz de prevenir las infecciones por virus. Las vacunas se utilizaban para prevenir las infecciones virales mucho antes del descubrimiento de los virus reales. Su uso ha dado como resultado una disminución drástica de la morbilidad (enfermedad) y la mortalidad (muerte) asociadas con infecciones virales como la polio , el sarampión , las paperas y la rubéola . [160] Las infecciones de viruela han sido erradicadas. [161] Hay vacunas disponibles para prevenir más de trece infecciones virales de humanos, [162] y se utilizan más para prevenir infecciones virales de animales. [163] Las vacunas pueden consistir en virus vivos atenuados o muertos, proteínas virales ( antígenos ) o ARN . [164] [165] Las vacunas vivas contienen formas debilitadas del virus, que no causan la enfermedad pero, no obstante, confieren inmunidad. Estos virus se denominan atenuados. Las vacunas vivas pueden ser peligrosas cuando se administran a personas con una inmunidad débil (que se describen como inmunodeprimidas ), porque en estas personas, el virus debilitado puede causar la enfermedad original. [166] Se utilizan técnicas de biotecnología e ingeniería genética para producir vacunas de subunidades. Estas vacunas utilizan solo las proteínas de la cápside del virus. La vacuna contra la hepatitis B es un ejemplo de este tipo de vacuna. [167] Las vacunas de subunidades son seguras para los pacientes inmunodeprimidos porque no pueden causar la enfermedad. [168] La vacuna contra el virus de la fiebre amarilla , una cepa viva atenuada llamada 17D, es probablemente la vacuna más segura y eficaz jamás generada. [169]
Medicamentos antivirales
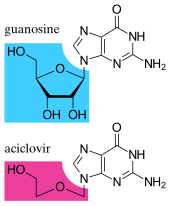
Los fármacos antivirales suelen ser análogos de nucleósidos (bloques de construcción de ADN falsos), que los virus incorporan por error a sus genomas durante la replicación. [170] El ciclo de vida del virus se detiene entonces porque el ADN recién sintetizado está inactivo. Esto se debe a que estos análogos carecen de los grupos hidroxilo , que, junto con los átomos de fósforo , se unen para formar la fuerte "columna vertebral" de la molécula de ADN. Esto se llama terminación de la cadena de ADN . [171] Ejemplos de análogos de nucleósidos son aciclovir para infecciones por virus del herpes simple y lamivudina para infecciones por VIH y virus de la hepatitis B. El aciclovir es uno de los fármacos antivirales más antiguos y más frecuentemente recetados. [172] Otros fármacos antivirales en uso se dirigen a diferentes etapas del ciclo de vida viral. El VIH depende de una enzima proteolítica llamada proteasa del VIH-1 para que se vuelva completamente infeccioso. Existe una gran clase de fármacos llamados inhibidores de la proteasa que inactivan esta enzima. [173] Existen alrededor de trece clases de medicamentos antivirales, cada uno de ellos dirigido a diferentes virus o etapas de replicación viral. [170]
La hepatitis C es causada por un virus ARN. En el 80% de las personas infectadas, la enfermedad es crónica y, sin tratamiento, la infección dura el resto de la vida. Existen tratamientos eficaces que utilizan antivirales de acción directa . [174] También se ha desarrollado el tratamiento de los portadores crónicos del virus de la hepatitis B utilizando estrategias similares que incluyen lamivudina y otros fármacos antivirales. [175]
Infección en otras especies
Los virus infectan toda la vida celular y, aunque los virus se encuentran en todo el mundo, cada especie celular tiene su propio rango específico que a menudo infecta sólo a esa especie. [6] : 3 Algunos virus, llamados satélites , pueden replicarse sólo dentro de células que ya han sido infectadas por otro virus. [30]
Virus animales
Los virus son patógenos importantes del ganado. Enfermedades como la fiebre aftosa y la lengua azul son causadas por virus. [176] Los animales de compañía como gatos, perros y caballos, si no están vacunados, son susceptibles a infecciones virales graves. El parvovirus canino es causado por un pequeño virus de ADN y las infecciones suelen ser fatales en las crías. [177] Como todos los invertebrados , la abeja melífera es susceptible a muchas infecciones virales. [178] La mayoría de los virus coexisten sin causar daño en su huésped y no causan signos ni síntomas de enfermedad. [6] : 4
Virus de plantas

Existen muchos tipos de virus de plantas, pero a menudo sólo causan una pérdida de rendimiento , y no es económicamente viable tratar de controlarlos. Los virus de plantas a menudo se propagan de planta a planta por organismos, conocidos como vectores . Estos suelen ser insectos, pero algunos hongos, gusanos nematodos , organismos unicelulares y plantas parásitas son vectores. [179] Cuando el control de las infecciones por virus de plantas se considera económico, para frutas perennes, por ejemplo, los esfuerzos se concentran en matar a los vectores y eliminar huéspedes alternativos como las malas hierbas. [13] : 802 Los virus de plantas no pueden infectar a los humanos y otros animales porque pueden reproducirse sólo en células vegetales vivas. [13] : 799–807
La papa, originaria de Perú, se ha convertido en un cultivo básico en todo el mundo. [180] El virus Y de la papa causa enfermedades en las papas y especies relacionadas, incluidos los tomates y los pimientos. En la década de 1980, este virus adquirió importancia económica cuando resultó difícil controlarlo en los cultivos de semilla de papa. Este virus, transmitido por pulgones , puede reducir el rendimiento de los cultivos hasta en un 80 por ciento, lo que causa pérdidas significativas en el rendimiento de la papa. [181]
Las plantas tienen mecanismos de defensa elaborados y efectivos contra los virus. Uno de los más efectivos es la presencia de los llamados genes de resistencia (R). Cada gen R confiere resistencia a un virus en particular al desencadenar áreas localizadas de muerte celular alrededor de la célula infectada, que a menudo se pueden ver a simple vista como manchas grandes. Esto impide que la infección se propague. [182] La interferencia del ARN también es una defensa eficaz en las plantas. [13] : 809 > Cuando se infectan, las plantas a menudo producen desinfectantes naturales que matan los virus, como el ácido salicílico , el óxido nítrico y las moléculas reactivas de oxígeno . [183]
Las partículas virales de plantas o partículas similares a virus (VLP) tienen aplicaciones tanto en biotecnología como en nanotecnología . Las cápsides de la mayoría de los virus de plantas son estructuras simples y robustas y pueden producirse en grandes cantidades ya sea por infección de plantas o por expresión en una variedad de sistemas heterólogos. Las partículas virales de plantas pueden modificarse genética y químicamente para encapsular material extraño y pueden incorporarse en estructuras supramoleculares para su uso en biotecnología. [184]
Virus bacterianos

Los bacteriófagos son un grupo común y diverso de virus y son la entidad biológica más abundante en los ambientes acuáticos: hay hasta diez veces más de estos virus en los océanos que bacterias, [185] alcanzando niveles de 250.000.000 de bacteriófagos por mililitro de agua de mar. [186] Estos virus infectan bacterias específicas uniéndose a moléculas receptoras de superficie y luego ingresando a la célula. En un corto período de tiempo, en algunos casos, solo minutos, la polimerasa bacteriana comienza a traducir el ARNm viral en proteínas. Estas proteínas se convierten en nuevos viriones dentro de la célula, proteínas auxiliares, que ayudan al ensamblaje de nuevos viriones, o proteínas involucradas en la lisis celular. Las enzimas virales ayudan en la descomposición de la membrana celular y, en el caso del fago T4 , en poco más de veinte minutos después de la inyección, se podrían liberar más de trescientos fagos. [13] : 834–835
La principal forma en que las bacterias se defienden de los bacteriófagos es mediante la producción de enzimas que destruyen el ADN extraño. Estas enzimas, llamadas endonucleasas de restricción , cortan el ADN viral que los bacteriófagos inyectan en las células bacterianas. [187] Las bacterias también contienen un sistema que utiliza secuencias CRISPR para retener fragmentos de los genomas de los virus con los que las bacterias han estado en contacto previamente, lo que les permite bloquear la replicación del virus a través de una forma de interferencia de ARN . [188] [189] Este sistema genético proporciona a las bacterias inmunidad adquirida a la infección. [190]
Algunos bacteriófagos se denominan " templados " porque causan infecciones latentes y no destruyen inmediatamente sus células huésped. En cambio, su ADN se incorpora al de la célula huésped como profago . Estas infecciones latentes se vuelven productivas cuando el ADN del profago se activa por estímulos como cambios en el medio ambiente. [191] Los intestinos de los animales, incluidos los humanos, contienen bacteriófagos templados, que se activan por diversos estímulos, incluidos los cambios en la dieta y los antibióticos. [192] Aunque se observaron por primera vez en bacteriófagos, se sabe que muchos otros virus forman provirus , incluido el VIH. [191] [193]
Virus arqueales
Algunos virus se replican dentro de las arqueas : estos son virus de ADN con formas inusuales y a veces únicas. [4] [55] Estos virus han sido estudiados con más detalle en las arqueas termófilas , particularmente en los órdenes Sulfolobales y Thermoproteales . [194] Las defensas contra estos virus involucran la interferencia de ARN de secuencias repetitivas de ADN dentro de los genomas de las arqueas que están relacionadas con los genes de los virus. [195] [196] La mayoría de las arqueas tienen sistemas CRISPR-Cas como defensa adaptativa contra los virus. Estos permiten que las arqueas retengan secciones de ADN viral, que luego se usan para atacar y eliminar infecciones posteriores por el virus usando un proceso similar a la interferencia de ARN. [197]
Papel en los ecosistemas acuáticos
Los virus son la entidad biológica más abundante en los ambientes acuáticos. [2] Hay alrededor de diez millones de ellos en una cucharadita de agua de mar. [198] La mayoría de estos virus son bacteriófagos que infectan bacterias heterotróficas y cianófagos que infectan cianobacterias y son esenciales para la regulación de los ecosistemas de agua salada y dulce. [199] Los bacteriófagos son inofensivos para las plantas y los animales, y son esenciales para la regulación de los ecosistemas marinos y de agua dulce . [200] son importantes agentes de mortalidad del fitoplancton , la base de la cadena alimentaria en ambientes acuáticos. [201] Infectan y destruyen bacterias en comunidades microbianas acuáticas, y son uno de los mecanismos más importantes de reciclaje del carbono y el ciclo de nutrientes en ambientes marinos. Las moléculas orgánicas liberadas de las células bacterianas muertas estimulan el crecimiento fresco de bacterias y algas, en un proceso conocido como derivación viral . [202] En particular, se ha demostrado que la lisis de bacterias por virus mejora el ciclo del nitrógeno y estimula el crecimiento del fitoplancton. [203] La actividad viral también puede afectar la bomba biológica , el proceso mediante el cual el carbono es secuestrado en las profundidades del océano. [204]
Los microorganismos constituyen más del 90% de la biomasa del mar. Se estima que los virus matan aproximadamente el 20% de esta biomasa cada día y que hay entre 10 y 15 veces más virus en los océanos que bacterias y arqueas. [205] Los virus también son agentes importantes responsables de la destrucción del fitoplancton , incluidas las floraciones de algas nocivas , [206] La cantidad de virus en los océanos disminuye a medida que se alejan de la costa y se adentran más en el agua, donde hay menos organismos hospedadores. [204]
En enero de 2018, los científicos informaron que 800 millones de virus, principalmente de origen marino, se depositan diariamente desde la atmósfera de la Tierra sobre cada metro cuadrado de la superficie del planeta, como resultado de una corriente atmosférica global de virus, que circula por encima del sistema meteorológico pero por debajo de la altitud de los viajes aéreos habituales, distribuyendo virus alrededor del planeta. [207] [208]
Como cualquier organismo, los mamíferos marinos son susceptibles a las infecciones virales. En 1988 y 2002, miles de focas comunes murieron en Europa a causa del virus del moquillo focino . [209] Muchos otros virus, incluidos los calicivirus , los herpesvirus , los adenovirus y los parvovirus , circulan en las poblaciones de mamíferos marinos. [204]
En diciembre de 2022, los científicos informaron sobre la primera observación de virovio a través de un experimento en agua de estanque que contenía clorovirus , que comúnmente infecta a las algas verdes en ambientes de agua dulce. Cuando se eliminaron todas las demás fuentes de alimento microbiano del agua, se observó que el ciliado Halteria había aumentado en número debido al consumo activo de clorovirus como fuente de alimento en lugar de su dieta bacterívora típica . [210] [211]
Papel en la evolución
Los virus son un medio natural importante para transferir genes entre diferentes especies, lo que aumenta la diversidad genética e impulsa la evolución. [9] [212] [213] Se cree que los virus desempeñaron un papel central en la evolución temprana, antes de la diversificación del último ancestro común universal en bacterias, arqueas y eucariotas. [214] Los virus siguen siendo uno de los mayores reservorios de diversidad genética inexplorada en la Tierra. [204]
Aplicaciones
Ciencias de la vida y medicina

Los virus son importantes para el estudio de la biología molecular y celular , ya que proporcionan sistemas simples que pueden usarse para manipular e investigar las funciones de las células. [26] : 8 El estudio y uso de virus han proporcionado información valiosa sobre aspectos de la biología celular. [215] Por ejemplo, los virus han sido útiles en el estudio de la genética y han ayudado a nuestra comprensión de los mecanismos básicos de la genética molecular , como la replicación del ADN , la transcripción , el procesamiento del ARN , la traducción , el transporte de proteínas y la inmunología .
Los genetistas suelen utilizar virus como vectores para introducir genes en las células que están estudiando. Esto es útil para hacer que la célula produzca una sustancia extraña o para estudiar el efecto de introducir un nuevo gen en el genoma. De manera similar, la viroterapia utiliza virus como vectores para tratar diversas enfermedades, ya que pueden dirigirse específicamente a las células y al ADN. Muestra un uso prometedor en el tratamiento del cáncer y en la terapia génica . Los científicos de Europa del Este han utilizado la terapia con fagos como una alternativa a los antibióticos durante algún tiempo, y el interés en este enfoque está aumentando, debido al alto nivel de resistencia a los antibióticos que ahora se encuentra en algunas bacterias patógenas. [216] La expresión de proteínas heterólogas por virus es la base de varios procesos de fabricación que se están utilizando actualmente para la producción de varias proteínas, como antígenos de vacunas y anticuerpos. Recientemente se han desarrollado procesos industriales utilizando vectores virales y varias proteínas farmacéuticas se encuentran actualmente en ensayos preclínicos y clínicos. [217]
Viroterapia
La viroterapia implica el uso de virus modificados genéticamente para tratar enfermedades. [218] Los científicos han modificado los virus para que se reproduzcan en células cancerosas y las destruyan, pero no infecten las células sanas. Talimogene laherparepvec (T-VEC), por ejemplo, es un virus del herpes simple modificado al que se le ha eliminado un gen, que es necesario para que los virus se repliquen en células sanas, y se lo ha reemplazado por un gen humano ( GM-CSF ) que estimula la inmunidad. Cuando este virus infecta las células cancerosas, las destruye y, al hacerlo, la presencia del gen GM-CSF atrae células dendríticas de los tejidos circundantes del cuerpo. Las células dendríticas procesan las células cancerosas muertas y presentan componentes de ellas a otras células del sistema inmunológico . [219] Tras completar con éxito los ensayos clínicos , el virus obtuvo la aprobación para el tratamiento del melanoma a finales de 2015. [220] Los virus que han sido reprogramados para matar células cancerosas se denominan virus oncolíticos . [221]
Ciencia de los materiales y nanotecnología
Desde el punto de vista de un científico de materiales, los virus pueden considerarse nanopartículas orgánicas . [222] Su superficie lleva herramientas específicas que les permiten cruzar las barreras de sus células anfitrionas. El tamaño y la forma de los virus y el número y la naturaleza de los grupos funcionales en su superficie están definidos con precisión. Como tal, los virus se utilizan comúnmente en la ciencia de los materiales como andamios para modificaciones de superficie enlazadas covalentemente. Una cualidad particular de los virus es que pueden adaptarse mediante evolución dirigida. Las poderosas técnicas desarrolladas por las ciencias de la vida se están convirtiendo en la base de los enfoques de ingeniería hacia los nanomateriales, abriendo una amplia gama de aplicaciones mucho más allá de la biología y la medicina. [223] Debido a su tamaño, forma y estructuras químicas bien definidas, los virus se han utilizado como plantillas para organizar materiales en la nanoescala. Los ejemplos incluyen el trabajo en el Laboratorio de Investigación Naval en Washington, DC, utilizando partículas del virus del mosaico del caupí (CPMV) para amplificar señales en sensores basados en microarrays de ADN . En esta aplicación, las partículas del virus separan los colorantes fluorescentes utilizados para la señalización para evitar la formación de dímeros no fluorescentes que actúan como extintores . [224] Otro ejemplo es el uso de CPMV como una placa de pruebas a nanoescala para la electrónica molecular. [225]
Virus sintéticos
Muchos virus pueden sintetizarse de novo ("desde cero"). El primer virus sintético se creó en 2002. [226] Aunque se trata de una idea un tanto errónea, no es el virus en sí lo que se sintetiza, sino su genoma de ADN (en el caso de un virus de ADN) o una copia de ADNc de su genoma (en el caso de los virus de ARN). Para muchas familias de virus, el ADN o ARN sintético desnudo (una vez convertido enzimáticamente a partir del ADNc sintético) es infeccioso cuando se introduce en una célula. Es decir, contiene toda la información necesaria para producir nuevos virus. Esta tecnología se está utilizando ahora para investigar nuevas estrategias de vacunas. [227] La capacidad de sintetizar virus tiene consecuencias de largo alcance, ya que los virus ya no pueden considerarse extintos, siempre que se conozca la información de su secuencia genómica y haya células permisivas disponibles. En junio de 2021, las secuencias genómicas completas de 11 464 virus diferentes, incluida la viruela, están disponibles públicamente en una base de datos en línea mantenida por los Institutos Nacionales de Salud . [228]
Armas
La capacidad de los virus para causar epidemias devastadoras en las sociedades humanas ha generado la preocupación de que los virus pudieran ser utilizados como armas para la guerra biológica . La recreación exitosa del infame virus de la influenza de 1918 en un laboratorio generó más preocupación . [229] El virus de la viruela devastó numerosas sociedades a lo largo de la historia antes de su erradicación. Solo hay dos centros en el mundo autorizados por la OMS para mantener reservas de virus de la viruela: el Centro Estatal de Investigación de Virología y Biotecnología VECTOR en Rusia y los Centros para el Control y la Prevención de Enfermedades en los Estados Unidos. [230] Puede usarse como arma, [230] como la vacuna contra la viruela a veces tenía efectos secundarios graves, ya no se usa rutinariamente en ningún país. Por lo tanto, gran parte de la población humana moderna casi no tiene resistencia establecida a la viruela y sería vulnerable al virus. [230]
Véase también
- Transmisión entre especies
- Glosario de virología
- Ley de virulencia decreciente : hipótesis refutada del epidemiólogo Theobald Smith
- Vida no celular
- Agente de transferencia genética
- Retrozima
- Los organismos más pequeños
- Teoría de la virulencia : teoría del biólogo Paul W. Ewald
- Metagenómica viral
- Viroplasm
- Zoonosis
Referencias
- ^ Wu KJ (15 de abril de 2020). «Hay más virus que estrellas en el universo. ¿Por qué solo algunos nos infectan? – Existen más de un cuatrillón de cuatrillones de virus individuales en la Tierra, pero la mayoría no están preparados para saltar a los humanos. ¿Podemos encontrar los que sí lo están?». National Geographic Society . Archivado desde el original el 15 de abril de 2020. Consultado el 18 de mayo de 2020 .
- ^ abc Koonin EV, Senkevich TG, Dolja VV (septiembre de 2006). "El antiguo mundo de los virus y la evolución de las células". Biology Direct . 1 (1): 29. doi : 10.1186/1745-6150-1-29 . PMC 1594570 . PMID 16984643.
- ^ Zimmer C (26 de febrero de 2021). «La vida secreta de un coronavirus: una burbuja aceitosa de genes de 100 nanómetros de ancho ha matado a más de dos millones de personas y ha transformado el mundo. Los científicos no saben muy bien qué hacer con ella». The New York Times . Archivado desde el original el 28 de diciembre de 2021. Consultado el 28 de febrero de 2021 .
- ^ ab Lawrence CM, Menon S, Eilers BJ, Bothner B, Khayat R, Douglas T, et al. (mayo de 2009). "Estudios estructurales y funcionales de virus arqueales". The Journal of Biological Chemistry . 284 (19): 12599–603. doi : 10.1074/jbc.R800078200 . PMC 2675988 . PMID 19158076.
- ^ Edwards RA, Rohwer F (junio de 2005). "Metagenómica viral". Nature Reviews. Microbiology . 3 (6): 504–10. doi :10.1038/nrmicro1163. PMID 15886693. S2CID 8059643.
- ^ abcdefghijklmn Dimmock NJ, Easton AJ, Leppard K (2007). Introducción a la virología moderna (sexta edición). Blackwell Publishing. ISBN 978-1-4051-3645-7.
- ^ abc "Taxonomía de virus: versión 2022". talk.ictvonline.org . Comité Internacional de Taxonomía de Virus . Consultado el 27 de abril de 2023 .
- ^ ab Breitbart M , Rohwer F (junio de 2005). "Aquí un virus, allí un virus, en todas partes el mismo virus?". Trends in Microbiology . 13 (6): 278–84. doi :10.1016/j.tim.2005.04.003. PMID 15936660.
- ^ ab Canchaya C, Fournous G, Chibani-Chennoufi S, Dillmann ML, Brüssow H (agosto de 2003). "Los fagos como agentes de transferencia lateral de genes". Current Opinion in Microbiology . 6 (4): 417–24. doi :10.1016/S1369-5274(03)00086-9. PMID 12941415.
- ^ ab Rybicki EP (1990). "La clasificación de organismos al borde de la vida, o problemas con la sistemática de los virus". Revista Sudafricana de Ciencias . 86 : 182–86.
- ^ ab Koonin EV, Starokadomskyy P (octubre de 2016). "¿Están vivos los virus? El paradigma del replicador arroja luz decisiva sobre una pregunta antigua pero equivocada". Estudios en Historia y Filosofía de las Ciencias Biológicas y Biomédicas . 59 : 125–34. doi :10.1016/j.shpsc.2016.02.016. PMC 5406846. PMID 26965225 .
- ^ Robilotti E, Deresinski S, Pinsky BA (enero de 2015). "Norovirus". Clinical Microbiology Reviews . 28 (1): 134–64. doi :10.1128/CMR.00075-14. PMC 4284304 . PMID 25567225.
- ^ abcdefghijklmnopqrs Shors T (2017). Entender los virus . Jones and Bartlett Publishers. ISBN 978-1-284-02592-7.
- ^ "Virus, n.", OED Online . Oxford University Press. Marzo de 2015.
- ^ ab Harper D (2011). "virus". Diccionario Etimológico en Línea . Consultado el 19 de diciembre de 2014 .
- ^ "Virulento, adj." OED Online . Oxford University Press. Marzo de 2015.
- ^ Harper D (2011). "virulento". Diccionario etimológico en línea . Consultado el 19 de diciembre de 2014 .
- ^ Buschard K, Thon R (2003). "Modelos animales diabéticos". En Hau J, Van Hoosier Jr GL (eds.). Manual de ciencia animal de laboratorio . Modelos animales. Vol. II (2.ª ed.). CRC Press. págs. 163, 166.
- ^ William T. Stearn: latín botánico. Historia, Gramática, Sintaxis, Terminología y Vocabulario. David & Charles, 3ª ed., 1983. Cita: "Virus: virus (sn II), gen. sing. viri, nom. pl. vira, gen. pl. vīrorum (para distinguirlo de virorum , de los hombres)".
- ^ Harper D (2011). "viral". Diccionario etimológico en línea . Consultado el 19 de diciembre de 2014 .
- ^ Harper D (2011). "virión". Diccionario etimológico en línea . Consultado el 19 de diciembre de 2014 .
- ^ Casjens S (2010). Mahy BW, Van Regenmortel MH (eds.). Enciclopedia de escritorio de virología general . Boston: Academic Press. pág. 167. ISBN 978-0-12-375146-1.
- ^ Iyer LM, Balaji S, Koonin EV, Aravind L (abril de 2006). "Genómica evolutiva de virus de ADN grande nucleocitoplasmáticos". Virus Research . 117 (1): 156–84. doi :10.1016/j.virusres.2006.01.009. PMID 16494962.
- ^ ab Sanjuán R, Nebot MR, Chirico N, Mansky LM, Belshaw R (octubre de 2010). "Tasas de mutación viral". Revista de Virología . 84 (19): 9733–9748. doi :10.1128/JVI.00694-10. PMC 2937809 . PMID 20660197.
- ^ Krupovic M, Dolja VV, Koonin EV (julio de 2019). "Origen de los virus: replicadores primordiales que reclutan cápsides de los hospedadores" (PDF) . Nature Reviews. Microbiology . 17 (7): 449–58. doi :10.1038/s41579-019-0205-6. PMID 31142823. S2CID 256744818.
- ^ abcdefghijklmnopqrstu Collier L, Balows A, Sussman M (1998). Mahy B, Collier LA (eds.). Microbiología e infecciones microbianas de Topley y Wilson . Virología. Vol. 1 (novena edición). ISBN 0-340-66316-2.
- ^ abcdefgh Mahy WJ, Regenmortel MH, eds. (2009). Enciclopedia de escritorio de virología general . Oxford: Academic Press. ISBN 978-0-12-375146-1.
- ^ McClintock B (junio de 1950). "El origen y comportamiento de los loci mutables en el maíz". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 36 (6): 344–55. Bibcode :1950PNAS...36..344M. doi : 10.1073/pnas.36.6.344 . PMC 1063197 . PMID 15430309.
- ^ Tsagris EM, Martínez de Alba AE, Gozmanova M, Kalantidis K (noviembre de 2008). "Viroides". Microbiología Celular . 10 (11): 2168–79. doi : 10.1111/j.1462-5822.2008.01231.x . PMID 18764915. S2CID 221581424.
- ^ ab La Scola B, Desnues C, Pagnier I, Robert C, Barrassi L, Fournous G, et al. (Septiembre de 2008). "El virófago como parásito único del mimivirus gigante". Naturaleza . 455 (7209): 100–04. Código Bib :2008Natur.455..100L. doi : 10.1038/naturaleza07218. PMID 18690211. S2CID 4422249.
- ^ Dimmock págs. 15-16
- ^ Zerbini FM, Kitajima EW (septiembre de 2022). "De Contagium vivum fluidum a Riboviria: una historia de la taxonomía de virus centrada en el virus del mosaico del tabaco". Biomoléculas . 12 (10): 1363. doi : 10.3390/biom12101363 . PMC 9599303 . PMID 36291572.
- ^ Holmes EC (octubre de 2007). "Evolución viral en la era genómica". PLOS Biology . 5 (10): e278. doi : 10.1371/journal.pbio.0050278 . PMC 1994994 . PMID 17914905.
- ^ Wimmer E, Mueller S, Tumpey TM, Taubenberger JK (diciembre de 2009). "Virus sintéticos: una nueva oportunidad para comprender y prevenir enfermedades virales". Nature Biotechnology . 27 (12): 1163–72. doi :10.1038/nbt.1593. PMC 2819212 . PMID 20010599.
- ^ Horn M (2008). "Clamidias como simbiontes en eucariotas". Revisión anual de microbiología . 62 : 113–31. doi :10.1146/annurev.micro.62.081307.162818. PMID 18473699.
- ^ Ammerman NC, Beier-Sexton M, Azad AF (noviembre de 2008). "Mantenimiento de laboratorio de Rickettsia rickettsii". Protocolos actuales en microbiología . 11 (1): 3A.5.1–3A.5.21. doi :10.1002/9780471729259.mc03a05s11. ISBN 978-0471729259. PMC 2725428 . PMID 19016440.
- ^ Forterre, P. El concepto de virocélula y la microbiología ambiental. ISME J 7, 233–236 (2013). https://doi.org/10.1038/ismej.2012.110
- ^ DeLong JP, Al-Sammak MA, Al-Ameeli ZT, Dunigan DD, Edwards KF, Fuhrmann JJ, et al. (febrero de 2022). "Hacia una visión integradora de los fenotipos virales". Nature Reviews. Microbiología . 20 (2): 83–94. doi :10.1038/s41579-021-00612-w. PMID 34522049.
- ^ Krasner R (2014). El desafío microbiano: una perspectiva de salud pública . Burlington, Mass: Jones & Bartlett Learning. ISBN 978-1-4496-7375-8.OCLC 794228026 .
- ^ Kiselev NA, Sherman MB, Tsuprun VL (1990). "Tinción negativa de proteínas". Electron Microscopy Reviews . 3 (1): 43–72. doi :10.1016/0892-0354(90)90013-I. PMID 1715774.
- ^ Caspar DL, Klug A (1962). "Principios físicos en la construcción de virus regulares". Simposios de Cold Spring Harbor sobre biología cuantitativa . 27 : 1–24. doi :10.1101/sqb.1962.027.001.005. PMID 14019094.
- ^ Crick FH, Watson JD (marzo de 1956). "Estructura de virus pequeños". Nature . 177 (4506): 473–75. Código Bibliográfico :1956Natur.177..473C. doi :10.1038/177473a0. PMID 13309339. S2CID 5740221.
- ^ Falvo MR, Washburn S, Superfine R, Finch M, Brooks FP, Chi V, et al. (marzo de 1997). "Manipulación de virus individuales: fricción y propiedades mecánicas". Revista biofísica . 72 (3): 1396–403. Código Bibliográfico :1997BpJ....72.1396F. doi :10.1016/S0006-3495(97)78786-1. PMC 1184522 . PMID 9138585.
- ^ Kuznetsov YG, Malkin AJ, Lucas RW, Plomp M, McPherson A (septiembre de 2001). "Obtención de imágenes de virus mediante microscopía de fuerza atómica". The Journal of General Virology . 82 (Pt 9): 2025–34. doi : 10.1099/0022-1317-82-9-2025 . PMID 11514711.
- ^ Straus SK, Bo HE (2018). "Proteínas y ensamblaje de bacteriófagos filamentosos". Complejos de proteínas y nucleoproteínas virales . Bioquímica subcelular. Vol. 88. págs. 261–79. doi :10.1007/978-981-10-8456-0_12. ISBN 978-981-10-8455-3. Número de identificación personal 29900501.
- ^ Wilson DP (2016). "Las características salientes de las cápsides virales se agrupan en grandes círculos icosaédricos". PLOS ONE . 11 (4): e0152319. Bibcode :2016PLoSO..1152319W. doi : 10.1371/journal.pone.0152319 . PMC 4821576 . PMID 27045511.
- ^ Casens S (2009). Enciclopedia de escritorio de virología general . Boston: Academic Press. págs. 167–74. ISBN. 978-0-12-375146-1.
- ^ Dhama K, Khan S, Tiwari R, Sircar S, Bhat S, Malik YS, et al. (septiembre de 2020). "Enfermedad por coronavirus 2019-COVID-19". Reseñas de microbiología clínica . 33 (4). doi :10.1128/CMR.00028-20. PMC 7405836 . PMID 32580969.
- ^ Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG (abril de 2004). "La máquina de inyección de ADN del bacteriófago T4". Current Opinion in Structural Biology . 14 (2): 171–80. doi :10.1016/j.sbi.2004.02.001. PMID 15093831.
- ^ Long GW, Nobel J, Murphy FA, Herrmann KL, Lourie B (septiembre de 1970). "Experiencia con microscopía electrónica en el diagnóstico diferencial de la viruela". Applied Microbiology . 20 (3): 497–504. doi :10.1128/AEM.20.3.497-504.1970. PMC 376966 . PMID 4322005.
- ^ Suzan-Monti M, La Scola B, Raoult D (abril de 2006). "Aspectos genómicos y evolutivos de Mimivirus". Virus Research . 117 (1): 145–55. doi :10.1016/j.virusres.2005.07.011. PMID 16181700.
- ^ Arslan D, Legendre M, Seltzer V, Abergel C, Claverie JM (octubre de 2011). "Un pariente lejano de Mimivirus con un genoma más grande destaca las características fundamentales de Megaviridae". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (42): 17486–91. Bibcode :2011PNAS..10817486A. doi : 10.1073/pnas.1110889108 . PMC 3198346 . PMID 21987820.
- ^ ab Philippe N, Legendre M, Doutre G, Couté Y, Poirot O, Lescot M, et al. (julio de 2013). "Pandoravirus: virus de ameba con genomas de hasta 2,5 Mb que alcanzan el de los eucariotas parásitos" (PDF) . Science . 341 (6143): 281–86. Bibcode :2013Sci...341..281P. doi :10.1126/science.1239181. PMID 23869018. S2CID 16877147.
- ^ Brandes N, Linial M (abril de 2019). "Virus gigantes: grandes sorpresas". Viruses . 11 (5): 404. doi : 10.3390/v11050404 . PMC 6563228 . PMID 31052218.
- ^ ab Prangishvili D, Forterre P, Garrett RA (noviembre de 2006). "Virus de las arqueas: una visión unificadora". Nature Reviews. Microbiología . 4 (11): 837–48. doi :10.1038/nrmicro1527. PMID 17041631. S2CID 9915859.
- ^ "Base de datos del genoma viral del NCBI". ncbi.nlm.nih.gov . Consultado el 15 de enero de 2017 .
- ^ Pennisi E (marzo de 2011). "Microbiología. La viralidad: exploración del papel de los virus en nuestros cuerpos". Science . 331 (6024): 1513. Bibcode :2011Sci...331.1513P. doi :10.1126/science.331.6024.1513. PMID 21436418.
- ^ Shi M, Lin XD, Tian JH, Chen LJ, Chen X, Li CX, et al. (diciembre de 2016). "Redefiniendo la virosfera del ARN de los invertebrados". Nature . 540 (7634): 539–43. Bibcode :2016Natur.540..539S. doi :10.1038/nature20167. PMID 27880757. S2CID 1198891.
- ^ Saunders VA, Carter J (2007). Virología: principios y aplicaciones . Chichester: John Wiley & Sons. pág. 72. ISBN 978-0-470-02387-7.
- ^ Belyi VA, Levine AJ, Skalka AM (diciembre de 2010). "Secuencias de virus de ADN monocatenario ancestrales en genomas de vertebrados: los parvoviridae y circoviridae tienen más de 40 a 50 millones de años". Journal of Virology . 84 (23): 12458–62. doi :10.1128/JVI.01789-10. PMC 2976387 . PMID 20861255.
- ^ Brandes N, Linial M (mayo de 2016). "Superposición de genes y restricciones de tamaño en el mundo viral". Biology Direct . 11 (1): 26. doi : 10.1186/s13062-016-0128-3 . PMC 4875738 . PMID 27209091.
- ^ Pressing J, Reanney DC (1984). "Genomas divididos y ruido intrínseco". Journal of Molecular Evolution . 20 (2): 135–46. Código Bibliográfico :1984JMolE..20..135P. doi :10.1007/BF02257374. PMC 7087551 . PMID 6433032.
- ^ Duffy S, Holmes EC (junio de 2009). "Validación de altas tasas de sustitución de nucleótidos en geminivirus: evidencia filogenética de virus del mosaico de la mandioca de África oriental". The Journal of General Virology . 90 (Pt 6): 1539–47. doi :10.1099/vir.0.009266-0. PMC 4091138 . PMID 19264617.
- ^ Sandbulte MR, Westgeest KB, Gao J, Xu X, Klimov AI, Russell CA, et al. (diciembre de 2011). "Deriva antigénica discordante de la neuraminidasa y la hemaglutinina en los virus de la influenza H1N1 y H3N2". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (51): 20748–53. Bibcode :2011PNAS..10820748S. doi : 10.1073/pnas.1113801108 . PMC 3251064 . PMID 22143798.
- ^ Moss RB, Davey RT, Steigbigel RT, Fang F (junio de 2010). "Abordar la gripe pandémica: una introducción a los antivirales contra la gripe y la resistencia a los fármacos". The Journal of Antimicrobial Chemotherapy . 65 (6): 1086–93. doi : 10.1093/jac/dkq100 . PMID 20375034.
- ^ Hampson AW, Mackenzie JS (noviembre de 2006). "Los virus de la gripe". The Medical Journal of Australia . 185 (S10): S39–43. doi :10.5694/j.1326-5377.2006.tb00705.x. PMID 17115950. S2CID 17069567.
- ^ Metzner KJ (diciembre de 2006). "Detección y significado de cuasiespecies minoritarias del VIH-1 resistente a fármacos". Journal of HIV Therapy . 11 (4): 74–81. PMID 17578210.
- ^ Goudsmit, Jaap. Sexo viral . Prensa de la Universidad de Oxford, 1998. ISBN 978-0-19-512496-5
- ^ Worobey M, Holmes EC (octubre de 1999). "Aspectos evolutivos de la recombinación en virus ARN". The Journal of General Virology . 80 (10): 2535–43. doi : 10.1099/0022-1317-80-10-2535 . PMID 10573145.
- ^ Lukashev AN (2005). "El papel de la recombinación en la evolución de los enterovirus". Reseñas en virología médica . 15 (3): 157–67. doi :10.1002/rmv.457. PMID 15578739. S2CID 26000112.
- ^ Umene K (julio de 1999). "Mecanismo y aplicación de la recombinación genética en los herpesvirus". Reseñas en virología médica . 9 (3): 171–82. doi :10.1002/(SICI)1099-1654(199907/09)9:3<171::AID-RMV243>3.0.CO;2-A. PMID 10479778. S2CID 43110533.
- ^ Su S, Wong G, Shi W, Liu J, Lai AC, Zhou J, et al. (junio de 2016). "Epidemiología, recombinación genética y patogénesis de los coronavirus". Tendencias en microbiología . 24 (6): 490–502. doi :10.1016/j.tim.2016.03.003. PMC 7125511 . PMID 27012512.
- ^ Barr JN, Fearns R (junio de 2010). "Cómo los virus de ARN mantienen la integridad de su genoma". The Journal of General Virology . 91 (Pt 6): 1373–87. doi :10.1099/vir.0.020818-0. PMID 20335491.
- ^ Freed EO (agosto de 2015). "Ensamblaje, liberación y maduración del VIH-1". Nature Reviews. Microbiology . 13 (8): 484–96. doi :10.1038/nrmicro3490. PMC 6936268 . PMID 26119571.
- ^ Yin J, Redovich J (junio de 2018). "Modelado cinético del crecimiento de virus en células". Microbiology and Molecular Biology Reviews . 82 (2). doi :10.1128/MMBR.00066-17. PMC 5968458 . PMID 29592895.
- ^ Más V, Melero JA (2013). "Entrada de virus con envoltura en células huésped: fusión de membranas". Estructura y física de los virus . Bioquímica subcelular. Vol. 68. pp. 467–87. doi :10.1007/978-94-007-6552-8_16. ISBN 978-94-007-6551-1. PMC 7121288 . PMID 23737062.
- ^ Boevink P, Oparka KJ (agosto de 2005). "Interacciones virus-huésped durante los procesos de movimiento". Fisiología vegetal . 138 (4): 1815–21. doi :10.1104/pp.105.066761. PMC 1183373 . PMID 16172094.
- ^ Blaas D (mayo de 2016). "Vías de entrada viral: el ejemplo de los virus del resfriado común". Wiener Medizinische Wochenschrift . 166 (7–8): 211–26. doi :10.1007/s10354-016-0461-2. PMC 4871925 . PMID 27174165.
- ^ Isomura H, Stinski MF (febrero de 2013). "Coordinación de la transcripción tardía de genes del citomegalovirus humano con la síntesis de ADN viral: virus recombinantes como posibles candidatos a vacunas terapéuticas". Opinión de expertos sobre objetivos terapéuticos . 17 (2): 157–66. doi :10.1517/14728222.2013.740460. PMID 23231449. S2CID 11448687.
- ^ Barman S, Ali A, Hui EK, Adhikary L, Nayak DP (septiembre de 2001). "Transporte de proteínas virales a las membranas apicales e interacción de la proteína de la matriz con glicoproteínas en el ensamblaje de virus de la influenza". Virus Research . 77 (1): 61–69. doi :10.1016/S0168-1702(01)00266-0. PMID 11451488.
- ^ Staginnus C, Richert-Pöggeler KR (octubre de 2006). "Pararetrovirus endógenos: viajeros de dos caras en el genoma de las plantas". Tendencias en la ciencia de las plantas . 11 (10): 485–91. Bibcode :2006TPS....11..485S. doi :10.1016/j.tplants.2006.08.008. PMID 16949329.
- ^ Roulston A, Marcellus RC, Branton PE (1999). "Virus y apoptosis". Revisión anual de microbiología . 53 : 577–628. doi :10.1146/annurev.micro.53.1.577. PMID 10547702.
- ^ Alwine JC (2008). "Modulación de las respuestas de estrés de las células huésped por el citomegalovirus humano". Citomegalovirus humano . Temas actuales en microbiología e inmunología. Vol. 325. págs. 263–79. doi :10.1007/978-3-540-77349-8_15. ISBN 978-3-540-77348-1. Número de identificación personal 18637511.
- ^ Barozzi P, Potenza L, Riva G, Vallerini D, Quadrelli C, Bosco R, et al. (Diciembre de 2007). "Células B y herpesvirus: un modelo de linfoproliferación". Reseñas de autoinmunidad . 7 (2): 132–36. doi :10.1016/j.autrev.2007.02.018. PMID 18035323.
- ^ Subramanya D, Grivas PD (noviembre de 2008). "VPH y cáncer de cuello uterino: actualizaciones sobre una relación establecida". Medicina de posgrado . 120 (4): 7–13. doi :10.3810/pgm.2008.11.1928. PMID 19020360. S2CID 1399003.
- ^ Sinclair J (marzo de 2008). "Citomegalovirus humano: latencia y reactivación en el linaje mieloide". Journal of Clinical Virology . 41 (3): 180–85. doi :10.1016/j.jcv.2007.11.014. PMID 18164651.
- ^ Jordan MC, Jordan GW, Stevens JG, Miller G (junio de 1984). "Virus herpes latentes en humanos". Anales de Medicina Interna . 100 (6): 866–80. doi :10.7326/0003-4819-100-6-866. PMID 6326635.
- ^ Sissons JG, Bain M, Wills MR (febrero de 2002). "Latencia y reactivación del citomegalovirus humano". The Journal of Infection . 44 (2): 73–77. doi :10.1053/jinf.2001.0948. PMID 12076064.
- ^ Crawford DH (2011). "Capítulo 2: Los virus están en todas partes". Virus: una introducción muy breve . Oxford University Press, EE. UU., pág. 16. ISBN 978-0-19-957485-8.
- ^ Baggesen DL, Sørensen G, Nielsen EM, Wegener HC (enero de 2010). "Phage typhimurium: ¿sigue siendo una herramienta útil para la vigilancia y la investigación de brotes?". Euro Surveillance . 15 (4): 19471. PMID 20122382 . Consultado el 19 de diciembre de 2014 .
- ^ Parker MT (septiembre de 2016). "Un marco ecológico del viroma humano proporciona una clasificación del conocimiento actual e identifica áreas de descubrimiento futuro". The Yale Journal of Biology and Medicine . 89 (3): 339–51. PMC 5045143 . PMID 27698618.
- ^ Woolhouse M, Scott F, Hudson Z, Howey R, Chase-Topping M (octubre de 2012). "Virus humanos: descubrimiento y emergencia". Philosophical Transactions of the Royal Society of London. Serie B, Ciencias Biológicas . 367 (1604): 2864–71. doi :10.1098/rstb.2011.0354. PMC 3427559 . PMID 22966141.
- ^ ab Ashour HM, Elkhatib WF, Rahman MM, Elshabrawy HA (marzo de 2020). "Información sobre el reciente nuevo coronavirus de 2019 (SARS-CoV-2) a la luz de brotes pasados de coronavirus humano". Patógenos . 9 (3): 186. doi : 10.3390/patógenos9030186 . PMC 7157630 . PMID 32143502.
- ^ Lwoff A, Horne RW, Tournier P (junio de 1962). "[Un sistema de virus]". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (en francés). 254 : 4225–27. PMID 14467544.
- ^ Lwoff A, Horne R, Tournier P (1962). "Un sistema de virus". Simposios de Cold Spring Harbor sobre biología cuantitativa . 27 : 51–55. doi :10.1101/sqb.1962.027.001.008. PMID 13931895.
- ^ Fauquet CM, Fargette D (agosto de 2005). "Comité internacional sobre taxonomía de virus y las 3.142 especies no asignadas". Virology Journal . 2 : 64. doi : 10.1186/1743-422X-2-64 . PMC 1208960 . PMID 16105179.
- ^ Comité Ejecutivo del Comité Internacional de Taxonomía de Virus (mayo de 2020). "El nuevo alcance de la taxonomía de virus: división de la virosfera en 15 rangos jerárquicos". Nat Microbiol . 5 (5): 668–74. doi :10.1038/s41564-020-0709-x. PMC 7186216 . PMID 32341570.
- ^ Khan MK, Alam MM (julio de 2021). "Brotes de gastroenteritis por norovirus, diversidad genómica y evolución: una descripción general". Revista médica Mymensingh . 30 (3): 863–73. PMID 34226482.
- ^ Eberle J, Gürtler L (2012). "Tipos, grupos, subtipos y formas recombinantes del VIH: errores en la replicación, presión de selección y cuasiespecies". Intervirology . 55 (2): 79–83. doi :10.1159/000331993. PMID 22286874. S2CID 5642060.
- ^ Comité Ejecutivo del Comité Internacional de Taxonomía de Virus (mayo de 2020). "El nuevo alcance de la taxonomía de virus: dividiendo la virosfera en 15 rangos jerárquicos". Nature Microbiology . 5 (5): 668–674. doi :10.1038/s41564-020-0709-x. PMC 7186216 . PMID 32341570.
- ^ Delwart EL (2007). "Metagenómica viral". Reseñas en virología médica . 17 (2): 115–131. doi : 10.1002/rmv.532. PMC 7169062. PMID 17295196.
- ^ Temin HM, Baltimore D (1972). "Síntesis de ADN dirigida por ARN y virus tumorales de ARN". Avances en la investigación de virus . 17 : 129–86. doi :10.1016/S0065-3527(08)60749-6. ISBN 978-0120398171. Número PMID 4348509.
- ^ Baltimore D (1974). "La estrategia de los virus ARN". Harvey Lectures . Serie 70. Serie 70: 57–74. PMID 4377923.
- ^ van Regenmortel MH, Mahy BW (enero de 2004). "Problemas emergentes en la taxonomía de virus". Enfermedades infecciosas emergentes . 10 (1): 8–13. doi :10.3201/eid1001.030279. PMC 3322749 . PMID 15078590.
- ^ Mayo MA (1999). "Desarrollos en la taxonomía de virus de plantas desde la publicación del 6º Informe del ICTV. Comité Internacional de Taxonomía de Virus". Archivos de Virología . 144 (8): 1659–66. doi : 10.1007/s007050050620 . PMID 10486120. S2CID 33422303.
- ^ de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (junio de 2004). "Clasificación de los virus del papiloma". Virología . 324 (1): 17–27. doi :10.1016/j.virol.2004.03.033. PMID 15183049.
- ^ Fisher B, Harvey RP, Champe PC (2007). "Capítulo 33 (Resúmenes de enfermedades)". Reseñas ilustradas de Lippincott: microbiología . Serie de reseñas ilustradas de Lippincott. Hagerstwon, MD: Lippincott Williams & Wilkins. págs. 367–392. ISBN 978-0-7817-8215-9.
- ^ Komaroff AL (diciembre de 2006). "¿Es el virus del herpes humano-6 un desencadenante del síndrome de fatiga crónica?". Journal of Clinical Virology . 37 (Supl 1): S39–46. doi :10.1016/S1386-6532(06)70010-5. PMID 17276367.
- ^ Chen CH, Chiu YL, Wei FC, Koong FJ, Liu HC, Shaw CK, et al. (enero de 1999). "Alta seroprevalencia de la infección por el virus Borna en pacientes esquizofrénicos, familiares y trabajadores de la salud mental en Taiwán". Psiquiatría molecular . 4 (1): 33–38. doi : 10.1038/sj.mp.4000484 . PMID 10089006. S2CID 19830976.
- ^ Margolis TP, Elfman FL, Leib D, Pakpour N, Apakupakul K, Imai Y, et al. (octubre de 2007). "Reactivación espontánea del virus del herpes simple tipo 1 en ganglios sensoriales murinos infectados de forma latente". Journal of Virology . 81 (20): 11069–74. doi :10.1128/JVI.00243-07. PMC 2045564 . PMID 17686862.
- ^ Whitley RJ, Roizman B (mayo de 2001). "Infecciones por el virus del herpes simple". Lancet . 357 (9267): 1513–18. doi :10.1016/S0140-6736(00)04638-9. PMID 11377626. S2CID 9854903.
- ^ Barton ES, White DW, Cathelyn JS, Brett-McClellan KA, Engle M, Diamond MS, et al. (mayo de 2007). "La latencia del virus del herpes confiere protección simbiótica frente a la infección bacteriana". Nature . 447 (7142): 326–29. Bibcode :2007Natur.447..326B. doi :10.1038/nature05762. PMID 17507983. S2CID 4425405.
- ^ Bertoletti A, Gehring A (octubre de 2007). "Respuesta inmunitaria y tolerancia durante la infección crónica por el virus de la hepatitis B". Hepatology Research . 37 (Supl 3): S331–38. doi :10.1111/j.1872-034X.2007.00221.x. PMID 17931183. S2CID 13386004.
- ^ Rodrigues C, Deshmukh M, Jacob T, Nukala R, Menon S, Mehta A (2001). "Importancia del ADN del VHB por PCR sobre los marcadores serológicos del VHB en pacientes agudos y crónicos". Indian Journal of Medical Microbiology . 19 (3): 141–44. PMID 17664817.
- ^ Nguyen VT, McLaws ML, Dore GJ (diciembre de 2007). "Infección por hepatitis B altamente endémica en zonas rurales de Vietnam". Revista de Gastroenterología y Hepatología . 22 (12): 2093–100. doi :10.1111/j.1440-1746.2007.05010.x. PMID 17645465. S2CID 29885790.
- ^ Fowler MG, Lampe MA, Jamieson DJ, Kourtis AP, Rogers MF (septiembre de 2007). "Reducción del riesgo de transmisión del virus de inmunodeficiencia humana de madre a hijo: éxitos pasados, progreso y desafíos actuales, y direcciones futuras". American Journal of Obstetrics and Gynecology . 197 (3 Suppl): S3–9. doi : 10.1016/j.ajog.2007.06.048 . PMID 17825648.
- ^ Sauerbrei A, Wutzler P (diciembre de 2000). "El síndrome de varicela congénita". Revista de Perinatología . 20 (8 parte 1): 548–54. doi : 10.1038/sj.jp.7200457. PMID 11190597. S2CID 7973561.
- ^ ab Antonovics J, Wilson AJ, Forbes MR, Hauffe HC, Kallio ER, Leggett HC, et al. (mayo de 2017). "La evolución del modo de transmisión". Philosophical Transactions of the Royal Society of London. Serie B, Ciencias Biológicas . 372 (1719). doi :10.1098/rstb.2016.0083. PMC 5352810 . PMID 28289251.
- ^ Garnett GP (febrero de 2005). "El papel de la inmunidad colectiva en la determinación del efecto de las vacunas contra las enfermedades de transmisión sexual". The Journal of Infectious Diseases . 191 (Supl 1): S97–106. doi : 10.1086/425271 . PMID 15627236.
- ^ Platonov AE (2006). "[La influencia de las condiciones climáticas en la epidemiología de las enfermedades transmitidas por vectores a través del ejemplo de la fiebre del Nilo Occidental en Rusia]". Vestnik Rossiiskoi Akademii Meditsinskikh Nauk (en ruso) (2): 25–29. PMID 16544901.
- ^ Jewell CP, Keeling MJ, Roberts GO (diciembre de 2009). "Predicción de infecciones no detectadas durante el brote de fiebre aftosa de 2007". Journal of the Royal Society, Interface . 6 (41): 1145–51. doi :10.1098/rsif.2008.0433. PMC 2817150 . PMID 19091686.
- ^ Patterson KD, Pyle GF (1991). "La geografía y la mortalidad de la pandemia de gripe de 1918". Boletín de Historia de la Medicina . 65 (1): 4–21. PMID 2021692.
- ^ Johnson NP, Mueller J (2002). "Actualización de los datos: mortalidad global de la pandemia de gripe "española" de 1918-1920". Boletín de Historia de la Medicina . 76 (1): 105–15. doi :10.1353/bhm.2002.0022. PMID 11875246. S2CID 22974230.
- ^ Eisinger RW, Fauci AS (marzo de 2018). "1". Enfermedades infecciosas emergentes . 24 (3): 413–16. doi :10.3201/eid2403.171797. PMC 5823353 . PMID 29460740.
- ^ Qin Y, Zhao MJ, Tan YY, Li XQ, Zheng JD, Peng ZB y otros. (Agosto de 2018). "[Historia de las pandemias de influenza en China durante el siglo pasado]". Zhonghua Liu Xing Bing Xue Za Zhi = Zhonghua Liuxingbingxue Zazhi (en chino). 39 (8): 1028–31. doi :10.3760/cma.j.issn.0254-6450.2018.08.003. PMID 30180422.
- ^ Gao F, Bailes E, Robertson DL, Chen Y, Rodenburg CM, Michael SF, et al. (febrero de 1999). "Origen del VIH-1 en el chimpancé Pan troglodytes troglodytes". Naturaleza . 397 (6718): 436–41. Código Bib :1999Natur.397..436G. doi : 10.1038/17130 . PMID 9989410. S2CID 4432185.
- ^ "Hoja informativa" (PDF) . ONUSIDA.org . 2018 . Consultado el 12 de diciembre de 2019 .
- ^ "DATOS DE LA ONU SIDA 2019". UNAIDS.org . 2019 . Consultado el 5 de diciembre de 2019 .
- ^ Mawar N, Saha S, Pandit A, Mahajan U (diciembre de 2005). "La tercera fase de la pandemia del VIH: consecuencias sociales del estigma y la discriminación relacionados con el VIH/SIDA y necesidades futuras" (PDF) . The Indian Journal of Medical Research . 122 (6): 471–84. PMID 16517997. Archivado desde el original (PDF) el 4 de marzo de 2016. Consultado el 19 de diciembre de 2014 .
- ^ "Situación de la epidemia mundial de VIH" (PDF) . ONUSIDA. 2008. Archivado desde el original (PDF) el 22 de noviembre de 2015 . Consultado el 19 de diciembre de 2014 .
- ^ Towner JS, Khristova ML, Sealy TK, Vincent MJ, Erickson BR, Bawiec DA, et al. (julio de 2006). "Genómica del virus de Marburgo y asociación con un gran brote de fiebre hemorrágica en Angola". Journal of Virology . 80 (13): 6497–516. doi :10.1128/JVI.00069-06. PMC 1488971 . PMID 16775337.
- ^ "Informe de la Organización Mundial de la Salud, 24 de septiembre de 2014" (PDF) .
- ^ "Revista de Virología". Revista de Virología .
- ^ Weiss SR, Leibowitz JL (2011). Patogenia del coronavirus . Avances en la investigación de virus. Vol. 81. págs. 85-164. doi :10.1016/B978-0-12-385885-6.00009-2. ISBN 978-0-12-385885-6. PMC 7149603 . PMID 22094080.
- ^ Wong AT, Chen H, Liu SH, Hsu EK, Luk KS, Lai CK, et al. (mayo de 2017). "Del SARS a la preparación para la gripe aviar en Hong Kong". Clinical Infectious Diseases . 64 (suppl_2): S98–S104. doi : 10.1093/cid/cix123 . PMID 28475794.
- ^ Deng SQ, Peng HJ (febrero de 2020). "Características y respuestas de salud pública al brote de enfermedad por coronavirus 2019 en China". Revista de medicina clínica . 9 (2): 575. doi : 10.3390/jcm9020575 . PMC 7074453 . PMID 32093211.
- ^ Han Q, Lin Q, Jin S, You L (abril de 2020). "Coronavirus 2019-nCoV: una breve perspectiva desde la primera línea". The Journal of Infection . 80 (4): 373–77. doi :10.1016/j.jinf.2020.02.010. PMC 7102581 . PMID 32109444.
- ^ Londoño E, Ortiz A (16 de marzo de 2020). "Restricciones de viaje por coronavirus en todo el mundo". The New York Times .
- ^ "Estados Unidos toma más medidas importantes para responder a la pandemia; los casos de COVID-19 en Europa se disparan". CIDRAP . 15 de marzo de 2020.
- ^ Einstein MH, Schiller JT, Viscidi RP, Strickler HD, Coursaget P, Tan T, et al. (junio de 2009). "Guía para médicos sobre inmunología del virus del papiloma humano: aspectos conocidos y desconocidos". The Lancet. Enfermedades infecciosas . 9 (6): 347–56. doi :10.1016/S1473-3099(09)70108-2. PMID 19467474.
- ^ Shuda M, Feng H, Kwun HJ, Rosen ST, Gjoerup O, Moore PS, et al. (octubre de 2008). "Las mutaciones del antígeno T son una firma tumoral específica humana para el poliomavirus de células de Merkel". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (42): 16272–77. Bibcode :2008PNAS..10516272S. doi : 10.1073/pnas.0806526105 . PMC 2551627 . PMID 18812503.
- ^ Pulitzer MP, Amin BD, Busam KJ (mayo de 2009). "Carcinoma de células de Merkel: revisión". Avances en patología anatómica . 16 (3): 135–44. doi :10.1097/PAP.0b013e3181a12f5a. PMID 19395876. S2CID 36110778.
- ^ Koike K (junio de 2007). "El virus de la hepatitis C contribuye a la hepatocarcinogénesis modulando las vías de señalización metabólica e intracelular". Journal of Gastroenterology and Hepatology . 22 (Supl 1): S108–11. doi :10.1111/j.1440-1746.2006.04669.x. PMID 17567457. S2CID 25399220.
- ^ Hu J, Ludgate L (2007). "Coinfección VIH-VHB y VIH-VHC y desarrollo de cáncer de hígado". Oncogénesis viral asociada al sida . Tratamiento e investigación del cáncer. Vol. 133. págs. 241–52. doi :10.1007/978-0-387-46816-7_9. ISBN 978-0-387-46804-4. Número de identificación personal 17672044.
- ^ Bellon M, Nicot C (2007). "Telomerasa: un factor crucial en la leucemia de células T humanas inducida por HTLV-I". Genómica y proteómica del cáncer . 4 (1): 21–25. PMID 17726237.
- ^ Schiffman M, Castle PE, Jerónimo J, Rodríguez AC, Wacholder S (septiembre de 2007). "Virus del papiloma humano y cáncer de cuello uterino". Lanceta . 370 (9590): 890–907. doi :10.1016/S0140-6736(07)61416-0. PMID 17826171. S2CID 20196938.
- ^ Klein E, Kis LL, Klein G (febrero de 2007). "Infección por el virus de Epstein-Barr en humanos: de inofensiva a interacciones virus-linfocitos potencialmente mortales". Oncogene . 26 (9): 1297–305. doi : 10.1038/sj.onc.1210240 . PMID 17322915.
- ^ Zur Hausen H (julio de 2008). "Nuevos poliomavirus humanos: resurgimiento de una familia de virus bien conocida como posibles carcinógenos humanos". Revista Internacional del Cáncer . 123 (2): 247–50. doi : 10.1002/ijc.23620 . PMID 18449881. S2CID 9482506.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Biología molecular de la célula (4.ª ed.). Nueva York y Londres: Garland Science. ISBN 0-8153-3218-1.
- ^ Ding SW, Voinnet O (agosto de 2007). "Inmunidad antiviral dirigida por ARN pequeños". Cell . 130 (3): 413–26. doi :10.1016/j.cell.2007.07.039. PMC 2703654 . PMID 17693253.
- ^ Patton JT, Vasquez-Del Carpio R, Spencer E (2004). "Replicación y transcripción del genoma del rotavirus". Current Pharmaceutical Design . 10 (30): 3769–77. doi :10.2174/1381612043382620. PMID 15579070.
- ^ Jayaram H, Estes MK, Prasad BV (abril de 2004). "Temas emergentes en la entrada celular, la organización del genoma, la transcripción y la replicación del rotavirus". Virus Research . 101 (1): 67–81. doi :10.1016/j.virusres.2003.12.007. PMID 15010218.
- ^ Greer S, Alexander GJ (diciembre de 1995). "Serología y detección viral". Baillière's Clinical Gastroenterology . 9 (4): 689–721. doi :10.1016/0950-3528(95)90057-8. PMID 8903801.
- ^ Matter L, Kogelschatz K, Germann D (abril de 1997). "Niveles séricos de anticuerpos contra el virus de la rubéola que indican inmunidad: respuesta a la vacunación de sujetos con concentraciones bajas o indetectables de anticuerpos". The Journal of Infectious Diseases . 175 (4): 749–55. doi : 10.1086/513967 . PMID 9086126.
- ^ Mallery DL, McEwan WA, Bidgood SR, Towers GJ, Johnson CM, James LC (noviembre de 2010). "Los anticuerpos median la inmunidad intracelular a través del motivo tripartito que contiene 21 (TRIM21)". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (46): 19985–90. Bibcode :2010PNAS..10719985M. doi : 10.1073/pnas.1014074107 . PMC 2993423 . PMID 21045130.
- ^ Cascalho M, Platt JL (2007). "Nuevas funciones de las células B". Critical Reviews in Immunology . 27 (2): 141–51. doi :10.1615/critrevimmunol.v27.i2.20. PMID 17725500.
- ^ Le Page C, Génin P, Baines MG, Hiscott J (2000). "Activación del interferón e inmunidad innata". Reseñas en Inmunogenética . 2 (3): 374–86. PMID 11256746.
- ^ Hilleman MR (octubre de 2004). "Estrategias y mecanismos para la supervivencia del huésped y del patógeno en infecciones virales agudas y persistentes". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (Supl 2): 14560–66. Bibcode :2004PNAS..10114560H. doi : 10.1073/pnas.0404758101 . PMC 521982 . PMID 15297608.
- ^ Libbey JE, Fujinami RS (2014). "Respuesta inmunitaria adaptativa a infecciones virales en el sistema nervioso central". Neurovirología . Manual de neurología clínica. Vol. 123. págs. 225–47. doi :10.1016/B978-0-444-53488-0.00010-9. ISBN 978-0444534880. PMC 4370180 . PMID 25015488.
- ^ Asaria P, MacMahon E (octubre de 2006). "Sarampión en el Reino Unido: ¿podemos erradicarlo para 2010?". BMJ . 333 (7574): 890–95. doi :10.1136/bmj.38989.445845.7C. PMC 1626346 . PMID 17068034.
- ^ Lane JM (2006). "Vacunación masiva y vigilancia/contención en la erradicación de la viruela". Vacunación masiva: aspectos globales: avances y obstáculos . Temas actuales en microbiología e inmunología. Vol. 304. págs. 17–29. doi :10.1007/3-540-36583-4_2. ISBN 978-3-540-29382-8. PMC 7120753 . PMID 16989262.
- ^ Arvin AM, Greenberg HB (enero de 2006). "Nuevas vacunas virales". Virology . 344 (1): 240–49. doi : 10.1016/j.virol.2005.09.057 . PMID 16364754.
- ^ Pastoret PP, Schudel AA, Lombard M (agosto de 2007). "Conclusiones: tendencias futuras en vacunología veterinaria". Revista científica y técnica . 26 (2): 489–94, 495–501, 503–09. doi :10.20506/rst.26.2.1759. PMID 17892169.
- ^ Palese P (enero de 2006). "¿Cómo fabricar mejores vacunas contra el virus de la gripe?". Enfermedades infecciosas emergentes . 12 (1): 61–65. doi :10.3201/eid1201.051043. PMC 3291403. PMID 16494719 .
- ^ Anand P, Stahel VP (mayo de 2021). "Revisión de la seguridad de las vacunas de ARNm contra la COVID-19: una revisión". Seguridad del paciente en cirugía . 15 (1): 20. doi : 10.1186/s13037-021-00291-9 . PMC 8087878 . PMID 33933145.
- ^ Thomssen R (1975). "Vacunas con virus vivos atenuados frente a vacunas con virus muertos". Monografías en Alergia . 9 : 155–76. PMID 1090805.
- ^ McLean AA (1986). "Desarrollo de vacunas contra la hepatitis A y la hepatitis B". Reseñas de enfermedades infecciosas . 8 (4): 591–98. doi :10.1093/clinids/8.4.591. PMID 3018891.
- ^ Casswall TH, Fischler B (octubre de 2005). "Vacunación del niño inmunocomprometido". Expert Review of Vaccines . 4 (5): 725–38. doi :10.1586/14760584.4.5.725. PMID 16221073. S2CID 40821818.
- ^ Barnett ED, Wilder-Smith A, Wilson ME (julio de 2008). "Vacunas contra la fiebre amarilla y viajeros internacionales". Expert Review of Vaccines . 7 (5): 579–87. doi :10.1586/14760584.7.5.579. PMID 18564013. S2CID 19352868.
- ^ ab De Clercq E, Li G (julio de 2016). "Medicamentos antivirales aprobados en los últimos 50 años". Clinical Microbiology Reviews . 29 (3): 695–747. doi :10.1128/CMR.00102-15. PMC 4978613 . PMID 27281742.
- ^ Magden J, Kääriäinen L, Ahola T (marzo de 2005). "Inhibidores de la replicación viral: desarrollos recientes y perspectivas". Applied Microbiology and Biotechnology . 66 (6): 612–21. doi :10.1007/s00253-004-1783-3. PMC 7082807 . PMID 15592828.
- ^ Mindel A, Sutherland S (septiembre de 1983). "Herpes genital: la enfermedad y su tratamiento, incluido el aciclovir intravenoso". The Journal of Antimicrobial Chemotherapy . 12 (Suppl B): 51–59. doi :10.1093/jac/12.suppl_b.51. PMID 6355051.
- ^ Palmisano L, Vella S (2011). "Una breve historia de la terapia antirretroviral de la infección por VIH: éxitos y desafíos". Annali dell'Istituto Superiore di Sanità . 47 (1): 44–48. doi :10.4415/ANN_11_01_10. PMID 21430338.
- ^ Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, Fried MW, Segal JB, Sulkowski MS (mayo de 2017). "Terapia oral con agentes de acción directa para la infección por el virus de la hepatitis C: una revisión sistemática". Anales de Medicina Interna . 166 (9): 637–48. doi :10.7326/M16-2575. PMC 5486987 . PMID 28319996.
- ^ Nguyen MH, Wong G, Gane E, Kao JH, Dusheiko G (marzo de 2020). "Virus de la hepatitis B: avances en la prevención, el diagnóstico y la terapia". Clinical Microbiology Reviews . 33 (2). doi :10.1128/CMR.00046-19. PMC 7048015 . PMID 32102898.
- ^ Goris N, Vandenbussche F, De Clercq K (abril de 2008). "Potencial de la terapia antiviral y la profilaxis para controlar las infecciones virales de ARN en el ganado". Antiviral Research . 78 (1): 170–78. doi :10.1016/j.antiviral.2007.10.003. PMID 18035428.
- ^ Carmichael LE (2005). "Un relato histórico anotado del parvovirus canino". Revista de Medicina Veterinaria. B, Enfermedades infecciosas y salud pública veterinaria . 52 (7–8): 303–11. doi :10.1111/j.1439-0450.2005.00868.x. PMID 16316389.
- ^ Chen Y, Zhao Y, Hammond J, Hsu HT, Evans J, Feldlaufer M (octubre-noviembre de 2004). "Infecciones virales múltiples en la abeja melífera y divergencia genómica de los virus de la abeja melífera". Journal of Invertebrate Pathology . 87 (2-3): 84-93. Bibcode :2004JInvP..87...84C. doi :10.1016/j.jip.2004.07.005. PMID 15579317.
- ^ Hull R (2002). "Capítulo 12: Transmisión 2: mecánica, semillas, polen y epidemiología". Matthews' Plant Virology (4.ª ed.). Academic Press. págs. 555–56. ISBN 978-0123611604. Recuperado el 21 de febrero de 2022 .
- ^ Zaheer K, Akhtar MH (2016). "Producción, uso y nutrición de la papa: una revisión". Reseñas críticas en ciencia de los alimentos y nutrición . 56 (5): 711–21. doi :10.1080/10408398.2012.724479. PMID 24925679. S2CID 33074838.
- ^ Fuentes S, Jones RA, Matsuoka H, Ohshima K, Kreuze J, Gibbs AJ (julio 2019). "Virus Y de la papa; la conexión andina". Virus Evolution . 5 (2): vez037. doi :10.1093/ve/vez037. PMC 6755682 . PMID 31559020.
- ^ Dinesh-Kumar SP, Tham WH, Baker BJ (diciembre de 2000). "Análisis de la estructura y la función del gen de resistencia N del virus del mosaico del tabaco". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 97 (26): 14789–94. Bibcode :2000PNAS...9714789D. doi : 10.1073/pnas.97.26.14789 . PMC 18997 . PMID 11121079.
- ^ Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP (octubre de 2005). "Mecanismos de resistencia de las plantas a los virus". Nature Reviews. Microbiology . 3 (10): 789–98. doi :10.1038/nrmicro1239. PMID 16132037. S2CID 27311732.
- ^ Lomonossoff GP (2011). "Partículas virales y sus usos en biotecnología y nanotecnología". Avances recientes en virología vegetal . Caister Academic Press . ISBN 978-1-904455-75-2.
- ^ Wommack KE, Colwell RR (marzo de 2000). "Virioplancton: virus en ecosistemas acuáticos". Microbiology and Molecular Biology Reviews . 64 (1): 69–114. doi :10.1128/MMBR.64.1.69-114.2000. PMC 98987 . PMID 10704475.
- ^ Bergh O, Børsheim KY, Bratbak G, Heldal M (agosto de 1989). "Gran abundancia de virus en ambientes acuáticos". Nature . 340 (6233): 467–68. Bibcode :1989Natur.340..467B. doi :10.1038/340467a0. PMID 2755508. S2CID 4271861.
- ^ Bickle TA, Krüger DH (junio de 1993). "Biología de la restricción del ADN". Microbiological Reviews . 57 (2): 434–50. doi :10.1128/MMBR.57.2.434-450.1993. PMC 372918 . PMID 8336674.
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, et al. (marzo de 2007). "CRISPR proporciona resistencia adquirida contra virus en procariotas". Science . 315 (5819): 1709–12. Bibcode :2007Sci...315.1709B. doi :10.1126/science.1138140. hdl : 20.500.11794/38902 . PMID 17379808. S2CID 3888761.
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP y otros. (Agosto de 2008). "Los pequeños ARN CRISPR guían la defensa antiviral en procariotas". Ciencia . 321 (5891): 960–64. Código bibliográfico : 2008 Ciencia... 321..960B. doi : 10.1126/ciencia.1159689. PMC 5898235 . PMID 18703739.
- ^ Mojica FJ, Rodriguez-Valera F (septiembre de 2016). "El descubrimiento de CRISPR en arqueas y bacterias". The FEBS Journal . 283 (17): 3162–69. doi :10.1111/febs.13766. hdl : 10045/57676 . PMID 27234458. S2CID 42827598.
- ^ ab Weiss RA (2017). "Intercambio de secuencias genéticas entre virus y huéspedes". Virus, genes y cáncer . Temas actuales en microbiología e inmunología. Vol. 407. págs. 1–29. doi :10.1007/82_2017_21. ISBN 978-3-319-61803-6. Número de identificación personal 28550453.
- ^ Hu J, Ye H, Wang S, Wang J, Han D (2021). "Activación del profago en el intestino: información sobre funciones y posibles aplicaciones". Frontiers in Microbiology . 12 : 785634. doi : 10.3389/fmicb.2021.785634 . PMC 8710666 . PMID 34966370.
- ^ Russ E, Iordanskiy S (enero de 2023). "Retrovirus endógenos como moduladores de la inmunidad innata". Patógenos . 12 (2): 162. doi : 10.3390/pathogens12020162 . PMC 9963469 . PMID 36839434.
- ^ Prangishvili D, Garrett RA (abril de 2004). "Morfotipos y genomas excepcionalmente diversos de virus hipertermofílicos crenarqueales" (PDF) . Biochemical Society Transactions . 32 (Pt 2): 204–08. doi :10.1042/BST0320204. PMID 15046572. S2CID 20018642.
- ^ Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria E (febrero de 2005). "Secuencias intermedias de repeticiones procarióticas regularmente espaciadas derivan de elementos genéticos foráneos". Journal of Molecular Evolution . 60 (2): 174–82. Bibcode :2005JMolE..60..174M. doi :10.1007/s00239-004-0046-3. PMID 15791728. S2CID 27481111.
- ^ Makarova KS, Grishin NV, Shabalina SA, Wolf YI, Koonin EV (marzo de 2006). "Un supuesto sistema inmunológico basado en la interferencia de ARN en procariotas: análisis computacional de la maquinaria enzimática prevista, analogías funcionales con la interferencia de ARN eucariota y mecanismos de acción hipotéticos". Biology Direct . 1 : 7. doi : 10.1186/1745-6150-1-7 . PMC 1462988 . PMID 16545108.
- ^ van der Oost J, Westra ER, Jackson RN, Wiedenheft B (julio de 2014). "Descifrando la base estructural y mecanicista de los sistemas CRISPR-Cas". Nature Reviews. Microbiology . 12 (7): 479–92. doi :10.1038/nrmicro3279. PMC 4225775 . PMID 24909109.
- ^ Dávila-Ramos S, Castelán-Sánchez HG, Martínez-Ávila L, Sánchez-Carbente MD, Peralta R, Hernández-Mendoza A, et al. (2019). "Una revisión sobre metagenómica viral en entornos extremos". Fronteras en Microbiología . 10 : 2403. doi : 10.3389/fmicb.2019.02403 . PMC 6842933 . PMID 31749771.
- ^ Zhang QY, Gui JF (diciembre de 2018). "Diversidad, contribución evolutiva y funciones ecológicas de los virus acuáticos". Science China Life Sciences . 61 (12): 1486–1502. doi :10.1007/s11427-018-9414-7. PMID 30443861. S2CID 53564176.
- ^ Weitz JS, Wilhelm SW (2013). "Un océano de virus". The Scientist . 27 (7): 35–39.
- ^ Suttle CA (septiembre de 2005). "Virus en el mar". Nature . 437 (7057): 356–61. Bibcode :2005Natur.437..356S. doi :10.1038/nature04160. PMID 16163346. S2CID 4370363.
- ^ Wilhelm SW, Suttle CA (1999). "Virus y ciclos de nutrientes en el mar: los virus desempeñan papeles críticos en la estructura y función de las redes alimentarias acuáticas". BioScience . 49 (10): 781–88. doi : 10.2307/1313569 . JSTOR 1313569.
- ^ Shelford EJ, Suttle CA (2018). "Transferencia de nitrógeno mediada por virus desde bacterias heterotróficas al fitoplancton". Biogeosciences . 15 (3): 809–15. Bibcode :2018BGeo...15..809S. doi : 10.5194/bg-15-809-2018 .
- ^ abcd Suttle CA (octubre de 2007). «Virus marinos: actores principales en el ecosistema global». Nature Reviews. Microbiology . 5 (10): 801–12. doi :10.1038/nrmicro1750. PMID 17853907. S2CID 4658457.
- ^ Wigington CH, Sonderegger D, Brussaard CP, Buchan A, Finke JF, Fuhrman JA, et al. (enero de 2016). "Reexamen de la relación entre la abundancia de virus marinos y células microbianas" (PDF) . Nature Microbiology . 1 (15024): 15024. doi :10.1038/nmicrobiol.2015.24. PMID 27572161. S2CID 52829633.
- ^ Brussaard CP (2004). "Control viral de las poblaciones de fitoplancton: una revisión". Revista de microbiología eucariota . 51 (2): 125–38. doi :10.1111/j.1550-7408.2004.tb00537.x. PMID 15134247. S2CID 21017882.
- ^ Robbins J (13 de abril de 2018). «Trillones y billones de virus caen del cielo cada día». The New York Times . Consultado el 14 de abril de 2018 .
- ^ Reche I, D'Orta G, Mladenov N, Winget DM, Suttle CA (abril de 2018). "Tasas de deposición de virus y bacterias por encima de la capa límite atmosférica". The ISME Journal . 12 (4): 1154–62. Bibcode :2018ISMEJ..12.1154R. doi :10.1038/s41396-017-0042-4. PMC 5864199 . PMID 29379178.
- ^ Hall AJ, Jepson PD, Goodman SJ, Harkonen T (2006). "Virus del moquillo phocino en los mares del Norte y de Europa: datos y modelos, naturaleza y crianza". Conservación biológica . 131 (2): 221–29. Código Bibliográfico :2006BCons.131..221H. doi :10.1016/j.biocon.2006.04.008.
- ^ DeLong JP, Van Etten JL, Al-Ameeli Z, Agarkova IV, Dunigan DD (enero de 2023). "El consumo de virus devuelve energía a las cadenas alimentarias". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 120 (1): e2215000120. Bibcode :2023PNAS..12015000D. doi :10.1073/pnas.2215000120. PMC 9910503 . PMID 36574690. S2CID 255219850.
- ^ Irving M (28 de diciembre de 2022). «Descubrimiento del primer «viróvoro»: un organismo que se alimenta de virus». Nuevo Atlas. Archivado desde el original el 29 de diciembre de 2022. Consultado el 29 de diciembre de 2022 .
- ^ Broecker F, Moelling K (2019). "¿Qué nos dicen los virus sobre la evolución y la inmunidad: más allá de Darwin?". Anales de la Academia de Ciencias de Nueva York . 1447 (1): 53–68. Bibcode :2019NYASA1447...53B. doi : 10.1111/nyas.14097 . PMC 6850104 . PMID 31032941.
- ^ Lauer, A. (2021). Virus, impulsores subestimados de la ecología y la evolución de la vida. En: Hurst, CJ (eds) Microbios: la piedra angular de la biosfera. Avances en microbiología ambiental, vol. 8. Springer, Cham. https://doi.org/10.1007/978-3-030-63512-1_28
- ^ Forterre P, Philippe H (junio de 1999). "El último ancestro común universal (LUCA), ¿simple o complejo?". The Biological Bulletin . 196 (3): 373–75, discusión 375–77. doi :10.2307/1542973. JSTOR 1542973. PMID 11536914.
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). "Virus: Estructura, función y usos". Biología celular molecular (4.ª ed.). Nueva York: WH Freeman.
- ^ Matsuzaki S, Rashel M, Uchiyama J, Sakurai S, Ujihara T, Kuroda M, et al. (octubre de 2005). "Terapia con bacteriófagos: una terapia revitalizada contra enfermedades infecciosas bacterianas". Journal of Infection and Chemotherapy . 11 (5): 211–19. doi :10.1007/s10156-005-0408-9. PMID 16258815. S2CID 8107934.
- ^ Gleba YY, Giritch A (2011). "Vectores virales de plantas para la expresión de proteínas". Avances recientes en virología vegetal . Caister Academic Press. ISBN 978-1-904455-75-2.
- ^ Jefferson A, Cadet VE, Hielscher A (septiembre de 2015). "Los mecanismos de los virus vaccinia modificados genéticamente para el tratamiento del cáncer". Critical Reviews in Oncology/Hematology . 95 (3): 407–16. doi :10.1016/j.critrevonc.2015.04.001. PMID 25900073.
- ^ Karimkhani C, Gonzalez R, Dellavalle RP (agosto de 2014). "Una revisión de nuevas terapias para el melanoma". American Journal of Clinical Dermatology . 15 (4): 323–37. doi :10.1007/s40257-014-0083-7. PMID 24928310. S2CID 38864550.
- ^ "La FDA aprueba la inmunoterapia inyectable de Amgen para el melanoma". Reuters . 27 de octubre de 2015 . Consultado el 24 de enero de 2020 .
- ^ Burke J, Nieva J, Borad MJ, Breitbach CJ (agosto de 2015). "Virus oncolíticos: perspectivas sobre el desarrollo clínico". Current Opinion in Virology . 13 : 55–60. doi :10.1016/j.coviro.2015.03.020. PMID 25989094.
- ^ Dogic Z (2016). "Fagos filamentosos como sistema modelo en la física de la materia blanda". Frontiers in Microbiology . 7 : 1013. doi : 10.3389/fmicb.2016.01013 . PMC 4927585 . PMID 27446051.
- ^ Fischlechner M, Donath E (2007). "Los virus como componentes básicos de materiales y dispositivos". Angewandte Chemie . 46 (18): 3184–93. doi :10.1002/anie.200603445. PMID 17348058.
- ^ Soto CM, Blum AS, Vora GJ, Lebedev N, Meador CE, Won AP, et al. (abril de 2006). "Amplificación de la señal fluorescente de colorantes de carbocianina utilizando nanopartículas virales diseñadas". Revista de la Sociedad Química Estadounidense . 128 (15): 5184–89. doi :10.1021/ja058574x. PMID 16608355.
- ^ Blum AS, Soto CM, Wilson CD, Brower TL, Pollack SK, Schull TL, et al. (julio de 2005). "Un virus diseñado como andamiaje para el autoensamblaje tridimensional en la nanoescala". Small . 1 (7): 702–06. doi :10.1002/smll.200500021. PMID 17193509.
- ^ Cello J, Paul AV, Wimmer E (agosto de 2002). "Síntesis química del ADNc del poliovirus: generación de virus infecciosos en ausencia de una plantilla natural". Science . 297 (5583): 1016–18. Bibcode :2002Sci...297.1016C. doi : 10.1126/science.1072266 . PMID 12114528. S2CID 5810309.
- ^ Coleman JR, Papamichail D, Skiena S, Futcher B, Wimmer E, Mueller S (junio de 2008). "Atenuación del virus mediante cambios a escala del genoma en el sesgo de pares de codones". Science . 320 (5884): 1784–87. Bibcode :2008Sci...320.1784C. doi :10.1126/science.1155761. PMC 2754401 . PMID 18583614.
- ^ "Base de datos del genoma viral del NIH". Ncbi.nlm.nih.gov . Consultado el 28 de junio de 2021 .
- ^ Zilinskas RA (agosto de 2017). "Una breve historia de los programas de armas biológicas y el uso de patógenos animales como agentes de guerra biológica". Revue Scientifique et Technique (Oficina Internacional de Epizootias) . 36 (2): 415–22. doi :10.20506/rst.36.2.2662. PMID 30152475.
- ^ abc Artenstein AW, Grabenstein JD (octubre de 2008). "Vacunas contra la viruela para la biodefensa: necesidad y viabilidad". Expert Review of Vaccines . 7 (8): 1225–37. doi :10.1586/14760584.7.8.1225. PMC 9709930 . PMID 18844596. S2CID 33855724.







