Receptor (bioquímica)
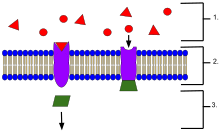
- Ligandos, ubicados fuera de la célula
- Los ligandos se conectan a proteínas receptoras específicas según la forma del sitio activo de la proteína.
- El receptor libera un mensajero una vez que el ligando se ha conectado al receptor.
En bioquímica y farmacología , los receptores son estructuras químicas, compuestas de proteínas , que reciben y transducen señales que pueden integrarse en sistemas biológicos. [1] Estas señales son típicamente mensajeros químicos [nb 1] que se unen a un receptor y producen respuestas fisiológicas como cambios en la actividad eléctrica de una célula . Por ejemplo, GABA , un neurotransmisor inhibidor , inhibe la actividad eléctrica de las neuronas al unirse a los receptores GABA A. [2] Hay tres formas principales en que se puede clasificar la acción del receptor: retransmisión de señal, amplificación o integración. [3] La retransmisión envía la señal hacia adelante , la amplificación aumenta el efecto de un solo ligando y la integración permite que la señal se incorpore a otra vía bioquímica. [3]
Las proteínas receptoras se pueden clasificar por su ubicación. Los receptores de la superficie celular , también conocidos como receptores transmembrana, incluyen canales iónicos controlados por ligando , receptores acoplados a proteína G y receptores hormonales ligados a enzimas . [1] Los receptores intracelulares son los que se encuentran dentro de la célula e incluyen receptores citoplasmáticos y receptores nucleares . [1] Una molécula que se une a un receptor se llama ligando y puede ser una proteína, un péptido (proteína corta) u otra molécula pequeña , como un neurotransmisor , una hormona , un fármaco, una toxina, un ion de calcio o partes del exterior de un virus o microbio. Una sustancia producida de forma endógena que se une a un receptor en particular se denomina su ligando endógeno. Por ejemplo, el ligando endógeno para el receptor nicotínico de acetilcolina es la acetilcolina , pero también puede ser activado por la nicotina [4] [5] y bloqueado por el curare . [6] Los receptores de un tipo particular están vinculados a vías bioquímicas celulares específicas que corresponden a la señal. Si bien en la mayoría de las células se encuentran numerosos receptores, cada receptor solo se unirá a ligandos de una estructura particular. Esto se ha comparado de manera análoga a cómo las cerraduras solo aceptan llaves con una forma específica . Cuando un ligando se une a un receptor correspondiente, activa o inhibe la vía bioquímica asociada al receptor, que también puede ser altamente especializada.
Las proteínas receptoras también se pueden clasificar según las propiedades de los ligandos. Estas clasificaciones incluyen quimiorreceptores , mecanorreceptores , receptores gravitrópicos , fotorreceptores , magnetorreceptores y gasorreceptores.
Estructura
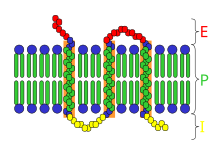
Las estructuras de los receptores son muy diversas e incluyen, entre otras, las siguientes categorías principales:
- Tipo 1: canales iónicos regulados por ligando (receptores ionotrópicos): estos receptores suelen ser el objetivo de neurotransmisores rápidos como la acetilcolina (nicotínica) y el GABA ; la activación de estos receptores produce cambios en el movimiento de iones a través de la membrana. Tienen una estructura heteromérica en la que cada subunidad consta del dominio de unión al ligando extracelular y un dominio transmembrana que incluye cuatro hélices alfa transmembrana . Las cavidades de unión al ligando se encuentran en la interfaz entre las subunidades.
- Tipo 2: Receptores acoplados a proteína G (receptores metabotrópicos): esta es la familia más grande de receptores e incluye los receptores para varias hormonas y transmisores lentos, por ejemplo, dopamina, glutamato metabotrópico. Están compuestos por siete hélices alfa transmembrana. Los bucles que conectan las hélices alfa forman dominios extracelulares e intracelulares. El sitio de unión para ligandos peptídicos más grandes generalmente se encuentra en el dominio extracelular, mientras que el sitio de unión para ligandos no peptídicos más pequeños a menudo se encuentra entre las siete hélices alfa y un bucle extracelular. [7] Los receptores mencionados anteriormente están acoplados a diferentes sistemas efectores intracelulares a través de proteínas G. [ 8] Las proteínas G son heterotrímeros compuestos por 3 subunidades: α (alfa), β (beta) y γ (gamma). En el estado inactivo, las tres subunidades se asocian entre sí y la subunidad α se une al GDP. [9] La activación de la proteína G provoca un cambio conformacional que conduce al intercambio de GDP por GTP. La unión de GTP a la subunidad α provoca la disociación de las subunidades β y γ. [10] Además, las tres subunidades, α, β y γ, tienen cuatro clases principales adicionales según su secuencia primaria. Estas incluyen G s , G i , G q y G 12 . [11]
- Tipo 3: Receptores ligados a quinasas y relacionados (ver “ Receptor de tirosina quinasa ” y “ Receptor ligado a enzimas ”) – Están compuestos por un dominio extracelular que contiene el sitio de unión del ligando y un dominio intracelular, a menudo con función enzimática, unidos por una única hélice alfa transmembrana. El receptor de insulina es un ejemplo.
- Tipo 4: Receptores nucleares – Aunque se les llama receptores nucleares, en realidad se encuentran en el citoplasma y migran al núcleo después de unirse con sus ligandos. Están compuestos por una región de unión al ligando C-terminal , un dominio de unión al ADN central (DBD) y un dominio N-terminal que contiene la región AF1 (función de activación 1). La región central tiene dos dedos de zinc que son responsables de reconocer las secuencias de ADN específicas de este receptor. El extremo N interactúa con otros factores de transcripción celular de manera independiente del ligando y, dependiendo de estas interacciones, puede modificar la unión/actividad del receptor. Los receptores de esteroides y de hormonas tiroideas son ejemplos de dichos receptores. [12]
Los receptores de membrana pueden aislarse de las membranas celulares mediante procedimientos de extracción complejos utilizando solventes , detergentes y/o purificación por afinidad .
Las estructuras y acciones de los receptores pueden estudiarse mediante métodos biofísicos como la cristalografía de rayos X , la RMN , el dicroísmo circular y la interferometría de polarización dual . Se han utilizado simulaciones por computadora del comportamiento dinámico de los receptores para comprender sus mecanismos de acción.
Enlace y activación
La unión de ligandos es un proceso de equilibrio . Los ligandos se unen a los receptores y se disocian de ellos según la ley de acción de masas en la siguiente ecuación, para un ligando L y un receptor R. Los corchetes alrededor de las especies químicas indican sus concentraciones.
Una medida de qué tan bien una molécula se adapta a un receptor es su afinidad de unión, que está inversamente relacionada con la constante de disociación K d . Un buen ajuste se corresponde con una alta afinidad y una baja K d . La respuesta biológica final (por ejemplo, cascada de segundos mensajeros , contracción muscular) solo se logra después de que se activa una cantidad significativa de receptores.
La afinidad es una medida de la tendencia de un ligando a unirse a su receptor. La eficacia es la medida del ligando unido para activar su receptor.
Agonistas versus antagonistas
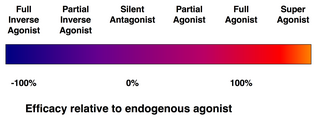
No todos los ligandos que se unen a un receptor también lo activan. Existen las siguientes clases de ligandos:
- Los agonistas (completos) son capaces de activar el receptor y producir una respuesta biológica potente. El ligando endógeno natural con mayor eficacia para un receptor determinado es, por definición, un agonista completo (100 % de eficacia).
- Los agonistas parciales no activan los receptores con máxima eficacia, incluso con unión máxima, lo que provoca respuestas parciales en comparación con las de los agonistas completos (eficacia entre 0 y 100%).
- Los antagonistas se unen a los receptores pero no los activan. Esto produce un bloqueo del receptor, inhibiendo la unión de los agonistas y los agonistas inversos. Los antagonistas del receptor pueden ser competitivos (o reversibles) y competir con el agonista por el receptor, o pueden ser antagonistas irreversibles que forman enlaces covalentes (o enlaces no covalentes de afinidad extremadamente alta) con el receptor y lo bloquean por completo. El inhibidor de la bomba de protones omeprazol es un ejemplo de antagonista irreversible. Los efectos del antagonismo irreversible solo pueden revertirse mediante la síntesis de nuevos receptores.
- Los agonistas inversos reducen la actividad de los receptores al inhibir su actividad constitutiva (eficacia negativa).
- Moduladores alostéricos : No se unen al sitio de unión del agonista del receptor sino a sitios de unión alostéricos específicos, a través de los cuales modifican el efecto del agonista. Por ejemplo, las benzodiazepinas (BZD) se unen al sitio BZD del receptor GABA A y potencian el efecto del GABA endógeno.
Téngase en cuenta que la idea de agonismo y antagonismo del receptor sólo se refiere a la interacción entre receptores y ligandos y no a sus efectos biológicos.
Actividad constitutiva
Se dice que un receptor capaz de producir una respuesta biológica en ausencia de un ligando unido muestra "actividad constitutiva". [13] La actividad constitutiva de un receptor puede ser bloqueada por un agonista inverso . Los fármacos antiobesidad rimonabant y taranabant son agonistas inversos del receptor cannabinoide CB1 y, aunque produjeron una pérdida de peso significativa, ambos fueron retirados debido a una alta incidencia de depresión y ansiedad, que se cree que están relacionadas con la inhibición de la actividad constitutiva del receptor cannabinoide.
El receptor GABA A tiene actividad constitutiva y conduce cierta corriente basal en ausencia de un agonista. Esto permite que la betacarbolina actúe como un agonista inverso y reduzca la corriente por debajo de los niveles basales.
Las mutaciones en los receptores que resultan en una mayor actividad constitutiva son la base de algunas enfermedades hereditarias, como la pubertad precoz (debido a mutaciones en los receptores de la hormona luteinizante) y el hipertiroidismo (debido a mutaciones en los receptores de la hormona estimulante de la tiroides).
Teorías de la interacción fármaco-receptor
Ocupación
Las primeras formas de la teoría de los receptores en la farmacología establecían que el efecto de un fármaco es directamente proporcional al número de receptores ocupados. [14] Además, el efecto de un fármaco cesa cuando el complejo fármaco-receptor se disocia.
Ariëns y Stephenson introdujeron los términos "afinidad" y "eficacia" para describir la acción de los ligandos unidos a los receptores. [15] [16]
- Afinidad : Capacidad de un fármaco de combinarse con un receptor para crear un complejo fármaco-receptor.
- Eficacia : Capacidad de un fármaco para iniciar una respuesta después de la formación del complejo fármaco-receptor.
Tasa
A diferencia de la teoría de la ocupación aceptada , la teoría de la tasa propone que la activación de los receptores es directamente proporcional al número total de encuentros de un fármaco con sus receptores por unidad de tiempo. La actividad farmacológica es directamente proporcional a las tasas de disociación y asociación, no al número de receptores ocupados: [17]
- Agonista: Fármaco con una asociación rápida y una disociación rápida.
- Agonista parcial: fármaco con una asociación intermedia y una disociación intermedia.
- Antagonista: Un fármaco con una asociación rápida y una disociación lenta.
Ajuste inducido
A medida que un fármaco se aproxima a un receptor, éste altera la conformación de su sitio de unión para producir un complejo fármaco-receptor.
Receptores de repuesto
En algunos sistemas receptores (por ejemplo, la acetilcolina en la unión neuromuscular del músculo liso), los agonistas pueden provocar una respuesta máxima con niveles muy bajos de ocupación del receptor (<1 %). Por lo tanto, ese sistema tiene receptores de repuesto o una reserva de receptores. Esta disposición produce una economía de producción y liberación de neurotransmisores. [12]
Regulación de receptores
Las células pueden aumentar ( regular positivamente ) o disminuir ( regular negativamente ) el número de receptores de una determinada hormona o neurotransmisor para modificar su sensibilidad a diferentes moléculas. Se trata de un mecanismo de retroalimentación que actúa localmente .
- Cambio en la conformación del receptor de modo que la unión del agonista no lo active. Esto se observa en los receptores de canales iónicos.
- Se observa un desacoplamiento de las moléculas efectoras del receptor con receptores acoplados a proteína G.
- Secuestro de receptores (internalización), [18] por ejemplo en el caso de los receptores hormonales.
Ejemplos y ligandos
Los ligandos para receptores son tan diversos como sus receptores. Los GPCR (7TM) son una familia particularmente amplia, con al menos 810 miembros. También hay LGIC para al menos una docena de ligandos endógenos, y muchos más receptores posibles a través de diferentes composiciones de subunidades. Algunos ejemplos comunes de ligandos y receptores incluyen: [19]
Canales iónicos y receptores acoplados a proteína G
En la siguiente tabla se muestran algunos ejemplos de receptores ionotrópicos (LGIC) y metabotrópicos (específicamente, GPCR). Los principales neurotransmisores son el glutamato y el GABA; otros neurotransmisores son neuromoduladores . Esta lista no es de ninguna manera exhaustiva.
| Ligando endógeno | Receptor de canal iónico (LGIC) | Receptor acoplado a proteína G (GPCR) | ||||
|---|---|---|---|---|---|---|
| Receptores | Corriente de iones [nb 2] | Ligando exógeno | Receptores | Proteína G | Ligando exógeno | |
| Glutamato | iGluRs : receptores NMDA , AMPA y kainato | Na + , K + , Ca2 + [19] | Ketamina | Receptores de glutamato : mGluRs | Gq o Gi/o | - |
| GABA | GABA A (incluido GABA A -rho ) | Cl − > HCO − 3 [19] | Benzodiazepinas | Receptor GABA B | Gi/o | Baclofeno |
| Acetilcolina | NAChr | Na + , K + , Ca2 + [19] | Nicotina | mAChR | Gq o Gi | Muscarina |
| Glicina | Receptor de glicina (GlyR) | Cl − > HCO − 3 [19] | Estricnina | - | - | - |
| Serotonina | Receptor 5- HT3 | Na + , K + [19] | Cereulida | 5-HT1-2 o 4-7 | Gs, Gi/o o Gq | - |
| ATP | Receptores P2X | Ca2 + , Na + , Mg2 + [19] | BzATP [ cita requerida ] | Receptores P2Y | Gs, Gi/o o Gq | - |
| Dopamina | Sin canales iónicos [ cita requerida ] | - | - | Receptor de dopamina | Gs o Gi/o | - |
Receptores ligados a enzimas
Los receptores ligados a enzimas incluyen las tirosinas quinasas receptoras (RTK), las proteínas quinasas específicas de serina/treonina, como en la proteína morfogenética ósea, y la guanilato ciclasa, como en el receptor del factor natriurético auricular. De las RTK, se han identificado 20 clases, con 58 RTK diferentes como miembros. A continuación se muestran algunos ejemplos:
| Clase RTK/Familia de receptores | Miembro | Ligando endógeno | Ligando exógeno |
|---|---|---|---|
| I | EGFR | FCE | Gefitinib |
| II | Receptor de insulina | Insulina | Quetocromina |
| IV | VEGFR | Factor de crecimiento endotelial vascular (VEGF) | Lenvatinib |
Receptores intracelulares
Los receptores pueden clasificarse según su mecanismo o su posición en la célula. A continuación se muestran 4 ejemplos de LGIC intracelulares:
| Receptor | Ligando | Corriente de iones |
|---|---|---|
| canales iónicos regulados por nucleótidos cíclicos | cGMP ( visión ), cAMP y cGTP ( olfato ) | Na + , K + [19] |
| Receptor IP3 | IP3 | Ca2 + [19] |
| Receptores intracelulares de ATP | ATP (cierra canal) [19] | K + [19] |
| Receptor de rianodina | Ca2 + | Ca2 + [19] |
Papel en la salud y la enfermedad
En los trastornos genéticos
Muchos trastornos genéticos implican defectos hereditarios en los genes receptores. A menudo, es difícil determinar si el receptor no funciona o si la hormona se produce en niveles reducidos; esto da lugar al grupo de trastornos endocrinos "pseudohipo" , en los que parece haber un nivel hormonal reducido cuando, de hecho, es el receptor el que no responde lo suficiente a la hormona.
En el sistema inmunológico
Los principales receptores del sistema inmunológico son los receptores de reconocimiento de patrones (PRR), los receptores tipo Toll (TLR), los receptores activados por células asesinas y los receptores inhibidores de células asesinas (KAR y KIR), los receptores del complemento , los receptores Fc , los receptores de células B y los receptores de células T. [20 ]
Véase también
- Base de datos K i
- Receptores vinculados a canales iónicos
- Neuropsicofarmacología
- Regresión de Schild para la inhibición del receptor de ligando
- Transducción de señales
- Marcador de células madre
- Lista de códigos MeSH (D12.776)
- Teoría de los receptores
Notas
- ^ En el caso del receptor rodopsina , la entrada es un fotón , no una sustancia química.
- ^ Diferentes LGIC conducen corrientes de diferentes iones . Esto se logra con filtros de selectividad, como el filtro de selectividad del canal iónico K+
Referencias
- ^ abc Guyton, Arthur C.; Hall, John E. (2016). Guyton and Hall Textbook of Medical Physiology. Filadelfia, Pensilvania: Elsevier Saunders. págs. 930–937. ISBN 9781455770052.OCLC 1027900365 .
- ^ Mihic, S. John; Harris, R. Adron (1997). "GABA y el receptor GABAA". Alcohol Health and Research World . 21 (2): 127–131. ISSN 0090-838X. PMC 6826832 . PMID 15704348.
- ^ ab Alberts B, Bray D, Hopkin K, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2014). Essential Cell Biology (Cuarta edición). Nueva York, NY, EE. UU.: Science. pág. 534. ISBN 978-0-8153-4454-4.
- ^ Gotti, Cecilia; Marks, Michael J.; Millar, Neil S.; Wonnacott, Susan (16 de septiembre de 2019). "Receptores nicotínicos de acetilcolina (versión 2019.4)". Guía de farmacología de la IUPHAR/BPS CITE . 2019 (4). doi : 10.2218/gtopdb/F76/2019.4 . Consultado el 17 de noviembre de 2020 .
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 9: Sistema nervioso autónomo". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. pág. 234. ISBN 9780071481274La nicotina... es un alcaloide natural de la planta del tabaco. La
lobelina es un alcaloide natural del tabaco indio. Ambos fármacos son agonistas de los receptores colinérgicos nicotínicos...
- ^ "Información sobre el medicamento Curare, profesional". Drugs.com . Archivado desde el original el 16 de noviembre de 2018. Consultado el 8 de diciembre de 2020 .
- ^ Congreve M, Marshall F (marzo de 2010). "El impacto de las estructuras GPCR en la farmacología y el diseño de fármacos basado en la estructura". British Journal of Pharmacology . 159 (5): 986–96. doi :10.1111/j.1476-5381.2009.00476.x. PMC 2839258 . PMID 19912230.
- ^ Qin K, Dong C, Wu G, Lambert NA (agosto de 2011). "Preensamblaje en estado inactivo de receptores acoplados a G(q) y heterotrímeros G(q)". Nature Chemical Biology . 7 (10): 740–7. doi :10.1038/nchembio.642. PMC 3177959 . PMID 21873996.
- ^ Zubay, Geoffrey (1998). Bioquímica, 4.ª edición . Dubuque, IA: William C Brown Pub., pág. 684. ISBN 0697219003.
- ^ Garrett, Reginald; Grisham, Charles (2012). Bioquímica . Cengage Learning. pág. 1130. ISBN 9781473733602.
- ^ Hamm, Heidi E.; Oldham, William M. (2008). "Activación de la proteína G heterotrimérica por receptores acoplados a proteína G". Nature Reviews Molecular Cell Biology . 9 (1). Nature Publishing Group: 60–71. doi :10.1038/nrm2299. PMID 18043707. S2CID 24267759.
- ^ ab Rang HP, Dale MM, Ritter JM, Flower RJ, Henderson G (2012). Farmacología de Rang y Dale (7.ª ed.). Elsevier Churchill Livingstone. ISBN 978-0-7020-3471-8.
- ^ Milligan G (diciembre de 2003). "Actividad constitutiva y agonistas inversos de los receptores acoplados a proteína G: una perspectiva actual". Farmacología molecular . 64 (6): 1271–6. doi :10.1124/mol.64.6.1271. PMID 14645655. S2CID 2454589.
- ^ Rang, HP (enero de 2006). "El concepto de receptor: la gran idea de la farmacología". British Journal of Pharmacology . 147 (Supl. 1): S9-16. doi :10.1038/sj.bjp.0706457. PMC 1760743 . PMID 16402126.
- ^ Ariens EJ (septiembre de 1954). «Afinidad y actividad intrínseca en la teoría de la inhibición competitiva. I. Problemas y teoría». Archives Internationales de Pharmacodynamie et de Therapie . 99 (1): 32–49. PMID 13229418.
- ^ Stephenson RP (diciembre de 1956). "Una modificación de la teoría del receptor". British Journal of Pharmacology and Chemotherapy . 11 (4): 379–93. doi :10.1111/j.1476-5381.1956.tb00006.x. PMC 1510558 . PMID 13383117.
- ^ Silverman RB (2004). "3.2.C Teorías de las interacciones fármaco-receptor". La química orgánica del diseño y la acción de los fármacos (2.ª ed.). Ámsterdam: Elsevier Academic Press. ISBN 0-12-643732-7.
- ^ Boulay G, Chrétien L, Richard DE, Guillemette G (noviembre de 1994). "La desensibilización a corto plazo del receptor de angiotensina II de las células glomerulares suprarrenales bovinas corresponde a un cambio de un estado de alta a baja afinidad". Endocrinología . 135 (5): 2130–6. doi :10.1210/en.135.5.2130. PMID 7956936.
- ^ abcdefghijkl Boulpaep EL, Boro WF (2005). Fisiología médica: un enfoque celular y molecular . San Luis, Missouri: Elsevier Saunders. pag. 90.ISBN 1-4160-2328-3.
- ^ Waltenbaugh C, Doan T, Melvold R, Viselli S (2008). Inmunología . Filadelfia: Wolters Kluwer Health/Lippincott Williams & Wilkins. pág. 20. ISBN 978-0-7817-9543-2.
Enlaces externos
- Base de datos GPCR y compendio de canales iónicos de la IUPHAR Archivado el 23 de marzo de 2019 en Wayback Machine
- Receptoma de membrana plasmática humana Archivado el 15 de septiembre de 2019 en Wayback Machine.
- Receptores de superficie celular en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
![{\displaystyle {[{\ce {L}}]+[{\ce {R}}]{\ce {<=>[{K_{d}}]}}[{\text{LR}}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bc59879baab1d42236bb74c50da94e2ceef5afd)