Inmunoglobulina M
| Inmunoglobulina M | |||||||
|---|---|---|---|---|---|---|---|
| (pentámero) | |||||||
 | |||||||
| Tipo de proteína | anticuerpo | ||||||
| |||||||
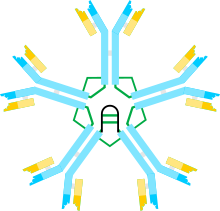
La inmunoglobulina M ( IgM ) es el mayor de varios isotipos de anticuerpos (también conocidos como inmunoglobulina ) que producen los vertebrados . La IgM es el primer anticuerpo que aparece en la respuesta a la exposición inicial a un antígeno ; [1] [2] lo que hace que también se le denomine anticuerpo de fase aguda. En los seres humanos y otros mamíferos que se han estudiado, los plasmoblastos del bazo son la principal fuente de producción de IgM específica. [3] [4]
Historia
En 1937, se observó un anticuerpo en caballos hiperinmunizados con polisacárido de neumococo que era mucho más grande en tamaño que la γ-globulina típica de conejo, [5] con un peso molecular de 990.000 daltons . [6] De acuerdo con su mayor tamaño, el nuevo anticuerpo se denominó originalmente γ-macroglobulina y, posteriormente, se denominó IgM (M por "macro"). Los dominios V de la inmunoglobulina normal son altamente heterogéneos, lo que refleja su papel en la protección contra la gran variedad de microbios infecciosos, y esta heterogeneidad impidió el análisis estructural detallado de la IgM. Posteriormente se descubrieron dos fuentes de IgM homogénea. Primero, se reconoció que la proteína de alto peso molecular producida por algunos pacientes con mieloma múltiple era una γ-macroglobulina producida por un tumor y, debido a que el tumor es un clon , la IgM que produce es homogénea. [7] En la década de 1960, se desarrollaron métodos para inducir tumores productores de inmunoglobulina (plasmacitomas) en ratones, proporcionando así una fuente de inmunoglobulinas homogéneas de varios isotipos, incluida la IgM (revisada en [8] ). Más recientemente, la expresión de genes de inmunoglobulina modificados genéticamente en cultivos de tejidos se puede utilizar para producir IgM con alteraciones específicas y, de este modo, identificar los requisitos moleculares para las características de interés. [ cita requerida ]
Estructura
Las inmunoglobulinas se componen de cadenas ligeras y cadenas pesadas. La cadena ligera (λ o κ) es una proteína de ~220 aminoácidos, compuesta por un dominio variable, VL (un segmento de aproximadamente 110 aminoácidos), y un dominio constante, CL (también de aproximadamente 110 aminoácidos de longitud). La cadena pesada μ de IgM es una proteína de ~576 aminoácidos, incluye un dominio variable (VH ~110 aminoácidos), cuatro dominios de región constante distintos (Cμ1, Cμ2, Cμ3, Cμ4, cada uno ~110 aminoácidos) y una "cola" de ~20 aminoácidos. La cadena pesada μ lleva oligosacáridos en cinco residuos de asparagina. Los oligosacáridos en IgM de ratón y humano se han caracterizado parcialmente mediante una variedad de técnicas, incluyendo RMN, unión de lectina, varios sistemas cromatográficos y sensibilidad enzimática (revisado en [9] ). La estructura de los oligosacáridos en cada sitio varía en detalle, y los oligosacáridos predominantes (biantenarios, triantenarios y con alto contenido de manosa) difieren entre los sitios. [ cita requerida ]

A) El heterodímero μL, a veces llamado semimero, con dominios de región variable (VH, VL) y constante (Cμ1, Cμ2, Cμ3, Cμ4tp; CL). Las cisteínas que median los enlaces disulfuro entre las cadenas μ se muestran como puntas de flecha rojas, de modo que un enlace disulfuro de cisteína aparece como una punta de flecha doble roja (rombo rojo). [ cita requerida ]
B) El “monómero” (μL)2 de IgM. Los enlaces disulfuro entre los dominios Cμ2 están representados por una punta de flecha doble roja.
C, D) Dos modelos para pentámero de IgM que contiene cadena J que han aparecido en varias publicaciones en varios momentos. Como en (B), los enlaces disulfuro entre los dominios Cμ2 y los enlaces disulfuro entre los dominios Cμ4tp están representados por una punta de flecha doble roja; Los enlaces disulfuro Cμ3 se representan (para mayor claridad) mediante flechas largas de dos puntas. La conectividad, es decir, el enlace disulfuro entre cadenas de las cadenas μ, se denota como conectividad eléctrica. En (C) los enlaces disulfuro Cμ3 unen cadenas μ en paralelo con los enlaces disulfuro Cμ4tp, y estos enlaces disulfuro unen cadenas μ en serie con los enlaces disulfuro Cμ2. En (D) los enlaces disulfuro Cμ2 y Cμ4tp unen cadenas μ en paralelo y ambos tipos unen cadenas μ en serie con los enlaces disulfuro Cμ3. (Figura reproducida con permiso del editor y los autores [10] ).
La estructura multimérica de la IgM se muestra esquemáticamente en la Figura 1. La Figura 1A muestra el "heterodímero" compuesto por una cadena ligera, denominada L, y una cadena pesada, denominada μ. Las cadenas pesada y ligera se mantienen unidas mediante enlaces disulfuro (representados como triángulos rojos) y mediante interacciones no covalentes.
La figura 1B muestra dos unidades μL unidas por un enlace disulfuro en los dominios Cμ2; esta estructura (μL)2 a menudo se denomina "monómero" de IgM, ya que es análoga en algunos aspectos a la estructura de la inmunoglobulina G (IgG) .
Sobre la base de su velocidad de sedimentación y apariencia en micrografías electrónicas, se infirió que la IgM generalmente se presenta como un "pentámero", es decir, un polímero compuesto de cinco "monómeros" [(μL)2]5, y fue representado originalmente por los modelos en las Figuras 1C y 1D, con enlaces disulfuro entre los dominios Cμ3 y entre las piezas de la cola. [11] [12] También se muestra que la IgM pentamérica incluye una tercera proteína, la cadena J. La cadena J (J para unir) fue descubierta como un componente unido covalentemente de la IgA y la IgM poliméricas. [13] [14] La cadena J es una proteína pequeña (~137 aminoácidos), ácida. Como se muestra, la cadena J une dos cadenas μ a través de enlaces disulfuro que involucran cisteínas en las piezas de la cola. [15]
Requisitos moleculares para la formación de IgM polimérica
Inicialmente se esperaba que la cadena J fuera importante para la formación de inmunoglobulinas poliméricas, y de hecho la polimerización de IgA depende fuertemente (pero no absolutamente) de la cadena J. [16] [17] Por el contrario, la IgM polimérica se forma eficientemente en ausencia de la cadena J. [18] [19]
La forma predominante de IgM humana y de ratón es el pentámero. A modo de comparación, la estructura de IgM de ranas (Xenopus) es predominantemente hexamérica, [20] [21] IgM de peces óseos es predominantemente tetramérica, y IgM de peces cartilaginosos (principalmente tiburones) es predominantemente pentamérica. [22] [23] Aunque la forma pentamérica predomina en ratones y humanos, también se ha observado la forma hexamérica. [24] [25] Estudios posteriores que utilizan sistemas de expresión de ADN recombinante indicaron que un hexámero es una forma principal de IgM de ratón cuando la IgM se produce en condiciones en las que se evita la incorporación de la cadena J, ya sea produciendo IgM en células que carecen de la cadena J [18] o produciendo IgM con una cadena pesada μ que carece de cisteína en la cola. [26] [27] En resumen, la IgM hexamérica nunca contiene la cadena J; La IgM pentamérica se puede formar de manera que incluya o no la cadena J. [28]
Una diferencia importante entre las cadenas pesadas μ y γ es la disponibilidad de cisteínas para formar enlaces disulfuro entre cadenas pesadas. En el caso de la cadena pesada γ, los únicos enlaces inter-γ están formados por cisteínas en la bisagra y, en consecuencia, cada cadena γ se une a solo otra cadena γ. Por el contrario, los dominios Cμ2 y Cμ3 y la cola incluyen cada uno una cisteína que forma un enlace disulfuro con otra cadena μ. Las cisteínas en los dominios Cμ2 median la formación de IgM monomérica (μL)2. La cola junto con la cisteína incluida es necesaria y suficiente para la formación de inmunoglobulinas poliméricas. Es decir, eliminar la cola de la cadena pesada μ previene la formación de IgM polimérica. [29] Por el contrario, las células que expresan una cadena pesada γ que se ha modificado para incluir la cola producen IgG polimérica. [30] [31] [32]
El papel de la cisteína en el dominio Cμ3 es más sutil. Las figuras 1C y 1D representan posibles modelos para la IgM pentamérica. En estos modelos, se prevé que cada cadena μ se una a otras dos cadenas μ. Sin embargo, ninguno de los modelos por sí solo puede explicar completamente la estructura de la IgM polimérica. Por ejemplo, el modelo de la figura 1C predice que el enlace disulfuro entre los dominios Cμ2 es esencial para la formación de la IgM polimérica unida mediante enlaces disulfuro. El modelo de la figura 1D predice que el enlace disulfuro entre los dominios Cμ3 es esencial. La IgM polimérica unida mediante enlaces disulfuro puede seguir formándose si falta alguna de las tres cisteínas. En el contexto de los modelos en los que cada cadena μ interactúa solo con otras dos cadenas μ, estos resultados sugieren que algunas moléculas son como las de la figura 1C y otras como las de la figura 1D. Sin embargo, la disponibilidad de tres cisteínas para la unión entre cadenas μ sugiere que las cadenas μ podrían unirse cada una a otras tres cadenas μ, como se ilustra en la Figura 2. En el mismo espíritu, la Figura 2C presenta un modelo para un pentámero que contiene cadena J que refleja evidencia de que la cadena J une cadenas μ que no están unidas a otras cadenas μ por las cisteínas en los dominios Cμ3. Estos y otros modelos, tanto regulares como irregulares, se analizan en otra parte. [27] [33]

A, B) Estas figuras representan dos de los muchos modelos posibles de enlaces disulfuro entre cadenas μ en IgM hexamérica. Como en la Figura 1, los enlaces disulfuro Cμ2 y los enlaces disulfuro Cμ4tp están representados por una doble punta de flecha roja, y los enlaces disulfuro Cμ3 están representados por las flechas largas de doble punta. En ambos modelos A y B, cada tipo de enlace disulfuro (Cμ2-Cμ2; Cμ3-Cμ3; Cμ4tp-Cμ4tp) une series de cadenas μ con cada una de las otras. Los métodos para distinguir estos y otros modelos se discuten en la referencia [28].
C) Esta representación de IgM pentamérica ilustra cómo la cadena J podría estar unida a cadenas μ que no están unidas a través de enlaces disulfuro Cμ3.
La IgM pentamérica se representa típicamente como que contiene una sola cadena J por polímero, pero en realidad las mediciones de la estequiometría de la cadena J han variado desde una molécula J por polímero hasta tres moléculas J por polímero. [34] [35] [36] [37] El amplio rango podría deberse a problemas técnicos, como un radiomarcaje incompleto o una cuantificación imprecisa de una línea de Ouchterlony. Sin embargo, la variación también podría deberse a la heterogeneidad en las preparaciones de IgM, es decir, las diversas preparaciones podrían haber diferido sustancialmente en su contenido de polímeros que contienen J y deficientes en J.
Estructura terciaria y cuaternaria de la región constante μ
Los dominios C2, C3 y C4tp individuales se generaron de forma independiente en E. coli y luego se estudiaron utilizando una variedad de enfoques, incluida la velocidad de sedimentación, la cristalografía de rayos X y la espectroscopia de RMN , para obtener información sobre la estructura tridimensional detallada de la cadena. Los dominios de la cadena pesada, como los de otras inmunoglobulinas, tienen las distintivas láminas superpuestas de siete hebras, que se estabilizan mediante enlaces disulfuro intradominio. En general, la región constante de IgM tiene una forma "similar a la de un hongo", con los dominios C2-C3 formando un disco similar a la cabeza del hongo y los dominios C4tp sobresaliendo como un tallo corto. [38]
Función
La IgM interactúa con varias otras moléculas fisiológicas:
- La IgM puede unirse al componente C1 del complemento y activar la vía clásica , lo que lleva a la opsonización de antígenos y la citólisis .
- La IgM se une al receptor de poliinmunoglobulina (pIgR) en un proceso que lleva la IgM a las superficies mucosas , como el lumen intestinal , y a la leche materna. Esta unión depende de la cadena J. [39]
- Se han detectado otros dos receptores Fc que se unen a IgM: Fcα/μ-R y Fcμ-R. Fcα/μ-R, al igual que pIgR, se une a IgM e IgA poliméricas. Fcα/μ-R puede mediar la endocitosis y su expresión en el intestino sugiere un papel en la inmunidad de las mucosas. Fcμ-R (antes conocido como Toso/Faim3) se une exclusivamente a IgM y puede mediar la captación celular del antígeno conjugado con IgM. [40] La inactivación de los genes correspondientes en ratones knock-out produce un fenotipo , pero las funciones fisiológicas de estos receptores aún son inciertas [41]
Regulación de la respuesta inmune
Las inmunoglobulinas específicas que se inyectan en animales junto con su antígeno pueden influir en la respuesta de anticuerpos a este mismo antígeno. [42] Los anticuerpos endógenos producidos después de una inmunización primaria también pueden afectar la respuesta de anticuerpos a una inmunización de refuerzo, lo que sugiere que se producen efectos similares durante las condiciones fisiológicas. Los efectos "reguladores" pueden ser positivos o negativos. Es decir, dependiendo del tipo de antígeno y del isotipo del anticuerpo, el efecto puede ser la supresión o el aumento de la respuesta de anticuerpos. Tales efectos están bien ilustrados por experimentos que involucran la inmunización con eritrocitos (glóbulos rojos) xenogénicos (extraños). Por ejemplo, cuando se administra IgG junto con eritrocitos xenogénicos, esta combinación causa una supresión casi completa de la respuesta de anticuerpos específicos de los eritrocitos. Este efecto se utiliza clínicamente para evitar que las madres Rh negativas se inmunicen contra los eritrocitos fetales Rh positivos, y su uso ha disminuido drásticamente la incidencia de la enfermedad hemolítica en los recién nacidos. [43] En contraste con el efecto de la IgG, la IgM específica de antígeno puede mejorar en gran medida la respuesta de anticuerpos, especialmente en el caso de antígenos grandes. [44] Por lo tanto, cuando se inyecta IgM específica para eritrocitos en animales (incluidos los humanos) junto con eritrocitos, se induce una respuesta de anticuerpos mucho más fuerte a los eritrocitos que cuando se administran eritrocitos solos. Varias líneas de evidencia indican que la capacidad de la IgM para activar el complemento es necesaria para su efecto potenciador. Es decir, la potenciación mediada por IgM no ocurre en animales que han sido depletados del componente C3 del complemento, ni en animales mutantes que carecen de los receptores 1 y 2 del complemento. De manera similar, la IgM mutante que no puede activar el complemento no mejora la respuesta inmune. Una posible explicación para la potenciación mediada por IgM es que los linfocitos B capturan complejos IgM-antígeno-complemento y transportan los complejos a áreas en el bazo donde se generan respuestas inmunes eficientes. Dado que la IgM se produce al principio de una respuesta inmunitaria, esto podría ser importante en el inicio de las respuestas de anticuerpos. [ cita requerida ]
Síntesis
En las células de la línea germinal (espermatozoides y óvulos), los genes que finalmente codificarán inmunoglobulinas no están en una forma funcional (ver recombinación V(D)J ). En el caso de la cadena pesada, tres segmentos de la línea germinal denominados V, D y J están ligados entre sí y se unen al ADN que codifica la región constante de la cadena pesada μ. Al principio de la ontogenia, las células B expresan tanto la cadena pesada μ como la δ; la coexpresión de estas dos cadenas pesadas, cada una con el mismo dominio V, depende del empalme alternativo y de los sitios alternativos de adición de poli-A. La expresión de los otros isotipos (γ, ε y α) se ve afectada por otro tipo de reordenamiento del ADN, un proceso llamado cambio de clase de inmunoglobulina . [45]
Importancia clínica
La IgM es la primera inmunoglobulina expresada en el feto humano (alrededor de las 20 semanas) [46] y filogenéticamente es el primer anticuerpo en desarrollarse. [47]
Los anticuerpos IgM aparecen en las primeras fases de la infección y suelen reaparecer, en menor medida, tras una mayor exposición. Los anticuerpos IgM no atraviesan la placenta humana (sólo el isotipo IgG ). [48]
Estas dos propiedades biológicas de la IgM la hacen útil en el diagnóstico de enfermedades infecciosas. La presencia de anticuerpos IgM en el suero de un paciente indica una infección reciente, o en el suero de un neonato indica una infección intrauterina (p. ej. , síndrome de rubéola congénita ).
El desarrollo de IgM anti-donante después del trasplante de órgano no está asociado con el rechazo del injerto, pero puede tener un efecto protector. [49]
A menudo se ha descubierto que la IgM presente en el suero normal se une a antígenos específicos, incluso en ausencia de inmunización previa. [50] Por este motivo, a veces se ha denominado a la IgM un "anticuerpo natural". Este fenómeno se debe probablemente a la gran avidez de la IgM, que le permite unirse de forma detectable incluso a antígenos de reacción cruzada débil que se producen de forma natural. Por ejemplo, los anticuerpos IgM que se unen a los antígenos A y B de los glóbulos rojos podrían formarse en las primeras etapas de la vida como resultado de la exposición a sustancias similares a A y B que están presentes en las bacterias o quizás también en los materiales vegetales.
Los anticuerpos IgM son los principales responsables de la aglutinación de los glóbulos rojos si el receptor de una transfusión de sangre recibe sangre que no es compatible con su tipo sanguíneo .
Una mutación de la cadena mu dentro de la IgM causa agammaglobulinemia autosómica recesiva. [51]
La presencia de IgM o, raramente, IgG es uno de los criterios obligatorios para el diagnóstico del síndrome de Schnitzler . [52] [53]
Véase también
Referencias
- ^ "Inmunoglobulina M". Diccionario American Heritage de la lengua inglesa (cuarta edición). Houghton Mifflin Company. 2004. ISBN 978-0618082308.
- ^ Alberts, B.; Johnson, A.; Lewis, J.; Walter, P.; Raff, M.; Roberts, K. (2002). "Capítulo 24". Biología molecular de la célula (4.ª ed.). Routledge. ISBN 978-0-8153-3288-6.
- ^ Capolunghi, F.; Rosado, MM; Sinibaldi, M.; Aranburu, A.; Carsetti, R. (2013). "¿Por qué necesitamos células B de memoria IgM?". Immunology Letters . 152 (2): 114–20. doi :10.1016/j.imlet.2013.04.007. PMID 23660557.
- ^ Williams, N.; O'Connell, PR (2008). "Capítulo 62". Bailey & Love's Short Practice of Surgery (25.ª ed.). CRC Press. pág. 1102. ISBN 9780340939321.
- ^ Heidelberger, M.; Pedersen, KO (1937). "El peso molecular de los anticuerpos". Revista de Medicina Experimental . 65 (3): 393–414. doi :10.1084/jem.65.3.393. PMC 2133497 . PMID 19870608.
- ^ Kabat, EA (1939). "El peso molecular de los anticuerpos". Revista de Medicina Experimental . 69 (1): 103–118. doi :10.1084/jem.69.1.103. PMC 2133729 . PMID 19870830.
- ^ Waldenström, J. (1943). "Mielomatisis incipiente o hieroglobulinemia "esencial" con fibrinogenopenia: ¿un nuevo síndrome?". Acta Medica Scandinavica . 142 (3–4): 216–247. doi :10.1111/j.0954-6820.1944.tb03955.x.
- ^ Potter, M. (2007). La historia temprana de los tumores de células plasmáticas en ratones, 1954-1976 . Vol. 98. págs. 17-51. doi :10.1016/S0065-230X(06)98002-6. ISBN 9780123738967. Número de identificación personal 17433907.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Monica, TJ; Williams, SB; Goochee, CF; Maiorella, BL (1995). "Caracterización de la glicosilación de una IgM humana producida por un hibridoma humano-ratón". Glycobiology . 5 (2): 175–185. doi :10.1093/glycob/5.2.175. PMID 7780192.
- ^ Heyman, B.; Shulman, MJ (2016). "Estructura, función y producción de inmunoglobulina M (IgM)". En Ratcliffe, M. (ed.). Enciclopedia de inmunobiología . Vol. 2. Elsevier. págs. 1–14. doi :10.1016/B978-0-12-374279-7.05001-3. ISBN . 978-0-12-374279-7.
- ^ Beale, D.; Feinstein, A. (1969). "Estudios sobre la reducción de una inmunoglobulina M 19S humana". Revista bioquímica . 112 (2): 187–194. doi :10.1042/bj1120187. PMC 1187691 . PMID 4979347.
- ^ Milstein, CP; et al. (1975). "Puentes disulfuro intercatenarios de la inmunoglobulina M de ratón". Revista bioquímica . 151 (3): 615–624. doi :10.1042/bj1510615. PMC 1172409 . PMID 766753.
- ^ Halpern, MS; Koshland, ME (1970). "Nueva subunidad de IgA secretora". Nature . 228 (5278): 1276–1278. Bibcode :1970Natur.228.1276H. doi :10.1038/2281276a0. PMID 5530654. S2CID 36189290.
- ^ Mestecky, J.; Zikin, J.; Butler, WT (1971). "Inmunoglobulina M e inmunoglobulina A secretora: presencia de una cadena polipeptídica común diferente de las cadenas ligeras". Science . 171 (3976): 1163–1165. Bibcode :1971Sci...171.1163M. doi :10.1126/science.171.3976.1163. PMID 5544873. S2CID 6834561.
- ^ Frutiger, S.; et al. (1992). "Asignación de enlaces disulfuro en la cadena J humana y su emparejamiento covalente con inmunoglobulina M". Bioquímica . 31 (50): 12643–12647. doi :10.1021/bi00165a014. PMID 1472500.
- ^ Johansen, FE; Braathen, R.; Brandtzaeg, P. (2000). "El papel de la cadena J en la formación de inmunoglobulina secretora". Revista escandinava de inmunología . 52 (3): 240–8. doi : 10.1046/j.1365-3083.2000.00790.x . PMID 10972899.
- ^ Sørensen, V.; et al. (2000). "Requisitos estructurales para la incorporación de la cadena J en IgM e IgA humanas". Inmunología internacional . 12 (1): 19–27. doi : 10.1093/intimm/12.1.19 . PMID 10607746.
- ^ ab Cattaneo, A.; Neuberger, MS (1987). "La inmunoglobulina polimérica M es secretada por transfectantes de células no linfoides en ausencia de la cadena J de inmunoglobulina". The EMBO Journal . 6 (9): 2753–2758. doi :10.1002/j.1460-2075.1987.tb02569.x. PMC 553699 . PMID 3119328.
- ^ Fazel, S.; Wiersma, EJ; Shulman, MJ (1997). "Interacción de la cadena J y el enlace disulfuro en el ensamblaje de IgM polimérica". Inmunología internacional . 9 (8): 1149–1158. doi : 10.1093/intimm/9.8.1149 . hdl : 1807/11898 . PMID 9263012.
- ^ Parkhouse, R.; Askonas, BA; Dourmashkin, RR (1970). "Estudios de microscopía electrónica de inmunoglobulina M de ratón; estructura y reconstitución después de la reducción". Inmunología . 18 (4): 575–584. PMC 1455497 . PMID 5421036.
- ^ Schwager, J.; Hadji-Azlmi, I. (1984). "Diferenciación de células B inducida por mitógeno en Xenopus laevis". Diferenciación . 27 (3): 182–188. doi :10.1111/j.1432-0436.1984.tb01426.x. PMID 6334001.
- ^ Fillatreau, S.; et al. (2013). "La asombrosa diversidad de clases de Ig y repertorios de células B en peces teleósteos". Frontiers in Immunology . 4 : 1–14. doi : 10.3389/fimmu.2013.00028 . PMC 3570791 . PMID 23408183.
- ^ Getahun, A.; et al. (1999). "Influencia de la secuencia C-terminal de la cadena μ en la polimerización de la inmunoglobulina M". Inmunología . 97 (3): 408–413. doi :10.1046/j.1365-2567.1999.00797.x. PMC 2326861 . PMID 10447761.
- ^ Dolder, F. (1971). "Presencia, aislamiento y puentes intercatenarios de inmunoglobulina M 7-S natural en suero humano". Biochimica et Biophysica Acta . 236 (3): 675–685. PMID 4997811.
- ^ Eskeland, T.; Christensen, TB (1975). "Moléculas de IgM con y sin cadena J en suero y después de la purificación, estudiadas por ultracentrifugación, electroforesis y microscopía electrónica". Scandinavian Journal of Immunology . 4 (3): 217–228. doi :10.1111/j.1365-3083.1975.tb02620.x. PMID 807966. S2CID 8246173.
- ^ Davis, AC; Roux, KH; Shulman, MJ (1988). "Sobre la estructura de la IgM polimérica". Revista Europea de Inmunología . 18 (7): 1001–1008. doi :10.1002/eji.1830180705. PMID 3136022. S2CID 34679165.
- ^ ab Davis, AC; et al. (1989). "Enlace disulfuro intermolecular en IgM: efectos de la sustitución de residuos de cisteína en la cadena pesada μ". The EMBO Journal . 8 (9): 2519–2526. doi :10.1002/j.1460-2075.1989.tb08389.x. PMC 401247 . PMID 2511005.
- ^ Collins, C.; Tsui, FW; Shulman, MJ (2002). "Activación diferencial del complemento humano y de cobaya por IgM pentamérica y hexamérica". Revista Europea de Inmunología . 32 (6): 1802–1810. doi : 10.1002/1521-4141(200206)32:6<1802::AID-IMMU1802>3.0.CO;2-C . PMID 12115664.
- ^ Davis, AC; et al. (1989). "Mutaciones de la cadena m H del ratón que impiden el ensamblaje de polímeros". Journal of Immunology . 43 (4): 1352–1357. doi : 10.4049/jimmunol.143.4.1352 . PMID 2501393. S2CID 40558731.
- ^ Smith, RIF; Coloma, MJ; Morrison, SL (1995). "La adición de una cola mu a la IgG da como resultado anticuerpos poliméricos con funciones efectoras mejoradas, incluida la citólisis mediada por complemento por IgG4". Journal of Immunology . 154 (5): 2226–2236. doi : 10.4049/jimmunol.154.5.2226 . PMID 7868896. S2CID 10506582.
- ^ Sørensen, V.; et al. (1996). "Efecto de las colas secretoras de IgM e IgA en la polimerización y secreción de IgM e IgG". Journal of Immunology . 156 (8): 2858–2865. doi : 10.4049/jimmunol.156.8.2858 . PMID 8609405. S2CID 23601980.
- ^ Smith, R.; Morrison, SL (1994). "IgG polimérica recombinante: un enfoque para diseñar anticuerpos más potentes". Nature Biotechnology . 12 (7): 683–688. doi :10.1038/nbt0794-683. PMID 7764912. S2CID 19055205.
- ^ Wiersma, EJ; Shulman, MJ (1995). "Ensamblaje de IgM: papel de los enlaces disulfuro y las interacciones no covalentes". Journal of Immunology . 154 (10): 5265–5272. doi : 10.4049/jimmunol.154.10.5265 . PMID 7730630. S2CID 22148157.
- ^ Chapuis, RM; Koshland, ME (1974). "Mecanismo de polimerización de IgM". Proc. Natl. Sci. USA 71 (3): 657–661. Bibcode :1974PNAS...71..657C. doi : 10.1073/pnas.71.3.657 . PMC 388071 . PMID 4207070.
- ^ Mihaesco, C.; Mihaesco, E.; Metzger, H. (1973). "Contenido variable de cadena J en IgM humana". FEBS Letters . 37 (2): 303–306. Bibcode :1973FEBSL..37..303M. doi : 10.1016/0014-5793(73)80483-1 . PMID 4202824. S2CID 41601548.
- ^ Brandtzaeg, P. (1976). "Formación de complejos entre el componente secretor y la inmunoglobulina humana relacionada con su contenido de cadena J". Revista escandinava de inmunología . 5 (4): 411–419. doi :10.1111/j.1365-3083.1976.tb00295.x. PMID 821140. S2CID 39847718.
- ^ Grubb, AO (1978). "Cuantificación de la cadena J en fluidos biológicos humanos mediante un procedimiento inmunoquímico simple". Acta Medica Scandinavica . 204 (1–6): 453–465. doi :10.1111/j.0954-6820.1978.tb08473.x. PMID 104551.
- ^ Müller, R.; et al. (2013). "Las estructuras de alta resolución de los dominios Fc de IgM revelan los principios de su formación de hexámeros". Proc. Natl. Sci. USA 110 (25): 10183–10188. Bibcode :2013PNAS..11010183M. doi : 10.1073/pnas.1300547110 . PMC 3690842 . PMID 23733956.
- ^ Johansen, FE; Braathen, R.; Brandtzaeg, P. (2000). "El papel de la cadena J en la formación de inmunoglobulina secretora". Revista escandinava de inmunología . 52 (3): 240–8. doi : 10.1046/j.1365-3083.2000.00790.x . PMID 10972899.
- ^ Shima, H.; et al. (2010). "Identificación de TOSO/FAIM3 como receptor Fc para IgM". Int. Inmunol. 22 (3): 149–56. doi : 10.1093/intimm/dxp121 . PMID 20042454.
- ^ Ouchida, R.; et al. (2012). "Función crítica del receptor Fc de IgM en la homeostasis de IgM, la supervivencia de las células B y las respuestas inmunitarias humorales". Proc. Natl. Sci. USA 109 (40): E2699–706. Bibcode :2012PNAS..109E2699O. doi : 10.1073/pnas.1210706109 . PMC 3479561 . PMID 22988094.
- ^ Heyman, B (2013). Regulación de la inmunidad humoral mediada por anticuerpos . en Nimmerjahn, F. (ed.) Mecanismos moleculares y celulares de la actividad de los anticuerpos: Springer.
- ^ Urbaniak, SJ y Greiss, MA (2000). "Enfermedad hemolítica RhD del feto y del recién nacido". Blood Rev . 14 (1): 33–61. doi :10.1054/blre.1999.0123. PMID 10805260.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Sörman A, Zhang L, Ding Z, Heyman, B. (2014). "Cómo los anticuerpos utilizan el complemento para regular las respuestas de anticuerpos". Mol. Immunol . 61 (2): 79–88. doi : 10.1016/j.molimm.2014.06.010 . PMID 25001046.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Murphy, K.; Weaver, C. (2016). Janeway's Immunobiology . Nueva York, NY: Garland Science/Taylor and Francis. pág. 195. ISBN 9780815345053.
- ^ van Furth, R.; Schuit, HR; Hijmans, W. (1965). "El desarrollo inmunológico del feto humano". Revista de Medicina Experimental . 122 (6): 1173–88. doi :10.1084/jem.122.6.1173. PMC 2138097 . PMID 4159036.
- ^ Reseña de Fisiología médica de William Francis Ganong
- ^ Matthews, TG; O'Herlihy, C. (noviembre de 1978). "Importancia de los niveles elevados de inmunoglobulina M en la sangre del cordón umbilical de lactantes pequeños para la edad gestacional". Archivos de enfermedades en la infancia . 53 (11): 895–898. doi :10.1136/adc.53.11.895. ISSN 1468-2044. PMC 1545275 . PMID 727813.
- ^ McAlister, CC; et al. (2004). "Producción de IgM anti-donante protectora después de un trasplante de hígado-riñón con resultado positivo en pruebas cruzadas". Trasplante de hígado . 10 (2): 315–9. doi : 10.1002/lt.20062 . PMID 14762873.
- ^ Jayasekera, JP; Moseman, EA; Carroll, MC (2007). "Los anticuerpos naturales y el complemento median la neutralización del virus de la gripe en ausencia de inmunidad previa". Journal of Virology . 81 (7): 3487–94. doi :10.1128/JVI.02128-06. PMC 1866020 . PMID 17202212.
- ^ "Entrada OMIM - # 601495 - AGAMMAGLOBULINEMIA 1, AUTOSÓMICA RECESIVA; AGM1". omim.org . Consultado el 25 de marzo de 2021 .
- ^ Gusdorf, L.; Lipsker, D. (17 de julio de 2017). "Síndrome de Schnitzler: una revisión". Current Rheumatology Reports . 19 (8): 46. doi :10.1007/s11926-017-0673-5. PMID 28718061. S2CID 13780498.
- ^ Simon, A.; Asli, B.; Braun-Falco, M.; Koning, H. De; Fermand, J.-P.; Grattan, C.; Krause, K.; Lachmann, H.; Lenormand, C.; Martinez-Taboada, V.; Maurer, M.; Peters, M.; Rizzi, R.; Rongioletti, F.; Ruzicka, T.; Schnitzler, L.; Schubert, B.; Sibilia, J.; Lipsker, D. (2013). "Síndrome de Schnitzler: diagnóstico, tratamiento y seguimiento". Alergia . 68 (5): 562–568. doi : 10.1111/all.12129 . PMID 23480774. S2CID 12831354.
Enlaces externos
- Inmunoglobulina+M en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Referencia sobre deficiencia de inmunoglobulina M de Medscape.com