Vía de señalización de Wnt
En biología celular, las vías de señalización de Wnt son un grupo de vías de transducción de señales que comienzan con proteínas que pasan señales a una célula a través de receptores de la superficie celular . El nombre Wnt es un acrónimo creado a partir de los nombres Wingless e Int-1. [1] Las vías de señalización de Wnt utilizan la comunicación entre células cercanas ( paracrina ) o la comunicación entre células del mismo tipo ( autocrina ). Están altamente conservadas evolutivamente en los animales, lo que significa que son similares en todas las especies animales, desde las moscas de la fruta hasta los humanos. [2] [3]
Se han caracterizado tres vías de señalización de Wnt: la vía Wnt canónica , la vía de polaridad celular planar no canónica y la vía Wnt/calcio no canónica . Las tres vías se activan mediante la unión de un ligando de proteína Wnt a un receptor de la familia Frizzled , que pasa la señal biológica a la proteína Dishevelled dentro de la célula. La vía Wnt canónica conduce a la regulación de la transcripción genética y se cree que está regulada negativamente en parte por el gen SPATS1 . [4] La vía de polaridad celular planar no canónica regula el citoesqueleto que es responsable de la forma de la célula. La vía Wnt/calcio no canónica regula el calcio dentro de la célula.
La señalización de Wnt se identificó primero por su papel en la carcinogénesis , luego por su función en el desarrollo embrionario . Los procesos embrionarios que controla incluyen la formación de patrones del eje corporal , la especificación del destino celular , la proliferación celular y la migración celular . Estos procesos son necesarios para la formación adecuada de tejidos importantes, incluidos los huesos, el corazón y los músculos. Su papel en el desarrollo embrionario se descubrió cuando las mutaciones genéticas en las proteínas de la vía Wnt produjeron embriones anormales de mosca de la fruta . Investigaciones posteriores descubrieron que los genes responsables de estas anomalías también influían en el desarrollo del cáncer de mama en ratones. La señalización de Wnt también controla la regeneración tisular en la médula ósea, la piel y el intestino adultos. [5]
La importancia clínica de esta vía fue demostrada por mutaciones que conducen a varias enfermedades, incluyendo cáncer de mama y próstata , glioblastoma , diabetes tipo II y otras. [6] [7] En los últimos años, los investigadores informaron el primer uso exitoso de inhibidores de la vía Wnt en modelos de enfermedad en ratones. [8]
Historia y etimología
El descubrimiento de la señalización de Wnt estuvo influenciado por la investigación sobre retrovirus oncogénicos (causantes de cáncer) . En 1982, Roel Nusse y Harold Varmus infectaron ratones con el virus del tumor mamario murino para mutar genes murinos y ver qué genes mutados podían causar tumores mamarios. Identificaron un nuevo protooncogén murino al que llamaron int1 (integración 1). [3] [9]
El int1 está altamente conservado en múltiples especies, incluidos los humanos y la Drosophila . Su presencia en D. melanogaster llevó a los investigadores a descubrir en 1987 que el gen int1 en Drosophila era en realidad el gen de Drosophila ya conocido y caracterizado conocido como Wingless (Wg). [3] Dado que las investigaciones previas de Christiane Nüsslein-Volhard y Eric Wieschaus (que les valió el Premio Nobel de Fisiología o Medicina en 1995) ya habían establecido la función de Wg como un gen de polaridad de segmento involucrado en la formación del eje corporal durante el desarrollo embrionario , los investigadores determinaron que el int1 de mamífero descubierto en ratones también está involucrado en el desarrollo embrionario. [10]
La investigación continua condujo al descubrimiento de otros genes relacionados con int1; sin embargo, debido a que esos genes no se identificaron de la misma manera que int1, la nomenclatura del gen int era inadecuada. Por lo tanto, la familia int/Wingless se convirtió en la familia Wnt e int1 se convirtió en Wnt1. El nombre Wnt es una combinación de int y Wg y significa "sitio de integración relacionado con Wingless". [3]
Proteínas
Wnt comprende una familia diversa de glicoproteínas de señalización modificadas por lípidos secretadas que tienen una longitud de 350 a 400 aminoácidos . [11] La modificación lipídica de todos los Wnt es la palmitoleoilación de un único residuo de cisteína totalmente conservado. [12] La palmitoleoilación es necesaria porque es necesaria para que Wnt se una a su proteína transportadora Wntless (WLS) para que pueda transportarse a la membrana plasmática para su secreción [13] y permite que la proteína Wnt se una a su receptor Frizzled [14] [15] Las proteínas Wnt también experimentan glicosilación , que une un carbohidrato para garantizar una secreción adecuada. [16] En la señalización de Wnt, estas proteínas actúan como ligandos para activar las diferentes vías de Wnt a través de rutas paracrinas y autocrinas. [2] [7]
Estas proteínas están altamente conservadas entre especies. [3] Se pueden encontrar en ratones, humanos, Xenopus , pez cebra , Drosophila y muchos otros. [17]
| Especies | Proteínas Wnt |
|---|---|
| Homo sapiens | WNT1 , WNT2 , WNT2B , WNT3 , WNT3A , WNT4 , WNT5A , WNT5B , WNT6 , WNT7A , WNT7B , WNT8A , WNT8B , WNT9A , WNT9B , WNT10A , WNT10B , WNT11 , WNT16 |
| Mus musculus (Proteínas idénticas a las del H. sapiens) | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt9A, Wnt9B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Xenopus | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt11R |
| Danio rerio | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Drosophila | Wg, DWnt2, DWnt3/5, DWnt 4, DWnt6, WntD/DWnt8, DWnt10 |
| Hidra | hywnt1, hywnt5a, hywnt8, hywnt7, hywnt9/10a, hywnt9/10b, hywnt9/10c, hywnt11, hywnt16 |
| C. elegans | mamá-2, lin-44, egl-20, cwn-1, cwn-2 [18] |
Mecanismo


Base
La señalización de Wnt comienza cuando una proteína Wnt se une al dominio extracelular rico en cisteína N-terminal de un receptor de la familia Frizzled (Fz). [19] Estos receptores abarcan la membrana plasmática siete veces y constituyen una familia distinta de receptores acoplados a proteína G (GPCR). [20] Sin embargo, para facilitar la señalización de Wnt, pueden requerirse correceptores junto con la interacción entre la proteína Wnt y el receptor Fz. Los ejemplos incluyen la proteína relacionada con el receptor de lipoproteína ( LRP )-5/6, el receptor de tirosina quinasa (RTK) y ROR2 . [7] Tras la activación del receptor, se envía una señal a la fosfoproteína Dishevelled (Dsh), que se encuentra en el citoplasma . Esta señal se transmite a través de una interacción directa entre Fz y Dsh. Las proteínas Dsh están presentes en todos los organismos y todas ellas comparten los siguientes dominios proteicos altamente conservados : un dominio DIX amino-terminal, un dominio PDZ central y un dominio DEP carboxi-terminal . Estos diferentes dominios son importantes porque después de Dsh, la señal de Wnt puede ramificarse en múltiples vías y cada vía interactúa con una combinación diferente de los tres dominios. [21]
Vías canónicas y no canónicas
Las tres vías de señalización de Wnt mejor caracterizadas son la vía Wnt canónica, la vía de polaridad celular planar no canónica y la vía Wnt/calcio no canónica. Como sugieren sus nombres, estas vías pertenecen a una de dos categorías: canónicas o no canónicas. La diferencia entre las categorías es que una vía canónica involucra a la proteína beta-catenina (β-catenina), mientras que una vía no canónica opera independientemente de ella. [19]

Vía canónica
La vía Wnt canónica (o vía Wnt/ β-catenina ) es la vía Wnt que provoca una acumulación de β-catenina en el citoplasma y su eventual translocación al núcleo para actuar como coactivador transcripcional de factores de transcripción que pertenecen a la familia TCF/LEF . Sin Wnt, la β-catenina no se acumularía en el citoplasma ya que un complejo de destrucción normalmente la degradaría. Este complejo de destrucción incluye las siguientes proteínas: Axin , adenomatosis polyposis coli (APC), proteína fosfatasa 2A (PP2A), glucógeno sintasa quinasa 3 (GSK3) y caseína quinasa 1 α (CK1α). [22] [23] Degrada la β-catenina dirigiéndola para la ubiquitinación , que posteriormente la envía al proteasoma para ser digerida. [19] [24] Sin embargo, tan pronto como Wnt se une a Fz y LRP5 / 6 , la función del complejo de destrucción se interrumpe. Esto se debe a que Wnt provoca la translocación del regulador negativo de Wnt, Axin, y el complejo de destrucción a la membrana plasmática. La fosforilación por otras proteínas en el complejo de destrucción posteriormente une a Axin a la cola citoplasmática de LRP5/6. Axin se desfosforila y su estabilidad y niveles disminuyen. Dsh luego se activa a través de la fosforilación y sus dominios DIX y PDZ inhiben la actividad GSK3 del complejo de destrucción. Esto permite que la β-catenina se acumule y se localice en el núcleo y posteriormente induzca una respuesta celular a través de la transducción génica junto con los factores de transcripción TCF/LEF (factor de células T/factor potenciador linfoide) [25] . [24] La β-catenina recluta otros coactivadores transcripcionales, como BCL9 , Pygopus [26] y Parafibromin/Hyrax. [27] La complejidad del complejo transcripcional ensamblado por la β-catenina está comenzando a emerger gracias a nuevos estudios proteómicos de alto rendimiento . [28] Sin embargo, aún falta una teoría unificada de cómo la β-catenina impulsa la expresión del gen objetivo, y los actores específicos del tejido podrían ayudar a la β-catenina a definir sus genes objetivo. [29] La extensividad de la β-cateninaLas proteínas que interactúan complican nuestra comprensión: la β-catenina puede ser fosforilada directamente en Ser552 por Akt, lo que provoca su disociación de los contactos célula-célula y su acumulación en el citosol, y después 14-3-3ζ interactúa con la β-catenina (pSer552) y mejora su translocación nuclear. [30] De hecho, se ha informado que BCL9 y Pygopus poseen varias funciones independientes de la β-catenina (por lo tanto, probablemente independientes de la señalización de Wnt). [31] [32] [33]
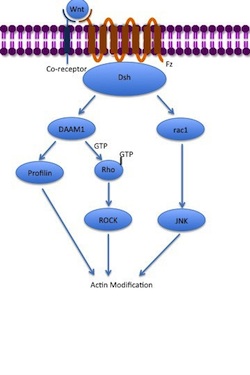
Vías no canónicas
La vía de polaridad celular planar no canónica (PCP) no involucra a la β-catenina. No utiliza LRP-5/6 como su correceptor y se cree que utiliza NRH1, Ryk , PTK7 o ROR2 . La vía PCP se activa a través de la unión de Wnt a Fz y su correceptor. Luego, el receptor recluta a Dsh , que utiliza sus dominios PDZ y DIX para formar un complejo con el activador asociado a Dishevelled de la morfogénesis 1 ( DAAM1 ). Luego, Daam1 activa la pequeña proteína G Rho a través de un factor de intercambio de guanina . Rho activa la quinasa asociada a Rho (ROCK), que es uno de los principales reguladores del citoesqueleto . Dsh también forma un complejo con rac1 y media la unión de la profilina a la actina . Rac1 activa JNK y también puede conducir a la polimerización de actina . La unión de la profilina a la actina puede provocar la reestructuración del citoesqueleto y la gastrulación . [7] [34]

La vía no canónica Wnt/calcio tampoco involucra a la β-catenina . Su función es ayudar a regular la liberación de calcio del retículo endoplasmático (RE) para controlar los niveles intracelulares de calcio. Al igual que otras vías Wnt, al unirse al ligando, el receptor Fz activado interactúa directamente con Dsh y activa dominios específicos de la proteína Dsh. Los dominios involucrados en la señalización Wnt/calcio son los dominios PDZ y DEP. [7] Sin embargo, a diferencia de otras vías Wnt, el receptor Fz interactúa directamente con una proteína G trimérica. Esta coestimulación de Dsh y la proteína G puede conducir a la activación de PLC o PDE específica de cGMP . Si se activa PLC, el componente de la membrana plasmática PIP2 se escinde en DAG e IP3 . Cuando IP3 se une a su receptor en el RE, se libera calcio. Las concentraciones aumentadas de calcio y DAG pueden activar Cdc42 a través de PKC . Cdc42 es un importante regulador de la formación de patrones ventrales. El aumento de calcio también activa la calcineurina y la CaMKII . La CaMKII induce la activación del factor de transcripción NFAT , que regula la adhesión celular, la migración y la separación de tejidos. [7] La calcineurina activa la quinasa TAK1 y NLK , que puede interferir con la señalización TCF/β-Catenina en la vía Wnt canónica. [35] Sin embargo, si se activa la PDE, se inhibe la liberación de calcio del RE. La PDE media esto a través de la inhibición de la PKG, que posteriormente causa la inhibición de la liberación de calcio. [7]
Vía Wnt integrada
La distinción binaria de las vías de señalización de Wnt canónicas y no canónicas ha sido objeto de escrutinio y se ha propuesto una vía de Wnt convergente e integrada. [36] Se encontró cierta evidencia de esto para un ligando de Wnt (Wnt5A). [37] Se describió evidencia de una vía de señalización de Wnt convergente que muestra la activación integrada de la señalización de Wnt/Ca2+ y Wnt/ β-catenina , para múltiples ligandos de Wnt, en líneas celulares de mamíferos. [38]
Otras vías
La señalización de Wnt también regula una serie de otras vías de señalización que no han sido tan ampliamente dilucidadas. Una de estas vías incluye la interacción entre Wnt y GSK3 . Durante el crecimiento celular, Wnt puede inhibir GSK3 para activar mTOR en ausencia de β-catenina. Sin embargo, Wnt también puede servir como un regulador negativo de mTOR a través de la activación del supresor tumoral TSC2 , que se regula positivamente a través de la interacción de Dsh y GSK3. [39] Durante la miogénesis , Wnt utiliza PA y CREB para activar los genes MyoD y Myf5 . [40] Wnt también actúa junto con Ryk y Src para permitir la regulación de la repulsión neuronal durante la guía axonal . Wnt regula la gastrulación cuando CK1 actúa como un inhibidor de Rap1-ATPasa para modular el citoesqueleto durante la gastrulación. Se logra una mayor regulación de la gastrulación cuando Wnt utiliza ROR2 junto con la vía CDC42 y JNK para regular la expresión de PAPC . La Dsh también puede interactuar con aPKC, Pa3, Par6 y LGl para controlar la polaridad celular y el desarrollo del citoesqueleto de microtúbulos . Si bien estas vías se superponen con componentes asociados con la señalización de PCP y Wnt/calcio, se consideran vías distintas porque producen respuestas diferentes. [7]
Regulación
Para garantizar un funcionamiento adecuado, la señalización de Wnt se regula constantemente en varios puntos a lo largo de sus vías de señalización. [41] Por ejemplo, las proteínas Wnt están palmitoiladas . La proteína porcupine media este proceso, lo que significa que ayuda a regular cuándo se secreta el ligando Wnt al determinar cuándo está completamente formado. La secreción se controla aún más con proteínas como GPR177 (wntless) y evenness interrumpido y complejos como el complejo retromer . [7] [24]
Tras la secreción , se puede evitar que el ligando llegue a su receptor mediante la unión de proteínas como los estabilizadores Dally y glipicano 3 (GPC3), que inhiben la difusión. En las células cancerosas, tanto las cadenas de sulfato de heparán [42] [43] como la proteína central [44] [45] de GPC3 participan en la regulación de la unión y activación de Wnt para la proliferación celular. [46] [47] Wnt reconoce una estructura de sulfato de heparán en GPC3, que contiene IdoA2S y GlcNS6S, y la 3-O-sulfatación en GlcNS6S3S mejora la unión de Wnt al glipicano de sulfato de heparán. [48] Se ha identificado un dominio rico en cisteína en el lóbulo N de GPC3 para formar un surco hidrofóbico de unión a Wnt que incluye fenilalanina-41 que interactúa con Wnt. [45] [49] El bloqueo del dominio de unión de Wnt utilizando un nanocuerpo llamado HN3 puede inhibir la activación de Wnt. [45]
En el receptor Fz, la unión de proteínas distintas de Wnt puede antagonizar la señalización. Los antagonistas específicos incluyen Dickkopf (Dkk), factor inhibidor de Wnt 1 (WIF-1), [50] [51] proteínas relacionadas con Frizzled secretadas (SFRP), Cerberus , Frzb , Wise , SOST y Naked cuticle . Estos constituyen inhibidores de la señalización de Wnt. Sin embargo, otras moléculas también actúan como activadores. Norrin y R-Spondin2 activan la señalización de Wnt en ausencia del ligando de Wnt.
Las interacciones entre las vías de señalización de Wnt también regulan la señalización de Wnt. Como se mencionó anteriormente, la vía Wnt/calcio puede inhibir TCF/β-catenina, lo que impide la señalización de la vía canónica de Wnt. [7] [24] La prostaglandina E2 (PGE2) es un activador esencial de la vía de señalización canónica de Wnt. La interacción de PGE2 con sus receptores E2/E4 estabiliza la β-catenina a través de la fosforilación mediada por cAMP/PKA. La síntesis de PGE2 es necesaria para los procesos mediados por la señalización de Wnt, como la regeneración tisular y el control de la población de células madre en el pez cebra y el ratón. [5] Curiosamente, las regiones no estructuradas de varias proteínas intrínsecamente desordenadas de gran tamaño desempeñan papeles cruciales en la regulación de la señalización de Wnt. [52]
Respuestas celulares inducidas
Desarrollo embrionario
La señalización de Wnt desempeña un papel fundamental en el desarrollo embrionario. Opera tanto en vertebrados como en invertebrados , incluidos humanos, ranas, pez cebra, C. elegans , Drosophila y otros. Se encontró por primera vez en la polaridad del segmento de Drosophila, donde ayuda a establecer polaridades anterior y posterior. Está implicado en otros procesos de desarrollo . Como sugiere su función en Drosophila , desempeña un papel clave en la formación del eje corporal , particularmente en la formación de los ejes anteroposterior y dorsoventral . Está involucrado en la inducción de la diferenciación celular para impulsar la formación de órganos importantes como los pulmones y los ovarios . Wnt asegura además el desarrollo de estos tejidos a través de la regulación adecuada de la proliferación y migración celular . Las funciones de señalización de Wnt se pueden dividir en patrón de ejes, especificación del destino celular, proliferación celular y migración celular. [53]
Patrones de ejes
En el desarrollo embrionario temprano, la formación de los ejes corporales primarios es un paso crucial para establecer el plan corporal general del organismo. Los ejes incluyen el eje anteroposterior, el eje dorsoventral y el eje derecha-izquierda. La señalización de Wnt está implicada en la formación de los ejes anteroposterior y dorsoventral (DV). La actividad de señalización de Wnt en el desarrollo anteroposterior se puede ver en mamíferos, peces y ranas. En los mamíferos, la línea primitiva y otros tejidos circundantes producen los compuestos morfogénicos Wnts, BMPs , FGFs , Nodal y ácido retinoico para establecer la región posterior durante la gástrula tardía . Estas proteínas forman gradientes de concentración. Las áreas de mayor concentración establecen la región posterior, mientras que las áreas de menor concentración indican la región anterior. En peces y ranas, la β-catenina producida por la señalización canónica de Wnt causa la formación de centros organizadores, que, junto con BMP, provocan la formación posterior. La participación de Wnt en la formación del eje DV se puede ver en la actividad de la formación del organizador de Spemann , que establece la región dorsal. La producción de β-catenina, que es la señalización canónica de Wnt, induce la formación de este organizador a través de la activación de los genes twin y siamois. [36] [53] De manera similar, en la gastrulación aviar, las células de la hoz de Koller expresan diferentes genes marcadores mesodérmicos que permiten el movimiento diferencial de las células durante la formación de la línea primitiva. La señalización de Wnt activada por los FGF es responsable de este movimiento. [54] [55]
La señalización de Wnt también está involucrada en la formación del eje de partes corporales y sistemas de órganos específicos más adelante en el desarrollo. En vertebrados, los gradientes de señalización morfogenética de sonic hedgehog (Shh) y Wnt establecen el eje dorsoventral del sistema nervioso central durante la formación del patrón axial del tubo neural . La señalización alta de Wnt establece la región dorsal mientras que la señalización alta de Shh indica la región ventral. [56] Wnt está involucrado en la formación de DV del sistema nervioso central a través de su participación en la guía de axones . Las proteínas Wnt guían los axones de la médula espinal en una dirección anteroposterior. [57] Wnt también está involucrado en la formación del eje DV de las extremidades. Específicamente, Wnt7a ayuda a producir el patrón dorsal de la extremidad en desarrollo. [36] [53]
En el modelo de desarrollo de las ondas de diferenciación embrionaria , Wnt desempeña un papel fundamental como parte de un complejo de señalización en células competentes listas para diferenciarse. Wnt reacciona a la actividad del citoesqueleto, estabilizando el cambio inicial creado por una onda de contracción o expansión pasajera y, simultáneamente, envía señales al núcleo mediante el uso de sus diferentes vías de señalización sobre en qué onda ha participado la célula individual. La actividad de Wnt, por tanto, amplifica la señalización mecánica que se produce durante el desarrollo. [58] [59]
Especificación del destino celular
La especificación del destino celular o la diferenciación celular es un proceso en el que las células indiferenciadas pueden convertirse en un tipo de célula más especializada. La señalización de Wnt induce la diferenciación de células madre pluripotentes en células progenitoras del mesodermo y el endodermo . [60] Estas células progenitoras se diferencian aún más en tipos de células como los linajes endoteliales, cardíacos y de músculo liso vascular. [61] La señalización de Wnt induce la formación de sangre a partir de células madre. Específicamente, Wnt3 conduce a células comprometidas con el mesodermo con potencial hematopoyético . [62] Wnt1 antagoniza la diferenciación neuronal y es un factor importante en la autorrenovación de las células madre neuronales. Esto permite la regeneración de las células del sistema nervioso, lo que es una prueba más de un papel en la promoción de la proliferación de células madre neuronales. [60] La señalización de Wnt está involucrada en la determinación de células germinales , la especificación del tejido intestinal , el desarrollo del folículo piloso , el desarrollo del tejido pulmonar, la diferenciación de las células de la cresta neural del tronco , el desarrollo de la nefrona , el desarrollo del ovario y la determinación del sexo . [53] La señalización de Wnt también antagoniza la formación del corazón, y se ha demostrado que la inhibición de Wnt es un inductor crítico del tejido cardíaco durante el desarrollo, [63] [64] [65] y los inhibidores de Wnt de moléculas pequeñas se utilizan rutinariamente para producir cardiomiocitos a partir de células madre pluripotentes. [66] [67]
Proliferación celular
Para que se produzca la diferenciación masiva de células necesaria para formar los tejidos celulares específicos de diferentes organismos, debe producirse la proliferación y el crecimiento de células madre embrionarias . Este proceso está mediado por la señalización Wnt canónica, que aumenta la β-catenina nuclear y citoplasmática. El aumento de β-catenina puede iniciar la activación transcripcional de proteínas como la ciclina D1 y c-myc , que controlan la transición de la fase G1 a la S en el ciclo celular . La entrada en la fase S provoca la replicación del ADN y, en última instancia, la mitosis , que son responsables de la proliferación celular. [68] Este aumento de la proliferación está directamente relacionado con la diferenciación celular porque, a medida que las células madre proliferan, también se diferencian. Esto permite el crecimiento y el desarrollo generales de sistemas de tejidos específicos durante el desarrollo embrionario. Esto es evidente en sistemas como el sistema circulatorio, donde Wnt3a conduce a la proliferación y expansión de las células madre hematopoyéticas necesarias para la formación de glóbulos rojos. [69]
La bioquímica de las células madre cancerosas es sutilmente diferente de la de otras células tumorales. Estas células llamadas adictas a Wnt secuestran y dependen de la estimulación constante de la vía Wnt para promover su crecimiento, supervivencia y migración descontrolados. En el cáncer , la señalización de Wnt puede volverse independiente de los estímulos regulares, a través de mutaciones en oncogenes descendentes y genes supresores de tumores que se activan permanentemente aunque el receptor normal no haya recibido una señal. La β-catenina se une a factores de transcripción como la proteína TCF4 y en combinación las moléculas activan los genes necesarios. LF3 inhibe fuertemente esta unión in vitro, en líneas celulares y redujo el crecimiento tumoral en modelos de ratón. Previno la replicación y redujo su capacidad de migrar, todo ello sin afectar a las células sanas. No quedaron células madre cancerosas después del tratamiento. El descubrimiento fue el producto del " diseño racional de fármacos ", que involucró tecnologías AlphaScreens y ELISA. [70]
Migración celular
La migración celular durante el desarrollo embrionario permite el establecimiento de ejes corporales, la formación de tejidos, la inducción de extremidades y varios otros procesos. La señalización de Wnt ayuda a mediar este proceso, particularmente durante la extensión convergente. La señalización tanto de la vía PCP de Wnt como de la vía Wnt canónica es necesaria para una extensión convergente adecuada durante la gastrulación. La extensión convergente está regulada además por la vía Wnt/calcio, que bloquea la extensión convergente cuando se activa. La señalización de Wnt también induce la migración celular en etapas posteriores del desarrollo a través del control del comportamiento migratorio de neuroblastos , células de la cresta neural , miocitos y células traqueales. [71]
La señalización de Wnt está involucrada en otro proceso clave de migración conocido como transición epitelial-mesenquimal (EMT). Este proceso permite que las células epiteliales se transformen en células mesenquimales de modo que ya no se mantengan en su lugar en la laminina . Implica la regulación negativa de la cadherina para que las células puedan desprenderse de la laminina y migrar. La señalización de Wnt es un inductor de la EMT, particularmente en el desarrollo mamario. [72]
Sensibilidad a la insulina

La insulina es una hormona peptídica que interviene en la homeostasis de la glucosa en ciertos organismos. En concreto, provoca la regulación positiva de los transportadores de glucosa en la membrana celular para aumentar la captación de glucosa del torrente sanguíneo . Este proceso está parcialmente mediado por la activación de la señalización Wnt/β-catenina, que puede aumentar la sensibilidad a la insulina de una célula. En particular, Wnt10b es una proteína Wnt que aumenta esta sensibilidad en las células del músculo esquelético. [73]
Implicaciones clínicas
Cáncer
Desde su descubrimiento inicial, la señalización de Wnt ha estado asociada con el cáncer . Cuando se descubrió Wnt1, se identificó por primera vez como un protooncogén en un modelo de ratón para el cáncer de mama. El hecho de que Wnt1 sea un homólogo de Wg muestra que está involucrado en el desarrollo embrionario, que a menudo requiere una rápida división y migración celular. La mala regulación de estos procesos puede conducir al desarrollo de tumores a través de una proliferación celular excesiva. [3]
La actividad de la vía Wnt canónica está involucrada en el desarrollo de tumores mamarios benignos y malignos . El papel de la vía Wnt en la quimiorresistencia tumoral también ha sido bien documentado, así como su papel en el mantenimiento de una subpoblación distinta de células iniciadoras de cáncer. [74] Su presencia se revela por niveles elevados de β-catenina en el núcleo y/o citoplasma, que pueden detectarse con tinción inmunohistoquímica y Western blot . El aumento de la expresión de β-catenina se correlaciona con un mal pronóstico en pacientes con cáncer de mama. Esta acumulación puede deberse a factores como mutaciones en β-catenina , deficiencias en el complejo de destrucción de β-catenina, más frecuentemente por mutaciones en regiones estructuralmente desordenadas de APC , sobreexpresión de ligandos Wnt, pérdida de inhibidores y/o disminución de la actividad de las vías reguladoras (como la vía Wnt/calcio). [52] [75] [76] Los tumores de mama pueden hacer metástasis debido a la participación de Wnt en la EMT. Las investigaciones que analizaron la metástasis del cáncer de mama de tipo basal a los pulmones mostraron que la represión de la señalización de Wnt/β-catenina puede prevenir la EMT, que puede inhibir la metástasis. [77]
La señalización de Wnt se ha implicado en el desarrollo de otros cánceres, así como en la fibromatosis desmoide . [78] Los cambios en la expresión de CTNNB1 , que es el gen que codifica la β-catenina, se pueden medir en cáncer de mama, colorrectal , melanoma , próstata , pulmón y otros cánceres. Se observó una mayor expresión de proteínas ligando de Wnt como Wnt1, Wnt2 y Wnt7A en el desarrollo de glioblastoma , cáncer de esófago y cáncer de ovario respectivamente. Otras proteínas que causan múltiples tipos de cáncer en ausencia de un funcionamiento adecuado incluyen ROR1, ROR2, SFRP4 , Wnt5A, WIF1 y las de la familia TCF/LEF. [79] La señalización de Wnt está implicada además en la patogénesis de la metástasis ósea del cáncer de mama y próstata con estudios que sugieren estados discretos de encendido y apagado. Wnt es regulado negativamente durante la etapa de latencia por DKK1 autocrino para evitar la vigilancia inmunológica, [80] así como durante las etapas de diseminación por Dact1 intracelular. [81] Mientras tanto, Wnt es activado durante la fase de crecimiento temprano por E-selectina . [82]
El vínculo entre PGE2 y Wnt sugiere que un aumento crónico relacionado con la inflamación de PGE2 puede conducir a la activación de la vía Wnt en diferentes tejidos, lo que resulta en carcinogénesis . [5]
Diabetes tipo II
La diabetes mellitus tipo 2 es una enfermedad común que causa una secreción reducida de insulina y un aumento de la resistencia a la insulina en la periferia. Produce un aumento de los niveles de glucosa en sangre, o hiperglucemia , que puede ser fatal si no se trata. Dado que la señalización de Wnt está involucrada en la sensibilidad a la insulina, el mal funcionamiento de su vía podría estar involucrado. La sobreexpresión de Wnt5b, por ejemplo, puede aumentar la susceptibilidad debido a su papel en la adipogénesis , ya que la obesidad y la diabetes tipo II tienen una alta comorbilidad . [83] La señalización de Wnt es un fuerte activador de la biogénesis mitocondrial . Esto conduce a una mayor producción de especies reactivas de oxígeno (ROS) que se sabe que causan daño celular y del ADN. [84] Este daño inducido por ROS es significativo porque puede causar resistencia a la insulina hepática aguda o resistencia a la insulina inducida por lesión. [85] Las mutaciones en los factores de transcripción asociados a la señalización de Wnt, como TCF7L2 , están relacionadas con una mayor susceptibilidad. [86]
Véase también
- AXIN1
- GSK-3
- Manejo de la caída del cabello
- Elemento de localización sin alas 3 (WLE3)
- Proteína 1 de la vía de señalización inducible por WNT1 (WISP1)
- Proteína 2 de la vía de señalización inducible por WNT1 (WISP2)
- Proteína 3 de la vía de señalización inducible por WNT1 (WISP3)
Referencias
- ^ Nusse R, Brown A, Papkoff J, Scambler P, Shackleford G, McMahon A, et al. (enero de 1991). "Una nueva nomenclatura para int-1 y genes relacionados: la familia de genes Wnt". Cell . 64 (2): 231. doi : 10.1016/0092-8674(91)90633-a . PMID 1846319. S2CID 3189574.
- ^ ab Nusse R, Varmus HE (junio de 1992). "Genes Wnt". Celúla . 69 (7): 1073–87. doi :10.1016/0092-8674(92)90630-U. PMID 1617723. S2CID 10422968.
- ^ abcdef Nusse R (enero de 2005). "Señalización de Wnt en la enfermedad y en el desarrollo". Cell Research . 15 (1): 28–32. doi : 10.1038/sj.cr.7290260 . PMID 15686623.
- ^ Zhang H, Zhang H, Zhang Y, Ng SS, Ren F, Wang Y, Duan Y, Chen L, Zhai Y, Guo Q, Chang Z (noviembre de 2010). "La proteína de interacción con el dominio DEP desaliñada (DDIP) inhibe la señalización de Wnt al promover la degradación de TCF4 y alterar el complejo TCF4 / beta-catenina". Señalización Celular . 22 (11): 1753–60. doi :10.1016/j.cellsig.2010.06.016. PMID 20603214.
- ^ abc Goessling W, North TE, Loewer S, Lord AM, Lee S, Stoick-Cooper CL, Weidinger G, Puder M, Daley GQ, Moon RT, Zon LI (marzo de 2009). "La interacción genética de la señalización de PGE2 y Wnt regula la especificación del desarrollo de las células madre y la regeneración". Cell . 136 (6): 1136–47. doi :10.1016/j.cell.2009.01.015. PMC 2692708 . PMID 19303855.
- ^ Logan CY, Nusse R (2004). "La vía de señalización de Wnt en el desarrollo y la enfermedad". Revisión anual de biología celular y del desarrollo . 20 : 781–810. CiteSeerX 10.1.1.322.311 . doi :10.1146/annurev.cellbio.20.010403.113126. PMID 15473860.
- ^ abcdefghij Komiya Y, Habas R (abril de 2008). "Vías de transducción de señales Wnt". Organogénesis . 4 (2): 68–75. doi : 10.4161/org.4.2.5851. PMC 2634250 . PMID 19279717.
- ^ Zimmerli D, Hausmann G, Cantù C, Basler K (diciembre de 2017). "Intervenciones farmacológicas en la vía Wnt: inhibición de la secreción de Wnt frente a alteración de las interfaces proteína-proteína de los factores nucleares". British Journal of Pharmacology . 174 (24): 4600–4610. doi :10.1111/bph.13864. PMC 5727313 . PMID 28521071.
- ^ Nusse R, van Ooyen A, Cox D, Fung YK, Varmus H (1984). "Modo de activación proviral de un supuesto oncogén mamario (int-1) en el cromosoma 15 del ratón". Nature . 307 (5947): 131–6. Bibcode :1984Natur.307..131N. doi :10.1038/307131a0. PMID 6318122. S2CID 4261052.
- ^ Klaus A, Birchmeier W (mayo de 2008). "Señalización de Wnt y su impacto en el desarrollo y el cáncer". Nature Reviews. Cáncer . 8 (5): 387–98. doi :10.1038/nrc2389. PMID 18432252. S2CID 31382024.
- ^ Cadigan KM, Nusse R (diciembre de 1997). "Señalización de Wnt: un tema común en el desarrollo animal". Genes & Development . 11 (24): 3286–305. doi : 10.1101/gad.11.24.3286 . PMID 9407023.
- ^ Hannoush RN (octubre de 2015). "Lipidización de proteínas sintéticas". Current Opinion in Chemical Biology . 28 : 39–46. doi :10.1016/j.cbpa.2015.05.025. PMID 26080277.
- ^ Yu J, Chia J, Canning CA, Jones CM, Bard FA, Virshup DM (mayo de 2014). "Transporte retrógrado de WLS al retículo endoplásmico durante la secreción de Wnt". Developmental Cell . 29 (3): 277–91. doi : 10.1016/j.devcel.2014.03.016 . PMID 24768165.
- ^ Janda CY, Waghray D, Levin AM, Thomas C, Garcia KC (julio de 2012). "Base estructural del reconocimiento de Wnt por Frizzled". Science . 337 (6090): 59–64. Bibcode :2012Sci...337...59J. doi :10.1126/science.1222879. PMC 3577348 . PMID 22653731.
- ^ Hosseini V, Dani C, Geranmayeh MH, Mohammadzadeh F, Nazari Soltan Ahmad S, Darabi M (junio de 2019). "Lipidización de Wnt: funciones en el tráfico, la modulación y la función". Journal of Cellular Physiology . 234 (6): 8040–8054. doi :10.1002/jcp.27570. PMID 30341908. S2CID 53009014.
- ^ Kurayoshi M, Yamamoto H, Izumi S, Kikuchi A (marzo de 2007). "La palmitoilación y la glicosilación postraduccional de Wnt-5a son necesarias para su señalización". The Biochemical Journal . 402 (3): 515–23. doi :10.1042/BJ20061476. PMC 1863570 . PMID 17117926.
- ^ Nusse, Roel. "La página de inicio de Wnt" . Consultado el 15 de abril de 2013 .
- ^ Sawa H, Korswagen HC (marzo de 2013). "Señalización WNT en C. Elegans". WormBook : 1–30. doi :10.1895/wormbook.1.7.2. PMC 5402212 . PMID 25263666.
- ^ abc Rao TP, Kühl M (junio de 2010). "Una descripción actualizada de las vías de señalización de Wnt: un preludio para más". Circulation Research . 106 (12): 1798–806. doi : 10.1161/CIRCRESAHA.110.219840 . PMID 20576942.
- ^ Schulte G, Bryja V (octubre de 2007). "La familia Frizzled de receptores acoplados a proteína G no convencionales". Tendencias en ciencias farmacológicas . 28 (10): 518–25. doi :10.1016/j.tips.2007.09.001. PMID 17884187.
- ^ Habas R, Dawid IB (febrero de 2005). "Señalización de Disheveled y Wnt: ¿es el núcleo la última frontera?". Journal of Biology . 4 (1): 2. doi : 10.1186/jbiol22 . PMC 551522 . PMID 15720723.
- ^ Minde DP, Anvarian Z, Rüdiger SG, Maurice MM (agosto de 2011). "Desorden desordenado: ¿cómo las mutaciones sin sentido en la proteína supresora de tumores APC conducen al cáncer?". Molecular Cancer . 10 : 101. doi : 10.1186/1476-4598-10-101 . PMC 3170638 . PMID 21859464.
- ^ Minde DP, Radli M, Forneris F, Maurice MM, Rüdiger SG (2013). Buckle AM (ed.). "La gran extensión del desorden en la poliposis adenomatosa coli ofrece una estrategia para proteger la señalización de Wnt contra mutaciones puntuales". PLOS ONE . 8 (10): e77257. Bibcode :2013PLoSO...877257M. doi : 10.1371/journal.pone.0077257 . PMC 3793970 . PMID 24130866.
- ^ abcd MacDonald BT, Tamai K, He X (julio de 2009). "Señalización Wnt/beta-catenina: componentes, mecanismos y enfermedades". Developmental Cell . 17 (1): 9–26. doi :10.1016/j.devcel.2009.06.016. PMC 2861485 . PMID 19619488.
- ^ Staal FJ, Clevers H (febrero de 2000). "Factores de transcripción Tcf/Lef durante el desarrollo de las células T: funciones únicas y superpuestas". The Hematology Journal . 1 (1): 3–6. doi :10.1038/sj.thj.6200001. PMID 11920163.
- ^ Kramps T, Peter O, Brunner E, Nellen D, Froesch B, Chatterjee S, Murone M, Züllig S, Basler K (abril de 2002). "La señalización Wnt/wingless requiere el reclutamiento de pygopus mediado por BCL9/legless al complejo nuclear beta-catenina-TCF" (PDF) . Cell . 109 (1): 47–60. doi :10.1016/s0092-8674(02)00679-7. PMID 11955446. S2CID 16720801. Archivado desde el original (PDF) el 2021-09-26 . Consultado el 2020-06-03 .
- ^ Mosimann C, Hausmann G, Basler K (abril de 2006). "Parafibromin/Hyrax activa la transcripción del gen diana Wnt/Wg mediante asociación directa con beta-catenina/Armadillo". Cell . 125 (2): 327–41. doi : 10.1016/j.cell.2006.01.053 . PMID 16630820.
- ^ van Tienen LM, Mieszczanek J, Fiedler M, Rutherford TJ, Bienz M (marzo de 2017). "Andamiaje constitutivo de múltiples componentes del potenciador de Wnt por Legless/BCL9". eLife . 6 : e20882. doi : 10.7554/elife.20882 . PMC 5352222 . PMID 28296634.
- ^ Söderholm, Simon; Cantù, Claudio (21 de octubre de 2020). "La transcripción dependiente de WNT/β-catenina: un asunto específico de los tejidos". WIREs Systems Biology and Medicine . 13 (3): e1511. doi : 10.1002/wsbm.1511 . PMC 9285942 . PMID 33085215.
- ^ Fang D, Hawke D, Zheng Y, Xia Y, Meisenhelder J, Nika H, Mills GB, Kobayashi R, Hunter T, Lu Z (abril de 2007). "La fosforilación de beta-catenina por AKT promueve la actividad transcripcional de beta-catenina". Journal of Biological Chemistry . 282 (15): 11221–9. doi : 10.1074/jbc.M611871200 . PMC 1850976 . PMID 17287208.
- ^ Cantù C, Valenta T, Hausmann G, Vilain N, Aguet M, Basler K (junio de 2013). "La interacción Pygo2-H3K4me2/3 es prescindible para el desarrollo del ratón y la transcripción dependiente de la señalización de Wnt". Desarrollo . 140 (11): 2377–86. doi : 10.1242/dev.093591 . PMID 23637336.
- ^ Cantù C, Zimmerli D, Hausmann G, Valenta T, Moor A, Aguet M, Basler K (septiembre de 2014). "Función de las proteínas Bcl9 dependiente de Pax6, pero independiente de β-catenina, en el desarrollo del cristalino del ratón". Genes & Development . 28 (17): 1879–84. doi :10.1101/gad.246140.114. PMC 4197948 . PMID 25184676.
- ^ Cantù C, Pagella P, Shajiei TD, Zimmerli D, Valenta T, Hausmann G, Basler K, Mitsiadis TA (febrero de 2017). "Un papel citoplasmático de los cofactores transcripcionales Wnt / β-catenina Bcl9, Bcl9l y Pygopus en la formación del esmalte dental". Señalización científica . 10 (465): eah4598. doi : 10.1126/scisignal.aah4598. PMID 28174279. S2CID 6845295.
- ^ Gordon MD, Nusse R (agosto de 2006). "Señalización de Wnt: múltiples vías, múltiples receptores y múltiples factores de transcripción". The Journal of Biological Chemistry . 281 (32): 22429–33. doi : 10.1074/jbc.R600015200 . PMID 16793760.
- ^ Sugimura R, Li L (diciembre de 2010). "Señalización Wnt no canónica en el desarrollo de vertebrados, células madre y enfermedades". Birth Defects Research. Parte C, Embryo Today . 90 (4): 243–56. doi :10.1002/bdrc.20195. PMID 21181886.
- ^ abc van Amerongen R, Nusse R (octubre de 2009). "Hacia una visión integrada de la señalización de Wnt en el desarrollo". Desarrollo . 136 (19): 3205–14. doi :10.1242/dev.033910. PMID 19736321. S2CID 16120512.
- ^ van Amerongen R, Fuerer C, Mizutani M, Nusse R (septiembre de 2012). "Wnt5a puede activar y reprimir la señalización Wnt/β-catenina durante el desarrollo embrionario del ratón". Biología del desarrollo . 369 (1): 101–14. doi :10.1016/j.ydbio.2012.06.020. PMC 3435145 . PMID 22771246.
- ^ Thrasivoulou C, Millar M, Ahmed A (diciembre de 2013). "Activación del calcio intracelular por múltiples ligandos de Wnt y translocación de β-catenina al núcleo: un modelo convergente de las vías Wnt/Ca2+ y Wnt/β-catenina". The Journal of Biological Chemistry . 288 (50): 35651–9. doi : 10.1074/jbc.M112.437913 . PMC 3861617 . PMID 24158438.
- ^ Inoki K, Ouyang H, Zhu T, Lindvall C, Wang Y, Zhang X, Yang Q, Bennett C, Harada Y, Stankunas K, Wang CY, He X, MacDougald OA, You M, Williams BO, Guan KL (septiembre de 2006). "TSC2 integra señales de energía y Wnt a través de una fosforilación coordinada por AMPK y GSK3 para regular el crecimiento celular". Cell . 126 (5): 955–68. doi : 10.1016/j.cell.2006.06.055 . PMID 16959574. S2CID 16047397.
- ^ Kuroda K, Kuang S, Taketo MM, Rudnicki MA (marzo de 2013). "La señalización Wnt canónica induce a BMP-4 para especificar la miofibrogénesis lenta de los mioblastos fetales". Músculo esquelético . 3 (1): 5. doi : 10.1186/2044-5040-3-5 . PMC 3602004 . PMID 23497616.
- ^ Malinauskas T, Jones EY (diciembre de 2014). "Moduladores extracelulares de la señalización de Wnt". Current Opinion in Structural Biology . 29 : 77–84. doi : 10.1016/j.sbi.2014.10.003 . PMID 25460271.
- ^ Gao W, Kim H, Feng M, Phung Y, Xavier CP, Rubin JS, Ho M (agosto de 2014). "Inactivación de la señalización de Wnt por un anticuerpo humano que reconoce las cadenas de heparán sulfato de glipicano-3 para la terapia del cáncer de hígado". Hepatología . 60 (2): 576–87. doi :10.1002/hep.26996. PMC 4083010 . PMID 24492943.
- ^ Gao W, Xu Y, Liu J, Ho M (mayo de 2016). "Mapeo de epítopos por un anticuerpo bloqueador de Wnt: evidencia del dominio de unión de Wnt en heparán sulfato". Scientific Reports . 6 : 26245. Bibcode :2016NatSR...626245G. doi :10.1038/srep26245. PMC 4869111 . PMID 27185050.
- ^ Gao W, Tang Z, Zhang YF, Feng M, Qian M, Dimitrov DS, Ho M (marzo de 2015). "La inmunotoxina dirigida al glipicano-3 hace retroceder el cáncer de hígado mediante la doble inhibición de la señalización de Wnt y la síntesis de proteínas". Nature Communications . 6 : 6536. Bibcode :2015NatCo...6.6536G. doi :10.1038/ncomms7536. PMC 4357278 . PMID 25758784.
- ^ abc Li N, Wei L, Liu X, Bai H, Ye Y, Li D, et al. (abril de 2019). "Un dominio rico en cisteína similar a Frizzled en Glypican-3 media la unión de Wnt y regula el crecimiento del tumor de carcinoma hepatocelular en ratones". Hepatología . 70 (4): 1231–1245. doi :10.1002/hep.30646. PMC 6783318 . PMID 30963603.
- ^ Ho M, Kim H (febrero de 2011). "Glypican-3: un nuevo objetivo para la inmunoterapia contra el cáncer". Revista Europea del Cáncer . 47 (3): 333–8. doi :10.1016/j.ejca.2010.10.024. PMC 3031711 . PMID 21112773.
- ^ Li N, Gao W, Zhang YF, Ho M (noviembre de 2018). "Glipícanos como dianas terapéuticas contra el cáncer". Tendencias en el cáncer . 4 (11): 741–754. doi :10.1016/j.trecan.2018.09.004. PMC 6209326 . PMID 30352677.
- ^ Gao, Wei; Xu, Yongmei; Liu, Jian; Ho, Mitchell (17 de mayo de 2016). "Mapeo de epítopos por un anticuerpo bloqueador de Wnt: evidencia del dominio de unión de Wnt en heparán sulfato". Scientific Reports . 6 : 26245. Bibcode :2016NatSR...626245G. doi :10.1038/srep26245. ISSN 2045-2322. PMC 4869111 . PMID 27185050.
- ^ Kolluri A, Ho M (2 de agosto de 2019). "El papel del glipicano-3 en la regulación de Wnt, YAP y Hedgehog en el cáncer de hígado". Frontiers in Oncology . 9 : 708. doi : 10.3389/fonc.2019.00708 . PMC 6688162 . PMID 31428581.
- ^ Malinauskas T, Aricescu AR, Lu W, Siebold C, Jones EY (julio de 2011). "Mecanismo modular de inhibición de la señalización de Wnt por el factor inhibidor de Wnt 1". Nature Structural & Molecular Biology . 18 (8): 886–93. doi :10.1038/nsmb.2081. PMC 3430870 . PMID 21743455.
- ^ Malinauskas T (marzo de 2008). "Acoplamiento de ácidos grasos al dominio WIF del factor inhibidor de Wnt humano 1". Lípidos . 43 (3): 227–30. doi :10.1007/s11745-007-3144-3. PMID 18256869. S2CID 31357937.
- ^ ab Minde DP, Radli M, Forneris F, Maurice MM, Rüdiger SG (2013). "La gran extensión del desorden en la poliposis adenomatosa coli ofrece una estrategia para proteger la señalización de Wnt contra mutaciones puntuales". PLOS ONE . 8 (10): e77257. Bibcode :2013PLoSO...877257M. doi : 10.1371/journal.pone.0077257 . PMC 3793970 . PMID 24130866.
- ^ abcd Gilbert SF (2010). Biología del desarrollo (novena edición). Sunderland, Mass.: Sinauer Associates. ISBN 9780878933846.
- ^ Vasiev B, Balter A, Chaplain M, Glazier JA, Weijer CJ (mayo de 2010). "Modelado de la gastrulación en el embrión de pollo: formación de la línea primitiva". PLOS ONE . 5 (5): e10571. Bibcode :2010PLoSO...510571V. doi : 10.1371/journal.pone.0010571 . PMC 2868022 . PMID 20485500.
- ^ Gilbert SF (2014). "Desarrollo temprano en aves". Biología del desarrollo (10.ª ed.). Sunderland (MA): Sinauer Associates.
- ^ Ulloa F, Martí E (enero de 2010). "Wnt ganó la guerra: el papel antagónico de Wnt sobre Shh controla la configuración dorsoventral del tubo neural de los vertebrados". Dinámica del desarrollo . 239 (1): 69–76. doi : 10.1002/dvdy.22058 . PMID 19681160.
- ^ Zou Y (septiembre de 2004). "Señalización Wnt en la guía axonal". Tendencias en neurociencias . 27 (9): 528–32. doi :10.1016/j.tins.2004.06.015. PMID 15331234. S2CID 15635026.
- ^ Gordon NK, Gordon R (marzo de 2016). "El orgánulo de diferenciación en embriones: el divisor del estado celular". Biología teórica y modelado médico . 13 : 11. doi : 10.1186/s12976-016-0037-2 . PMC 4785624. PMID 26965444 .
- ^ Gordon N, Gordon, R (2016). Embryogenesis Explained . Singapur: World Scientific Publishing . págs. 580–591. doi :10.1142/8152. ISBN . 978-981-4740-69-2.
- ^ ab Nusse R (mayo de 2008). "Señalización de Wnt y control de células madre". Cell Research . 18 (5): 523–7. doi : 10.1038/cr.2008.47 . PMID 18392048.
- ^ Bakre MM, Hoi A, Mong JC, Koh YY, Wong KY, Stanton LW (octubre de 2007). "Generación de progenitores mesendodérmicos multipotenciales a partir de células madre embrionarias de ratón mediante la activación sostenida de la vía Wnt". The Journal of Biological Chemistry . 282 (43): 31703–12. doi : 10.1074/jbc.M704287200 . PMID 17711862.
- ^ Woll PS, Morris JK, Painschab MS, Marcus RK, Kohn AD, Biechele TL, Moon RT, Kaufman DS (enero de 2008). "La señalización de Wnt promueve el desarrollo de células hematoendoteliales a partir de células madre embrionarias humanas". Blood . 111 (1): 122–31. doi :10.1182/blood-2007-04-084186. PMC 2200802 . PMID 17875805.
- ^ Schneider VA, Mercola M (febrero de 2001). "El antagonismo de Wnt inicia la cardiogénesis en Xenopus laevis". Genes & Development . 15 (3): 304–15. doi :10.1101/gad.855601. PMC 312618 . PMID 11159911.
- ^ Marvin MJ, Di Rocco G, Gardiner A, Bush SM, Lassar AB (febrero de 2001). "La inhibición de la actividad de Wnt induce la formación del corazón a partir del mesodermo posterior". Genes & Development . 15 (3): 316–27. doi :10.1101/gad.855501. PMC 312622 . PMID 11159912.
- ^ Ueno S, Weidinger G, Osugi T, Kohn AD, Golob JL, Pabon L, Reinecke H, Moon RT, Murry CE (junio de 2007). "Función bifásica de la señalización Wnt/beta-catenina en la especificación cardíaca en células madre embrionarias y de pez cebra". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (23): 9685–90. Bibcode :2007PNAS..104.9685U. doi : 10.1073/pnas.0702859104 . PMC 1876428 . PMID 17522258.
- ^ Willems E, Spiering S, Davidovics H, Lanier M, Xia Z, Dawson M, Cashman J, Mercola M (agosto de 2011). "Los inhibidores de moléculas pequeñas de la vía Wnt promueven de forma potente los cardiomiocitos del mesodermo derivado de células madre embrionarias humanas". Circulation Research . 109 (4): 360–4. doi :10.1161/CIRCRESAHA.111.249540. PMC 3327303 . PMID 21737789.
- ^ Burridge PW, Matsa E, Shukla P, Lin ZC, Churko JM, Ebert AD, Lan F, Diecke S, Huber B, Mordwinkin NM, Plews JR, Abilez OJ, Cui B, Gold JD, Wu JC (agosto de 2014). "Generación químicamente definida de cardiomiocitos humanos". Nature Methods . 11 (8): 855–60. doi :10.1038/nmeth.2999. PMC 4169698 . PMID 24930130.
- ^ Kaldis P, Pagano M (diciembre de 2009). "Señalización de Wnt en la mitosis". Developmental Cell . 17 (6): 749–50. doi : 10.1016/j.devcel.2009.12.001 . PMID 20059944.
- ^ Willert K, Jones KA (junio de 2006). "Señalización de Wnt: ¿la fiesta está en el núcleo?". Genes & Development . 20 (11): 1394–404. doi : 10.1101/gad.1424006 . PMID 16751178.
- ^ Hodge, Russ (25 de enero de 2016). "Hackear los programas de las células madre del cáncer". medicalxpress.com . Medical Express . Consultado el 12 de febrero de 2016 .
- ^ Schambony A, Wedlich D (2013). Señalización Wnt y migración celular. Landes Bioscience . Consultado el 7 de mayo de 2013 .
{{cite book}}:|website=ignorado ( ayuda ) - ^ Micalizzi DS, Farabaugh SM, Ford HL (junio de 2010). "Transición epitelial-mesenquimal en el cáncer: paralelismos entre el desarrollo normal y la progresión tumoral". Journal of Mammary Gland Biology and Neoplasia . 15 (2): 117–34. doi :10.1007/s10911-010-9178-9. PMC 2886089 . PMID 20490631.
- ^ Abiola M, Favier M, Christodoulou-Vafeiadou E, Pichard AL, Martelly I, Guillet-Deniau I (diciembre de 2009). "La activación de la señalización Wnt/beta-catenina aumenta la sensibilidad a la insulina a través de una regulación recíproca de Wnt10b y SREBP-1c en células del músculo esquelético". PLOS ONE . 4 (12): e8509. Bibcode :2009PLoSO...4.8509A. doi : 10.1371/journal.pone.0008509 . PMC 2794543 . PMID 20041157.
- ^ Milosevic, V. et al. Los circuitos autocrinos Wnt/IL-1β/IL-8 controlan la quimiorresistencia en las células iniciadoras del mesotelioma mediante la inducción de ABCB5. Int. J. Cancer, https://doi.org/10.1002/ijc.32419
- ^ Howe LR, Brown AM (enero de 2004). "Señalización de Wnt y cáncer de mama". Cancer Biology & Therapy . 3 (1): 36–41. doi : 10.4161/cbt.3.1.561 . PMID 14739782.
- ^ Taketo MM (abril de 2004). "Apagar el cáncer activado por la señal Wnt". Nature Genetics . 36 (4): 320–2. doi : 10.1038/ng0404-320 . PMID 15054482.
- ^ DiMeo TA, Anderson K, Phadke P, Fan C, Feng C, Perou CM, Naber S, Kuperwasser C (julio de 2009). "Una nueva firma de metástasis pulmonar vincula la señalización de Wnt con la autorrenovación de células cancerosas y la transición epitelial-mesenquimal en el cáncer de mama de tipo basal". Cancer Research . 69 (13): 5364–73. doi :10.1158/0008-5472.CAN-08-4135. PMC 2782448 . PMID 19549913.
- ^ Howard, J. Harrison; Pollock, Raphael E. (junio de 2016). "Fibromatosis desmoide intraabdominal y de la pared abdominal". Oncología y terapia . 4 (1): 57–72. doi :10.1007/s40487-016-0017-z. ISSN 2366-1070. PMC 5315078 . PMID 28261640.
- ^ Anastas JN, Moon RT (enero de 2013). "Vías de señalización de WNT como dianas terapéuticas en el cáncer". Nature Reviews. Cáncer . 13 (1): 11–26. doi :10.1038/nrc3419. PMID 23258168. S2CID 35599667.
- ^ Malladi, Srinivas; Macalinao, Danilo G.; Jin, Xin; Él, Lan; Basnet, Harihar; Zou, Yilong; de Stanchina, Elisa; Massagué, Joan (24-03-2016). "Latencia metastásica y evasión inmune mediante inhibición autocrina de WNT". Celúla . 165 (1): 45–60. doi :10.1016/j.cell.2016.02.025. ISSN 1097-4172. PMC 4808520 . PMID 27015306.
- ^ Esposito, Mark; Fang, Cao; Cook, Katelyn C.; Park, Nana; Wei, Yong; Spadazzi, Chiara; Bracha, Dan; Gunaratna, Ramesh T.; Laevsky, Gary; DeCoste, Christina J.; Slabodkin, Hannah (marzo de 2021). "Los condensados biomoleculares DACT1 inducidos por TGF-β reprimen la señalización de Wnt para promover la metástasis ósea". Nature Cell Biology . 23 (3): 257–267. doi :10.1038/s41556-021-00641-w. ISSN 1476-4679. PMC 7970447 . PMID 33723425.
- ^ Esposito, Mark; Mondal, Nandini; Greco, Todd M.; Wei, Yong; Spadazzi, Chiara; Lin, Song-Chang; Zheng, Hanqiu; Cheung, Corey; Magnani, John L.; Lin, Sue-Hwa; Cristea, Ileana M. (mayo de 2019). "La E-selectina del nicho vascular óseo induce la transición mesenquimal-epitelial y la activación de Wnt en células cancerosas para promover la metástasis ósea". Nature Cell Biology . 21 (5): 627–639. doi :10.1038/s41556-019-0309-2. ISSN 1476-4679. PMC 6556210 . PMID 30988423.
- ^ Welters HJ, Kulkarni RN (diciembre de 2008). "Señalización de Wnt: relevancia para la biología de las células beta y la diabetes". Tendencias en endocrinología y metabolismo . 19 (10): 349–55. doi :10.1016/j.tem.2008.08.004. PMID 18926717. S2CID 19299033.
- ^ Yoon JC, Ng A, Kim BH, Bianco A, Xavier RJ, Elledge SJ (julio de 2010). "La señalización de Wnt regula la fisiología mitocondrial y la sensibilidad a la insulina". Genes & Development . 24 (14): 1507–18. doi :10.1101/gad.1924910. PMC 2904941 . PMID 20634317.
- ^ Zhai L, Ballinger SW, Messina JL (marzo de 2011). "El papel de las especies reactivas de oxígeno en la resistencia a la insulina inducida por lesiones". Endocrinología molecular . 25 (3): 492–502. doi :10.1210/me.2010-0224. PMC 3045736 . PMID 21239612.
- ^ Grant SF, Thorleifsson G, Reynisdottir I, Benediktsson R, Manolescu A, Sainz J, et al. (marzo de 2006). "La variante del gen del factor de transcripción 7-like 2 (TCF7L2) confiere riesgo de diabetes tipo 2". Nature Genetics . 38 (3): 320–3. doi :10.1038/ng1732. PMID 16415884. S2CID 28825825.
Lectura adicional
- Milosevic V, et al. (enero de 2020). "Los circuitos autocrinos Wnt/IL-1β/IL-8 controlan la quimiorresistencia en las células iniciadoras del mesotelioma mediante la inducción de ABCB5". Int. J. Cancer . 146 (1): 192–207. doi :10.1002/ijc.32419. hdl : 2318/1711962 . PMID 31107974. S2CID 160014053.
- Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (junio de 2011). "Páginas de moléculas de puerta de enlace de señalización: una perspectiva de modelo de datos". Bioinformática . 27 (12): 1736–8. doi :10.1093/bioinformatics/btr190. PMC 3106186 . PMID 21505029.
Enlaces externos
- Proteínas Wnt+ en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.