Racha primitiva
| Racha primitiva | |
|---|---|
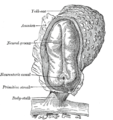
 Vista superficial del embrión de un conejo . arg. Disco embrionario . pr. Raya primitiva. gc. Medialuna germinal. | |
| Detalles | |
| Escenario Carnegie | 6b |
| Días | 15 |
| Identificadores | |
| latín | línea primitiva |
| Malla | D054240 |
| Terminología anatómica [editar en Wikidata] | |
La línea primitiva es una estructura que se forma en el embrión temprano en los amniotas . [1] En los anfibios , la estructura equivalente es el blastoporo . [2] Durante el desarrollo embrionario temprano , el disco embrionario adquiere forma ovalada y luego forma de pera con el extremo ancho hacia la parte anterior y la región más estrecha proyectada hacia la parte posterior. La línea primitiva forma una estructura longitudinal de línea media en la región posterior más estrecha (caudal) del embrión en desarrollo en su lado dorsal. [3] En la primera formación, la línea primitiva se extiende por la mitad de la longitud del embrión. En el embrión humano , esto aparece en la etapa 6 , aproximadamente a los 17 días. [4]
La línea primitiva establece la simetría bilateral , determina el sitio de la gastrulación e inicia la formación de la capa germinal . Para formar la línea primitiva, las células madre mesenquimales se disponen a lo largo de la línea media prospectiva, estableciendo el segundo eje embrionario y el sitio donde las células ingresarán y migrarán durante el proceso de gastrulación y formación de la capa germinal. [5]
La línea primitiva se extiende a través de esta línea media y crea los ejes corporales izquierdo-derecho y cráneo-caudal. [6] [7] La gastrulación implica la ingresión de los progenitores del mesodermo y su migración a su posición final, [6] [8] donde se diferenciarán en la capa germinal del mesodermo [5] que, junto con las capas germinales del endodermo y el ectodermo, darán lugar a todos los tejidos del organismo adulto.
Estructura

El epiblasto , una única capa epitelial del disco embrionario bilaminar , es la fuente de todo el material embrionario en los amniotas , y algunas de sus células darán lugar a la línea primitiva. [5] [8] En los anfibios , la estructura equivalente es el blastoporo . [2] La línea primitiva forma una estructura longitudinal de línea media en la región caudal (posterior) más estrecha del embrión en desarrollo en su lado dorsal. [3] En la primera formación, la línea primitiva se extiende por la mitad de la longitud del embrión. En el embrión humano, esto aparece en la etapa Carnegie 6 , alrededor de los 17 días. [4]
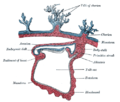
Hacia el extremo craneal (anterior) del disco, la línea primitiva se expande en un área conocida como el nódulo primitivo que es el organizador de la gastrulación . [9] En las aves, incluido el polluelo, este nódulo organizador se llama nódulo de Hensen . En los anfibios , donde se identificó por primera vez, se lo conoce como el organizador de Spemann-Mangold .
En el centro del nódulo hay una depresión circular denominada fosa primitiva . La fosa primitiva se extiende hacia el extremo caudal en una depresión estrecha en la línea primitiva llamada surco primitivo [9] ( en latín : sulcus primitivus ). El surco se crea mediante el repliegue de las células epiblásticas . [10] [11]
Tras la aparición y formación del nódulo, la fosa y el surco, la línea comienza a retroceder caudalmente. Alrededor del día 20 en el embrión humano, las partes restantes de la línea se agrandan para producir una masa de células caudales en la línea media denominada yema de la cola o eminencia caudal . [9] También en ese momento, la notocorda se desarrolla cranealmente a partir del nódulo primitivo. Para el día 22, la línea primitiva ha retrocedido hasta alcanzar entre el 10 y el 20% de la longitud del embrión y, para el día 26, aparentemente ha desaparecido. [9]

Formación
El embrión de pollo como organismo modelo ha proporcionado mucha información sobre la formación de la línea primitiva. En la blástula del pollo , su formación implica el movimiento coordinado y la reorganización de las células en el epiblasto. [12] Dos flujos de células que giran en sentido contrario se encuentran en el extremo posterior, donde se forma la línea. [12] Hay poco movimiento en el centro de estos flujos, mientras que el mayor movimiento se observa en la periferia de los vórtices. [7] Los movimientos de vórtice comparados con el movimiento polonesa son clave para la formación de la línea primitiva. [13] Las células que recubren la hoz de Koller en el extremo posterior del embrión de pollo se mueven hacia la línea media, se encuentran y cambian de dirección hacia el centro del epiblasto. Las células de la zona marginal posterior lateral reemplazan a las células que abandonaron la hoz de Koller al encontrarse en el centro de esta región, cambiando de dirección y extendiéndose anteriormente. [8] [14] A medida que estas células se mueven y se concentran en el extremo posterior del embrión, la línea experimenta una transición de una capa epitelial de una a varias capas que la convierte en una estructura visible macroscópicamente. [8] Se han propuesto varios mecanismos, que incluyen la proliferación activa, la división celular orientada, la intercalación célula-célula y el movimiento celular quimiotáctico , para explicar la naturaleza de los movimientos celulares necesarios para formar la línea primitiva. [15] [8]
La zona marginal de un embrión de pollo contiene células que contribuirán a la formación de la estría. [8] Esta región tiene un gradiente anterior a posterior definido en su capacidad para inducir la estría primitiva, y el extremo posterior tiene el potencial más alto. [16] Todas las células del epiblasto pueden responder a las señales de la zona marginal, [5] pero una vez que una región determinada es inducida por estas señales y experimenta la formación de la estría, las células restantes en el epiblasto ya no responden a estas señales inductivas y evitan la formación de otra estría. [16]
Debajo del epiblasto se encuentra el hipoblasto , donde se origina el tejido extraembrionario. [8] En el pollo, la ausencia del hipoblasto da como resultado múltiples vetas, [17] lo que sugiere que su presencia es importante para regular la formación de una única veta primitiva. En ratones y otros mamíferos, esta estructura se conoce como endodermo visceral anterior (AVE). [17] El AVE migra desde el endodermo visceral (hipoblasto). [18] El hipoblasto también desempeña un papel importante en la regulación de la formación de vetas. La eliminación del hipoblasto en el pollo da como resultado vetas ectópicas con un patrón correcto , lo que sugiere que el hipoblasto sirve para inhibir la formación de la veta primitiva. [19]
Vías de señalización

La formación de la línea primitiva en el pollo está altamente regulada por una red compleja de vías de señalización . Para este proceso se requiere la activación de varios factores secretados (Vg1, Nodal , Wnt8C , FGF8 y Chordin ) y factores de transcripción ( Brachyury y Goosecoid ) adyacentes al sitio de formación de la línea. [20] [21] [22] [23] [19]
Señalización Vg1 y Wnt
De manera similar, la expresión incorrecta de Vg1 (un miembro de la familia del factor de crecimiento transformante beta (TGF-β)) y los injertos de la zona marginal posterior [16] en pollos también pueden inducir estrías ectópicas, pero solo dentro de la zona marginal del embrión, [22] lo que indica una característica específica de esta región en su capacidad para inducir la formación de estrías. Varias líneas de evidencia apuntan a la expresión de Wnt como el determinante de esta capacidad. La eliminación de Wnt3 en embriones de ratón da como resultado la ausencia de formación de estrías, de manera similar al fenotipo de los embriones mutantes de B-catenina . [24] Además, la mutación del regulador negativo intracelular de la señalización de Wnt, Axin , [25] y la expresión incorrecta del cWnt8C de pollo [26] produce múltiples estrías en embriones de ratón. La localización de Wnt y los componentes de su vía, Lef1 y B-catenina, respaldan aún más el papel inductor de estrías en la zona marginal. [22] Además, se expresa como un gradiente decreciente de posterior a anterior, [22] [23] correspondiente a la capacidad de inducción de estrías de la zona marginal. La expresión incorrecta de Vg1 o Wnt1 por sí sola no logró inducir una estría ectópica en el pollo, pero su expresión incorrecta en conjunto resultó en la formación de estrías ectópicas, lo que confirma que la capacidad de inducción de estrías de la zona marginal posterior podría atribuirse a la señalización de Wnt [22] y que Vg1 y Wnt deben cooperar para inducir este proceso. La expresión incorrecta de Vg1 junto con antagonistas de Wnt, Crescent o Dkk-1 , previene la formación de estrías ectópicas, [22] demostrando la importancia de la actividad de Wnt en la formación de estrías ectópicas inducidas por Vg1 y, por lo tanto, su implicación en la formación normal de estrías primitivas.
Señalización nodal
Nodal , un inductor mesodérmico conocido de la familia del factor de crecimiento transformante beta (familia TGFB), [19] ha sido implicado en la formación de vetas. Los embriones de ratón mutantes para Nodal no logran gastrularse y carecen de la mayor parte del mesodermo, [27] pero más que desempeñar un papel en la inducción del mesodermo, Nodal regula la inducción y/o el mantenimiento de la veta primitiva. [27] En presencia de hipoblasto, Nodal es incapaz de inducir vetas ectópicas en el embrión de pollo, mientras que su eliminación induce la expresión de Nodal, Chordin y Brachyury, [19] lo que sugiere que el hipoblasto debe tener un cierto efecto inhibidor sobre la señalización de Nodal. De hecho, el antagonista multifuncional de la señalización de Nodal, Wnt y BMP, Cerberus (producido en el hipoblasto) y Cerberus-Short (que inhibe solo a Nodal), a través de su efecto sobre la señalización de Nodal, inhibe la formación de vetas. [19] Finalmente, el hipoblasto se desplaza anteriormente por el endoblasto en movimiento, lo que permite la formación de vetas en el extremo posterior. En el extremo anterior, la presencia del hipoblasto y los antagonistas que secreta, como Cerberus, inhiben la expresión de Nodal y, por lo tanto, restringen la formación de vetas solo al extremo posterior. [19] De manera similar al hipoblasto en el pollo, el AVE en el ratón secreta dos antagonistas de la señalización de Nodal, similar a Cerberus, Cerl y Lefty1 . [19] [28] En el ratón, los mutantes dobles Cer-/-; Lefty1-/- desarrollan múltiples vetas [17] como lo indica la expresión ectópica de Brachyury y pueden ser rescatados parcialmente mediante la eliminación de una copia del gen Nodal. [17] En el ratón, el AVE restringe la formación de vetas a través de las funciones redundantes de Cer1 y Lefty1, que regulan negativamente la señalización de Nodal. [17] El papel del AVE del ratón en asegurar la formación de una única línea primitiva se conserva evolutivamente en el hipoblasto del pollo. [17] [19]
Señalización de FGF
Otra vía importante en la modulación de la formación de la veta primitiva es el FGF , que se cree que trabaja junto con Nodal para regular este proceso. [29] La inhibición de la señalización del FGF a través de la expresión de un receptor negativo dominante, utilizando un inhibidor del receptor del FGF (SU5402) o la eliminación de los ligandos del FGF, inhibe la formación del mesodermo [7] y esto, a su vez, inhibe la formación de la veta. [8] Además, la formación de la veta ectópica inducida por Vg1 requirió la señalización del FGF. [29]
Señalización BMP
Por último, la señalización de BMP también es importante para regular el proceso de formación de estrías en el embrión de pollo. El sitio de formación de estrías se caracteriza por señales de BMP bajas, mientras que el resto del epiblasto muestra altos niveles de activación de BMP. [30] Además, la expresión incorrecta de BMP4 o BMP7 previene la formación de estrías, mientras que el inhibidor de BMP Chordin induce la formación de estrías ectópicas en el pollo, [31] lo que sugiere que es probable que la formación de estrías requiera la inhibición de BMP.
Implicaciones éticas
La línea primitiva es un concepto importante en la bioética , donde algunos expertos han sostenido que la experimentación con embriones humanos es permisible, pero sólo antes de que se desarrolle la línea primitiva, generalmente alrededor del decimocuarto día de existencia. Dichos bioeticistas consideran que el desarrollo de la línea primitiva significa la creación de un ser humano único. [32] En algunos países, es ilegal desarrollar un embrión humano durante más de 14 días fuera del cuerpo de una mujer. [33]
Véase también
Imágenes adicionales
- Embrión humano: longitud 2 mm. Vista dorsal, con el amnios abierto. X 30.
- Sección lateral del blastodisco de mamífero .
Referencias
- ^ "Definición de AMNIOTE". www.merriam-webster.com . Consultado el 11 de mayo de 2022 .
- ^ ab Wolpert, Lewis (2015). Principios del desarrollo (quinta edición). Oxford, Reino Unido. pág. 113. ISBN 9780199678143.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ ab Schoenwolf, Gary C. (2015). Larsen's human embryology (Quinta edición). Filadelfia, Pensilvania. pág. 57. ISBN 9781455706846.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ ab Standring, Susan (2016). Anatomía de Gray: la base anatómica de la práctica clínica (Cuarenta y uno ed.). [Filadelfia]. pág. 181. ISBN 9780702052309.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ abcd Mikawa T, Poh AM, Kelly KA, Ishii Y, Reese DE (2004). "Inducción y modelado de la línea primitiva, un centro organizador de la gastrulación en el amniota". Dev Dyn . 229 (3): 422–32. doi : 10.1002/dvdy.10458 . PMID 14991697. S2CID 758473.
- ^ ab Downs KM (2009). "La enigmática veta primitiva: nociones y desafíos prevalecientes en relación con el eje corporal de los mamíferos". BioEssays . 31 (8): 892–902. doi :10.1002/bies.200900038. PMC 2949267 . PMID 19609969.
- ^ abc Chuai M, Zeng W, Yang X, Boychenko V, Glazier JA, Weijer CJ (2006). "Movimiento celular durante la formación de la línea primitiva en polluelos". Dev. Biol . 296 (1): 137–49. doi :10.1016/j.ydbio.2006.04.451. PMC 2556955. PMID 16725136 .
- ^ abcdefgh Chuai M, Weijer CJ (2008). "Los mecanismos que subyacen a la formación de la línea primitiva en el embrión de pollo". Curr Top Dev Biol . Temas actuales en biología del desarrollo. 81 : 135–56. doi :10.1016/S0070-2153(07)81004-0. ISBN 978-0-12-374253-7. Número de identificación personal 18023726.
- ^ abcd Schoenwolf, Gary C. (2015). Larsen's human embryology (Quinta edición). Filadelfia, Pensilvania. Págs. 78-80. ISBN 9781455706846.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Moore, Keith L.; Persaud, TVN; Torchia, Mark G. (2018). "4 - Tercera semana del desarrollo humano". El ser humano en desarrollo (11.ª ed.). Saunders . págs. 47–63. ISBN 9780323611541.
- ^ Standring, Susan (2020). "10 - Poblaciones celulares en la gastrulación". Anatomía de Gray (42.ª ed.). Elsevier . págs. 188-195. ISBN 9780702077050.
- ^ ab Cui C, Yang X, Chuai M, Glazier JA, Weijer CJ (2005). "Análisis de los patrones de flujo tisular durante la formación de la veta primitiva en el embrión de pollo". Dev. Biol . 284 (1): 37–47. doi : 10.1016/j.ydbio.2005.04.021 . PMID 15950214.
- ^ Saadaoui, M; Rocancourt, D; Roussel, J; Corson, F; Gros, J (24 de enero de 2020). "Un anillo de tensión impulsa los flujos de tejido para dar forma al embrión amniota gastrulante". Science . 367 (6476): 453–458. Bibcode :2020Sci...367..453S. doi : 10.1126/science.aaw1965 . PMID 31974255. S2CID 92787648.
- ^ Hatada Y, Stern CD (1994). "Un mapa del destino del epiblasto del embrión de pollo temprano". Desarrollo . 120 (10): 2879–89. doi :10.1242/dev.120.10.2879. PMID 7607078.
- ^ Mikawa, Takashi; Poh, Alisa M.; Kelly, Kristine A.; Ishii, Yasuo; Reese, David E. (2004). "Inducción y modelado de la línea primitiva, un centro organizador de la gastrulación en el amniota". Dinámica del desarrollo . 229 (3): 422–432. doi : 10.1002/dvdy.10458 . PMID 14991697. S2CID 758473.
- ^ abc Khaner O, Eyal-Giladi H (1989). "La zona marginal del polluelo y la formación de la raya primitiva. I. Efecto coordinativo de la inducción y la inhibición". Dev. Biol . 134 (1): 206–14. doi :10.1016/0012-1606(89)90090-0. PMID 2731648.
- ^ abcdef Perea-Gomez A, Vella FD, Shawlot W, Oulad-Abdelghani M, Chazaud C, Meno C, Pfister V, Chen L, Robertson E, Hamada H, Behringer RR, Ang SL (2002). "Los antagonistas nodales en el endodermo visceral anterior previenen la formación de múltiples vetas primitivas". Dev Cell . 3 (5): 745–56. doi : 10.1016/S1534-5807(02)00321-0 . PMID 12431380.
- ^ Gilbert, Scott F. (2006). Biología del desarrollo (8.ª ed.). Sunderland, Mass.: Sinauer Associates Publishers. pág. 358. ISBN 9780878932504.
- ^ abcdefgh Bertocchini F, Stern CD (2002). "El hipoblasto del embrión de pollo posiciona la línea primitiva antagonizando la señalización nodal". Dev Cell . 3 (5): 735–44. doi : 10.1016/S1534-5807(02)00318-0 . PMID 12431379.
- ^ Shah SB, Skromne I, Hume CR, Kessler DS, Lee KJ, Stern CD, Dodd J (1997). "La expresión errónea de Vg1 de pollo en la zona marginal induce la formación de la raya primitiva". Desarrollo . 124 (24): 5127–38. doi :10.1242/dev.124.24.5127. PMID 9362470.
- ^ Bachvarova RF, Skromne I, Stern CD (1998). "Inducción de la línea primitiva y el nódulo de Hensen por la zona marginal posterior en el embrión de pollo temprano". Desarrollo . 125 (17): 3521–34. doi :10.1242/dev.125.17.3521. PMID 9693154.
- ^ abcdef Skromne I, Stern CD (2001). "Las interacciones entre las vías de señalización de Wnt y Vg1 inician la formación de la línea primitiva en el embrión de pollo". Desarrollo . 128 (15): 2915–27. doi :10.1242/dev.128.15.2915. PMID 11532915.
- ^ ab Skromne I, Stern CD (2002). "Una jerarquía de expresión génica que acompaña la inducción de la línea primitiva por Vg1 en el embrión de pollo". Mech. Dev . 114 (1–2): 115–8. doi : 10.1016/S0925-4773(02)00034-5 . PMID 12175495.
- ^ Liu P, Wakamiya M, Shea MJ, Albrecht U, Behringer RR, Bradley A (1999). "Requisitos de Wnt3 en la formación del eje vertebrado". Nat. Genet . 22 (4): 361–5. doi :10.1038/11932. PMID 10431240. S2CID 22195563.
- ^ Zeng L, Fagotto F, Zhang T, Hsu W, Vasicek TJ, Perry WL 3rd, Lee JJ, Tilghman SM, Gumbiner BM, Costantini F (1997). "El locus fusionado del ratón codifica Axin, un inhibidor de la vía de señalización de Wnt que regula la formación del eje embrionario". Cell . 90 (1): 181–92. doi : 10.1016/S0092-8674(00)80324-4 . PMID 9230313.
- ^ Pöpperl H, Schmidt C, Wilson V, Hume CR, Dodd J, Krumlauf R, Beddington RS (1997). "La expresión errónea de Cwnt8C en el ratón induce un eje embrionario ectópico y causa un truncamiento del neuroectodermo anterior". Desarrollo . 124 (15): 2997–3005. doi :10.1242/dev.124.15.2997. PMID 9247341.
- ^ ab Conlon FL, Lyons KM, Takaesu N, Barth KS, Kispert A, Herrmann B, Robertson EJ (1994). "Un requisito primario para el nodo en la formación y mantenimiento de la línea primitiva en el ratón". Desarrollo . 120 (7): 1919–28. doi :10.1242/dev.120.7.1919. PMID 7924997.
- ^ C Perea-Gomez A, Rhinn M, Ang SL (2001). "Papel del endodermo visceral anterior en la restricción de señales posteriores en el embrión de ratón". Int J Dev Biol . 45 (1): 311–20. PMID 11291861.
- ^ ab Bertocchini F, Skromne I, Wolpert L, Stern CD (2004). "Determinación de la polaridad embrionaria en un sistema regulador: evidencia de inhibidores endógenos que actúan secuencialmente durante la formación de la línea primitiva en el embrión de pollo". Desarrollo . 131 (14): 3381–90. doi : 10.1242/dev.01178 . PMID 15226255. S2CID 942758.
- ^ Faure S, de Santa Barbara P, Roberts DJ, Whitman M (2002). "Patrones endógenos de señalización de BMP durante el desarrollo temprano del pollo". Dev. Biol . 244 (1): 44–65. doi : 10.1006/dbio.2002.0579 . PMID 11900458.
- ^ Streit A, Lee KJ, Woo I, Roberts C, Jessell TM, Stern CD (1998). "La chordina regula el desarrollo de la línea primitiva y la estabilidad de las células neuronales inducidas, pero no es suficiente para la inducción neuronal en el embrión de pollo". Desarrollo . 125 (3): 507–19. doi :10.1242/dev.125.3.507. PMID 9425145.
- ^ "El Consejo Presidencial sobre Bioética, Clonación Humana y Dignidad Humana: Una Investigación Ética. Capítulo 6". Julio de 2002.
- ^ Departamento de Salud y Envejecimiento del Gobierno de Australia, 22 de diciembre de 2008