Catequina
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC (2 R ,3 S )-2-(3,4-Dihidroxifenil)-3,4-dihidro-2 H -cromeno-3,5,7-triol | |
| Otros nombres Cianidanol Cianidanol (+)-catequina D-Catequina Ácido catequínico Ácido catequiico Cianidol Dexcianidanol (2 R ,3 S )-Catequina 2,3- trans -Catequina (2 R , 3 S )-Flavan-3,3′,4′,5,7-pentol | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 3DMet |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.005.297 |
| Número CE |
|
| BARRIL |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C15H14O6 | |
| Masa molar | 290,271 g·mol −1 |
| Apariencia | Sólido incoloro |
| Punto de fusión | 175 a 177 °C (347 a 351 °F; 448 a 450 K) |
| UV-vis (λmáx . ) | 276 nm |
Rotación quiral ([α] D ) | +14,0° |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Mutagénico para células somáticas de mamíferos, mutagénico para bacterias y levaduras. |
| Etiquetado SGA : | |
 | |
| Advertencia | |
| H315 , H319 , H335 | |
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332+P313 , P337+P313 , P362 , P403+P233 , P405 , P501 | |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | (+)-catequina: 10 000 mg/kg en rata (RTECS) 10 000 mg/kg en ratón 3890 mg/kg en rata (otra fuente) |
| Ficha de datos de seguridad (FDS) | Sciencelab AppliChem [ enlace muerto permanente ] |
| Farmacología | |
| Oral | |
| Farmacocinética : | |
| Orinas | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La catequina / ˈkætɪtʃɪn / es un flavan - 3-ol , un tipo de metabolito secundario que cumple funciones antioxidantes en las plantas . Pertenece al subgrupo de polifenoles llamados flavonoides .
El nombre de la familia química de las catequinas deriva de catechu , que es el jugo tánico o extracto hervido de Mimosa catechu ( Acacia catechu Lf). [1]
Química

La catequina posee dos anillos de benceno (llamados anillos A y B) y un heterociclo de dihidropirano (el anillo C) con un grupo hidroxilo en el carbono 3. El anillo A es similar a una fracción de resorcinol mientras que el anillo B es similar a una fracción de catecol . Hay dos centros quirales en la molécula en los carbonos 2 y 3. Por lo tanto, tiene cuatro diastereoisómeros . Dos de los isómeros están en configuración trans y se denominan catequina y los otros dos están en configuración cis y se denominan epicatequina .
El isómero de catequina más común es la (+)-catequina. El otro estereoisómero es la (−)-catequina o ent -catequina. El isómero de epicatequina más común es la (−)-epicatequina (también conocida con los nombres L -epicatequina, epicatecol, (−)-epicatecol, L -acacatequina, L -epicatecol, epicatequina, 2,3- cis -epicatequina o (2 R ,3 R )-(−)-epicatequina).
Los diferentes epímeros se pueden separar mediante cromatografía en columna quiral . [2]
Sin hacer referencia a ningún isómero en particular, la molécula puede llamarse simplemente catequina. Las mezclas de los diferentes enantiómeros pueden llamarse (±)-catequina o DL -catequina y (±)-epicatequina o DL -epicatequina.
La catequina y la epicatequina son los componentes básicos de las proantocianidinas , un tipo de tanino condensado.
- Galería de diastereoisómeros
- (+)-catequina (2 R ,3 S )
- (−)-catequina (2 S ,3 R )
- (−)-epicatequina (2 R ,3 R )
- (+)-epicatequina (2 S ,3 S )

Además, la flexibilidad del anillo C permite dos isómeros de conformación , lo que coloca al anillo B en una posición pseudoecuatorial (confórmero E) o en una posición pseudoaxial (confórmero A). Los estudios confirmaron que la (+)-catequina adopta una mezcla de confórmeros A y E en solución acuosa y se ha evaluado que su equilibrio conformacional es 33:67. [3]
Como flavonoides, las catequinas pueden actuar como antioxidantes cuando se encuentran en altas concentraciones in vitro , pero en comparación con otros flavonoides, su potencial antioxidante es bajo. [4] La capacidad de extinguir el oxígeno singlete parece estar relacionada con la estructura química de la catequina, con la presencia de la fracción catecol en el anillo B y la presencia de un grupo hidroxilo que activa el doble enlace en el anillo C. [5]
Oxidación
Los experimentos electroquímicos muestran que el mecanismo de oxidación de la (+)-catequina se lleva a cabo en pasos secuenciales, relacionados con los grupos catecol y resorcinol , y que la oxidación depende del pH. La oxidación de los grupos donadores de electrones catecol 3',4'-dihidroxilo ocurre primero, a potenciales positivos muy bajos, y es una reacción reversible. Se ha demostrado que los grupos hidroxilo de la fracción resorcinol oxidada posteriormente experimentan una reacción de oxidación irreversible. [6]
El sistema lacasa / ABTS oxida la (+)-catequina a productos oligoméricos [7] de los cuales la proantocianidina A2 es un dímero.
Datos espectrales

| UV-Vis | |
|---|---|
| Lambda-máxima : | 276 nm |
| Coeficiente de extinción (log ε ) | 4.01 |
| IR | |
| Principales bandas de absorción | 1600 cm −1 (anillos de benceno) |
| RMN | |
| RMN de protones
| del : 2,49 (1H, dd, J = 16,0, 8,6 Hz, H-4a), |
| RMN de carbono-13 | |
| Otros datos de RMN | |
| EM | |
| Masas de fragmentos principales | ESI-MS [M+H] + m / z : 291,0
|
Fenómenos naturales
La (+)-catequina y la (−)-epicatequina, así como sus conjugados de ácido gálico , son constituyentes omnipresentes de las plantas vasculares y componentes frecuentes de los remedios herbales tradicionales , como Uncaria rhynchophylla . Los dos isómeros se encuentran principalmente como componentes del cacao y del té , así como en las uvas Vitis vinifera . [9] [10] [11]
En la comida
Las principales fuentes dietéticas de catequinas en Europa y Estados Unidos son el té y las frutas de pepita . [12] [13]
Las catequinas y epicatequinas se encuentran en el cacao , [14] que, según una base de datos, tiene el contenido más alto (108 mg/100 g) de catequinas entre los alimentos analizados, seguido del jugo de ciruela pasa (25 mg/100 ml) y la vaina de haba (16 mg/100 g). [15] El aceite de açaí , obtenido del fruto de la palma de açaí ( Euterpe oleracea ), contiene (+)-catequinas (67 mg/kg). [16]
Las catequinas son diversas en los alimentos, [15] desde los duraznos [17] hasta el té verde y el vinagre . [15] [18] Las catequinas se encuentran en el grano de cebada , donde son el principal compuesto fenólico responsable de la decoloración de la masa . [19] El sabor asociado con la (+)-catequina monomérica o la (−)-epicatequina se describe como ligeramente astringente , pero no amargo. [20]
Metabolismo
Biosíntesis
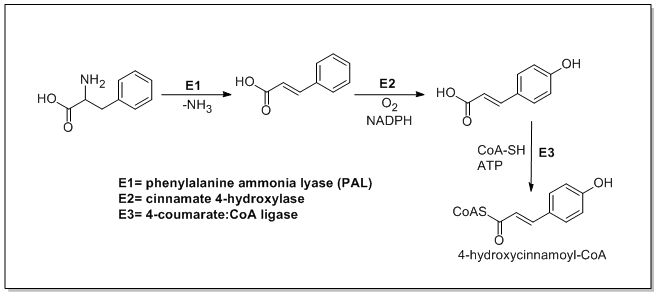
La biosíntesis de la catequina comienza con una unidad de inicio llamada 4-hidroxicinamoil CoA , que sufre una extensión de cadena mediante la adición de tres malonil-CoA a través de la vía PKSIII. El 4-hidroxicinamoil CoA se biosintetiza a partir de L -fenilalanina a través de la vía del shikimato. La L -fenilalanina es desaminada primero por la fenilalanina amoniaco liasa (PAL), formando ácido cinámico que luego se oxida a ácido 4-hidroxicinámico por la cinamato 4-hidroxilasa. Luego, la chalcona sintasa cataliza la condensación de 4-hidroxicinamoil CoA y tres moléculas de malonil-CoA para formar chalcona . La chalcona es luego isomerizada a naringenina por la chalcona isomerasa, que es oxidada a eriodictiol por la flavonoide 3'-hidroxilasa y luego oxidada a taxifolina por la flavanona 3-hidroxilasa. La taxifolina es luego reducida por la dihidroflavanol 4-reductasa y la leucoantocianidina reductasa para producir catequina. La biosíntesis de la catequina se muestra a continuación [21] [22] [23]
La leucocianidina reductasa (LCR) utiliza 2,3- trans -3,4- cis -leucocianidina para producir (+)-catequina y es la primera enzima en la vía específica de la proantocianidina (PA). Su actividad se ha medido en hojas, flores y semillas de las legumbres Medicago sativa , Lotus japonicus , Lotus uliginosus , Hedysarum sulfurescens y Robinia pseudoacacia . [24] La enzima también está presente en Vitis vinifera (uva). [25]
Biodegradación
La catequina oxigenasa, una enzima clave en la degradación de la catequina, está presente en hongos y bacterias. [26]
Entre las bacterias, la degradación de (+)-catequina puede lograrse por Acinetobacter calcoaceticus . La catequina se metaboliza a ácido protocatéquico (PCA) y ácido carboxílico floroglucinol (PGCA). [27] También es degradada por Bradyrhizobium japonicum . El ácido carboxílico floroglucinol se descarboxila aún más a floroglucinol , que se deshidroxila a resorcinol . El resorcinol se hidroxila a hidroxiquinol . El ácido protocatéquico y el hidroxiquinol experimentan una escisión intradiol a través de la protocatecuato 3,4-dioxigenasa y la hidroxiquinol 1,2-dioxigenasa para formar β-carboxi- cis , cis -ácido mucónico y acetato de maleilo . [28]
Entre los hongos, la degradación de la catequina puede lograrse por Chaetomium cupreum . [29]
Metabolismo en humanos

-epicatechin_metabolism_in_humans_as_a_function_of_time_post-oral_intake.jpg/440px-Schematic_representation_of_(−)-epicatechin_metabolism_in_humans_as_a_function_of_time_post-oral_intake.jpg)
Las catequinas se metabolizan tras su absorción en el tracto gastrointestinal , en particular el yeyuno , [31] y en el hígado , dando lugar a los denominados metabolitos de epicatequina estructuralmente relacionados (SREM). [32] Las principales vías metabólicas de los SREM son la glucuronidación , sulfatación y metilación del grupo catecol por la catecol-O-metil transferasa , detectándose solo pequeñas cantidades en el plasma. [33] [30] Sin embargo, la mayoría de las catequinas dietéticas son metabolizadas por el microbioma colónico a gamma-valerolactonas y ácidos hipúricos que sufren una mayor biotransformación , glucuronidación , sulfatación y metilación en el hígado . [33]
La configuración estereoquímica de las catequinas tiene un fuerte impacto en su captación y metabolismo, siendo la captación más alta para la (−)-epicatequina y más baja para la (−)-catequina. [34]
Biotransformación
La biotransformación de (+)-catequina en taxifolina mediante una oxidación en dos pasos puede lograrse mediante Burkholderia sp. [35]
La (+)-catequina y la (−)-epicatequina son transformadas por el hongo filamentoso endofítico Diaporthe sp. en los derivados 3,4-cis-dihidroxiflavano, (+)-(2 R ,3 S ,4 S )-3,4,5,7,3′,4′-hexahidroxiflavano (leucocianidina) y (−)-(2R,3R,4R)-3,4,5,7,3′,4′-hexahidroxiflavano, respectivamente, mientras que la (−)-catequina y la (+)-epicatequina con un grupo (2 S )-fenilo resistieron la biooxidación. [36]
La leucoantocianidina reductasa (LAR) utiliza (2 R ,3 S )-catequina, NADP + y H 2 O para producir 2,3- trans -3,4- cis - leucocianidina , NADPH y H + . Su expresión génica se ha estudiado en el desarrollo de bayas de uva y hojas de vid. [37]
Glicósidos
- La (2 R ,3 S )-catequina-7- O -β- D -glucopiranósido se puede aislar de la cebada ( Hordeum vulgare L.) y la malta. [38]
- El epigeósido (catequina-3- O -α- L -ramnopiranosil-(1–4)-β- D -glucopiranosil-(1–6)-β- D -glucopiranósido) se puede aislar de los rizomas de Epigynum auritum . [39]
Investigación
-epicatechin_metabolism.pdf/page1-440px-Inter-species_differences_in_(-)-epicatechin_metabolism.pdf.jpg)
Función vascular
Solo una evidencia limitada de estudios dietéticos indica que las catequinas pueden afectar la vasodilatación dependiente del endotelio , lo que podría contribuir a la regulación normal del flujo sanguíneo en humanos. [40] [41] Las catequinas del té verde pueden mejorar la presión arterial, especialmente cuando la presión arterial sistólica es superior a 130 mmHg. [42] [43]
Debido al extenso metabolismo durante la digestión, se desconoce el destino y la actividad de los metabolitos de catequina responsables de este efecto en los vasos sanguíneos, así como el modo de acción real. [33] [44]
Eventos adversos
La catequina y sus metabolitos pueden unirse fuertemente a los glóbulos rojos y de ese modo inducir el desarrollo de autoanticuerpos , lo que resulta en anemia hemolítica e insuficiencia renal . [45] Esto resultó en la retirada del mercado del fármaco que contiene catequina Catergen, utilizado para tratar la hepatitis viral , [46] en 1985. [47]
Las catequinas del té verde pueden ser hepatotóxicas [48] y la Autoridad Europea de Seguridad Alimentaria ha recomendado no superar los 800 mg al día. [49]
Otro
Un metanálisis limitado mostró que aumentar el consumo de té verde y sus catequinas a siete tazas por día proporcionó una pequeña reducción en el cáncer de próstata . [50] Los métodos de nanopartículas están bajo investigación preliminar como posibles sistemas de administración de catequinas. [51]
Efectos botánicos
Las catequinas liberadas al suelo por algunas plantas pueden obstaculizar el crecimiento de sus vecinas, una forma de alelopatía . [52] Centaurea maculosa , la centaurea maculosa a menudo estudiada por este comportamiento, libera isómeros de catequina en el suelo a través de sus raíces, lo que potencialmente tiene efectos como antibiótico o herbicida . Una hipótesis es que causa una onda de especies reactivas de oxígeno a través de la raíz de la planta objetivo para matar las células de la raíz por apoptosis . [53] La mayoría de las plantas en el ecosistema europeo tienen defensas contra la catequina, pero pocas plantas están protegidas contra ella en el ecosistema norteamericano donde Centaurea maculosa es una maleza invasiva y descontrolada. [52]
La catequina actúa como un factor inhibidor de infecciones en las hojas de fresa. [54] La epicatequina y la catequina pueden prevenir la enfermedad del fruto del café al inhibir la melanización apresoria de Colletotrichum kahawae . [55]
Referencias
- ^ "Origen de las plantas de Cutch y Catechu". Organización de las Naciones Unidas para la Alimentación y la Agricultura. 5 de noviembre de 2011. Archivado desde el original el 10 de febrero de 2019. Consultado el 26 de julio de 2016 .
- ^ Rinaldo D, Batista JM, Rodrigues J, Benfatti AC, Rodrigues CM, dos Santos LC, et al. (Agosto de 2010). "Determinación de diastereómeros de catequinas de las hojas de especies de Byrsonima mediante HPLC-PAD-CD quiral". Quiralidad . 22 (8): 726–733. doi :10.1002/chir.20824. PMID 20143413.
- ^ Kríz Z, Koca J, Imberty A, Charlot A, Auzély-Velty R (julio de 2003). "Investigación de la formación de complejos de (+)-catequina por beta-ciclodextrina mediante una combinación de técnicas de RMN, microcalorimetría y modelado molecular". Química orgánica y biomolecular . 1 (14): 2590–2595. doi :10.1039/B302935M. PMID 12956082.
- ^ Pietta PG (julio de 2000). "Flavonoides como antioxidantes". Journal of Natural Products . 63 (7): 1035–1042. doi :10.1021/np9904509. PMID 10924197. S2CID 23310671.
- ^ Tournaire C, Croux S, Maurette MT, Beck I, Hocquaux M, Braun AM, Oliveros E (agosto de 1993). "Actividad antioxidante de los flavonoides: eficiencia de extinción del oxígeno singlete ( 1 Δ g )". Revista de fotoquímica y fotobiología. B, Biología . 19 (3): 205–215. doi :10.1016/1011-1344(93)87086-3. PMID 8229463.
- ^ Janeiro P, Oliveira Brett AM (2004). "Mecanismos de oxidación electroquímica de la catequina". Analytica Chimica Acta . 518 (1–2): 109–115. Bibcode :2004AcAC..518..109J. doi :10.1016/j.aca.2004.05.038. hdl : 10316/5128 .
- ^ Osman AM, Wong KK, Fernyhough A (abril de 2007). "El sistema lacasa/ABTS oxida la (+)-catequina a productos oligoméricos". Tecnología enzimática y microbiana . 40 (5): 1272–1279. doi :10.1016/j.enzmictec.2006.09.018.
- ^ Lin YP, Chen TY, Tseng HW, Lee MH, Chen ST (junio de 2009). "Compuestos protectores de células neuronales aislados de Phoenix hanceana var. formosana". Fitoquímica . 70 (9): 1173–1181. Código Bibliográfico :2009PChem..70.1173L. doi :10.1016/j.phytochem.2009.06.006. PMID 19628235. S2CID 28636157.
- ^ Aizpurua-Olaizola O, Ormazabal M, Vallejo A, Olivares M, Navarro P, Etxebarria N, Usobiaga A (enero de 2015). "Optimización de extracciones consecutivas en fluido supercrítico de ácidos grasos y polifenoles de residuos de uva de Vitis vinifera". Revista de ciencia de los alimentos . 80 (1): E101–E107. doi :10.1111/1750-3841.12715. PMID 25471637.
- ^ Freudenberg K, Cox RF, Braun E (1932). "La catequina del grano de cacao1". Revista de la Sociedad Química Americana . 54 (5): 1913–1917. doi :10.1021/ja01344a026.
- ^ "Michiyo Tsujimura (1888–1969)". Archivado desde el original el 21 de noviembre de 2015 . Consultado el 10 de noviembre de 2015 .
- ^ Chun OK, Chung SJ, Song WO (mayo de 2007). "Ingesta estimada de flavonoides en la dieta y principales fuentes de alimentos de los adultos estadounidenses". The Journal of Nutrition . 137 (5): 1244–1252. doi : 10.1093/jn/137.5.1244 . PMID 17449588.
- ^ Vogiatzoglou A, Mulligan AA, Lentjes MA, Luben RN, Spencer JP, Schroeter H, et al. (2015). "Ingesta de flavonoides en adultos europeos (18 a 64 años)". PLOS ONE . 10 (5): e0128132. Bibcode :2015PLoSO..1028132V. doi : 10.1371/journal.pone.0128132 . PMC 4444122 . PMID 26010916.
- ^ Kwik-Uribe C, Bektash RM (2008). "Flavonoles del cacao: medición, biodisponibilidad y bioactividad" (PDF) . Revista de nutrición clínica de Asia y el Pacífico . 17 (Supl. 1): 280–283. PMID 18296356.
- ^ abc "Polifenoles en infusión de té verde". Phenol-Explorer, v 3.5. 2014. Consultado el 1 de noviembre de 2014 .
- ^ Pacheco-Palencia LA, Mertens-Talcott S, Talcott ST (junio de 2008). "Composición química, propiedades antioxidantes y estabilidad térmica de un aceite enriquecido con fitoquímicos de Açaí ( Euterpe oleracea Mart.)". Journal of Agricultural and Food Chemistry . 56 (12): 4631–4636. doi :10.1021/jf800161u. PMID 18522407.
- ^ Cheng GW, Crisosto CH (1995). "Potencial de oscurecimiento, composición fenólica y actividad de polifenoloxidasa de extractos tampón de tejido de piel de melocotón y nectarina". Revista de la Sociedad Estadounidense de Ciencias Hortícolas . 120 (5): 835–838. doi : 10.21273/JASHS.120.5.835 .
- ^ Gálvez MC, Barroso CG, Pérez-Bustamante JA (1994). "Análisis de compuestos polifenólicos de diferentes muestras de vinagre". Zeitschrift für Lebensmittel-Untersuchung und-Forschung . 199 (1): 29–31. doi :10.1007/BF01192948. S2CID 91784893.
- ^ Quinde-Axtell Z, Baik BK (diciembre de 2006). "Compuestos fenólicos del grano de cebada y su implicación en la decoloración de los productos alimenticios". Journal of Agricultural and Food Chemistry . 54 (26): 9978–9984. doi :10.1021/jf060974w. PMID 17177530.
- ^ Kielhorn, S.; Thorngate, JH III (1999). "Sensaciones orales asociadas con los flavan-3-oles (+)-catequina y (−)-epicatequina". Calidad y preferencia alimentaria . 10 (2): 109–116. doi :10.1016/S0950-3293(98)00049-4.
- ^ Rani A, Singh K, Ahuja PS, Kumar S (marzo de 2012). "Regulación molecular de la biosíntesis de catequinas en el té [ Camellia sinensis (L.) O. Kuntze]". Gene . 495 (2): 205–210. doi :10.1016/j.gene.2011.12.029. PMID 22226811.
- ^ Punyasiri PA, Abeysinghe IS, Kumar V, Treutter D, Duy D, Gosch C, et al. (noviembre de 2004). "Biosíntesis de flavonoides en la planta del té Camellia sinensis: propiedades de las enzimas de las vías prominentes de la epicatequina y la catequina". Archivos de bioquímica y biofísica . 431 (1): 22–30. doi :10.1016/j.abb.2004.08.003. PMID 15464723.
- ^ Dewick PM (2009). Productos naturales medicinales: un enfoque biosintético (3.ª ed.). Reino Unido: John Wiley & Sons. ISBN 978-0-470-74167-2.[ página necesaria ]
- ^ Skadhauge B, Gruber MY, Thomsen KK, Von Wettstein D (abril de 1997). "Actividad de la leucocianidina reductasa y acumulación de proantocianidinas en los tejidos de las leguminosas en desarrollo". American Journal of Botany . 84 (4): 494–503. doi :10.2307/2446026. JSTOR 2446026.
- ^ Maugé C, Granier T, d'Estaintot BL, Gargouri M, Manigand C, Schmitter JM, et al. (abril de 2010). "Estructura cristalina y mecanismo catalítico de la leucoantocianidina reductasa de Vitis vinifera". Journal of Molecular Biology . 397 (4): 1079–1091. doi :10.1016/j.jmb.2010.02.002. PMID 20138891.
- ^ Arunachalam, M.; Mohan Raj, M.; Mohan, N.; Mahadevan, A. (2003). "Biodegradación de la catequina" (PDF) . Actas de la Academia Nacional de Ciencias de la India . B69 (4): 353–370. Archivado desde el original (PDF) el 16 de marzo de 2012.
- ^ Arunachalam M, Mohan N, Sugadev R, Chellappan P, Mahadevan A (junio de 2003). "Degradación de (+) -catequina por Acinetobacter calcoaceticus MTC 127". Biochimica et Biophysica Acta (BBA) - Temas generales . 1621 (3): 261–265. doi :10.1016/S0304-4165(03)00077-1. PMID 12787923.
- ^ Hopper W, Mahadevan A (1997). "Degradación de catequina por Bradyrhizobium japonicum ". Biodegradación . 8 (3): 159–165. doi :10.1023/A:1008254812074. S2CID 41221044.
- ^ Sambandam T, Mahadevan A (enero de 1993). "Degradación de catequina y purificación y caracterización parcial de la catequina oxigenasa de Chaetomium cupreum ". Revista mundial de microbiología y biotecnología . 9 (1): 37–44. doi :10.1007/BF00656513. PMID 24419836. S2CID 1257624.
- ^ abcd Ottaviani JI, Borges G, Momma TY, Spencer JP, Keen CL, Crozier A, Schroeter H (julio de 2016). "El metaboloma de [2-14C](−)-epicatequina en humanos: implicaciones para la evaluación de la eficacia, seguridad y mecanismos de acción de los bioactivos polifenólicos". Scientific Reports . 6 : 29034. Bibcode :2016NatSR...629034O. doi :10.1038/srep29034. PMC 4929566 . PMID 27363516.
- ^ Actis-Goretta L, Lévèques A, Rein M, Teml A, Schäfer C, Hofmann U, et al. (octubre de 2013). "Absorción intestinal, metabolismo y excreción de (−)-epicatequina en humanos sanos evaluados mediante una técnica de perfusión intestinal". The American Journal of Clinical Nutrition . 98 (4): 924–933. doi : 10.3945/ajcn.113.065789 . PMID 23864538.
- ^ Ottaviani JI, Momma TY, Kuhnle GK, Keen CL, Schroeter H (abril de 2012). "Metabolitos de (−)-epicatequina estructuralmente relacionados en humanos: evaluación utilizando estándares auténticos sintetizados químicamente de novo". Free Radical Biology & Medicine . 52 (8): 1403–1412. doi : 10.1016/j.freeradbiomed.2011.12.010 . PMID 22240152.
- ^ abc "Flavonoides". Instituto Linus Pauling, Universidad Estatal de Oregón, Corvallis. 2016. Consultado el 24 de julio de 2016 .
- ^ Ottaviani JI, Momma TY, Heiss C, Kwik-Uribe C, Schroeter H, Keen CL (enero de 2011). "La configuración estereoquímica de los flavonoles influye en el nivel y el metabolismo de los flavonoles en humanos y su actividad biológica in vivo". Free Radical Biology & Medicine . 50 (2): 237–244. doi :10.1016/j.freeradbiomed.2010.11.005. PMID 21074608.
- ^ Matsuda M, Otsuka Y, Jin S, Wasaki J, Watanabe J, Watanabe T, Osaki M (febrero de 2008). "Biotransformación de (+)-catequina en taxifolina mediante una oxidación en dos pasos: etapa primaria del metabolismo de (+)-catequina por una nueva bacteria degradante de (+)-catequina, Burkholderia sp. KTC-1, aislada de turba tropical" . Comunicaciones de investigación bioquímica y biofísica . 366 (2): 414–419. doi :10.1016/j.bbrc.2007.11.157. PMID 18068670.
- ^ Shibuya H, Agusta A, Ohashi K, Maehara S, Simanjuntak P (julio de 2005). "Bioxidación de (+)-catequina y (−)-epicatequina en derivados de 3,4-dihidroxiflavano por el hongo endofítico Diaporthe sp. aislado de una planta de té". Chemical & Pharmaceutical Bulletin . 53 (7): 866–867. doi : 10.1248/cpb.53.866 . PMID 15997157.
- ^ Bogs J, Downey MO, Harvey JS, Ashton AR, Tanner GJ, Robinson SP (octubre de 2005). "Síntesis de proantocianidinas y expresión de genes que codifican leucoantocianidina reductasa y antocianidina reductasa en el desarrollo de bayas de uva y hojas de vid". Fisiología vegetal . 139 (2): 652–663. doi :10.1104/pp.105.064238. JSTOR 4281902. PMC 1255985 . PMID 16169968.
- ^ Friedrich W, Galensa R (2002). "Identificación de un nuevo glucósido de flavanol de la cebada ( Hordeum vulgare L.) y la malta". Investigación y tecnología alimentaria europea . 214 (5): 388–393. doi :10.1007/s00217-002-0498-x. S2CID 84221785.
- ^ Jin QD, Mu QZ (1991). "[Estudio sobre los constituyentes glucósidos de Epigynum auritum ]". Yao Xue Xue Bao (Acta Pharmaceutica Sinica) (en chino). 26 (11): 841–845. PMID 1823978.
- ^ Hooper L, Kay C, Abdelhamid A, Kroon PA, Cohn JS, Rimm EB, Cassidy A (marzo de 2012). "Efectos del chocolate, el cacao y los flavan-3-oles en la salud cardiovascular: una revisión sistemática y un metanálisis de ensayos aleatorizados". The American Journal of Clinical Nutrition . 95 (3): 740–751. doi : 10.3945/ajcn.111.023457 . PMID 22301923.
- ^ Ellinger S, Reusch A, Stehle P, Helfrich HP (junio de 2012). "La epicatequina ingerida a través de productos de cacao reduce la presión arterial en humanos: un modelo de regresión no lineal con un enfoque bayesiano". The American Journal of Clinical Nutrition . 95 (6): 1365–1377. doi : 10.3945/ajcn.111.029330 . PMID 22552030.
- ^ Khalesi S, Sun J, Buys N, Jamshidi A, Nikbakht-Nasrabadi E, Khosravi-Boroujeni H (septiembre de 2014). "Catequinas del té verde y presión arterial: una revisión sistemática y metanálisis de ensayos controlados aleatorizados". Revista Europea de Nutrición . 53 (6): 1299–1311. doi :10.1007/s00394-014-0720-1. PMID 24861099. S2CID 206969226.
- ^ Aprotosoaie AC, Miron A, Trifan A, Luca VS, Costache II (diciembre de 2016). "Los efectos cardiovasculares de los polifenoles del cacao: una descripción general". Enfermedades . 4 (4): 39. doi : 10.3390/diseases4040039 . PMC 5456324 . PMID 28933419.
- ^ Schroeter H, Heiss C, Balzer J, Kleinbongard P, Keen CL, Hollenberg NK, et al. (enero de 2006). "(−)-Epicatechin media los efectos beneficiosos del cacao rico en flavanol en la función vascular en humanos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (4): 1024–1029. Bibcode :2006PNAS..103.1024S. doi : 10.1073/pnas.0510168103 . PMC 1327732 . PMID 16418281.
- ^ Martínez SE, Davies NM, Reynolds JK (2013). "Toxicología y seguridad de los flavonoides". Métodos de análisis, farmacocinética preclínica y clínica, seguridad y toxicología . John Wiley & Son. pág. 257. ISBN 978-0-470-57871-1.
- ^ Bode JC (1987). Okolicsányi L, Csomós G, Crepaldi G (eds.). Evaluación y Manejo de la Enfermedad Hepatobiliar . Berlín: Springer-Verlag. pag. 371.doi : 10.1007 /978-3-642-72631-6. ISBN 978-3-642-72631-6. Número de identificación del sujeto 3167832.
- ^ "Ruhen der Zulassung für Catergen" (PDF) . Deutsches Ärzteblatt . 82 (38): 2706.
- ^ Health Canada (15 de noviembre de 2017). "Resumen de la revisión de seguridad: productos naturales para la salud que contienen extracto de té verde: evaluación del riesgo potencial de daño hepático (hepatotoxicidad)". www.canada.ca . Consultado el 6 de mayo de 2022 .
- ^ Younes M, Aggett P, Aguilar F, Crebelli R, Dusemund B, Filipič M, et al. (abril de 2018). "Opinión científica sobre la seguridad de las catequinas del té verde". Revista EFSA . 16 (4): e05239. doi :10.2903/j.efsa.2018.5239. PMC 7009618 . PMID 32625874.
- ^ Guo Y, Zhi F, Chen P, Zhao K, Xiang H, Mao Q, et al. (marzo de 2017). "El té verde y el riesgo de cáncer de próstata: una revisión sistemática y un metanálisis". Medicina . 96 (13): e6426. doi :10.1097/MD.0000000000006426. PMC 5380255 . PMID 28353571.
- ^ Ye JH, Augustin MA (2018). "Nanopartículas y micropartículas para la administración de catequinas: rendimiento físico y biológico". Critical Reviews in Food Science and Nutrition . 59 (10): 1563–1579. doi :10.1080/10408398.2017.1422110. PMID 29345975. S2CID 29522787.
- ^ ab Broz AK, Vivanco JM, Schultz MJ, Perry LG, Paschke MW (2006). "Metabolitos secundarios y alelopatía en invasiones de plantas: un estudio de caso de Centaurea maculosa". En Taiz L, Zeiger E, Møller IM, Murphy A (eds.). Fisiología y desarrollo de las plantas (6.ª ed.). Sinauer Associates.
- ^ Bais HP, Vepachedu R, Gilroy S, Callaway RM, Vivanco JM (septiembre de 2003). "Alelopatía e invasión de plantas exóticas: desde moléculas y genes hasta interacciones entre especies". Science . 301 (5638): 1377–1380. Bibcode :2003Sci...301.1377B. doi :10.1126/science.1083245. PMID 12958360. S2CID 26483595.
- ^ Yamamoto M, Nakatsuka S, Otani H, Kohmoto K, Nishimura S (junio de 2000). "(+)-Catequina actúa como un factor inhibidor de infecciones en hojas de fresa". Fitopatología . 90 (6): 595–600. doi :10.1094/PHYTO.2000.90.6.595. PMID 18944538.
- ^ Chen Z, Liang J, Zhang C, Rodrigues CJ (octubre de 2006). "La epicatequina y la catequina pueden prevenir la enfermedad de la baya del café mediante la inhibición de la melanización apresoria de Colletotrichum kahawae ". Biotechnology Letters . 28 (20): 1637–1640. doi :10.1007/s10529-006-9135-2. PMID 16955359. S2CID 30593181.