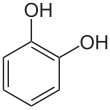
Catecol
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Benceno-1,2-diol [1] | |||
| Otros nombres Pirocatecol [1] 1,2-Bencenodiol 2-Hidroxifenol 1,2-Dihidroxibenceno o -Bencenodiol o -Dihidroxibenceno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 471401 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos |
| ||
| Tarjeta informativa de la ECHA | 100.004.025 | ||
| Número CE |
| ||
| 2936 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C6H6O2 | |||
| Masa molar | 110,112 g·mol −1 | ||
| Apariencia | Cristales plumosos de color blanco a marrón | ||
| Olor | Olor débil y fenólico | ||
| Densidad | 1,344 g/cm 3 , sólido | ||
| Punto de fusión | 105 °C (221 °F; 378 K) | ||
| Punto de ebullición | 245,5 °C (473,9 °F; 518,6 K) (sublimación) | ||
| 312 g/L a 20 °C [2] | |||
| Solubilidad | muy soluble en piridina soluble en cloroformo , benceno , CCl4 , éter , acetato de etilo | ||
| registro P | 0,88 | ||
| Presión de vapor | 20 Pa (20 °C) | ||
| Acidez (p K a ) | 9.45, 12.8 | ||
| −6,876 × 10 −5 cm3 / mol | |||
Índice de refracción ( n D ) | 1.604 | ||
| 2,62 ± 0,03 D [3] | |||
| Estructura | |||
| monoclínico | |||
| Termoquímica | |||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −354,1 kJ·mol −1 | ||
Entalpía de fusión (Δ f H ⦵ fus ) | 22,8 kJ·mol −1 (en el punto de fusión) | ||
| Peligros | |||
| Etiquetado SGA : | |||
   | |||
| Peligro | |||
| H301 , H311 , H315 , H317 , H318 , H332 , H341 | |||
| P261 , P301 , P302 , P305 , P310 , P312 , P330 , P331 , P338 , P351 , P352 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | 127 °C (261 °F; 400 K) | ||
| 510 °C (950 °F; 783 K) | |||
| Límites de explosividad | 1,4%–? [4] | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 300 mg/kg (rata, oral) | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | ninguno [4] | ||
REL (recomendado) | TWA 5 ppm (20 mg/m 3 ) [piel] [4] | ||
IDLH (Peligro inmediato) | En Dakota del Norte [4] | ||
| Ficha de datos de seguridad (FDS) | Sigma-Aldrich | ||
| Compuestos relacionados | |||
Bencenodioles relacionados | Resorcinol Hidroquinona | ||
Compuestos relacionados | 1,2-benzoquinona | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El catecol ( / ˈkætɪtʃɒl / o / ˈkætɪkɒl / ), también conocido como pirocatecol o 1,2 -dihidroxibenceno , es un compuesto orgánico con la fórmula molecular C6H4 (OH) 2 . Es el isómero orto de los tres isómeros bencenodioles . Este compuesto incoloro se produce de forma natural en cantidades traza. Se descubrió por primera vez mediante la destilación destructiva del extracto de planta catequina . En la actualidad, se producen de forma sintética unas 20.000 toneladas de catecol al año como producto químico orgánico básico, principalmente como precursor de pesticidas, sabores y fragancias. Se encuentran pequeñas cantidades de catecol en frutas y verduras . [2]
Aislamiento y síntesis
El catecol fue aislado por primera vez en 1839 por Edgar Hugo Emil Reinsch (1809-1884) al destilarlo de la preparación tánica sólida catequina , que es el residuo del catechu , el jugo hervido o concentrado de Mimosa catechu ( Acacia catechu ). [5] Al calentar la catequina por encima de su punto de descomposición, una sustancia que Reinsch llamó primero Brenz-Katechusäure (ácido catechu quemado) sublimó como una eflorescencia blanca . Este era un producto de descomposición térmica de los flavonoides en la catequina. En 1841, tanto Wackenroder como Zwenger redescubrieron independientemente el catecol; al informar sobre sus hallazgos, Philosophical Magazine acuñó el nombre de pirocatequina . [6] En 1852, Erdmann se dio cuenta de que el catecol era benceno con dos átomos de oxígeno agregados; En 1867, August Kekulé se dio cuenta de que el catecol era un diol del benceno, por lo que en 1868, el catecol fue catalogado como pirocatecol . [7] En 1879, el Journal of the Chemical Society recomendó que el catecol se llamara "catecol", y al año siguiente, fue catalogado como tal. [8]
Desde entonces se ha demostrado que el catecol se encuentra en forma libre de forma natural en el kino y en el alquitrán de madera de haya . Su ácido sulfónico se ha detectado en la orina de caballos y humanos. [9]
El catecol se produce industrialmente mediante la hidroxilación del fenol utilizando peróxido de hidrógeno . [2]
- C6H5OH + H2O2 → C6H4 ( OH ) 2 + H2O
Se puede producir por reacción de salicilaldehído con una base y peróxido de hidrógeno ( oxidación de Dakin ), [10] así como por hidrólisis de fenoles 2-sustituidos, especialmente 2-clorofenol , con soluciones acuosas calientes que contienen hidróxidos de metales alcalinos. Su derivado de metil éter, el guayacol , se convierte en catecol por hidrólisis del enlace CH 3 −O promovida por ácido yodhídrico (HI). [10]
Reacciones
Al igual que otros derivados difuncionales del benceno, el catecol se condensa fácilmente para formar compuestos heterocíclicos . Por ejemplo, el uso de tricloruro de fósforo u oxicloruro de fósforo da lugar al clorofosfonito o clorofosfonato cíclico , respectivamente; el cloruro de sulfurilo da lugar al sulfato ; y el fosgeno ( COCl 2 ) da lugar al carbonato : [11]
- C 6 H 4 (OH) 2 + XCl 2 → C 6 H 4 (O 2 X) + 2 HCl donde X = PCl o POCl; SO 2 ; CO
Las soluciones básicas de catecol reaccionan con el hierro (III) para dar el color rojo [Fe(C 6 H 4 O 2 ) 3 ] 3− . El cloruro férrico da una coloración verde con la solución acuosa, mientras que la solución alcalina cambia rápidamente a un color verde y finalmente a un color negro al exponerse al aire. [12] Las enzimas dioxigenasas que contienen hierro catalizan la escisión del catecol.
Química redox
Los catecoles se convierten en el radical semiquinona. A pH = 7 , esta conversión ocurre a 100 mV: [ cita requerida ]
- C6H4 ( OH ) 2 → C6H4 (O)(OH ) + ½ H2
El radical semiquinona se puede reducir al dianión catecolato, siendo el potencial dependiente del pH:
- C6H4 (O ) ( OH ) + e− → [ C6H4O2 ] 2− + H +
El catecol se produce mediante una reducción reversible de dos electrones y dos protones de 1,2-benzoquinona ( E 0 = +795 mV frente a SHE ; E m (a pH 7) = +380 mV frente a SHE). [13]
El dianión catecolato de la serie redox , el semiquinonato monoaniónico y la benzoquinona se denominan colectivamente dioxolenos . Los dioxolenos pueden funcionar como ligandos para iones metálicos. [14]
Derivados del catecol
- Catecoles de origen natural
- 3,4-dihidroxi-9,10-secoandrosta-1,3,5(10)-trieno-9,17-diona , un metabolito del colesterol [15]
- Catequina , un componente del té.
- Piceatannol , un antioxidante que se encuentra en algunos vinos tintos.
- Urushiols , el agente activo en la hiedra venenosa (R = (CH 2 ) 14 CH 3 , (CH 2 ) 7 CH=CHCH 2 CH=CHCH 2 CH=CH 2 , y otros)
- Dopamina , derivada del aminoácido tirosina, un adhesivo utilizado por los mejillones . [16]
- Quercetina , que se encuentra en muchos alimentos.
Los derivados de catecol se encuentran ampliamente presentes en la naturaleza. A menudo surgen por hidroxilación de fenoles. [17] La cutícula de los artrópodos está formada por quitina unida a una proteína por una fracción de catecol . La cutícula puede fortalecerse mediante reticulación ( curtido y esclerotización ), en particular en los insectos , y por supuesto mediante biomineralización . [18]
El derivado sintético 4- tert -butilcatecol se utiliza como antioxidante e inhibidor de la polimerización .
Usos
Aproximadamente el 50% del catecol sintético se consume en la producción de pesticidas , y el resto se utiliza como precursor de productos químicos finos como perfumes y productos farmacéuticos. [2] Es un componente básico común en la síntesis orgánica . [19] Varios sabores y fragancias industrialmente importantes se preparan a partir del catecol. El guayacol se prepara por metilación del catecol y luego se convierte en vainillina en una escala de aproximadamente 10M kg por año (1990). El éter monoetílico relacionado del catecol, el guetol, se convierte en etilvainillina , un componente de los dulces de chocolate . El 3- trans -isocanfilciclohexanol, ampliamente utilizado como reemplazo del aceite de sándalo , se prepara a partir del catecol a través del guayacol y el alcanfor . El piperonal , un aroma floral, se prepara a partir del metileno diéter del catecol seguido de condensación con glioxal y descarboxilación . [20]
El catecol se utiliza como revelador fotográfico en blanco y negro , pero, a excepción de algunas aplicaciones especiales, su uso es en gran medida histórico. Se rumorea que se utilizó brevemente en el revelador HC-110 de Eastman Kodak y se rumorea que es un componente del revelador Neofin Blau de Tetenal. [21] Es un componente clave de Finol de Moersch Photochemie en Alemania. El revelado moderno de catecol fue iniciado por el conocido fotógrafo Sandy King. Su fórmula "PyroCat" es popular entre los fotógrafos de película en blanco y negro modernos. [22] Desde entonces, el trabajo de King ha inspirado un mayor desarrollo del siglo XXI por parte de otros, como Jay De Fehr con los reveladores Hypercat y Obsidian Acqua, entre otros. [21]
Nomenclatura
Aunque rara vez se encuentra, el " nombre IUPAC preferido " (PIN) oficial del catecol es benceno-1,2-diol . [23] El nombre trivial pirocatecol es un nombre IUPAC retenido, de acuerdo con las Recomendaciones para la Nomenclatura de la Química Orgánica de 1993. [24] [25]
Véase también
Referencias
- ^ ab "Front Matter". Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. pág. 691. doi :10.1039/9781849733069-FP001. ISBN . 978-0-85404-182-4.
- ^ abcd Fiege, Helmut; Voges, Heinz-Werner; Hamamoto, Toshikazu; Umemura, Sumio; Iwata, Tadao; Miki, Hisaya; Fujita, Yasuhiro; Buysch, Hans-Josef; Garbe, Dorotea; Paulus, Wilfried (2000), "Derivados del fenol", Enciclopedia de química industrial de Ullmann , doi :10.1002/14356007.a19_313, ISBN 978-3-527-30385-4
- ^ Lander, John J.; Svirbely, WJ (1945). "Los momentos dipolares del catecol, el resorcinol y la hidroquinona". Revista de la Sociedad Química Americana . 67 (2): 322–324. doi :10.1021/ja01218a051.
- ^ abcd Guía de bolsillo del NIOSH sobre peligros químicos. "#0109". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ↑ Hugo Reinsch (1839) "Einige Bemerkungen über Catechu" (Algunas observaciones sobre el catechu), Repertorium für die Pharmacie , 68 : 49-58. Reinsch describe la preparación de catecol en la pág. 56: "Bekanntlich wird die Katechusäure bei der Destillation zerstört, während sich ein geringer Theil davon als krystallinischer Anflug sublimirt, welcher aber noch nicht näher untersucht worden ist. Diese Säure ist vielleicht dieselbe, welche ich bei der zerstörenden Destillation des Katechus erhalten…” (Como es bien sabido, el ácido catechu se destruye por destilación, mientras que una pequeña porción se sublima en forma de eflorescencia cristalina, que sin embargo aún no ha sido examinada detalladamente. Este ácido es quizás el mismo que obtuve por destilación destructiva de catechu. ;… ). En la pág. 58, Reinsch nombra el nuevo compuesto: "Die Eigenschaften dieser Säure sind so bestimmt, dass man sie füglich als eine eigenthümliche Säure betrachten und sie mit dem Namen Brenz-Katechusäure belegen kann". (Las propiedades de este ácido son tan definidas que se puede considerarlo, con razón, un ácido extraño y darle el nombre de "ácido catecu quemado".)
- ^ Ver:
- H. Wackenroder (1841) "Eigenschaften der Catechusäure" (Propiedades del ácido catechu), Annalen der Chemie und Pharmacie , 37 : 306-320.
- Constantin Zwenger (1841) "Ueber Catechin" (Sobre la catequina), Annalen der Chemie und Pharmacie , 37 : 320-336.
- (Anon.) (1841) "Sobre la catequina (ácido catequínico) y la pirocatequina (ácido pirocatequínico)", Philosophical Magazine , 19 : 194-195.
- ^ Ver:
- Rudolf Wagner (1852) "Ueber die Farbstoffe des Gelbholzes (Morus tinctoria.)" (Sobre la materia colorante de la morera de Dyer (Morus tinctoria.)), Journal für praktische Chemie , 55 : 65-76. Ver pág. 65.
- August Kekulé (1867) "Ueber die Sulfosäuren des Phenols" (Sobre los sulfonatos de fenol) Zeitschrift für Chemie , nueva serie, 3 : 641–646; ver pág. 643.
- Joseph Alfred Naquet, con William Cortis, trad., y Thomas Stevenson, ed., Principles of Chemistry, found on Modern Theories (Londres, Inglaterra: Henry Renshaw, 1868), pág. 657. Véase también pág. 720.
- ^ Ver:
- En 1879, el Comité de Publicación del Journal of the Chemical Society emitió instrucciones a sus redactores para "Distinguir todos los alcoholes, es decir, los derivados hidroxílicos de los hidrocarburos, por nombres que terminan en ol, por ejemplo , quinol, catecol, … " Véase: Alfred H. Allen (20 de junio de 1879) "Nomenclatura de cuerpos orgánicos", English Mechanic and World of Science , 29 (743): 369.
- William Allen Miller, ed., Elementos de química: teórica y práctica, Parte III: Química de compuestos de carbono o química orgánica, Sección I… , 5.ª ed. (Londres, Inglaterra: Longmans, Green and Co., 1880), pág. 524.
- ^ Zheng, LT; Ryu, GM; Kwon, BM; Lee, WH; Suk, K. (2008). "Efectos antiinflamatorios de los catecoles en células de microglia estimuladas por lipopolisacáridos: inhibición de la neurotoxicidad microglial". Revista Europea de Farmacología . 588 (1): 106–13. doi :10.1016/j.ejphar.2008.04.035. PMID 18499097.
- ^ ab HD Dakin, HT Clarke, ER Taylor (1923). "Catecol". Síntesis orgánicas . 3 : 28. doi : 10.15227/orgsyn.003.0028.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ RS Hanslick, WF Bruce, A. Mascitti (1953). "Carbonato de o-fenileno". Org. Synth . 33 : 74. doi :10.15227/orgsyn.033.0074.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Anderson, Bryan F.; Buckingham, David A.; Robertson, Glen B.; Webb, John; Murray, Keith S.; Clark, Paul E. (1976). "Modelos para el quelato de transporte de hierro bacteriano enteroquelina" . Nature . 262 (5570): 722–724. Bibcode :1976Natur.262..722A. doi :10.1038/262722a0. PMID 134287. S2CID 3045676.
- ^ Schweigert, Nina; Zehnder, Alexander JB ; Eggen, Rik IL (2001). "Propiedades químicas de los catecoles y sus modos moleculares de acción tóxica en células, desde microorganismos hasta mamíferos. Minirevisión". Microbiología ambiental . 3 (2): 81–91. doi :10.1046/j.1462-2920.2001.00176.x. PMID 11321547.
- ^ Griffith, WP (1993). "Avances recientes en la química del dioxoleno". Química de metales de transición . 18 (2): 250–256. doi :10.1007/BF00139966. S2CID 93790780.
- ^ PDB : 2ZI8 ; Yam KC, D'Angelo I, Kalscheuer R, Zhu H, Wang JX, Snieckus V, Ly LH, Converse PJ, Jacobs WR, Strynadka N, Eltis LD (marzo de 2009). "Estudios de una dioxigenasa que escinde anillos iluminan el papel del metabolismo del colesterol en la patogénesis de Mycobacterium tuberculosis". PLOS Pathog . 5 (3): e1000344. doi : 10.1371/journal.ppat.1000344 . PMC 2652662 . PMID 19300498.
- ^ Saiz-Poseu, J.; Mancebo-Aracil, J.; Nador, F.; Busqué, F.; Ruiz-Molina, D. (2019). "La química detrás de la adhesión basada en catecol". Edición internacional Angewandte Chemie . 58 (3): 696–714. doi :10.1002/anie.201801063. hdl :11336/94743. PMID 29573319. S2CID 4228374.
- ^ Bolton, Judy L.; Dunlap, Tareisha L.; Dietz, Birgit M. (2018). "Formación y objetivos biológicos de las o-quinonas botánicas". Toxicología alimentaria y química . 120 : 700–707. doi : 10.1016 /j.fct.2018.07.050 . PMC 6643002. PMID 30063944. S2CID 51887182.
- ^ Briggs DEG (1999). "Tafonomía molecular de cutículas animales y vegetales: preservación selectiva y diagénesis". Philosophical Transactions of the Royal Society B: Biological Sciences . 354 (1379): 7–17. doi :10.1098/rstb.1999.0356. PMC 1692454 .
- ^ Enciclopedia de reactivos para síntesis orgánica , 2001, doi :10.1002/047084289X, hdl : 10261/236866 , ISBN 978-0-471-93623-7
- ^ Fahlbusch, Karl-Georg; Hammerschmidt, Franz-Josef; Panten, Johannes; Pickenhagen, Wilhelm; Schatkowski, Dietmar; Bauer, Kurt; Garbe, Dorotea; Surburg, Horst (2003), "Sabores y fragancias", Enciclopedia de química industrial de Ullmann , doi :10.1002/14356007.a11_141, ISBN 978-3-527-30385-4
- ^ de Stephen G. Anchell (10 de septiembre de 2012). The Darkroom Cookbook . Taylor & Francis. ISBN 978-1136092770.
- ^ Stephen G. Anchell; Bill Troop (1998). El libro de recetas para el revelado de películas . ISBN 978-0240802770.
- ^ Nombres IUPAC preferidos. Septiembre de 2004, Capítulo 6, Secciones 60–64, pág. 38
- ^ IUPAC, Comisión de Nomenclatura de Química Orgánica. Guía para la nomenclatura de compuestos orgánicos de la IUPAC (Recomendaciones 1993) R-5.5.1.1 Alcoholes y fenoles.
- ^ Panico, R.; Powell, WH, eds. (1994). Una guía para la nomenclatura de compuestos orgánicos de la IUPAC 1993. Oxford: Blackwell Science. ISBN 978-0-632-03488-8.
Este artículo incorpora texto de una publicación que ahora es de dominio público : Chisholm, Hugh , ed. (1911). "Catechu". Encyclopædia Britannica (11.ª ed.). Cambridge University Press.
Enlaces externos
- Ficha internacional de seguridad química 0411
- Guía de bolsillo del NIOSH sobre peligros químicos
- Monografía del IARC: “Catecol”
- Nomenclatura IUPAC de la química orgánica (versión en línea del " Libro Azul ")





![3,4-dihidroxi-9,10-secoandrosta-1,3,5(10)-trieno-9,17-diona, un metabolito del colesterol[15]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d8/DHSA.svg/89px-DHSA.svg.png)




![Dopamina, derivada del aminoácido tirosina, un adhesivo utilizado por los mejillones.[16]](http://upload.wikimedia.org/wikipedia/commons/thumb/2/2f/Dopamine.svg/180px-Dopamine.svg.png)


