Experimento de Franck-Hertz

| Parte de una serie de artículos sobre |
| Mecánica cuántica |
|---|
El experimento de Franck-Hertz fue la primera medición eléctrica que mostró claramente la naturaleza cuántica de los átomos . Fue presentado el 24 de abril de 1914 en la Sociedad Alemana de Física en un artículo de James Franck y Gustav Hertz . [1] [2] Franck y Hertz habían diseñado un tubo de vacío para estudiar electrones energéticos que volaban a través de un vapor fino de átomos de mercurio . Descubrieron que, cuando un electrón colisionaba con un átomo de mercurio, podía perder solo una cantidad específica (4,9 electronvoltios ) de su energía cinética antes de volar. [3] Esta pérdida de energía corresponde a la desaceleración del electrón desde una velocidad de aproximadamente 1,3 millones de metros por segundo a cero. [4] Un electrón más rápido no desacelera completamente después de una colisión, sino que pierde exactamente la misma cantidad de su energía cinética. Los electrones más lentos simplemente rebotan en los átomos de mercurio sin perder ninguna velocidad o energía cinética significativa.
Estos resultados experimentales demostraron ser consistentes con el modelo de Bohr para átomos que había sido propuesto el año anterior por Niels Bohr . El modelo de Bohr fue un precursor de la mecánica cuántica y del modelo de capas electrónicas de los átomos. Su característica clave era que un electrón dentro de un átomo ocupa uno de los "niveles de energía cuántica" del átomo. Antes de la colisión, un electrón dentro del átomo de mercurio ocupaba su nivel de energía más bajo disponible. Después de la colisión, el electrón dentro ocupa un nivel de energía más alto con 4,9 electronvoltios (eV) más de energía. Esto significa que el electrón está más débilmente unido al átomo de mercurio. No había niveles intermedios ni posibilidades en el modelo cuántico de Bohr. Esta característica fue "revolucionaria" porque era incompatible con la expectativa de que un electrón pudiera estar unido al núcleo de un átomo por cualquier cantidad de energía. [3] [5]
En un segundo artículo presentado en mayo de 1914, Franck y Hertz informaron sobre la emisión de luz por los átomos de mercurio que habían absorbido energía de las colisiones. [6] Demostraron que la longitud de onda de esta luz ultravioleta correspondía exactamente a los 4,9 eV de energía que había perdido el electrón volador. La relación entre energía y longitud de onda también había sido predicha por Bohr porque había seguido la estructura presentada por Hendrik Lorentz en el Congreso Solvay de 1911. En Solvay, Hendrik Lorentz sugirió después de la charla de Einstein sobre la estructura cuántica que la energía de un rotador se estableciera igual a nhv . [7] [8] Por lo tanto, Bohr había seguido las instrucciones dadas en 1911 y había copiado la fórmula propuesta por Lorentz y otros en su modelo atómico de 1913. [ 9 ] Lorentz había estado en lo cierto. La cuantificación de los átomos coincidía con su fórmula incorporada en el modelo de Bohr. [3] Se dice que, tras una presentación de estos resultados por parte de Franck unos años más tarde, Albert Einstein comentó: "Es tan hermoso que te hace llorar". [10]
El 10 de diciembre de 1926, Franck y Hertz recibieron el Premio Nobel de Física de 1925 "por su descubrimiento de las leyes que gobiernan el impacto de un electrón sobre un átomo". [11]
Experimento

El experimento original de Franck y Hertz utilizó un tubo de vacío calentado que contenía una gota de mercurio ; informaron que la temperatura del tubo era de 115 °C, en la que la presión de vapor del mercurio es de aproximadamente 100 pascales (aproximadamente una milésima parte de la presión atmosférica). [1] [12] En la fotografía se muestra un tubo de Franck-Hertz contemporáneo. Está equipado con tres electrodos: un cátodo caliente que emite electrones ; una rejilla de malla metálica ; y un ánodo . El voltaje de la rejilla es positivo en relación con el cátodo, de modo que los electrones emitidos desde el cátodo caliente son atraídos hacia él. La corriente eléctrica medida en el experimento se debe a los electrones que pasan a través de la rejilla y llegan al ánodo. El potencial eléctrico del ánodo es ligeramente negativo en relación con la rejilla, de modo que los electrones que llegan al ánodo tienen al menos una cantidad correspondiente de energía cinética después de pasar por la rejilla. [13]

Los gráficos publicados por Franck y Hertz (ver figura) muestran la dependencia de la corriente eléctrica que sale del ánodo del potencial eléctrico entre la rejilla y el cátodo.
- En el caso de diferencias de potencial bajas (hasta 4,9 voltios), la corriente que pasa por el tubo aumenta de manera constante a medida que aumenta la diferencia de potencial. Este comportamiento es típico de los tubos de vacío auténticos que no contienen vapor de mercurio; los voltajes más altos dan lugar a una " corriente limitada por la carga espacial " mayor.
- A 4,9 voltios la corriente cae bruscamente, hasta casi llegar a cero.
- Luego la corriente aumenta nuevamente de manera constante a medida que se incrementa aún más el voltaje, hasta que se alcanzan 9,8 voltios (exactamente 4,9+4,9 voltios).
- A 9,8 voltios se observa una caída brusca similar.
- Si bien no es evidente en las mediciones originales de la figura, esta serie de caídas de corriente en incrementos de aproximadamente 4,9 voltios continúa hasta alcanzar potenciales de al menos 70 voltios. [14]
Franck y Hertz observaron en su primer artículo que la energía característica de 4,9 eV de su experimento se correspondía bien con una de las longitudes de onda de la luz emitida por los átomos de mercurio en las descargas de gas . Estaban utilizando una relación cuántica entre la energía de excitación y la longitud de onda correspondiente de la luz, que atribuyeron ampliamente a Johannes Stark y a Arnold Sommerfeld ; predice que 4,9 eV corresponde a la luz con una longitud de onda de 254 nm. [1] La misma relación también se incorporó en la teoría de fotones de Einstein de 1905 del efecto fotoeléctrico . [15] En un segundo artículo, Franck y Hertz informaron sobre la emisión óptica de sus tubos, que emitían luz con una única longitud de onda prominente de 254 nm. [6] La figura de la derecha muestra el espectro de un tubo de Franck-Hertz; casi toda la luz emitida tiene una única longitud de onda. Como referencia, la figura también muestra el espectro de una luz de descarga de gas de mercurio, que emite luz en varias longitudes de onda además de 254 nm. La figura se basa en los espectros originales publicados por Franck y Hertz en 1914. El hecho de que el tubo de Franck-Hertz emitiera sólo la longitud de onda, correspondiente casi exactamente al período de voltaje que habían medido, fue muy importante. [13]
Modelado de colisiones de electrones con átomos.
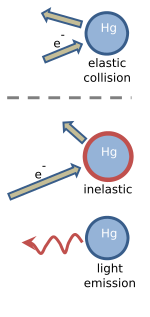
Franck y Hertz explicaron su experimento en términos de colisiones elásticas e inelásticas entre los electrones y los átomos de mercurio. [1] [2] Los electrones que se mueven lentamente chocan elásticamente con los átomos de mercurio. Esto significa que la dirección en la que se mueve el electrón se altera por la colisión, pero su velocidad no cambia. Una colisión elástica se ilustra en la figura, donde la longitud de la flecha indica la velocidad del electrón. El átomo de mercurio no se ve afectado por la colisión, principalmente porque es aproximadamente cuatrocientas mil veces más masivo que un electrón. [16] [17]
Cuando la velocidad del electrón supera los 1,3 millones de metros por segundo, [4] las colisiones con un átomo de mercurio se vuelven inelásticas. Esta velocidad corresponde a una energía cinética de 4,9 eV, que se deposita en el átomo de mercurio. Como se muestra en la figura, la velocidad del electrón se reduce y el átomo de mercurio se "excita". Poco tiempo después, los 4,9 eV de energía que se depositaron en el átomo de mercurio se liberan en forma de luz ultravioleta con una longitud de onda de exactamente 254 nm. Después de la emisión de luz, el átomo de mercurio vuelve a su estado original, no excitado. [16] [17]
Si los electrones emitidos desde el cátodo volaran libremente hasta llegar a la rejilla, adquirirían una energía cinética proporcional al voltaje aplicado a la rejilla. 1 eV de energía cinética corresponde a una diferencia de potencial de 1 voltio entre la rejilla y el cátodo. [18] Las colisiones elásticas con los átomos de mercurio aumentan el tiempo que tarda un electrón en llegar a la rejilla, pero la energía cinética promedio de los electrones que llegan allí no se ve muy afectada. [17]
Cuando el voltaje de la red alcanza los 4,9 V, las colisiones de electrones cerca de la red se vuelven inelásticas y los electrones se ralentizan considerablemente. La energía cinética de un electrón típico que llega a la red se reduce tanto que no puede viajar más lejos para alcanzar el ánodo, cuyo voltaje está configurado para repeler ligeramente a los electrones. La corriente de electrones que llega al ánodo cae, como se ve en el gráfico. Nuevos aumentos en el voltaje de la red restauran suficiente energía a los electrones que sufrieron colisiones inelásticas para que puedan volver a alcanzar el ánodo. La corriente aumenta de nuevo a medida que el potencial de la red aumenta más allá de 4,9 V. A 9,8 V, la situación cambia de nuevo. Los electrones que han viajado aproximadamente la mitad del camino desde el cátodo hasta la red ya han adquirido suficiente energía para sufrir una primera colisión inelástica. A medida que continúan lentamente hacia la red desde el punto medio, su energía cinética se acumula de nuevo, pero cuando llegan a la red pueden sufrir una segunda colisión inelástica. Una vez más, la corriente hacia el ánodo cae. Este proceso se repetirá a intervalos de 4,9 voltios; cada vez los electrones sufrirán una colisión inelástica adicional. [16] [17]
Teoría cuántica temprana
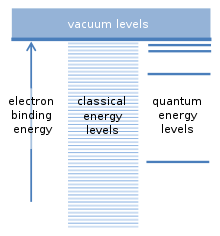
Aunque Franck y Hertz no lo sabían cuando publicaron sus experimentos en 1914 [19] , en 1913 Niels Bohr había publicado un modelo para los átomos que tuvo mucho éxito en explicar las propiedades ópticas del hidrógeno atómico. Estas se observaban habitualmente en descargas de gas, que emitían luz en una serie de longitudes de onda. Las fuentes de luz ordinarias, como las bombillas incandescentes, emiten luz en todas las longitudes de onda. Bohr había calculado las longitudes de onda emitidas por el hidrógeno con mucha precisión [20] .
El supuesto fundamental del modelo de Bohr se refiere a las posibles energías de enlace de un electrón con el núcleo de un átomo. El átomo puede ionizarse si una colisión con otra partícula proporciona al menos esta energía de enlace. Esto libera al electrón del átomo y deja atrás un ion con carga positiva. Existe una analogía con los satélites que orbitan alrededor de la Tierra. Cada satélite tiene su propia órbita y prácticamente cualquier distancia orbital y cualquier energía de enlace de satélite son posibles. Como un electrón es atraído hacia la carga positiva del núcleo atómico por una fuerza similar, los llamados cálculos "clásicos" sugieren que cualquier energía de enlace también debería ser posible para los electrones. Sin embargo, Bohr supuso que solo existe una serie específica de energías de enlace, que corresponden a los "niveles de energía cuántica" para el electrón. Un electrón se encuentra normalmente en el nivel de energía más bajo, con la mayor energía de enlace. Los niveles adicionales se encuentran más arriba, con energías de enlace más pequeñas. Las energías de enlace intermedias que se encuentran entre estos niveles no están permitidas. Esta fue una suposición revolucionaria. [5]
Franck y Hertz habían propuesto que la característica de 4,9 V de sus experimentos se debía a la ionización de los átomos de mercurio por colisiones con los electrones volantes emitidos en el cátodo. En 1915, Bohr publicó un artículo en el que señalaba que las mediciones de Franck y Hertz eran más coherentes con el supuesto de los niveles cuánticos en su propio modelo para los átomos. [21] En el modelo de Bohr, la colisión excitaba un electrón interno dentro del átomo desde su nivel más bajo hasta el primer nivel cuántico por encima de él. El modelo de Bohr también predijo que se emitiría luz cuando el electrón interno regresara de su nivel cuántico excitado al más bajo; su longitud de onda correspondía a la diferencia de energía de los niveles internos del átomo, lo que se ha denominado la relación de Bohr. [3] La observación de Franck y Hertz de la emisión de su tubo a 254 nm también era coherente con la perspectiva de Bohr. Franck y Hertz, que escribieron después del final de la Primera Guerra Mundial en 1918, habían adoptado en gran medida la perspectiva de Bohr para interpretar su experimento, que se ha convertido en uno de los pilares experimentales de la mecánica cuántica. [10] [2] Como lo describió Abraham Pais, "la belleza del trabajo de Franck y Hertz no reside solo en la medición de la pérdida de energía E 2 - E 1 del electrón que choca, sino que también observaron que, cuando la energía de ese electrón supera los 4,9 eV, el mercurio comienza a emitir luz ultravioleta de una frecuencia definida ν como se define en la fórmula anterior. De ese modo, dieron (sin darse cuenta al principio) la primera prueba experimental directa de la relación de Bohr". [3] El propio Franck enfatizó la importancia del experimento de emisión ultravioleta en un epílogo de la película del Comité de Estudio de Ciencias Físicas (PSSC) de 1960 sobre el experimento de Franck-Hertz. [19]
Experimento con neón
En los laboratorios de instrucción, el experimento de Franck-Hertz se realiza a menudo utilizando gas neón , que muestra el inicio de colisiones inelásticas con un resplandor naranja visible en el tubo de vacío, y que también es no tóxico, en caso de que el tubo se rompa. Con tubos de mercurio, el modelo para colisiones elásticas e inelásticas predice que debería haber bandas estrechas entre el ánodo y la rejilla donde el mercurio emite luz, pero la luz es ultravioleta e invisible. Con neón, el intervalo de voltaje de Franck-Hertz es de 18,7 voltios, y aparece un resplandor naranja cerca de la rejilla cuando se aplican 18,7 voltios. Este resplandor se acercará al cátodo con un potencial de aceleración creciente e indica las ubicaciones donde los electrones han adquirido los 18,7 eV necesarios para excitar un átomo de neón. A 37,4 voltios, serán visibles dos resplandores distintos: uno a medio camino entre el cátodo y la rejilla, y otro justo en la rejilla de aceleración. Los potenciales más altos, espaciados a intervalos de 18,7 voltios, darán lugar a regiones brillantes adicionales en el tubo.
Una ventaja adicional del neón para los laboratorios de instrucción es que el tubo puede utilizarse a temperatura ambiente. Sin embargo, la longitud de onda de la emisión visible es mucho mayor que la predicha por la relación de Bohr y el intervalo de 18,7 V. Una explicación parcial de la luz naranja implica dos niveles atómicos que se encuentran 16,6 eV y 18,7 eV por encima del nivel más bajo. Los electrones excitados al nivel de 18,7 eV caen al nivel de 16,6 eV, con la consiguiente emisión de luz naranja. [22]
- Experimento de Franck-Hertz con gas neón: 3 regiones brillantes
- Experimento de Franck-Hertz con neón: corriente del ánodo versus voltaje de la red (relativo al cátodo).
Referencias
- ^ abcde Franck, J.; Hertz, G. (1914). "Über Zusammenstöße zwischen Elektronen und Molekülen des Quecksilberdampfes und die Ionisierungsspannung desselben" [Sobre las colisiones entre electrones y moléculas de vapor de mercurio y el potencial de ionización de los mismos] (PDF) . Verhandlungen der Deutschen Physikalischen Gesellschaft (en alemán). 16 : 457–467. Archivado desde el original (PDF) el 2 de febrero de 2017 . Consultado el 21 de enero de 2017 .Una traducción de este artículo aparece en Boorse, Henry A.; Motz, Lloyd (1966). "46. La teoría cuántica se pone a prueba". El mundo del átomo . Vol. 1. Basic Books. págs. 766–778. OCLC 534667.En sus artículos iniciales, Franck y Hertz interpretaron el potencial de 4,9 V asociado con las colisiones inelásticas entre electrones y mercurio como un indicador del potencial de ionización del mercurio. La relación con el modelo atómico de Bohr surgió algo más tarde.
- ^ abc Lemmerich, Jost (2011). Ciencia y conciencia: la vida de James Franck. Traducido por Ann Hentschel. Stanford University Press. pp. 45–50. ISBN 9780804779098.
Luego aparecieron en rápida sucesión dos artículos de Franck y Hertz sobre mediciones del mercurio vaporizado que iban a inscribir sus nombres en los registros de la historia de la física. El primer artículo fue presentado por Gustav Hertz en la reunión de la Sociedad Alemana de Física el 24 de abril de 1914, el segundo por James Franck el 22 de mayo. (p. 45)
Traducción de Aufrecht im Sturm der Zeit: der Physiker James Franck, 1882-1964 . Verlag für Geschichte der Naturwissenschaften und der Technik. 2007.ISBN 9783928186834.OCLC 234125038 . - ^ abcde Pais, Abraham (1995). "Introducción a los átomos y sus núcleos". En Brown, Laurie M .; Pais, Abraham; Pippard, Brian (eds.). Física del siglo XX . Vol. 1. American Institute of Physics Press. pág. 89. ISBN 9780750303101.
Ahora bien, la belleza del trabajo de Franck y Hertz no reside sólo en la medición de la pérdida de energía E 2 - E 1 del electrón que choca, sino que también observaron que, cuando la energía de ese electrón supera los 4,9 eV, el mercurio comienza a emitir luz ultravioleta de una frecuencia definida ν, tal como se define en la fórmula anterior. De este modo, dieron (sin darse cuenta al principio) la primera prueba experimental directa de la relación de Bohr.
La frecuencia ν está relacionada con la longitud de onda λ de la luz mediante la fórmula ν = c / λ , donde c =2,99 × 10 8 m/s es la velocidad de la luz en el vacío. - ^ ab Para convertir electronvoltios a velocidades de electrones, véase "La velocidad de los electrones". Practical Physics . Nuffield Foundation . Consultado el 18 de abril de 2014 .
- ^ ab Cohen, I. Bernard (1985). Revolución en la ciencia . Belknap Press. págs. 427–428. ISBN 9780674767775En 1912 ,
un joven danés que trabajaba en el laboratorio de Rutherford en Manchester propuso un nuevo modelo revolucionario del átomo. ... Lo que hacía que la teoría de Bohr fuera difícil de creer era la idea de estados u órbitas discretos y fijos, sin que fueran posibles estados intermedios.
- ^ abc Franck, J.; Hertz, G. (1914). "Über die Erregung der Quecksilberresonanzlinie 253,6 μμ durch Elektronenstöße" [Sobre la excitación de líneas de resonancia de mercurio a 253,6 nm mediante colisiones de electrones]. Verhandlungen der Deutschen Physikalischen Gesellschaft (en alemán). 16 : 512–517.El símbolo μμ es un uso poco común y anticuado para un nanómetro . Este artículo fue reimpreso en Franck, James; Hertz, Gustav; Hermann, Armin [en alemán] (1967). Die Elektronenstoßversuche . Múnich: E. Battenberg. OCLC 9956175.
- ^ Actas originales de la Conferencia Solvay de 1911 publicadas en 1912. THÉORIE DU RAYONNEMENT ET LES QUANTA. RAPPORTS ET DISCUSSIONS DELA Réunion tenue à Bruxelles, del 30 de octubre al 3 de noviembre de 1911, Sous les Auspices dk ME SOLVAY. Publicados por MM. P. LANGEVIN y M. de BROGLIE. Traducido del francés, pág. 447.
- ^ Heilbron, John L. y Thomas S. Kuhn. “La génesis del átomo de Bohr”. Historical Studies in the Physical Sciences, vol. 1, University of California Press, 1969, pp. vi–290, p. 244 doi :10.2307/27757291.
- ^ Véase el modelo de Bohr
- ^ ab Rice, Stuart A. ; Jortner, Joshua (2010). "James Franck 1882–1964: A Biographical Memoir". Academia Nacional de Ciencias (EE. UU.). p. 6.
Nuestra comprensión del mundo se transformó gracias a los resultados de este experimento; se podría decir que es uno de los fundamentos más importantes de la verificación experimental de la naturaleza cuántica de la materia.
- ^ Oseen, CW (10 de diciembre de 1926). «Premio Nobel de Física 1925 – Discurso de presentación». La Fundación Nobel.
- ^ Huber, Marcia L.; Laesecke, Arno; Friend, Daniel G. (abril de 2006). "La presión de vapor del mercurio" (PDF) . Instituto Nacional de Normas. pág. 5. Archivado desde el original (PDF) el 24 de diciembre de 2016. Consultado el 8 de abril de 2014 .NISTIR 6643.
- ^ ab Brandt, Siegmund (2008). "25. El experimento de Franck Hertz (1914)". La cosecha de un siglo: descubrimientos de la física moderna en 100 episodios . Oxford University Press. pág. 272. ISBN 9780191580123.
- ^ Thornton, Stephen; Rex, Andrew (2012). Física moderna para científicos e ingenieros (4.ª edición). Cengage Learning. págs. 154-156. ISBN 9781133103721.
- ^ Pais, Abraham (1982). Sutil es el Señor: La ciencia y la vida de Albert Einstein . Oxford University Press. pág. 381. ISBN 9780191524028.La energía E de un fotón es el producto de la constante de Planck h y la relación c / λ de la velocidad de la luz c y la longitud de onda λ .
- ^ abc Melissinos, Adrian Constantin; Napolitano, Jim (2003). "1.3 El experimento de Franck-Hertz". Experimentos en física moderna . Gulf Professional Publishing. págs. 10-19. ISBN 9780124898516.Esta referencia sugiere incorrectamente que Franck y Hertz conocían el modelo de Bohr cuando publicaron sus experimentos. El propio Franck lo comentó en una entrevista al final de su vida; véase Holton, Gerald (1961). "Sobre el pasado reciente de la física". American Journal of Physics . 61 (12): 805–810. Bibcode :1961AmJPh..29..805H. doi : 10.1119/1.1937623 .
- ^ abcd Demtröder, Wolfgang (2010). "3.4.4 Experimento de Franck-Hertz". Átomos, moléculas y fotones: una introducción a la física atómica, molecular y cuántica . Springer. págs. 118-120. ISBN. 9783642102981.
- ^ En su experimento original, Franck y Hertz utilizaron platino tanto para el cátodo como para la rejilla. Cuando se utilizan materiales diferentes para los electrodos, hay una contribución adicional a la energía cinética más allá del voltaje aplicado externamente. Véase Thornton, Stephen; Rex, Andrew (2012). Física moderna para científicos e ingenieros (4.ª ed.). Cengage Learning. pp. 154–156. ISBN 9781133103721.
- ^ ab En 1960, Franck explicó que él y Hertz desconocían las ideas de Bohr cuando se presentaron sus dos artículos de 1914. Franck hizo sus comentarios como epílogo de la película sobre el experimento de Franck-Hertz del Comité de Estudio de Ciencias Físicas (1960). La película está disponible en línea; véase Byron L. Youtz (narrador); James Franck (epílogo); Jack Churchill (director) (1960). Experimento de Franck-Hertz (película de 16 mm). Servicios educativos. 25 minutos en. OCLC 4949442 . Consultado el 1 de julio de 2014 .. Una transcripción del epílogo se publicó poco después de que se hiciera la película; véase Holton, Gerald (1961). "Sobre el pasado reciente de la física". American Journal of Physics . 61 (12): 805–810. Bibcode :1961AmJPh..29..805H. doi : 10.1119/1.1937623 .
- ^ Heilbron, John L. (1985). "Las primeras teorías del átomo de Bohr" . En francés, AP ; Kennedy, PJ (eds.). Niels Bohr: A Centenary Volume . Cambridge, Massachusetts: Harvard University Press. págs. 33–49. ISBN. 9780674624160.OCLC 12051112 .
- ^ Kragh, Helge (2012). Niels Bohr y el átomo cuántico: el modelo de Bohr de la estructura atómica 1913-1925. Oxford University Press. pág. 144. ISBN 9780191630460.Kragh cita una frase de uno de los artículos de Bohr de 1915 en el que analiza los artículos de Franck y Hertz de 1914: "Parece que su experimento puede ser coherente con la suposición de que este voltaje (4,9 V) corresponde sólo a la transición del estado normal a algún otro estado estacionario del átomo neutro".
- ^ Csele, Mark (2011). "2.6 El experimento de Franck-Hertz". Fundamentos de fuentes de luz y láseres . John Wiley & Sons. págs. 31–36. ISBN 9780471675228.
Lectura adicional
- Basile, Giorgio. "Tubo de mercurio Franck–Hertz 3B Scientific U8482170".Selección de imágenes de un tubo de vacío utilizado para el experimento de Franck-Hertz en laboratorios de instrucción.
- Franck, James (1965). "Transformación de la energía cinética de los electrones libres en energía de excitación de los átomos por impactos" (PDF) . Conferencias Nobel de Física 1922-1941 . Elsevier.Traducción de la conferencia Nobel que dio Franck el 11 de diciembre de 1926.
- Gearhart, Clayton A. (2014). "Los experimentos de Franck-Hertz, 1911-1914: Experimentalistas en busca de una teoría". Física en perspectiva . 16 (3): 293–343. Bibcode :2014PhP....16..293G. doi :10.1007/s00016-014-0139-3. S2CID 118257144.
- Hertz, Gustav (1965). "Los resultados de las pruebas de impacto de electrones a la luz de la teoría de los átomos de Bohr" (PDF) . Conferencias Nobel de Física 1922-1941 . Elsevier.Traducción de la conferencia Nobel que Hertz dio el 11 de diciembre de 1926.
- Nicoletopoulos, Peter (2012). "Literatura actualizada sobre el experimento de Franck-Hertz". Archivado desde el original el 16 de enero de 2012.Véase también "Literatura actualizada sobre el experimento de Franck-Hertz".Nicoletopoulos, que murió en 2013, había sido autor y coautor de varios artículos relacionados con el experimento de Franck-Hertz; estos artículos desafían las interpretaciones convencionales del experimento. Véase Robson, Robert; White, Ronald. "En memoria de Peter Nicoletopoulos" (PDF) . ARC Centre of Excellence for Antimatter–Matter Studies: Annual Report 2012 . Consejo Australiano de Investigación. p. 3. Archivado desde el original (PDF) el 24 de enero de 2014 . Consultado el 29 de marzo de 2014 .
- Rapior, G.; Sengstock, K.; Baev, V. (2006). "Nuevas características del experimento de Franck–Hertz" (PDF) . Am. J. Phys . 74 (5): 423–428. Bibcode :2006AmJPh..74..423R. doi :10.1119/1.2174033. Archivado desde el original (PDF) el 2014-04-13 . Consultado el 2014-03-30 .El artículo original de Franck y Hertz informó corrientes de ánodo de hasta aproximadamente 15 V, como se ilustra en la figura anterior. Se producen máximos y mínimos adicionales cuando se mide la corriente a voltajes más altos. Este artículo señala que el espaciamiento entre los mínimos y los máximos no es exactamente 4,9 V, sino que aumenta para voltajes más altos y varía con la temperatura, y proporciona un modelo para este efecto.



