Macrófago
| Macrófago | |
|---|---|
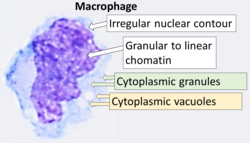 Citología de un macrófago con características típicas. Tinción de Wright . | |
| Detalles | |
| Pronunciación | /ˈmakrə(ʊ)feɪdʒ/ |
| Sistema | Sistema inmunitario |
| Función | Fagocitosis |
| Identificadores | |
| latín | macrófagocito |
| Acrónimo(s) | Mφ , MΦ |
| Malla | D008264 |
| El | H2.00.03.0.01007 |
| FMA | 63261 |
| Términos anatómicos de microanatomía [editar en Wikidata] | |
Los macrófagos ( / ˈm æ k r oʊ f eɪ dʒ / ; abreviado M φ , MΦ o MP ) son un tipo de glóbulo blanco del sistema inmune innato que engulle y digiere patógenos, como células cancerosas , microbios , restos celulares y sustancias extrañas, que no tienen proteínas específicas de las células corporales sanas en su superficie. [1] [2] Este proceso se llama fagocitosis , que actúa para defender al huésped contra infecciones y lesiones. [3]
Los macrófagos se encuentran en prácticamente todos los tejidos, [4] donde patrullan en busca de patógenos potenciales mediante un movimiento ameboide . Toman diversas formas (con varios nombres) en todo el cuerpo (p. ej., histiocitos , células de Kupffer , macrófagos alveolares , microglia y otros), pero todos son parte del sistema de fagocitos mononucleares . Además de la fagocitosis, desempeñan un papel fundamental en la defensa no específica ( inmunidad innata ) y también ayudan a iniciar mecanismos de defensa específicos ( inmunidad adaptativa ) al reclutar otras células inmunes como los linfocitos . Por ejemplo, son importantes como presentadores de antígenos a las células T. En los seres humanos, los macrófagos disfuncionales causan enfermedades graves como la enfermedad granulomatosa crónica que resultan en infecciones frecuentes.
Además de aumentar la inflamación y estimular el sistema inmunológico, los macrófagos también desempeñan un papel antiinflamatorio importante y pueden disminuir las reacciones inmunológicas a través de la liberación de citocinas . Los macrófagos que estimulan la inflamación se denominan macrófagos M1, mientras que los que la disminuyen y estimulan la reparación tisular se denominan macrófagos M2. [5] Esta diferencia se refleja en su metabolismo; los macrófagos M1 tienen la capacidad única de metabolizar la arginina a la molécula "asesina" óxido nítrico , mientras que los macrófagos M2 tienen la capacidad única de metabolizar la arginina a la molécula "reparadora" ornitina . [6] Sin embargo, esta dicotomía ha sido cuestionada recientemente a medida que se ha descubierto una mayor complejidad. [7]
Los macrófagos humanos tienen un diámetro de aproximadamente 21 micrómetros (0,00083 pulgadas) [8] y se producen por la diferenciación de monocitos en los tejidos. Se pueden identificar mediante citometría de flujo o tinción inmunohistoquímica por su expresión específica de proteínas como CD14 , CD40 , CD11b , CD64 , F4/80 (ratones)/ EMR1 (humanos), lisozima M, MAC-1 /MAC-3 y CD68 . [9]
Los macrófagos fueron descubiertos y nombrados por primera vez por Élie Metchnikoff , un zoólogo del Imperio ruso, en 1884. [10] [11]
Estructura
Tipos
La mayoría de los macrófagos se encuentran ubicados en puntos estratégicos donde es probable que se produzca una invasión microbiana o una acumulación de partículas extrañas. Estas células juntas como grupo se conocen como sistema fagocítico mononuclear y anteriormente se conocían como sistema reticuloendotelial. Cada tipo de macrófago, determinado por su ubicación, tiene un nombre específico:
| Nombre de la celda | Localización anatómica |
| Macrófagos del tejido adiposo | Tejido adiposo (grasa) |
| Monocitos | Médula ósea / sangre |
| Células de Kupffer | Hígado |
| Histiocitos sinusales | Ganglios linfáticos |
| Macrófagos alveolares (células del polvo) | Alvéolos pulmonares |
| Macrófagos tisulares (histiocitos) que dan lugar a células gigantes | Tejido conectivo |
| Microglia | Sistema nervioso central |
| Células de Hofbauer | Placenta |
| Células mesangiales intraglomerulares [12] | Riñón |
| Osteoclastos [13] | Hueso |
| Células de Langerhans | Piel |
| Células epitelioides | Granulomas |
| Macrófagos de pulpa roja ( células de revestimiento sinusoidal ) | Pulpa roja del bazo |
| Macrófagos peritoneales | Cavidad peritoneal |
| Macrófagos perivasculares [14] | estrechamente asociado con los vasos sanguíneos |
Las investigaciones sobre las células de Kupffer se ven obstaculizadas porque, en el caso de los seres humanos, las células de Kupffer solo son accesibles para el análisis inmunohistoquímico a partir de biopsias o autopsias. En ratas y ratones, son difíciles de aislar y, tras la purificación, solo se pueden obtener aproximadamente 5 millones de células de un ratón.
Los macrófagos pueden expresar funciones paracrinas dentro de órganos que son específicas de la función de ese órgano. En el testículo , por ejemplo, se ha demostrado que los macrófagos pueden interactuar con las células de Leydig secretando 25-hidroxicolesterol , un oxisterol que las células de Leydig vecinas pueden convertir en testosterona . [15] Además, los macrófagos testiculares pueden participar en la creación de un entorno inmunológico privilegiado en el testículo y en la mediación de la infertilidad durante la inflamación del testículo.
Los macrófagos residentes cardíacos participan en la conducción eléctrica a través de la comunicación de unión estrecha con los miocitos cardíacos . [16]
Los macrófagos se pueden clasificar según su función fundamental y su activación. Según esta clasificación, existen macrófagos de activación clásica (M1) , macrófagos de cicatrización de heridas (también conocidos como macrófagos de activación alternativa (M2) ) y macrófagos reguladores (Mregs). [17]
Desarrollo
Los macrófagos que residen en tejidos sanos adultos derivan de monocitos circulantes o se establecen antes del nacimiento y luego se mantienen durante la vida adulta independientemente de los monocitos. [18] [19] Por el contrario, la mayoría de los macrófagos que se acumulan en sitios enfermos generalmente derivan de monocitos circulantes. [20] La extravasación de leucocitos describe la entrada de monocitos en tejido dañado a través del endotelio de los vasos sanguíneos a medida que se convierten en macrófagos. Los monocitos son atraídos a un sitio dañado por sustancias químicas a través de la quimiotaxis , desencadenada por una variedad de estímulos que incluyen células dañadas, patógenos y citocinas liberadas por macrófagos que ya están en el sitio. En algunos sitios como el testículo, se ha demostrado que los macrófagos pueblan el órgano a través de la proliferación. [21] A diferencia de los neutrófilos de vida corta , los macrófagos sobreviven más tiempo en el cuerpo, hasta varios meses.
Función
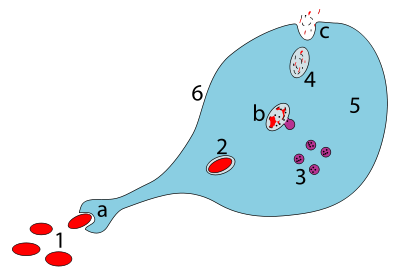
a. Ingestión mediante fagocitosis, se forma un fagosoma
b. La fusión de los lisosomas con el fagosoma crea un fagolisosoma ; el patógeno se descompone mediante enzimas
c. Se expulsa o asimila el material de desecho (este último no se muestra en la imagen)
Partes:
1. Patógenos
2. Fagosoma
3. Lisosomas
4. Material de desecho
5. Citoplasma
6. Membrana celular
Fagocitosis
Los macrófagos son fagocitos profesionales y están altamente especializados en la eliminación de células muertas o moribundas y de restos celulares. Esta función es importante en la inflamación crónica, ya que las primeras etapas de la inflamación están dominadas por los neutrófilos, que son ingeridos por los macrófagos cuando alcanzan la mayoría de edad (consulte CD31 para obtener una descripción de este proceso). [22]
Los neutrófilos son atraídos primero a un sitio, donde realizan su función y mueren, antes de que ellos o sus trampas extracelulares de neutrófilos sean fagocitados por los macrófagos. [22] [23] Cuando están en el sitio, la primera ola de neutrófilos, después del proceso de envejecimiento y después de las primeras 48 horas, estimula la aparición de los macrófagos por lo que estos macrófagos luego ingerirán los neutrófilos envejecidos. [22]
La eliminación de células moribundas es manejada, en mayor medida, por macrófagos fijos , que permanecerán en lugares estratégicos como los pulmones, el hígado, el tejido neural , los huesos, el bazo y el tejido conectivo, ingiriendo materiales extraños como patógenos y reclutando macrófagos adicionales si es necesario. [24]
Cuando un macrófago ingiere un patógeno, éste queda atrapado en un fagosoma , que luego se fusiona con un lisosoma . Dentro del fagolisosoma , las enzimas y los peróxidos tóxicos digieren el patógeno. Sin embargo, algunas bacterias, como Mycobacterium tuberculosis , se han vuelto resistentes a estos métodos de digestión. Las Salmonellae tifoideas inducen su propia fagocitosis por los macrófagos del huésped in vivo e inhiben la digestión por acción lisosomal, utilizando así los macrófagos para su propia replicación y provocando la apoptosis de los macrófagos. [25] Los macrófagos pueden digerir más de 100 bacterias antes de que finalmente mueran debido a sus propios compuestos digestivos.
Papel en la respuesta inmune innata
Cuando un patógeno invade, los macrófagos residentes en el tejido se encuentran entre las primeras células en responder. [26] Dos de las principales funciones de los macrófagos residentes en el tejido son fagocitar el antígeno entrante y secretar citocinas proinflamatorias que inducen inflamación y reclutan otras células inmunes al sitio. [27]
Fagocitosis de patógenos

Los macrófagos pueden internalizar antígenos a través de la fagocitosis mediada por receptores. [28] Los macrófagos tienen una amplia variedad de receptores de reconocimiento de patrones (PRR) que pueden reconocer patrones moleculares asociados a microbios (MAMP) de patógenos. Muchos PRR, como los receptores tipo Toll (TLR), los receptores carroñeros (SR), los receptores de lectina tipo C, entre otros, reconocen patógenos para la fagocitosis. [28] Los macrófagos también pueden reconocer patógenos para la fagocitosis indirectamente a través de las opsoninas , que son moléculas que se adhieren a los patógenos y los marcan para la fagocitosis. [29] Las opsoninas pueden causar una adhesión más fuerte entre el macrófago y el patógeno durante la fagocitosis, por lo tanto, las opsoninas tienden a mejorar la actividad fagocítica de los macrófagos. [30] Tanto las proteínas del complemento como los anticuerpos pueden unirse a los antígenos y opsonizarlos. Los macrófagos tienen receptores de complemento 1 (CR1) y 3 (CR3) que reconocen las proteínas de complemento unidas a patógenos C3b e iC3b, respectivamente, así como receptores γ cristalizables en fragmentos (FcγRs) que reconocen la región cristalizable en fragmentos (Fc) de los anticuerpos de inmunoglobulina G (IgG) unidos a antígenos . [29] [31] Al fagocitar y digerir patógenos, los macrófagos pasan por un estallido respiratorio donde se consume más oxígeno para suministrar la energía necesaria para producir especies reactivas de oxígeno (ROS) y otras moléculas antimicrobianas que digieren los patógenos consumidos. [27] [32]
Secreción de citocinas
El reconocimiento de MAMP por PRR puede activar macrófagos residentes en el tejido para secretar citocinas proinflamatorias que reclutan otras células inmunes. Entre los PRR, los TLR juegan un papel importante en la transducción de señales que conduce a la producción de citocinas. [28] La unión de MAMP a TLR desencadena una serie de eventos posteriores que finalmente activan el factor de transcripción NF-κB y dan como resultado la transcripción de los genes de varias citocinas proinflamatorias, incluidas IL-1β , IL-6 , TNF-α , IL-12B e interferones de tipo I como IFN-α e IFN-β. [33] Sistémicamente, IL-1β, IL-6 y TNF-α inducen fiebre e inician la respuesta de fase aguda en la que el hígado secreta proteínas de fase aguda . [26] [27] [34] A nivel local, IL-1β y TNF-α provocan vasodilatación, donde los espacios entre las células epiteliales de los vasos sanguíneos se ensanchan, y una regulación positiva de las moléculas de adhesión de la superficie celular en las células epiteliales para inducir la extravasación de leucocitos . [26] [27]
Los neutrófilos se encuentran entre las primeras células inmunes reclutadas por los macrófagos para salir de la sangre a través de la extravasación y llegar al sitio de la infección. [34] Los macrófagos secretan muchas quimiocinas como CXCL1 , CXCL2 y CXCL8 (IL-8) que atraen a los neutrófilos al sitio de la infección. [26] [34] Una vez que los neutrófilos han terminado de fagocitar y eliminar el antígeno al final de la respuesta inmune, experimentan apoptosis y los macrófagos se reclutan de los monocitos de la sangre para ayudar a eliminar los restos apoptóticos. [35]
Los macrófagos también reclutan otras células inmunes como monocitos, células dendríticas, células asesinas naturales, basófilos, eosinófilos y células T a través de quimiocinas como CCL2 , CCL4 , CCL5 , CXCL8 , CXCL9 , CXCL10 y CXCL11 . [26] [34] Junto con las células dendríticas, los macrófagos ayudan a activar las células asesinas naturales (NK) a través de la secreción de interferones tipo I (IFN-α e IFN-β) e IL-12 . IL-12 actúa con IL-18 para estimular la producción de interferón gamma (IFN-γ) citocina proinflamatoria por las células NK, que sirve como una fuente importante de IFN-γ antes de que se active el sistema inmunológico adaptativo. [34] [36] El IFN-γ mejora la respuesta inmune innata al inducir un fenotipo más agresivo en los macrófagos, lo que les permite matar patógenos de manera más eficiente. [34]
Algunos de los quimioatrayentes de células T secretados por los macrófagos incluyen CCL5 , CXCL9 , CXCL10 y CXCL11 . [26]
Papel en la inmunidad adaptativa

Interacciones con CD4+Células T auxiliares
Los macrófagos son células presentadoras de antígenos (APC) profesionales, lo que significa que pueden presentar péptidos de antígenos fagocitados en moléculas del complejo mayor de histocompatibilidad (MHC) II en su superficie celular para las células T auxiliares. [38] Los macrófagos no son activadores primarios de células T auxiliares vírgenes que nunca se han activado previamente, ya que los macrófagos residentes en el tejido no viajan a los ganglios linfáticos donde residen las células T auxiliares vírgenes. [39] [40] Aunque los macrófagos también se encuentran en órganos linfoides secundarios como los ganglios linfáticos, no residen en zonas de células T y no son eficaces para activar las células T auxiliares vírgenes. [39] Los macrófagos en los tejidos linfoides están más involucrados en la ingestión de antígenos y evitando que entren en la sangre, así como en la absorción de desechos de los linfocitos apoptóticos. [39] [41] Por lo tanto, los macrófagos interactúan principalmente con células T auxiliares previamente activadas que han abandonado el ganglio linfático y han llegado al sitio de la infección o con células T de memoria residentes en el tejido. [40]
Los macrófagos proporcionan ambas señales necesarias para la activación de las células T colaboradoras: 1) Los macrófagos presentan la molécula MHC clase II unida al péptido antigénico para que sea reconocida por el receptor de células T (TCR) correspondiente, y 2) el reconocimiento de patógenos por los PRR induce a los macrófagos a regular positivamente las moléculas coestimuladoras CD80 y CD86 (también conocidas como B7 ) que se unen a CD28 en las células T colaboradoras para proporcionar la señal coestimuladora. [34] [38] Estas interacciones permiten que las células T colaboradoras alcancen la función efectora completa y les proporcionan señales continuas de supervivencia y diferenciación que les impiden sufrir apoptosis debido a la falta de señalización del TCR. [38] Por ejemplo, la señalización de IL-2 en las células T regula positivamente la expresión de la proteína antiapoptótica Bcl-2 , pero la producción de IL-2 por parte de las células T y el receptor de IL-2 de alta afinidad IL-2RA requieren una señal continua del reconocimiento del TCR del antígeno unido al MHC. [34] [42]
Activación
Los macrófagos pueden alcanzar diferentes fenotipos de activación a través de interacciones con diferentes subconjuntos de células T auxiliares, como TH 1 y TH 2. [ 17] Aunque existe un amplio espectro de fenotipos de activación de macrófagos, hay dos fenotipos principales que se reconocen comúnmente. [17] Son los macrófagos activados clásicamente, o macrófagos M1, y los macrófagos activados alternativamente, o macrófagos M2. Los macrófagos M1 son proinflamatorios, mientras que los macrófagos M2 son principalmente antiinflamatorios. [17]
Clásico
Las células TH 1 desempeñan un papel importante en la activación clásica de los macrófagos como parte de la respuesta inmune tipo 1 contra patógenos intracelulares (como bacterias intracelulares ) que pueden sobrevivir y replicarse dentro de las células huésped, especialmente aquellos patógenos que se replican incluso después de ser fagocitados por macrófagos. [43] Después de que el TCR de las células TH 1 reconoce moléculas MHC clase II unidas a péptidos antigénicos específicos en los macrófagos, las células TH 1 1) secretan IFN-γ y 2) regulan positivamente la expresión del ligando CD40 (CD40L), que se une a CD40 en los macrófagos. [44] [34] Estas 2 señales activan los macrófagos y mejoran su capacidad para matar patógenos intracelulares a través del aumento de la producción de moléculas antimicrobianas como el óxido nítrico (NO) y el superóxido (O 2- ). [26] [34] Esta mejora de la capacidad antimicrobiana de los macrófagos por parte de las células TH 1 se conoce como activación clásica de los macrófagos, y los macrófagos activados se conocen como macrófagos activados clásicamente o macrófagos M1. Los macrófagos M1 a su vez regulan positivamente las moléculas B7 y la presentación de antígenos a través de moléculas MHC de clase II para proporcionar señales que sostienen la ayuda de las células T. [44] La activación de los macrófagos TH 1 y M1 es un ciclo de retroalimentación positiva, en el que el IFN-γ de las células TH 1 regula positivamente la expresión de CD40 en los macrófagos; la interacción entre el CD40 en los macrófagos y el CD40L en las células T activa a los macrófagos para que secreten IL-12; y la IL-12 promueve una mayor secreción de IFN-γ de las células TH 1 . [34] [44] El contacto inicial entre el antígeno MHC II unido al macrófago y el TCR sirve como punto de contacto entre las dos células donde se concentra la mayor parte de la secreción de IFN-γ y CD-40L en las células T, por lo que es probable que solo se activen los macrófagos que interactúan directamente con las células T H 1. [34]
Además de activar los macrófagos M1, las células TH 1 expresan el ligando Fas (FasL) y la linfotoxina beta (LT-β) para ayudar a matar a los macrófagos crónicamente infectados que ya no pueden matar patógenos. [34] La muerte de los macrófagos crónicamente infectados libera patógenos al espacio extracelular que luego pueden ser eliminados por otros macrófagos activados. [34] Las células TH 1 también ayudan a reclutar más monocitos, el precursor de los macrófagos, al sitio de la infección. Las TH 1 secretan TNF-α y LT-α para facilitar la unión de los vasos sanguíneos a los monocitos y su salida. [34] Las TH 1 secretan CCL2 como quimioatrayente para los monocitos. IL-3 y GM-CSF liberados por las células TH 1 estimulan una mayor producción de monocitos en la médula ósea. [34]
Cuando los patógenos intracelulares no pueden eliminarse, como en el caso de Mycobacterium tuberculosis , el patógeno se contiene a través de la formación de granuloma , una agregación de macrófagos infectados rodeados de células T activadas. [45] Los macrófagos que bordean los linfocitos activados a menudo se fusionan para formar células gigantes multinucleadas que parecen tener una mayor capacidad antimicrobiana debido a su proximidad a las células T H 1, pero con el tiempo, las células en el centro comienzan a morir y forman tejido necrótico. [40] [45]
Alternativa
Las células T H 2 desempeñan un papel importante en la activación alternativa de los macrófagos como parte de la respuesta inmune tipo 2 contra grandes patógenos extracelulares como los helmintos . [34] [46] Las células T H 2 secretan IL-4 e IL-13, que activan los macrófagos para convertirse en macrófagos M2, también conocidos como macrófagos activados alternativamente. [46] [47] Los macrófagos M2 expresan arginasa-1 , una enzima que convierte la arginina en ornitina y urea . [46] La ornitina ayuda a aumentar la contracción del músculo liso para expulsar el gusano y también participa en la reparación de tejidos y heridas. La ornitina puede metabolizarse aún más a prolina , que es esencial para sintetizar colágeno . [46] Los macrófagos M2 también pueden disminuir la inflamación al producir antagonista del receptor de IL-1 (IL-1RA) y receptores de IL-1 que no conducen a una señalización inflamatoria descendente (IL-1RII). [34] [48]
Interacciones con CD8+células T citotóxicas
Otra parte de la activación de la inmunidad adaptativa implica la estimulación de CD8 + a través de la presentación cruzada de péptidos antigénicos en moléculas MHC de clase I. Los estudios han demostrado que los macrófagos proinflamatorios son capaces de realizar la presentación cruzada de antígenos en moléculas MHC de clase I, pero aún no está claro si la presentación cruzada de macrófagos desempeña un papel en la activación de células T CD8 + vírgenes o de memoria . [27] [49] [41]
Interacciones con las células B
Se ha demostrado que los macrófagos secretan las citocinas BAFF y APRIL, que son importantes para el cambio de isotipo de las células plasmáticas. APRIL e IL-6 secretadas por los precursores de los macrófagos en la médula ósea ayudan a mantener la supervivencia de las células plasmáticas alojadas en la médula ósea. [50]
Subtipos
Existen varias formas activadas de macrófagos. [17] A pesar de un espectro de formas de activar los macrófagos, hay dos grupos principales designados M1 y M2 . Macrófagos M1: como se mencionó anteriormente (anteriormente denominados macrófagos activados clásicamente), [52] los macrófagos "asesinos" M1 son activados por LPS e IFN-gamma , y secretan altos niveles de IL-12 y bajos niveles de IL-10 . Los macrófagos M1 tienen funciones proinflamatorias, bactericidas y fagocíticas. [53] Por el contrario, la designación M2 "reparadora" (también denominada macrófagos activados alternativamente) se refiere ampliamente a los macrófagos que funcionan en procesos constructivos como la cicatrización de heridas y la reparación de tejidos, y aquellos que desactivan la activación dañina del sistema inmunológico al producir citocinas antiinflamatorias como IL-10 . M2 es el fenotipo de los macrófagos tisulares residentes y puede elevarse aún más por IL-4 . Los macrófagos M2 producen niveles elevados de IL-10 y TGF-beta y niveles bajos de IL-12. Los macrófagos asociados a tumores son principalmente del fenotipo M2 y parecen promover activamente el crecimiento tumoral. [54]
Los macrófagos existen en una variedad de fenotipos que están determinados por el papel que desempeñan en la maduración de la herida. Los fenotipos se pueden separar predominantemente en dos categorías principales: M1 y M2. Los macrófagos M1 son el fenotipo dominante observado en las primeras etapas de la inflamación y son activados por cuatro mediadores clave: interferón-γ (IFN-γ), factor de necrosis tumoral (TNF) y patrones moleculares asociados al daño (DAMP). Estas moléculas mediadoras crean una respuesta proinflamatoria que, a su vez, produce citocinas proinflamatorias como la interleucina-6 y el TNF. A diferencia de los macrófagos M1, los macrófagos M2 secretan una respuesta antiinflamatoria mediante la adición de interleucina-4 o interleucina-13. También desempeñan un papel en la cicatrización de heridas y son necesarios para la revascularización y la reepitelización. Los macrófagos M2 se dividen en cuatro tipos principales según sus funciones: M2a, M2b, M2c y M2d. La forma en que se determinan los fenotipos M2 aún es tema de discusión, pero los estudios han demostrado que su entorno les permite adaptarse al fenotipo más apropiado para curar la herida de manera eficiente. [53]
Los macrófagos M2 son necesarios para la estabilidad vascular. Producen factor de crecimiento endotelial vascular-A y TGF-β1 . [53] Existe un cambio de fenotipo de macrófagos M1 a M2 en heridas agudas, sin embargo, este cambio se ve afectado en heridas crónicas. Esta desregulación da como resultado una cantidad insuficiente de macrófagos M2 y sus factores de crecimiento correspondientes que ayudan en la reparación de la herida. Con una falta de estos factores de crecimiento/citocinas antiinflamatorias y una sobreabundancia de citocinas proinflamatorias de los macrófagos M1, las heridas crónicas no pueden sanar de manera oportuna. Normalmente, después de que los neutrófilos comen desechos/patógenos, realizan apoptosis y son eliminados. En este punto, la inflamación no es necesaria y M1 experimenta un cambio a M2 (antiinflamatorio). Sin embargo, la desregulación ocurre ya que los macrófagos M1 son incapaces/no fagocitan neutrófilos que han experimentado apoptosis, lo que conduce a un aumento de la migración de macrófagos y la inflamación. [53]
Tanto los macrófagos M1 como los M2 desempeñan un papel en la promoción de la aterosclerosis . Los macrófagos M1 promueven la aterosclerosis mediante la inflamación. Los macrófagos M2 pueden eliminar el colesterol de los vasos sanguíneos, pero cuando el colesterol se oxida, los macrófagos M2 se convierten en células espumosas apoptóticas que contribuyen a la placa ateromatosa de la aterosclerosis. [55] [56]
Papel en la regeneración muscular
El primer paso para entender la importancia de los macrófagos en la reparación, el crecimiento y la regeneración muscular es que hay dos "olas" de macrófagos con el inicio del uso del músculo dañado: subpoblaciones que tienen y no tienen una influencia directa en la reparación del músculo. La ola inicial es una población fagocítica que aparece durante períodos de mayor uso muscular que son suficientes para causar lisis de la membrana muscular e inflamación de la membrana, que puede ingresar y degradar el contenido de las fibras musculares lesionadas. [57] [58] [59] Estos macrófagos fagocíticos de invasión temprana alcanzan su concentración más alta aproximadamente 24 horas después del inicio de alguna forma de lesión o recarga de células musculares. [60] Su concentración disminuye rápidamente después de 48 horas. [58] El segundo grupo son los tipos no fagocíticos que se distribuyen cerca de las fibras regenerativas. Estos alcanzan su pico entre dos y cuatro días y permanecen elevados durante varios días mientras el tejido muscular se está reconstruyendo. [58] La primera subpoblación no tiene ningún beneficio directo en la reparación del músculo, mientras que el segundo grupo no fagocítico sí lo tiene.
Se piensa que los macrófagos liberan sustancias solubles que influyen en la proliferación, diferenciación, crecimiento, reparación y regeneración del músculo, pero en este momento se desconoce el factor que se produce para mediar estos efectos. [60] Se sabe que la participación de los macrófagos en la promoción de la reparación tisular no es específica del músculo; se acumulan en numerosos tejidos durante la fase del proceso de curación después de una lesión. [61]
Papel en la cicatrización de heridas
Los macrófagos son esenciales para la cicatrización de heridas . [62] Reemplazan a los neutrófilos polimorfonucleares como células predominantes en la herida el segundo día después de la lesión. [63] Atraídos al sitio de la herida por los factores de crecimiento liberados por las plaquetas y otras células, los monocitos del torrente sanguíneo ingresan al área a través de las paredes de los vasos sanguíneos. [64] La cantidad de monocitos en la herida alcanza su punto máximo entre un día y un día y medio después de que ocurre la lesión. Una vez que están en el sitio de la herida, los monocitos maduran y se convierten en macrófagos. El bazo contiene la mitad de los monocitos del cuerpo en reserva listos para ser desplegados en el tejido lesionado. [65] [66]
La función principal de los macrófagos es fagocitar bacterias y tejido dañado, [62] y también desbridan el tejido dañado liberando proteasas. [67] Los macrófagos también secretan una serie de factores como factores de crecimiento y otras citocinas, especialmente durante el tercer y cuarto día posterior a la herida. Estos factores atraen a la zona a las células implicadas en la etapa de proliferación de la cicatrización. [68] Los macrófagos también pueden restringir la fase de contracción. [69] Los macrófagos son estimulados por el bajo contenido de oxígeno de su entorno para producir factores que inducen y aceleran la angiogénesis [70] y también estimulan las células que reepitelizan la herida, crean tejido de granulación y depositan una nueva matriz extracelular . [71] [ mejor fuente necesaria ] Al secretar estos factores, los macrófagos contribuyen a impulsar el proceso de cicatrización de la herida a la siguiente fase.
Papel en la regeneración de las extremidades
Los científicos han descubierto que, además de ingerir restos materiales, los macrófagos participan en la regeneración típica de las extremidades de la salamandra. [72] [73] Descubrieron que la eliminación de los macrófagos de una salamandra dio como resultado un fracaso de la regeneración de las extremidades y una respuesta de cicatrización. [72] [73]
Papel en la homeostasis del hierro
Como se ha descrito anteriormente, los macrófagos desempeñan un papel fundamental en la eliminación de células muertas o moribundas y de restos celulares. Los eritrocitos tienen una vida media de 120 días y, por tanto, los macrófagos del bazo y el hígado los destruyen constantemente. Los macrófagos también engullen macromoléculas y, por tanto, desempeñan un papel fundamental en la farmacocinética de los hierros parenterales . [ cita requerida ]
El hierro que se libera de la hemoglobina se almacena internamente en la ferritina o se libera a la circulación a través de la ferroportina . En los casos en que los niveles sistémicos de hierro están elevados o hay inflamación, los niveles elevados de hepcidina actúan sobre los canales de ferroportina de los macrófagos, lo que hace que el hierro permanezca dentro de los macrófagos. [ cita requerida ]
Papel en la retención de pigmento

Los melanófagos son un subconjunto de macrófagos residentes en los tejidos capaces de absorber pigmento, ya sea nativo del organismo o exógeno (como los tatuajes ), del espacio extracelular. A diferencia de los melanocitos dendríticos de la unión , que sintetizan melanosomas y contienen varias etapas de su desarrollo, los melanófagos solo acumulan melanina fagocitada en fagosomas similares a lisosomas. [74] [75] Esto ocurre repetidamente a medida que el pigmento de los macrófagos dérmicos muertos es fagocitado por sus sucesores, preservando el tatuaje en el mismo lugar. [76]
Papel en la homeostasis tisular
Cada tejido alberga su propia población especializada de macrófagos residentes, que mantienen interconexiones recíprocas con el estroma y el tejido funcional. [77] [78] Estos macrófagos residentes son sésiles (no migratorios), proporcionan factores de crecimiento esenciales para apoyar la función fisiológica del tejido (por ejemplo, la comunicación cruzada entre macrófagos y neuronas en los intestinos), [79] y pueden proteger activamente el tejido del daño inflamatorio. [80]
Macrófagos asociados a los nervios
Los macrófagos asociados a los nervios o NAM son aquellos macrófagos residentes en los tejidos que están asociados a los nervios. Se sabe que algunos de ellos tienen una morfología alargada de hasta 200 μm [81]
Importancia clínica
Debido a su papel en la fagocitosis, los macrófagos están implicados en muchas enfermedades del sistema inmunitario. Por ejemplo, participan en la formación de granulomas , lesiones inflamatorias que pueden ser causadas por un gran número de enfermedades. Se han descrito, por ejemplo, algunos trastornos, en su mayoría raros, de fagocitosis y función ineficaces de los macrófagos. [82]
Como huésped de patógenos intracelulares
En su función de células inmunitarias fagocíticas, los macrófagos se encargan de engullir a los patógenos para destruirlos. Algunos patógenos subvierten este proceso y, en su lugar, viven dentro del macrófago. Esto proporciona un entorno en el que el patógeno se oculta del sistema inmunitario y le permite replicarse. [ cita requerida ]
Las enfermedades que cursan con este tipo de comportamiento incluyen la tuberculosis (causada por Mycobacterium tuberculosis ) y la leishmaniasis (causada por especies de Leishmania ). [ cita requerida ]
Para minimizar la posibilidad de convertirse en el huésped de una bacteria intracelular, los macrófagos han desarrollado mecanismos de defensa como la inducción de óxido nítrico y de intermediarios reactivos de oxígeno, [83] que son tóxicos para los microbios. Los macrófagos también han desarrollado la capacidad de restringir el suministro de nutrientes del microbio e inducir la autofagia . [84]
Tuberculosis
Una vez engullido por un macrófago, el agente causal de la tuberculosis, Mycobacterium tuberculosis , [85] evita las defensas celulares y utiliza la célula para replicarse. Evidencias recientes sugieren que en respuesta a la infección pulmonar de Mycobacterium tuberculosis , los macrófagos periféricos maduran al fenotipo M1. El fenotipo M1 de los macrófagos se caracteriza por una mayor secreción de citocinas proinflamatorias (IL-1β, TNF-α e IL-6) y un aumento de las actividades glucolíticas esenciales para la eliminación de la infección. [1]
Leishmaniasis
Tras la fagocitosis por parte de un macrófago, el parásito Leishmania se encuentra en una vacuola fagocítica. En circunstancias normales, esta vacuola fagocítica se transformaría en un lisosoma y su contenido sería digerido. Las Leishmania alteran este proceso y evitan ser destruidas; en su lugar, se instalan dentro de la vacuola. [ cita requerida ]
Chikunguña
La infección de los macrófagos en las articulaciones se asocia con inflamación local durante y después de la fase aguda de Chikungunya (causada por CHIKV o virus Chikungunya). [86]
Otros
El adenovirus (la causa más común de conjuntivitis) puede permanecer latente en un macrófago huésped, con una diseminación viral continua durante 6 a 18 meses después de la infección inicial. [ cita requerida ]
Las especies de Brucella pueden permanecer latentes en un macrófago a través de la inhibición de la fusión fagosoma - lisosoma ; causa brucelosis (fiebre ondulante). [ cita requerida ]
Legionella pneumophila , el agente causante de la enfermedad del legionario , también establece su residencia dentro de los macrófagos. [ cita requerida ]
Cardiopatía
Los macrófagos son las células predominantes implicadas en la creación de las lesiones progresivas de la placa de la aterosclerosis . [87]
El reclutamiento focal de macrófagos ocurre después del inicio del infarto agudo de miocardio . Estos macrófagos funcionan para eliminar desechos, células apoptóticas y preparar el tejido para la regeneración . [88] Los macrófagos protegen contra la taquicardia ventricular inducida por isquemia en ratones hipocalémicos. [89]
Infección por VIH
Los macrófagos también desempeñan un papel en la infección por el virus de la inmunodeficiencia humana (VIH). Al igual que las células T , los macrófagos pueden infectarse con el VIH e incluso convertirse en un reservorio de la replicación continua del virus en todo el cuerpo. El VIH puede entrar en el macrófago a través de la unión de gp120 a CD4 y al segundo receptor de membrana, CCR5 (un receptor de quimiocina). Tanto los monocitos circulantes como los macrófagos sirven como reservorio para el virus. [90] Los macrófagos son más capaces de resistir la infección por VIH-1 que las células T CD4+, aunque la susceptibilidad a la infección por VIH difiere entre los subtipos de macrófagos. [91]
Cáncer
Los macrófagos pueden contribuir al crecimiento y progresión tumoral al promover la proliferación e invasión de células tumorales, fomentando la angiogénesis tumoral y suprimiendo las células inmunes antitumorales. [92] [93] Los compuestos inflamatorios, como el factor de necrosis tumoral (TNF)-alfa liberado por los macrófagos activan el interruptor genético factor nuclear-kappa B. NF-κB luego ingresa al núcleo de una célula tumoral y activa la producción de proteínas que detienen la apoptosis y promueven la proliferación celular y la inflamación. [94] Además, los macrófagos sirven como fuente de muchos factores proangiogénicos, incluido el factor endotelial vascular (VEGF), el factor de necrosis tumoral-alfa (TNF-alfa), el factor estimulante de colonias de macrófagos (M-CSF/CSF1) y la IL-1 y la IL-6 , [95] contribuyendo aún más al crecimiento tumoral.
Se ha demostrado que los macrófagos se infiltran en varios tumores. Su número se correlaciona con un mal pronóstico en ciertos cánceres, incluidos los cánceres de mama, cuello uterino, vejiga, cerebro y próstata. [96] [97] Algunos tumores también pueden producir factores, incluidos M-CSF/CSF1, MCP-1/CCL2 y angiotensina II , que desencadenan la amplificación y movilización de macrófagos en los tumores. [98] [99] [100] Además, los macrófagos del seno subcapsular en los ganglios linfáticos que drenan el tumor pueden suprimir la progresión del cáncer al contener la propagación de materiales derivados del tumor. [101]
Terapia contra el cáncer
Los estudios experimentales indican que los macrófagos pueden afectar todas las modalidades terapéuticas, incluyendo la cirugía , la quimioterapia , la radioterapia , la inmunoterapia y la terapia dirigida . [93] [102] [103] Los macrófagos pueden influir en los resultados del tratamiento tanto de forma positiva como negativa. Los macrófagos pueden ser protectores de diferentes maneras: pueden eliminar las células tumorales muertas (en un proceso llamado fagocitosis ) después de los tratamientos que matan estas células; pueden servir como depósitos de fármacos para algunos fármacos contra el cáncer; [104] también pueden ser activados por algunas terapias para promover la inmunidad antitumoral. [105] Los macrófagos también pueden ser perjudiciales de varias maneras: por ejemplo, pueden suprimir varias quimioterapias, [106] [107] radioterapias [108] [109] e inmunoterapias. [110] [111] Debido a que los macrófagos pueden regular la progresión tumoral, actualmente se están probando estrategias terapéuticas para reducir el número de estas células o para manipular sus fenotipos en pacientes con cáncer. [112] [113] Sin embargo, los macrófagos también están involucrados en la citotoxicidad mediada por anticuerpos (ADCC) y se ha propuesto que este mecanismo es importante para ciertos anticuerpos de inmunoterapia contra el cáncer. [114]
Obesidad
Se ha observado que un mayor número de macrófagos proinflamatorios en el tejido adiposo obeso contribuye a las complicaciones de la obesidad, incluida la resistencia a la insulina y la diabetes tipo 2. [115]
Por lo tanto, la modulación del estado inflamatorio de los macrófagos del tejido adiposo se ha considerado un posible objetivo terapéutico para tratar las enfermedades relacionadas con la obesidad. [116] Aunque los macrófagos del tejido adiposo están sujetos al control homeostático antiinflamatorio por la inervación simpática, los experimentos con ratones knock out del gen ADRB2 indican que este efecto se ejerce indirectamente a través de la modulación de la función de los adipocitos, y no a través de la activación directa del receptor adrenérgico Beta-2 , lo que sugiere que la estimulación adrenérgica de los macrófagos puede ser insuficiente para afectar la inflamación o la función del tejido adiposo en la obesidad. [117]
Dentro del tejido graso ( adiposo ) de ratones deficientes en CCR2 , hay un mayor número de eosinófilos , mayor activación de macrófagos alternativos y una propensión a la expresión de citocinas tipo 2. Además, este efecto se exageró cuando los ratones se volvieron obesos debido a una dieta alta en grasas. [118] Esto es causado parcialmente por un cambio de fenotipo de los macrófagos inducido por la necrosis de las células grasas ( adipocitos ). En un individuo obeso, algunos adipocitos estallan y sufren muerte necrótica, lo que hace que los macrófagos M2 residenciales cambien al fenotipo M1. Esta es una de las causas de un estado inflamatorio crónico sistémico de bajo grado asociado con la obesidad. [119] [120]
Macrófagos intestinales
Aunque su estructura es muy similar a la de los macrófagos tisulares, los macrófagos intestinales han desarrollado características y funciones específicas en función de su entorno natural, que es el tracto digestivo. Los macrófagos y los macrófagos intestinales tienen una gran plasticidad, lo que hace que su fenotipo se vea alterado por sus entornos. [121] Al igual que los macrófagos, los macrófagos intestinales son monocitos diferenciados, aunque los macrófagos intestinales tienen que coexistir con el microbioma de los intestinos. Esto supone un reto teniendo en cuenta que las bacterias que se encuentran en el intestino no se reconocen como "propias" y podrían ser objetivos potenciales de fagocitosis por parte de los macrófagos. [122]
Para evitar la destrucción de las bacterias intestinales, los macrófagos intestinales han desarrollado diferencias clave en comparación con otros macrófagos. Principalmente, los macrófagos intestinales no inducen respuestas inflamatorias. Mientras que los macrófagos tisulares liberan varias citocinas inflamatorias, como IL-1, IL-6 y TNF-α, los macrófagos intestinales no producen ni secretan citocinas inflamatorias. Este cambio es causado directamente por el entorno de los macrófagos intestinales. Las células epiteliales intestinales circundantes liberan TGF-β , que induce el cambio de macrófago proinflamatorio a macrófago no inflamatorio. [122]
Aunque la respuesta inflamatoria está regulada a la baja en los macrófagos intestinales, la fagocitosis aún se lleva a cabo. No hay una caída en la eficiencia de la fagocitosis ya que los macrófagos intestinales pueden fagocitar eficazmente las bacterias, S. typhimurium y E. coli , pero los macrófagos intestinales todavía no liberan citocinas, incluso después de la fagocitosis. Además, los macrófagos intestinales no expresan receptores de lipopolisacáridos (LPS), IgA o IgG. [123] La falta de receptores de LPS es importante para el intestino ya que los macrófagos intestinales no detectan los patrones moleculares asociados a microbios (MAMPS/PAMPS) del microbioma intestinal. Tampoco expresan receptores de factores de crecimiento IL-2 e IL-3. [122]
Papel en la enfermedad
Se ha demostrado que los macrófagos intestinales desempeñan un papel en la enfermedad inflamatoria intestinal (EII), como la enfermedad de Crohn (EC) y la colitis ulcerosa (CU). En un intestino sano, los macrófagos intestinales limitan la respuesta inflamatoria en el intestino, pero en un estado patológico, la cantidad y la diversidad de macrófagos intestinales se alteran. Esto conduce a la inflamación del intestino y a los síntomas de la enfermedad de la EII. Los macrófagos intestinales son fundamentales para mantener la homeostasis intestinal . La presencia de inflamación o patógenos altera esta homeostasis y, al mismo tiempo, altera los macrófagos intestinales. [124] Todavía no se ha determinado un mecanismo para la alteración de los macrófagos intestinales mediante el reclutamiento de nuevos monocitos o cambios en los macrófagos intestinales ya presentes. [123]
Además, un nuevo estudio revela que los macrófagos limitan el acceso del hierro a las bacterias al liberar vesículas extracelulares, lo que mejora los resultados de la sepsis. [125]
Medios de comunicación
- Se observa un macrófago J774 activo que absorbe cuatro conidios de manera cooperativa. Las células J774 fueron tratadas con 5 ng/ml de interferón-γ una noche antes de filmar con conidios. Se realizaron observaciones cada 30 s durante un período de 2,5 h.
- Se pueden ver dos macrófagos alveolares muy activos ingiriendo conidios . El lapso de tiempo es de 30 segundos por fotograma durante 2,5 horas.
Historia
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección necesita ser ampliada . Puedes ayudar agregándole algo. ( Marzo de 2018 ) |
Los macrófagos fueron descubiertos por primera vez a finales del siglo XIX por Élie Metchnikoff . [126] Élie Metchnikoff revolucionó la rama de los macrófagos al combinar conocimientos filosóficos y el estudio evolutivo de la vida. [127] Más tarde, Van Furth durante la década de 1960 propuso la idea de que los monocitos sanguíneos circulantes en adultos permitieron el origen de todos los macrófagos tisulares. [128] En los últimos años, la publicación sobre los macrófagos ha llevado a la gente a creer que múltiples macrófagos tisulares residentes son independientes de los monocitos sanguíneos, ya que se forman durante la etapa embrionaria del desarrollo. [129] En el siglo XXI, todas las ideas sobre el origen de los macrófagos (presentes en los tejidos) se compilan para sugerir que los organismos fisiológicamente complejos forman macrófagos de forma independiente mediante mecanismos que no tienen que depender de los monocitos sanguíneos. [130]
Véase también
- Bacteriófago
- Célula dendrítica
- Histiocito
- Lista de los distintos tipos de células del cuerpo humano adulto
Referencias
- ^ ab Mahla RS, Kumar A, Tutill HJ, Krishnaji ST, Sathyamoorthy B, Noursadeghi M, et al. (enero de 2021). "La mitofagia mediada por NIX regula la reprogramación metabólica en células fagocíticas durante la infección por micobacterias". Tuberculosis . 126 (enero): 102046. doi :10.1016/j.tube.2020.102046. PMID 33421909. S2CID 231437641.
- ^ "Regenerative Medicine Partnership in Education". Archivado desde el original el 25 de abril de 2015 . Consultado el 7 de mayo de 2015 .
- ^ Nahrendorf M, Hoyer FF, Meerwaldt AE, van Leent MM, Senders ML, Calcagno C, et al. (octubre de 2020). "Obtención de imágenes de macrófagos cardiovasculares y pulmonares con el sensor de tomografía por emisión de positrones 64Cu-Macrin en ratones, conejos y cerdos". Circulation: Cardiovascular Imaging . 13 (10): e010586. doi :10.1161/CIRCIMAGING.120.010586. PMC 7583675 . PMID 33076700.
- ^ Ovchinnikov DA (septiembre de 2008). "Macrófagos en el embrión y más allá: mucho más que fagocitos gigantes". Génesis . 46 (9): 447–462. doi : 10.1002/dvg.20417 . PMID 18781633. S2CID 38894501.
Los macrófagos están presentes esencialmente en todos los tejidos, comenzando con el desarrollo embrionario y, además de su papel en la defensa del huésped y en la eliminación de células apoptóticas, cada vez se reconocen más por su función trófica y su papel en la regeneración.
- ^ Mills CD (2012). "Macrófagos M1 y M2: oráculos de salud y enfermedad". Critical Reviews in Immunology . 32 (6): 463–488. doi :10.1615/CritRevImmunol.v32.i6.10. PMID 23428224.
- ^ Murphy K, Weaver C (2006). Inmunobiología de Janeway . Garland Science, Nueva York. pp. 464, 904. ISBN 978-0-8153-4551-0.
- ^ Ransohoff RM (julio de 2016). "Una pregunta polarizante: ¿existen las microglias M1 y M2?". Nature Neuroscience . 19 (8): 987–991. doi :10.1038/nn.4338. PMID 27459405. S2CID 27541569.
- ^ Krombach F, Münzing S, Allmeling AM, Gerlach JT, Behr J, Dörger M (septiembre de 1997). "Tamaño celular de los macrófagos alveolares: una comparación entre especies". Environmental Health Perspectives . 105 (Supl 5): 1261–1263. doi :10.2307/3433544. JSTOR 3433544. PMC 1470168 . PMID 9400735.
- ^ Khazen W, M'bika JP, Tomkiewicz C, Benelli C, Chany C, Achour A, et al. (octubre de 2005). "Expresión de marcadores selectivos de macrófagos en adipocitos humanos y de roedores". FEBS Letters . 579 (25): 5631–5634. doi : 10.1016/j.febslet.2005.09.032 . PMID 16213494. S2CID 6066984.
- ^ Zalkind S (2001). Ilya Mechnikov: Su vida y su obra . Honolulu, Hawái: University Press of the Pacific. pp. 78, 210. ISBN 978-0-89875-622-7.
- ^ Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili SA, Mardani F, et al. (septiembre de 2018). "Plasticidad, polarización y función de los macrófagos en la salud y la enfermedad". Revista de fisiología celular . 233 (9): 6425–6440. doi : 10.1002/jcp.26429 . PMID 29319160. S2CID 3621509.
- ^ Lote CJ. Principios de fisiología renal, 5.ª edición . Springer. pág. 37.
- ^ Shirazi S, Ravindran S, Cooper LF (diciembre de 2022). "Inmunomodulación mediada por topografía en la osteointegración; ¿aliado o enemigo?". Biomateriales . 291 : 121903. doi :10.1016/j.biomaterials.2022.121903. PMC 10148651 . PMID 36410109.
- ^ Siret C, van Lessen M, Bavais J, Jeong HW, Reddy Samawar SK, Kapupara K, et al. (2022). "Descifrando la heterogeneidad de los macrófagos perivasculares Lyve1+ en el cerebro del ratón". Nature Communications . 13 (1): 7366. Bibcode :2022NatCo..13.7366S. doi : 10.1038/s41467-022-35166-9 . PMC 9712536 . PMID 36450771.
- ^ Nes WD, Lukyanenko YO, Jia ZH, Quideau S, Howald WN, Pratum TK, et al. (marzo de 2000). "Identificación del factor lipofílico producido por los macrófagos que estimula la esteroidogénesis". Endocrinología . 141 (3): 953–958. doi : 10.1210/endo.141.3.7350 . PMID 10698170.
- ^ Hulsmans M, Clauss S, Xiao L, Aguirre AD, King KR, Hanley A, et al. (abril de 2017). "Los macrófagos facilitan la conducción eléctrica en el corazón". Cell . 169 (3): 510–522.e20. doi :10.1016/j.cell.2017.03.050. PMC 5474950 . PMID 28431249.
- ^ abcde Mosser DM, Edwards JP (diciembre de 2008). "Explorando el espectro completo de la activación de los macrófagos". Nature Reviews. Inmunología . 8 (12): 958–969. doi :10.1038/nri2448. PMC 2724991 . PMID 19029990.
- ^ Perdiguero EG, Geissmann F (enero de 2016). "El desarrollo y mantenimiento de los macrófagos residentes". Nature Immunology . 17 (1): 2–8. doi :10.1038/ni.3341. PMC 4950995 . PMID 26681456.
- ^ Ginhoux F, Guilliams M (marzo de 2016). "Ontogenia y homeostasis de macrófagos residentes en tejidos". Inmunidad . 44 (3): 439–449. doi : 10.1016/j.immuni.2016.02.024 . PMID 26982352.
- ^ Pittet MJ, Nahrendorf M, Swirski FK (junio de 2014). "El viaje desde la célula madre hasta el macrófago". Anales de la Academia de Ciencias de Nueva York . 1319 (1): 1–18. Bibcode :2014NYASA1319....1P. doi :10.1111/nyas.12393. PMC 4074243 . PMID 24673186.
- ^ Wang M, Yang Y, Cansever D, Wang Y, Kantores C, Messiaen S, et al. (enero de 2021). "Existen dos poblaciones de macrófagos independientes de monocitos que se mantienen por sí mismos en el epidídimo y el testículo adultos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 118 (1): e2013686117. Bibcode :2021PNAS..11813686W. doi : 10.1073/pnas.2013686117 . PMC 7817195 . PMID 33372158.
- ^ abc Eming SA, Krieg T, Davidson JM (marzo de 2007). "Inflamación en la reparación de heridas: mecanismos moleculares y celulares". The Journal of Investigative Dermatology . 127 (3): 514–25. doi : 10.1038/sj.jid.5700701 . PMID 17299434.
=Monocitos/macrófagos. A menos que los estímulos para el reclutamiento de neutrófilos persistan en el sitio de la herida, la infiltración de neutrófilos cesa después de unos días, y los neutrófilos gastados son fagocitados por los macrófagos, que están presentes en el lado de la herida dentro de los 2 días posteriores a la lesión.
- ^ Monteith AJ, Miller JM, Maxwell CN, Chazin WJ, Skaar EP (septiembre de 2021). "Las trampas extracelulares de neutrófilos mejoran la eliminación de patógenos bacterianos por parte de los macrófagos". Science Advances . 7 (37): eabj2101. Bibcode :2021SciA....7.2101M. doi : 10.1126/sciadv.abj2101 . PMC 8442908 . PMID 34516771.
- ^ Verma N, Saraf S (15 de noviembre de 2017). "El papel de los macrófagos: una descripción general". Revista de administración de fármacos y terapéutica . 7 (6): 91–103. doi : 10.22270/jddt.v7i6.1521 . ISSN 2250-1177.
- ^ YashRoy RC (2000). "Secuestro de macrófagos por Salmonella (310r) a través de la señalización exocitótica de tipo III: un mecanismo de infección del íleon de pollo". Indian Journal of Poultry Science . 35 (3): 276–281.
- ^ abcdefg Arango Duque G, Descoteaux A (7 de octubre de 2014). "Citocinas de macrófagos: participación en la inmunidad y enfermedades infecciosas". Frontiers in Immunology . 5 : 491. doi : 10.3389/fimmu.2014.00491 . PMC 4188125 . PMID 25339958.
- ^ abcde Punt J, Stranford S, Jones P, Owen J (25 de mayo de 2018). Inmunología de Kuby (8.ª ed.). Nueva York, Nueva York: WH Freeman. ISBN 978-1-4641-8978-4.
- ^ abc Fu YL, Harrison RE (29 de abril de 2021). "Receptores fagocíticos microbianos y su posible participación en la inducción de citocinas en macrófagos". Frontiers in Immunology . 12 : 662063. doi : 10.3389/fimmu.2021.662063 . PMC 8117099 . PMID 33995386.
- ^ ab Hirayama D, Iida T, Nakase H (diciembre de 2017). "La función fagocítica de los macrófagos que refuerzan la inmunidad innata y la homeostasis tisular". Revista internacional de ciencias moleculares . 19 (1): 92. doi : 10.3390/ijms19010092 . PMC 5796042 . PMID 29286292.
- ^ Uribe-Querol E, Rosales C (2 de junio de 2020). "Fagocitosis: nuestra comprensión actual de un proceso biológico universal". Frontiers in Immunology . 11 : 1066. doi : 10.3389/fimmu.2020.01066 . PMC 7280488 . PMID 32582172.
- ^ Law SK (1 de enero de 1988). "Receptores C3 en macrófagos". Journal of Cell Science. Suplemento . 9 (Suplemento_9): 67–97. doi :10.1242/jcs.1988.Suplemento_9.4. PMID 2978518. S2CID 29387085.
- ^ Forman HJ, Torres M (diciembre de 2002). "Especies reactivas de oxígeno y señalización celular: explosión respiratoria en la señalización de macrófagos". American Journal of Respiratory and Critical Care Medicine . 166 (12 Pt 2): S4–S8. doi :10.1164/rccm.2206007. PMID 12471082. S2CID 22246117.
- ^ Liu T, Zhang L, Joo D, Sun SC (14 de julio de 2017). "Señalización NF-κB en la inflamación". Transducción de señales y terapia dirigida . 2 (1): 17023–. doi :10.1038/sigtrans.2017.23. PMC 5661633 . PMID 29158945.
- ^ abcdefghijklmnopqr Murphy K, Weaver C, Berg L (2022). Inmunobiología de Janeway (10.ª ed.). Nueva York, Nueva York: WW Norton & Company. ISBN 978-0-393-88487-6.
- ^ Eming SA, Krieg T, Davidson JM (marzo de 2007). "Inflamación en la reparación de heridas: mecanismos moleculares y celulares". The Journal of Investigative Dermatology . 127 (3): 514–525. doi : 10.1038/sj.jid.5700701 . PMID 17299434.
- ^ Mezouar S, Mege JL (julio de 2020). "Cambiando el paradigma del IFN-γ en la interfaz entre la inmunidad innata y adaptativa: IFN-γ derivado de macrófagos". Journal of Leukocyte Biology . 108 (1): 419–426. doi :10.1002/JLB.4MIR0420-619RR. PMID 32531848. S2CID 219622032.
- ^ Kress H, Stelzer EH, Holzer D, Buss F, Griffiths G, Rohrbach A (julio de 2007). "Los filopodios actúan como tentáculos fagocíticos y tiran con pasos discretos y una velocidad dependiente de la carga". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (28): 11633–11638. Bibcode :2007PNAS..10411633K. doi : 10.1073/pnas.0702449104 . PMC 1913848 . PMID 17620618.
- ^ abc Guerriero JL (2019). "Macrófagos: su historia no contada en la activación y función de las células T". Revista internacional de biología celular y molecular . 342 . Elsevier: 73–93. doi :10.1016/bs.ircmb.2018.07.001. ISBN 978-0-12-815381-9. Número PMID 30635094.
- ^ abc Itano AA, Jenkins MK (agosto de 2003). "Presentación de antígenos a células T CD4 vírgenes en el ganglio linfático". Nature Immunology . 4 (8): 733–739. doi :10.1038/ni957. PMID 12888794. S2CID 10305140.
- ^ abc Murphy K, Weaver C (2016). Janeway's Immunobiology (9.ª ed.). Nueva York, Nueva York: Garland Science. págs. 363–364. ISBN 978-0-8153-4505-3.
- ^ ab Gray EE, Cyster JG (2012). "Macrófagos de los ganglios linfáticos". Revista de inmunidad innata . 4 (5–6): 424–436. doi :10.1159/000337007. PMC 3574571 . PMID 22488251.
- ^ Abbas AK (septiembre de 2020). "La sorprendente historia de IL-2". The American Journal of Pathology . 190 (9): 1776–1781. doi : 10.1016/j.ajpath.2020.05.007 . PMID 32828360. S2CID 221280663.
- ^ Annunziato F, Romagnani C, Romagnani S (marzo de 2015). "Los 3 tipos principales de inmunidad efectora innata y adaptativa mediada por células". The Journal of Allergy and Clinical Immunology . 135 (3): 626–635. doi : 10.1016/j.jaci.2014.11.001 . PMID 25528359.
- ^ abc Cai H, Zhang Y, Wang J, Gu J (23 de junio de 2021). "Defectos en la reprogramación de macrófagos en la terapia contra el cáncer: el impacto negativo de PD-L1/PD-1". Frontiers in Immunology . 12 : 690869. doi : 10.3389/fimmu.2021.690869 . PMC 8260839 . PMID 34248982.
- ^ ab Hilhorst M, Shirai T, Berry G, Goronzy JJ, Weyand CM (2014). "Interacciones entre células T y macrófagos y formación de granulomas en vasculitis". Frontiers in Immunology . 5 : 432. doi : 10.3389/fimmu.2014.00432 . PMC 4162471 . PMID 25309534.
- ^ abcd Rolot M, Dewals BG (2 de julio de 2018). "Activación y funciones de los macrófagos durante la infección por helmintos: avances recientes en ratones de laboratorio". Journal of Immunology Research . 2018 : 2790627. doi : 10.1155/2018/2790627 . PMC 6051086 . PMID 30057915.
- ^ Gordon S (enero de 2003). "Activación alternativa de macrófagos". Nature Reviews. Inmunología . 3 (1): 23–35. doi :10.1038/nri978. PMID 12511873. S2CID 23185583.
- ^ Peters VA, Joesting JJ, Freund GG (agosto de 2013). "Receptor 2 de IL-1 (IL-1R2) y su función en la regulación inmunitaria". Cerebro, comportamiento e inmunidad . 32 : 1–8. doi :10.1016/j.bbi.2012.11.006. PMC 3610842 . PMID 23195532.
- ^ Muntjewerff EM, Meesters LD, van den Bogaart G (8 de julio de 2020). "Presentación cruzada de antígenos por macrófagos". Fronteras en Inmunología . 11 : 1276. doi : 10.3389/fimmu.2020.01276 . PMC 7360722 . PMID 32733446.
- ^ Xu W, Banchereau J (enero de 2014). "Las células presentadoras de antígenos instruyen la diferenciación de las células plasmáticas". Frontiers in Immunology . 4 : 504. doi : 10.3389/fimmu.2013.00504 . PMC 3880943 . PMID 24432021.
- ^ Cotran RS, Kumar V, Collins T (1999). Base patológica de la enfermedad de Robbins . Filadelfia: WB Saunders Company. ISBN 978-0-7216-7335-6.
- ^ "La historia de los linfocitos". New Scientist (1605) . Consultado el 13 de septiembre de 2007 .
- ^ abcd Hesketh M, Sahin KB, West ZE, Murray RZ (julio de 2017). "Los fenotipos de macrófagos regulan la formación de cicatrices y la curación de heridas crónicas". Revista internacional de ciencias moleculares . 18 (7): 1545. doi : 10.3390/ijms18071545 . PMC 5536033 . PMID 28714933.
- ^ Galdiero MR, Garlanda C, Jaillon S, Marone G, Mantovani A (julio de 2013). "Macrófagos y neutrófilos asociados a tumores en la progresión tumoral". Journal of Cellular Physiology . 228 (7): 1404–1412. doi :10.1002/jcp.24260. PMID 23065796. S2CID 41189572.
- ^ Hotamisligil GS (abril de 2010). "Estrés del retículo endoplasmático y aterosclerosis". Nature Medicine . 16 (4): 396–399. doi :10.1038/nm0410-396. PMC 2897068 . PMID 20376052.
- ^ Oh J, Riek AE, Weng S, Petty M, Kim D, Colonna M, et al. (abril de 2012). "El estrés del retículo endoplasmático controla la diferenciación de los macrófagos M2 y la formación de células espumosas". The Journal of Biological Chemistry . 287 (15): 11629–11641. doi : 10.1074/jbc.M111.338673 . PMC 3320912 . PMID 22356914.
- ^ Krippendorf BB, Riley DA (enero de 1993). "Distinción entre cambios inducidos por descarga y recarga en el músculo sóleo de la rata". Muscle & Nerve . 16 (1): 99–108. doi :10.1002/mus.880160116. PMID 8423838. S2CID 23012375.
- ^ abc St Pierre BA, Tidball JG (julio de 1994). "Respuesta diferencial de las subpoblaciones de macrófagos a la recarga del músculo sóleo después de la suspensión de las extremidades traseras de la rata". Journal of Applied Physiology . 77 (1): 290–297. doi :10.1152/jappl.1994.77.1.290. PMID 7961247.
- ^ Tidball JG, Berchenko E, Frenette J (abril de 1999). "La invasión de macrófagos no contribuye a la lesión de la membrana muscular durante la inflamación". Journal of Leukocyte Biology . 65 (4): 492–498. doi : 10.1002/jlb.65.4.492 . PMID 10204578. S2CID 23315528.
- ^ ab Schiaffino S, Partridge T (2008). Reparación y regeneración del músculo esquelético . Avances en la investigación muscular. Vol. 3.
- ^ Bréchot N, Gomez E, Bignon M, Khallou-Laschet J, Dussiot M, Cazes A, et al. (2008). "La modulación del estado de activación de los macrófagos protege el tejido de la necrosis durante la isquemia crítica de las extremidades en ratones deficientes en trombospondina-1". PLOS ONE . 3 (12): e3950. Bibcode :2008PLoSO...3.3950B. doi : 10.1371/journal.pone.0003950 . PMC 2597179 . PMID 19079608.
- ^ ab de la Torre J., Sholar A. (2006). Cicatrización de heridas: heridas crónicas. Emedicine.com. Consultado el 20 de enero de 2008.
- ^ "Las fases de la cicatrización de heridas cutáneas" (PDF) . Expert Reviews in Molecular Medicine . 5 . Cambridge University Press. 21 de marzo de 2003. Archivado desde el original (PDF) el 17 de diciembre de 2008.
- ^ Lorenz HP, Longaker MT (2003). "Heridas: biología, patología y tratamiento". (PDF) . En Li M, Norton JA, Bollinger RR, Chang AE, Lowry SF, Mulvihill SJ, Pass HI, Thompson RW (eds.). Práctica esencial de la cirugía . Nueva York, NY: Springer. págs. 77–88. ISBN. 978-0-387-22744-3. Archivado desde el original (PDF) el 31 de octubre de 2005.
- ^ Swirski FK, Nahrendorf M, Etzrodt M, Wildgruber M, Cortez-Retamozo V, Panizzi P, et al. (julio de 2009). "Identificación de monocitos de reservorio esplénico y su despliegue en sitios inflamatorios". Science . 325 (5940): 612–616. Bibcode :2009Sci...325..612S. doi :10.1126/science.1175202. PMC 2803111 . PMID 19644120.
- ^ Jia T, Pamer EG (julio de 2009). "Inmunología. Prescindible pero no irrelevante". Science . 325 (5940): 549–550. Bibcode :2009Sci...325..549J. doi :10.1126/science.1178329. PMC 2917045 . PMID 19644100.
- ^ Deodhar AK, Rana RE (1997). "Fisiología quirúrgica de la cicatrización de heridas: una revisión". Revista de Medicina de Postgrado . 43 (2): 52–56. PMID 10740722.
- ^ Rosenberg L., de la Torre J. (2006). Cicatrización de heridas, factores de crecimiento. Emedicine.com. Consultado el 20 de enero de 2008.
- ^ Newton PM, Watson JA, Wolowacz RG, Wood EJ (agosto de 2004). "Los macrófagos restringen la contracción de un modelo de cicatrización de heridas in vitro". Inflamación . 28 (4): 207–214. doi :10.1023/B:IFLA.0000049045.41784.59. PMID 15673162. S2CID 9612298.
- ^ Greenhalgh DG (septiembre de 1998). "El papel de la apoptosis en la cicatrización de heridas". Revista internacional de bioquímica y biología celular . 30 (9): 1019–1030. doi :10.1016/S1357-2725(98)00058-2. PMID 9785465.
- ^ Stashak TS, Farstvedt E, Othic A (junio de 2004). "Actualización sobre apósitos para heridas: indicaciones y mejor uso". Técnicas clínicas en la práctica equina . 3 (2): 148–163. doi :10.1053/j.ctep.2004.08.006.
- ^ ab Souppouris A (23 de mayo de 2013). "Los científicos identifican una célula que podría contener el secreto de la regeneración de las extremidades". the verge.com.
Los investigadores han identificado una célula que ayuda a la regeneración de las extremidades en las salamandras. Los macrófagos son un tipo de célula reparadora que devora células muertas y patógenos, y activa otras células inmunes para responder a los patógenos.
- ^ ab Godwin JW, Pinto AR, Rosenthal NA (junio de 2013). "Los macrófagos son necesarios para la regeneración de las extremidades de las salamandras adultas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 110 (23): 9415–9420. Bibcode :2013PNAS..110.9415G. doi : 10.1073/pnas.1300290110 . PMC 3677454 . PMID 23690624.
- ^ Mishima Y (octubre de 1967). "Lisosomas en la fagocitosis y síntesis de malanina". Nature . 216 (5110): 67. Bibcode :1967Natur.216...67M. doi : 10.1038/216067a0 . PMID 6050674. S2CID 4285140.
- ^ Mishima Y (enero de 1966). "Diferenciación celular y subcelular de la fagocitosis y síntesis de melanina por actividad lisosomal y melanosómica". The Journal of Investigative Dermatology . 46 (1): 70–75. doi : 10.1038/jid.1966.11 . PMID 5905254.
- ^ Baranska A, Shawket A, Jouve M, Baratin M, Malosse C, Voluzan O, et al. (abril de 2018). "Revelar la dinámica de los macrófagos de la piel explica tanto la persistencia del tatuaje como su eliminación extenuante". The Journal of Experimental Medicine . 215 (4): 1115–1133. doi :10.1084/jem.20171608. PMC 5881467 . PMID 29511065.
- ^ Okabe Y, Medzhitov R (mayo de 2014). "Las señales específicas de tejido controlan el programa reversible de localización y polarización funcional de los macrófagos". Cell . 157 (4): 832–844. doi :10.1016/j.cell.2014.04.016. PMC 4137874 . PMID 24792964.
- ^ Gosselin D, Link VM, Romanoski CE, Fonseca GJ, Eichenfield DZ, Spann NJ, et al. (diciembre de 2014). "El entorno impulsa la selección y la función de los potenciadores que controlan las identidades de los macrófagos específicos de los tejidos". Cell . 159 (6): 1327–1340. doi :10.1016/j.cell.2014.11.023. PMC 4364385 . PMID 25480297.
- ^ Muller PA, Koscsó B, Rajani GM, Stevanovic K, Berres ML, Hashimoto D, et al. (julio de 2014). "La comunicación cruzada entre los macrófagos de la muscularis y las neuronas entéricas regula la motilidad gastrointestinal". Cell . 158 (2): 300–313. doi :10.1016/j.cell.2014.04.050. PMC 4149228 . PMID 25036630.
- ^ Uderhardt S, Martins AJ, Tsang JS, Lämmermann T, Germain RN (abril de 2019). "Los macrófagos residentes ocultan las microlesiones tisulares para prevenir el daño inflamatorio provocado por los neutrófilos". Cell . 177 (3): 541–555.e17. doi :10.1016/j.cell.2019.02.028. PMC 6474841 . PMID 30955887.
- ^ Kolter J, Kierdorf K, Henneke P (enero de 2020). "Origen y diferenciación de los macrófagos asociados a los nervios". Revista de inmunología . 204 (2): 271–279. doi : 10.4049/jimmunol.1901077 . PMID 31907269. S2CID 210043405.
- ^ Wolf AJ, Underhill DM (2014). "Fagocitosis". Macrófagos: biología y función en la patología de las enfermedades . Springer New York. págs. 91–109. doi :10.1007/978-1-4939-1311-4_5. ISBN 978-1-4939-1310-7.
- ^ Herb M, Schramm M (febrero de 2021). "Funciones de las ROS en los macrófagos y la inmunidad antimicrobiana". Antioxidantes . 10 (2): 313. doi : 10.3390/antiox10020313 . PMC 7923022 . PMID 33669824.
- ^ Weiss G, Schaible UE (marzo de 2015). "Mecanismos de defensa de los macrófagos contra bacterias intracelulares". Revisiones inmunológicas . 264 (1): 182–203. doi :10.1111/imr.12266. PMC 4368383 . PMID 25703560.
- ^ Ryan KJ, Ray CG, eds. (2004). Microbiología médica Sherris (4.ª ed.). McGraw Hill. ISBN 978-0-8385-8529-0.
- ^ Dupuis-Maguiraga L, Noret M, Brun S, Le Grand R, Gras G, Roques P (2012). "Enfermedad de Chikungunya: marcadores asociados a la infección desde la fase aguda hasta la crónica de la artralgia inducida por arbovirus". PLOS Neglected Tropical Diseases . 6 (3): e1446. doi : 10.1371/journal.pntd.0001446 . PMC 3313943 . PMID 22479654.
- ^ Lucas AD, Greaves DR (noviembre de 2001). "Ateroesclerosis: papel de las quimiocinas y los macrófagos". Expert Reviews in Molecular Medicine . 3 (25): 1–18. doi :10.1017/S1462399401003696. PMID 14585150. S2CID 8952545.
- ^ Frantz S, Nahrendorf M (mayo de 2014). "Macrófagos cardíacos y su papel en la cardiopatía isquémica". Investigación cardiovascular . 102 (2): 240–248. doi :10.1093/cvr/cvu025. PMC 3989449 . PMID 24501331.
- ^ Grune J, Lewis AJ, Yamazoe M, Hulsmans M, Rohde D, Xiao L, et al. (julio de 2022). "Los neutrófilos incitan y los macrófagos evitan la tormenta eléctrica después de un infarto de miocardio". Nature Cardiovascular Research . 1 (7): 649–664. doi :10.1038/s44161-022-00094-w. PMC 9410341 . PMID 36034743. S2CID 250475623.
- ^ Bol SM, Cobos-Jiménez V, Kootstra NA, van't Wout AB (febrero de 2011). "Macrófago". Virología del futuro . 6 (2): 187–208. doi :10.2217/fvl.10.93.
- ^ Koppensteiner H, Brack-Werner R, Schindler M (octubre de 2012). "Macrófagos y su relevancia en la infección por el virus de inmunodeficiencia humana tipo I". Retrovirology . 9 (1): 82. doi : 10.1186/1742-4690-9-82 . PMC 3484033 . PMID 23035819.
- ^ Qian BZ, Pollard JW (abril de 2010). "La diversidad de macrófagos mejora la progresión tumoral y la metástasis". Cell . 141 (1): 39–51. doi :10.1016/j.cell.2010.03.014. PMC 4994190 . PMID 20371344.
- ^ ab Engblom C, Pfirschke C, Pittet MJ (julio de 2016). "El papel de las células mieloides en las terapias contra el cáncer". Nature Reviews. Cáncer . 16 (7): 447–462. doi :10.1038/nrc.2016.54. PMID 27339708. S2CID 21924175.
- ^ Stix G (julio de 2007). "Una llama maligna. Comprender la inflamación crónica, que contribuye a la enfermedad cardíaca, el Alzheimer y una variedad de otras dolencias, puede ser una clave para desvelar los misterios del cáncer". Scientific American . 297 (1): 60–67. Bibcode :2007SciAm.297a..60S. doi :10.1038/scientificamerican0707-60. PMID 17695843.
- ^ Lin EY, Li JF, Gnatovskiy L, Deng Y, Zhu L, Grzesik DA, et al. (diciembre de 2006). "Los macrófagos regulan el interruptor angiogénico en un modelo murino de cáncer de mama". Cancer Research . 66 (23): 11238–11246. doi :10.1158/0008-5472.can-06-1278. PMID 17114237. S2CID 12722658.
- ^ Bingle L, Brown NJ, Lewis CE. El papel de los macrófagos asociados a tumores en la progresión tumoral: implicaciones para nuevas terapias contra el cáncer. J Pathol 2002; 196:254–65.
- ^ de Groot AE (julio de 2018). "El modelo in vitro de macrófagos asociados a tumores humanos implica la proliferación de macrófagos como un mecanismo para mantener las poblaciones de macrófagos asociados a tumores". Cancer Research . 78 (13 Suplemento): 4060. doi :10.1158/1538-7445.AM2018-4060. S2CID 80769044.
- ^ Lin EY, Nguyen AV, Russell RG, Pollard JW (marzo de 2001). "El factor estimulante de colonias 1 promueve la progresión de los tumores mamarios a la malignidad". The Journal of Experimental Medicine . 193 (6): 727–740. doi :10.1084/jem.193.6.727. PMC 2193412 . PMID 11257139.
- ^ Qian BZ, Li J, Zhang H, Kitamura T, Zhang J, Campion LR, et al. (junio de 2011). "CCL2 recluta monocitos inflamatorios para facilitar la metástasis de tumores de mama". Nature . 475 (7355): 222–225. doi :10.1038/nature10138. PMC 3208506 . PMID 21654748.
- ^ Cortez-Retamozo V, Etzrodt M, Newton A, Ryan R, Pucci F, Sio SW, et al. (febrero de 2013). "La angiotensina II impulsa la producción de macrófagos promotores de tumores". Inmunidad . 38 (2): 296–308. doi :10.1016/j.immuni.2012.10.015. PMC 3582771 . PMID 23333075.
- ^ Pucci F, Garris C, Lai CP, Newton A, Pfirschke C, Engblom C, et al. (abril de 2016). "Los macrófagos de la SCS suprimen el melanoma al restringir las interacciones entre vesículas y células B derivadas de tumores". Science . 352 (6282): 242–246. Bibcode :2016Sci...352..242P. doi :10.1126/science.aaf1328. PMC 4960636 . PMID 26989197.
- ^ Mantovani A, Allavena P (abril de 2015). "La interacción de las terapias contra el cáncer con los macrófagos asociados a tumores". The Journal of Experimental Medicine . 212 (4): 435–445. doi :10.1084/jem.20150295. PMC 4387285 . PMID 25753580.
- ^ De Palma M, Lewis CE (marzo de 2013). "Regulación de las respuestas tumorales a las terapias contra el cáncer por parte de los macrófagos". Cancer Cell . 23 (3): 277–286. doi : 10.1016/j.ccr.2013.02.013 . PMID 23518347.
- ^ Miller MA, Zheng YR, Gadde S, Pfirschke C, Zope H, Engblom C, et al. (octubre de 2015). "Los macrófagos asociados a tumores actúan como un reservorio de liberación lenta del profármaco nanoterapéutico Pt(IV)". Nature Communications . 6 : 8692. Bibcode :2015NatCo...6.8692M. doi :10.1038/ncomms9692. PMC 4711745 . PMID 26503691.
- ^ Klug F, Prakash H, Huber PE, Seibel T, Bender N, Halama N, et al. (noviembre de 2013). "La irradiación en dosis bajas programa la diferenciación de los macrófagos hacia un fenotipo iNOS⁺/M1 que organiza una inmunoterapia eficaz de las células T". Cancer Cell . 24 (5): 589–602. doi : 10.1016/j.ccr.2013.09.014 . PMID 24209604.
- ^ Ruffell B, Chang-Strachan D, Chan V, Rosenbusch A, Ho CM, Pryer N, et al. (noviembre de 2014). "La IL-10 de macrófagos bloquea las respuestas dependientes de las células T CD8+ a la quimioterapia al suprimir la expresión de IL-12 en células dendríticas intratumorales". Cancer Cell . 26 (5): 623–637. doi :10.1016/j.ccell.2014.09.006. PMC 4254570 . PMID 25446896.
- ^ DeNardo DG, Brennan DJ, Rexhepaj E, Ruffell B, Shiao SL, Madden SF, et al. (junio de 2011). "La complejidad leucocitaria predice la supervivencia del cáncer de mama y regula funcionalmente la respuesta a la quimioterapia". Cancer Discovery . 1 (1): 54–67. doi :10.1158/2159-8274.CD-10-0028. PMC 3203524 . PMID 22039576.
- ^ Shiao SL, Ruffell B, DeNardo DG, Faddegon BA, Park CC, Coussens LM (mayo de 2015). "Las células T CD4(+) polarizadas en TH2 y los macrófagos limitan la eficacia de la radioterapia". Cancer Immunology Research . 3 (5): 518–525. doi :10.1158/2326-6066.CIR-14-0232. PMC 4420686 . PMID 25716473.
- ^ Kozin SV, Kamoun WS, Huang Y, Dawson MR, Jain RK, Duda DG (julio de 2010). "El reclutamiento de células precursoras mieloides pero no endoteliales facilita el recrecimiento tumoral después de la irradiación local". Cancer Research . 70 (14): 5679–5685. doi :10.1158/0008-5472.CAN-09-4446. PMC 2918387 . PMID 20631066.
- ^ Arlauckas SP, Garris CS, Kohler RH, Kitaoka M, Cuccarese MF, Yang KS, et al. (mayo de 2017). "Las imágenes in vivo revelan una vía de resistencia mediada por macrófagos asociada a tumores en la terapia anti-PD-1". Science Translational Medicine . 9 (389): eaal3604. doi :10.1126/scitranslmed.aal3604. PMC 5734617 . PMID 28490665.
- ^ Zhu Y, Knolhoff BL, Meyer MA, Nywening TM, West BL, Luo J, et al. (septiembre de 2014). "El bloqueo de CSF1/CSF1R reprograma los macrófagos que se infiltran en el tumor y mejora la respuesta a la inmunoterapia de puntos de control de células T en modelos de cáncer de páncreas". Cancer Research . 74 (18): 5057–5069. doi :10.1158/0008-5472.CAN-13-3723. PMC 4182950 . PMID 25082815.
- ^ Ries CH, Cannarile MA, Hoves S, Benz J, Wartha K, Runza V, et al. (junio de 2014). "El uso de anticuerpos anti-CSF-1R para atacar a los macrófagos asociados a tumores revela una estrategia para la terapia contra el cáncer". Cancer Cell . 25 (6): 846–859. doi : 10.1016/j.ccr.2014.05.016 . PMID 24898549.
- ^ Ruffell B, Coussens LM (abril de 2015). "Macrófagos y resistencia terapéutica en el cáncer". Cancer Cell . 27 (4): 462–472. doi :10.1016/j.ccell.2015.02.015. PMC 4400235 . PMID 25858805.
- ^ Sharma N, Vacher J, Allison JP (mayo de 2019). "El ligando TLR1/2 mejora la eficacia antitumoral del bloqueo de CTLA-4 al aumentar la depleción de Treg intratumoral". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 116 (21): 10453–10462. Bibcode :2019PNAS..11610453S. doi : 10.1073/pnas.1819004116 . PMC 6534983 . PMID 31076558.
- ^ Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, Ferrante AW. La obesidad está asociada con la acumulación de macrófagos en el tejido adiposo" Journal of Clinical Investigation 2003; 112:1796–808.
- ^ Guilherme A, Henriques F, Bedard AH, diputado checo (abril de 2019). "Vías moleculares que vinculan la inervación adiposa con la acción de la insulina en la obesidad y la diabetes mellitus". Nature Reviews. Endocrinología . 15 (4): 207–225. doi :10.1038/s41574-019-0165-y. PMC 7073451. PMID 30733616 .
- ^ Petkevicius K, Bidault G, Virtue S, Newland SA, Dale M, Dugourd A, et al. (junio de 2021). "El receptor beta2-adrenérgico de macrófagos es prescindible para la inflamación y la función del tejido adiposo". Metabolismo molecular . 48 : 101220. doi : 10.1016 /j.molmet.2021.101220 . PMC 8086137. PMID 33774223.
- ^ Bolus WR, Gutierrez DA, Kennedy AJ, Anderson-Baucum EK, Hasty AH (octubre de 2015). "La deficiencia de CCR2 conduce a un aumento de eosinófilos, activación alternativa de macrófagos y expresión de citocinas tipo 2 en el tejido adiposo". Journal of Leukocyte Biology . 98 (4): 467–477. doi :10.1189/jlb.3HI0115-018R. PMC 4763864 . PMID 25934927.
- ^ Boutens L, Stienstra R (mayo de 2016). "Macrófagos del tejido adiposo: descontrol durante la obesidad". Diabetologia . 59 (5): 879–894. doi :10.1007/s00125-016-3904-9. PMC 4826424 . PMID 26940592.
- ^ Cinti S, Mitchell G, Barbatelli G, Murano I, Ceresi E, Faloia E, et al. (noviembre de 2005). "La muerte de los adipocitos define la localización y la función de los macrófagos en el tejido adiposo de ratones y humanos obesos". Journal of Lipid Research . 46 (11): 2347–2355. doi : 10.1194/jlr.M500294-JLR200 . PMID 16150820.
- ^ Kühl AA, Erben U, Kredel LI, Siegmund B (7 de diciembre de 2015). "Diversidad de macrófagos intestinales en enfermedades inflamatorias del intestino". Frontiers in Immunology . 6 : 613. doi : 10.3389/fimmu.2015.00613 . PMC 4670857 . PMID 26697009.
- ^ abc Smythies LE, Sellers M, Clements RH, Mosteller-Barnum M, Meng G, Benjamin WH, et al. (enero de 2005). "Los macrófagos intestinales humanos muestran una profunda anergia inflamatoria a pesar de una ávida actividad fagocítica y bactericida". The Journal of Clinical Investigation . 115 (1): 66–75. doi :10.1172/JCI19229. PMC 539188 . PMID 15630445.
- ^ ab Mowat AM, Bain CC (2011). "Macrófagos mucosos en la homeostasis intestinal y la inflamación". Revista de inmunidad innata . 3 (6): 550–564. doi :10.1159/000329099. PMC 3224516 . PMID 22025201.
- ^ Bain CC, Mowat AM (julio de 2014). "Macrófagos en la homeostasis intestinal y la inflamación". Revisiones inmunológicas . 260 (1): 102–117. doi :10.1111/imr.12192. PMC 4141699 . PMID 24942685.
- ^ Weiss G (enero de 2023). "Las vesículas de macrófagos privan a las bacterias de hierro". Nature Metabolism . 5 (1): 10–12. doi :10.1038/s42255-022-00719-1. PMID 36658401. S2CID 256030791.
- ^ Epelman S, Lavine KJ, Randolph GJ (julio de 2014). "Origen y funciones de los macrófagos tisulares". Inmunidad . 41 (1): 21–35. doi :10.1016/j.immuni.2014.06.013. PMC 4470379 . PMID 25035951.
- ^ Mass E, Lachmann N (septiembre de 2021). "De la biología de los macrófagos a las inmunoterapias celulares basadas en macrófagos". Terapia génica . 28 (9): 473–476. doi :10.1038/s41434-021-00221-5. PMC 8455330 . PMID 33542457.
- ^ Epelman S, Lavine KJ, Randolph GJ (julio de 2014). "Origen y funciones de los macrófagos tisulares". Inmunidad . 41 (1): 21–35. doi :10.1016/j.immuni.2014.06.013. PMC 4470379 . PMID 25035951.
- ^ Italiani P, Boraschi D (agosto de 2015). "Nuevos conocimientos sobre los macrófagos tisulares: desde su origen hasta el desarrollo de la memoria". Immune Network . 15 (4): 167–176. doi :10.4110/in.2015.15.4.167. PMC 4553254 . PMID 26330802.
- ^ Lazarov T, Juarez-Carreño S, Cox N, Geissmann F (junio de 2023). "Fisiología y enfermedades de los macrófagos residentes en los tejidos". Nature . 618 (7966): 698–707. Bibcode :2023Natur.618..698L. doi :10.1038/s41586-023-06002-x. PMC 10649266 . PMID 37344646.
