CD86
| CD86 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | CD86 , B7-2, B7.2, B70, CD28LG2, LAB72, molécula CD86 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 601020; MGI : 101773; HomoloGene : 10443; Tarjetas genéticas : CD86; OMA :CD86 - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
El grupo de diferenciación 86 (también conocido como CD86 y B7-2 ) es una proteína expresada constitutivamente en células dendríticas , células de Langerhans , macrófagos , células B (incluidas las células B de memoria ) y en otras células presentadoras de antígenos . [5] Junto con CD80 , CD86 proporciona señales coestimuladoras necesarias para la activación y supervivencia de las células T. Dependiendo del ligando unido , CD86 puede indicar autorregulación y asociación célula-célula, o atenuación de la regulación y disociación célula-célula. [6]
El gen CD86 codifica una proteína de membrana de tipo I que es miembro de la superfamilia de las inmunoglobulinas . [7] El empalme alternativo da como resultado dos variantes de transcripción que codifican diferentes isoformas . Se han descrito variantes de transcripción adicionales, pero no se han determinado sus secuencias de longitud completa. [8]
Estructura
CD86 pertenece a la familia B7 de la superfamilia de inmunoglobulinas. [9] Es una glicoproteína de 70 kDa compuesta por 329 aminoácidos . Tanto CD80 como CD86 comparten un motivo de aminoácidos conservado que forma su dominio de unión a ligando . [10] CD86 consta de dominios extracelulares similares a Ig (uno variable y uno constante), una región transmembrana y un dominio citoplasmático corto que es más largo que el de CD80. [11] [12] Los ligandos coestimuladores CD80 y CD86 se pueden encontrar en células presentadoras de antígenos profesionales como monocitos , células dendríticas e incluso células B activadas. También se pueden inducir en otros tipos de células, por ejemplo, células T. [13] La expresión de CD86 es más abundante en comparación con CD80, y tras su activación, CD86 aumenta más rápido que CD80. [14]
A nivel de proteína, CD86 comparte un 25% de identidad con CD80 [15] y ambos están codificados en el cromosoma humano 3q13.33q21. [16]
Papel en la coestimulación, activación e inhibición de células T
CD86 y CD80 se unen como ligandos a la molécula coestimuladora CD28 en la superficie de todas las células T vírgenes , [17] y al receptor inhibidor CTLA-4 (antígeno 4 de linfocito T citotóxico, también conocido como CD152). [18] [19] CD28 y CTLA-4 tienen funciones importantes, pero opuestas, en la estimulación de las células T. La unión a CD28 promueve las respuestas de las células T, mientras que la unión a CTLA-4 las inhibe. [20]
La interacción entre CD86 ( CD80 ) expresado en la superficie de una célula presentadora de antígeno con CD28 en la superficie de una célula T madura, ingenua, es necesaria para la activación de la célula T. [21] Para activarse, el linfocito debe interactuar tanto con el antígeno como con el ligando coestimulador en la misma célula presentadora de antígeno. El receptor de células T (TCR) interactúa con moléculas del complejo mayor de histocompatibilidad (MHC) de clase II , [13] y esta señalización debe ir acompañada de señales coestimuladoras, proporcionadas por un ligando coestimulador. Estas señales coestimuladoras son necesarias para prevenir la anergia y son proporcionadas por la interacción entre CD80/CD86 y la molécula coestimuladora CD28. [22] [23]
Esta interacción proteica también es esencial para que los linfocitos T reciban la señal de activación completa, lo que a su vez conduce a la diferenciación y división de células T, la producción de interleucina 2 y la expansión clonal. [9] [22] La interacción entre CD86 y CD28 activa la proteína quinasa activada por mitógeno y el factor de transcripción nf-κB en la célula T. Estas proteínas regulan positivamente la producción de CD40L (utilizada en la activación de células B), IL-21 e IL-21R (utilizadas para la división/proliferación) e IL-2 , entre otras citocinas. [21] La interacción también regula la autotolerancia al apoyar la homeostasis de las células T reguladoras CD4+CD25+ , también conocidas como Tregs. [9]
La CTLA-4 es una molécula coinhibidora que se induce en las células T activadas. La interacción entre la CTLA-4 y CD80/CD86 conduce a la entrega de señales negativas a las células T y a la reducción del número de moléculas coestimulantes en la superficie celular. También puede desencadenar una vía de señalización responsable de la expresión de la enzima IDO (indolamina-2,3-dioxigenasa). Esta enzima puede metabolizar el aminoácido triptófano , que es un componente importante para la proliferación y diferenciación exitosas de los linfocitos T. La IDO reduce la concentración de triptófano en el medio ambiente, suprimiendo así la activación de las células T convencionales, al mismo tiempo que promueve la función de las células T reguladoras. [24] [25]
Tanto el CD80 como el CD86 se unen a CTLA-4 con mayor afinidad que el CD28. Esto permite que el CTLA-4 supere al CD28 en la competencia por la unión CD80/CD86. [23] [26] Entre el CD80 y el CD86, el CD80 parece tener mayor afinidad tanto por CTLA-4 como por CD28 que el CD86. Esto sugiere que el CD80 es un ligando más potente que el CD86, [15] pero los estudios realizados con ratones knock out para CD80 y CD86 han demostrado que el CD86 es más importante en la activación de las células T que el CD80. [27]
Mediación de Treg
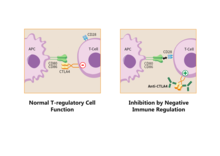
Las vías de la familia B7:CD28 tienen papeles clave en la regulación de la activación y la tolerancia de las células T. Sus señales negativas secundarias son responsables de la regulación negativa de las respuestas celulares. Por todas estas razones, estas vías se consideran objetivos terapéuticos. [9]
Las células T reguladoras producen CTLA-4 . Debido a su interacción con CD80/CD86, las células Treg pueden competir con las células T convencionales y bloquear sus señales coestimuladoras. La expresión de CTLA-4 por parte de las células Treg puede regular negativamente de forma eficaz tanto CD80 como CD86 en las células APC, [28] suprimir la respuesta inmunitaria y provocar un aumento de la anergia . [6] Dado que CTLA-4 se une a CD86 con mayor afinidad que CD28, la coestimulación necesaria para la activación adecuada de las células T también se ve afectada. [29] En un trabajo del grupo Sagurachi se demostró que las células Treg podían regular negativamente CD80 y CD86, pero no CD40 o MHC clase II en las células dendríticas de una forma que dependía de la adhesión. La regulación negativa se bloqueaba con el anticuerpo anti-CTLA-4 y se cancelaba si las células Treg eran deficientes en CTLA-4. [30]
Cuando se une a CTLA-4, el CD86 puede eliminarse de la superficie de una APC y pasar a la célula Treg en un proceso llamado trogocitosis . [6] El bloqueo de este proceso con anticuerpos anti-CTLA-4 es útil para un tipo específico de inmunoterapia contra el cáncer llamada "Terapia del cáncer por inhibición de la regulación inmunitaria negativa". [31] El inmunólogo japonés Tasuku Honjo y el inmunólogo estadounidense James P. Allison ganaron el Premio Nobel de Fisiología o Medicina en 2018 por su trabajo sobre este tema.
Papel en la patología
Se estudian los roles tanto del CD80 como del CD86 en el contexto de muchas patologías. Se examinó la inhibición selectiva de los inhibidores coestimuladores en un modelo de inflamación pulmonar alérgica e hiperreactividad de las vías respiratorias (AHR). [32] Dado que la respuesta inicial del huésped al Staphylococcus aureus , especialmente la respuesta inmunitaria basada en células T, es un factor que contribuye a la patogénesis de la neumonía aguda , se investigó el papel de la vía CD80/CD86 en la patogénesis. [33] Las moléculas coestimuladoras también se investigaron en el contexto del asma bronquial , [34] Treg en el cáncer , [35] e inmunoterapia . [36]
Véase también
- Cúmulo de diferenciación
- CD80
- CD28
- CTLA-4
- Lista de grupos de diferenciación humana para una lista de moléculas de CD
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000114013 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000022901 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ Lenschow DJ, Su GH, Zuckerman LA, Nabavi N, Jellis CL, Gray GS, et al. (diciembre de 1993). "Expresión y significado funcional de un ligando adicional para CTLA-4". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 90 (23): 11054–8. Bibcode :1993PNAS...9011054L. doi : 10.1073/pnas.90.23.11054 . PMC 47920 . PMID 7504292.
- ^ abc Ohue Y, Nishikawa H (julio de 2019). "Células T reguladoras (Treg) en el cáncer: ¿pueden las células Treg ser un nuevo objetivo terapéutico?". Cancer Science . 110 (7): 2080–2089. doi :10.1111/cas.14069. PMC 6609813 . PMID 31102428.
- ^ Chen C, Gault A, Shen L, Nabavi N (mayo de 1994). "Clonación molecular y expresión de la molécula-1 coestimuladora de células T tempranas y su caracterización como molécula B7-2". Journal of Immunology . 152 (10): 4929–36. doi : 10.4049/jimmunol.152.10.4929 . PMID 7513726. S2CID 22260156.
- ^ "Gen Entrez: molécula CD86 CD86".
- ^ abcd Greenwald RJ, Freeman GJ, Sharpe AH (2005). "Revisitando la familia B7". Revisión anual de inmunología . 23 : 515–48. doi :10.1146/annurev.immunol.23.021704.115611. PMID 15771580.
- ^ Yu C, Sonnen AF, George R, Dessailly BH, Stagg LJ, Evans EJ, et al. (febrero de 2011). "El reconocimiento del ligando de cuerpo rígido impulsa la activación del receptor del antígeno 4 del linfocito T citotóxico (CTLA-4)". The Journal of Biological Chemistry . 286 (8): 6685–96. doi : 10.1074/jbc.M110.182394 . PMC 3057841 . PMID 21156796.
- ^ Freeman GJ, Borriello F, Hodes RJ, Reiser H, Hathcock KS, Laszlo G, et al. (noviembre de 1993). "Descubrimiento de un contrarreceptor CTLA-4 alternativo funcional en ratones deficientes en B7". Science . 262 (5135): 907–9. Bibcode :1993Sci...262..907F. doi :10.1126/science.7694362. PMID 7694362.
- ^ Sharpe AH, Freeman GJ (febrero de 2002). "La superfamilia B7-CD28". Nature Reviews. Inmunología . 2 (2): 116–26. doi :10.1038/nri727. PMID 11910893. S2CID 205492817.
- ^ de Murphy K, Weaver C, Janeway C (2017). Inmunobiología de Janeway (novena edición). Nueva York. ISBN 978-0-8153-4505-3.OCLC 933586700 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Sansom DM (octubre de 2000). "CD28, CTLA-4 y sus ligandos: ¿quién hace qué y a quién?". Inmunología . 101 (2): 169–77. doi :10.1046/j.1365-2567.2000.00121.x. PMC 2327073 . PMID 11012769.
- ^ ab Collins AV, Brodie DW, Gilbert RJ, Iaboni A, Manso-Sancho R, Walse B, et al. (agosto de 2002). "Revisión de las propiedades de interacción de las moléculas coestimulantes". Inmunidad . 17 (2): 201–10. doi : 10.1016/s1074-7613(02)00362-x . PMID 12196291.
- ^ Mir MA (25 de mayo de 2015). Desarrollo de moléculas coestimulantes para la inmunoterapia de enfermedades . Londres. ISBN 978-0-12-802675-5.OCLC 910324332 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Linsley PS, Brady W, Grosmaire L, Aruffo A, Damle NK, Ledbetter JA (marzo de 1991). "La unión del antígeno de activación de células B B7 a CD28 coestimula la proliferación de células T y la acumulación de ARNm de interleucina 2". The Journal of Experimental Medicine . 173 (3): 721–30. doi :10.1084/jem.173.3.721. PMC 2118836 . PMID 1847722.
- ^ Lim TS, Goh JK, Mortellaro A, Lim CT, Hämmerling GJ, Ricciardi-Castagnoli P (2012). "CD80 y CD86 regulan de manera diferencial las interacciones mecánicas de las células T con las células dendríticas presentadoras de antígenos y las células B". PLOS ONE . 7 (9): e45185. Bibcode :2012PLoSO...745185L. doi : 10.1371/journal.pone.0045185 . PMC 3443229 . PMID 23024807.
- ^ Linsley PS, Brady W, Urnes M, Grosmaire LS, Damle NK, Ledbetter JA (septiembre de 1991). "CTLA-4 es un segundo receptor para el antígeno de activación de células B B7". The Journal of Experimental Medicine . 174 (3): 561–9. doi :10.1084/jem.174.3.561. PMC 2118936 . PMID 1714933.
- ^ Sansom DM, Manzotti CN, Zheng Y (junio de 2003). "¿Cuál es la diferencia entre CD80 y CD86?". Tendencias en inmunología . 24 (6): 314–9. doi :10.1016/s1471-4906(03)00111-x. PMID 12810107.
- ^ ab Dyck L, Mills KH (mayo de 2017). "Puntos de control inmunitario y su inhibición en el cáncer y las enfermedades infecciosas". Revista Europea de Inmunología . 47 (5): 765–779. doi : 10.1002/eji.201646875 . PMID 28393361.
- ^ ab Coyle AJ, Gutierrez-Ramos JC (marzo de 2001). "La superfamilia B7 en expansión: creciente complejidad en las señales coestimulantes que regulan la función de las células T". Nature Immunology . 2 (3): 203–9. doi :10.1038/85251. PMID 11224518. S2CID 20542148.
- ^ ab Gause WC, Urban JF, Linsley P, Lu P (1995). "El papel de la señalización B7 en la diferenciación de células T CD4+ ingenuas a células T auxiliares productoras de interleucina-4 efectoras". Investigación inmunológica . 14 (3): 176–88. doi : 10.1007/BF02918215 . PMID 8778208. S2CID 20098311.
- ^ Chen L, Flies DB (abril de 2013). "Mecanismos moleculares de coestimulación y co-inhibición de células T". Nature Reviews. Inmunología . 13 (4): 227–42. doi :10.1038/nri3405. PMC 3786574 . PMID 23470321.
- ^ Munn DH, Sharma MD, Mellor AL (abril de 2004). "La ligación de B7-1/B7-2 por parte de las células T CD4+ humanas desencadena la actividad de la indolamina 2,3-dioxigenasa en las células dendríticas". Journal of Immunology . 172 (7): 4100–10. doi : 10.4049/jimmunol.172.7.4100 . PMID 15034022.
- ^ Walker LS, Sansom DM (noviembre de 2011). "El papel emergente de CTLA4 como regulador extrínseco celular de las respuestas de las células T". Nature Reviews. Inmunología . 11 (12): 852–63. doi :10.1038/nri3108. PMID 22116087. S2CID 9617595.
- ^ Borriello F, Sethna MP, Boyd SD, Schweitzer AN, Tivol EA, Jacoby D, et al. (marzo de 1997). "B7-1 y B7-2 tienen funciones superpuestas y críticas en el cambio de clase de inmunoglobulina y la formación del centro germinal". Inmunidad . 6 (3): 303–13. doi : 10.1016/s1074-7613(00)80333-7 . PMID 9075931.
- ^ Walker LS, Sansom DM (febrero de 2015). "Señales confusas: progreso reciente en la biología de CTLA-4". Tendencias en inmunología . 36 (2): 63–70. doi :10.1016/j.it.2014.12.001. PMC 4323153 . PMID 25582039.
- ^ Lightman SM, Utley A, Lee KP (3 de mayo de 2019). "Supervivencia de células plasmáticas de larga vida (LLPC): armando el rompecabezas". Frontiers in Immunology . 10 : 965. doi : 10.3389/fimmu.2019.00965 . PMC 6510054 . PMID 31130955.
- ^ Onishi Y, Fehervari Z, Yamaguchi T, Sakaguchi S (julio de 2008). "Las células T reguladoras naturales Foxp3+ forman preferentemente agregados en células dendríticas in vitro e inhiben activamente su maduración". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (29): 10113–8. Bibcode :2008PNAS..10510113O. doi : 10.1073/pnas.0711106105 . PMC 2481354 . PMID 18635688.
- ^ Chen R, Ganesan A, Okoye I, Arutyunova E, Elahi S, Lemieux MJ, et al. (marzo de 2020). "Dirigir la B7-1 en inmunoterapia". Medicinal Research Reviews . 40 (2): 654–682. doi :10.1002/med.21632. PMID 31448437. S2CID 201748060.
- ^ Mark DA, Donovan CE, De Sanctis GT, Krinzman SJ, Kobzik L, Linsley PS, et al. (noviembre de 1998). "Las moléculas coestimulantes CD80 y CD86 regulan la inflamación pulmonar alérgica". Inmunología internacional . 10 (11): 1647–55. doi : 10.1093/intimm/10.11.1647 . PMID 9846693.
- ^ Parker D (julio de 2018). "La señalización CD80/CD86 contribuye a la respuesta proinflamatoria de Staphylococcus aureus en las vías respiratorias". Cytokine . 107 : 130–136. doi :10.1016/j.cyto.2018.01.016. PMC 5916031 . PMID 29402722.
- ^ Chen YQ, Shi HZ (enero de 2006). "Vía coestimulante CD28/CTLA-4--CD80/CD86 e ICOS--B7RP-1 en el asma bronquial". Allergy . 61 (1): 15–26. doi :10.1111/j.1398-9995.2006.01008.x. PMID 16364152. S2CID 23564785.
- ^ Ohue Y, Nishikawa H (julio de 2019). "Células T reguladoras (Treg) en el cáncer: ¿pueden las células Treg ser un nuevo objetivo terapéutico?". Cancer Science . 110 (7): 2080–2089. doi :10.1111/cas.14069. PMC 6609813 . PMID 31102428.
- ^ Bourque J, Hawiger D (2018). "Enlaces inmunomoduladores de la asociación entre células dendríticas y células T". Critical Reviews in Immunology . 38 (5): 379–401. doi :10.1615/CritRevImmunol.2018026790. PMC 6380512 . PMID 30792568.
Enlaces externos
- Página de detalles del gen CD86 y ubicación del genoma humano CD86 en el navegador de genoma de la UCSC .
Lectura adicional
- Davila S, Froeling FE, Tan A, Bonnard C, Boland GJ, Snippe H, et al. (abril de 2010). "Nuevas asociaciones genéticas detectadas en un estudio de respuesta del huésped a la vacuna contra la hepatitis B". Genes e inmunidad . 11 (3): 232–8. doi : 10.1038/gene.2010.1 . PMID 20237496.
- Csillag A, Boldogh I, Pazmandi K, Magyarics Z, Gogolak P, Sur S, et al. (marzo de 2010). "El estrés oxidativo inducido por polen influye en las respuestas inmunitarias innatas y adaptativas a través de la alteración de las funciones de las células dendríticas". Journal of Immunology . 184 (5): 2377–85. doi :10.4049/jimmunol.0803938. PMC 3028537 . PMID 20118277.
- Bossé Y, Lemire M, Poon AH, Daley D, He JQ, Sandford A, et al. (octubre de 2009). "Asma y genes que codifican componentes de la vía de la vitamina D". Investigación respiratoria . 10 (1): 98. doi : 10.1186/1465-9921-10-98 . PMC 2779188 . PMID 19852851.
- Mosbruger TL, Duggal P, Goedert JJ, Kirk GD, Hoots WK, Tobler LH, et al. (mayo de 2010). "Análisis de genes candidatos a gran escala de la eliminación espontánea del virus de la hepatitis C". The Journal of Infectious Diseases . 201 (9): 1371–80. doi :10.1086/651606. PMC 2853721 . PMID 20331378.
- Bugeon L, Dallman MJ (octubre de 2000). "Coestimulación de células T". Revista estadounidense de medicina respiratoria y de cuidados críticos . 162 (4 puntos 2): S164-8. doi :10.1164/ajrccm.162.supplement_3.15tac5. PMID 11029388.
- Pan XM, Gao LB, Liang WB, Liu Y, Zhu Y, Tang M, et al. (julio de 2010). "Polimorfismo CD86 +1057 G/A y riesgo de cáncer colorrectal". ADN y biología celular . 29 (7): 381–6. doi :10.1089/dna.2009.1003. PMID 20380573.
- Dalla-Costa R, Pincerati MR, Beltrame MH, Malheiros D, Petzl-Erler ML (agosto de 2010). "Los polimorfismos en las regiones cromosómicas 2q33 y 3q21, incluidos los genes de ligando y correceptor de células T, pueden influir en la susceptibilidad al pénfigo foliáceo". Inmunología humana . 71 (8): 809–17. doi :10.1016/j.humimm.2010.04.001. PMID 20433886.
- Talmud PJ, Drenos F, Shah S, Shah T, Palmen J, Verzilli C, et al. (noviembre de 2009). "Señales de asociación centradas en genes para lípidos y apolipoproteínas identificadas a través del HumanCVD BeadChip". American Journal of Human Genetics . 85 (5): 628–42. doi :10.1016/j.ajhg.2009.10.014. PMC 2775832 . PMID 19913121.
- Carreño LJ, Pacheco R, Gutierrez MA, Jacobelli S, Kalergis AM (noviembre de 2009). "La actividad de la enfermedad en el lupus eritematoso sistémico se asocia con una expresión alterada de receptores gamma Fc de baja afinidad y moléculas coestimulantes en células dendríticas". Inmunología . 128 (3): 334–41. doi :10.1111/j.1365-2567.2009.03138.x. PMC 2770681 . PMID 20067533.
- Koyasu S (abril de 2003). "El papel de PI3K en las células inmunitarias". Nature Immunology . 4 (4): 313–9. doi :10.1038/ni0403-313. PMID 12660731. S2CID 9951653.
- Kim SH, Lee JE, Kim SH, Jee YK, Kim YK, Park HS, et al. (diciembre de 2009). "Las variantes alélicas de los genes CD40 y CD40L interactúan para promover reacciones alérgicas cutáneas inducidas por antibióticos". Alergia clínica y experimental . 39 (12): 1852–6. doi :10.1111/j.1365-2222.2009.03336.x. PMID 19735272. S2CID 26024387.
- Liu Y, Liang WB, Gao LB, Pan XM, Chen TY, Wang YY, et al. (noviembre de 2010). "Polimorfismos de los genes CTLA4 y CD86 y susceptibilidad a la enfermedad pulmonar obstructiva crónica". Inmunología humana . 71 (11): 1141–6. doi :10.1016/j.humimm.2010.08.007. PMID 20732370.
- Ma XN, Wang X, Yan YY, Yang L, Zhang DL, Sheng X, et al. (junio de 2010). "Ausencia de asociación entre el polimorfismo CD86 +1057G/A y la enfermedad de la arteria coronaria". ADN y biología celular . 29 (6): 325–8. doi :10.1089/dna.2009.0987. PMID 20230296.
- Ishizaki Y, Yukaya N, Kusuhara K, Kira R, Torisu H, Ihara K, et al. (Abril de 2010). "PD1 como gen de susceptibilidad candidato común a la panencefalitis esclerosante subaguda". Genética Humana . 127 (4): 411–9. doi :10.1007/s00439-009-0781-z. PMID 20066438. S2CID 12633836.
- Chang TT, Kuchroo VK, Sharpe AH (2002). "Papel de la vía B7-CD28/CTLA-4 en las enfermedades autoinmunes". Direcciones actuales en autoinmunidad . 5 : 113–30. doi :10.1159/000060550. ISBN 3-8055-7308-1. Número de identificación personal 11826754.
- Grujic M, Bartholdy C, Remy M, Pinschewer DD, Christensen JP, Thomsen AR (agosto de 2010). "El papel de CD80/CD86 en la generación y el mantenimiento de células T CD8+ funcionales específicas del virus en ratones infectados con el virus de la coriomeningitis linfocítica". Journal of Immunology . 185 (3): 1730–43. doi : 10.4049/jimmunol.0903894 . PMID 20601595.
- Quaranta MG, Mattioli B, Giordani L, Viora M (noviembre de 2006). "Los efectos inmunorreguladores de la proteína Nef del VIH-1 en las células dendríticas y la patogénesis del SIDA". FASEB Journal . 20 (13): 2198–208. doi : 10.1096/fj.06-6260rev . PMID 17077296. S2CID 3111709.
- Schuurhof A, Bont L, Siezen CL, Hodemaekers H, van Houwelingen HC, Kimman TG, et al. (junio de 2010). "Polimorfismo de la interleucina-9 en lactantes con infección por el virus respiratorio sincitial: un efecto opuesto en niños y niñas". Pediatric Pulmonology . 45 (6): 608–13. doi :10.1002/ppul.21229. PMID 20503287. S2CID 24678182.
- Bailey SD, Xie C, Do R, Montpetit A, Diaz R, Mohan V, et al. (octubre de 2010). "La variación en el locus NFATC2 aumenta el riesgo de edema inducido por tiazolidinediona en el estudio de evaluación de la reducción de la diabetes con medicación de ramipril y rosiglitazona (DREAM)". Diabetes Care . 33 (10): 2250–3. doi :10.2337/dc10-0452. PMC 2945168 . PMID 20628086.
- Radziewicz H, Ibegbu CC, Hon H, Bédard N, Bruneau J, Workowski KA, et al. (marzo de 2010). "La expresión transitoria de CD86 en las células T CD8+ específicas del virus de la hepatitis C en la infección aguda está vinculada a una señalización suficiente de IL-2". Journal of Immunology . 184 (5): 2410–22. doi :10.4049/jimmunol.0902994. PMC 2924663 . PMID 20100932.
Este artículo incorpora texto de la Biblioteca Nacional de Medicina de los Estados Unidos , que se encuentra en el dominio público .