Neurotransmisor
Un neurotransmisor es una molécula de señalización secretada por una neurona para afectar a otra célula a través de una sinapsis . La célula que recibe la señal, o célula diana, puede ser otra neurona, pero también podría ser una glándula o una célula muscular . [1]
Los neurotransmisores se liberan desde las vesículas sinápticas hacia la hendidura sináptica , donde pueden interactuar con los receptores de neurotransmisores en la célula diana. El efecto del neurotransmisor en la célula diana está determinado por el receptor al que se une. Muchos neurotransmisores se sintetizan a partir de precursores simples y abundantes, como los aminoácidos , que están fácilmente disponibles y a menudo requieren una pequeña cantidad de pasos biosintéticos para su conversión.
Los neurotransmisores son esenciales para el funcionamiento de los sistemas neuronales complejos. Se desconoce el número exacto de neurotransmisores únicos en los seres humanos, pero se han identificado más de 100. [2] Los neurotransmisores comunes incluyen glutamato , GABA , acetilcolina , glicina y norepinefrina .
Mecanismo y ciclo
Síntesis
Los neurotransmisores se sintetizan generalmente en las neuronas y están formados por, o se derivan de, moléculas precursoras que se encuentran en abundancia en la célula. Las clases de neurotransmisores incluyen aminoácidos , monoaminas y péptidos . Las monoaminas se sintetizan alterando un solo aminoácido. Por ejemplo, el precursor de la serotonina es el aminoácido triptófano. Los transmisores peptídicos, o neuropéptidos, son transmisores proteicos que a menudo se liberan junto con otros transmisores para tener un efecto modulador. [3] Los neurotransmisores de purina, como el ATP, se derivan de ácidos nucleicos. Otros neurotransmisores están formados por productos metabólicos como el óxido nítrico y el monóxido de carbono . [ cita requerida ]
| Ejemplos | |
|---|---|
| Aminoácidos | glicina , glutamato |
| Monoaminas | serotonina , epinefrina , dopamina |
| Péptidos | sustancia P , opioides |
| Purinas | ATP , GTP |
| Otro | óxido nítrico , monóxido de carbono |
Almacenamiento

Los neurotransmisores se almacenan generalmente en vesículas sinápticas , agrupadas cerca de la membrana celular en la terminal axónica de la neurona presináptica. Sin embargo, algunos neurotransmisores, como los gases metabólicos monóxido de carbono y óxido nítrico, se sintetizan y liberan inmediatamente después de un potencial de acción sin almacenarse nunca en vesículas. [4]
Liberar
En general, un neurotransmisor se libera en la terminal presináptica en respuesta a una señal eléctrica llamada potencial de acción en la neurona presináptica. Sin embargo, también se produce una liberación "básica" de bajo nivel sin estimulación eléctrica. Los neurotransmisores se liberan en la hendidura sináptica y se difunden a través de ella , donde se unen a receptores específicos en la membrana de la neurona postsináptica. [5]
Interacción del receptor
Después de ser liberados en la hendidura sináptica, los neurotransmisores se difunden a través de la sinapsis, donde pueden interactuar con los receptores de la célula diana. El efecto del neurotransmisor depende de la identidad de los receptores de la célula diana presentes en la sinapsis. Dependiendo del receptor, la unión de los neurotransmisores puede causar excitación , inhibición o modulación de la neurona postsináptica. Consulte a continuación para obtener más información. [ cita requerida ]
Eliminación
Para evitar la activación continua de los receptores en la célula postsináptica o diana, los neurotransmisores deben eliminarse de la hendidura sináptica. [6] Los neurotransmisores se eliminan a través de uno de tres mecanismos:
- Difusión: los neurotransmisores salen de la hendidura sináptica, donde son absorbidos por las células gliales . Estas células gliales, generalmente astrocitos , absorben el exceso de neurotransmisores.
- Los astrocitos, un tipo de célula glial del cerebro, contribuyen activamente a la comunicación sináptica a través de la difusión astrocítica o gliotransmisión . La actividad neuronal desencadena un aumento de los niveles de calcio astrocítico, lo que provoca la liberación de gliotransmisores, como el glutamato , el ATP y la D-serina. Estos gliotransmisores se difunden en el espacio extracelular , interactúan con las neuronas cercanas e influyen en la transmisión sináptica. Al regular los niveles de neurotransmisores extracelulares, los astrocitos ayudan a mantener una función sináptica adecuada. Esta comunicación bidireccional entre astrocitos y neuronas añade complejidad a la señalización cerebral, con implicaciones para la función cerebral y los trastornos neurológicos. [7] [8]
- Degradación enzimática: las proteínas llamadas enzimas descomponen los neurotransmisores.
- Recaptación : los neurotransmisores se reabsorben en la neurona presináptica. Los transportadores, o proteínas de transporte de membrana , bombean los neurotransmisores desde la hendidura sináptica hacia las terminales axónicas (la neurona presináptica), donde se almacenan para su reutilización.
Por ejemplo, la acetilcolina se elimina al escindir su grupo acetilo la enzima acetilcolinesterasa ; la colina restante es absorbida y reciclada por la neurona presináptica para sintetizar más acetilcolina . [9] Otros neurotransmisores pueden difundirse fuera de sus uniones sinápticas objetivo y se eliminan del cuerpo a través de los riñones o se destruyen en el hígado. Cada neurotransmisor tiene vías de degradación muy específicas en puntos reguladores, que pueden ser el objetivo del sistema regulador del cuerpo o de la medicación. La cocaína bloquea un transportador de dopamina responsable de la recaptación de dopamina. Sin el transportador, la dopamina se difunde mucho más lentamente desde la hendidura sináptica y continúa activando los receptores de dopamina en la célula objetivo. [10]
Descubrimiento
Hasta principios del siglo XX, los científicos asumían que la mayoría de la comunicación sináptica en el cerebro era eléctrica. Sin embargo, a través de exámenes histológicos de Ramón y Cajal , se descubrió una brecha de 20 a 40 nm entre neuronas, conocida hoy como hendidura sináptica . La presencia de tal brecha sugería comunicación a través de mensajeros químicos que atravesaban la hendidura sináptica, y en 1921 el farmacólogo alemán Otto Loewi confirmó que las neuronas pueden comunicarse liberando sustancias químicas. A través de una serie de experimentos que involucraban los nervios vagos de las ranas, Loewi pudo reducir manualmente la frecuencia cardíaca de las ranas controlando la cantidad de solución salina presente alrededor del nervio vago. Al completar este experimento, Loewi afirmó que la regulación simpática de la función cardíaca puede mediarse a través de cambios en las concentraciones químicas. Además, a Otto Loewi se le atribuye el descubrimiento de la acetilcolina (ACh), el primer neurotransmisor conocido. [11]
Identificación
Para identificar neurotransmisores, normalmente se consideran los siguientes criterios:
- Síntesis: La sustancia química debe producirse dentro de la neurona o estar presente en ella como molécula precursora.
- Liberación y respuesta: Cuando se activa la neurona, la sustancia química debe liberarse y provocar una respuesta en las células o neuronas objetivo.
- Respuesta experimental: La aplicación de la sustancia química directamente a las células objetivo debería producir la misma respuesta observada cuando la sustancia química se libera naturalmente desde las neuronas.
- Mecanismo de eliminación: Debe existir un mecanismo para eliminar el neurotransmisor de su sitio de acción una vez que su función de señalización haya finalizado. [12]
Sin embargo, dados los avances en farmacología , genética y neuroanatomía química , el término "neurotransmisor" puede aplicarse a sustancias químicas que:
- Transportar mensajes entre neuronas a través de la influencia sobre la membrana postsináptica.
- Tienen poco o ningún efecto sobre el voltaje de la membrana, pero tienen una función de transporte común, como cambiar la estructura de la sinapsis.
- Comunicarse enviando mensajes en dirección inversa que afectan la liberación o recaptación de transmisores.
La localización anatómica de los neurotransmisores se determina típicamente utilizando técnicas inmunocitoquímicas , que identifican la ubicación de las propias sustancias transmisoras o de las enzimas que participan en su síntesis. Las técnicas inmunocitoquímicas también han revelado que muchos transmisores, en particular los neuropéptidos , están co-localizados, es decir, una neurona puede liberar más de un transmisor desde su terminal sináptica . [13] Se pueden utilizar varias técnicas y experimentos, como la tinción , la estimulación y la recolección, para identificar neurotransmisores en todo el sistema nervioso central . [14]
Comportamiento
Las neuronas se comunican entre sí a través de sinapsis , puntos de contacto especializados donde los neurotransmisores transmiten señales. Cuando un potencial de acción alcanza la terminal presináptica , el potencial de acción puede desencadenar la liberación de neurotransmisores en la hendidura sináptica. Estos neurotransmisores luego se unen a los receptores en la membrana postsináptica, influyendo en la neurona receptora de manera inhibitoria o excitatoria . Si las influencias excitatorias generales superan a las influencias inhibitorias, la neurona receptora puede generar su propio potencial de acción, continuando la transmisión de información a la siguiente neurona en la red. Este proceso permite el flujo de información y la formación de redes neuronales complejas. [15]
Modulación
Un neurotransmisor puede tener un efecto excitador, inhibidor o modulador sobre la célula diana. El efecto está determinado por los receptores con los que interactúa el neurotransmisor en la membrana postsináptica. El neurotransmisor influye en el flujo de iones transmembrana ya sea para aumentar (excitador) o para disminuir (inhibidor) la probabilidad de que la célula con la que entra en contacto produzca un potencial de acción. Las sinapsis que contienen receptores con efectos excitadores se denominan sinapsis de tipo I, mientras que las de tipo II contienen receptores con efectos inhibidores. [16] Por lo tanto, a pesar de la amplia variedad de sinapsis, todas transmiten mensajes de solo estos dos tipos. Los dos tipos tienen un aspecto diferente y se ubican principalmente en diferentes partes de las neuronas bajo su influencia. [17] Los receptores con efectos moduladores se distribuyen por todas las membranas sinápticas y la unión de los neurotransmisores pone en marcha cascadas de señalización que ayudan a la célula a regular su función. [18] La unión de neurotransmisores a receptores con efectos moduladores puede tener muchos resultados. Por ejemplo, puede producir un aumento o una disminución de la sensibilidad a futuros estímulos mediante el reclutamiento de más o menos receptores en la membrana sináptica.
Las sinapsis de tipo I (excitatorias) suelen estar situadas en los ejes o las espinas de las dendritas, mientras que las de tipo II (inhibitorias) suelen estar situadas en el cuerpo celular. Además, las sinapsis de tipo I tienen vesículas sinápticas redondas, mientras que las de tipo II son aplanadas. El material de las membranas presinápticas y postsinápticas es más denso en una sinapsis de tipo I que en una de tipo II, y la hendidura sináptica de tipo I es más ancha. Por último, la zona activa de una sinapsis de tipo I es más grande que la de una sinapsis de tipo II.
Las diferentes ubicaciones de las sinapsis de tipo I y tipo II dividen a una neurona en dos zonas: un árbol dendrítico excitador y un cuerpo celular inhibidor. Desde una perspectiva inhibidora, la excitación llega a través de las dendritas y se propaga al cono axónico para desencadenar un potencial de acción . Si se debe detener el mensaje, la mejor manera de hacerlo es aplicar inhibición en el cuerpo celular, cerca del cono axónico donde se origina el potencial de acción. Otra forma de conceptualizar la interacción excitadora-inhibidora es imaginar la excitación superando la inhibición. Si el cuerpo celular está normalmente en un estado inhibido, la única forma de generar un potencial de acción en el cono axónico es reducir la inhibición del cuerpo celular. En esta estrategia de "abrir las puertas", el mensaje excitador es como un caballo de carreras listo para correr por la pista, pero primero, se debe quitar la puerta de salida inhibidora. [19]
Acciones de los neurotransmisores
Como se explicó anteriormente, la única acción directa de un neurotransmisor es activar un receptor. Por lo tanto, los efectos de un sistema de neurotransmisores dependen de las conexiones de las neuronas que utilizan el transmisor y de las propiedades químicas de los receptores.
- El glutamato se utiliza en la gran mayoría de las sinapsis excitatorias rápidas en el cerebro y la médula espinal. También se utiliza en la mayoría de las sinapsis que son "modificables", es decir, capaces de aumentar o disminuir su fuerza. Se cree que las sinapsis modificables son los principales elementos de almacenamiento de memoria en el cerebro. La liberación excesiva de glutamato puede sobreestimular el cerebro y provocar excitotoxicidad que causa muerte celular y da lugar a convulsiones o accidentes cerebrovasculares. [20] La excitotoxicidad se ha relacionado con ciertas enfermedades crónicas, como el accidente cerebrovascular isquémico , la epilepsia , la esclerosis lateral amiotrófica , la enfermedad de Alzheimer , la enfermedad de Huntington y la enfermedad de Parkinson . [21]
- El GABA se utiliza en la gran mayoría de las sinapsis inhibitorias rápidas en prácticamente todas las partes del cerebro. Muchos fármacos sedantes/tranquilizantes actúan potenciando los efectos del GABA. [22] En consecuencia, la glicina es el transmisor inhibidor en la médula espinal .
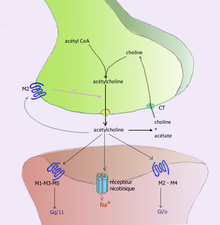
- La acetilcolina fue el primer neurotransmisor descubierto en los sistemas nerviosos periférico y central. Activa los músculos esqueléticos en el sistema nervioso somático y puede excitar o inhibir los órganos internos en el sistema autónomo. [14] Se distingue por ser el transmisor en la unión neuromuscular que conecta los nervios motores con los músculos. El curare , veneno paralizante para las flechas, actúa bloqueando la transmisión en estas sinapsis. La acetilcolina también actúa en muchas regiones del cerebro, pero utilizando diferentes tipos de receptores , incluidos los receptores nicotínicos y muscarínicos . [23]
- La dopamina tiene varias funciones importantes en el cerebro, entre ellas la regulación del comportamiento motor, los placeres relacionados con la motivación y también la excitación emocional. Desempeña un papel fundamental en el sistema de recompensa ; la enfermedad de Parkinson se ha relacionado con niveles bajos de dopamina y la esquizofrenia con niveles altos de dopamina. [24]
- La serotonina es un neurotransmisor monoamínico . La mayor parte se produce y se encuentra en el intestino (aproximadamente el 90 %), y el resto en las neuronas del sistema nervioso central . Su función es regular el apetito, el sueño, la memoria y el aprendizaje, la temperatura, el estado de ánimo, el comportamiento, la contracción muscular y la función del sistema cardiovascular y el sistema endocrino . Se especula que tiene un papel en la depresión, ya que se ha observado que algunos pacientes deprimidos tienen concentraciones más bajas de metabolitos de serotonina en el líquido cefalorraquídeo y el tejido cerebral. [25]
- La noradrenalina es un neurotransmisor que pertenece a la clasificación de las catecolaminas . Se sintetiza a partir del aminoácido tirosina . En el sistema nervioso periférico , una de las funciones principales de la noradrenalina es estimular la liberación de la hormona del estrés epinefrina (es decir, adrenalina ) de las glándulas suprarrenales . [26]
- La epinefrina , un neurotransmisor y hormona , se sintetiza a partir de la tirosina . Se libera desde las glándulas suprarrenales y desempeña un papel en la respuesta de lucha o huida . La epinefrina tiene efectos vasoconstrictores , que promueven el aumento de la frecuencia cardíaca, la presión arterial y la movilización de energía. La vasoconstricción influye en el metabolismo al promover la descomposición de la glucosa liberada en el torrente sanguíneo. La epinefrina también tiene efectos broncodilatadores , que es la relajación de las vías respiratorias. [26]
Tipos
Existen muchas formas diferentes de clasificar los neurotransmisores. Dividirlos en aminoácidos , péptidos y monoaminas es suficiente para algunos propósitos de clasificación. [27]
Principales neurotransmisores:
- Aminoácidos : glutamato , [28] aspartato , D-serina , ácido gamma-aminobutírico (GABA), [nb 1] glicina
- Gasotransmisores : óxido nítrico (NO), monóxido de carbono (CO), sulfuro de hidrógeno ( H2S )
- Monoaminas :
- Catecolaminas : dopamina (DA), noradrenalina (NE), epinefrina (adrenalina)
- Indolaminas : serotonina (5-HT, SER), melatonina
- histamina
- Aminas traza : fenetilamina , N -metilfenetilamina , tiramina , 3-yodotironamina , octopamina , triptamina , etc.
- Péptidos : oxitocina , somatostatina , sustancia P , transcripción regulada por cocaína y anfetamina , péptidos opioides [29]
- Purinas : trifosfato de adenosina (ATP), adenosina
- Otros: acetilcolina (ACh), anandamida , etc.
Además, se han descubierto más de 100 péptidos neuroactivos y se descubren nuevos con regularidad. [30] [31] Muchos de ellos se liberan junto con un transmisor de molécula pequeña. Sin embargo, en algunos casos, un péptido es el transmisor primario en una sinapsis. La beta-endorfina es un ejemplo relativamente conocido de un neurotransmisor peptídico porque participa en interacciones altamente específicas con los receptores opioides en el sistema nervioso central .
Algunos neurotransmisores también consideran a los iones individuales (como el zinc liberado sinápticamente) [32], así como algunas moléculas gaseosas como el óxido nítrico (NO), el monóxido de carbono (CO) y el sulfuro de hidrógeno (H 2 S). [33] Los gases se producen en el citoplasma neuronal y se difunden inmediatamente a través de la membrana celular hacia el líquido extracelular y hacia las células cercanas para estimular la producción de segundos mensajeros. Los neurotransmisores de gas soluble son difíciles de estudiar, ya que actúan rápidamente y se descomponen inmediatamente, existiendo solo durante unos segundos.
El transmisor más frecuente es el glutamato , que es excitatorio en más del 90% de las sinapsis del cerebro humano. [28] El siguiente más frecuente es el ácido gamma-aminobutírico, o GABA, que es inhibidor en más del 90% de las sinapsis que no utilizan glutamato. Aunque otros transmisores se utilizan en menos sinapsis, pueden ser muy importantes funcionalmente: la gran mayoría de las drogas psicoactivas ejercen sus efectos alterando las acciones de algunos sistemas de neurotransmisores, a menudo actuando a través de transmisores distintos del glutamato o el GABA. Las drogas adictivas como la cocaína y las anfetaminas ejercen sus efectos principalmente en el sistema de la dopamina. Las drogas opiáceas adictivas ejercen sus efectos principalmente como análogos funcionales de los péptidos opioides , que, a su vez, regulan los niveles de dopamina.
Lista de neurotransmisores, péptidos y moléculas de señalización gaseosa
Esta lista está incompleta , puedes ayudar agregando los elementos que faltan. ( Enero 2017 ) |
Sistemas de neurotransmisores
Las neuronas que expresan ciertos tipos de neurotransmisores a veces forman sistemas distintos, donde la activación del sistema afecta grandes volúmenes del cerebro, llamado transmisión de volumen . Los principales sistemas de neurotransmisores incluyen el sistema de noradrenalina (norepinefrina), el sistema de dopamina , el sistema de serotonina y el sistema colinérgico , entre otros. Las aminas traza tienen un efecto modulador sobre la neurotransmisión en las vías de monoamina (es decir, las vías de dopamina, norepinefrina y serotonina) en todo el cerebro a través de la señalización a través del receptor 1 asociado a aminas traza . [37] [38] A continuación, se presenta una breve comparación de estos sistemas:
| Sistema | Origen y proyecciones de la vía | Procesos y conductas cognitivas reguladas |
|---|---|---|
| Sistema de noradrenalina [39] [40] [41] [42] [43] [44] | Vías noradrenérgicas :
|
|
| Sistema dopaminérgico [41] [42] [43] [45] [46] [47] | Vías dopaminérgicas :
|
|
| Sistema de histamina [42] [43] [48] | Vías histaminérgicas :
|
|
| Sistema serotoninérgico [39] [41] [42] [43] [49] [50] [51] | Vías serotoninérgicas : Núcleos caudales (CN):
Núcleos rostrales (RN):
|
|
| Sistema de acetilcolina [39] [41] [42] [43] [52] | Vías colinérgicas : Núcleos colinérgicos del prosencéfalo (FCN):
Neuronas colinérgicas tónicamente activas del estriado (TAN)
Núcleos colinérgicos del tronco encefálico (BCN):
|
|
| Sistema de adrenalina [53] [54] | Vías adrenérgicas :
|
Efectos de las drogas
La comprensión de los efectos de los fármacos sobre los neurotransmisores constituye una parte importante de las iniciativas de investigación en el campo de la neurociencia . La mayoría de los neurocientíficos involucrados en este campo de investigación creen que tales esfuerzos pueden hacer avanzar aún más nuestra comprensión de los circuitos responsables de diversas enfermedades y trastornos neurológicos, así como las formas de tratar eficazmente y, algún día, posiblemente prevenir o curar dichas enfermedades. [55] [ cita médica requerida ]
Los fármacos pueden influir en el comportamiento alterando la actividad de los neurotransmisores. Por ejemplo, los fármacos pueden reducir la tasa de síntesis de neurotransmisores al afectar a las enzimas sintéticas de ese neurotransmisor. Cuando se bloquea la síntesis de neurotransmisores, la cantidad de neurotransmisores disponibles para su liberación se reduce sustancialmente, lo que da como resultado una disminución de la actividad de los neurotransmisores. Algunos fármacos bloquean o estimulan la liberación de neurotransmisores específicos. Alternativamente, los fármacos pueden impedir el almacenamiento de neurotransmisores en vesículas sinápticas al provocar fugas en las membranas de las vesículas sinápticas. Los fármacos que impiden que un neurotransmisor se una a su receptor se denominan antagonistas del receptor . Por ejemplo, los fármacos utilizados para tratar a pacientes con esquizofrenia, como el haloperidol, la clorpromazina y la clozapina, son antagonistas de los receptores de dopamina en el cerebro. Otros fármacos actúan uniéndose a un receptor e imitando al neurotransmisor normal. Dichos fármacos se denominan agonistas del receptor . Un ejemplo de agonista de los receptores es la morfina , un opiáceo que imita los efectos del neurotransmisor endógeno β-endorfina para aliviar el dolor. Otros fármacos interfieren en la desactivación de un neurotransmisor después de que se ha liberado, prolongando así su acción. Esto se puede lograr bloqueando la recaptación o inhibiendo las enzimas degradativas. Por último, los fármacos también pueden impedir que se produzca un potencial de acción, bloqueando la actividad neuronal en todo el sistema nervioso central y periférico . Los fármacos como la tetrodotoxina que bloquean la actividad neuronal suelen ser letales.
Las drogas que actúan sobre los neurotransmisores de los sistemas principales afectan a todo el sistema, lo que puede explicar la complejidad de la acción de algunas drogas. La cocaína , por ejemplo, bloquea la recaptación de dopamina en la neurona presináptica , dejando las moléculas del neurotransmisor en el espacio sináptico durante un período prolongado. Dado que la dopamina permanece en la sinapsis durante más tiempo, el neurotransmisor continúa uniéndose a los receptores de la neurona postsináptica , lo que provoca una respuesta emocional placentera. La adicción física a la cocaína puede ser resultado de la exposición prolongada a un exceso de dopamina en las sinapsis, lo que conduce a la regulación negativa de algunos receptores postsinápticos. Una vez que desaparecen los efectos de la droga, una persona puede deprimirse debido a la menor probabilidad de que el neurotransmisor se una a un receptor. La fluoxetina es un inhibidor selectivo de la recaptación de serotonina (ISRS), que bloquea la recaptación de serotonina por la célula presináptica, lo que aumenta la cantidad de serotonina presente en la sinapsis y además le permite permanecer allí durante más tiempo, lo que proporciona el potencial para el efecto de la serotonina liberada naturalmente. [56] La AMPT previene la conversión de tirosina en L-DOPA , el precursor de la dopamina; la reserpina previene el almacenamiento de dopamina dentro de las vesículas ; y el deprenil inhibe la monoaminooxidasa (MAO)-B y, por lo tanto, aumenta los niveles de dopamina.
| Droga | Interactúa con | Interacción del receptor | Tipo | Efectos |
|---|---|---|---|---|
| Toxina botulínica (Botox) | Acetilcolina | – | Antagonista | Bloquea la liberación de acetilcolina en el SNP Previene las contracciones musculares. |
| Veneno de araña viuda negra | Acetilcolina | – | Agonista | Promueve la liberación de acetilcolina en el SNP Estimula las contracciones musculares. |
| Neostigmina | Acetilcolina | – | – | Interfiere con la actividad de la acetilcolineasa. Aumenta los efectos de la ACh en los receptores. Se utiliza para tratar la miastenia gravis. |
| Nicotina | Acetilcolina | Nicotínico (músculo esquelético) | Agonista | Aumenta la actividad de ACh Aumenta la atención Efectos de refuerzo |
| d-tubocurarina | Acetilcolina | Nicotínico (músculo esquelético) | Antagonista | Disminuye la actividad en el sitio del receptor. |
| Curare | Acetilcolina | Nicotínico (músculo esquelético) | Antagonista | Disminuye la actividad de ACh Previene las contracciones musculares. |
| Muscarina | Acetilcolina | Muscarínico (corazón y músculo liso) | Agonista | Aumenta la actividad de ACh Tóxico |
| Atropina | Acetilcolina | Muscarínico (corazón y músculo liso) | Antagonista | Bloquea la constricción de la pupila. Bloquea la producción de saliva. |
| Escopolamina ( hioscina ) | Acetilcolina | Muscarínico (corazón y músculo liso) | Antagonista | Trata el mareo por movimiento y las náuseas y vómitos posoperatorios. |
| AMPT | Dopamina/norepinefrina | – | – | Inactiva la tirosina hidroxilasa e inhibe la producción de dopamina. |
| Reserpina | Dopamina | – | – | Previene el almacenamiento de dopamina y otras monoaminas en las vesículas sinápticas. Provoca sedación y depresión. |
| Apomorfina | Dopamina | Receptor D2 (autorreceptores presinápticos/receptores postsinápticos) | Antagonista (dosis baja) / agonista directo (dosis alta) | Dosis baja: bloquea los autorreceptores. Dosis alta: estimula los receptores postsinápticos. |
| Anfetamina | Dopamina/norepinefrina | – | Agonista indirecto | Libera dopamina, noradrenalina y serotonina. Bloquea la recaptación [37] [38] |
| Metanfetamina | Dopamina/norepinefrina | – | – | Libera dopamina y noradrenalina. Bloquea la recaptación |
| Metilfenidato | Dopamina | – | – | Bloquea la recaptación Mejora la atención y el control de los impulsos en el TDAH |
| Cocaína | Dopamina | – | Agonista indirecto | Bloquea la recaptación en la presinapsis. Bloquea los canales de sodio dependientes del voltaje Puede utilizarse como anestésico tópico (gotas para los ojos). |
| Deprenil | Dopamina | – | Agonista | Inhibe la MAO-B Previene la destrucción de la dopamina. |
| Clorpromazina | Dopamina | Receptores D2 | Antagonista | Bloquea los receptores D2 Alivia las alucinaciones. |
| MPTP | Dopamina | – | – | Resultados en síntomas similares al Parkinson |
| PCPA | Serotonina (5-HT) | – | Antagonista | Altera la síntesis de serotonina al bloquear la actividad de la triptófano hidroxilasa. |
| Ondansetrón | Serotonina (5-HT) | Receptores 5-HT 3 | Antagonista | Reduce los efectos secundarios de la quimioterapia y la radiación. Reduce las náuseas y los vómitos. |
| Buspirona | Serotonina (5-HT) | Receptores 5-HT 1A | Agonista parcial | Trata los síntomas de ansiedad y depresión. |
| Fluoxetina | Serotonina (5-HT) | apoya la recaptación de 5-HT | ISRS | Inhibe la recaptación de serotonina. Trata la depresión, algunos trastornos de ansiedad y el TOC [56] Ejemplos comunes: Prozac y Sarafem |
| Fenfluramina | Serotonina (5-HT) | – | – | Provoca liberación de serotonina. Inhibe la recaptación de serotonina. Se utiliza como supresor del apetito. |
| Dietilamida del ácido lisérgico | Serotonina (5-HT) | Receptores postsinápticos 5-HT 2A | Agonista directo | Produce distorsiones de la percepción visual. Estimula los receptores 5-HT 2A en el prosencéfalo |
| Metilendioximetanfetamina ( MDMA ) | Serotonina (5-HT)/norepinefrina | – | – | Estimula la liberación de serotonina y noradrenalina e inhibe la recaptación. Provoca efectos excitatorios y alucinógenos. |
| Estricnina | Glicina | – | Antagonista | Provoca espasmos musculares graves [58] |
| Difenhidramina | Histamina | Atraviesa la barrera hematoencefálica y provoca somnolencia. | ||
| Tetrahidrocannabinol (THC) | Endocannabinoides | Receptores cannabinoides (CB) | Agonista | Produce analgesia y sedación. Aumenta el apetito Efectos cognitivos |
| Rimonabante | Endocannabinoides | Receptores cannabinoides (CB) | Antagonista | Suprime el apetito Se utiliza para dejar de fumar. |
| MAFP | Endocannabinoides | – | – | Inhibe la FAAH Se utiliza en investigaciones para aumentar la actividad del sistema cannabinoide. |
| AM1172 | Endocannabinoides | – | – | Bloquea la recaptación de cannabinoides Se utiliza en investigaciones para aumentar la actividad del sistema cannabinoide. |
| Anandamida (endógena) | – | Receptores cannabinoides (CB); receptores 5-HT 3 | – | Reducir las náuseas y los vómitos. |
| Cafeína | Adenosina | Receptores de adenosina | Antagonista | Bloquea los receptores de adenosina Aumenta el estado de vigilia |
| PCP | Glutamato | Receptor NMDA | Antagonista indirecto | Bloquea el sitio de unión del PCP Evita que los iones de calcio entren en las neuronas. Perjudica el aprendizaje |
| AP5 | Glutamato | Receptor NMDA | Antagonista | Bloquea el sitio de unión del glutamato en el receptor NMDA Perjudica la plasticidad sináptica y ciertas formas de aprendizaje. |
| Ketamina | Glutamato | Receptor NMDA | Antagonista | Se utiliza como anestesia. Induce un estado de trance, ayuda a aliviar el dolor y la sedación. |
| Asociación Nacional de Médicos de la Región Administrativa Especial (NMDA) | Glutamato | Receptor NMDA | Agonista | Se utiliza en investigación para estudiar el receptor NMDA Receptor ionotrópico |
| AMPA | Glutamato | Receptor AMPA | Agonista | Se utiliza en investigación para estudiar el receptor AMPA Receptor ionotrópico |
| Aliglicina | GABA | – | – | Inhibe la síntesis de GABA Provoca convulsiones |
| Muscimol | GABA | Receptor GABA | Agonista | Provoca sedación |
| Bicuculina | GABA | Receptor GABA | Antagonista | Causas de convulsiones |
| Benzodiazepinas | GABA | Receptor GABA A | Agonistas indirectos | Ansiolítico, sedante, deterioro de la memoria, relajación muscular. |
| Barbitúricos | GABA | Receptor GABA A | Agonistas indirectos | Sedación, deterioro de la memoria, relajación muscular. |
| Alcohol | GABA | Receptor GABA | Agonista indirecto | Sedación, deterioro de la memoria, relajación muscular. |
| Picrotoxin | GABA | Receptor GABA A | Antagonista indirecto | Las dosis altas provocan convulsiones. |
| Tiagabina | GABA | – | Antagonista | Antagonista del transportador GABA Aumentar la disponibilidad de GABA Reduce la probabilidad de convulsiones. |
| Moclobemida | Noradrenalina | – | Agonista | Bloquea la MAO-A para tratar la depresión |
| Idazoxán | Noradrenalina | autorreceptores adrenérgicos alfa-2 | Agonista | Bloquea los autorreceptores alfa-2 Se utiliza para estudiar el sistema de noradrenalina. |
| Ácido fusárico | Noradrenalina | – | – | Inhibe la actividad de la dopamina beta-hidroxilasa que bloquea la producción de noradrenalina. Se utiliza para estudiar el sistema de noradrenalina sin afectar el sistema de dopamina. |
| Opiáceos ( opio , morfina , heroína y oxicodona ) | Opiáceos | Receptor opioide [59] | Agonistas | Analgesia, sedación y efectos reforzantes. |
| Naloxona | Opiáceos | – | Antagonista | Revierte los síntomas de intoxicación o sobredosis de opiáceos (es decir, problemas respiratorios). |
Agonistas
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección necesita ser ampliada con: cobertura de agonistas completos y su distinción de agonistas parciales y agonistas inversos. Puedes ayudar agregando más información. ( Agosto de 2015 ) |
Un agonista es una sustancia química capaz de unirse a un receptor, como un receptor de neurotransmisores, e iniciar la misma reacción que se produce típicamente mediante la unión de la sustancia endógena. [60] Por lo tanto, un agonista de un neurotransmisor iniciará la misma respuesta del receptor que el transmisor. En las neuronas, un fármaco agonista puede activar los receptores de neurotransmisores de forma directa o indirecta. Los agonistas de unión directa se pueden caracterizar además como agonistas completos , agonistas parciales y agonistas inversos . [61] [62]
Los agonistas directos actúan de manera similar a un neurotransmisor al unirse directamente a su(s) sitio(s) receptor(es) asociado(s), que puede(n) estar ubicado(s) en la neurona presináptica o postsináptica, o en ambas. [63] Normalmente, los receptores de neurotransmisores se encuentran en la neurona postsináptica, mientras que los autorreceptores de neurotransmisores se encuentran en la neurona presináptica, como es el caso de los neurotransmisores monoamínicos ; [37] en algunos casos, un neurotransmisor utiliza neurotransmisión retrógrada , un tipo de señalización de retroalimentación en las neuronas donde el neurotransmisor se libera postsinápticamente y se une a los receptores objetivo ubicados en la neurona presináptica. [64] [nota 1] La nicotina , un compuesto que se encuentra en el tabaco , es un agonista directo de la mayoría de los receptores nicotínicos de acetilcolina , ubicados principalmente en las neuronas colinérgicas . [59] Los opiáceos , como la morfina , la heroína , la hidrocodona , la oxicodona , la codeína y la metadona , son agonistas del receptor opioide μ ; esta acción media sus propiedades euforizantes y analgésicas . [59]
Los agonistas indirectos aumentan la unión de los neurotransmisores a sus receptores diana estimulando la liberación o previniendo la recaptación de neurotransmisores. [63] Algunos agonistas indirectos desencadenan la liberación de neurotransmisores y previenen la recaptación de neurotransmisores . La anfetamina , por ejemplo, es un agonista indirecto de los receptores postsinápticos de dopamina, noradrenalina y serotonina en cada una de sus respectivas neuronas; [37] [38] produce tanto la liberación de neurotransmisores en la neurona presináptica como posteriormente en la hendidura sináptica y previene su recaptación desde la hendidura sináptica activando TAAR1 , un receptor acoplado a proteína G presináptico , y uniéndose a un sitio en VMAT2 , un tipo de transportador de monoamina ubicado en vesículas sinápticas dentro de las neuronas monoaminérgicas . [37] [38]
Antagonistas
Un antagonista es una sustancia química que actúa dentro del cuerpo para reducir la actividad fisiológica de otra sustancia química (como un opiáceo); especialmente una que se opone a la acción sobre el sistema nervioso de un fármaco o una sustancia que se produce naturalmente en el cuerpo al combinarse con su receptor nervioso y bloquearlo. [65]
Hay dos tipos principales de antagonistas: antagonistas de acción directa y antagonistas de acción indirecta:
- Antagonistas de acción directa: ocupan el espacio presente en los receptores que de otro modo estaría ocupado por los propios neurotransmisores. Esto hace que se bloquee la unión de los neurotransmisores a los receptores. Un ejemplo de uno de los más comunes es la atropina.
- Antagonistas de acción indirecta: fármacos que inhiben la liberación/producción de neurotransmisores (p. ej., reserpina ).
Antagonistas de fármacos
Un fármaco antagonista es aquel que se adhiere (o se une) a un sitio llamado receptor sin activarlo para producir una respuesta biológica. Por lo tanto, se dice que no tiene actividad intrínseca. Un antagonista también puede denominarse "bloqueador" de receptores porque bloquea el efecto de un agonista en el sitio. Por lo tanto, los efectos farmacológicos de un antagonista hacen que los agonistas del sitio receptor correspondiente (por ejemplo, fármacos, hormonas, neurotransmisores) no se unan a él y lo activen. Los antagonistas pueden ser "competitivos" o "irreversibles".
Un antagonista competitivo compite con un agonista por la unión al receptor. A medida que aumenta la concentración del antagonista, la unión del agonista se inhibe progresivamente, lo que da lugar a una disminución de la respuesta fisiológica. Una concentración elevada de un antagonista puede inhibir por completo la respuesta. Sin embargo, esta inhibición se puede revertir mediante un aumento de la concentración del agonista, ya que el agonista y el antagonista compiten por la unión al receptor. Por lo tanto, los antagonistas competitivos pueden caracterizarse por desplazar la relación dosis-respuesta del agonista hacia la derecha. En presencia de un antagonista competitivo, se necesita una mayor concentración del agonista para producir la misma respuesta observada en ausencia del antagonista.
Un antagonista irreversible se une al receptor con tanta fuerza que lo vuelve inaccesible para unirse al agonista. Los antagonistas irreversibles pueden incluso formar enlaces químicos covalentes con el receptor. En cualquier caso, si la concentración del antagonista irreversible es lo suficientemente alta, el número de receptores no unidos que quedan para la unión del agonista puede ser tan bajo que incluso altas concentraciones del agonista no producen la respuesta biológica máxima. [66]
Precursores
En los seres humanos, las catecolaminas y las aminas traza fenetilaminérgicas se derivan del aminoácido L-fenilalanina . |
Si bien la ingesta de precursores de neurotransmisores aumenta la síntesis de neurotransmisores, la evidencia es contradictoria en cuanto a si aumenta la liberación de neurotransmisores y la activación de receptores postsinápticos. Incluso con una mayor liberación de neurotransmisores, no está claro si esto dará como resultado un aumento a largo plazo en la fuerza de la señal de neurotransmisores, ya que el sistema nervioso puede adaptarse a cambios como el aumento de la síntesis de neurotransmisores y, por lo tanto, puede mantener una activación constante. [70] [ ¿ Fuente médica poco confiable? ] Algunos neurotransmisores pueden tener un papel en la depresión y hay cierta evidencia que sugiere que la ingesta de precursores de estos neurotransmisores puede ser útil en el tratamiento de la depresión leve y moderada. [70] [ ¿ Fuente médica poco confiable? ] [71]
Precursores de catecolaminas y aminas traza
La L -DOPA , un precursor de la dopamina que cruza la barrera hematoencefálica , se utiliza en el tratamiento de la enfermedad de Parkinson . En el caso de los pacientes deprimidos en los que está implicada una baja actividad del neurotransmisor noradrenalina , hay pocas pruebas de que la administración del precursor del neurotransmisor sea beneficiosa. La L-fenilalanina y la L-tirosina son precursoras de la dopamina , la noradrenalina y la epinefrina . Estas conversiones requieren vitamina B6 , vitamina C y S-adenosilmetionina . Algunos estudios sugieren posibles efectos antidepresivos de la L-fenilalanina y la L-tirosina, pero hay mucho margen para realizar más investigaciones en esta área. [70] [ ¿ Fuente médica poco fiable? ]
Precursores de serotonina
Se ha demostrado que la administración de L-triptófano , un precursor de la serotonina , duplica la producción de serotonina en el cerebro. Es significativamente más eficaz que un placebo en el tratamiento de la depresión leve y moderada. [70] [¿ Fuente médica poco fiable? ] Esta conversión requiere vitamina C. [ 25] El 5-hidroxitriptófano (5-HTP), también un precursor de la serotonina , es más eficaz que un placebo. [70] [¿ Fuente médica poco fiable? ]
Enfermedades y trastornos
Las enfermedades y los trastornos también pueden afectar a sistemas de neurotransmisores específicos. A continuación se enumeran los trastornos que se producen por un aumento, una disminución o un desequilibrio de determinados neurotransmisores.
Dopamina
Por ejemplo, los problemas en la producción de dopamina (principalmente en la sustancia negra ) pueden provocar la enfermedad de Parkinson , un trastorno que afecta la capacidad de una persona para moverse como quiere, lo que produce rigidez, temblores y otros síntomas. Algunos estudios sugieren que tener muy poca o demasiada dopamina o problemas para usar la dopamina en las regiones del cerebro que piensan y sienten puede desempeñar un papel en trastornos como la esquizofrenia o el trastorno por déficit de atención con hiperactividad (TDAH). La dopamina también está involucrada en la adicción y el consumo de drogas, ya que la mayoría de las drogas recreativas provocan un influjo de dopamina en el cerebro (especialmente los opioides y las metanfetaminas ) que produce una sensación placentera, por lo que los usuarios anhelan constantemente las drogas.
Serotonina
De manera similar, después de que algunas investigaciones sugirieran que los medicamentos que bloquean el reciclaje, o recaptación, de serotonina parecían ayudar a algunas personas diagnosticadas con depresión, se teorizó que las personas con depresión podrían tener niveles de serotonina más bajos de lo normal. Aunque esta teoría se popularizó ampliamente, no se confirmó en investigaciones posteriores. [72] Por lo tanto, los inhibidores selectivos de la recaptación de serotonina (ISRS) se utilizan para aumentar las cantidades de serotonina en las sinapsis.
Glutamato

Además, los problemas con la producción o el uso de glutamato se han vinculado de manera sugestiva y tentativamente con muchos trastornos mentales, incluidos el autismo , el trastorno obsesivo-compulsivo (TOC), la esquizofrenia y la depresión . [73] Tener demasiado glutamato se ha relacionado con enfermedades neurológicas como la enfermedad de Parkinson , la esclerosis múltiple , la enfermedad de Alzheimer , los accidentes cerebrovasculares y la ELA (esclerosis lateral amiotrófica). [74]
Desequilibrio de neurotransmisores
En general, no existen "normas" científicamente establecidas para los niveles apropiados o "equilibrios" de los diferentes neurotransmisores. En la mayoría de los casos, es prácticamente imposible incluso medir los niveles de neurotransmisores en un cerebro o cuerpo en cualquier momento determinado en el tiempo. Los neurotransmisores regulan la liberación de cada uno, y los desequilibrios débiles y constantes en esta regulación mutua se relacionaron con el temperamento en personas sanas. [75] [76] [77] [78] [79] Los desequilibrios o alteraciones fuertes en los sistemas de neurotransmisores se han asociado con muchas enfermedades y trastornos mentales. Estos incluyen el Parkinson, la depresión, el insomnio, el trastorno por déficit de atención e hiperactividad (TDAH), la ansiedad, la pérdida de memoria, los cambios dramáticos en el peso y las adicciones. El estrés físico o emocional crónico puede contribuir a los cambios en el sistema de neurotransmisores. La genética también juega un papel en las actividades de los neurotransmisores.
Aparte del uso recreativo, los medicamentos que interactúan directa o indirectamente con uno o más transmisores o sus receptores se recetan comúnmente para problemas psiquiátricos y psicológicos. Cabe destacar que los medicamentos que interactúan con la serotonina y la noradrenalina se recetan a pacientes con problemas como la depresión y la ansiedad, aunque la idea de que existe mucha evidencia médica sólida que respalda tales intervenciones ha sido ampliamente criticada. [80] Los estudios han demostrado que el desequilibrio de la dopamina tiene una influencia en la esclerosis múltiple y otros trastornos neurológicos. [81]
Véase también
Notas
- ^ En el sistema nervioso central, la anandamida y otros endocannabinoides utilizan la neurotransmisión retrógrada, ya que su liberación es postsináptica, mientras que su receptor objetivo, el receptor cannabinoide 1 (CB1), es presináptico. [64] La planta de cannabis contiene Δ 9 -tetrahidrocannabinol , que es un agonista directo en CB1. [64]
- ^ GABA es un aminoácido no proteinogénico
Referencias
- ^ Smelser, Neil J.; Baltes, Paul B. (2001). Enciclopedia internacional de las ciencias sociales y del comportamiento (1.ª ed.). Ámsterdam, Nueva York: Elsevier. ISBN 978-0-08-043076-8.
- ^ Cuevas J (1 de enero de 2019). "Neurotransmisores y su ciclo de vida". Módulo de referencia en ciencias biomédicas . Elsevier. doi :10.1016/b978-0-12-801238-3.11318-2. ISBN 978-0-12-801238-3.
- ^ Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM (2001). "Neurotransmisores peptídicos". Neurociencia (2.ª ed.). Sinauer Associates.
- ^ Sanders KM, Ward SM (enero de 2019). "Óxido nítrico y su función como neurotransmisor inhibidor no adrenérgico ni colinérgico en el tracto gastrointestinal". British Journal of Pharmacology . 176 (2): 212–227. doi :10.1111/bph.14459. PMC 6295421 . PMID 30063800.
- ^ Elias LJ, Saucier DM (2005). Neuropsicología: Fundamentos clínicos y experimentales . Boston: Pearson.
- ^ Chergui K, Suaud-Chagny MF, Gonon F (octubre de 1994). "Relación no lineal entre el flujo de impulsos, la liberación de dopamina y la eliminación de dopamina en el cerebro de la rata in vivo". Neurociencia . 62 (3): 641–645. doi :10.1016/0306-4522(94)90465-0. PMID 7870295. S2CID 20465561.
- ^ Mustafa, Asif K.; Kim, Paul M.; Snyder, Solomon H. (agosto de 2004). "D-serina como un supuesto neurotransmisor glial". Neuron Glia Biology . 1 (3): 275–281. doi :10.1017/S1740925X05000141. ISSN 1741-0533. PMC 1403160 . PMID 16543946.
- ^ Wolosker, Herman; Dumin, Elena; Balan, Livia; Foltyn, Veronika N. (julio de 2008). "d-Aminoácidos en el cerebro: d-serina en la neurotransmisión y la neurodegeneración: d-serina en la neurotransmisión y la neurodegeneración". FEBS Journal . 275 (14): 3514–3526. doi : 10.1111/j.1742-4658.2008.06515.x . PMID 18564180. S2CID 25735605.
- ^ Thapa S, Lv M, Xu H (30 de noviembre de 2017). "Acetilcolinesterasa: un objetivo primario para fármacos e insecticidas". Mini Reseñas en Química Medicinal . 17 (17): 1665–1676. doi :10.2174/1389557517666170120153930. PMID 28117022.
- ^ Vasica G, Tennant CC (septiembre de 2002). "Consumo de cocaína y complicaciones cardiovasculares". The Medical Journal of Australia . 177 (5): 260–262. doi :10.5694/j.1326-5377.2002.tb04761.x. PMID 12197823. S2CID 18572638.
- ^ Saladin, Kenneth S. Anatomía y fisiología: la unidad de forma y función . McGraw Hill. 2009 ISBN 0-07-727620-5
- ^ Teleanu, Raluca Ioana; Niculescu, Adelina-Gabriela; Rosa, Eugenia; Vladâcenco, Oana; Grumezescu, Alexandru Mihai; Teleanu, Daniel Mihai (25 de mayo de 2022). "Neurotransmisores: factores clave en los trastornos neurológicos y neurodegenerativos del sistema nervioso central". Revista Internacional de Ciencias Moleculares . 23 (11): 5954. doi : 10.3390/ijms23115954 . ISSN 1422-0067. PMC 9180936 . PMID 35682631.
- ^ Breedlove SM , Watson NV (2013). Psicología biológica: una introducción a la neurociencia conductual, cognitiva y clínica (séptima edición). Sunderland, MA: Sinauer Associates. ISBN 978-0878939275.
- ^ ab Whishaw B, Kolb IQ (2014). Una introducción al cerebro y la conducta (4.ª ed.). Nueva York, NY: Worth Publishers. págs. 150-151. ISBN 978-1429242288.
- ^ Purves, Dale; Augustine, George J.; Fitzpatrick, David; Katz, Lawrence C.; LaMantia, Anthony-Samuel; McNamara, James O.; Williams, S. Mark (2001), "Excitatory and Inhibitory Postsynaptic Potentials", Neuroscience. 2.ª edición , Sinauer Associates , consultado el 14 de julio de 2023.
- ^ Peters A, Palay SL (diciembre de 1996). "La morfología de las sinapsis". Journal of Neurocytology . 25 (12): 687–700. doi :10.1007/BF02284835. PMID 9023718. S2CID 29365393.
- ^ Shier D, Butler J, Lewis R (5 de enero de 2015). Anatomía y fisiología humana de Hole (decimocuarta ed.). Nueva York, Nueva York. ISBN 978-0-07-802429-0.OCLC 881146319 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Di Chiara G, Morelli M, Consolo S (junio de 1994). "Funciones moduladoras de los neurotransmisores en el cuerpo estriado: interacciones ACh/dopamina/NMDA". Tendencias en neurociencias . 17 (6): 228–233. doi :10.1016/0166-2236(94)90005-1. PMID 7521083. S2CID 32085555.
- ^ Whishaw B, Kolb IQ (2014). Una introducción al cerebro y la conducta (4.ª ed.). Nueva York, NY: Worth Publishers. ISBN 978-1429242288.
- ^ Gross L (noviembre de 2006). "Los jugadores "de apoyo" toman la iniciativa en la protección del cerebro sobreestimulado". PLOS Biology . 4 (11): e371. doi : 10.1371/journal.pbio.0040371 . PMC 1609133 . PMID 20076484.
- ^ Yang JL, Sykora P, Wilson DM, Mattson MP, Bohr VA (agosto de 2011). "El neurotransmisor excitatorio glutamato estimula la reparación del ADN para aumentar la resiliencia neuronal". Mecanismos de envejecimiento y desarrollo . 132 (8–9): 405–11. doi :10.1016/j.mad.2011.06.005. PMC 3367503 . PMID 21729715.
- ^ Antagonistas del receptor de orexina: una nueva clase de pastillas para dormir, National Sleep Foundation.
- ^ "Receptores de acetilcolina". Ebi.ac.uk. Consultado el 25 de agosto de 2014 .
- ^ Schacter, Gilbert y Weger. Psicología. Estados Unidos de América. 2009. Versión impresa.
- ^ ab Universidad de Bristol. "Introducción a la serotonina" . Consultado el 15 de octubre de 2009 .
- ^ ab Sheffler, Zachary M.; Reddy, Vamsi; Pillarisetty, Leela Sharath (2023), "Fisiología, neurotransmisores", StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 30969716 , consultado el 16 de julio de 2023
- ^ Prasad BV (2020). Examinando los fundamentos biológicos del comportamiento humano . Estados Unidos de América: IGI Global. pág. 81. ISBN 978-1799-8286-17.
- ^ ab Sapolsky R (2005). "Biología y comportamiento humano: los orígenes neurológicos de la individualidad, 2.º". The Teaching Company.
Ver páginas 13 y 14 de la Guía
- ^ Snyder SH, Innis RB (1979). "Neurotransmisores peptídicos". Revista Anual de Bioquímica . 48 : 755–82. doi :10.1146/annurev.bi.48.070179.003543. PMID 38738.
- ^ Corbière A, Vaudry H, Chan P, Walet-Balieu ML, Lecroq T, Lefebvre A, et al. (18 de septiembre de 2019). "Estrategias para la identificación de neuropéptidos bioactivos en vertebrados". Frontiers in Neuroscience . 13 : 948. doi : 10.3389/fnins.2019.00948 . PMC 6759750 . PMID 31619945.
- ^ Fricker LD, Devi LA (mayo de 2018). "Neuropéptidos y receptores huérfanos: nuevos objetivos terapéuticos". Farmacología y terapéutica . 185 : 26–33. doi :10.1016/j.pharmthera.2017.11.006. PMC 5899030 . PMID 29174650.
- ^ Kodirov SA, Takizawa S, Joseph J, Kandel ER, Shumyatsky GP, Bolshakov VY (octubre de 2006). "El zinc liberado sinápticamente abre la puerta a la potenciación a largo plazo de las vías de condicionamiento del miedo". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (41): 15218–23. Bibcode :2006PNAS..10315218K. doi : 10.1073/pnas.0607131103 . PMC 1622803 . PMID 17005717.
- ^ "Simposio internacional sobre óxido nítrico – Dr. John Andrews – MaRS". MaRS . Archivado desde el original el 14 de octubre de 2014.
- ^ "Dopamina: actividad biológica". Guía de farmacología de la IUPHAR/BPS . Unión Internacional de Farmacología Básica y Clínica . Consultado el 29 de enero de 2016 .
- ^ Grandy DK, Miller GM, Li JX (febrero de 2016). ""TAARgeting Addiction"--The Alamo Bears Witness to Another Revolution: An Overview of the Plenary Symposium of the 2015 Behavior, Biology and Chemistry Conference". Dependencia de drogas y alcohol . 159 : 9–16. doi :10.1016/j.drugalcdep.2015.11.014. PMC 4724540. PMID 26644139.
TAAR1 es un receptor de alta afinidad para METH/AMPH y DA
. - ^ Lin Y, Hall RA, Kuhar MJ (octubre de 2011). "Estimulación del péptido CART de la señalización mediada por proteína G en células PC12 diferenciadas: identificación de PACAP 6-38 como antagonista del receptor CART". Neuropéptidos . 45 (5): 351–8. doi :10.1016/j.npep.2011.07.006. PMC 3170513 . PMID 21855138.
- ^ abcde Miller GM (enero de 2011). "El papel emergente del receptor 1 asociado a trazas de aminas en la regulación funcional de los transportadores de monoaminas y la actividad dopaminérgica". Journal of Neurochemistry . 116 (2): 164–76. doi :10.1111/j.1471-4159.2010.07109.x. PMC 3005101 . PMID 21073468.
- ^ abcd Eiden LE, Weihe E (enero de 2011). "VMAT2: un regulador dinámico de la función neuronal monoaminérgica cerebral que interactúa con drogas de abuso". Anales de la Academia de Ciencias de Nueva York . 1216 (1): 86–98. Bibcode :2011NYASA1216...86E. doi :10.1111/j.1749-6632.2010.05906.x. PMC 4183197 . PMID 21272013.
VMAT2 es el transportador vesicular del SNC no solo para las aminas biógenas DA, NE, EPI, 5-HT y HIS, sino probablemente también para las aminas traza TYR, PEA y tironamina (THYR) ... Las neuronas [traza aminérgicas] en el SNC de los mamíferos serían identificables como neuronas que expresan VMAT2 para almacenamiento y la enzima biosintética descarboxilasa de aminoácidos aromáticos (AADC).
- ^ abc Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 6: Sistemas de proyección amplia: monoaminas, acetilcolina y orexina". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. pág. 155. ISBN 9780071481274Diferentes subregiones del ATV reciben entradas glutamatérgicas de la corteza prefrontal, entradas orexinérgicas del hipotálamo lateral, entradas colinérgicas y también glutamatérgicas
y GABAérgicas del núcleo tegmental laterodorsal y el núcleo pedunculopontino, entradas noradrenérgicas del locus ceruleus, entradas serotoninérgicas de los núcleos del rafe y entradas GABAérgicas del núcleo accumbens y el pálido ventral.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 6: Sistemas de proyección amplia: monoaminas, acetilcolina y orexina". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 145, 156–157. ISBN 9780071481274.
Las fibras NE descendentes modulan las señales aferentes del dolor. ... El locus ceruleus (LC), que se encuentra en el suelo del cuarto ventrículo en la protuberancia rostral, contiene más del 50% de todas las neuronas noradrenérgicas del cerebro; inerva tanto el prosencéfalo (p. ej., proporciona prácticamente toda la NE a la corteza cerebral) como regiones del tronco encefálico y la médula espinal. ... Las otras neuronas noradrenérgicas del cerebro se encuentran en grupos sueltos de células en el tronco encefálico, incluidas las regiones tegmentales laterales. Estas neuronas se proyectan en gran medida dentro del tronco encefálico y la médula espinal. La NE, junto con la 5HT, la ACh, la histamina y la orexina, es un regulador crítico del ciclo sueño-vigilia y de los niveles de excitación. ... La activación de LC también puede aumentar la ansiedad... La estimulación de los receptores β-adrenérgicos en la amígdala produce una mejor memoria para los estímulos codificados bajo una fuerte emoción negativa... La epinefrina se encuentra solo en una pequeña cantidad de neuronas centrales, todas ubicadas en el bulbo raquídeo. La epinefrina está involucrada en funciones viscerales, como el control de la respiración.
- ^ abcd Rang HP (2003). Farmacología . Edimburgo: Churchill Livingstone. pp. 474 para el sistema de la noradrenalina, página 476 para el sistema de la dopamina, página 480 para el sistema de la serotonina y página 483 para el sistema colinérgico. ISBN 978-0-443-07145-4.
- ^ abcde Iwańczuk W, Guźniczak P (2015). "Fundamentos neurofisiológicos de los fenómenos del sueño, el despertar, la conciencia y la consciencia. Parte 1". Terapia intensiva en anestesiología . 47 (2): 162–7. doi : 10.5603/AIT.2015.0015 . PMID 25940332.
El sistema activador reticular ascendente (ARAS) es responsable de un estado de vigilia sostenido. ... La proyección talámica está dominada por neuronas colinérgicas que se originan en el núcleo tegmental pedunculopontino de la protuberancia y el mesencéfalo (PPT) y en los núcleos tegmental laterodorsal de la protuberancia y el mesencéfalo (LDT) [17, 18]. La proyección hipotalámica involucra neuronas noradrenérgicas del locus coeruleus (LC) y neuronas serotoninérgicas de los núcleos del rafe dorsal y medio (DR), que pasan a través del hipotálamo lateral y alcanzan axones del núcleo tubero-mamilar (TMN) histaminérgico, formando juntos una vía que se extiende hacia el prosencéfalo, la corteza y el hipocampo. La excitación cortical también aprovecha las neuronas dopaminérgicas de la sustancia negra (SN), el área tegmentaria ventral (VTA) y el área gris periacueductal (PAG). Menos neuronas colinérgicas del puente y el mesencéfalo envían proyecciones al prosencéfalo a lo largo de la vía ventral, sin pasar por el tálamo [19, 20].
- ^ abcde Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 12: Sueño y despertar". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York, EE. UU.: McGraw-Hill Medical. pág. 295. ISBN 9780071481274.
El ARAS es una estructura compleja que consta de varios circuitos diferentes, incluidas las cuatro vías monoaminérgicas... La vía de la noradrenalina se origina en el locus ceruleus (LC) y los núcleos relacionados del tronco encefálico; las neuronas serotoninérgicas se originan también en los núcleos del rafe dentro del tronco encefálico; las neuronas dopaminérgicas se originan en el área tegmental ventral (VTA); y la vía histaminérgica se origina en neuronas en el núcleo tuberomamilar (TMN) del hipotálamo posterior. Como se analiza en el Capítulo 6, estas neuronas se proyectan ampliamente por todo el cerebro desde grupos restringidos de cuerpos celulares. La noradrenalina, la serotonina, la dopamina y la histamina tienen funciones moduladoras complejas y, en general, promueven la vigilia. El PT en el tronco encefálico también es un componente importante del ARAS. La actividad de las neuronas colinérgicas del PT (células REM-on) promueve el sueño REM. Durante la vigilia, las células REM activas son inhibidas por un subconjunto de neuronas de noradrenalina y serotonina ARAS llamadas células REM desactivadas.
- ^ Rinaman L (febrero de 2011). "Neuronas noradrenérgicas A2 del rombencéfalo: diversos roles en las funciones autónomas, endocrinas, cognitivas y conductuales". American Journal of Physiology. Fisiología reguladora, integradora y comparativa . 300 (2): R222-35. doi :10.1152 / ajpregu.00556.2010. PMC 3043801. PMID 20962208.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 6: Sistemas de proyección amplia: monoaminas, acetilcolina y orexina". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 147-148, 154-157. ISBN 9780071481274.
Las neuronas del SNc inervan densamente el estriado dorsal donde desempeñan un papel crítico en el aprendizaje y la ejecución de programas motores. Las neuronas del VTA inervan el estriado ventral (núcleo accumbens), el bulbo olfatorio, la amígdala, el hipocampo, la corteza prefrontal orbital y medial y la corteza cingulada. Las neuronas DA del VTA desempeñan un papel crítico en la motivación, el comportamiento relacionado con la recompensa, la atención y múltiples formas de memoria. ... Así, actuando en diversos campos terminales, la dopamina confiere prominencia motivacional ("querer") a la recompensa en sí o señales asociadas (región de la capa del núcleo accumbens), actualiza el valor asignado a diferentes objetivos a la luz de esta nueva experiencia (corteza prefrontal orbital), ayuda a consolidar múltiples formas de memoria (amígdala e hipocampo) y codifica nuevos programas motores que facilitarán la obtención de esta recompensa en el futuro (región central del núcleo accumbens y estriado dorsal). ... La DA tiene múltiples acciones en la corteza prefrontal. Promueve el "control cognitivo" de la conducta: la selección y el control exitoso de la conducta para facilitar el logro de las metas elegidas. Los aspectos del control cognitivo en los que la DA desempeña un papel incluyen la memoria de trabajo, la capacidad de mantener la información "en línea" para guiar las acciones, la supresión de conductas prepotentes que compiten con las acciones dirigidas a un objetivo y el control de la atención y, por lo tanto, la capacidad de superar las distracciones. ... Las proyecciones noradrenérgicas del LC interactúan así con las proyecciones dopaminérgicas del VTA para regular el control cognitivo. ...
- ^ Calipari ES, Bagot RC, Purushothaman I, Davidson TJ, Yorgason JT, Peña CJ, et al. (marzo de 2016). "La imagenología in vivo identifica la firma temporal de las neuronas espinosas medianas D1 y D2 en la recompensa de la cocaína". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 113 (10): 2726–31. Bibcode :2016PNAS..113.2726C. doi : 10.1073/pnas.1521238113 . PMC 4791010 . PMID 26831103.
Trabajos previos han demostrado que la estimulación optogenética de las neuronas espinosas medianas D1 promueve la recompensa, mientras que la estimulación de las neuronas espinosas medianas D2 produce aversión.
- ^ Ikemoto S (noviembre de 2010). "Circuitos de recompensa cerebral más allá del sistema de dopamina mesolímbico: una teoría neurobiológica". Neuroscience and Biobehavioral Reviews . 35 (2): 129–50. doi :10.1016/j.neubiorev.2010.02.001. PMC 2894302 . PMID 20149820.
Estudios recientes sobre la autoadministración intracraneal de neuroquímicos (fármacos) encontraron que las ratas aprenden a autoadministrarse varios fármacos en las estructuras de dopamina mesolímbicas: el área tegmental ventral posterior, el núcleo accumbens de la capa medial y el tubérculo olfatorio medial. ... En la década de 1970 se reconoció que el tubérculo olfatorio contiene un componente estriatal, que está lleno de neuronas espinosas medianas GABAérgicas que reciben entradas glutamatérgicas de regiones corticales y entradas dopaminérgicas del ATV y se proyectan al pálido ventral al igual que el núcleo accumbens.
Figura 3: El estriado ventral y la autoadministración de anfetamina - ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 6: Sistemas de proyección amplia: monoaminas, acetilcolina y orexina". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 175-176. ISBN 9780071481274.
Dentro del cerebro, la histamina es sintetizada exclusivamente por neuronas con sus cuerpos celulares en el núcleo tuberomamilar (NTM) que se encuentra dentro del hipotálamo posterior. Hay aproximadamente 64000 neuronas histaminérgicas por lado en los humanos. Estas células se proyectan por todo el cerebro y la médula espinal. Las áreas que reciben proyecciones especialmente densas incluyen la corteza cerebral, el hipocampo, el neoestriado, el núcleo accumbens, la amígdala y el hipotálamo. ... Si bien la función mejor caracterizada del sistema de la histamina en el cerebro es la regulación del sueño y la excitación, la histamina también está involucrada en el aprendizaje y la memoria ... También parece que la histamina está involucrada en la regulación de la alimentación y el equilibrio energético.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 6: Sistemas de proyección amplia: monoaminas, acetilcolina y orexina". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 158-160. ISBN 9780071481274.
[El] rafe dorsal inerva preferentemente la corteza cerebral, el tálamo, las regiones estriatales (caudado-putamen y núcleo accumbens) y los núcleos dopaminérgicos del mesencéfalo (p. ej., la sustancia negra y el área tegmental ventral), mientras que el rafe medio inerva el hipocampo, el tabique y otras estructuras del prosencéfalo límbico. ... está claro que la 5HT influye en el sueño, la excitación, la atención, el procesamiento de la información sensorial en la corteza cerebral y aspectos importantes de la emoción (probablemente incluida la agresión) y la regulación del estado de ánimo. ... Los núcleos rostrales, que incluyen el núcleo linearis, el rafe dorsal, el rafe medial y el rafe pontis, inervan la mayor parte del cerebro, incluido el cerebelo. Los núcleos caudales, que comprenden el rafe mayor, el rafe pálido y el rafe oscuro, tienen proyecciones más limitadas que terminan en el cerebelo, el tronco encefálico y la médula espinal.
- ^ Nestler EJ. "Brain Reward Pathways". Icahn School of Medicine at Mount Sinai . Nestler Lab . Consultado el 16 de agosto de 2014 .
El rafe dorsal es el sitio principal de las neuronas serotoninérgicas en el cerebro, que, al igual que las neuronas noradrenérgicas, modulan de forma generalizada la función cerebral para regular el estado de activación y el estado de ánimo del organismo.
- ^ Marston OJ, Garfield AS, Heisler LK (junio de 2011). "El papel de los sistemas centrales de serotonina y melanocortina en el control del equilibrio energético". Revista Europea de Farmacología . 660 (1): 70–9. doi :10.1016/j.ejphar.2010.12.024. PMID 21216242.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Capítulo 6: Sistemas de proyección amplia: monoaminas, acetilcolina y orexina". En Sydor A, Brown RY (eds.). Neurofarmacología molecular: una base para la neurociencia clínica (2.ª ed.). Nueva York: McGraw-Hill Medical. págs. 167-175. ISBN 9780071481274Los núcleos colinérgicos del prosencéfalo basal
están compuestos por el núcleo septal medial (Ch1), el núcleo vertical de la banda diagonal (Ch2), la rama horizontal de la banda diagonal (Ch3) y el núcleo basal de Meynert (Ch4). Los núcleos colinérgicos del tronco encefálico incluyen el núcleo pedunculopontino (Ch5), el núcleo tegmental laterodorsal (Ch6), la habénula medial (Ch7) y el núcleo parabigeminal (Ch8).
- ^ Guyenet PG, Stornetta RL, Bochorishvili G, Depuy SD, Burke PG, Abbott SB (agosto de 2013). "Neuronas C1: las EMT del cuerpo". Revista estadounidense de fisiología. Fisiología reguladora, integradora y comparativa . 305 (3): R187-204. doi : 10.1152/ajpregu.00054.2013. PMC 3743001. PMID 23697799.
- ^ Stornetta RL, Guyenet PG (marzo de 2018). "Neuronas C1: ¿un punto nodal para el estrés?". Fisiología experimental . 103 (3): 332–336. doi :10.1113/EP086435. PMC 5832554 . PMID 29080216.
- ^ "Conversaciones neuronales: cómo se comunican las células cerebrales". Brainfacts.org . Consultado el 2 de diciembre de 2014 .
- ^ ab Yadav VK, Ryu JH, Suda N, Tanaka KF, Gingrich JA, Schütz G, et al. (noviembre de 2008). "Lrp5 controla la formación ósea inhibiendo la síntesis de serotonina en el duodeno". Cell . 135 (5): 825–37. doi :10.1016/j.cell.2008.09.059. PMC 2614332 . PMID 19041748.
- ^ Carlson, NR y Birkett, MA (2017). Fisiología del comportamiento (12.ª ed.). Pearson, págs. 100-115. ISBN 978-0134080918
- ^ "CDC Strychnine. Facts about Strychnine" ( Preparación y respuesta ante emergencias de salud pública ) . Consultado el 7 de mayo de 2018 .
- ^ abc "Cuadro de neurotransmisores y fármacos". Ocw.mit.edu . Consultado el 25 de agosto de 2014 .
- ^ "Agonista: definición y más del diccionario gratuito Merriam-Webster". Merriam-webster.com . Consultado el 25 de agosto de 2014 .
- ^ Atack J., Lavreysen H. (2010) Agonista. En: Stolerman IP (eds) Enciclopedia de psicofarmacología. Springer, Berlín, Heidelberg. https://doi.org/10.1007/978-3-540-68706-1_1565
- ^ Roth BL (febrero de 2016). "DREADDs para neurocientíficos". Neuron . 89 (4): 683–694. doi : 10.1016/j.neuron.2016.01.040 . PMC 4759656 . PMID 26889809.
- ^ ab Ries RK, Fiellin DA, Miller SC (2009). Principios de la medicina de las adicciones (4.ª ed.). Filadelfia: Wolters Kluwer/Lippincott Williams & Wilkins. págs. 709–710. ISBN 9780781774772. Recuperado el 16 de agosto de 2015 .
- ^ abc Flores A, Maldonado R, Berrendero F (diciembre de 2013). "Interacción entre cannabinoides e hipocretina en el sistema nervioso central: lo que sabemos hasta ahora". Frontiers in Neuroscience . 7 : 256. doi : 10.3389/fnins.2013.00256 . PMC 3868890 . PMID 24391536.
• Figura 1: Esquema de la expresión de CB1 en el cerebro y neuronas orexinérgicas que expresan OX1 u OX2
• Figura 2: Mecanismos de señalización sináptica en los sistemas de cannabinoides y orexinas - ^ "Antagonista". Definición médica de Antagonista . Consultado el 5 de noviembre de 2014 .
- ^ Goeders NE (2001). "Antagonista". Enciclopedia de drogas, alcohol y comportamiento adictivo . Consultado el 2 de diciembre de 2014 .
- ^ Broadley KJ (marzo de 2010). "Los efectos vasculares de las trazas de aminas y anfetaminas". Farmacología y terapéutica . 125 (3): 363–375. doi :10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (mayo de 2005). "Un renacimiento de las aminas traza inspirado en una nueva familia de GPCR". Tendencias en ciencias farmacológicas . 26 (5): 274–281. doi :10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ Wang X, Li J, Dong G, Yue J (febrero de 2014). "Los sustratos endógenos del CYP2D cerebral". Revista Europea de Farmacología . 724 : 211–218. doi :10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ abcde Meyers S (febrero de 2000). "Uso de precursores de neurotransmisores para el tratamiento de la depresión" (PDF) . Alternative Medicine Review . 5 (1): 64–71. PMID 10696120. Archivado desde el original (PDF) el 5 de agosto de 2004.
- ^ van Praag HM (marzo de 1981). "Manejo de la depresión con precursores de serotonina". Psiquiatría biológica . 16 (3): 291–310. PMID 6164407.
- ^ Healy D (abril de 2015). "Serotonina y depresión". BMJ . 350 : h1771. doi :10.1136/bmj.h1771. PMID 25900074. S2CID 38726584.
- ^ "NIMH Brain Basics". Institutos Nacionales de Salud de EE . UU . Archivado desde el original el 29 de octubre de 2014. Consultado el 29 de octubre de 2014 .
- ^ Bittigau P, Ikonomidou C (noviembre de 1997). "Glutamato en enfermedades neurológicas". Revista de neurología infantil . 12 (8): 471–85. doi :10.1177/088307389701200802. PMID 9430311. S2CID 1258390.
- ^ Netter, P. (1991) Variables bioquímicas en el estudio del temperamento. En Strelau, J. y Angleitner, A. (Eds.), Exploraciones en el temperamento: Perspectivas internacionales sobre teoría y medición 147–161. Nueva York: Plenum Press.
- ^ Trofimova I, Robbins TW (mayo de 2016). "Sistemas de temperamento y excitación: una nueva síntesis de psicología diferencial y neuroquímica funcional". Neuroscience and Biobehavioral Reviews . 64 : 382–402. doi :10.1016/j.neubiorev.2016.03.008. hdl : 11375/26202 . PMID 26969100. S2CID 13937324.
- ^ Cloninger CR, Svrakic DM, Przybeck TR. Un modelo psicobiológico del temperamento y el carácter" Arch Gen Psychiatry 1993; 50:975-990.
- ^ Trofimova IN (2016). "La interrelación entre los aspectos funcionales de las actividades y un modelo neuroquímico del temperamento adulto". En Arnold MC (ed.). Temperamentos: diferencias individuales, influencias sociales y ambientales e impacto en la calidad de vida . Nueva York: Nova Science Publishers, Inc., págs. 77-147.
- ^ Depue RA, Morrone-Strupinsky JV (junio de 2005). "Un modelo neuroconductual del vínculo afiliativo: implicaciones para la conceptualización de un rasgo humano de afiliación". The Behavioral and Brain Sciences . 28 (3): 313–50, discusión 350–95. doi :10.1017/s0140525x05000063. PMID 16209725.
- ^ Leo, J., y Lacasse, J. (10 de octubre de 2007). Los medios de comunicación y la teoría del desequilibrio químico de la depresión. Recuperado el 1 de diciembre de 2014, de http://psychrights.org/articles/TheMediaandChemicalImbalanceTheoryofDepression.pdf
- ^ Dobryakova E, Genova HM, DeLuca J, Wylie GR (12 de marzo de 2015). "La hipótesis del desequilibrio de la dopamina en la fatiga en la esclerosis múltiple y otros trastornos neurológicos". Frontiers in Neurology . 6 : 52. doi : 10.3389/fneur.2015.00052 . PMC 4357260 . PMID 25814977.
Enlaces externos
- Purves, Dale; Augustine, George J.; Fitzpatrick, David; Katz, Lawrence C.; LaMantia, Anthony-Samuel; McNamara, James O.; Williams, S. Mark (2001). "Capítulo 6. Neurotransmisores". ¿Qué define a un neurotransmisor? (2.ª ed.). Sunderland (MA): Sinauer Associates. ISBN 0-87893-742-0.
{{cite book}}:|journal=ignorado ( ayuda ) - Holz, Ronald W.; Fisher, Stephen K. (1999). "Capítulo 10. Transmisión sináptica y señalización celular: una descripción general". En Siegel, George J; Agranoff, Bernard W; Albers, R Wayne; Fisher, Stephen K; Uhler, Michael D (eds.). Transmisión sináptica (6.ª ed.). Filadelfia: Lippincott-Raven. ISBN 0-397-51820-X.
{{cite book}}:|journal=ignorado ( ayuda ) - Neurotransmisores y péptidos neuroactivos en el sitio web Neurociencia para niños



