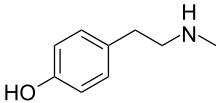
N-metiltiramina
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 4-[2-(Metilamino)etil]fenol | |
| Otros nombres Metil-4-tiramina; 4-hidroxi- N -metilfenetilamina; p -(2-metilaminoetil)fenol | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.006.120 |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C9H13NO | |
| Masa molar | 151,209 g·mol −1 |
| Apariencia | sólido cristalino incoloro |
| Densidad | 1,03 g/ml |
| Punto de fusión | 130 a 131 °C (266 a 268 °F; 403 a 404 K) |
| Punto de ebullición | 271 °C (520 °F; 544 K) (183-185 °C a 9 mm; 135 °C a 0,05 mm) |
| moderadamente soluble en agua | |
| Peligros | |
| punto de inflamabilidad | 120 °C (248 °F; 393 K) |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La N -metiltiramina ( NMT ), también conocida como 4-hidroxi- N -metilfenetilamina , es una amina traza humana [1] [2] y un alcaloide de fenetilamina naturalque se encuentra en una variedad de plantas. [3] Como su nombre lo indica, es el análogo N-metil de la tiramina , que es una amina traza biógena bien conocidacon la que la NMT comparte muchas propiedades farmacológicas. Biosintéticamente, la NMT se produce por la N- metilación de la tiramina a través de la acción de la enzima feniletanolamina N -metiltransferasa en humanos [1] [2] y la tiramina N -metiltransferasa en plantas. [4]
Aparición
La N-metiltiramina parece estar ampliamente distribuida en las plantas. [3] [5]
La NMT fue aislada como un producto natural por primera vez, a partir de raíces de cebada germinadas , por Kirkwood y Marion en 1950. Estos químicos descubrieron que 600 g de cebada, después de la germinación y el crecimiento de 10 días, producían 168 mg de N-metiltiramina. [6] Dado que la cebada, a través de su conversión en malta , se utiliza ampliamente en la producción de cerveza , varios grupos de investigadores han examinado la cerveza y la malta en busca de la presencia de NMT. Citando un estudio de 1965 de McFarlane, [7] Poocharoen informó que la cerveza contenía ~ 5–8 mg/L de NMT. [8] El contenido de NMT de varias maltas y fracciones de malta fue estudiado ampliamente por el propio Poocharoen, quien también proporcionó una buena cobertura de la literatura relacionada hasta 1983. Este investigador encontró una concentración media de NMT en la cebada cruda [9] de ~ 5 μg/g; En maltas verdes (es decir, cebada que se había remojado en agua durante 2 días y luego germinado durante 4 días), la concentración media fue de ~ 21 μg/g, y en maltas secadas (es decir, maltas verdes que se habían calentado en un horno durante 1-2 días) la concentración media fue de ~ 27 μg/g. Cuando solo se examinaron las raíces de malta verde, su contenido medio de NMT fue de ~ 1530 μg/g, mientras que el nivel medio en las raíces de malta secadas fue de ~ 1960 μg/g. [8]
Estudios de especies de Acacia han demostrado la presencia de niveles significativos de NMT en sus hojas: ~ 240-1240 ppm (o μg/g) en A. rigidula [10] y ~ 190-750 ppm en A. berlandieri . [11] Las semillas de A. schweinfurthii produjeron 440 μg/g de NMT. [12]
El NMT se encuentra en la naranja amarga , Citrus aurantium , y se ha informado de una concentración de ~180 μg/g a partir de un extracto elaborado a partir de la fruta madura, aunque el método mediante el cual se preparó este extracto no está descrito con mucha claridad. [13]
La N -metiltiramina se produce a partir de la para -tiramina por la feniletanolamina N -metiltransferasa (PNMT) en el cerebro humano. [1] [2] |
Química
Síntesis
La NMT se ha sintetizado de varias maneras. Una de las primeras síntesis es la descrita por Walpole, que la realizó mediante la siguiente secuencia de pasos: (i) acetilación de 4-metoxifenetilamina con anhídrido acético; (ii) metilación de la amida utilizando Na/yoduro de metilo; (iii) escisión del éter metílico al fenol utilizando HI; (iv) hidrólisis del grupo N-acetilo con HCl acuoso. Walpole también describió una secuencia alternativa, pero similar, de reacciones que conducen a la NMT, comenzando con la conversión de 4-metoxifenetilamina a su bencenosulfonamida, que luego fue N-metilada y desprotegida. [15]
Corti propuso un método diferente para producir NMT: lo preparó mediante la descarboxilación térmica de la N-metiltirosina (ratanhin) calentando el aminoácido en fluoreno a 250 °C. Aunque la N-metiltirosina se produce de forma natural, se obtuvo mediante la metilación de la tirosina utilizando sulfato de dimetilo. [16]
Kirkwood y Marion también fabricaron NMT a partir de 4-metoxifenetilamina, pero primero se convirtió en imina con benzaldehído, seguido de metilación con sulfato de dimetilo ; el producto se convirtió en N-metil-4-metoxifenetilamina y finalmente se des-O-metiló con HBr para dar N-metiltiramina. [6]
Sales comunes
Clorhidrato de N -metiltiramina, C9H13NO.HCl : pf 148,5 ° C; muy soluble en agua y en etanol. [ 15]
Oxalato de hidrógeno de N -metiltiramina, C 9 H 13 NO.C 2 H 2 O 4 : pf 250 °C; muy poco soluble en agua. [15]
Basicidad
Los pKa aparentes (ver el artículo original para la discusión) para la N -metiltiramina protonada son 9,76 (H fenólico) y 10,71 (H amónico). [17]
Farmacología
El NMT es un presor , con una potencia de 1/140 × epinefrina . [18] Basándose en experimentos con perros, Hjort describió al NMT como un "muy buen agente presor": se produjo un aumento de la presión arterial de >130 mm y ~ 5 minutos de duración mediante la inyección de 1-2,5 μM de soluciones de la sal de HCl en perros que pesaban ~ 10 kg. [19] Camp informó de una respuesta presora, que se inhibió mediante un tratamiento previo con reserpina , a la administración de NMT a cabras. [20]
La administración subcutánea de 10 mg/kg de la sal de HCl de NMT a ratones aumentó la liberación de noradrenalina (NE) del corazón en un 36% con respecto al control, medida después de 2 horas. A modo de comparación, la misma dosis de clorhidrato de tiramina provocó una liberación de NE del 50% con respecto al control en este ensayo. [21] Camp observó una disminución cualitativamente similar en el contenido de NE del corazón de rata después del tratamiento con NMT. [20]
Sin dar muchos detalles experimentales, Evans et al. informaron que el NMT aumentó la presión arterial en ratas, inhibió las contracciones inducidas eléctricamente del íleon de cobaya, relajó el tono estimulado por acetilcolina del músculo traqueal aislado de cobaya y aumentó la frecuencia y la fuerza contráctil de la aurícula aislada de cobaya. El efecto sobre la presión arterial fue antagonizado competitivamente por la guanetidina , mientras que los efectos sobre la aurícula aislada fueron inhibidos por la desipramina . Aunque no se dieron dosis, se describió que el NMT era equipotente con la tiramina en todos los tejidos. También se observó que el manejo del NMT causó dolores de cabeza por migraña en uno de los investigadores. [12]
Se ha descubierto que el NMT es un potente estimulante de la liberación de gastrina en la rata, con una [[ED 50 ]] de ~ 10 μg/kg. [22] Estos investigadores utilizaron un procedimiento de aislamiento guiado por bioensayo para demostrar que el NMT era el componente de la cerveza responsable de producir una mayor liberación de gastrina, que a su vez aumenta la secreción de ácido gástrico . Con fines comparativos, también probaron la tiramina y la N,N-dimetiltiramina ( hordenina ) en su ensayo, encontrando que 83 nM/kg (que corresponden a 12,5 μg/kg de NMT) de cada compuesto mejoraba la liberación de gastrina en ~ 58% para NMT, ~ 24% para tiramina y ~ 60% para hordenina.
Para probar las indicaciones de estudios anteriores de que, al igual que la propia tiramina, la NMT producía la mayoría de sus efectos farmacológicos al estimular la liberación de noradrenalina (NE), Koda y sus colaboradores investigaron la acción de la NMT sobre los adrenoceptores α2 , que están involucrados en la regulación de la NE. Estos investigadores encontraron que la NMT competía con la unión de [ 3H ]-p-aminoclonidina a los receptores α2 del cerebro de rata con una CI50 de ~5,5 x 10−6 M. Al igual que otros antagonistas α2 , también se encontró que la NMT, en dosis ip de 20 o 100 mg/kg, inhibía la hipermotilidad inducida en ratones por (−)- escopolamina de una manera dependiente de la dosis. Las mismas dosis de NMT en ausencia de escopolamina no tuvieron efectos significativos sobre la actividad locomotora en ratones. [23]
Dado que el NMT es uno de los componentes de la naranja amarga, Citrus aurantium , Mercader y sus colaboradores estudiaron sus efectos sobre la lipólisis y descubrieron que inhibía la lipólisis en ratas. El NMT (al igual que la tiramina) tampoco logró estimular la lipólisis en los adipocitos humanos a una concentración de 10 μg/ml (es decir, ~ 66 μM/L); incluso a ≥ 100 μg/ml, el NMT y la tiramina indujeron solo el 20% de la lipólisis producida por el fármaco estándar de referencia, la isoprenalina . [24]
El NMT es un sustrato competitivo para la MAO . [25]
Se sabe que es un estimulador de las secreciones pancreáticas en ratas. [26]
Se ha demostrado que NMT es un agonista del TAAR1 , de manera similar a su compuesto original, la tiramina . [27] La CE50 de NMT en el receptor TAAR1 humano fue de ~ 2 μM, en comparación con ~ 1 μM para la tiramina . [28]
Farmacocinética
La farmacocinética de la NMT se ha estudiado en conejos y ratones utilizando un fármaco que había sido radiomarcado con tritio en C-3 y C-5 en el anillo de benceno. Se midieron las concentraciones plasmáticas en los conejos, mientras que la distribución, el metabolismo y la excreción se determinaron en los ratones. Después de la administración intravenosa a los conejos, se encontró que el T 1/2 de la fase α era de 0,3 minutos y el T 1/2 de la fase β era de 5,6 minutos. Estas cifras indicaban una distribución rápida de la sangre a los tejidos y una semivida plasmática muy corta. En los 2 minutos posteriores a la inyección, se detectaron niveles significativos de radiactividad en todos los tejidos examinados, siendo las cantidades más altas en el riñón y el hígado. No quedó radiactividad detectable en el plasma después de 30 minutos. Se encontró algo de NMT en los cerebros de los ratones tratados con el fármaco, lo que indica que una pequeña cantidad cruzó la barrera hematoencefálica . ~ 80% de la dosis administrada se recuperó de la orina de los ratones en 1 hora. [29]
Toxicología
La DL50 de la sal de HCl de NMT (ratón; ip) = 227 mg/kg. [18] Otro estudio de toxicidad aguda de NMT (bajo el código de la compañía Sterling-Winthrop "WIN 5582") encontró que tenía una DL50 = 275 mg/kg, después de la administración intravenosa a ratones. [30]
Véase también
Referencias
- ^ abcd Broadley KJ (marzo de 2010). "Los efectos vasculares de las trazas de aminas y anfetaminas". Farmacología y terapéutica . 125 (3): 363–375. doi :10.1016/j.pharmthera.2009.11.005. PMID 19948186.
- ^ abcd Lindemann L, Hoener MC (mayo de 2005). "Un renacimiento de las aminas traza inspirado en una nueva familia de GPCR". Tendencias en ciencias farmacológicas . 26 (5): 274–281. doi :10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ ab TA Smith (1977). "Fenetilamina y compuestos relacionados en plantas". Fitoquímica 16 9 – 18.
- ^ Metabolismo de la tirosina - Vía de referencia Archivado el 26 de julio de 2019 en Wayback Machine , Enciclopedia de Kyoto de Genes y Genomas (KEGG)
- ^ TA Stewart y I. Stewart (1970) Lloydia 33 244-254.
- ^ desde S. Kirkwood y L. Marion (1950) J. Am. Chem. Soc. 72 2522-2524.
- ^ WD McFarlane (1965). "Aminas y fenoles derivados de la tirosina en el mosto y la cerveza". Proc. Europ. Brew. Conv. 387.
- ^ ab B. Poocharoen (1983), Tesis de doctorado, Universidad Estatal de Oregón. http://ir.library.oregonstate.edu/xmlui/handle/1957/27227
- ^ El nivel de NMT en la cebada no germinada es generalmente insignificante, pero aumenta a medida que avanza la germinación (la primera parte del proceso de "malteado").
- ^ BA Clement, CM Goff y TDA Forbes (1998). "Aminas y alcaloides tóxicos de Acacia rigidula ". Fitoquímica 49 1377-1380.
- ^ BA Clement, CM Goff y TDA Forbes (1997) Fitoquímica 46 249-254.
- ^ ab CS Evans, EA Bell y ES Johnson (1979) Fitoquímica 18 2022-2023.
- ^ BC Nelson y otros (2007) J. Agric. Fd. Chem. 55 9769-9775.
- ^ Wang X, Li J, Dong G, Yue J (febrero de 2014). "Los sustratos endógenos del CYP2D cerebral". Revista Europea de Farmacología . 724 : 211–218. doi :10.1016/j.ejphar.2013.12.025. PMID 24374199.
- ^ abc GS Walpole (1910) J. Chem. Soc., Trad. 97 941-999.
- ^ UA Corti (1949) Helv. Chim. Acta 32 681-686.
- ^ T. Kappe y MD Armstrong (1965) J. Med. Chem. 8 368-374.
- ^ desde WH Hartung (1945) Ind. Eng. Química. 37 126-137.
- ^ AJ Hjort (1934) J. Pharmacol. Exp. Ahí. 101-112 .
- ^ ab BJ Camp (1970) Soy. J. Veterinario. Res. 31 755-762.
- ^ J. W. Daly, CR Creveling y B. Witkop (1966) J. Med. Chem. 9 273-280.
- ^ Y. Yokoo y otros (1999) Alcohol & Alcoholism 34 161-168. http://alcalc.oxfordjournals.org/content/34/2/161.full.pdf+html
- ^ H. Koda y col. (1999) Japón. J. Farmacol. 81 313-315.
- ^ J. Mercader, E. Wanecq, J. Chen y C. Carpene (2011) J. Physiol. Biochem. 67 443-452.
- ^ W. Kemmerling (1996) Z. Naturforsch. C 51 59-64.
- ^ Tsutsumi, E.; Kanai, S.; Ohta, M.; Suwa, Y.; Miyasaka, K., Eri; Kanai, Setsuko; Ohta, Minoru; Suwa, Yoshihide; Miyasaka, Kyoko (2010). "Efecto estimulante de la N-metiltiramina, un congénere de la cerveza, sobre la secreción pancreática en ratas conscientes". Alcoholismo: investigación clínica y experimental . 34 (Supl 1): S14–S17. doi :10.1111/j.1530-0277.2009.00893.x. PMID 19298333.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Lindemann, L.; Hoener, MC (2005). "Un renacimiento en las aminas traza inspirado en una nueva familia de GPCR". Tendencias en Ciencias Farmacológicas . 26 (5): 274–281. doi :10.1016/j.tips.2005.03.007. PMID 15860375.
- ^ L. Lindemann y col. (2005) Genómica 85 372-385.
- ^ H. Hai, Z.-G. Guo y J.-M. Wang (1989) Zhougguo Yao Li Xue Bao (Acta Pharmacologica Sinica) 10 41-45. http://www.chinaphar.com/1671-4083/10/41.pdf
- ^ AM Lands y JI Grant (1952). "La acción vasopresora y la toxicidad de los derivados de ciclohexiletilamina". J. Pharmacol. Exp. Ther. 106 341-345.


