Buspirona
 | |
 | |
| Datos clínicos | |
|---|---|
| Pronunciación | / ˈbjuːspɪrooʊn / ( BEW - spi - rohn ) |
| Nombres comerciales | Buspar |
| Otros nombres | MJ 9022-1 [1] |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a688005 |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Por la boca |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | 3,9% [3] |
| Unión de proteínas | 86–95% [4] |
| Metabolismo | Hígado (a través de CYP3A4 ) [8] [9] |
| Metabolitos | 5-OH-Buspirona; 6-OH-Buspirona; 8-OH-Buspirona; 1-PPInformación sobre herramientas 1-(2-pirimidinil)piperazina[5] [6] [7] |
| Vida media de eliminación | 2,5 horas [8] |
| Excreción | Orina : 29–63% [4] Heces : 18–38% [4] |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.048.232 |
| Datos químicos y físicos | |
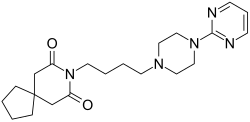
| Fórmula | C21H31N5O2 |
| Masa molar | 385,512 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| (verificar) | |
La buspirona , que se vende bajo la marca Buspar , entre otras, es un ansiolítico , un medicamento utilizado principalmente para tratar los trastornos de ansiedad , en particular el trastorno de ansiedad generalizada (TAG). [10] [11] Es un agonista parcial del receptor de serotonina 5-HT 1A , que aumenta la acción de los receptores de serotonina en el cerebro. [3] Se toma por vía oral y tarda entre dos y seis semanas en ser completamente eficaz. [10] [11]
Los efectos secundarios comunes de la buspirona incluyen náuseas , dolores de cabeza , mareos y dificultad para concentrarse. [10] [12] Los efectos secundarios graves pueden incluir trastornos del movimiento , síndrome serotoninérgico y convulsiones . [12] Su uso en el embarazo parece ser seguro, pero no se ha estudiado bien, y su uso durante la lactancia no se ha estudiado bien. [12] [13]
La buspirona se desarrolló en 1968 y se aprobó para uso médico en los Estados Unidos en 1986. [10] [11] Está disponible como medicamento genérico . [12] En 2022, fue el 54.º medicamento más recetado en los Estados Unidos, con más de 12 millones de recetas. [14] [15]
Usos médicos
Ansiedad
La buspirona se utiliza para el tratamiento a corto y largo plazo de los trastornos de ansiedad o de los síntomas de ansiedad. [16] [17] [18] [19] [20] Generalmente se prefiere a las benzodiazepinas porque no activa los receptores que hacen que medicamentos como el alprazolam sean adictivos. [11]
La buspirona no tiene efectos ansiolíticos inmediatos y, por lo tanto, tiene un inicio de acción retardado ; su efectividad clínica completa puede requerir de 2 a 4 semanas para manifestarse. [21] Se ha demostrado que el fármaco es igualmente eficaz en el tratamiento del trastorno de ansiedad generalizada (TAG) que las benzodiazepinas, entre ellas el diazepam , el alprazolam , el lorazepam y el clorazepato . [3] No se sabe que la buspirona sea eficaz en el tratamiento de otros trastornos de ansiedad además del TAG. [22]
Otros usos
Disfunción sexual
Hay cierta evidencia de que la buspirona por sí sola puede ser útil en el tratamiento del trastorno del deseo sexual hipoactivo (TDSH) en mujeres. [23] La buspirona también puede ser eficaz en el tratamiento de la disfunción sexual inducida por antidepresivos . [11] [24] [25]
Misceláneas
La buspirona no es eficaz como tratamiento para la abstinencia de benzodiazepinas , la abstinencia de barbitúricos o la abstinencia de alcohol / delirium tremens . [26]
Los antidepresivos ISRS y IRSN como la paroxetina y la venlafaxina pueden causar síndrome reversible de dolor mandibular/espasmo mandibular (aunque no es común), y la buspirona parece tener éxito en el tratamiento del bruxismo en el apretamiento mandibular inducido por ISRS/IRSN. [27] [28]
Contraindicaciones
La buspirona tiene estas contraindicaciones: [29] [30]
- Hipersensibilidad a la buspirona
- Acidosis metabólica , como en la diabetes
- No debe utilizarse con inhibidores de la MAO.
- Función hepática y/o renal gravemente comprometida
Efectos secundarios
Los efectos secundarios conocidos asociados con la buspirona incluyen mareos , dolores de cabeza , náuseas , tinnitus y parestesia . [3] La buspirona es relativamente bien tolerada y no está asociada con sedación , deterioro cognitivo y psicomotor , relajación muscular , dependencia física o efectos anticonvulsivos . [3] Además, la buspirona no produce euforia [21] y no es una droga de abuso . [17]
Sobredosis
La buspirona parece ser relativamente benigna en casos de sobredosis de un solo fármaco , aunque no parece haber datos definitivos disponibles sobre este tema. [31] En un ensayo clínico , se administró buspirona a voluntarios varones sanos en una dosis de 375 mg/día y produjo efectos secundarios que incluyeron náuseas , vómitos , mareos , somnolencia , miosis y malestar gástrico . [16] [17] [19] En los primeros ensayos clínicos, se administró buspirona en dosis incluso tan altas como 2400 mg/día, observándose acatisia , temblor y rigidez muscular . [32] Las sobredosis deliberadas con 250 mg y hasta 300 mg de buspirona han provocado somnolencia en aproximadamente el 50% de los individuos. [32] Se ha informado de una muerte por ingestión concomitante de 450 mg de buspirona con alprazolam , diltiazem , alcohol y cocaína . [32]
Interacciones
Se ha demostrado in vitro que la buspirona se metaboliza por la enzima CYP3A4 . [9] Este hallazgo es consistente con las interacciones in vivo observadas entre la buspirona y estos inhibidores o inductores del citocromo P450 3A4 (CYP3A4), entre otros: [29]
- Itraconazol : Aumento del nivel plasmático de buspirona.
- Rifampicina : Disminución de los niveles plasmáticos de buspirona.
- Nefazodona : Aumento de los niveles plasmáticos de buspirona.
- Haloperidol : Aumento de los niveles plasmáticos de buspirona.
- Carbamazepina : Disminución de los niveles plasmáticos de buspirona.
- Pomelo: aumenta significativamente los niveles plasmáticos de buspirona. [33] Ver interacciones entre pomelo y medicamentos .
- Fluvoxamina : aumenta moderadamente los niveles plasmáticos de buspirona. [34]
Se ha informado de presión arterial elevada cuando se ha administrado buspirona a pacientes que tomaban inhibidores de la monoaminooxidasa (IMAO). [29]
Farmacología
Farmacodinamia
| Sitio | K yo (nM) | Acción | Especies | Árbitro |
|---|---|---|---|---|
| 5-HT 1A | 3,98–214 21 (mediana) | Agonista | Humano | [35] [36] |
| 5-HT 1B | >100.000 | Agonista? [37] | Rata | [38] |
| 5-HT 1D | 22.000–42.700 | Agonista? [37] | Humano | [39] [40] |
| 5-HT2A | Antagonista | Humano | ||
| 5- HT2C | 1.100–6.026 | Antagonista? [37] | Rata/cerdo | [38] |
| 5- HT7 | 375–381 840 | Antagonista? [37] | Rata humana | [41] [42] [43] |
| alfa 1 | 1.000 | Antagonista | Rata | [38] |
| alfa 2 | 6.000 | Antagonista | Rata | [44] |
| alfa 2A | 7.3 ( 1-PP)Información sobre herramientas 1-(2-pirimidinil)piperazina) | Antagonista | Humano | [38] |
| β | 8.800 | Antagonista | Rata | [38] |
| D1 | 33.000 | Antagonista | Rata | [38] |
| D2 | 484 240 | Antagonista | Rata humana | [45] [38] |
| D3 | 98 | Antagonista | Humano | [45] |
| D4 | 29 | Antagonista | Humano | [45] |
| mAChInformación sobre herramientas Receptor muscarínico de acetilcolina | 38.000 | ? | Rata | [38] |
| GABA A ( BDZ ) | >100.000 | - | Rata | [38] |
| Los valores se expresan en K i (nM). Cuanto menor sea el valor, más fuertemente se une el fármaco al sitio. | ||||
La buspirona actúa como un agonista parcial del receptor de serotonina 5-HT 1A con alta afinidad . [3] [38] Es un agonista parcial tanto de los receptores presinápticos 5-HT 1A , que son autorreceptores inhibidores , como de los receptores postsinápticos 5-HT 1A . [3] Se cree que los principales efectos de la buspirona están mediados por su interacción con el receptor presináptico 5-HT 1A , reduciendo así la activación de las neuronas productoras de serotonina. [3] La buspirona también parece tener menores afinidades por los receptores de serotonina 5-HT 2A , 5-HT 2B , 5-HT 2C , 5-HT 6 , 5-HT 7 donde probablemente actúa como antagonista. [37]
Además de unirse a los receptores de serotonina, la buspirona es un antagonista del receptor de dopamina D 2 con afinidad débil. [3] [38] Bloquea preferentemente los autorreceptores presinápticos inhibidores D 2 y antagoniza los receptores postsinápticos D 2 solo en dosis más altas. [3] De acuerdo con esto, se ha descubierto que la buspirona aumenta la neurotransmisión dopaminérgica en la vía nigroestriatal en dosis bajas, mientras que en dosis más altas, los receptores postsinápticos D 2 se bloquean y se observan efectos antidopaminérgicos como hipoactividad y estereotipia reducida , aunque notablemente no catalepsia , en animales. [3] También se ha descubierto que la buspirona se une con mucha mayor afinidad a los receptores de dopamina D 3 y D 4 , donde es de manera similar un antagonista. [45]
Un metabolito principal de la buspirona, la 1-(2-pirimidinil)piperazina (1-PP), se encuentra en concentraciones circulantes más altas que la propia buspirona y se sabe que actúa como un potente antagonista del receptor α2 - adrenérgico. [44] [46] [47] Este metabolito puede ser responsable de la mayor actividad noradrenérgica y dopaminérgica observada con la buspirona en animales. [46] [48] La buspirona también tiene una afinidad muy débil y probablemente clínicamente sin importancia por el receptor α1 - adrenérgico . [38] [49] Sin embargo, se ha informado que la buspirona ha demostrado una "eficacia intrínseca significativa y selectiva" en el receptor α1 - adrenérgico expresado de una "manera dependiente del tejido y de la especie". [49]
A diferencia de las benzodiazepinas, la buspirona no interactúa con el complejo receptor GABA A. [3] [50]
Farmacocinética
La buspirona tiene una biodisponibilidad oral baja del 3,9% en relación con la inyección intravenosa debido al extenso metabolismo de primer paso . [3] El tiempo hasta alcanzar los niveles plasmáticos máximos después de la ingestión es de 0,9 a 1,5 horas. [3] Se informa que tiene una vida media de eliminación de 2,8 horas, [3] aunque una revisión de 14 estudios encontró que la vida media terminal media oscilaba entre 2 y 11 horas, y un estudio incluso informó una vida media terminal de 33 horas. [5] La buspirona se metaboliza principalmente por CYP3A4 , y se han observado interacciones farmacológicas importantes con inhibidores e inductores de esta enzima . [8] [9] Los principales metabolitos de la buspirona incluyen 5-hidroxibuspirona, 6-hidroxibuspirona, 8-hidroxibuspirona y 1-PP. [51] [5] [6] [7] Se ha identificado a la 6-hidroxibuspirona como el metabolito hepático predominante de la buspirona, con niveles plasmáticos que son 40 veces mayores que los de la buspirona después de la administración oral de buspirona a humanos. [6] El metabolito es un agonista parcial de alta afinidad del receptor 5-HT 1A (K i = 25 nM) de manera similar a la buspirona, y ha demostrado ocupación del receptor 5-HT 1A in vivo . [6] Como tal, es probable que desempeñe un papel importante en los efectos terapéuticos de la buspirona. [6] También se ha descubierto que el 1-PP circula a niveles más altos que los de la propia buspirona y puede desempeñar de manera similar un papel significativo en los efectos clínicos de la buspirona. [46] [48]

Química
La buspirona es un miembro de la clase química de la azapirona y consta de componentes azaspirodecanodiona y pirimidinilpiperazina unidos entre sí por una cadena de butilo .
Análogos
Los análogos estructurales de la buspirona incluyen otras azapironas como gepirona , ipsapirona , perospirona y tandospirona . [55]
Se han registrado varios análogos. [56]
Síntesis
También se han descrito varios métodos de síntesis. [57] [58] [59] Un método comienza con la alquilación de 1-(2-pirimidil)piperazina ( 1 ) con 3-cloro-1-cianopropano (4-clorobutironitrilo) ( 2 ) para dar ( 3 ). A continuación, se realiza la reducción del grupo nitrilo mediante hidrogenación catalítica o con hidruro de litio y aluminio (LAH) dando ( 4 ). A continuación, la amina primaria se hace reaccionar con anhídrido 3,3-tetrametilenglutárico ( 5 ) para producir buspirona ( 6 ). [60] [61] [62] [63] [64]

Historia
La buspirona fue sintetizada por primera vez por un equipo de Mead Johnson en 1968 [22] pero no fue patentada hasta 1980. [65] [60] [66] Inicialmente fue desarrollada como un antipsicótico que actuaba sobre el receptor D 2 pero se encontró que era ineficaz en el tratamiento de la psicosis ; entonces fue utilizada como ansiolítico en su lugar. [3] En 1986, Bristol-Myers Squibb obtuvo la aprobación de la FDA para la buspirona en el tratamiento del TAG. [22] [67] La patente expiró en 2001, y la buspirona ahora está disponible como un medicamento genérico .
Sociedad y cultura

Nombres genéricos
La buspirona es la DCITooltip Nombre común internacional, PROHIBICIÓNDescripción emergente Nombre aprobado en Gran Bretaña, flujo de caja descontadoInformación sobre herramientas Denominación Comuna Francesa, y DCITInformación sobre herramientas Denominación Comune Italianade buspirona, mientras que el clorhidrato de buspirona es su USANDescripción emergente Nombre adoptado por Estados Unidos, BANCODescripción emergente Nombre aprobado en Gran Bretaña, y ENEDescripción emergente Nombre aceptado en japonés. [1] [68] [69] [70]
Nombres de marca
La buspirona se vendía principalmente bajo la marca Buspar. [68] [70] Actualmente, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) indica que Buspar ya no se comercializa. [71] En 2010, en respuesta a una petición ciudadana, la FDA determinó que Buspar no se retiraba de la venta por razones de seguridad o eficacia. [72]
Referencias
- ^ ab Elks J (14 de noviembre de 2014). Diccionario de fármacos: datos químicos: datos químicos, estructuras y bibliografías. Springer. pp. 192–. ISBN 978-1-4757-2085-3.
- ^ Anvisa (31 de marzo de 2023). "RDC Nº 784 - Listas de Substâncias Entorpecentes, Psicotrópicas, Precursoras e Outras sob Controle Especial" [Resolución del Consejo Colegiado N° 784 - Listas de Sustancias Estupefacientes, Psicotrópicas, Precursoras y Otras Sustancias Bajo Control Especial] (en portugués brasileño). Diário Oficial da União (publicado el 4 de abril de 2023). Archivado desde el original el 3 de agosto de 2023 . Consultado el 16 de agosto de 2023 .
- ^ abcdefghijklmnop Loane C, Politis M (junio de 2012). "Buspirona: ¿de qué se trata?". Brain Research . 1461 : 111–118. doi :10.1016/j.brainres.2012.04.032. PMID 22608068. S2CID 11734819.
- ^ abc "buspirona (Rx) - BuSpar, Buspirex, más". Referencia de Medscape . WebMD . Consultado el 14 de noviembre de 2013 .
- ^ abc Gammans RE, Mayol RF, LaBudde JA (marzo de 1986). "Metabolismo y disposición de la buspirona". The American Journal of Medicine . 80 (3B): 41–51. doi :10.1016/0002-9343(86)90331-1. PMID 3515929.
- ^ abcde Schatzberg AF, Nemeroff CB (2009). El libro de texto de psicofarmacología de la American Psychiatric Publishing. American Psychiatric Pub. págs. 490–. ISBN 978-1-58562-309-9.
- ^ ab Wong H, Dockens RC, Pajor L, Yeola S, Grace JE, Stark AD, et al. (agosto de 2007). "La 6-hidroxibuspirona es un metabolito activo principal de la buspirona: evaluación de la farmacocinética y la ocupación del receptor de 5-hidroxitriptamina 1A en ratas". Metabolismo y disposición de fármacos . 35 (8): 1387–1392. doi :10.1124/dmd.107.015768. PMID 17494642. S2CID 25558546.
- ^ abc Mahmood I, Sahajwalla C (abril de 1999). "Farmacocinética clínica y farmacodinamia de la buspirona, un fármaco ansiolítico". Farmacocinética clínica . 36 (4): 277–287. doi :10.2165/00003088-199936040-00003. PMID 10320950. S2CID 1102318.
- ^ abcd Zhu M, Zhao W, Jimenez H, Zhang D, Yeola S, Dai R, et al. (abril de 2005). "Metabolismo de buspirona mediado por citocromo P450 3A en microsomas hepáticos humanos". Metabolismo y disposición de fármacos . 33 (4): 500–507. doi :10.1124/dmd.104.000836. PMID 15640381. S2CID 10142905.
- ^ abcd "Monografía de clorhidrato de buspirona para profesionales". Drugs.com .
- ^ abcde Wilson TK, Tripp J (enero de 2018). "Buspirona". StatPearls . PMID 30285372.
- ^ abcd Formulario nacional británico: BNF 76 (76.ª edición). Pharmaceutical Press. 2018. pág. 338. ISBN 9780857113382.
- ^ "Advertencias sobre la buspirona durante el embarazo y la lactancia". Drugs.com .
- ^ "Los 300 mejores de 2022". ClinCalc . Archivado desde el original el 30 de agosto de 2024 . Consultado el 30 de agosto de 2024 .
- ^ "Estadísticas de uso del fármaco buspirona, Estados Unidos, 2013-2022". ClinCalc . Consultado el 30 de agosto de 2024 .
- ^ ab "Buspirone HCL (buspirone hydrochloride) tablet [Watson Laboratories, Inc.]". DailyMed . Watson Laboratories, Inc. Julio de 2013 . Consultado el 14 de noviembre de 2013 .
- ^ abc "Buspar (clorhidrato de buspirona) Tabletas 5 mg y 10 mg INFORMACIÓN DEL PRODUCTO" (PDF) . TGA eBusiness Services . Aspen Pharma Pty Ltd. Enero de 2010 . Consultado el 14 de noviembre de 2013 .
- ^ Rossi S, ed. (2013). Manual de medicamentos australianos (edición de 2013). Adelaida: The Australian Medicines Handbook Unit Trust. ISBN 978-0-9805790-9-3.
- ^ ab "Comprimidos de buspirona de 10 mg". Compendio electrónico de medicamentos . Actavis UK Ltd. 10 de septiembre de 2012. Archivado desde el original el 13 de noviembre de 2013. Consultado el 14 de noviembre de 2013 .
- ^ Comité de Formulario Conjunto. Formulario Nacional Británico (BNF) . Pharmaceutical Press. pág. 224.
- ^ ab Sadock BJ, Sadock VA, Ruiz P (22 de septiembre de 2014). Sinopsis de psiquiatría de Kaplan y Sadock: ciencias del comportamiento/psiquiatría clínica. Wolters Kluwer Health. págs. 3211–. ISBN 978-1-4698-8375-5.
- ^ abc Howland RH (noviembre de 2015). "Buspirona: regreso al futuro". Revista de enfermería psicosocial y servicios de salud mental . 53 (11): 21–24. doi :10.3928/02793695-20151022-01. PMID 26535760.
- ^ Goldstein I, Kim NN, Clayton AH, DeRogatis LR, Giraldi A, Parish SJ, et al. (enero de 2017). "Trastorno del deseo sexual hipoactivo: revisión del panel de consenso de expertos de la Sociedad Internacional para el Estudio de la Salud Sexual de la Mujer (ISSWSH)". Mayo Clinic Proceedings . 92 (1): 114–128. doi : 10.1016/j.mayocp.2016.09.018 . PMID 27916394.
- ^ Trinchieri M, Trinchieri M, Perletti G, Magri V, Stamatiou K, Cai T, et al. (agosto de 2021). "Disfunción eréctil y eyaculatoria asociada al uso de fármacos psicotrópicos: una revisión sistemática". The Journal of Sexual Medicine . 18 (8): 1354–1363. doi :10.1016/j.jsxm.2021.05.016. PMID 34247952. S2CID 235798526.
La buspirona, un ansiolítico no benzodiazepínico, ha demostrado incluso mejorar la función sexual en ciertas personas. Por este motivo, se han propuesto como agentes de aumento (antídotos) o agentes de sustitución en pacientes con disfunción sexual emergente después del tratamiento con antidepresivos.
- ^ Montejo AL, Prieto N, de Alarcón R, Casado-Espada N, de la Iglesia J, Montejo L (octubre de 2019). "Estrategias de tratamiento de la disfunción sexual relacionada con los antidepresivos: un enfoque clínico". Revista de Medicina Clínica . 8 (10): 1640. doi : 10.3390/jcm8101640 . PMC 6832699 . PMID 31591339.
- ^ Sontheimer DL, Ables AZ (marzo de 2001). "¿Es eficaz el tratamiento con imipramina o buspirona en pacientes que desean interrumpir el uso de benzodiazepinas a largo plazo?". The Journal of Family Practice . 50 (3): 203. PMID 11252203.
- ^ Garrett AR, Hawley JS (abril de 2018). "Bruxismo asociado a ISRS: una revisión sistemática de informes de casos publicados". Neurología. Práctica clínica . 8 (2): 135–141. doi :10.1212/CPJ.0000000000000433. PMC 5914744 . PMID 29708207.
- ^ Prisco V, Iannaccone T, Di Grezia G (1 de abril de 2017). "Uso de buspirona en el bruxismo del sueño inducido por inhibidores selectivos de la recaptación de serotonina". Psiquiatría europea . Resumen del 25.º Congreso Europeo de Psiquiatría. 41 : S855. doi :10.1016/j.eurpsy.2017.01.1701. S2CID 148816505.
- ^ abc "Monografía de buspirona". Drugs.com . Consultado el 27 de agosto de 2011 .
- ^ Geddes J, Gelder MG, Mayou R (2005). Psiquiatría. Oxford [Oxfordshire]: Oxford University Press. pág. 237. ISBN 978-0-19-852863-0.
- ^ Fulton B, Brogden RN (1997). "Buspirona". Medicamentos para el sistema nervioso central . 7 (1): 68–88. doi :10.2165/00023210-199707010-00007. ISSN 1172-7047. S2CID 57668523.
- ^ abc Dart RC (2004). Toxicología médica. Lippincott Williams & Wilkins. págs. 886–. ISBN 978-0-7817-2845-4.
- ^ Lilja JJ, Kivistö KT, Backman JT, Lamberg TS, Neuvonen PJ (diciembre de 1998). "El jugo de pomelo aumenta sustancialmente las concentraciones plasmáticas de buspirona". Farmacología clínica y terapéutica . 64 (6): 655–660. doi :10.1016/S0009-9236(98)90056-X. PMID 9871430. S2CID 22009095.
- ^ Lamberg TS, Kivistö KT, Laitila J, Mårtensson K, Neuvonen PJ (1998). "El efecto de la fluvoxamina en la farmacocinética y farmacodinámica de la buspirona". Revista Europea de Farmacología Clínica . 54 (9–10): 761–766. doi :10.1007/s002280050548. PMID 9923581. S2CID 21939719.
- ^ ab Roth BL , Driscol J. "PDSP Ki Database". Programa de detección de drogas psicoactivas (PDSP) . Universidad de Carolina del Norte en Chapel Hill y el Instituto Nacional de Salud Mental de los Estados Unidos . Consultado el 14 de agosto de 2017 .
- ^ Boess FG, Martin IL (1994). "Biología molecular de los receptores 5-HT". Neurofarmacología . 33 (3–4): 275–317. doi :10.1016/0028-3908(94)90059-0. PMID 7984267. S2CID 35553281.
- ^ abcde Sato H, Skelin I, Diksic M (julio de 2010). "El tratamiento crónico con buspirona disminuye la densidad de los receptores 5-HT1B y el transportador de serotonina, pero aumenta la densidad de los receptores 5-HT2A en el modelo de depresión en ratas bulbectomizadas: un estudio autorradiográfico". Brain Research . 1345 : 28–44. doi :10.1016/j.brainres.2010.05.054. PMID 20501324. S2CID 22979155.
- ^ abcdefghijkl Hamik A, Oksenberg D, Fischette C, Peroutka SJ (julio de 1990). "Análisis de las interacciones de la tandospirona (SM-3997) con los sitios de unión de los receptores de neurotransmisores". Psiquiatría biológica . 28 (2): 99–109. doi : 10.1016/0006-3223(90)90627-e . PMID 1974152. S2CID 25608914.
- ^ Peroutka SJ, Switzer JA, Hamik A (1989). "Identificación de sitios de unión de 5-hidroxitriptamina 1D en membranas cerebrales humanas". Synapse . 3 (1): 61–66. doi :10.1002/syn.890030109. PMID 2521959. S2CID 23503235.
- ^ Waeber C, Schoeffter P, Palacios JM, Hoyer D (junio de 1988). "Farmacología molecular de los sitios de reconocimiento de 5-HT1D: estudios de unión de radioligandos en membranas cerebrales humanas, porcinas y de ternera". Archivos de farmacología de Naunyn-Schmiedeberg . 337 (6): 595–601. doi :10.1007/bf00175783. PMID 2975354. S2CID 21344978.
- ^ Lovenberg TW, Baron BM, de Lecea L, Miller JD, Prosser RA, Rea MA, et al. (septiembre de 1993). "Un nuevo receptor de serotonina activador de la adenilato ciclasa (5-HT7) implicado en la regulación de los ritmos circadianos de los mamíferos". Neuron . 11 (3): 449–458. doi :10.1016/0896-6273(93)90149-l. PMID 8398139. S2CID 28729004.
- ^ Ruat M, Traiffort E, Leurs R, Tardivel-Lacombe J, Diaz J, Arrang JM, et al. (septiembre de 1993). "Clonación molecular, caracterización y localización de un receptor de serotonina de alta afinidad (5-HT7) que activa la formación de AMPc". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 90 (18): 8547–8551. Bibcode :1993PNAS...90.8547R. doi : 10.1073/pnas.90.18.8547 . PMC 47394 . PMID 8397408.
- ^ Perry CK, Casey AB, Felsing DE, Vemula R, Zaka M, Herrington NB, et al. (febrero de 2020). "Síntesis de nuevos análogos de 2-aminotetralina 5-sustituida: afinidad del receptor acoplado a proteína G 5-HT1A y 5-HT7, 3D-QSAR y modelado molecular". Química bioorgánica y medicinal . 28 (3): 115262. doi : 10.1016/j.bmc.2019.115262 . PMID 31882369. S2CID 209498915.
- ^ ab Blier P, Curet O, Chaput Y, de Montigny C (julio de 1991). "Tandospirona y su metabolito, 1-(2-pirimidinil)-piperazina--II. Efectos de la administración aguda de 1-PP y la administración a largo plazo de tandospirona sobre la neurotransmisión noradrenérgica". Neurofarmacología . 30 (7): 691–701. doi :10.1016/0028-3908(91)90176-c. PMID 1681447. S2CID 44297577.
- ^ abcd Bergman J, Roof RA, Furman CA, Conroy JL, Mello NK, Sibley DR, et al. (marzo de 2013). "Modificación de la autoadministración de cocaína mediante buspirona (Buspar): posible implicación de los receptores de dopamina D3 y D4". The International Journal of Neuropsychopharmacology . 16 (2): 445–458. doi :10.1017/S1461145712000661. PMC 5100812 . PMID 22827916.
- ^ abc Tunnicliff G (septiembre de 1991). "Base molecular de la acción ansiolítica de la buspirona". Farmacología y toxicología . 69 (3): 149–156. doi :10.1111/j.1600-0773.1991.tb01289.x. PMID 1796057.
- ^ Zuideveld KP, Rusiç-Pavletiç J, Maas HJ, Peletier LA, Van der Graaf PH, Danhof M (diciembre de 2002). "Modelado farmacocinético-farmacodinámico de buspirona y su metabolito 1-(2-pirimidinil)-piperazina en ratas". Revista de farmacología y terapéutica experimental . 303 (3): 1130–1137. doi :10.1124/jpet.102.036798. PMID 12438536. S2CID 14139919.
- ^ ab Fava M (2007). "La combinación de buspirona y bupropión en el tratamiento de la depresión". Psicoterapia y psicosomática . 76 (5): 311–312. doi :10.1159/000104708. PMID 17700052. S2CID 46284917.
- ^ ab Stern TA, Fava M, Wilens TE, Rosenbaum JF (27 de abril de 2015). Massachusetts General Hospital Psychopharmacology and Neurotherapeutics E-Book. Elsevier Health Sciences. págs. 29–. ISBN 978-0-323-41323-7.
- ^ Nutt DJ, Ballenger JC (15 de abril de 2008). Trastornos de ansiedad. John Wiley & Sons. pp. 395–. ISBN 978-0-470-98683-7.
- ^ Zhu Y, Chen G, Zhang K, Chen C, Chen W, Zhu M, et al. (noviembre de 2022). "Identificación de puntos blandos metabólicos de alto rendimiento en microsomas hepáticos mediante LC/UV/MS: aplicación de un enfoque de tiempo de incubación de una sola variable". Moléculas . 27 (22): 8058. doi : 10.3390/molecules27228058 . PMC 9693510 . PMID 36432161.
- ^ Zhu Y, Chen G, Zhang K, Chen C, Chen W, Zhu M, et al. (noviembre de 2022). "Identificación de puntos blandos metabólicos de alto rendimiento en microsomas hepáticos mediante LC/UV/MS: aplicación de un enfoque de tiempo de incubación de una sola variable". Moléculas . 27 (22): 8058. doi : 10.3390/molecules27228058 . PMC 9693510 . PMID 36432161.
- ^ Dockens RC, Salazar DE, Fulmor IE, Wehling M, Arnold ME, Croop R (noviembre de 2006). "Farmacocinética de un metabolito activo de buspirona recientemente identificado después de la administración de buspirona en su rango de dosis terapéutica". Journal of Clinical Pharmacology . 46 (11): 1308–1312. doi :10.1177/0091270006292250. PMID 17050795. S2CID 25050964.
- ^ Jajoo HK, Mayol RF, LaBudde JA, Blair IA (1989). "Metabolismo del fármaco ansiolítico buspirona en sujetos humanos". Metabolismo y disposición de fármacos . 17 (6): 634–640. PMID 2575499.
- ^ Taylor DP, Moon SL (julio de 1991). "Buspirona y compuestos relacionados como ansiolíticos alternativos". Neuropéptidos . 19 (Supl): 15–19. doi :10.1016/0143-4179(91)90078-w. PMID 1679210. S2CID 13730683.
- ^ Yevich JP, Temple DL, New JS, Taylor DP, Riblet LA (febrero de 1983). "Análogos de buspirona. 1. Relaciones estructura-actividad en una serie de derivados de N-aril- y heteroarilpiperazina". Journal of Medicinal Chemistry . 26 (2): 194–203. doi :10.1021/jm00356a014. PMID 6131130. S2CID 28619843.
- ^ Cybulski J, Chilmonczyk Z, Szelejewski W, Wojtasiewicz K, Wróbel JT (1992). "Una síntesis eficiente de buspirona y sus análogos". Archiv der Pharmazie . 325 (5): 313–315. doi :10.1002/ardp.19923250513. S2CID 83676454.
- ^ Kuo DL (1993). "Síntesis de buspirona y gepirona catalizada por Pd(0)". Heterocycles . 36 (7): 1463–1469. doi :10.3987/COM-93-6357.
- ^ Mou J, Zong ZM, Wei XY (agosto de 2008). "Síntesis sencilla de buspirona ansiolítica". Preparaciones y procedimientos orgánicos internacionales . 40 (4): 391–394. doi :10.1080/00304940809458099. eISSN 1945-5453. ISSN 0030-4948. S2CID 95124245.
- ^ ab Allen LE, Ferguson HC, Kissel JW (mayo de 1972). "Agentes psicosedantes. 2. 8-(4-Substituted 1-piperazinylalquil)-8-azaspiro(4.5)decano-7,9-dionas". Journal of Medicinal Chemistry . 15 (5): 477–479. doi :10.1021/jm00275a009. PMID 5035267.
- ^ DE2057845 idem Y Wu, J Rayburn, patente estadounidense 3.717.634 (1973 de Mead Johnson ).
- ^ US 3907801, Wu YH, Rayburn JW, expedido en 1975, asignado a Mead Johnson
- ^ US 3976776, Wu YH, Rayburn JW, expedido en 1976, asignado a Mead Johnson
- ^ US 4810789, Behme RJ, Kensler TT, Mikolasek DG, expedido en 1989, asignado a Bristol Myers
- ^ US 4182763, Casten GP, McKinney GR, Newton RE, Tompkins EC, Weikel Jr JH, "Método antiansiedad con buspirona", publicado el 8 de enero de 1980, asignado a Mead Johnson & Co. y Bristol-Meyers Co.
- ^ US 3907801, Hua WY, Warren RJ, "N-[(4-piridil-piperazino)-alquil]-azaespiroalcanodionas", publicada el 23 de septiembre de 1975, asignada a Mead_Johnson
- ^ "Aprobación de entrada de nueva molécula tipo 1" (PDF) . Administración Federal de Medicamentos de los Estados Unidos. 9 de septiembre de 1986.
- ^ ab Index Nominum 2000: Directorio internacional de medicamentos. Taylor & Francis. Enero de 2000. Págs. 149–. ISBN 978-3-88763-075-1.
- ^ Morton IK, Hall JM (6 de diciembre de 2012). Diccionario conciso de agentes farmacológicos: propiedades y sinónimos. Springer Science & Business Media. pp. 57–. ISBN 978-94-011-4439-1.
- ^ ab "Buspirona". Drugs.com .
- ^ "Medicamentos@FDA: Productos farmacéuticos aprobados por la FDA". Administración de Alimentos y Medicamentos .
- ^ "Determinación de que los comprimidos de buspar (clorhidrato de buspirona), de 10 miligramos, 15 miligramos y 30 miligramos, no se retiraron de la venta por razones de seguridad o eficacia". Registro Federal . 19 de octubre de 2010 . Consultado el 20 de septiembre de 2019 .


