Catálisis


La catálisis ( / k ə ˈ t æ l ə s ɪ s / ) es el aumento de la velocidad de una reacción química debido a una sustancia añadida conocida como catalizador [1] [2] ( / ˈ k æ t əl ɪ s t / ). Los catalizadores no son consumidos por la reacción y permanecen inalterados después de ella. [3] Si la reacción es rápida y el catalizador se recicla rápidamente, a menudo bastan cantidades muy pequeñas de catalizador; [4] la mezcla, el área superficial y la temperatura son factores importantes en la velocidad de reacción. Los catalizadores generalmente reaccionan con uno o más reactivos para formar intermediarios que posteriormente dan el producto de reacción final, en el proceso de regeneración del catalizador.
El aumento de la velocidad se produce porque el catalizador permite que la reacción se produzca mediante un mecanismo alternativo que puede ser mucho más rápido que el mecanismo no catalizado. Sin embargo, el mecanismo no catalizado sigue siendo posible, de modo que la velocidad total (catalizada más no catalizada) solo puede aumentar en presencia del catalizador y nunca disminuir. [5]
La catálisis puede clasificarse como homogénea , cuyos componentes se encuentran dispersos en la misma fase (normalmente gaseosa o líquida) que el reactivo, o heterogénea , cuyos componentes no se encuentran en la misma fase. Las enzimas y otros biocatalizadores suelen considerarse una tercera categoría.
La catálisis es omnipresente en la industria química de todo tipo. [6] Se estima que el 90% de todos los productos químicos producidos comercialmente involucran catalizadores en alguna etapa del proceso de su fabricación.
El término "catalizador" se deriva del griego καταλύειν , kataluein , que significa "aflojar" o "desatar". El concepto de catálisis fue inventado por la química Elizabeth Fulhame , basándose en su novedoso trabajo en experimentos de oxidación-reducción. [7] [8]
Principios generales
Ejemplo
Un ejemplo ilustrativo es el efecto de los catalizadores para acelerar la descomposición del peróxido de hidrógeno en agua y oxígeno :
- 2H2O2 → 2H2O + O2
Esta reacción se produce porque los productos de reacción son más estables que el compuesto de partida, pero esta descomposición es tan lenta que existen soluciones de peróxido de hidrógeno disponibles comercialmente. En presencia de un catalizador como el dióxido de manganeso, esta reacción se produce mucho más rápidamente. Este efecto se observa fácilmente por la efervescencia del oxígeno. [9] El catalizador no se consume en la reacción y puede recuperarse sin cambios y reutilizarse indefinidamente. En consecuencia, se dice que el dióxido de manganeso cataliza esta reacción. En los organismos vivos, esta reacción es catalizada por enzimas (proteínas que sirven como catalizadores) como la catalasa .
Otro ejemplo es el efecto de los catalizadores sobre la contaminación del aire y la reducción de la cantidad de monóxido de carbono. El desarrollo de catalizadores activos y selectivos para la conversión de monóxido de carbono en productos deseables es una de las funciones más importantes de los catalizadores. El uso de catalizadores para la hidrogenación de monóxido de carbono ayuda a eliminar este gas tóxico y también a obtener materiales útiles. [10]
Unidades
La unidad derivada del SI para medir la actividad catalítica de un catalizador es el katal , que se cuantifica en moles por segundo. La productividad de un catalizador se puede describir mediante el número de recambio (o TON) y la actividad catalítica mediante la frecuencia de recambio (TOF), que es el TON por unidad de tiempo. El equivalente bioquímico es la unidad enzimática . Para obtener más información sobre la eficiencia de la catálisis enzimática, consulte el artículo sobre enzimas .
Mecanismos de reacción catalítica
En general, las reacciones químicas ocurren más rápido en presencia de un catalizador porque el catalizador proporciona un mecanismo de reacción alternativo (vía de reacción) que tiene una energía de activación menor que el mecanismo no catalizado. En los mecanismos catalizados, el catalizador se regenera. [11] [12] [13] [14]
Como ejemplo sencillo que ocurre en fase gaseosa, la reacción 2 SO 2 + O 2 → 2 SO 3 se puede catalizar añadiendo óxido nítrico . La reacción se produce en dos pasos:
- 2 NO + O 2 → 2 NO 2 (determinante de la velocidad)
- NO 2 + SO 2 → NO + SO 3 (rápido)
El catalizador de NO se regenera. La velocidad total es la velocidad del paso lento [14]
- v = 2k 1 [NO] 2 [O 2 ].
Un ejemplo de catálisis heterogénea es la reacción del oxígeno y el hidrógeno en la superficie del dióxido de titanio (TiO 2 , o titania ) para producir agua. La microscopía de efecto túnel mostró que las moléculas experimentan adsorción y disociación . Los átomos de O y H disociados, unidos a la superficie, se difunden juntos. Los estados de reacción intermedios son: HO 2 , H 2 O 2 , luego H 3 O 2 y el producto de reacción ( dímeros de moléculas de agua ), después de lo cual la molécula de agua se desorbe de la superficie del catalizador. [15] [16]
Energética de reacción

Los catalizadores permiten vías de reacción que difieren de las reacciones no catalizadas. Estas vías tienen una energía de activación menor . En consecuencia, más colisiones moleculares tienen la energía necesaria para alcanzar el estado de transición . Por lo tanto, los catalizadores pueden permitir reacciones que de otro modo quedarían bloqueadas o ralentizadas por una barrera cinética. El catalizador puede aumentar la velocidad de reacción o la selectividad, o permitir la reacción a temperaturas más bajas. Este efecto se puede ilustrar con un diagrama de perfil de energía .
En la reacción elemental catalizada , los catalizadores no cambian la extensión de una reacción: no tienen efecto sobre el equilibrio químico de una reacción. La relación entre las velocidades de reacción directa e inversa no se ve afectada (véase también termodinámica ). La segunda ley de la termodinámica describe por qué un catalizador no cambia el equilibrio químico de una reacción. Supongamos que existiera un catalizador que cambiara un equilibrio. La introducción del catalizador en el sistema daría como resultado una reacción para pasar al nuevo equilibrio, produciendo energía. La producción de energía es un resultado necesario ya que las reacciones son espontáneas solo si se produce energía libre de Gibbs , y si no hay barrera de energía, no hay necesidad de un catalizador. Entonces, la eliminación del catalizador también daría como resultado una reacción, produciendo energía; es decir, la adición y su proceso inverso, la eliminación, producirían energía. Por lo tanto, un catalizador que pudiera cambiar el equilibrio sería una máquina de movimiento perpetuo , una contradicción con las leyes de la termodinámica. [17] Por lo tanto, los catalizadores no alteran la constante de equilibrio. (Sin embargo, un catalizador puede cambiar las concentraciones de equilibrio al reaccionar en un paso posterior. Luego se consume a medida que avanza la reacción y, por lo tanto, también es un reactivo. Un ejemplo ilustrativo es la hidrólisis de ésteres catalizada por bases , donde el ácido carboxílico producido reacciona inmediatamente con el catalizador base y, por lo tanto, el equilibrio de la reacción se desplaza hacia la hidrólisis).
El catalizador estabiliza el estado de transición más que el material de partida. Disminuye la barrera cinética al disminuir la diferencia de energía entre el material de partida y el estado de transición. No cambia la diferencia de energía entre los materiales de partida y los productos (barrera termodinámica), ni la energía disponible (esta es proporcionada por el entorno en forma de calor o luz).
Conceptos relacionados
Algunos de los denominados catalizadores son en realidad precatalizadores . Los precatalizadores se convierten en catalizadores en la reacción. Por ejemplo, el catalizador de Wilkinson RhCl(PPh3 ) 3 pierde un ligando de trifenilfosfina antes de entrar en el verdadero ciclo catalítico. Los precatalizadores son más fáciles de almacenar, pero se activan fácilmente in situ . Debido a este paso de preactivación, muchas reacciones catalíticas implican un período de inducción .
En la catálisis cooperativa , las especies químicas que mejoran la actividad catalítica se denominan cocatalizadores o promotores .
En la catálisis en tándem, dos o más catalizadores diferentes se acoplan en una reacción en un solo recipiente.
En la autocatálisis , el catalizador es un producto de la reacción global, a diferencia de todos los demás tipos de catálisis considerados en este artículo. El ejemplo más simple de autocatálisis es una reacción de tipo A + B → 2 B, en uno o en varios pasos. La reacción global es simplemente A → B, de modo que B es un producto. Pero como B también es un reactivo, puede estar presente en la ecuación de velocidad y afectar la velocidad de reacción. A medida que avanza la reacción, la concentración de B aumenta y puede acelerar la reacción como catalizador. En efecto, la reacción se acelera a sí misma o se autocataliza. Un ejemplo es la hidrólisis de un éster como la aspirina a un ácido carboxílico y un alcohol . En ausencia de catalizadores ácidos añadidos, el producto de ácido carboxílico cataliza la hidrólisis.
La catálisis conmutable se refiere a un tipo de catálisis en la que el catalizador puede alternarse entre diferentes estados fundamentales que poseen una reactividad distinta, generalmente mediante la aplicación de un estímulo externo. [18] Esta capacidad de cambiar reversiblemente el catalizador permite el control espaciotemporal sobre la actividad catalítica y la selectividad. Los estímulos externos utilizados para cambiar el catalizador pueden incluir cambios en la temperatura, el pH, la luz, [19] los campos eléctricos o la adición de agentes químicos.
Un catalizador verdadero puede trabajar en conjunto con un catalizador de sacrificio . El catalizador verdadero se consume en la reacción elemental y se convierte en una forma desactivada. El catalizador de sacrificio regenera el catalizador verdadero para otro ciclo. El catalizador de sacrificio se consume en la reacción y, como tal, no es realmente un catalizador, sino un reactivo. Por ejemplo, el tetróxido de osmio (OsO 4 ) es un buen reactivo para la dihidroxilación, pero es altamente tóxico y costoso. En la dihidroxilación de Upjohn , el catalizador de sacrificio N-óxido de N-metilmorfolina (NMMO) regenera OsO 4 , y solo se necesitan cantidades catalíticas de OsO 4 .
Clasificación
La catálisis puede clasificarse como homogénea o heterogénea . Una catálisis homogénea es aquella cuyos componentes están dispersos en la misma fase (normalmente gaseosa o líquida) que las moléculas del reactivo . Una catálisis heterogénea es aquella en la que los componentes de la reacción no están en la misma fase. Las enzimas y otros biocatalizadores suelen considerarse una tercera categoría. Se aplican principios mecanísticos similares a la catálisis heterogénea, homogénea y biocatálisis.
Catálisis heterogénea


Los catalizadores heterogéneos actúan en una fase diferente a la de los reactivos . La mayoría de los catalizadores heterogéneos son sólidos que actúan sobre sustratos en una mezcla de reacción líquida o gaseosa . Los catalizadores heterogéneos importantes incluyen zeolitas , alúmina , [20] óxidos de orden superior, carbono grafítico, óxidos de metales de transición , metales como el níquel Raney para la hidrogenación y óxido de vanadio (V) para la oxidación del dióxido de azufre en trióxido de azufre mediante el proceso de contacto . [21]
Se conocen diversos mecanismos para las reacciones en superficies , dependiendo de cómo se produce la adsorción ( Langmuir-Hinshelwood , Eley-Rideal y Mars -van Krevelen ). [22] El área superficial total de un sólido tiene un efecto importante en la velocidad de reacción. Cuanto menor sea el tamaño de partícula del catalizador, mayor será el área superficial para una masa dada de partículas.
Un catalizador heterogéneo tiene sitios activos , que son los átomos o las caras del cristal donde se une el sustrato. Los sitios activos son átomos, pero a menudo se describen como una faceta (borde, superficie, escalón, etc.) de un sólido. La mayor parte del volumen, pero también la mayor parte de la superficie de un catalizador heterogéneo, puede ser catalíticamente inactiva. Averiguar la naturaleza del sitio activo es un desafío técnico.
Por ejemplo, el catalizador para el proceso Haber para la síntesis de amoniaco a partir de nitrógeno e hidrógeno se describe a menudo como hierro . Pero estudios detallados y muchas optimizaciones han llevado a catalizadores que son mezclas de óxido de hierro-potasio-calcio-aluminio. [23] Los gases que reaccionan se adsorben en sitios activos en las partículas de hierro. Una vez adsorbidos físicamente, los reactivos se disocian parcial o totalmente y forman nuevos enlaces. De esta manera, se rompe el triple enlace particularmente fuerte en el nitrógeno, lo que sería extremadamente poco común en la fase gaseosa debido a su alta energía de activación. Por lo tanto, la energía de activación de la reacción general se reduce y la velocidad de reacción aumenta. [24] Otro lugar donde se aplica un catalizador heterogéneo es en la oxidación de dióxido de azufre en óxido de vanadio (V) para la producción de ácido sulfúrico . [21] Muchos catalizadores heterogéneos son de hecho nanomateriales.
Los catalizadores heterogéneos suelen estar " soportados ", lo que significa que el catalizador se dispersa en un segundo material que mejora la eficacia o minimiza su coste. Los soportes evitan o minimizan la aglomeración y la sinterización de pequeñas partículas de catalizador, exponiendo más área superficial, por lo que los catalizadores tienen una mayor actividad específica (por gramo) sobre el soporte. A veces, el soporte es simplemente una superficie sobre la que se extiende el catalizador para aumentar el área superficial. Más a menudo, el soporte y el catalizador interactúan, lo que afecta a la reacción catalítica. Los soportes también se pueden utilizar en la síntesis de nanopartículas proporcionando sitios para que las moléculas individuales del catalizador se unan químicamente. Los soportes son materiales porosos con una gran área superficial, más comúnmente alúmina , zeolitas o varios tipos de carbón activado . Los soportes especializados incluyen dióxido de silicio , dióxido de titanio , carbonato de calcio y sulfato de bario . [25]
Electrocatalizadores
En el contexto de la electroquímica , específicamente en la ingeniería de celdas de combustible , se utilizan diversos catalizadores que contienen metales para mejorar las velocidades de las semirreacciones que componen la celda de combustible. Un tipo común de electrocatalizador de celda de combustible se basa en nanopartículas de platino que están soportadas sobre partículas de carbono ligeramente más grandes . Cuando entra en contacto con uno de los electrodos de una celda de combustible, este platino aumenta la velocidad de reducción del oxígeno, ya sea a agua o a hidróxido o peróxido de hidrógeno .
Catálisis homogénea
Los catalizadores homogéneos funcionan en la misma fase que los reactivos. Normalmente, los catalizadores homogéneos se disuelven en un disolvente con los sustratos. Un ejemplo de catálisis homogénea implica la influencia de H + en la esterificación de ácidos carboxílicos, como la formación de acetato de metilo a partir de ácido acético y metanol . [26] Los procesos de alto volumen que requieren un catalizador homogéneo incluyen hidroformilación , hidrosililación e hidrocianación . Para los químicos inorgánicos, la catálisis homogénea a menudo es sinónimo de catalizadores organometálicos . [27] Sin embargo, muchos catalizadores homogéneos no son organometálicos, como lo ilustra el uso de sales de cobalto que catalizan la oxidación de p-xileno a ácido tereftálico .
Organocatálisis
Mientras que los metales de transición a veces atraen la mayor parte de la atención en el estudio de la catálisis, las pequeñas moléculas orgánicas sin metales también pueden exhibir propiedades catalíticas, como es evidente por el hecho de que muchas enzimas carecen de metales de transición. Típicamente, los catalizadores orgánicos requieren una carga más alta (cantidad de catalizador por unidad de cantidad de reactivo, expresada en mol% de cantidad de sustancia ) que los catalizadores basados en metales de transición (-iones), pero estos catalizadores generalmente están disponibles comercialmente a granel, lo que ayuda a reducir los costos. A principios de la década de 2000, estos organocatalizadores se consideraban de "nueva generación" y son competitivos con los catalizadores tradicionales que contienen metales (-iones). Se supone que los organocatalizadores operan de manera similar a las enzimas sin metales utilizando, por ejemplo, interacciones no covalentes como el enlace de hidrógeno . La disciplina de la organocatálisis se divide en la aplicación de organocatalizadores covalentes (por ejemplo, prolina , DMAP ) y no covalentes (por ejemplo, organocatálisis de tiourea ) que se refieren a la unión y la interacción preferidas del sustrato con el catalizador , respectivamente. El Premio Nobel de Química 2021 fue otorgado conjuntamente a Benjamin List y David WC MacMillan "por el desarrollo de la organocatálisis asimétrica". [28]
Fotocatalizadores
La fotocatálisis es el fenómeno en el que el catalizador puede recibir luz para generar un estado excitado que efectúa reacciones redox. [29] El oxígeno singlete se produce generalmente mediante fotocatálisis. Los fotocatalizadores son componentes de las células solares sensibilizadas con colorante .
Enzimas y biocatalizadores
En biología, las enzimas son catalizadores basados en proteínas que intervienen en el metabolismo y el catabolismo . La mayoría de los biocatalizadores son enzimas, pero otras clases de biomoléculas no basadas en proteínas también presentan propiedades catalíticas, incluidas las ribozimas y las desoxirribozimas sintéticas . [30]
Los biocatalizadores pueden considerarse un intermediario entre los catalizadores homogéneos y heterogéneos, aunque, en sentido estricto, las enzimas solubles son catalizadores homogéneos y las enzimas unidas a la membrana son heterogéneas. Varios factores afectan la actividad de las enzimas (y otros catalizadores), entre ellos la temperatura, el pH, la concentración de enzimas, el sustrato y los productos. Un reactivo particularmente importante en las reacciones enzimáticas es el agua, que es el producto de muchas reacciones de formación de enlaces y un reactante en muchos procesos de ruptura de enlaces.
En la biocatálisis , se emplean enzimas para preparar muchos productos químicos básicos, incluidos el jarabe de maíz con alto contenido de fructosa y la acrilamida .
Algunos anticuerpos monoclonales cuyo objetivo de unión es una molécula estable que se asemeja al estado de transición de una reacción química pueden funcionar como catalizadores débiles para esa reacción química al reducir su energía de activación. [31] Estos anticuerpos catalíticos a veces se denominan " abzimas ".
Significado

Se estima que el 90% de todos los productos químicos producidos comercialmente utilizan catalizadores en alguna etapa del proceso de fabricación. En 2005, los procesos catalíticos generaron alrededor de 900 mil millones de dólares en productos en todo el mundo. [33] La catálisis es tan omnipresente que no es fácil clasificar las subáreas. A continuación se examinan algunas áreas de especial concentración.
Procesamiento de energía
El refinado del petróleo hace un uso intensivo de la catálisis para la alquilación , el craqueo catalítico (ruptura de hidrocarburos de cadena larga en fragmentos más pequeños), el reformado de nafta y el reformado con vapor (conversión de hidrocarburos en gas de síntesis ). Incluso los gases de escape de la quema de combustibles fósiles se tratan mediante catálisis: los convertidores catalíticos , compuestos típicamente de platino y rodio , descomponen algunos de los subproductos más dañinos de los gases de escape de los automóviles.
- 2CO2 + 2NO → 2CO2 + N2
En lo que respecta a los combustibles sintéticos, un proceso antiguo pero todavía importante es la síntesis de hidrocarburos de Fischer-Tropsch a partir de gas de síntesis , que a su vez se procesa mediante reacciones de desplazamiento de agua-gas , catalizadas por hierro. La reacción de Sabatier produce metano a partir de dióxido de carbono e hidrógeno. El biodiésel y los biocombustibles relacionados requieren un procesamiento mediante catalizadores inorgánicos y biocatalizadores.
Las pilas de combustible dependen de catalizadores para las reacciones anódicas y catódicas.
Los calentadores catalíticos generan calor sin llama a partir de un suministro de combustible combustible.
Productos químicos a granel

Algunos de los productos químicos de mayor escala se producen mediante oxidación catalítica, a menudo utilizando oxígeno . Algunos ejemplos son el ácido nítrico (a partir del amoníaco), el ácido sulfúrico (a partir del dióxido de azufre hasta el trióxido de azufre mediante el proceso de contacto ), el ácido tereftálico a partir del p-xileno, el ácido acrílico a partir del propileno o el propano y el acrilonitrilo a partir del propano y el amoníaco. [22]
La producción de amoniaco es uno de los procesos de mayor escala y de mayor consumo energético. En el proceso Haber, el nitrógeno se combina con hidrógeno sobre un catalizador de óxido de hierro. [34] El metanol se prepara a partir de monóxido de carbono o dióxido de carbono, pero utilizando catalizadores de cobre y zinc.
Los polímeros a granel derivados del etileno y el propileno suelen prepararse mediante catálisis Ziegler-Natta . Los poliésteres, las poliamidas y los isocianatos se obtienen mediante catálisis ácido-base .
La mayoría de los procesos de carbonilación requieren catalizadores metálicos; algunos ejemplos incluyen el proceso de ácido acético de Monsanto y la hidroformilación .
Productos químicos finos
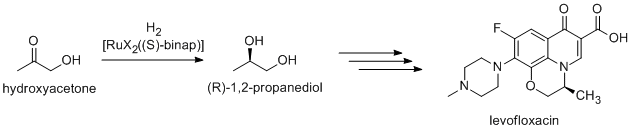
Muchos productos químicos finos se preparan mediante catálisis; los métodos incluyen los de la industria pesada, así como procesos más especializados que serían prohibitivamente caros a gran escala. Los ejemplos incluyen la reacción de Heck y las reacciones de Friedel-Crafts . Debido a que la mayoría de los compuestos bioactivos son quirales , muchos productos farmacéuticos se producen mediante catálisis enantioselectiva ( síntesis catalítica asimétrica ). El (R)-1,2-propanodiol, el precursor del antibacteriano levofloxacino , se puede sintetizar de manera eficiente a partir de hidroxiacetona utilizando catalizadores basados en complejos de BINAP -rutenio, en la hidrogenación asimétrica de Noyori : [35]
Procesamiento de alimentos
Una de las aplicaciones más obvias de la catálisis es la hidrogenación (reacción con gas hidrógeno ) de grasas utilizando un catalizador de níquel para producir margarina . [36] Muchos otros alimentos se preparan mediante biocatálisis (ver más abajo).
Ambiente
La catálisis afecta al medio ambiente al aumentar la eficiencia de los procesos industriales, pero también tiene un papel directo en el medio ambiente. Un ejemplo notable es el papel catalítico de los radicales libres de cloro en la descomposición del ozono . Estos radicales se forman por la acción de la radiación ultravioleta sobre los clorofluorocarbonos (CFC).
- Cl · +O3 → ClO · + O2
- ClO · +O · → Cl · + O2
Historia
El término "catalizador", definido ampliamente como cualquier cosa que aumenta la velocidad de un proceso, se deriva del griego καταλύειν, que significa "anular", "desatar" o "recoger". El concepto de catálisis fue inventado por la química Elizabeth Fulhame y descrito en un libro de 1794, basado en su novedoso trabajo sobre reacciones de oxidación-reducción. [7] [8] [37] La primera reacción química en química orgánica que utilizó conscientemente un catalizador fue estudiada en 1811 por Gottlieb Kirchhoff , quien descubrió la conversión catalizada por ácido del almidón en glucosa. El término catálisis fue utilizado más tarde por Jöns Jakob Berzelius en 1835 [38] para describir las reacciones que son aceleradas por sustancias que permanecen inalteradas después de la reacción. Fulhame , que precedió a Berzelius, trabajó con agua en lugar de metales en sus experimentos de reducción. Otros químicos del siglo XVIII que trabajaron en catálisis fueron Eilhard Mitscherlich [39] que se refirió a ella como procesos de contacto , y Johann Wolfgang Döbereiner [40] [41] que habló de acción de contacto. Desarrolló la lámpara de Döbereiner , un encendedor basado en hidrógeno y una esponja de platino , que se convirtió en un éxito comercial en la década de 1820 que perdura en la actualidad. Humphry Davy descubrió el uso del platino en catálisis. [42] En la década de 1880, Wilhelm Ostwald en la Universidad de Leipzig inició una investigación sistemática sobre las reacciones que eran catalizadas por la presencia de ácidos y bases, y descubrió que las reacciones químicas ocurren a velocidades finitas y que estas velocidades pueden usarse para determinar las fortalezas de los ácidos y las bases. Por este trabajo, Ostwald recibió el Premio Nobel de Química de 1909. [43] Vladimir Ipatieff realizó algunas de las primeras reacciones a escala industrial, incluido el descubrimiento y comercialización de la oligomerización y el desarrollo de catalizadores para la hidrogenación. [44]
Inhibidores, venenos y promotores
Una sustancia añadida que reduce la velocidad se denomina inhibidor de la reacción si es reversible y veneno para el catalizador si es irreversible. [1] Los promotores son sustancias que aumentan la actividad catalítica, aunque no sean catalizadores por sí mismos. [45]
A los inhibidores a veces se los denomina "catalizadores negativos" ya que disminuyen la velocidad de reacción. [46] Sin embargo, se prefiere el término inhibidor ya que no funcionan introduciendo una ruta de reacción con mayor energía de activación; esto no reduciría la velocidad ya que la reacción continuaría ocurriendo por la ruta no catalizada. En cambio, actúan desactivando catalizadores o eliminando intermediarios de reacción como radicales libres. [46] [11] En la catálisis heterogénea , la coquización inhibe el catalizador, que queda cubierto por productos secundarios poliméricos .
El inhibidor puede modificar la selectividad además de la velocidad. Por ejemplo, en la hidrogenación de alquinos a alquenos , se puede utilizar un catalizador de paladio (Pd) parcialmente "envenenado" con acetato de plomo (II) (Pb(CH 3 CO 2 ) 2 ) ( catalizador de Lindlar ). [47] Sin la desactivación del catalizador, el alqueno producido se hidrogenaría aún más a alcano . [48] [49]
El inhibidor puede producir este efecto, por ejemplo, envenenando selectivamente sólo ciertos tipos de sitios activos. Otro mecanismo es la modificación de la geometría de la superficie. Por ejemplo, en las operaciones de hidrogenación, los grandes planos de la superficie del metal funcionan como sitios de catálisis de hidrogenólisis , mientras que los sitios que catalizan la hidrogenación de compuestos insaturados son más pequeños. Por lo tanto, un veneno que cubra la superficie aleatoriamente tenderá a reducir el número de grandes planos no contaminados, pero dejará sitios proporcionalmente más pequeños libres, cambiando así la selectividad de la hidrogenación frente a la hidrogenólisis. También son posibles muchos otros mecanismos.
Los promotores pueden cubrir la superficie para evitar la producción de una capa de coque, o incluso eliminar activamente dicho material (por ejemplo, renio sobre platino en la formación de plataformas ). Pueden ayudar a la dispersión del material catalítico o unirse a reactivos.
Véase también
- Reacción química
- Abzima
- Catálisis ácida (incluye catálisis básica)
- Autocatálisis
- BIG-NSE (Escuela Superior de Ciencias Naturales e Ingeniería de Berlín)
- Catalysis Science & Technology (revista de química)
- Teoría de resonancia catalítica
- Electrocatalizador
- Factores desencadenantes ambientales
- Catálisis enzimática
- Catalizadores industriales
- Microscopio de fuerza con sonda Kelvin
- Reactivo limitante
- Concepto de Murburn
- Adyuvante farmacéutico
- Catálisis de límite de fase
- Catalizador de transferencia de fase
- Fotocatálisis
- Ribozima (biocatalizador de ARN)
- Enzimas SUMO
- Reducción programada de temperatura
- Espectroscopia de desorción térmica
Referencias
- IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "catalyst". doi :10.1351/goldbook.C00876
- ^ ab "Catalizador". Compendio de terminología química de la IUPAC . Oxford: Blackwell Scientific Publications. 2009. doi :10.1351/goldbook.C00876. ISBN 978-0-9678550-9-7.
- ^ Masel, Richard I (2001). Cinética química y catálisis . Nueva York: Wiley-Interscience. ISBN 0-471-24197-0.
- ^ Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (1999). Cinética y dinámica química (2.ª ed.). Prentice Hall. pág. 147. ISBN 0-13-737123-3Un catalizador se
define como una sustancia química que aumenta la velocidad de una reacción química sin consumirse en la reacción.
- ^ Lerner, Louise (2011). "7 cosas que quizás no sabías sobre la catálisis". Laboratorio Nacional de Argonne .
- ^ Laidler, Keith J.; Meiser, John H. (1982). Química física . Benjamin/Cummings. pág. 425. ISBN 0-8053-5682-7Los
inhibidores no funcionan introduciendo una vía de reacción más alta; esto no reduciría la velocidad, ya que la reacción continuaría ocurriendo por el mecanismo alternativo.
- ^ Carroll, Gregory T.; Kirschman, David L. (23 de enero de 2023). "La unidad de filtración catalítica de humo quirúrgico reduce los niveles de formaldehído en un entorno de quirófano simulado". ACS Chemical Health & Safety . 30 (1): 21–28. doi :10.1021/acs.chas.2c00071. ISSN 1871-5532. S2CID 255047115.
- ^ ab Laidler, Keith J.; Cornish-Bowden, Athel (1997). ""Elizabeth Fulhame y el descubrimiento de la catálisis: 100 años antes de Buchner" (PDF) . En Cornish-Bowden, Athel (ed.). Cerveza nueva en una vieja botella: Eduard Buchner y el crecimiento del conocimiento bioquímico . Valencia: Universitat de Valencia. pp. 123–126. ISBN. 9788437033280. Archivado desde el original (PDF) el 23 de enero de 2015 . Consultado el 14 de marzo de 2021 .
- ^ ab Rayner-Canham, Marelene; Rayner-Canham, Geoffrey William (2001). Mujeres en la química: sus roles cambiantes desde los tiempos de la alquimia hasta mediados del siglo XX . Sociedad Química Estadounidense. ISBN 978-0-8412-3522-9.
- ^ "Genio en una botella". Universidad de Minnesota . 2 de marzo de 2005. Archivado desde el original el 5 de abril de 2008.
- ^ Torkashvand, Mostafa; Sarabadani Tafreshi, Saeedeh; de Leeuw, Nora H. (mayo de 2023). "Estudio de la teoría funcional de la densidad de la hidrogenación de monóxido de carbono sobre la superficie de Co (001): implicaciones para el proceso Fischer-Tropsch". Catalysts . 13 (5): 837. doi : 10.3390/catal13050837 . ISSN 2073-4344.
- ^ ab Laidler, KJ y Meiser, JH (1982) Química física , Benjamin/Cummings, p. 425. ISBN 0-618-12341-5 .
- ^ Laidler, Keith J.; Meiser, John H. (1982). Química física . Benjamin/Cummings. págs. 424–425. ISBN 0-8053-5682-7.
- ^ Atkins, Peter; de Paula, Julio (2006). Química física de Atkins (8.ª ed.). WHFreeman. pág. 839. ISBN 0-7167-8759-8El catalizador reduce la energía de activación de la reacción al proporcionar una ruta alternativa que evita
el paso lento, que determina la velocidad, de la reacción no catalizada.
- ^ ab Steinfeld, Jeffrey I.; Francisco, Joseph S.; Hase, William L. (1999). Cinética y dinámica química (2.ª ed.). Prentice Hall. págs. 147-150. ISBN 0-13-737123-3La concentración del
catalizador [C] aparece en la expresión de velocidad, pero no en la relación de equilibrio.
- ^ Jacoby, Mitch (16 de febrero de 2009). "Cómo fabricar agua paso a paso". Chemical & Engineering News . pág. 10.
- ^ Matthiesen J, Wendt S, Hansen JØ, Madsen GK, Lira E, Galliker P, Vestergaard EK, Schaub R, Laegsgaard E, Hammer B, Besenbacher F (2009). "Observación de todos los pasos intermedios de una reacción química en una superficie de óxido mediante microscopía de efecto túnel". ACS Nano . 3 (3): 517–26. CiteSeerX 10.1.1.711.974 . doi :10.1021/nn8008245. ISSN 1520-605X. PMID 19309169.
- ^ Robertson, AJB (1970) Catálisis de reacciones de gases mediante metales . Logos Press, Londres.
- ^ Vlatković, Matea; Collins, Beatrice SL; Feringa, Ben L. (2016). "Sistemas dinámicos de respuesta para la función catalítica". Química: una revista europea . 22 (48): 17080–17111. doi : 10.1002/chem.201602453 . PMID 27717167.
- ^ Roelz M, Butschke B, Breit B (mayo de 2024). "Ligandos NHC integrados con azobenceno: una plataforma versátil para la catálisis de metales conmutable por luz visible". Revista de la Sociedad Química Estadounidense . 146 (19): 13210–13225. doi : 10.1021/jacs.4c01138 . PMID: 38709955.
- ^ Shafiq, Iqrash; Shafique, Sumeer; Akhter, Parveen; Yang, Wenshu; Hussain, Murid (23 de junio de 2020). "Desarrollos recientes en catalizadores de hidrodesulfuración soportados en alúmina para la producción de productos de refinería sin azufre: una revisión técnica". Catalysis Reviews . 64 (1): 1–86. doi :10.1080/01614940.2020.1780824. ISSN 0161-4940. S2CID 225777024.
- ^ ab Housecroft, Catherine E.; Sharpe, Alan G. (2005). Química inorgánica (2.ª ed.). Pearson Prentice-Hall. pág. 805. ISBN 0130-39913-2.
- ^ ab Knözinger, Helmut y Kochloefl, Karl (2002) "Catálisis heterogénea y catalizadores sólidos" en Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim. doi :10.1002/14356007.a05_313
- ^ Appl, Max (2006). "Amoníaco". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a02_143.pub2. ISBN 3527306730.
- ^ "Química del vanadio". Chemistry LibreTexts . 3 de octubre de 2013 . Consultado el 8 de julio de 2022 .
- ^ Chadha, Utkarsh; Selvaraj, Senthil Kumaran; Ashokan, Hridya; Hariharan, Sai P.; Mateo Pablo, V.; Venkatarangan, Vishal; Paramasivam, Velmurugan (8 de febrero de 2022). "Nanomateriales complejos en catálisis para aplicaciones químicamente importantes: desde la síntesis y el procesamiento de hidrocarburos hasta aplicaciones de energía renovable". Avances en ciencia e ingeniería de materiales . 2022 : e1552334. doi : 10.1155/2022/1552334 . ISSN 1687-8434.
- ^ Behr, Arno (2002) "Compuestos organometálicos y catálisis homogénea" en Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim. doi :10.1002/14356007.a18_215
- ^ Elschenbroich, C. (2006) Organometálicos . Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ "El Premio Nobel de Química 2021". NobelPrize.org .
- ^ Melchiorre, Paolo (2022). "Introducción: procesos catalíticos fotoquímicos". Chemical Reviews . 122 (2): 1483–1484. doi : 10.1021/acs.chemrev.1c00993 . PMID 35078320. S2CID 246287799.
- ^ Nelson, DL y Cox, MM (2000) Lehninger, Principios de bioquímica 3.ª ed. Worth Publishing: Nueva York. ISBN 1-57259-153-6 .
- ^ Anticuerpos catalíticos explicados de forma sencilla. Documentroot.com (6 de marzo de 2010). Recuperado el 11 de noviembre de 2015.
- ^ Solovev, Alexander A.; Sanchez, Samuel; Mei, Yongfeng; Schmidt, Oliver G. (2011). "Microbombas tubulares catalíticas sintonizables que funcionan a bajas concentraciones de peróxido de hidrógeno" (PDF) . Química física. Física química . 13 (21): 10131–35. Bibcode :2011PCCP...1310131S. doi :10.1039/C1CP20542K. PMID 21505711. Archivado (PDF) desde el original el 28 de marzo de 2019.
- ^ 1.4.3 Eficiencia de los procesos industriales Archivado el 17 de mayo de 2008 en Wayback Machine . climatetechnology.gov
- ^ Smil, Vaclav (2004). Enriqueciendo la Tierra: Fritz Haber, Carl Bosch y la transformación de la producción mundial de alimentos (1.ª ed.). Cambridge, MA: MIT. ISBN 9780262693134.
- ^ Dub, Pavel A.; Gordon, John C. (2018). "El papel de la funcionalidad N–H unida al metal en los catalizadores moleculares de tipo Noyori". Nature Reviews Chemistry . 2 (12): 396–408. doi :10.1038/s41570-018-0049-z. S2CID 106394152.
- ^ Clark, Jim (octubre de 2013). "Tipos de catálisis". Chemguide.
- ^ Bård Lindström y Lars J. Petterson (2003) "Una breve historia de la catálisis" Cattech , 7 (4): 130–38.
- ^ Berzelius, JJ (1835) Årsberättelsen om framsteg i fysik och kemi [Informe anual sobre los avances en física y química ]. Estocolmo, Suecia: Real Academia Sueca de Ciencias. Después de revisar las investigaciones de Eilhard Mitscherlich sobre la formación del éter, Berzelius acuña la palabra katalys (catálisis) en la p. 245:
Original: Jag skall derföre, för att begagna en i kemien välkänd härledning, kalla den kroppars katalytiska kraft, sönderdelning genom denna kraft katalys, likasom vi med ordet analys beteckna åtskiljandet af kroppars beståndsdelar medelst den vanliga kemiska frändskapen.
Traducción : Por lo tanto, para emplear una derivación bien conocida en química, llamaré a los cuerpos [es decir, sustancias] [catalíticos] fuerza catalítica y a la descomposición de [otros] cuerpos por esta fuerza catálisis , así como con la palabra análisis significamos la separación de los constituyentes de los cuerpos por las afinidades químicas usuales.
- ^ Mitscherlich, E. (1834). "Ueber die Aetherbildung" [Sobre la formación del éter]. Annalen der Physik und Chemie . 31 (18): 273–82. Código bibliográfico : 1834AnP...107..273M. doi : 10.1002/andp.18341071802.
- ^ Döbereiner (1822). "Glühendes Verbrennen des Alkohols durch verschiedene erhitzte Metalle und Metalloxyde" [Quema incandescente de alcohol mediante diversos metales y óxidos metálicos calentados]. Revista para química y física . 34 : 91–92.
- ^ Döbereiner (1823). "Neu entdeckte merkwürdige Eigenschaften des Platinsuboxyds, des oxydirten Schwefel-Platins und des metallischen Plainstaubes" [Propiedades notables recientemente descubiertas del subóxido de platino, el sulfuro de platino oxidado y el polvo de platino metálico]. Revista para química y física . 38 : 321–26.
- ^ Davy, Humphry (1817). "Algunos nuevos experimentos y observaciones sobre la combustión de mezclas gaseosas, con una descripción de un método para preservar una luz continua en mezclas de gases inflamables y aire sin llama". Philosophical Transactions of the Royal Society of London . 107 : 77–85. doi :10.1098/rstl.1817.0009. S2CID 97988261.
- ^ Roberts, MW (2000). "Nacimiento del concepto catalítico (1800-1900)". Catalysis Letters . 67 (1): 1–4. doi :10.1023/A:1016622806065. S2CID 91507819.
- ^ Nicholas, Christopher P. (21 de agosto de 2018). "Deshidratación, dienos, alto octanaje y altas presiones: contribuciones de Vladimir Nikolaevich Ipatieff, un padre de la catálisis". ACS Catalysis . 8 (9): 8531–39. doi : 10.1021/acscatal.8b02310 .
- ^ Dhara SS; Umare SS (2018). Un libro de texto de química para ingeniería. India: S. Chand Publishing. pág. 66. ISBN 9789352830688.
- ^ ab Laidler, KJ (1978) Química física con aplicaciones biológicas , Benjamin/Cummings. págs. 415–17. ISBN 0-8053-5680-0 .
- ^ Lindlar H.; Dubuis R. (2016). "Catalizador de paladio para la reducción parcial de acetilenos". Síntesis orgánicas . doi :10.15227/orgsyn.046.0089; Volúmenes recopilados , vol. 5, pág. 880.
- ^ Jencks, WP (1969) Catálisis en química y enzimología McGraw-Hill, Nueva York. ISBN 0-07-032305-4
- ^ Bender, Myron L; Komiyama, Makoto y Bergeron, Raymond J (1984) La química bioorgánica de la catálisis enzimática Wiley-Interscience, Hoboken, EE. UU. ISBN 0-471-05991-9
Enlaces externos
- Ayuda científica: Página de catalizadores para ciencias de nivel secundario
- Presentación de WA Herrmann Technische Universität Archivado el 28 de octubre de 2005 en Wayback Machine .
- Catalizador de alumita, Laboratorio Kameyama-Sakurai, Japón
- Grupo de Química Inorgánica y Catálisis, Universidad de Utrecht, Países Bajos
- Centro de Química de Superficies y Catálisis
- Grupo de Carbones y Catalizadores, Universidad de Concepción, Chile
- Centro para la Habilitación de Nuevas Tecnologías a Través de la Catálisis, Centro de Innovación Química de la NSF, EE. UU.
- "Las burbujas activan los catalizadores químicos" Archivado el 22 de julio de 2012 en Wayback Machine , revista Science News en línea, 6 de abril de 2009.



