Reacción de desplazamiento de agua y gas
La reacción de desplazamiento de agua-gas (WGSR) describe la reacción del monóxido de carbono y el vapor de agua para formar dióxido de carbono e hidrógeno :
- CO + H2O ⇌ CO2 + H2
La reacción de desplazamiento del gas de agua fue descubierta por el físico italiano Felice Fontana en 1780. No fue hasta mucho después que se comprendió el valor industrial de esta reacción. Antes de principios del siglo XX, el hidrógeno se obtenía haciendo reaccionar vapor a alta presión con hierro para producir óxido de hierro e hidrógeno. Con el desarrollo de procesos industriales que requerían hidrógeno, como la síntesis de amoníaco de Haber-Bosch , se necesitaba un método menos costoso y más eficiente de producción de hidrógeno . Como solución a este problema, la WGSR se combinó con la gasificación del carbón para producir hidrógeno.
Aplicaciones
La WGSR es una reacción industrial de gran valor que se utiliza en la fabricación de amoníaco, hidrocarburos , metanol e hidrógeno . Su aplicación más importante es en conjunción con la conversión de monóxido de carbono a partir del reformado con vapor de metano u otros hidrocarburos en la producción de hidrógeno. [1] En el proceso Fischer-Tropsch , la WGSR es una de las reacciones más importantes que se utilizan para equilibrar la relación H2 / CO. Proporciona una fuente de hidrógeno a expensas del monóxido de carbono, que es importante para la producción de hidrógeno de alta pureza para su uso en la síntesis de amoníaco.
La reacción de desplazamiento de agua a gas puede ser una reacción secundaria no deseada en procesos que involucran agua y monóxido de carbono, por ejemplo, el proceso Monsanto basado en rodio . El proceso Cativa basado en iridio utiliza menos agua, lo que suprime esta reacción.
Pilas de combustible
El WGSR puede ayudar a la eficiencia de las celdas de combustible al aumentar la producción de hidrógeno. El WGSR se considera un componente crítico en la reducción de las concentraciones de monóxido de carbono en celdas que son susceptibles al envenenamiento por monóxido de carbono, como la celda de combustible de membrana de intercambio de protones (PEM) . [2] Los beneficios de esta aplicación son dobles: no solo la reacción de desplazamiento de gas de agua reduciría efectivamente la concentración de monóxido de carbono, sino que también aumentaría la eficiencia de las celdas de combustible al aumentar la producción de hidrógeno. [2] Desafortunadamente, los catalizadores comerciales actuales que se utilizan en los procesos industriales de desplazamiento de gas de agua no son compatibles con las aplicaciones de celdas de combustible. [3] Con la alta demanda de combustible limpio y el papel crítico de la reacción de desplazamiento de gas de agua en las celdas de combustible de hidrógeno, el desarrollo de catalizadores de desplazamiento de gas de agua para la aplicación en la tecnología de celdas de combustible es un área de interés de investigación actual.
Los catalizadores para aplicaciones de celdas de combustible deben operar a bajas temperaturas. Dado que el reactor WGSR es lento a temperaturas más bajas, donde el equilibrio favorece la producción de hidrógeno, los reactores WGS requieren grandes cantidades de catalizadores, lo que aumenta su costo y tamaño más allá de su aplicación práctica. [2] El catalizador LTS comercial utilizado en plantas industriales a gran escala también es pirofórico en su estado inactivo y, por lo tanto, presenta problemas de seguridad para aplicaciones de consumo. [3] El desarrollo de un catalizador que pueda superar estas limitaciones es relevante para la implementación de una economía del hidrógeno.
Cambio de gas de agua mejorado por sorción
La reacción WGS se utiliza en combinación con la adsorción sólida de CO 2 en el desplazamiento de agua y gas mejorado por sorción (SEWGS) para producir una corriente de hidrógeno a alta presión a partir de gas de síntesis . [4]
Condiciones de reacción
El equilibrio de esta reacción muestra una dependencia significativa de la temperatura y la constante de equilibrio disminuye con el aumento de la temperatura, es decir, se observa una mayor formación de hidrógeno a temperaturas más bajas.
Dependencia de la temperatura

Con el aumento de la temperatura, la velocidad de reacción aumenta, pero la producción de hidrógeno se vuelve menos favorable termodinámicamente [5] ya que la reacción de desplazamiento del gas de agua es moderadamente exotérmica ; este cambio en el equilibrio químico se puede explicar de acuerdo con el principio de Le Chatelier . En el rango de temperatura de 600 a 2000 K, la constante de equilibrio para la WGSR tiene la siguiente relación: [3]
Preocupaciones prácticas
Para aprovechar tanto la termodinámica como la cinética de la reacción, la reacción de desplazamiento de gas de agua a escala industrial se lleva a cabo en múltiples etapas adiabáticas que consisten en un desplazamiento de alta temperatura (HTS) seguido de un desplazamiento de baja temperatura (LTS) con enfriamiento entre sistemas. [6] El HTS inicial aprovecha las altas velocidades de reacción, pero da como resultado una conversión incompleta de monóxido de carbono. Un reactor de desplazamiento de baja temperatura posterior reduce el contenido de monóxido de carbono a <1%. Los catalizadores HTS comerciales se basan en óxido de hierro - óxido de cromo y el catalizador LTS es a base de cobre. El catalizador de cobre es susceptible al envenenamiento por azufre . Los compuestos de azufre se eliminan antes del reactor LTS mediante un lecho protector. Una limitación importante para el HTS es la relación H2O /CO donde las relaciones bajas pueden conducir a reacciones secundarias como la formación de hierro metálico, metanación , deposición de carbono y la reacción de Fischer-Tropsch.
Catálisis por desplazamiento de alta temperatura
La composición típica del catalizador HTS comercial se ha informado como 74,2% Fe2O3 , 10,0% Cr2O3 , 0,2% MgO (el porcentaje restante se atribuye a los componentes volátiles). [ 7 ] El cromo actúa para estabilizar el óxido de hierro y evita la sinterización . El funcionamiento de los catalizadores HTS se produce dentro del rango de temperatura de 310 ° C a 450 °C. La temperatura aumenta a lo largo de la longitud del reactor debido a la naturaleza exotérmica de la reacción. Como tal, la temperatura de entrada se mantiene a 350 °C para evitar que la temperatura de salida supere los 550 °C. Los reactores industriales funcionan en un rango de presión atmosférica a 8375 kPa (82,7 atm). [7] La búsqueda de catalizadores HT WGS de alto rendimiento sigue siendo un tema intensivo de investigación en los campos de la química y la ciencia de los materiales. La energía de activación es un criterio clave para la evaluación del rendimiento catalítico en las reacciones WGS. Hasta la fecha, algunos de los valores de energía de activación más bajos se han encontrado para catalizadores que consisten en nanopartículas de cobre sobre materiales de soporte de ceria , [8] con valores tan bajos como Ea = 34 kJ/mol reportados en relación con la generación de hidrógeno.
Catálisis por desplazamiento a baja temperatura
Los catalizadores para la reacción WGS de temperatura más baja se basan comúnmente en fases cerámicas cargadas con cobre u óxido de cobre, mientras que los soportes más comunes incluyen alúmina o alúmina con óxido de zinc, otros soportes pueden incluir óxidos de tierras raras, espinelas o perovskitas. [9] Se ha informado que una composición típica de un catalizador LTS comercial es 32-33% CuO, 34-53% ZnO, 15-33% Al 2 O 3 . [3] La especie catalítica activa es CuO. La función de ZnO es proporcionar soporte estructural y prevenir el envenenamiento del cobre por azufre. El Al 2 O 3 previene la dispersión y la contracción de los gránulos. El reactor de desplazamiento LTS opera en un rango de 200 a 250 °C. El límite superior de temperatura se debe a la susceptibilidad del cobre a la sinterización térmica. Estas temperaturas más bajas también reducen la aparición de reacciones secundarias que se observan en el caso del HTS. También se han utilizado metales nobles como el platino, soportado sobre ceria, para LTS. [10]
Mecanismo
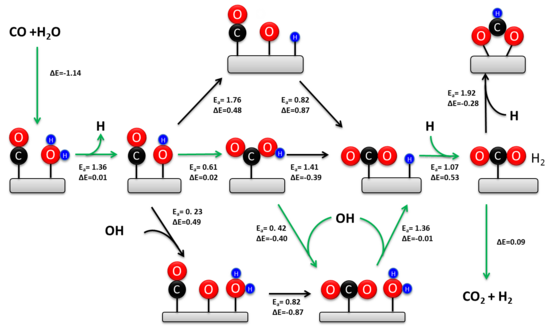
La reacción de oxidación de metales pesados (WGSR) se ha estudiado ampliamente durante más de cien años. El mecanismo cinético relevante depende de la composición del catalizador y de la temperatura. [6] [14] Se han propuesto dos mecanismos: un mecanismo asociativo de Langmuir-Hinshelwood y un mecanismo redox. El mecanismo redox se considera generalmente como cinéticamente relevante durante la reacción de oxidación de metales pesados a alta temperatura (> 350 °C) sobre el catalizador industrial de hierro-cromo. [5] Históricamente, ha habido mucha más controversia en torno al mecanismo a bajas temperaturas. Estudios experimentales recientes confirman que el mecanismo carboxílico asociativo es la vía predominante a baja temperatura en los catalizadores de metales de transición soportados en óxido metálico. [15] [13]
Mecanismo asociativo
En 1920, Armstrong y Hilditch propusieron por primera vez el mecanismo asociativo. En este mecanismo, el CO y el H 2 O se adsorben en la superficie del catalizador, seguido de la formación de un intermedio y la desorción de H 2 y CO 2 . En general, el H 2 O se disocia en el catalizador para producir OH y H adsorbidos. El agua disociada reacciona con el CO para formar un intermedio carboxilo o formiato. El intermedio posteriormente se deshidrogena para producir CO 2 y H adsorbido. Dos átomos de H adsorbidos se recombinan para formar H 2 .
Ha habido una controversia significativa en torno al intermediario cinéticamente relevante durante el mecanismo asociativo. Estudios experimentales indican que ambos intermediarios contribuyen a la velocidad de reacción sobre catalizadores de metales de transición soportados en óxido metálico. [15] [13] Sin embargo, la vía carboxilo representa alrededor del 90% de la velocidad total debido a la estabilidad termodinámica del formato adsorbido en el soporte de óxido. El sitio activo para la formación de carboxilo consiste en un átomo de metal adyacente a un hidroxilo adsorbido. Este conjunto se forma fácilmente en la interfaz metal-óxido y explica la actividad mucho mayor de los metales de transición soportados en óxido en relación con las superficies metálicas extendidas. [13] La frecuencia de recambio para el WGSR es proporcional a la constante de equilibrio de la formación de hidroxilo, lo que racionaliza por qué los soportes de óxido reducibles (por ejemplo, CeO 2 ) son más activos que los soportes irreducibles (por ejemplo, SiO 2 ) y las superficies metálicas extendidas (por ejemplo, Pt). A diferencia del sitio activo para la formación de carboxilo, la formación de formato ocurre en superficies metálicas extendidas. El intermedio de formato se puede eliminar durante la WGSR utilizando catalizadores de metales de transición dispersos atómicamente soportados en óxido, lo que confirma aún más el predominio cinético de la vía carboxilo. [16]
Mecanismo redox
El mecanismo redox implica un cambio en el estado de oxidación del material catalítico. En este mecanismo, el CO es oxidado por un átomo de O que pertenece intrínsecamente al material catalítico para formar CO2 . Una molécula de agua sufre una adsorción disociativa en la vacante de O recién formada para producir dos hidroxilos. Los hidroxilos se desproporcionan para producir H2 y devolver la superficie catalítica a su estado previo a la reacción.
Modelos homogéneos
El mecanismo implica el ataque nucleofílico del agua o hidróxido en un centro M-CO, generando un ácido metalacarboxílico . [2] [17]
Termodinámica
El WGSR es exergónico , con los siguientes parámetros termodinámicos a temperatura ambiente (298 K):
Energía libre ΔG ⊖ = –6,82 kcal Entalpía ΔH ⊖ = –9,84 kcal Entropía ΔS ⊖ = –10,1 cal/grado
En solución acuosa, la reacción es menos exergónica. [18]
Cambio inverso de agua y gas
En la conversión de dióxido de carbono en materiales útiles, se utiliza la reacción de desplazamiento de agua-gas para producir monóxido de carbono a partir de hidrógeno y dióxido de carbono. A esto a veces se lo denomina reacción inversa de desplazamiento de agua-gas . [19]
El gas de agua se define como un gas combustible que consiste principalmente en monóxido de carbono (CO) e hidrógeno (H 2 ). El término "desplazamiento" en desplazamiento de agua-gas significa cambiar la relación de composición del gas de agua (CO:H 2 ). La relación se puede aumentar añadiendo CO 2 o reducir añadiendo vapor al reactor.
Véase también
- Utilización de recursos in situ
- Productor de hidrógeno de Lane
- Proximidad
- Catalizadores industriales
- Cambio de gas de agua mejorado por sorción
- Gas de síntesis
Referencias
- ^ Catálisis por desplazamiento de gas de agua: un estudio combinado experimental y computacional
- ^ abcd Vielstich, Wolf; Lamm, Arnold; Gasteiger, Hubert A., eds. (2003). Manual de pilas de combustible: fundamentos, tecnología, aplicaciones . Nueva York: Wiley. ISBN 978-0-471-49926-8.
- ^ abcd Callaghan, Caitlin (2006). Cinética y catálisis de la reacción de desplazamiento de agua-gas: un enfoque microcinético y de teoría de grafos (PhD). Instituto Politécnico de Worcester.
- ^ Jansen, Daniel; van Selow, Eduardo; Cobden, Pablo; Manzolini, Giampaolo; Macchi, Ennio; Gazzani, Mateo; Blom, Richard; Heriksen, Partow Pakdel; Beavis, rico; Wright, Andrés (1 de enero de 2013). "¡La tecnología SEWGS ya está lista para ampliarse!" (PDF) . Procedimiento energético . 37 : 2265–2273. doi : 10.1016/j.egypro.2013.06.107 . ISSN 1876-6102.
- ^ ab Ratnasamy, Chandra; Wagner, Jon P. (septiembre de 2009). "Catálisis por desplazamiento de gas de agua". Catalysis Reviews . 51 (3): 325–440. doi :10.1080/01614940903048661. S2CID 98530242.
- ^ ab Smith RJ, Byron; Muruganandam Loganthan; Murthy Shekhar Shantha (2010). "Una revisión de la reacción de desplazamiento de gas de agua". Revista internacional de ingeniería de reactores químicos . 8 : 1–32. doi :10.2202/1542-6580.2238. S2CID 96769998.
- ^ ab Newsome, David S. (1980). "La reacción de desplazamiento de agua-gas". Catalysis Reviews: Science and Engineering . 21 (2): 275–318. doi :10.1080/03602458008067535.
- ^ Rodríguez, JA; Liu, P.; Wang, X.; Wen, W.; Hanson, J.; Hrbek, J.; Pérez, M.; Evans, J. (15 de mayo de 2009). "Actividad de desplazamiento de agua-gas de superficies de Cu y nanopartículas de Cu soportadas en óxidos metálicos". Catalysis Today . 143 (1–2): 45–50. doi :10.1016/j.cattod.2008.08.022.
- ^ Coletta, Vítor C.; Gonçalves, Renato V.; Bernardi, María IB; Hanaor, Dorian AH; Assadi, M. Hussein N.; Marcos, Francielle CF; Nogueira, Francisco GE; Assaf, Elisabete M.; Mastelaro, Valmor R. (2021). "Perovskitas SrTiO3 modificadas con Cu hacia una catálisis mejorada por cambio de agua-gas: un estudio experimental y computacional combinado". Materiales Energéticos Aplicados ACS . 4 : 452–461. arXiv : 2104.06739 . doi :10.1021/acsaem.0c02371. S2CID 233231670.
- ^ Jain, Rishabh; Maric, Radenka (abril de 2014). "Síntesis de nano-Pt sobre soporte de ceria como catalizador para la reacción de desplazamiento de agua-gas mediante tecnología de deposición por pulverización reactiva". Catálisis Aplicada A: General . 475 : 461–468. doi :10.1016/j.apcata.2014.01.053.
- ^ Gokhale, Amit A.; Dumesic, James A.; Mavrikakis, Manos (1 de enero de 2008). "Sobre el mecanismo de la reacción de desplazamiento de gas de agua a baja temperatura en el cobre". Revista de la Sociedad Química Americana . 130 (4): 1402–1414. doi :10.1021/ja0768237. ISSN 0002-7863. PMID 18181624.
- ^ Grabow, Lars C.; Gokhale, Amit A.; Evans, Steven T.; Dumesic, James A.; Mavrikakis, Manos (1 de marzo de 2008). "Mecanismo de la reacción de desplazamiento de gas de agua en Pt: primeros principios, experimentos y modelado microcinético". The Journal of Physical Chemistry C . 112 (12): 4608–4617. doi :10.1021/jp7099702. ISSN 1932-7447.
- ^ abcd Nelson, Nicholas C.; Szanyi, János (15 de mayo de 2020). "Activación del hidrógeno heterolítico: comprensión de los efectos de soporte en el desplazamiento de agua-gas, la hidrodesoxigenación y la catálisis de oxidación de CO". ACS Catalysis . 10 (10): 5663–5671. doi :10.1021/acscatal.0c01059. OSTI 1656557. S2CID 218798723.
- ^ Yao, Siyu; Zhang, Xiao; Zhou, Wu; Gao, Rui; Xu, Wenqian; Ye, Yifan; Lin, Lili; Wen, Xiaodong; Liu, Ping; Chen, Bingbing; Crumlin, Ethan (22 de junio de 2017). "Cúmulos de Au en capas atómicas sobre α-MoC como catalizadores para la reacción de desplazamiento de agua-gas a baja temperatura" (PDF) . Science . 357 (6349): 389–393. Bibcode :2017Sci...357..389Y. doi : 10.1126/science.aah4321 . ISSN 0036-8075. PMID 28642235. S2CID 206651887.
- ^ ab Nelson, Nicholas C.; Nguyen, Manh-Thuong; Glezakou, Vassiliki-Alexandra; Rousseau, Roger; Szanyi, János (octubre de 2019). "Formación de intermediarios carboxílicos a través de un sitio activo metaestable generado in situ durante la catálisis por desplazamiento de agua-gas" . Nature Catalysis . 2 (10): 916–924. doi :10.1038/s41929-019-0343-2. ISSN 2520-1158. S2CID 202729116.
- ^ Nelson, Nicholas C.; Chen, Linxiao; Meira, Debora; Kovarik, Libor; Szanyi, János (2020). "Dispersión in situ de paladio en TiO2 durante la reacción inversa de desplazamiento de agua-gas: formación de paladio disperso atómicamente" . Angewandte Chemie International Edition . 59 (40): 17657–17663. doi :10.1002/anie.202007576. ISSN 1521-3773. OSTI 1661896. PMID 32589820. S2CID 220118889.
- ^ Barakat, Tarek; Rooke, Joanna C.; Genty, Eric; Cousin, Renaud; Siffert, Stéphane; Su, Bao-Lian (1 de enero de 2013). "Catalizadores de oro en tecnologías de remediación ambiental y de transferencia de agua-gas". Energy & Environmental Science . 6 (2): 371. doi :10.1039/c2ee22859a.
- ^ King, AD; King, RB; Yang, DB, "Catálisis homogénea de la reacción de desplazamiento del gas de agua utilizando pentacarbonilo de hierro", J. Am. Chem. Soc. 1980, vol. 102, págs. 1028-1032. doi :10.1021/ja00523a020
- ^ Guil-López, R.; Mota, N.; Llorente, J.; Millán, E.; Pawelec, B.; Fierro, JLG; Navarro, RM (2019). "Síntesis de metanol a partir de CO2: una revisión de los últimos avances en catálisis heterogénea". Materiales . 12 (23): 3902. Bibcode :2019Mate...12.3902G. doi : 10.3390/ma12233902 . ISSN 1996-1944. PMC 6926878 . PMID 31779127.
