Célula linfoide innata
Las células linfoides innatas ( ILC ) son la familia de células inmunes innatas descubierta más recientemente , derivadas de los progenitores linfoides comunes (CLP). En respuesta al daño tisular patógeno, las ILC contribuyen a la inmunidad a través de la secreción de moléculas de señalización y la regulación de las células inmunes innatas y adaptativas. Las ILC son principalmente células residentes en los tejidos, que se encuentran tanto en tejidos linfoides (asociados al sistema inmunitario) como no linfoides, y rara vez en la sangre. Son particularmente abundantes en las superficies mucosas, desempeñando un papel clave en la inmunidad y la homeostasis de las mucosas . Las características que permiten su diferenciación de otras células inmunes incluyen la morfología linfoide regular , la ausencia de receptores de antígenos reordenados que se encuentran en las células T y B (debido a la falta del gen RAG ) y los marcadores fenotípicos generalmente presentes en las células mieloides o dendríticas . [1]
Con base en la diferencia en las vías de desarrollo, fenotipo y moléculas de señalización producidas, en 2013, las ILC se dividieron en tres grupos: 1, 2 y 3, sin embargo, después de una mayor investigación, ahora se dividen en cinco grupos: células NK , ILC1, ILC2 , ILC3 y células inductoras de tejido linfoide (LTi). [2] Las ILC están implicadas en múltiples funciones fisiológicas, incluyendo la homeostasis tisular , la morfogénesis , el metabolismo , la reparación y la regeneración. Muchas de sus funciones son similares a las de las células T , por lo tanto, se ha sugerido que son las contrapartes innatas de las células T. [3] La desregulación de las ILC puede conducir a patología inmunológica como alergia , asma bronquial y enfermedad autoinmune . [4]
Clasificación
El desarrollo de las células ILC se inicia en respuesta a la presencia de factores de transcripción que se activan debido a la presencia de factores microambientales circundantes, como: citocinas , ligandos Notch y ritmo circadiano (cambios de comportamiento incorporados que siguen un ciclo diario). Una vez maduras, las células ILC liberan citocinas. Por lo tanto, la clasificación de las células ILC se basa en las diferencias en los perfiles de factores de transcripción y citocinas asociados con el desarrollo y la función de los diferentes subtipos de células ILC. [5]
| Estímulos | Señales tisulares | Celúla | Mediadores | Función inmunológica |
|---|---|---|---|---|
| Tumores Microbios intracelulares (virus, bacterias, parásitos) | IL-12 |  | IFN- γ | Inmunidad tipo 1 ( activación de macrófagos , citotoxicidad , radicales de oxígeno ) |
| Moléculas extracelulares grandes (parásitos y alérgenos) | IL-25 |  | IL-4 , IL-5 , IL-13 , IL-9 | Inmunidad tipo 2 ( producción de moco , activación alternativa de macrófagos, reparación de la matriz extracelular /tejido, vasodilatación , termorregulación) |
| Microbios extracelulares (bacterias, hongos) | IL-1B |  | IL-22 , IL-17 | Inmunidad tipo 3 ( fagocitosis , péptidos antimicrobianos, supervivencia del epitelio) |
| Células organizadoras mesenquimales ( ácido retinoico , CXCL13 , RANK-L) | IL-1B |  | RANK , TNF , linfotoxina | Formación de estructuras linfoides secundarias |
Grupo 1 de las ILC
Los linajes de células ILC1 y NK divergen temprano en sus vías de desarrollo y pueden discriminarse por su diferencia en la dependencia de factores de transcripción , su citotoxicidad y su expresión de marcadores residentes. Las células NK son células citotóxicas, que circulan en el torrente sanguíneo y matan células infectadas por virus y tumorales . Las ILC1 son células residentes en los tejidos no citotóxicas o débilmente citotóxicas, que funcionan en la defensa contra infecciones por virus y ciertas bacterias .
Debido a que las ILC1 y las células NK tienen características compartidas y no compartidas, la clasificación de las ILC1 humanas ha sido problemática. Ambos tipos de células producen IFN-γ como su citocina principal y requieren el factor de transcripción T-bet para hacerlo. [6] Ambas células también pueden producir IFN-γ cuando las citocinas IL-15 o IL-12 se regulan positivamente en los tejidos después de una infección o lesión, y secretan TGFβ1 junto con IFN-γ cuando se estimulan. Esto impulsa la remodelación de la matriz extracelular y epitelial intestinal. [7] La coestimulación con IL-18 también aumenta significativamente los niveles de IFN-γ. [8] La liberación de IFN-γ estimula los macrófagos y otros fagocitos mononucleares para inducir un efecto antimicrobiano que erradique las infecciones intracelulares. Los radicales de oxígeno producidos por ambos tipos de células también ayudan a erradicar la infección. Las células ILC1 y NK también pueden producir TNF-α , lo que contribuye aún más a la respuesta inflamatoria, dependiendo de la expresión de sus moléculas.
Existen diferencias en la dependencia de los factores de transcripción entre las células NK y las ILC1. Aunque ambos tipos de células utilizan T-bet para el desarrollo, se ha descubierto que las células NK están presentes en huéspedes deficientes en T-bet, pero las ILC1 dependen completamente de su presencia. [6] Sin embargo, el desarrollo de las células NK depende completamente de la presencia del factor de transcripción Eomes, mientras que las ILC1 pueden desarrollarse independientemente de su presencia. [6] Esto significa que, en general, Eomes se puede utilizar como un marcador para las células NK, lo que sugiere que las células NK maduras son Tbet + Eomes + y las ILC1 son Tbet + Eomes -. [9]
Las ILC1 y las células NK tienen algunos marcadores fenotípicos en común, entre ellos: NK1.1 en ratones y receptores de células NK (NCR) como NKp44 y NKp46 tanto en humanos como en ratones. [10] [6] También tienen diferencias en los marcadores fenotípicos, incluida la expresión de CD127 en las ILC1 humanas, que no está presente en todas las células NK. Además, NKp80, un marcador de las células NK humanas, no se expresa en las ILC1. En ratones, se ha demostrado que CD200R distingue las células NK de las ILC1. [11] La relación entre los linajes de células ILC1 y NK sigue siendo confusa debido a la falta de estos marcadores característicos presentes en algunas células NK/ILC1 en ciertos tejidos, o después de ciertos eventos de infección/inflamación. Esto respalda la teoría de la función específica del tejido. [10] Por ejemplo, CD127 , aunque expresado por la mayoría de las ILC1, está ausente en las ILC1 residentes en las glándulas salivales, que también tienen la capacidad de expresar Eomes , una característica fundamental de las células NK. [12]
Debido a la producción de granzimas y perforina , las células NK se consideran las contrapartes innatas de las células T CD8+ citotóxicas , mientras que las ILC1 se consideran la contraparte innata de las células T colaboradoras , debido a la producción exclusiva de IFN-γ sin actividad citotóxica. [13]
Grupo 2 de las ILC
Las ILC2 son residentes en los tejidos y participan en la respuesta innata a los parásitos, como la infección por helmintos, ayudando a reparar el daño tisular. Son abundantes en los tejidos de la piel, [14] [15] los pulmones, el hígado y el intestino. [6] [16] Se caracterizan por la producción de anfiregulina y citocinas de tipo 2, incluidas IL-4 , IL-5 e IL-13 , en respuesta a IL-25 , TSLP e IL-33 . [6] Debido a su firma de citocinas, se consideran las contrapartes innatas de las células Th2 .
Expresan marcadores de superficie característicos y receptores para quimiocinas , que están involucradas en la distribución de células linfoides a sitios orgánicos específicos. En humanos, las ILC2 expresan CRTH2 , KLRG1 , SST2 , CD161 y CD25 . [3] En ratones, las ILC2 expresan CD44 , pero no CD161 . [3]
Las ILC2 requieren IL-7 para su desarrollo, lo que activa los factores de transcripción fundamentales RORα y GATA3 . GATA3 también es necesario para el mantenimiento de la función de las ILC2, y la privación de GATA3 inhibe el desarrollo y la función de las células.
Aunque se consideran homogéneas, las ILC2 se pueden clasificar en subpoblaciones de ILC2 naturales (nILC2) e ILC2 inflamatorias (iILC2), dependiendo de su capacidad de respuesta a IL-33 e IL-25. [3] Las nILC2 son las que responden a IL-33 en tejidos en un estado inmune natural, mientras que las iILC2 responden a IL-25 o al parásito helminto. [3] Las nILC2 expresan más Thy1 y ST2 , y KLRG1 reducido . [3] Las iILC2, expresan más KLRG1, y Thy1 y ST2 reducidos. [3] Además de estas subpoblaciones, otra población, llamada célula ILC210, se caracteriza por su capacidad de producir IL-10 . [3]
Grupo 3 de las ILC
Las ILC3 están involucradas en la respuesta inmune innata a las bacterias y hongos extracelulares. Desempeñan un papel clave en la homeostasis de las bacterias intestinales y en la regulación de las respuestas de las células Th17 . [17] Las ILC3 adultas humanas se encuentran principalmente en la lámina propia del intestino y las amígdalas, sin embargo, también se encuentran en el bazo , el endometrio , la decidua y la piel. [18]
Las ILC3 dependen del factor de transcripción RORγt para su desarrollo y función. [19] Expresan RORγt en respuesta a IL-1β e IL-23, o señales patógenas. [20] IL-22 es la principal citocina producida por las ILC3 y desempeña un papel fundamental en el mantenimiento de la homeostasis intestinal. Sin embargo, las ILC3 producen una variedad de otras citocinas, incluidas IL-17, IL-22, IFN-γ y GM-CSF , dependiendo de los estímulos ambientales. [21]
Hay dos subconjuntos de ILC3, NCR- y NCR+ ILC3, con el NCR mostrado en ILC3 de ratones siendo NKp46, en comparación con NKp44 mostrado en ILC3 humanos. [21] Las ILC3 NKp44+ están altamente enriquecidas en las amígdalas y los intestinos, como fuente exclusiva de IL-22. [21] Algunas ILC3 también pueden expresar otros marcadores de células NK, incluyendo NKp30 y CD56 . [22] Las ILC3 NCR- producen principalmente IL-17A e IL-17F, y bajo ciertas circunstancias, IL-22. [23] Las ILC3 NCR- pueden diferenciarse en NCR+ al aumentar los niveles de expresión de T-bet. [5] A pesar de expresar marcadores de células NK, las ILC3 difieren en gran medida de las células NK, con diferentes vías de desarrollo y funciones efectoras.
Células inductoras de tejido linfoide (LTi)

Las células LTi se consideran un linaje separado debido a su vía de desarrollo única, sin embargo, a menudo se las considera parte del grupo ILC3 debido a sus muchas características similares. Al igual que las ILC3, las células LTi dependen de RORγt. Están involucradas en la formación de ganglios linfáticos secundarios y placas de Peyer al promover el desarrollo del tejido linfoide, lo que hacen a través de la acción de la linfotoxina , un miembro de la superfamilia TNF . [6] Son fundamentales durante las etapas embrionarias y adultas del desarrollo del sistema inmunológico y, por lo tanto, las células LTi están presentes en órganos y tejidos temprano durante el desarrollo embrionario. [6] Tienen un papel fundamental en la organización del tejido linfoide primario y secundario y en el tejido linfoide adulto, regulando la respuesta inmune adaptativa y manteniendo las estructuras del tejido linfoide secundario. [25]
Su producción es estimulada por el ácido retinoico , CXCL13, RANK-L y las citocinas IL-1B, IL-23 e IL-6. [26] Expresan c-Kit , CCR6 , CD25 , CD127 y CD90 , sin embargo, no NCR. [6] La expresión de OX40L es otro buen marcador para células LTi en ratones adultos y humanos. [24] Pueden ser CD4+/-. Al igual que las ILC3, tras la activación, las células LTi producen principalmente IL-17A , IL-17F e IL-22. [23] Están mediadas por RANK, TNF , IL-17 e IL-22.
Las células LTi inducen la expresión de AIRE , el gen regulador autoinmune, al permitir el desarrollo de células epiteliales tímicas embrionarias. [24] Lo hacen a través de la señalización de la linfotoxina α4β7 y RANK-L. [24] Las células LTi también permiten la supervivencia de las células T CD4+ de memoria y, por lo tanto, las respuestas inmunitarias de memoria, dentro de los ganglios linfáticos recién formados. [24] Lo hacen a través de los miembros de la superfamilia TNF OX40L y CD30L , que envían señales a las células T CD4+. [24] Esta función podría usarse para prevenir la autoinmunidad y mejorar las respuestas de memoria después de la vacunación. [24]
Desarrollo
Nuestra comprensión de las vías implicadas en el desarrollo de las células madre in situ se ha vuelto clara recién en los últimos años, y nuestro conocimiento se basa principalmente en las vías de los ratones. [6] Las células madre in situ tienen la capacidad de diferenciarse en varios tipos de células diferentes, incluidas las células T, las células B y las células madre in situ, dependiendo de las señales celulares presentes. Con la excepción de las células NK, todas las células madre in situ requieren la señalización de IL-7 para sobrevivir. El represor transcripcional ID2 parece antagonizar la diferenciación de las células B y T , lo que produce un precursor dependiente de ID2 que puede diferenciarse aún más con factores de transcripción específicos del linaje. [4]
Las ILC son independientes del gen activador de recombinación (RAG), en cambio, dependen de la señalización de citocinas a través de la cadena gamma del receptor de citocinas común y la vía de la quinasa JAK3 para su desarrollo. [27]
Desarrollo temprano
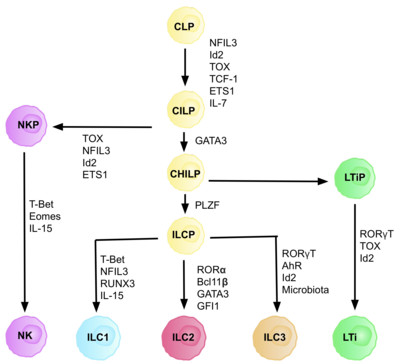
Las células ILC se derivan de progenitores linfoides innatos comunes (CILP), que a su vez se derivan de las células CLP, que tienen la capacidad de diferenciarse en varios tipos de células linfoides diferentes , incluidas las células T y B. [6] Las CILP pueden luego diferenciarse en precursores de células NK (NKP), o los progenitores linfoides innatos auxiliares comunes descritos más recientemente (CHILP). [6] Los CHILP pueden luego diferenciarse en progenitores inductores de tejido linfoide (LTiP) y precursores de células linfoides innatas (ILCP). Los factores presentes en el microambiente determinan la progresión de las CLP hacia subtipos específicos de células ILC, incluidos los ligandos Notch, las citocinas, el ritmo circadiano y la expresión de factores de transcripción. [ cita requerida ]
Identificación de la célula progenitora de ILC (ILCP)
El desarrollo de CLP a CILP y luego a ILC requiere el factor de transcripción ID2 , para mediar la supresión de los destinos de las células linfoides que generan células T y B. [27] Lo hace mediante la reducción de la actividad de los factores de transcripción E-box ( E2A , E2-2 y HEB ), críticos en el desarrollo de células B y T. [27] Inicialmente se asumió que ID2 era necesario para que las CLP se diferenciaran en todos los subconjuntos de ILC, sin embargo, la investigación mostró que la eliminación de ID2 durante el desarrollo de CLP, paraliza el desarrollo de todos los subconjuntos de ILC excepto los progenitores de células NK, que no dependen de la presencia de Id2. [28] Debido a esta constatación, se identificó un grupo de células de linaje negativo (requisito de cualquier célula precursora verdadera), que dependían completamente de la presencia de ID2 y expresaban otros marcadores clave de ILC, con el fenotipo: Lin-ID2+IL7Ra+CD25-α4β7+, que ahora se conocen como los progenitores linfoides innatos similares a los colaboradores comunes CHILP. [28] Se los denomina "similares a los colaboradores comunes" debido a su similitud con los destinos de las células efectoras T colaboradoras.
Dependencia del factor de transcripción
Cada etapa de diferenciación depende de la expresión de diferentes factores de transcripción, incluidos: NFIL3 , TCF-1 , ETS1 , GATA3, PLZF, T-bet, Eomes, RUNX3 , RORα, Bcl11b , Gfi1, RORγt y AhR . [6] La expresión coordinada de estos factores de transcripción específicos activa o reprime genes diana críticos en la diferenciación de los subconjuntos de linfocitos. [27] En particular, Nfil3, cuya expresión está regulada por citocinas, controla la diferenciación de las ILC a través de los factores de transcripción Id2, RORγt, Eomes y Tox . [29] Esto proporciona evidencia de que las señales tisulares juegan un papel clave en las decisiones de destino en los linajes de ILC.
Origen y migración
Los estudios sugieren que el sitio primario de desarrollo de las ILC es el hígado en el feto y la médula ósea en los adultos, ya que es allí donde se han encontrado CLP, NKP y CHILP. [27] Luego, las células salen y circulan en la sangre hasta que llegan a sus tejidos designados, codificados por moléculas de adhesión y quimiocinas . [27] Sin embargo, también se ha demostrado que la maduración de las ILC puede tener lugar fuera de los tejidos linfoides primarios, de forma similar a la maduración de las células T auxiliares vírgenes.
Se han encontrado precursores de células NK y precursores de ILC3 en las amígdalas humanas y ILCP fetales presentes en el intestino del ratón, acumulándose en las placas de Peyer. [30] [31] El ácido retinoico, producido por muchos tipos de células, como las células nerviosas, las células dendríticas y las células del estroma , favorece la diferenciación de las ILC3, en lugar de las ILC2, y es necesario para su maduración completa. [27] Además, AhR, que puede activarse a través de ligandos producidos después del catabolismo alimentario, es necesario para el mantenimiento de la función y la expresión de las ILC3 intestinales. [30]
Función
Las células ILC participan en nuestra respuesta inmunitaria a los patógenos en todos los órganos, en particular en las superficies mucosas. [13] Son clave en la respuesta inmunitaria innata debido a su capacidad de secretar rápidamente citocinas inmunorreguladoras, sin embargo, también desempeñan un papel en la conformación de la respuesta adaptativa al interactuar con otras células inmunitarias. El microambiente del tejido en el que residen determina y afina la expresión de los diversos perfiles de las células ILC, facilitando su interacción en múltiples funciones efectoras.
La posición estratégica y el arraigamiento profundo de las células intercelulares en los tejidos les permiten mantener la homeostasis y, por lo tanto, el funcionamiento saludable de los tejidos. Sin embargo, las células intercelulares también tienen funciones perjudiciales en diferentes sitios de la mucosa. [32]
Dado que la función de las ILC está vinculada a su localización tisular específica, la determinación de las señales involucradas en su localización y patrones de migración será importante para la identificación de nuevas vías para el tratamiento de enfermedades. [21]
Infección por helmintos y reparación de tejidos
Una propiedad fundamental de la inmunidad de tipo 2, y por lo tanto de las células ILC2, es lidiar con organismos de gran tamaño, que no pueden ser digeridos, como los helmintos . [33] En el intestino, en respuesta a una infección por helmintos, las células epiteliales secretan altos niveles de IL-25, activando las células ILC2. Las ILC2 producen IL-13, que impulsa la diferenciación de células epiteliales adicionales, a través de las vías de señalización Notch. Esta instrucción permite que el tejido se remodele para permitir la expulsión del parásito helminto y otros patógenos grandes.
La IL-13 también activa las células T, induciendo respuestas fisiológicas adicionales para expulsar al parásito. [34] Las células T estimulan la secreción de moco de las células caliciformes, la contracción del músculo liso y secretan señales que reclutan mastocitos y eosinófilos al sitio, estimulando la proliferación de células B. [34]
La infección puede provocar daños en los tejidos debido a la migración del helminto. Las ILC2 tienen un papel clave en la reparación del daño tisular después de la infección, al producir ligandos como AREG , para los receptores del factor de crecimiento epitelial, lo que facilita la diferenciación de las células epiteliales para la reparación tisular. [6] Esto puede funcionar para mejorar la función de barrera del epitelio y retardar la entrada de patógenos. [34]

En múltiples nichos tisulares, las ILC tienen una relación con células no hematopoyéticas, como las células del estroma. En el pulmón, las ILC2 tienen una localización distinta en las células del estroma, que liberan IL-33 y TSLP, lo que promueve la homeostasis de las ILC2, tanto en estado estable como en respuesta a la infección por helmintos, después de que estos se han desarrollado en el intestino y han migrado al pulmón a través de la sangre. [35]
Las ILC2 pulmonares se encuentran cerca de los vasos sanguíneos, lo que permite el reclutamiento de eosinófilos de la sangre. También se encuentran dentro de las vías respiratorias, donde pueden acumularse patógenos potenciales. Esto significa que están en estrecho contacto con las células neuroendocrinas , que activan las ILC2 a través de la liberación del péptido relacionado con el gen de la calcitonina . [36] Otros estudios también confirman la regulación de la función de las ILC a través de circuitos neuronales .
Además, las ILC1 y las ILC3 liberan radicales de oxígeno y enzimas letales en respuesta a una infección patógena, lo que provoca daños en el tejido del huésped. Las respuestas de reparación del tejido están coordinadas por la respuesta inmunitaria de tipo 2, después de que las ILC3 y las ILC1 hayan limpiado el tejido de microbios y residuos.
Mucosa intestinal
Las células ILC intestinales están expuestas a metabolitos dietéticos, microbianos y endógenos. La migración de las células ILC al intestino delgado está mediada por la integrina α4β7 y el receptor CCR9. Las células ILC2 expresan CCR9 en la médula ósea, por lo que pueden trasladarse directamente al intestino; sin embargo, se requiere ácido retinoico para permitir la expresión de CCR9 en las células ILC1 y ILC3.
Las ILC facilitan el mantenimiento de la integridad de la barrera intestinal, protegiendo de diversas bacterias e infecciones virales. Las ILC3 son el subconjunto más abundante presente tanto en el intestino adulto como en el fetal. [37] La distribución de las ILC en el intestino cambia durante el desarrollo y se distribuyen de manera desigual a lo largo de los segmentos del tracto gastrointestinal. Esta distribución a diferentes nichos dentro del intestino está mediada por distintas cascadas de señalización. [38] En los humanos, aproximadamente el 70% de las ILC intestinales son NCR+ y el 15% son NCR-. [39]

Las ILC3 interactúan directamente con la flora bacteriana , creando una red entre la microbiota y el huésped, favoreciendo la homeostasis. Las ILC3 restringen la colonización de múltiples bacterias no beneficiosas en el intestino, a través de la secreción de IL-22, estimulando las células epiteliales para producir péptidos antimicrobianos. [40] La producción de IL-22 es inducida debido a la producción de IL-23 e IL-1β por macrófagos y DC, y promueve la curación de la capa mucosa. [3] Por ejemplo, IL-22 puede promover la reparación del daño intestinal después de la quimioterapia o radioterapia . Las ILC3 regulan la contención de bacterias comensales en el lumen, lo que permite que se expongan a los fagocitos de la lámina propia, lo que conduce a la preparación de las células T. Aunque pueden presentar antígenos, a través de los receptores MHC de clase II , las ILC carecen de moléculas coestimuladoras y, por lo tanto, juegan un papel en la anergia de las células T , promoviendo la tolerancia a los comensales beneficiosos. [39] Por lo tanto, la relación entre las ILC3 y las células T en el intestino es crucial para mantener la homeostasis, ya que en ausencia de las ILC3, podría haber una activación descontrolada de las células T. Además, la microbiota desempeña un papel en el ajuste fino de la producción de IL-22 por las ILC3, por ejemplo, las bacterias filamentosas segmentadas en el íleon regulan la producción de IL-22 y permiten la diferenciación de las células Th17. [41] [42]
Las ILC3 interactúan con el sistema nervioso entérico para mantener la homeostasis intestinal, ya que en respuesta a las bacterias, las células gliales en la lámina propia secretan factores neurotróficos , que a través del receptor neurorregulador RET , inducen la producción de IL-22 por las ILC3. [43] Las células dendríticas también pueden producir IL-23 durante el estrés inducido por patógenos, activando también las ILC3 permitiendo la producción de IL-22. Uno de los mecanismos por los cuales la IL-22 regula la microbiota presente en el intestino es a través de los patrones de glicosilación de las células epiteliales. [44] La expresión de IL-22 y linfotoxina por las ILC3 controla la expresión de la fucosiltransferasa 2, que permite la fucosilación de las células epiteliales, proporcionando una fuente de nutrientes para las bacterias luminales. [44]
Los ligandos AHR de la dieta o la microbiota son reconocidos por las células inmunes, regulando el desarrollo de las ILC y las funciones de las células NK en el intestino. En respuesta a los metabolitos del triptófano, la señalización de AhR mantiene la expresión de IL-22 y la homeostasis intestinal. [6] El ácido retinoico, producido por las células dendríticas, promueve la expresión de receptores de localización intestinal en las ILC1 y las ILC3, y mejora la función de las ILC3, al regular positivamente RORγt e IL-22. [6] También existe una comunicación cruzada entre los macrófagos y las ILC3, a través de la producción de GM-CSF impulsada por RORγt, que depende de la señalización microbiana, y la producción de IL-1β por los macrófagos. [39] Una deficiencia en la dieta de vitamina A da como resultado un número anormalmente pequeño de ILC3 y, por lo tanto, una reducción de la producción de IL-22 y una mayor susceptibilidad a las infecciones. Por el contrario, el ácido retinoico suprime la proliferación de ILC2 al regular negativamente IL-7Ra , y se ha demostrado que la privación de vitamina A mejora la resistencia mediada por ILC2 a la infección por helmintos en ratones. [39] Por lo tanto, las ILC3 forman una red de interacciones para mantener la homeostasis intestinal, entre el microbioma , el epitelio intestinal, las células neurogliales y otras células inmunes.
Las células LTi están presentes en las placas de Peyer y los folículos linfoides , interactuando con las células B facilitando la producción de IgA , que promueve el comensalismo del huésped con la microbiota local. [45] Las ILC1 y las células NK producen IFN-γ para combatir los patógenos intracelulares. Tras la infección de C. difficile , las ILC1 y las ILC3 cooperan para combatir la infección. [46] Las ILC2 inducen la diferenciación de las células caliciformes y la producción de moco en el intestino para proteger del daño tisular tras la infección parasitaria.
Microambiente tumoral
Diferentes grupos de células linfoides innatas tienen la capacidad de influir en la tumorigénesis de varias maneras. [47] [48]
Las células NK del grupo 1 son la población de células NK con el potencial antitumoral más significativo, y poseen la capacidad de reconocer la falta de MHC de clase I en la superficie de las células tumorales. [49] De esta manera, actúan de manera complementaria con las células T citotóxicas que reconocen y destruyen las células tumorales que presentan un antígeno extraño en el MHC de clase I. [50] [51] Las células NK expresan una serie de receptores de células NK activadores de la superficie celular con especificidad para ligandos inducidos por estrés sobreexpresados en las células tumorales. Consulte la página de células asesinas naturales para obtener más información sobre las células NK en la vigilancia tumoral.
Las ILC1 influyen en el microambiente tumoral mediante la producción de las citocinas IFN-γ y TNF-α, que al comienzo de la respuesta inmune polarizan otras células inmunes, como los macrófagos M1 , las células dendríticas y las células T citotóxicas al sitio, creando un ambiente inflamatorio. [52] Si tiene éxito, el reclutamiento de estas células matará a las células tumorígenas, sin embargo, en algunos casos, IFN-γ y TNF-α pueden desempeñar un papel en la inducción de células inmunes inmunosupresoras, como las MDSC , y por lo tanto citocinas antiinflamatorias, lo que permite un entorno inmunológico del que las células tumorales pueden escapar . [53] [54] [48]
El papel de las ILC2 e ILC3 en la vigilancia tumoral depende del microambiente que encuentran en sus tejidos residentes.
Las ILC2 producen citocinas que promueven una respuesta inmune antiinflamatoria, por ejemplo IL-13, IL-4, anfirregulina, que favorecen el crecimiento tumoral. [55] Sin embargo, en algunos entornos, las ILC2 pueden producir IL-5, lo que promueve una respuesta citotóxica de los eosinófilos y, por lo tanto, una respuesta antitumoral. [56] [57]
Las ILC3 también pueden estar implicadas en entornos pro o antitumorales. La producción de IL-17 puede favorecer el crecimiento de tumores y metástasis, ya que induce la permeabilidad de los vasos sanguíneos; sin embargo, la regulación positiva del MHC de clase II en su superficie puede preparar a las células T CD4+, lo que tiene un efecto antitumoral. [58] Además, se ha informado que las ILC3 promueven la formación de estructuras linfoides terciarias en el cáncer de pulmón, lo que desempeña un papel protector. [59]
Hígado y metabolismo

Todos los subconjuntos de ILC están presentes en el hígado y regulan la respuesta inmunitaria para proteger el tejido de infecciones virales y bacterianas. [60] Las ILC1 son el subconjunto dominante de ILC presente en el hígado. Su producción de IFN-γ promueve la supervivencia de los hepatocitos . [61] La producción de IFN-γ por las ILC1 depende de la expresión del receptor de células NK CD226 . [61] La producción de IFN-γ impulsada por IL-12 por las ILC1 es acelerada por el ATP extracelular , y el IFN-γ regula positivamente las moléculas prosupervivencia Bcl-2 y Bcl-xL en los hepatocitos. [61]
Las células NK desempeñan un papel en la respuesta inmunitaria contra las hepatitis virales B y C , limitando la fibrosis hepática y el cáncer de hígado . Eliminan las células hepáticas en el hígado fibrótico a través de TRAIL y/o NKG2D .
Las ILC desempeñan un papel importante en el mantenimiento del estrés alimentario y la homeostasis metabólica. La producción de metabolitos de triptófano hace que el factor de transcripción AhR induzca la expresión de IL-22, manteniendo el número de ILC3 presentes y, por lo tanto, la homeostasis intestinal. [6] El metabolito de la vitamina A, el ácido retinoico, también regula positivamente la expresión de IL-22 y, por lo tanto, la ausencia de la vía de señalización de AhR y del ácido retinoico da como resultado una inmunidad reducida a las infecciones bacterianas, como la infección gastrointestinal por Citrobacter rodentium . [6] El ácido retinoico también mejora la expresión de marcadores de anidación intestinal en las ILC1 y las ILC3. Por lo tanto, la disponibilidad de nutrientes en la dieta modifica la respuesta inmune de las ILC a la infección y la inflamación, lo que resalta la importancia de una dieta equilibrada y saludable.
Las ILC2 apoyan un ambiente inmune tipo 2 en el tejido adiposo , a través de la producción de IL-5, IL-4 e IL-13. Esto regula la adiposidad, la resistencia a la insulina y el gasto calórico. [6] La desregulación de esto causa una inflamación persistente tipo 1, que conduce a la obesidad . Las ILC2 promueven la formación de adipocitos y, por lo tanto, un mayor gasto de energía. Por lo tanto, la disminución de las respuestas de las ILC2 en el tejido es una característica de la obesidad, ya que esto interrumpe su papel crucial en la homeostasis energética, lo que resulta en un menor gasto de energía y un mayor adiposidad. [62] Además de las ILC2, las ILC1 contribuyen a la homeostasis de los macrófagos del tejido adiposo tanto en condiciones delgadas como obesas, constituyendo el 5-10% de la población de linfocitos residentes, en los depósitos adiposos magros humanos. [10] Una dieta alta en grasas aumenta el número de ILC1 y la activación del tejido adiposo, aumentando los niveles de IFN-γ y TNF-α. Las ILC1 producen el quimioatrayente de macrófagos CCL2 y, por lo tanto, la señalización de ILC1-macrófagos es un regulador clave del tejido adiposo. [63] Esta vía podría ser un objetivo potencial para el tratamiento de pacientes con enfermedad hepática .
Infección respiratoria
Las ILC2 promueven la proliferación de células epiteliales y caliciformes y, por lo tanto, la producción de moco en el tracto respiratorio. Estas funciones contribuyen a la restauración y el mantenimiento de la integridad epitelial. Las ILC2 proporcionan una defensa contra las infecciones por helmintos en el pulmón, a través de la producción de AhR, IL-9 e IL-13. [64] Se cree que estas ILC2 se originan en el intestino y migran al pulmón para combatir la infección por helmintos. [65]
Las células ILC1 y NK secretan IFN-γ en respuesta a infecciones virales en los pulmones, incluidos el rinovirus y el virus respiratorio sincitial (VSR). [3]
Las ILC3 también están implicadas en infecciones pulmonares, a través de la secreción de IL-17 e IL-22, por ejemplo en la infección por S. pneumoniae . Se requieren más estudios para descifrar el papel de las ILC en las infecciones respiratorias humanas. [66]
Reparación de la piel

La evidencia muestra que las ILC3 y las ILC2 se reclutan en la dermis herida tanto en ratones como en humanos, a través de la señalización epidérmica Notch1. [39] Las ILC3 secretan IL-17F, que desempeña un papel en las respuestas inmunitarias y celulares epiteliales durante la cicatrización de heridas, al reclutar macrófagos al sitio. La expresión de TNF también desempeña un papel en la cicatrización de heridas, ya que dirige la localización de las ILC3 en la epidermis de la piel dañada. [39] En respuesta a la liberación de IL-33 por la epidermis, las ILC2 secretan altos niveles de anfiregulina, un factor de crecimiento epidérmico crítico, por lo tanto, contribuyendo a la cicatrización de heridas cutáneas . [39]
Mucosa oral
La mucosa oral está colonizada por comensales y está expuesta a antígenos y patógenos de la dieta. Las ILC en la mucosa oral ayudan a mantener la barrera y protegen contra infecciones. Las ILC3 y las ILC1 intraepiteliales se identificaron inicialmente en las amígdalas y se encontraron en las encías humanas. Aproximadamente el 10-15% de los linfocitos se identificaron como ILC, la mayoría de ellos produciendo ILC1 de IFN-γ. Las ILC3 en la orofaringe protegen contra la infección de Candida albicans produciendo IL-17A e IL-17F inducidas por IL-23. Los ratones que carecían de ILC3 debido a la eliminación o depleción de RORγt sufrieron infecciones graves por Candida albicans. [67]
Vías respiratorias
Se ha demostrado que las ILC pueden secretar neurotransmisores y neuropéptidos en los pulmones. Las ILC2 interactúan con las neuronas del tracto respiratorio por la proximidad a las fibras nerviosas, y las ILC2 productoras de IL-5 residentes en los pulmones se encuentran en regiones ricas en colágeno cerca de la confluencia de vasos sanguíneos de tamaño mediano y vías respiratorias. Además, las ILC2 productoras de IL-5 se encuentran en células neuroendocrinas pulmonares en las uniones de las ramificaciones de las vías respiratorias en las que se concentran las partículas que entran en las vías respiratorias. La localización de las ILC2 en las vías respiratorias sugiere que la residencia de las ILC2 está definida por microambientes en diferentes zonas del tejido. [68]
Circuitos circadianos
Las interacciones entre el reloj circadiano y las células intercelulares intestinales se han demostrado mediante el estudio de la regulación del reloj genético maestro Arntl. Su eliminación dio lugar a la desregulación de las células intercelulares intestinales (ILC3) causada por cambios epigenéticos, lo que impulsó la expresión de IL-22 y contribuyó a la alteración del microbioma, las células epiteliales y una absorción interrumpida de lípidos en el intestino. Por otro lado, la eliminación de Nr1d1, una proteína implicada en la regulación de las respuestas metabólicas circadianas, dio lugar a la reducción de las ILC3 NCR+ y al aumento de la producción de IL-17, mientras que no afectó a las ILC3 similares a LTi. [69]
Patología
Asma

Se ha confirmado que las ILC2 desempeñan un papel patogénico durante la inflamación pulmonar. Las células epiteliales del pulmón expresan las citocinas IL-33 e IL-25, o TSLP, en respuesta a varios alérgenos , hongos y virus. Estas citocinas activan las ILC2 y, por lo tanto, hay un mayor número de ILC2 y citocinas de tipo 2 (IL-4/5/13) en pacientes con asma alérgica. [3] Secretan IL-13, lo que inicia la inflamación pulmonar alérgica y, además, promueven la diferenciación Th2, lo que aumenta la producción de IL-13 y, por lo tanto, amplifica la respuesta alérgica. [70]
La producción de IL-5 por las ILC2 en el pulmón conduce al reclutamiento de eosinófilos, y se sabe que otras poblaciones celulares interactúan y dan forma a la presencia de ILC2 pulmonares en la inflamación de las vías respiratorias en pacientes asmáticos. Además, también promueven la proliferación de células B. Se cree que el aumento de la presencia de ILC2 se correlaciona con la gravedad de la enfermedad, y la evidencia confirma que algunas ILC2 "experimentadas con alérgenos" persisten después de la resolución de la inflamación inicial, mostrando similitudes con las células T de memoria. La presencia de las ILC2 "experimentadas con alérgenos" puede ser la razón por la que los pacientes asmáticos a menudo están sensibilizados a varios alérgenos. [39]
Esta respuesta inmune alérgica parece ser independiente de las células T y B, y hay evidencia que confirma que se pueden inducir respuestas alérgicas que se asemejan a los síntomas del asma en ratones que carecen de células T y B, utilizando IL-33. [71] [72]
No está tan claro cómo afectan otras células ILC al asma, pero los estudios muestran una correlación entre la cantidad de células ILC3 productoras de IL-17 y la gravedad de la enfermedad. Se ha demostrado en ratones que las células NK y las ILC1 inhiben la expansión de las ILC2 debido a la producción de IFN-γ y, por lo tanto, pueden ayudar a controlar la enfermedad. Se requieren más investigaciones en pacientes humanos para determinar cómo afecta el equilibrio entre los diferentes subconjuntos al asma. [73]
Enfermedad autoinmune
Las células NK expresan muchos receptores de superficie celular que pueden ser activadores, inhibidores, de adhesión, de citocinas o quimiotácticos. La integración de la información recopilada a través de estas numerosas entradas permite a las células NK mantener la autotolerancia y reconocer las señales de estrés de las células propias. [74] Si la regulación dinámica y matizada de la activación de las células NK se desequilibra a favor del ataque a las células propias, se desarrolla patología de enfermedad autoinmune. La desregulación de las células NK se ha relacionado con una serie de trastornos autoinmunes, entre ellos la esclerosis múltiple , el lupus eritematoso sistémico y la diabetes mellitus tipo I. [ 75]
La evidencia sugiere que la focalización de las células IL-1 puede ser beneficiosa en el diseño de terapias para trastornos autoinmunes. Como las células IL-1 y las células T tienen muchas funciones redundantes, la focalización y neutralización de sus citocinas efectoras podría ser una mejor opción. Alternativamente, la focalización de sus mediadores activadores ascendentes (IL-23, IL-1B o IL-6), o sus factores de supervivencia (IL-7) podrían usarse como un enfoque para tratar enfermedades inflamatorias. [21]
Rinitis alérgica

También se ha descubierto que la frecuencia de ILC2 está elevada en otros tejidos con síntomas alérgicos, como los pólipos nasales de pacientes con rinosinusitis crónica y en pacientes con enfermedad respiratoria exacerbada por aspirina . [3] La concentración de ILC2 se correlaciona positivamente con la gravedad de las enfermedades.
Las ILC2 se activan debido a la presencia de TSLP e IL-4, producidas por células epiteliales y eosinófilos respectivamente. Luego producen IL-4, IL-5 e IL-13, activando aún más a los eosinófilos, en un ciclo de retroalimentación positiva , que promueve la inflamación. La interrupción de este ciclo podría ser una terapia potencial para la rinitis. Las células NK parecen desempeñar un papel beneficioso, ya que están menos presentes en las personas con rinitis alérgica. [76]
Enfermedad inflamatoria intestinal (EII) y cáncer intestinal
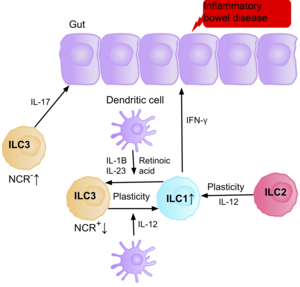
Las investigaciones sugieren que las ILC3 productoras de NCR que producen IL-17 contribuyen a la fisiopatología de la EII debido a su mayor abundancia en el intestino de los pacientes con enfermedad de Crohn . [39] Además, la cantidad de ILC1 en la mucosa intestinal de los pacientes con enfermedad de Crohn aumenta de aproximadamente el 10% al 40% del total de ILC presentes. [39] El aumento de las ILC presentes se correlaciona con la gravedad de la enfermedad. La evidencia sugiere que la plasticidad entre las ILC3 y las ILC1 en el intestino es un factor importante de la enfermedad de Crohn, y que las ILC3 se diferencian en ILC1 cuando se exponen a la IL-12 producida por las células dendríticas. [39] Sin embargo, la IL-23, la IL-1B y el ácido retinoico presentes en el intestino pueden impulsar la diferenciación de las ILC1 de nuevo a las ILC3. [39] La evidencia también sugiere la capacidad de las ILC2 de adquirir el fenotipo proinflamatorio, con las ILC2 produciendo IFN-γ presente en el intestino de pacientes con enfermedad de Crohn, en respuesta a ciertos factores ambientales como las citocinas. [39]
Los pacientes con EII tienen un mayor riesgo de padecer cáncer intestinal debido a la inflamación crónica, cuando las ILC3 adquieren el fenotipo proinflamatorio ILC1 durante la inflamación crónica. Dado que las ILC se acumulan en el intestino de los pacientes con EII, se cree que pueden tener un papel protumorigénico. En apoyo de esto, los estudios muestran un aumento en la cantidad de citocinas efectoras IL-23, IL-17 e IL-22 en el microambiente tumoral del cáncer intestinal. [77] [78] [79]
Las células NK secretan IFN-γ, que tiene efectos antitumorales. Múltiples estudios muestran una disminución de la frecuencia de células NK e IFN-γ presentes en el intestino o la sangre periférica de pacientes con cáncer intestinal. [80] [81] Se requieren más estudios para abordar su papel exacto en el entorno del cáncer intestinal.
Cáncer de hígado y obesidad
Las ILC1 hepáticas contribuyen a la patogénesis de la hepatitis B crónica debido a la producción de IFN-γ y TNF-α. La alteración del epitelio que recubre los conductos biliares hepáticos se observa con frecuencia en respuesta a la inflamación hepática crónica, y el aumento de la proliferación de estos conductos se asocia con el cáncer de hígado. [60] La evidencia sugiere que la proliferación mejorada es desencadenada por IL-13, que es producida por la producción inducida por IL-33 de células ILC2. También se ha demostrado que las ILC2 mejoran la progresión de la fibrosis hepática, lo que a su vez promueve el desarrollo de cáncer de hígado. [60]
La disponibilidad de nutrientes dietéticos específicos puede afectar la homeostasis inmunológica de las ILC al alterar la energía almacenada en el tejido adiposo. El tejido adiposo mantiene la homeostasis metabólica y ahora se considera un órgano completamente inmunocompetente. La desnutrición y la glotonería pueden desregular las respuestas de las ILC a través de cambios en los nutrientes dietéticos, lo que tiene efectos directos en la energía almacenada en el tejido adiposo. [10] La obesidad se asocia con cambios en la flora gastrointestinal, mayor afluencia de ácidos grasos libres desde el tejido adiposo al hígado y mayor permeabilidad intestinal. [10] La estrecha proximidad anatómica del tracto gastrointestinal y el hígado significa que el transporte de metabolitos bacterianos a través de la vena porta desencadena la inflamación, actuando sobre las células inmunes innatas, incluidas las ILC1, por lo tanto, desempeñando un papel importante en la activación de un estado inflamatorio en el hígado. Por lo tanto, la inflamación asociada con la obesidad puede influir en la progresión de la enfermedad hepática, debido al desarrollo de resistencia a la insulina y desregulación metabólica. [10] Las ILC1, como reguladoras clave de la inflamación del tejido adiposo, son por lo tanto un objetivo terapéutico potencial para el tratamiento de personas con enfermedad hepática o síndrome metabólico .
También se han identificado ILC2 en el tejido adiposo blanco de humanos y ratones , lo que contribuye al desarrollo de la obesidad. Cuando se produce una desregulación de la homeostasis en el tejido adiposo, la disminución de las respuestas de las ILC2 es una característica de la obesidad, ya que esto interrumpe su papel crucial en la homeostasis energética, lo que da como resultado un menor gasto energético y un aumento de la adiposidad. [62]
Inflamación de la piel
La frecuencia de las ILC2 es mayor en la piel inflamada de pacientes con dermatitis atópica que en pacientes sanos. [39] Las ILC2 de la piel de los pacientes tenían una regulación positiva de los receptores IL-25, IL-33, TSLP y PGD2, lo que sugiere su papel en la activación de las ILC2. Los basófilos y los mastocitos también están presentes en estas lesiones cutáneas, que producen IL-4 y PGD2 , lo que activa aún más las ILC2.


La psoriasis , otra enfermedad inflamatoria de la piel, causa un engrosamiento epidérmico, formando placas que están pobladas principalmente por células T y células dendríticas. Las células T presentan una respuesta inmune de tipo 1; sin embargo, se cree que el engrosamiento y la inflamación de la epidermis son causados por la producción de IL-22, IL-17A e IL-17F por otras células T como las células T Th17 o γδ . [39] Sin embargo, datos más recientes sugieren que las ILC3 de hecho producen una gran cantidad de estas citocinas, con un aumento en la cantidad de ILC3 en la sangre periférica de pacientes con psoriasis. [39]
Artritis
Las células ILC se han estudiado en las barreras mucosas y su interacción con la inmunidad adaptativa, implicándolas así con enfermedades autoinmunes. En la artritis caracterizada por la presencia de autoanticuerpos, la comunicación cruzada desregulada entre las células Tfh y B se ha implicado en la generación de esos anticuerpos. Curiosamente, se ha sugerido que las respuestas inflamatorias Th17 y Tfh se generan en el tracto gastrointestinal y que la microbiota puede aumentar esta respuesta. Por lo tanto, el desarrollo de las células ILC implicadas en la regulación de la respuesta inmune contra la microbiota en el intestino se ha asociado con la artritis. En el caso de las ILC2 tiene un papel importante en la regulación de las respuestas inflamatorias mediante la producción de IL-4, IL-9 e IL-13. [82]
Esclerosis múltiple
En el caso de las ILC3 en la esclerosis múltiple, estas células se han relacionado con los agregados linfoides terciarios en el cerebro de pacientes con enfermedad progresiva. Además, el aumento de las ILC3 similares a LTi se correlacionó con los autoanticuerpos en el líquido encefálico. [82]
Plasticidad
Nuestra clasificación de las células ILC en subconjuntos proporciona un marco simplificado; sin embargo, a pesar del sistema de clasificación anterior, varios estudios sugieren que su desarrollo y mantenimiento fenotípico es mucho más complejo, con un alto nivel de plasticidad entre los subconjuntos. Los estudios han confirmado la capacidad de algunos subconjuntos de células ILC de convertirse en un subconjunto diferente en presencia de citocinas específicas. [13] [47] Esta es también una característica común en las células T, y se cree que esta plasticidad es fundamental para permitir que nuestro sistema inmunológico ajuste las respuestas a tantos patógenos diferentes. [13] La plasticidad de las células ILC requiere receptores de citocinas, sus factores de transcripción y el acceso de regiones de cromatina definidas a los factores de transcripción; sin embargo, aún no está claro dónde se producen estas citocinas y dónde se produce la diferenciación in vivo. [6]

Las ILC presentes en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) son un ejemplo prototípico de plasticidad de las ILC. Estudios tanto en humanos como en ratones han demostrado que las ILC2 residentes en los pulmones adquieren un fenotipo ILC1 durante la EPOC, lo que aumenta la secreción de IFN-γ y, por lo tanto, la inflamación. [83] Varios desencadenantes, incluido el humo del cigarrillo, causan la secreción de IL-12 e IL-18, lo que provoca la diferenciación de las ILC2 en ILC1. La expresión de GATA3 se regula a la baja y la expresión de T-bet se regula al alza. [83] Por lo tanto, los pacientes tienen una mayor proporción de ILC1:ILC2 en sangre, y la abundancia de ILC1 presentes se correlaciona con la gravedad de la enfermedad. [83]
La capacidad de las ILC3 de convertirse en células similares a las ILC1 se ha demostrado in vitro e in vivo. [84] [85] [47] Cuando las ILC3 se cultivan con IL-2 e IL-15, provocan la regulación positiva de T-bet y del receptor de IL-12 (IL-12R) β2, lo que permite la conversión de las ILC3 en ILC1. Además, los estudios sugieren que la IL-23 puede promover la conversión de las ILC1 en ILC3. [85]
Cada vez hay más evidencia que indica que las ILC2 también tienen un cierto grado de plasticidad, y hay estudios que confirman su capacidad de convertirse en ILC1 e ILC3 tras la exposición a estímulos ambientales específicos, como citocinas o ligandos Notch. [86] [47]
La señalización inducida por las citocinas regula la plasticidad entre ILC3 e ILC1, induciendo la expresión de T-bet. En pacientes con enfermedad de Crohn, el aumento de ILC1 a expensas de ILC3 posiblemente por la producción de IL-2 a partir de células T reguladoras, lo que lleva a un estado patogénico y eventos inflamatorios. Aunque la plasticidad es reversible, durante la diferenciación de ILC3 NKp46+ a ILC1, la modulación de la expresión de T-bet depende de IL-23, IL-2 e IL-1b y se mejora con ácido retinoico. Por lo tanto, la plasticidad de ILC3 a ILC1 depende de las células dendríticas que producen estas citocinas. Aunque la interconversión de ILC1 e ILC3 está modulada por la expresión diferencial de RORγt y T-bet, quedan diferentes preguntas que deben explicarse para comprender la inflamación causada por estas células. [87]
En el caso de ILC2, Gata3 puede verse inhibida debido a la exposición a agentes infecciosos como el virus de la influenza, el virus respiratorio sincitial y Staphylococcus aureus, lo que aumenta la expresión de IL12Rb2, IL-18Ra y T-bet. La diferenciación de ILC2 a ILC1 también puede ser reversible, aunque el mecanismo aún no se comprende. [87]
En ciertos entornos, como la inflamación, las enfermedades crónicas o los microambientes tumorales, las células NK activadas pueden comenzar a expresar CD49a y CXCR6 , marcadores comunes de ILC1, lo que fortalece sus propiedades plásticas. [88] [89]
Determinar el grado de plasticidad de las ILC durante la enfermedad podría ser útil para permitirnos prevenir o mejorar su conversión en otros subconjuntos que pueden estar contribuyendo a la patogenicidad. [47] [90]
Innato o adaptativo
Históricamente, la distinción entre el sistema inmunitario innato y adaptativo se centraba en la naturaleza no específica y la falta de memoria del sistema innato. [91] A medida que ha surgido información sobre las funciones de las células NK y otras células ILC como efectoras y orquestadoras de la respuesta inmunitaria adaptativa, esta distinción se ha vuelto menos clara. Algunos investigadores sugieren que la definición debería centrarse más en la codificación de la línea germinal de los receptores en el sistema inmunitario innato frente a los receptores reordenados del sistema inmunitario adaptativo. [74]
Véase también
Referencias
- ^ Spits H, Cupedo T (2012). "Células linfoides innatas: nuevos conocimientos sobre el desarrollo, las relaciones de linaje y la función". Revisión anual de inmunología . 30 : 647–75. doi :10.1146/annurev-immunol-020711-075053. PMID 22224763.
- ^ Spits H, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. (febrero de 2013). "Células linfoides innatas: una propuesta para una nomenclatura uniforme". Nature Reviews. Inmunología . 13 (2): 145–9. doi : 10.1038/nri3365 . PMID 23348417. S2CID 2228459.
- ^ abcdefghijkl Panda SK, Colonna M (2019). "Células linfoides innatas en la inmunidad de las mucosas". Frontiers in Immunology . 10 : 861. doi : 10.3389/fimmu.2019.00861 . PMC 6515929 . PMID 31134050.
- ^ ab Walker JA, Barlow JL, McKenzie AN (febrero de 2013). "Células linfoides innatas: ¿cómo pudimos pasarlas por alto?". Nature Reviews. Inmunología . 13 (2): 75–87. doi :10.1038/nri3349. PMID 23292121. S2CID 14580303.
- ^ ab Klose CS, Kiss EA, Schwierzeck V, Ebert K, Hoyler T, d'Hargues Y, et al. (febrero de 2013). "Un gradiente de T-bet controla el destino y la función de las células linfoides innatas CCR6-RORγt+". Nature . 494 (7436): 261–5. Bibcode :2013Natur.494..261K. doi :10.1038/nature11813. PMID 23334414. S2CID 4390857.
- ^ abcdefghijklmnopqrstu vw Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. (Agosto de 2018). "Células linfoides innatas: 10 años después". Celúla . 174 (5): 1054-1066. doi : 10.1016/j.cell.2018.07.017 . PMID 30142344.
- ^ Jowett GM, Norman MD, Yu TT, Rosell Arévalo P, Hoogland D, Lust ST, et al. (febrero de 2021). "ILC1 impulsa la remodelación del epitelio intestinal y de la matriz". Nature Materials . 20 (2): 250–259. Código Bibliográfico :2021NatMa..20..250J. doi :10.1038/s41563-020-0783-8. PMC 7611574 . PMID 32895507. S2CID 221521946.
- ^ Daussy C, Faure F, Mayol K, Viel S, Gasteiger G, Charrier E, et al. (marzo de 2014). "T-bet y Eomes instruyen el desarrollo de dos linajes distintos de células asesinas naturales en el hígado y en la médula ósea". The Journal of Experimental Medicine . 211 (3): 563–77. doi : 10.1084/jem.20131560 . PMC 3949572 . PMID 24516120.
- ^ Simonetta F, Pradier A, Roosnek E (2016). "T-bet y eomesodermina en el desarrollo, la maduración y la función de las células NK". Frontiers in Immunology . 7 : 241. doi : 10.3389/fimmu.2016.00241 . PMC 4913100 . PMID 27379101.
- ^ abcdef Luci C, Vieira E, Perchet T, Gual P, Golub R (2019). "Las células asesinas naturales y las células linfoides innatas tipo 1 son nuevos actores en la enfermedad del hígado graso no alcohólico". Frontiers in Immunology . 10 : 1192. doi : 10.3389/fimmu.2019.01192 . PMC 6546848 . PMID 31191550.
- ^ Weizman OE, Adams NM, Schuster IS, Krishna C, Pritykin Y, Lau C, et al. (noviembre de 2017). "ILC1 confiere protección temprana al huésped en los sitios iniciales de infección viral". Cell . 171 (4): 795–808.e12. doi : 10.1016/j.cell.2017.09.052 . PMC 5687850 . PMID 29056343.
- ^ Cortez VS, Fuchs A, Cella M, Gilfillan S, Colonna M (mayo de 2014). "Vanguardia: las células NK de las glándulas salivales se desarrollan independientemente de Nfil3 en estado estable". Journal of Immunology . 192 (10): 4487–91. doi : 10.4049/jimmunol.1303469 . PMID 24740507.
- ^ abcd Colonna M (junio de 2018). "Células linfoides innatas: diversidad, plasticidad y funciones únicas en la inmunidad". Inmunidad . 48 (6): 1104–1117. doi : 10.1016/j.immuni.2018.05.013 . PMC 6344351 . PMID 29924976.
- ^ Kim BS, Siracusa MC, Saenz SA, Noti M, Monticelli LA, Sonnenberg GF, et al. (enero de 2013). "TSLP provoca respuestas de células linfoides innatas independientes de IL-33 para promover la inflamación de la piel". Science Translational Medicine . 5 (170): 170ra16. doi :10.1126/scitranslmed.3005374. PMC 3637661 . PMID 23363980.
- ^ Roediger B, Kyle R, Yip KH, Sumaria N, Guy TV, Kim BS, et al. (junio de 2013). "Inmunovigilancia cutánea y regulación de la inflamación por células linfoides innatas del grupo 2". Nature Immunology . 14 (6): 564–73. doi :10.1038/ni.2584. PMC 4282745 . PMID 23603794.
- ^ Neill DR, Wong SH, Bellosi A, Flynn RJ, Daly M, Langford TK, et al. (abril de 2010). "Los nuocitos representan un nuevo leucocito efector innato que media la inmunidad de tipo 2". Nature . 464 (7293): 1367–70. Bibcode :2010Natur.464.1367N. doi :10.1038/nature08900. PMC 2862165 . PMID 20200518.
- ^ Mjösberg J, Bernink J, Golebski K, Karrich JJ, Peters CP, Blom B, et al. (octubre de 2012). "El factor de transcripción GATA3 es esencial para la función de las células linfoides innatas humanas tipo 2". Inmunidad . 37 (4): 649–59. doi : 10.1016/j.immuni.2012.08.015 . PMID 23063330.
- ^ Juelke K, Romagnani C (febrero de 2016). "Diferenciación de células linfoides innatas humanas (ILC)". Current Opinion in Immunology . 38 : 75–85. doi :10.1016/j.coi.2015.11.005. PMID 26707651.
- ^ Buonocore S, Ahern PP, Uhlig HH, Ivanov II, Littman DR, Maloy KJ, Powrie F (abril de 2010). "Las células linfoides innatas impulsan la patología intestinal innata dependiente de interleucina-23". Nature . 464 (7293): 1371–5. Bibcode :2010Natur.464.1371B. doi :10.1038/nature08949. PMC 3796764 . PMID 20393462.
- ^ Gaffen SL, Jain R, Garg AV, Cua DJ (septiembre de 2014). "El eje inmunológico IL-23-IL-17: de los mecanismos a las pruebas terapéuticas". Nature Reviews. Inmunología . 14 (9): 585–600. doi :10.1038/nri3707. PMC 4281037 . PMID 25145755.
- ^ abcde Pantazi E, Powell N (2019). "Grupo 3 de células ILC: ¿pacificadores o alborotadores? ¿Qué te dice tu instinto?". Frontiers in Immunology . 10 : 676. doi : 10.3389/fimmu.2019.00676 . PMC 6460375 . PMID 31024537.
- ^ Cupedo T, Crellin NK, Papazian N, Rombouts EJ, Weijer K, Grogan JL, et al. (Enero de 2009). "Las células inductoras de tejido linfoide fetal humano son precursoras productoras de interleucina 17 de las células asesinas naturales RORC + CD127 +". Inmunología de la naturaleza . 10 (1): 66–74. doi :10.1038/ni.1668. PMID 19029905. S2CID 22864899.
- ^ ab Takatori H, Kanno Y, Watford WT, Tato CM, Weiss G, Ivanov II, et al. (enero de 2009). "Las células similares a inductores del tejido linfoide son una fuente innata de IL-17 e IL-22". The Journal of Experimental Medicine . 206 (1): 35–41. doi : 10.1084/jem.20072713 . PMC 2626689 . PMID 19114665.
- ^ abcdefg Withers DR (mayo de 2011). "Células inductoras de tejido linfoide". Current Biology . 21 (10): R381-2. doi : 10.1016/j.cub.2011.03.022 . PMID 21601793.
- ^ Mebius RE, Rennert P, Weissman IL (octubre de 1997). "Los ganglios linfáticos en desarrollo recogen células CD4+CD3- LTbeta+ que pueden diferenciarse en células APC, células NK y células foliculares, pero no en células T o B". Inmunidad . 7 (4): 493–504. doi : 10.1016/S1074-7613(00)80371-4 . PMID 9354470.
- ^ Strober W (noviembre de 2010). "La célula LTi, un camaleón inmunológico". Inmunidad . 33 (5): 650–2. doi :10.1016/j.immuni.2010.11.016. PMC 3426921 . PMID 21094460.
- ^ abcdefg Eberl G, Colonna M, Di Santo JP, McKenzie AN (mayo de 2015). "Células linfoides innatas. Células linfoides innatas: un nuevo paradigma en inmunología". Ciencia . 348 (6237): aaa6566. doi : 10.1126/ciencia.aaa6566 . PMC 5658207 . PMID 25999512.
- ^ ab Klose CS, Flach M, Möhle L, Rogell L, Hoyler T, Ebert K, et al. (abril de 2014). "Diferenciación de las células linfoides intercelulares de tipo 1 a partir de un progenitor común a todos los linajes de células linfoides innatas de tipo auxiliar". Cell . 157 (2): 340–356. doi : 10.1016/j.cell.2014.03.030 . PMID 24725403.
- ^ Xu W, Domingues RG, Fonseca-Pereira D, Ferreira M, Ribeiro H, López-Lastra S, et al. (Marzo de 2015). "NFIL3 orquesta la aparición de precursores de células linfoides innatas auxiliares comunes". Informes celulares . 10 (12): 2043–54. doi : 10.1016/j.celrep.2015.02.057 . PMID 25801035.
- ^ ab Bando JK, Liang HE, Locksley RM (febrero de 2015). "Identificación y distribución de células linfoides innatas en desarrollo en el intestino fetal del ratón". Nature Immunology . 16 (2): 153–60. doi :10.1038/ni.3057. PMC 4297560 . PMID 25501629.
- ^ Lee JS, Cella M, McDonald KG, Garlanda C, Kennedy GD, Nukaya M, et al. (noviembre de 2011). "AHR impulsa el desarrollo de células intestinales ILC22 y tejidos linfoides posnatales a través de vías dependientes e independientes de Notch". Nature Immunology . 13 (2): 144–51. doi :10.1038/ni.2187. PMC 3468413 . PMID 22101730.
- ^ Kotas ME, Locksley RM (junio de 2018). "¿Por qué células linfoides innatas?". Inmunidad . 48 (6): 1081–1090. doi : 10.1016/j.immuni.2018.06.002 . PMC 6145487 . PMID 29924974.
- ^ Löser S, Smith KA, Maizels RM (2019). "Células linfoides innatas en infecciones por helmintos: ¿obligatorias o accesorias?". Frontiers in Immunology . 10 : 620. doi : 10.3389/fimmu.2019.00620 . PMC 6467944 . PMID 31024526.
- ^ abc Palm NW, Rosenstein RK, Medzhitov R (abril de 2012). "Defensas alérgicas del huésped". Nature . 484 (7395): 465–72. Bibcode :2012Natur.484..465P. doi :10.1038/nature11047. PMC 3596087 . PMID 22538607.
- ^ Dahlgren MW, Jones SW, Cautivo KM, Dubinin A, Ortiz-Carpena JF, Farhat S, et al. (Marzo de 2019). "Las células estromales adventicias definen nichos de tejido de células linfoides innatas del grupo 2". Inmunidad . 50 (3): 707–722.e6. doi : 10.1016/j.immuni.2019.02.002 . PMC 6553479 . PMID 30824323.
- ^ Sui P, Wiesner DL, Xu J, Zhang Y, Lee J, Van Dyken S, et al. (junio de 2018). "Las células neuroendocrinas pulmonares amplifican las respuestas alérgicas al asma". Science . 360 (6393): eaan8546. doi : 10.1126/science.aan8546 . PMC 6387886 . PMID 29599193.
- ^ Bernink JH, Peters CP, Munneke M, te Velde AA, Meijer SL, Weijer K, et al. (marzo de 2013). "Las células linfoides innatas de tipo 1 humanas se acumulan en los tejidos mucosos inflamados". Nature Immunology . 14 (3): 221–9. doi :10.1038/ni.2534. PMID 23334791. S2CID 8614680.
- ^ Willinger T (2019). "Control metabólico de la migración de células linfoides innatas". Frontiers in Immunology . 10 : 2010. doi : 10.3389/fimmu.2019.02010 . PMC 6713999 . PMID 31507605.
- ^ abcdefghijklmnopqrstu vw Ebbo M, Crinier A, Vély F, Vivier E (noviembre de 2017). "Células linfoides innatas: actores principales en enfermedades inflamatorias". Nature Reviews. Inmunología . 17 (11): 665–678. doi :10.1038/nri.2017.86. PMID 28804130. S2CID 2651328.
- ^ Zheng Y, Valdez PA, Danilenko DM, Hu Y, Sa SM, Gong Q, et al. (marzo de 2008). "La interleucina-22 media la defensa temprana del huésped contra la adhesión y eliminación de patógenos bacterianos". Nature Medicine . 14 (3): 282–9. doi :10.1038/nm1720. PMID 18264109. S2CID 15742387.
- ^ Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ y col. (Septiembre de 2006). "El receptor nuclear huérfano RORgammat dirige el programa de diferenciación de células T auxiliares proinflamatorias IL-17 +". Celúla . 126 (6): 1121–33. doi : 10.1016/j.cell.2006.07.035 . PMID 16990136. S2CID 9034013.
- ^ Zhou L, Ivanov II, Spolski R, Min R, Shenderov K, Egawa T, et al. (septiembre de 2007). "IL-6 programa la diferenciación de células T(H)-17 al promover la participación secuencial de las vías IL-21 e IL-23". Nature Immunology . 8 (9): 967–74. doi :10.1038/ni1488. PMID 17581537. S2CID 21177884.
- ^ Ibiza S, García-Cassani B, Ribeiro H, Carvalho T, Almeida L, Marques R, et al. (julio de 2016). "Los neurorreguladores derivados de células gliales controlan las células linfoides innatas de tipo 3 y la defensa intestinal". Nature . 535 (7612): 440–443. Bibcode :2016Natur.535..440I. doi :10.1038/nature18644. PMC 4962913 . PMID 27409807.
- ^ ab Goto Y, Obata T, Kunisawa J, Sato S, Ivanov II, Lamichhane A, et al. (septiembre de 2014). "Las células linfoides innatas regulan la glicosilación de las células epiteliales intestinales". Ciencia . 345 (6202): 1254009. doi : 10.1126/science.1254009. PMC 4774895 . PMID 25214634.
- ^ Macpherson AJ, Yilmaz B, Limenitakis JP, Ganal-Vonarburg SC (abril de 2018). "Función de la IgA en relación con la microbiota intestinal". Revisión anual de inmunología . 36 (1): 359–381. doi :10.1146/annurev-immunol-042617-053238. PMID 29400985.
- ^ Abt MC, Lewis BB, Caballero S, Xiong H, Carter RA, Sušac B, et al. (julio de 2015). "Las defensas inmunitarias innatas mediadas por dos subconjuntos de células ILC son fundamentales para la protección contra la infección aguda por Clostridium difficile". Cell Host & Microbe . 18 (1): 27–37. doi : 10.1016/j.chom.2015.06.011 . PMC 4537644 . PMID 26159718.
- ^ abcde Wagner M, Moro K, Koyasu S (mayo de 2017). "Heterogeneidad plástica de las células linfoides innatas en el cáncer". Tendencias en el cáncer . 3 (5): 326–335. doi :10.1016/j.trecan.2017.03.008. PMID 28718410.
- ^ ab Wagner M, Koyasu S (mayo de 2019). "Inmunoedición del cáncer por células linfoides innatas". Tendencias en inmunología . 40 (5): 415–430. doi :10.1016/j.it.2019.03.004. PMID 30992189. S2CID 119093972.
- ^ Dadi S, Chhangawala S, Whitlock BM, Franklin RA, Luo CT, Oh SA, et al. (enero de 2016). "Inmunovigilancia del cáncer mediante células linfoides innatas residentes en el tejido y células T similares a las innatas". Cell . 164 (3): 365–77. doi :10.1016/j.cell.2016.01.002. PMC 4733424 . PMID 26806130.
- ^ Cerwenka A, Lanier LL (octubre de 2001). "Células asesinas naturales, virus y cáncer". Nature Reviews. Inmunología . 1 (1): 41–9. doi :10.1038/35095564. PMID 11905813. S2CID 205021117.
- ^ Smyth MJ, Godfrey DI, Trapani JA (abril de 2001). "Una nueva mirada a la inmunovigilancia y la inmunoterapia tumoral". Nature Immunology . 2 (4): 293–9. doi :10.1038/86297. PMID 11276199. S2CID 24779449.
- ^ Fuchs A, Vermi W, Lee JS, Lonardi S, Gilfillan S, Newberry RD, et al. (abril de 2013). "Las células linfoides innatas intraepiteliales de tipo 1 son un subconjunto único de células productoras de IFN-γ sensibles a IL-12 e IL-15". Inmunidad . 38 (4): 769–81. doi :10.1016/j.immuni.2013.02.010. PMC 3634355 . PMID 23453631.
- ^ Lechner MG, Liebertz DJ, Epstein AL (agosto de 2010). "Caracterización de células supresoras derivadas de mieloides inducidas por citocinas a partir de células mononucleares de sangre periférica humana normales". Journal of Immunology . 185 (4): 2273–84. doi :10.4049/jimmunol.1000901. PMC 2923483 . PMID 20644162.
- ^ Heeren, A. Marijne, et al. "Las tasas elevadas e interrelacionadas de células presentadoras de antígenos PD-L1+ CD14+ y células T reguladoras marcan el microambiente de los ganglios linfáticos metastásicos de pacientes con cáncer de cuello uterino". Investigación en inmunología del cáncer (2014): canimm-0149.
- ^ Zhu J (septiembre de 2015). "Diferenciación de células T helper 2 (Th2), desarrollo de células linfoides innatas tipo 2 (ILC2) y regulación de la producción de interleucina-4 (IL-4) e IL-13". Citocina . 75 (1): 14–24. doi :10.1016/j.cyto.2015.05.010. PMC 4532589 . PMID 26044597.
- ^ Ikutani M, Yanagibashi T, Ogasawara M, Tsuneyama K, Yamamoto S, Hattori Y, et al. (Enero de 2012). "Identificación de células productoras de IL-5 innatas y su papel en la regulación de los eosinófilos pulmonares y la inmunidad antitumoral". Revista de Inmunología . 188 (2): 703–13. doi : 10.4049/jimmunol.1101270 . PMID 22174445.
- ^ Wagner M, Ealey KN, Tetsu H, Kiniwa T, Motomura Y, Moro K, Koyasu S (febrero de 2020). "El ácido láctico derivado de tumores contribuye a la escasez de ILC2 intratumorales". Informes celulares . 30 (8): 2743–2757.e5. doi : 10.1016/j.celrep.2020.01.103 . hdl : 11250/2763785 . PMID 32101749.
- ^ Ducimetière L, Vermeer M, Tugues S (2019). "La interacción entre las células linfoides innatas y el microambiente tumoral". Frontiers in Immunology . 10 : 2895. doi : 10.3389/fimmu.2019.02895 . PMC 6923277 . PMID 31921156.
- ^ Carrega P, Loiacono F, Di Carlo E, Scaramuccia A, Mora M, Conte R, et al. (Septiembre de 2015). "NCR (+) ILC3 se concentra en el cáncer de pulmón humano y se asocia con estructuras linfoides intratumorales". Comunicaciones de la naturaleza . 6 (1): 8280. Código bibliográfico : 2015NatCo...6.8280C. doi : 10.1038/ncomms9280 . PMID 26395069.
- ^ abc Ochel A, Tiegs G, Neumann K (abril de 2019). "Células linfoides innatas de tipo 2 en el hígado y el intestino: del conocimiento actual a las perspectivas futuras". Revista internacional de ciencias moleculares . 20 (8): 1896. doi : 10.3390/ijms20081896 . PMC 6514972 . PMID 30999584.
- ^ abc Nabekura T, Riggan L, Hildreth AD, O'Sullivan TE, Shibuya A (enero de 2020). "Las células linfoides innatas de tipo 1 protegen a los ratones de la lesión hepática aguda a través de la secreción de interferón-γ para regular positivamente la expresión de Bcl-xL en los hepatocitos". Inmunidad . 52 (1): 96–108.e9. doi : 10.1016/j.immuni.2019.11.004 . PMC 8108607 . PMID 31810881.
- ^ ab Brestoff JR, Kim BS, Saenz SA, Stine RR, Monticelli LA, Sonnenberg GF, et al. (marzo de 2015). "Las células linfoides innatas del grupo 2 promueven la formación de tejido adiposo blanco y limitan la obesidad". Nature . 519 (7542): 242–6. Bibcode :2015Natur.519..242B. doi :10.1038/nature14115. PMC 4447235 . PMID 25533952.
- ^ Lee BC, Kim MS, Pae M, Yamamoto Y, Eberlé D, Shimada T, et al. (abril de 2016). "Las células asesinas naturales adiposas regulan los macrófagos del tejido adiposo para promover la resistencia a la insulina en la obesidad". Metabolismo celular . 23 (4): 685–98. doi : 10.1016/j.cmet.2016.03.002 . PMC 4833527 . PMID 27050305.
- ^ Turner JE, Morrison PJ, Wilhelm C, Wilson M, Ahlfors H, Renauld JC, et al. (diciembre de 2013). "La supervivencia mediada por IL-9 de las células linfoides innatas de tipo 2 promueve el control de daños en la inflamación pulmonar inducida por helmintos". The Journal of Experimental Medicine . 210 (13): 2951–65. doi : 10.1084/jem.20130071 . PMC 3865473 . PMID 24249111.
- ^ Huang Y, Mao K, Chen X, Sun MA, Kawabe T, Li W, et al. (enero de 2018). "El tráfico interorgánico dependiente de S1P de las células linfoides innatas del grupo 2 respalda la defensa del huésped". Science . 359 (6371): 114–119. Bibcode :2018Sci...359..114H. doi : 10.1126/science.aam5809 . PMC 6956613 . PMID 29302015.
- ^ Van Maele L, Carnoy C, Cayet D, Ivanov S, Porte R, Deruy E, et al. (agosto de 2014). "Activación de células linfoides innatas de tipo 3 y secreción de interleucina 22 en los pulmones durante la infección por Streptococcus pneumoniae". The Journal of Infectious Diseases . 210 (3): 493–503. doi : 10.1093/infdis/jiu106 . PMID 24577508.
- ^ Panda SK, Colonna M (7 de mayo de 2019). "Células linfoides innatas en la inmunidad de las mucosas". Frontiers in Immunology . 10 : 861. doi : 10.3389/fimmu.2019.00861 . PMC 6515929 . PMID 31134050.
- ^ Vivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. (Agosto de 2018). "Células linfoides innatas: 10 años después". Celúla . 174 (5): 1054-1066. doi : 10.1016/j.cell.2018.07.017 . PMID 30142344. S2CID 52079371.
- ^ Domingues RG, Hepworth MR (6 de febrero de 2020). "Circuitos sensoriales inmunorreguladores en la función de las células linfoides innatas (ILC3) del grupo 3 y la homeostasis tisular". Frontiers in Immunology . 11 : 116. doi : 10.3389/fimmu.2020.00116 . PMC 7015949 . PMID 32117267.
- ^ Halim TY, Steer CA, Mathä L, Gold MJ, Martinez-Gonzalez I, McNagny KM, et al. (marzo de 2014). "Las células linfoides innatas del grupo 2 son fundamentales para el inicio de la inflamación alérgica pulmonar mediada por células T helper 2 adaptativas". Inmunidad . 40 (3): 425–35. doi : 10.1016/j.immuni.2014.01.011 . PMC 4210641 . PMID 24613091.
- ^ Oboki K, Nakae S, Matsumoto K, Saito H (abril de 2011). "IL-33 y la inflamación de las vías respiratorias". Investigación sobre alergias, asma e inmunología . 3 (2): 81–8. doi :10.4168/aair.2011.3.2.81. PMC 3062800 . PMID 21461246.
- ^ Kondo H, Ichikawa Y, Imokawa G (marzo de 1998). "La sensibilización percutánea con alérgenos a través de una piel con barrera alterada provoca una respuesta de citocinas Th2 dominante". Revista Europea de Inmunología . 28 (3): 769–79. doi : 10.1002/(SICI)1521-4141(199803)28:03<769::AID-IMMU769>3.0.CO;2-H . PMID 9541570. S2CID 21654970.
- ^ Kim HY, Lee HJ, Chang YJ, Pichavant M, Shore SA, Fitzgerald KA, et al. (enero de 2014). "Las células linfoides innatas productoras de interleucina-17 y el inflamasoma NLRP3 facilitan la hiperreactividad de las vías respiratorias asociada a la obesidad". Nature Medicine . 20 (1): 54–61. doi :10.1038/nm.3423. PMC 3912313 . PMID 24336249.
- ^ ab Vivier E, Raulet DH, Moretta A, Caligiuri MA, Zitvogel L, Lanier LL, et al. (Enero de 2011). "¿Inmunidad innata o adaptativa? El ejemplo de las células asesinas naturales". Ciencia . 331 (6013): 44–9. Código Bib : 2011 Ciencia... 331... 44V. doi : 10.1126/ciencia.1198687. PMC 3089969 . PMID 21212348.
- ^ Baxter AG, Smyth MJ (febrero de 2002). "El papel de las células NK en las enfermedades autoinmunes". Autoinmunidad . 35 (1): 1–14. doi :10.1080/08916930290005864. PMID 11908701. S2CID 28199633.
- ^ Scordamaglia F, Balsamo M, Scordamaglia A, Moretta A, Mingari MC, Canonica GW, et al. (febrero de 2008). "Perturbaciones de las funciones reguladoras de las células asesinas naturales en enfermedades alérgicas respiratorias". The Journal of Allergy and Clinical Immunology . 121 (2): 479–85. doi :10.1016/j.jaci.2007.09.047. PMID 18061653.
- ^ Langowski JL, Zhang X, Wu L, Mattson JD, Chen T, Smith K, et al. (julio de 2006). "IL-23 promueve la incidencia y el crecimiento de tumores". Nature . 442 (7101): 461–5. Bibcode :2006Natur.442..461L. doi :10.1038/nature04808. PMID 16688182. S2CID 4431794.
- ^ Wu S, Rhee KJ, Albesiano E, Rabizadeh S, Wu X, Yen HR, et al. (septiembre de 2009). "Un comensal colónico humano promueve la tumorogénesis del colon a través de la activación de las respuestas de las células T auxiliares de tipo 17". Nature Medicine . 15 (9): 1016–22. doi :10.1038/nm.2015. PMC 3034219 . PMID 19701202.
- ^ Grivennikov SI, Wang K, Mucida D, Stewart CA, Schnabl B, Jauch D, et al. (noviembre de 2012). "Los defectos de barrera vinculados con el adenoma y los productos microbianos impulsan el crecimiento tumoral mediado por IL-23/IL-17". Nature . 491 (7423): 254–8. Bibcode :2012Natur.491..254G. doi :10.1038/nature11465. PMC 3601659 . PMID 23034650.
- ^ Bie Q, Zhang P, Su Z, Zheng D, Ying X, Wu Y, et al. (2014). "La polarización de las ILC2 en sangre periférica podría contribuir al microambiente inmunosupresor en pacientes con cáncer gástrico". Journal of Immunology Research . 2014 : 923135. doi : 10.1155/2014/923135 . PMC 3987940 . PMID 24741632.
- ^ Lee J, Park KH, Ryu JH, Bae HJ, Choi A, Lee H, et al. (septiembre de 2017). "Actividad de células asesinas naturales para la producción de IFN-gamma como marcador diagnóstico de apoyo para el cáncer gástrico". Oncotarget . 8 (41): 70431–70440. doi : 10.18632/oncotarget.19712 . PMC 5642566 . PMID 29050291.
- ^ ab Sonnenberg GF, Hepworth MR (octubre de 2019). "Interacciones funcionales entre células linfoides innatas e inmunidad adaptativa". Nature Reviews. Inmunología . 19 (10): 599–613. doi :10.1038/s41577-019-0194-8. PMC 6982279 . PMID 31350531.
- ^ abc Bal SM, Bernink JH, Nagasawa M, Groot J, Shikhagaie MM, Golebski K, et al. (junio de 2016). "IL-1β, IL-4 e IL-12 controlan el destino de las células linfoides innatas del grupo 2 en la inflamación de las vías respiratorias humanas en los pulmones". Inmunología de la naturaleza . 17 (6): 636–45. doi :10.1038/ni.3444. PMID 27111145. S2CID 883747.
- ^ Cella M, Otero K, Colonna M (junio de 2010). "La expansión de células NK-22 humanas con IL-7, IL-2 e IL-1beta revela plasticidad funcional intrínseca". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (24): 10961–6. Bibcode :2010PNAS..10710961C. doi : 10.1073/pnas.1005641107 . PMC 2890739 . PMID 20534450.
- ^ ab Bernink JH, Krabbendam L, Germar K, de Jong E, Gronke K, Kofoed-Nielsen M, et al. (julio de 2015). "Interleucina-12 y -23 controlan la plasticidad de las células linfoides innatas CD127(+) del grupo 1 y del grupo 3 en la lámina propia intestinal". Inmunidad . 43 (1): 146–60. doi : 10.1016/j.immuni.2015.06.019 . PMID 26187413.
- ^ Zhang K, Xu X, Pasha MA, Siebel CW, Costello A, Haczku A, et al. (marzo de 2017). "Vanguardia: la señalización Notch promueve la plasticidad de las células linfoides innatas del grupo 2". Journal of Immunology . 198 (5): 1798–1803. doi : 10.4049/jimmunol.1601421 . PMC 5321819 . PMID 28115527.
- ^ ab Meininger I, Carrasco A, Rao A, Soini T, Kokkinou E, Mjösberg J (octubre de 2020). "Características específicas de tejido de las células linfoides innatas". Tendencias en inmunología . 41 (10): 902–917. doi : 10.1016/j.it.2020.08.009 . PMID 32917510. S2CID 221636264.
- ^ Gao Y, Souza-Fonseca-Guimaraes F, Bald T, Ng SS, Young A, Ngiow SF, et al. (septiembre de 2017). "Inmunoevasión tumoral mediante la conversión de células NK efectoras en células linfoides innatas tipo 1". Inmunología de la naturaleza . 18 (9): 1004-1015. doi :10.1038/ni.3800. PMID 28759001. S2CID 30239.
- ^ Cortez VS, Ulland TK, Cervantes-Barragan L, Bando JK, Robinette ML, Wang Q, et al. (septiembre de 2017). "SMAD4 impide la conversión de células NK en células similares a ILC1 al reducir la señalización no canónica de TGF-β". Nature Immunology . 18 (9): 995–1003. doi :10.1038/ni.3809. PMC 5712491 . PMID 28759002.
- ^ Bald T, Wagner M, Gao Y, Koyasu S, Smyth MJ (febrero de 2019). "Escondite: plasticidad de las células linfoides innatas en el cáncer". Seminarios de inmunología . 41 : 101273. doi :10.1016/j.smim.2019.04.001. PMID 30979591. S2CID 111390262.
- ^ Lanier LL (febrero de 2013). "Tonos de gris: la visión borrosa de la inmunidad innata y adaptativa" (PDF) . Nature Reviews. Inmunología . 13 (2): 73–4. doi :10.1038/nri3389. PMID 23469373. S2CID 27204420.
Enlaces externos
- Células linfoides innatas: 10 años después
- Células linfoides innatas: protagonistas de las enfermedades inflamatorias
- ¿Por qué las ILC?
- Biología de las células linfoides innatas y NK
- Células linfoides innatas en la inmunidad de las mucosas