Vitamina A
 | |
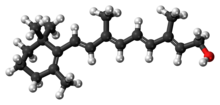 El retinol juega un papel biológico en la visión, pero la mayoría de los efectos de la vitamina A son ejercidos por el ácido retinoico, que se une a los receptores nucleares y regula la transcripción genética. | |
| Datos clínicos | |
|---|---|
| AHFS / Drogas.com | Monografía |
| Datos de licencia |
|
| Vías de administración | Por vía oral , intramuscular [1] |
| Clase de droga | Vitamina |
| Código ATC | |
| Estatus legal | |
| Estatus legal |
|
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Araña química |
|
| UNIVERSIDAD |
|
| EBICh |
|
| Química biológica |
|
| Tarjeta informativa de la ECHA | 100.031.195 |
| Datos químicos y físicos | |
| Fórmula | C20H30O |
| Masa molar | 286,459 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| Punto de fusión | 62–64 °C (144–147 °F) |
| Punto de ebullición | 137–138 °C (279–280 °F) (10 −6 mmHg ) |
| |
| |
La vitamina A es una vitamina liposoluble que es un nutriente esencial . El término "vitamina A" abarca un grupo de compuestos orgánicos químicamente relacionados que incluyen retinol , ésteres de retinilo y varios carotenoides provitamínicos (precursores) , más notablemente β-caroteno ( beta - caroteno ). [3] [4] [5] [6] La vitamina A tiene múltiples funciones: crecimiento durante el desarrollo del embrión , mantenimiento del sistema inmunológico y visión saludable. Para ayudar a la visión específicamente, se combina con la proteína opsina para formar rodopsina , la molécula que absorbe la luz necesaria tanto para la visión con poca luz ( visión escotópica ) como para la visión en color . [7]
La vitamina A se presenta en dos formas principales en los alimentos: A) los retinoides, que se encuentran en los alimentos de origen animal , ya sea como retinol o unidos a un ácido graso para convertirse en un éster de retinilo, y B) los carotenoides α-caroteno ( alfa -caroteno), β-caroteno, γ-caroteno ( gamma -caroteno) y la xantofila beta-criptoxantina (todos los cuales contienen anillos de β- ionona ) que funcionan como provitamina A en animales herbívoros y omnívoros que poseen las enzimas que escinden y convierten los carotenoides provitamínicos en retinol. [8] Algunas especies carnívoras carecen de esta enzima. Los otros carotenoides no tienen actividad retinoide. [6]
El retinol dietético se absorbe en el tracto digestivo a través de difusión pasiva . A diferencia del retinol, el β-caroteno es absorbido por los enterocitos por el receptor depurador de la proteína transportadora de membrana B1 (SCARB1), que se regula positivamente en épocas de deficiencia de vitamina A (VAD). [6] El retinol se almacena en gotitas de lípidos en el hígado . Una alta capacidad de almacenamiento a largo plazo de retinol significa que los humanos bien nutridos pueden pasar meses con una dieta deficiente en vitamina A, mientras mantienen los niveles sanguíneos en el rango normal. [4] Solo cuando las reservas del hígado están casi agotadas se mostrarán los signos y síntomas de deficiencia. [4] El retinol se convierte reversiblemente en retinal, luego irreversiblemente en ácido retinoico, que activa cientos de genes . [9]
La deficiencia de vitamina A es común en los países en desarrollo, especialmente en África subsahariana y el sudeste asiático . La deficiencia puede ocurrir a cualquier edad, pero es más común en niños en edad preescolar y mujeres embarazadas, estas últimas debido a la necesidad de transferir retinol al feto. Se estima que la deficiencia de vitamina A afecta aproximadamente a un tercio de los niños menores de cinco años en todo el mundo, lo que resulta en cientos de miles de casos de ceguera y muertes por enfermedades infantiles debido a la falla del sistema inmunológico. [10] La ceguera nocturna reversible es un indicador temprano de un estado bajo de vitamina A. El retinol plasmático se utiliza como un biomarcador para confirmar la deficiencia de vitamina A. El retinol en la leche materna puede indicar una deficiencia en las madres lactantes. Ninguna de estas medidas indica el estado de las reservas hepáticas. [6]
La Unión Europea y varios países han establecido recomendaciones para la ingesta dietética y límites superiores para una ingesta segura. La toxicidad por vitamina A, también conocida como hipervitaminosis A , ocurre cuando hay una acumulación excesiva de vitamina A en el cuerpo. Los síntomas pueden incluir efectos en el sistema nervioso, anomalías hepáticas, fatiga , debilidad muscular, cambios en los huesos y la piel, y otros. Los efectos adversos de la toxicidad tanto aguda como crónica se revierten después de suspender el consumo de suplementos en dosis altas. [6]
Definición
La vitamina A es una vitamina liposoluble , una categoría que también incluye las vitaminas D , E y K. La vitamina abarca varios compuestos o metabolitos naturales relacionados químicamente, es decir, vitámeros , que contienen un anillo de β- ionona . [4] La forma dietética primaria es el retinol , que puede tener una molécula de ácido graso unida, creando un éster de retinilo , cuando se almacena en el hígado. El retinol, la forma de transporte y almacenamiento de la vitamina A, es interconvertible con retinal, catalizado a retinal por las retinol deshidrogenasas y nuevamente a retinol por las retinaldehído reductasas. [11]
El retinal (también conocido como retinaldehído) puede convertirse irreversiblemente en ácido todo-trans -retinoico por la acción de la deshidrogenasa de la retina.
- retinal + NAD + + H 2 O → ácido retinoico + NADH + H +
El ácido retinoico es transportado activamente al núcleo celular por CRABp2, donde regula miles de genes uniéndose directamente a los genes diana a través de los receptores de ácido retinoico . [6]
Además del retinol, el retinal y el ácido retinoico, existen carotenoides de origen vegetal, fúngico o bacteriano que pueden metabolizarse en retinol y, por lo tanto, son vitámeros de vitamina A. [12]
También existen los llamados retinoides de segunda, tercera y cuarta generación , que no se consideran vitámeros de vitamina A porque no se pueden convertir en retinol, retinal o ácido transretinoico . Algunos son medicamentos de venta con receta, orales o tópicos, para diversas indicaciones. Algunos ejemplos son el etretinato , la acitretina , el adapaleno , el bexaroteno , el tazaroteno y el trifaroteno . [13] [14]
Absorción, metabolismo y excreción.
Los ésteres de retinol de alimentos de origen animal (o sintetizados para suplementos dietéticos para humanos y animales domésticos) son tratados por hidrolasas de ésteres de retinol en el lumen del intestino delgado para liberar retinol libre. El retinol ingresa a los enterocitos por difusión pasiva . La eficiencia de absorción está en el rango del 70 al 90%. Los humanos corren el riesgo de sufrir toxicidad aguda o crónica por vitamina A porque no existen mecanismos para suprimir la absorción o excretar el exceso en la orina. [5] Dentro de la célula, el retinol está unido a la proteína de unión al retinol 2 (RBP2). Luego se reesterifica enzimáticamente por la acción de la lecitina retinol aciltransferasa y se incorpora a los quilomicrones que se secretan en el sistema linfático .
A diferencia del retinol, el β-caroteno es absorbido por los enterocitos por el receptor depurador de la proteína transportadora de membrana B1 (SCARB1). La proteína se regula al alza en momentos de VAD . Si el estado de vitamina A está en el rango normal, SCARB1 se regula a la baja, lo que reduce la absorción. [6] También se regula a la baja la enzima beta-caroteno 15,15'-dioxigenasa (antes conocida como beta- caroteno 15,15'-monooxigenasa) codificada por el gen BCMO1, responsable de escindir simétricamente el β-caroteno en retinal. [8] El β-caroteno absorbido se incorpora como tal en los quilomicrones o primero se convierte en retinal y luego en retinol, unido a RBP2. Después de una comida, aproximadamente dos tercios de los quilomicrones son absorbidos por el hígado y el resto se distribuye a los tejidos periféricos. Los tejidos periféricos también pueden convertir el quilomicrón β-caroteno en retinol. [6] [15]
La capacidad de almacenar retinol en el hígado significa que los seres humanos bien nutridos pueden pasar meses con una dieta deficiente en vitamina A sin manifestar signos y síntomas de deficiencia. Dos tipos de células hepáticas son responsables del almacenamiento y la liberación: los hepatocitos y las células estrelladas hepáticas (HSC). Los hepatocitos absorben los quilomicrones ricos en lípidos, unen el retinol a la proteína de unión al retinol 4 (RBP4) y transfieren el retinol-RBP4 a las HSC para su almacenamiento en gotas de lípidos como ésteres de retinol. La movilización invierte el proceso: la hidrolasa de éster de retinol libera retinol libre que se transfiere a los hepatocitos, se une a la RBP4 y se coloca en la circulación sanguínea . Aparte de después de una comida o cuando el consumo de grandes cantidades excede la capacidad de almacenamiento del hígado, más del 95% del retinol en circulación está unido a la RBP4. [15]
Carnívoros
Los carnívoros estrictos gestionan la vitamina A de forma diferente a los omnívoros y herbívoros . Los carnívoros son más tolerantes a las ingestas elevadas de retinol porque esas especies tienen la capacidad de excretar retinol y ésteres de retinilo en la orina. Los carnívoros también tienen la capacidad de almacenar más en el hígado, debido a una mayor proporción de HSC hepáticas a hepatocitos en comparación con los omnívoros y herbívoros. Para los humanos, el contenido hepático puede variar de 20 a 30 μg/gramo de peso húmedo. Notoriamente, el hígado de oso polar es agudamente tóxico para los humanos porque se ha informado de un contenido en el rango de 2215 a 10 400 μg/g de peso húmedo. [16] Como se señaló, en los humanos, el retinol circula unido a RBP4. Los carnívoros mantienen R-RBP4 dentro de un rango estrecho mientras también tienen ésteres de retinilo en circulación. El retinol unido se entrega a las células mientras que los ésteres se excretan en la orina. [16] En general, las especies carnívoras son malos convertidores de carotenoides que contienen ionona, y los carnívoros puros, como los félidos (gatos), carecen por completo de la enzima de escisión. Deben tener retinol o ésteres de retinilo en su dieta. [16]
Herbívoros
Los herbívoros consumen carotenoides que contienen ionona y los convierten en retinal. Algunas especies, como el ganado vacuno y los caballos, tienen cantidades mensurables de β-caroteno circulando en la sangre y se almacenan en la grasa corporal , lo que crea células grasas amarillas . La mayoría de las especies tienen grasa blanca y no tienen β-caroteno en circulación. [16]
Activación y excreción
En el hígado y los tejidos periféricos de los humanos, el retinol se convierte reversiblemente en retinal por la acción de las alcohol deshidrogenasas, que también son responsables de la conversión de etanol en acetaldehído . El retinal se oxida irreversiblemente a ácido retinoico (AR) por la acción de las aldehído deshidrogenasas. El AR regula la activación o desactivación de los genes. La degradación oxidativa del AR es inducida por el AR: su presencia desencadena su eliminación, lo que genera una señal de transcripción genética de acción corta. Esta desactivación está mediada por un sistema enzimático del citocromo P450 (CYP), específicamente las enzimas CYP26A1 , CYP26B1 y CYP26C1 . CYP26A1 es la forma predominante en el hígado humano; todos los demás tejidos adultos humanos contenían niveles más altos de CYP26B1. CYP26C1 se expresa principalmente durante el desarrollo embrionario. Los tres convierten el ácido retinoico en 4-oxo-RA, 4-OH-RA y 18-OH-RA. El ácido glucurónico forma conjugados de glucurónido solubles en agua con los metabolitos oxidados, que luego se excretan en la orina y las heces. [9]
Funciones metabólicas
Aparte de la visión, las funciones metabólicas de la vitamina A están mediadas por el ácido retinoico all-trans (AR) . La formación de AR a partir del retinal es irreversible. Para evitar la acumulación de AR, se oxida y se elimina con bastante rapidez, es decir, tiene una vida media corta. Tres citocromos catalizan la oxidación del ácido retinoico. Los genes para Cyp26A1, Cyp26B1 y Cyp26C1 son inducidos por altos niveles de AR, lo que proporciona un ciclo de retroalimentación autorregulador. [17] [18]
Visión y salud ocular
El estado de vitamina A afecta la salud ocular a través de dos funciones independientes. La retina es un factor esencial en las células de los bastones y los conos de la retina que responden a la exposición a la luz enviando señales nerviosas al cerebro. Un signo temprano de deficiencia de vitamina A es la ceguera nocturna. [6] La vitamina A en forma de ácido retinoico es esencial para las funciones normales de las células epiteliales. La deficiencia de vitamina A grave, común en bebés y niños pequeños en el sudeste asiático, causa xeroftalmia caracterizada por sequedad del epitelio conjuntival y la córnea. Si no se trata, la xeroftalmia progresa a ulceración corneal y ceguera. [19]
Visión
El papel de la vitamina A en el ciclo visual está relacionado específicamente con el compuesto retinal. El retinol es convertido por la enzima RPE65 dentro del epitelio pigmentario de la retina en 11 - cis -retinal. Dentro del ojo, el 11- cis -retinal se une a la proteína opsina para formar rodopsina en las células de los bastones y yodopsina en las células de los conos. Cuando la luz entra en el ojo, el 11- cis -retinal se isomeriza a la forma all-trans . El all-trans -retinal se disocia de la opsina en una serie de pasos llamados fotoblanqueo. Esta isomerización induce una señal nerviosa a lo largo del nervio óptico hasta el centro visual del cerebro. Después de separarse de la opsina, el all-trans -retinal se recicla y se convierte nuevamente a la forma 11- cis -retinal mediante una serie de reacciones enzimáticas, que luego completa el ciclo uniéndose a la opsina para reformar la rodopsina en la retina. [6] Además, parte del todo-trans -retinal puede convertirse en la forma todo-trans -retinol y luego transportarse con una proteína de unión al retinol interfotorreceptor a las células epiteliales pigmentadas de la retina. Una esterificación posterior en ésteres todo-trans -retinilo permite el almacenamiento de todo-trans -retinol dentro de las células epiteliales pigmentarias para su reutilización cuando sea necesario. Es por esta razón que una deficiencia de vitamina A inhibirá la reformación de la rodopsina y conducirá a uno de los primeros síntomas, la ceguera nocturna. [6] [20] [21]
Ceguera nocturna
La ceguera nocturna causada por la DVA es una dificultad reversible de los ojos para adaptarse a la luz tenue. Es común en niños pequeños que tienen una dieta inadecuada en retinol y β-caroteno. Un proceso llamado adaptación a la oscuridad generalmente causa un aumento en las cantidades de fotopigmentos en respuesta a niveles bajos de iluminación. Esto aumenta la sensibilidad a la luz hasta 100.000 veces en comparación con las condiciones normales de luz diurna. La mejora significativa en la visión nocturna se produce en diez minutos, pero el proceso puede tardar hasta dos horas en alcanzar el efecto máximo. [7] Las personas que esperaban trabajar en un entorno oscuro usaban gafas de color rojo o estaban en un entorno de luz roja para no revertir la adaptación porque la luz roja no agota la rodopsina a diferencia de lo que ocurre con la luz amarilla o verde. [21]
Xeroftalmia y ceguera infantil

La xeroftalmia, causada por una deficiencia grave de vitamina D, se caracteriza por una sequedad patológica del epitelio conjuntival y la córnea. La conjuntiva se vuelve seca, gruesa y arrugada. Un síntoma característico es la aparición de manchas de Bitot, que son grumos de restos de queratina que se acumulan en el interior de la conjuntiva. Si no se trata, la xeroftalmia puede provocar síndrome del ojo seco, ulceración corneal y, en última instancia, ceguera como resultado del daño en la córnea y la retina. Aunque la xeroftalmia es un problema relacionado con los ojos, la prevención (y la reversión) son funciones del ácido retinoico, que se sintetiza a partir del retinal en lugar del ciclo del 11- cis -retinal a la rodopsina. [22]
En todo el sudeste asiático, se estima que más de la mitad de los niños menores de seis años tienen VAD subclínica y ceguera nocturna, siendo la progresión a xeroftalmia la principal causa de ceguera infantil prevenible. [22] Se estima que cada año hay 350.000 casos de ceguera infantil debido a VAD. [19] Las causas son la VAD durante el embarazo, seguida de una baja transferencia de vitamina A durante la lactancia y dietas infantiles bajas en vitamina A o β-caroteno. [22] [19] La prevalencia de niños en edad preescolar que son ciegos debido a VAD es menor de lo esperado a partir de la incidencia de nuevos casos solo porque la VAD infantil aumenta significativamente la mortalidad por todas las causas. [19]
Según una revisión Cochrane de 2017, la DVA, utilizando el retinol sérico inferior a 0,70 μmol/L como criterio, es un importante problema de salud pública que afecta a unos 190 millones de niños menores de cinco años en países de ingresos bajos y medios, principalmente en África subsahariana y el sudeste asiático. En lugar de o en combinación con programas de fortificación de alimentos, muchos países han implementado programas de salud pública en los que se administran periódicamente a los niños dosis orales muy grandes de vitamina A sintética, generalmente palmitato de retinilo, como un medio para prevenir y tratar la DVA. Las dosis fueron de 50.000 a 100.000 UI ( unidades internacionales ) para niños de 6 a 11 meses y de 100.000 a 200.000 UI para niños de 12 meses a cinco años, este último típicamente cada cuatro a seis meses. Además de una reducción del 24% en la mortalidad por todas las causas, se informaron resultados relacionados con los ojos. La prevalencia de manchas de Bitot en el seguimiento se redujo en un 58%, la ceguera nocturna en un 68% y la xeroftalmia en un 69%. [23]
Regulación genética
El RA regula la transcripción génica uniéndose a receptores nucleares conocidos como receptores de ácido retinoico (RAR; RARα, RARβ, RARγ) que están unidos al ADN como heterodímeros con receptores de retinoides "X" (RXR; RXRα, RXRβ, RXRγ). Los RAR y RXR deben dimerizarse antes de poder unirse al ADN. La expresión de más de 500 genes responde al ácido retinoico. [6] Los heterodímeros RAR-RXR reconocen elementos de respuesta al ácido retinoico en el ADN. [24] Al unirse al ácido retinoico, los receptores experimentan un cambio conformacional que hace que los correpresores se disocien de los receptores. Los coactivadores pueden unirse al complejo receptor, lo que puede ayudar a aflojar la estructura de la cromatina de las histonas o puede interactuar con la maquinaria transcripcional. [25] Esta respuesta regula al alza o a la baja la expresión de genes diana, incluidos los genes que codifican los propios receptores. [20] Para desactivar la señalización del receptor de ácido retinoico, tres citocromos (Cyp26A1, Cyp26B1 Cyp26C1) catalizan la oxidación del AR. Los genes de estas proteínas son inducidos por altas concentraciones de AR, lo que proporciona un mecanismo de retroalimentación reguladora. [6]
Embriología
En vertebrados e invertebrados cordados, la AR tiene un papel fundamental durante el desarrollo. La alteración de los niveles de señalización endógena de AR durante la embriología temprana, ya sea demasiado baja o demasiado alta, conduce a defectos de nacimiento, [26] [27] incluyendo defectos vasculares y cardiovasculares congénitos. [28] [29] Cabe destacar que el trastorno del espectro alcohólico fetal abarca anomalías congénitas, incluyendo defectos craneofaciales, auditivos y oculares, anomalías neuroconductuales y discapacidades mentales causadas por el consumo materno de alcohol durante el embarazo. Se propone que en el embrión existe competencia entre el acetaldehído, un metabolito del etanol, y el retinaldehído (retinal) por la actividad de la aldehído deshidrogenasa, lo que resulta en una deficiencia de ácido retinoico y atribuye los defectos de nacimiento congénitos a la pérdida de la activación del gen activado por AR. En apoyo de esta teoría, los defectos de desarrollo inducidos por el etanol se pueden mejorar aumentando los niveles de retinol o retinal. [30] En cuanto a los riesgos de un exceso de AR durante la embriogénesis, los medicamentos recetados tretinoína ( ácido all-trans -retinoico) e isotretinoína (ácido 13-cis-retinoico), utilizados por vía oral o tópica para el tratamiento del acné, están etiquetados con advertencias en recuadro para mujeres embarazadas o mujeres que pueden quedar embarazadas, ya que son teratógenos humanos conocidos. [31] [32]
Funciones inmunes
La DVA se ha relacionado con una resistencia comprometida a las enfermedades infecciosas. [33] [34] En países donde la DVA en la primera infancia es común, se ha demostrado que los programas de salud pública de suplementación con vitamina A iniciados en la década de 1980 reducen la incidencia de diarrea y sarampión, y la mortalidad por todas las causas. [23] [35] [36] La DVA también aumenta el riesgo de reacción exagerada del sistema inmunológico, lo que conduce a una inflamación crónica en el sistema intestinal, reacciones alérgicas más fuertes y enfermedades autoinmunes. [33] [34] [37]
Los linfocitos y monocitos son tipos de glóbulos blancos del sistema inmunológico . [38] Los linfocitos incluyen células asesinas naturales , que funcionan en la inmunidad innata , células T para la inmunidad celular adaptativa y células B para la inmunidad humoral adaptativa impulsada por anticuerpos . Los monocitos se diferencian en macrófagos y células dendríticas . Algunos linfocitos migran al timo donde se diferencian en varios tipos de células T, en algunos casos denominadas células T "asesinas" o "auxiliares" y se diferencian aún más después de salir del timo. Cada subtipo tiene funciones impulsadas por los tipos de citocinas secretadas y los órganos a los que las células migran preferentemente, también descrito como tráfico o anidación. [39] [40]
El ácido retinoico (AR) activa los receptores en la médula ósea, lo que da como resultado la generación de nuevos glóbulos blancos. [41] El AR regula la proliferación y diferenciación de los glóbulos blancos, el movimiento dirigido de las células T al sistema intestinal y la regulación positiva y negativa de la función de los linfocitos. [33] [34] [35] [36] [37] [42] Si el AR es adecuado, se suprime el subtipo de célula T colaboradora Th1 y se inducen los subtipos Th2, Th17 e iTreg (para regulador). Las células dendríticas ubicadas en el tejido intestinal tienen enzimas que convierten el retinal en ácido todo-trans -retinoico, para ser absorbido por los receptores de ácido retinoico en los linfocitos. El proceso desencadena la expresión genética que lleva a que los tipos de células T Th2, Th17 e iTreg se muevan y se instalen en los ganglios linfáticos mesentéricos y las placas de Peyer , respectivamente fuera y en la pared interna del intestino delgado. [35] [36] El efecto neto es una regulación negativa de la actividad inmune, vista como tolerancia a los alérgenos alimentarios y tolerancia a las bacterias residentes y otros organismos en el microbioma del intestino grueso. [33] [34] [37] En un estado deficiente de vitamina A, la inmunidad innata se ve comprometida y predominan las células Th1 proinflamatorias. [33] [42]
Piel
Las deficiencias de vitamina A se han relacionado con una mayor susceptibilidad a las infecciones y la inflamación de la piel. [43] La vitamina A parece modular la respuesta inmunitaria innata y mantiene la homeostasis de los tejidos epiteliales y la mucosa a través de su metabolito, el ácido retinoico (AR). Como parte del sistema inmunitario innato, los receptores tipo Toll en las células de la piel responden a los patógenos y al daño celular induciendo una respuesta inmunitaria proinflamatoria que incluye una mayor producción de AR. [43] El epitelio de la piel se encuentra con bacterias, hongos y virus. Los queratinocitos de la capa epidérmica de la piel producen y secretan péptidos antimicrobianos (AMP). La producción de AMP, resistina y catelicidina , es promovida por el AR. [43]
Unidades de medida
Como algunos carotenoides se pueden convertir en vitamina A, se ha intentado determinar qué cantidad de ellos en la dieta equivale a una determinada cantidad de retinol, de modo que se puedan hacer comparaciones de los beneficios de diferentes alimentos. La situación puede ser confusa porque las equivalencias aceptadas han cambiado con el tiempo.
Durante muchos años se utilizó un sistema de equivalencias en el que una unidad internacional (UI) equivalía a 0,3 μg de retinol (~1 nmol), 0,6 μg de β-caroteno o 1,2 μg de otros carotenoides provitamina A. [44] Esta relación se expresaba alternativamente mediante el equivalente de retinol (RE): un RE correspondía a 1 μg de retinol, a 2 μg de β-caroteno disuelto en aceite, a 6 μg de β-caroteno en alimentos y a 12 μg de α-caroteno , γ-caroteno o β- criptoxantina en alimentos.
Investigaciones más recientes han demostrado que la absorción de carotenoides provitamina A es sólo la mitad de lo que se creía anteriormente. Como resultado, en 2001 el Instituto de Medicina de los Estados Unidos recomendó una nueva unidad, el equivalente de actividad del retinol (RAE). Cada μg de RAE corresponde a 1 μg de retinol, 2 μg de β-caroteno en aceite, 12 μg de β-caroteno "dietético" o 24 μg de los otros tres carotenoides provitamina A dietéticos. [5]
| Sustancia y su entorno químico (por 1 μg) | Unión Internacional de Industriales (IU) (1989) | μg RE (1989) [5] | μg RAE (2001) [5] |
|---|---|---|---|
| Retinol | 3.33 | 1 | 1 |
| β-Caroteno , disuelto en aceite | 1.67 | 1/2 | 1/2 |
| β-Caroteno, un ingrediente dietético común | 1.67 | 1/6 | 1/12 |
| 0,83 | 1/12 | 1/24 |
Los modelos animales han demostrado que en la pared celular del enterocito, el β-caroteno es absorbido por el receptor depurador de la proteína transportadora de membrana de clase B, tipo 1 (SCARB1). El β-caroteno absorbido se convierte en retinal y luego en retinol. El primer paso del proceso de conversión consiste en que una molécula de β-caroteno es escindida por la enzima β-caroteno-15, 15'-monooxigenasa, que en los seres humanos y otras especies de mamíferos está codificada por el gen BCM01, [8] en dos moléculas de retinal. Cuando el retinol plasmático está en el rango normal, la expresión génica de SCARB1 y BC01 se suprime, lo que crea un ciclo de retroalimentación que suprime la absorción y conversión de β-caroteno. [12] La supresión de la absorción no es completa, ya que el receptor 36 no está regulado a la baja. [12]
Recomendaciones dietéticas
En 2001, la Academia Nacional de Medicina de Estados Unidos actualizó las ingestas dietéticas de referencia (IDR) para la vitamina A, que incluían las cantidades dietéticas recomendadas (RDA). [5] En el caso de los bebés de hasta 12 meses, no había suficiente información para establecer una RDA, por lo que en su lugar se muestra la ingesta adecuada (IA). En cuanto a la seguridad, también se establecieron niveles máximos de ingesta tolerables (UL). En el caso de los UL, no se suman los carotenoides al calcular la ingesta total de vitamina A para las evaluaciones de seguridad. [5]
| Grupo de etapas de la vida | RDA o IA de EE. UU. (μg RAE/día) [5] | Límites superiores de EE. UU. (μg/día) [5] | |
|---|---|---|---|
| Bebés | 0–6 meses | 400 (IA) | 600 |
| 7–12 meses | 500 (IA) | 600 | |
| Niños | 1–3 años | 300 | 600 |
| 4–8 años | 400 | 900 | |
| Hombres | 9–13 años | 600 | 1700 |
| 14–18 años | 900 | 2800 | |
| >19 años | 900 | 3000 | |
| Hembras | 9–13 años | 600 | 1700 |
| 14–18 años | 700 | 2800 | |
| >19 años | 700 | 3000 | |
| Embarazo | <19 años | 750 | 2800 |
| >19 años | 770 | 3000 | |
| Lactancia | <19 años | 1200 | 2800 |
| >19 años | 1300 | 3000 | |
La Autoridad Europea de Seguridad Alimentaria (AESA) denomina al conjunto de información Valores Dietéticos de Referencia (Dietary Reference Values), con Ingesta de Referencia Poblacional (PRI) en lugar de RDA, y Requerimiento Promedio en lugar de EAR. La AI y UL se definen de la misma manera que en los Estados Unidos. Para mujeres y hombres de 15 años o más, los PRI se establecen en 650 y 750 μg RE/día respectivamente. El PRI para el embarazo es de 700 μg RE/día, para la lactancia, 1300/día. Para niños de 1 a 14 años, los PRI aumentan con la edad de 250 a 600 μg RE/día. Estos PRI son similares a las RDA de EE. UU. [45] La EFSA revisó la misma cuestión de seguridad que Estados Unidos y estableció los UL en 800 para las edades de 1 a 3 años, 1100 para las edades de 4 a 6 años, 1500 para las edades de 7 a 10 años, 2000 para las edades de 11 a 14 años, 2600 para las edades de 15 a 17 años y 3000 μg/día para las edades de 18 años y más para la vitamina A preformada, es decir, sin incluir las contribuciones dietéticas de los carotenoides. [46]
Seguridad
La toxicidad por vitamina A ( hipervitaminosis A ) se produce cuando se acumula demasiada vitamina A en el organismo. Proviene del consumo de vitamina A preformada, pero no de carotenoides, ya que la conversión de estos últimos en retinol se suprime por la presencia de una cantidad adecuada de retinol.
Seguridad del retinol
Existen informes históricos de hipervitaminosis aguda de exploradores del Ártico que consumieron hígado de foca barbuda o de oso polar, ambas fuentes muy ricas de retinol almacenado, [47] y también hay informes de casos de hipervitaminosis aguda por consumir hígado de pescado, [48] pero, por lo demás, no existe riesgo de consumir demasiado a través de alimentos de consumo común. Solo el consumo de suplementos dietéticos que contienen retinol puede provocar toxicidad aguda o crónica. [6] La toxicidad aguda ocurre después de una dosis única o de corto plazo de más de 150.000 μg. Los síntomas incluyen visión borrosa, náuseas, vómitos, mareos y dolor de cabeza en un plazo de 8 a 24 horas. En los bebés de 0 a 6 meses a los que se les administró una dosis oral para prevenir el desarrollo de DVA, se observó un abultamiento de la fontanela craneal después de 24 horas, que generalmente se resolvió a las 72 horas. [49] Puede producirse toxicidad crónica con el consumo a largo plazo de vitamina A en dosis de 25.000 a 33.000 UI/día durante varios meses. [4] El consumo excesivo de alcohol puede provocar toxicidad crónica en dosis bajas. [3] Los síntomas pueden incluir efectos sobre el sistema nervioso, anomalías hepáticas, fatiga , debilidad muscular, cambios en los huesos y la piel, entre otros. Los efectos adversos de la toxicidad aguda y crónica se revierten una vez que se suspende el consumo. [5]
En 2001, con el fin de determinar los UL para adultos, el Instituto de Medicina de los EE. UU. consideró tres efectos adversos principales y se decidió por dos: teratogenicidad , es decir, causar defectos de nacimiento, y anomalías hepáticas. Se consideró la reducción de la densidad mineral ósea, pero se descartó porque la evidencia en humanos era contradictoria. [5] Durante el embarazo, especialmente durante el primer trimestre, el consumo de retinol en cantidades superiores a 4500 μg/día aumentó el riesgo de defectos de nacimiento, pero no por debajo de esa cantidad, estableciendo así un "Nivel de efecto adverso no observado" (NOAEL). Dada la calidad de la evidencia de los ensayos clínicos, el NOAEL se dividió por un factor de incertidumbre de 1,5 para establecer el UL para mujeres en edad reproductiva en 3000 μg/día de vitamina A preformada. Para todos los demás adultos, se detectaron anomalías hepáticas en ingestas superiores a 14 000 μg/día. Dada la escasa calidad de la evidencia clínica, se utilizó un factor de incertidumbre de 5 y, con redondeo, el UL se estableció en 3000 μg/día. A pesar de que el UL estadounidense se estableció en 3000 μg, es posible comprar suplementos dietéticos sin receta que contienen 7500 μg (25 000 UI), con una advertencia en la etiqueta que dice "No está destinado a un uso a largo plazo, a menos que se realice bajo supervisión médica". [50]
En el caso de los niños, los UL se extrapolaron a partir del valor de los adultos, ajustados en función del peso corporal relativo. En el caso de los bebés, varios estudios de casos informaron efectos adversos que incluyen fontanelas abultadas, aumento de la presión intracraneal, pérdida de apetito, hiperirritabilidad y descamación de la piel después de la ingestión crónica del orden de 6000 o más μg/día. Dada la pequeña base de datos, un factor de incertidumbre de 10 dividido por el "nivel más bajo de efecto adverso observado" (LOAEL) condujo a un UL de 600 μg/día. [5]
Seguridad del β-caroteno
No se han reportado efectos adversos aparte de la carotenemia por el consumo de alimentos ricos en β-caroteno. La suplementación con β-caroteno no causa hipervitaminosis A. [12] Se llevaron a cabo dos grandes ensayos clínicos (ATBC y CARET) en fumadores de tabaco para ver si años de suplementación con β-caroteno a 20 o 30 mg/día en cápsulas rellenas de aceite reducirían el riesgo de cáncer de pulmón. [51] Estos ensayos se implementaron porque los estudios observacionales habían reportado una menor incidencia de cáncer de pulmón en fumadores de tabaco que tenían dietas más altas en β-caroteno. Inesperadamente, la suplementación con altas dosis de β-caroteno o retinol resultó en una mayor incidencia de cáncer de pulmón y de mortalidad total debido a mortalidad cardíaca. [52] [12] Teniendo en cuenta esta y otras evidencias, el Instituto de Medicina de los EE. UU. decidió no establecer un Nivel Máximo de Ingesta Tolerable (UL) para β-caroteno. [12] [51] La Autoridad Europea de Seguridad Alimentaria, actuando en representación de la Unión Europea, también decidió no establecer un UL para el β-caroteno. [46]

Carotenosis
La carotenemia , también conocida como carotenemia, es una afección médica benigna y reversible en la que un exceso de carotenoides en la dieta produce una coloración anaranjada de la capa más externa de la piel. Se asocia a un alto valor de β-caroteno en sangre. Esto puede ocurrir después de un mes o dos de consumo de alimentos ricos en β-caroteno, como zanahorias, jugo de zanahoria, jugo de mandarina, mangos o, en África, aceite de palma rojo. Los suplementos dietéticos de β-caroteno pueden tener el mismo efecto. La decoloración se extiende a las palmas y las plantas de los pies, pero no a la parte blanca del ojo , lo que ayuda a distinguir la afección de la ictericia . [53] Se ha confirmado que el consumo de más de 30 mg/día durante un período prolongado conduce a la carotenemia. [12] [54]
Etiquetado de EE.UU.
Para los fines del etiquetado de alimentos y suplementos dietéticos en los EE. UU., la cantidad en una porción se expresa como un porcentaje del valor diario (% VD). Para los fines del etiquetado de vitamina A, el 100 % del valor diario se estableció en 5000 UI, pero se revisó a 900 μg RAE el 27 de mayo de 2016. [55] [56] Se proporciona una tabla de los valores diarios antiguos y nuevos para adultos en Ingesta diaria de referencia .
Fuentes
| Alimento | μg RAE (2001) [5] por 100 g [57] |
|---|---|
| aceite de hígado de bacalao | 30.000 |
| hígado de res (cocido) | 4.970–21.145 |
| hígado de pollo (cocido) | 4.296 |
| mantequilla (barra) | 684 |
| queso cheddar | 316 |
| huevo (cocido) | 140 |
La vitamina A se encuentra en muchos alimentos. [57] La vitamina A en los alimentos existe como retinol preformado (una forma activa de vitamina A) que se encuentra en el hígado animal, los productos lácteos y de huevo, y algunos alimentos fortificados, o como carotenoides provitamina A, que son pigmentos vegetales que se digieren en vitamina A después de consumir alimentos vegetales ricos en carotenoides, generalmente de color rojo, naranja o amarillo. [4] Los pigmentos carotenoides pueden estar enmascarados por las clorofilas en vegetales de hojas verdes oscuras, como las espinacas. La biodisponibilidad relativamente baja de los carotenoides de los alimentos vegetales resulta en parte de la unión a las proteínas: cortar, homogeneizar o cocinar altera las proteínas vegetales, lo que aumenta la biodisponibilidad de los carotenoides provitamina A. [4]
Las dietas vegetarianas y veganas pueden proporcionar suficiente vitamina A en forma de carotenoides provitamina A si la dieta incluye zanahorias, jugo de zanahoria, batatas, verduras de hoja verde como espinacas y col rizada y otros alimentos ricos en carotenoides. En los EE. UU., la ingesta diaria promedio de β-caroteno está en el rango de 2 a 7 mg. [58]
Algunos alimentos procesados y suplementos dietéticos son fuentes de vitamina A o β-caroteno. [4] [5]
A pesar de que Estados Unidos ha establecido un límite máximo de 3000 μg/día para adultos, algunas empresas estadounidenses venden vitamina A (como palmitato de retinilo) como suplemento dietético con cantidades de 7500 μg/día. [59] [60]
Fortificación
Algunos países exigen o recomiendan la fortificación de los alimentos. En enero de 2022, 37 países, principalmente en África subsahariana, exigen la fortificación de alimentos con vitamina A, generalmente en forma de palmitato de retinilo o acetato de retinilo, como el aceite de cocina , 11,7 mg/kg, y Nigeria, aceite, 6 mg/kg; harina de trigo y maíz, 2 mg/kg. [ 61 ] Otros 12 países, principalmente en el sudeste asiático, tienen un programa de fortificación voluntaria. Por ejemplo, el gobierno de la India recomienda 7,95 mg/kg en aceite y 0,626 mg/kg en harina de trigo y arroz. Sin embargo, el cumplimiento en los países con fortificación voluntaria es menor que en los países con fortificación obligatoria. [61] Ningún país de Europa o América del Norte fortifica los alimentos con vitamina A. [61]
| Alimento | μg RAE (2001) [5] por 100 g [57] |
|---|---|
| Batata al horno sin grasas añadidas | 957 |
| Zanahoria congelada, cocida, sin grasa añadida | 843 |
| Calabaza enlatada, cocida | 767 |
| Espinacas frescas, cocidas, sin grasas añadidas. | 341 |
| Col rizada fresca, cocida, sin grasas añadidas | 245 |
Aparte de la fortificación mediante la adición de vitamina A sintética a los alimentos, se han explorado medios para fortificar los alimentos mediante ingeniería genética. La investigación sobre el arroz comenzó en 1982. [62] Los primeros ensayos de campo de cultivares de arroz dorado se llevaron a cabo en 2004. [63] El resultado fue el "Arroz Dorado", una variedad de arroz Oryza sativa producida mediante ingeniería genética para biosintetizar β-caroteno, un precursor del retinol, en las partes comestibles del arroz. [64] [65] En mayo de 2018, las agencias reguladoras de los Estados Unidos, Canadá, Australia y Nueva Zelanda concluyeron que el Arroz Dorado cumplía con los estándares de seguridad alimentaria. [66] El 21 de julio de 2021, Filipinas se convirtió en el primer país en emitir oficialmente el permiso de bioseguridad para la propagación comercial del Arroz Dorado. [67] [68] Sin embargo, en abril de 2023, la Corte Suprema de Filipinas emitió un auto de Kalikasan ordenando al Departamento de Agricultura detener la distribución comercial de arroz genéticamente modificado en el país. [69]
Suplementación con vitamina A (VAS)

La administración de suplementos orales en dosis altas sigue siendo la principal estrategia para minimizar la deficiencia. [71] En 2017, más de 80 países en todo el mundo están implementando programas universales de VAS dirigidos a niños de 6 a 59 meses de edad a través de campañas nacionales semestrales. [72] Las dosis en estos programas son una dosis de 50 000 o 100 000 UI para niños de 6 a 11 meses y de 100 000 a 200 000 UI para niños de 12 meses a cinco años, cada cuatro a seis meses. [23]
Deficiencia
Causas primarias
La deficiencia de vitamina A es común en los países en desarrollo , especialmente en África subsahariana y el sudeste asiático . La deficiencia puede ocurrir a cualquier edad, pero es más común en niños en edad preescolar y mujeres embarazadas, estas últimas debido a la necesidad de transferir retinol al feto. Las causas son la baja ingesta de alimentos de origen animal que contienen retinol y la baja ingesta de alimentos de origen vegetal que contienen caroteno. Se estima que la deficiencia de vitamina A afecta aproximadamente a un tercio de los niños menores de cinco años en todo el mundo, [73] posiblemente provocando la muerte de 670.000 niños menores de cinco años al año. [74]
Entre 250.000 y 500.000 niños en los países en desarrollo quedan ciegos cada año debido a la deficiencia de vitamina A. [3] La deficiencia de vitamina A es "la principal causa de ceguera infantil evitable", según UNICEF . [10] [22] También aumenta el riesgo de muerte por enfermedades infantiles comunes, como la diarrea . UNICEF considera que abordar la deficiencia de vitamina A es fundamental para reducir la mortalidad infantil , el cuarto de los Objetivos de Desarrollo del Milenio de las Naciones Unidas . [10]
Durante el diagnóstico, la ceguera nocturna y los ojos secos son signos de deficiencia de vitamina A que pueden reconocerse sin necesidad de realizar pruebas bioquímicas. El retinol plasmático se utiliza para confirmar el estado de vitamina A. Una concentración plasmática de aproximadamente 2,0 μmol/L es normal; menos de 0,70 μmol/L (equivalente a 20 μg/dL) indica deficiencia de vitamina A moderada, y menos de 0,35 μmol/L (10 μg/dL) indica deficiencia de vitamina A grave. Un nivel de retinol en la leche materna inferior a 8 μg/gramo de grasa láctea se considera insuficiente. [6] Una debilidad de estas medidas es que no son buenos indicadores de las reservas hepáticas de vitamina A como ésteres de retinilo en las células estrelladas hepáticas . La cantidad de vitamina A que sale del hígado, unida a la proteína transportadora de retinol (RBP), está bajo un estricto control siempre que haya suficientes reservas hepáticas. Solo cuando el contenido hepático de vitamina A cae por debajo de aproximadamente 20 μg/gramo, la concentración en la sangre disminuye. [5] [75]
Causas secundarias
Existen otras causas de deficiencia además de la baja ingesta dietética de vitamina A como retinol o carotenos. Se necesita una dieta adecuada de proteínas y energía calórica para una tasa normal de síntesis de RBP, sin la cual, el retinol no puede movilizarse para salir del hígado. Las infecciones sistémicas pueden causar disminuciones transitorias en la síntesis de RBP incluso si no hay desnutrición proteico-calórica. El consumo crónico de alcohol reduce el almacenamiento de vitamina A en el hígado. [5] La enfermedad del hígado graso no alcohólico (NAFLD), caracterizada por la acumulación de grasa en el hígado, es la manifestación hepática del síndrome metabólico . El daño hepático por NAFLD reduce la capacidad de almacenamiento del hígado para el retinol y reduce la capacidad de movilizar las reservas hepáticas para mantener la concentración circulante normal. [76] La vitamina A parece estar involucrada en la patogénesis de la anemia por diversos mecanismos biológicos, como la mejora del crecimiento y la diferenciación de las células progenitoras de eritrocitos, la potenciación de la inmunidad a las infecciones y la movilización de las reservas de hierro de los tejidos.
Requisitos de los animales
Todas las especies de vertebrados y cordados requieren vitamina A, [27] ya sea como carotenoides dietéticos o retinol preformado al consumir otros animales. Se han reportado deficiencias en perros, gatos, aves, reptiles y anfibios criados en laboratorio y como mascotas, [77] [78] también en pollos y pavos criados comercialmente. [79] Las especies herbívoras como caballos, ganado vacuno y ovejas pueden obtener suficiente β-caroteno de los pastos verdes para estar saludables, pero el contenido en la hierba de los pastos seca debido a la sequía y el heno almacenado durante mucho tiempo puede ser demasiado bajo, lo que conduce a la DVA. [77] Las especies omnívoras y carnívoras, especialmente las que se encuentran en la parte superior de la cadena alimentaria, pueden acumular grandes cantidades de ésteres de retinilo en sus hígados, o bien excretar ésteres de retinilo en la orina como un medio para lidiar con el excedente. [16] Antes de la era del retinol sintético, el aceite de hígado de bacalao , rico en vitaminas A y D, era un suplemento dietético de consumo común. [80] [81] Los invertebrados no pueden sintetizar carotenoides ni retinol, y por lo tanto deben obtener estos nutrientes esenciales del consumo de algas, plantas o animales. [82] [83] [84]
Usos médicos
En 2021, la vitamina A fue el medicamento número 298 más recetado en los Estados Unidos, con más de 500 000 recetas. [85] [86]
Prevención y tratamiento de la deficiencia
El reconocimiento de su prevalencia y consecuencias ha llevado a los gobiernos y a las organizaciones no gubernamentales a promover la fortificación de los alimentos con vitamina A [61] y a crear programas que administren grandes dosis orales de vitamina A en forma de bolo a niños pequeños cada cuatro a seis meses. [72] En 2008, la Organización Mundial de la Salud estimó que la suplementación con vitamina A durante una década en 40 países evitó 1,25 millones de muertes por DVA. [87] Una revisión Cochrane informó que la suplementación con vitamina A se asocia con una reducción clínicamente significativa de la morbilidad y la mortalidad en niños de seis meses a cinco años de edad. La mortalidad por todas las causas se redujo en un 14% y la incidencia de diarrea en un 12%. [23] Sin embargo, una revisión Cochrane realizada por el mismo grupo concluyó que no había evidencia suficiente para recomendar la suplementación general con vitamina A para bebés de uno a seis meses de edad, ya que no redujo la mortalidad o la morbilidad infantil. [49]
Ácido retinoico oral
Se ha demostrado que el ácido retinoico (AR) consumido por vía oral, como all-trans -tretinoína o 13- cis -isotretinoína, mejora la salud de la piel del rostro activando genes y diferenciando los queratinocitos (células cutáneas inmaduras) en células epidérmicas maduras. El AR reduce el tamaño y la secreción de las glándulas sebáceas y, al hacerlo, reduce la cantidad de bacterias tanto en los conductos como en la superficie de la piel. Reduce la inflamación mediante la inhibición de las respuestas quimiotácticas de los monocitos y los neutrófilos. En los EE. UU., la isotretinoína se lanzó al mercado en 1982 como un tratamiento revolucionario para el acné vulgar grave y refractario . Se demostró que una dosis de 0,5 a 1,0 mg/kg de peso corporal/día es suficiente para producir una reducción en la excreción de sebo del 90% en un mes o dos, pero la duración recomendada del tratamiento es de 4 a 6 meses. [31] La isotretinoína es un teratógeno conocido, con un riesgo estimado de entre el 20% y el 35% de defectos físicos congénitos en los bebés expuestos a la isotretinoína en el útero , incluidos numerosos defectos congénitos como defectos craneofaciales, malformaciones cardiovasculares y neurológicas o trastornos tímicos. Se ha establecido que los deterioros neurocognitivos en ausencia de defectos físicos son del 30% al 60%. Por estas razones, se iniciaron programas de educación para médicos y pacientes, recomendando que, en el caso de las mujeres en edad fértil, se inicie la anticoncepción un mes antes de comenzar con la isotretinoína oral (o tópica) y se continúe durante un mes después de finalizar el tratamiento. [31]
Además del uso aprobado para tratar el acné vulgar, los investigadores han investigado aplicaciones fuera de etiqueta para afecciones dermatológicas, como rosácea, psoriasis y otras afecciones. [88] Se informó que la rosácea respondió favorablemente a dosis menores que las utilizadas para el acné. La isotretinoína en combinación con luz ultravioleta demostró ser eficaz para tratar la psoriasis . La isotretinoína en combinación con interferón alfa inyectado mostró cierto potencial para tratar las verrugas genitales . La isotretinoína en combinación con fluorouracilo tópico o interferón alfa inyectado mostró cierto potencial para tratar lesiones cutáneas precancerosas y cáncer de piel. [88]
Ácido retinoico tópico y retinol

Los ácidos retinoicos tretinoína ( ácido todo-trans -retinoico) e isotretinoína ( ácido 13- cis -retinoico) son medicamentos tópicos recetados que se usan para tratar el acné quístico moderado a severo y el acné que no responde a otros tratamientos. [89] [90] [91] [92] Estos generalmente se aplican como una crema para la piel en el rostro después de la limpieza para eliminar el maquillaje y los aceites de la piel. La tretinoína y la isotretinoína actúan uniéndose a dos familias de receptores nucleares dentro de los queratinocitos: los receptores de ácido retinoico (RAR) y los receptores X de retinoides (RXR). [93] Estos eventos contribuyen a la normalización de la queratinización folicular y la disminución de la cohesión de los queratinocitos, lo que resulta en una oclusión folicular reducida y la formación de microcomedones. [94] El complejo retinoide-receptor compite por las proteínas coactivadoras de AP-1, un factor de transcripción clave involucrado en la inflamación. [93] Los productos con ácido retinoico también reducen la secreción de sebo , una fuente de nutrientes para las bacterias, de los poros faciales. [95]
Estos medicamentos, cuando se aplican de forma tópica, están designados en los EE. UU. como categoría C en el embarazo (los estudios de reproducción en animales han demostrado un efecto adverso en el feto) y no deben ser utilizados por mujeres embarazadas o mujeres que prevén quedar embarazadas. [32] Muchos países establecieron una política de prevención del embarazo basada en la educación de médicos y pacientes. [96]
El trifaroteno es un retinoide de prescripción médica para el tratamiento tópico del acné vulgar. [14] Funciona como un agonista del receptor de ácido retinoico (RAR)-γ . [97]
Los productos tópicos sin receta que tienen afirmaciones de salud para reducir el acné facial, combatir las manchas oscuras de la piel y reducir las arrugas y líneas asociadas con el envejecimiento a menudo contienen palmitato de retinilo . La hipótesis es que este se absorbe y desesterifica a retinol libre, luego se convierte en retinaldehído y se metaboliza aún más a ácido todo-trans -retinoico, de donde tendrá los mismos efectos que los productos de prescripción con menos efectos secundarios. [98] Hay alguna evidencia ex vivo con piel humana de que el retinol esterificado se absorbe y luego se convierte en retinol. [99] Además del retinol esterificado, algunos de estos productos contienen retinoato de hidroxipinacolona, identificado como ácido 9- cis -retinoico esterificado. [100]
Síntesis
Biosíntesis
La síntesis de carotenoides se lleva a cabo en plantas, ciertos hongos y bacterias. Estructuralmente, los carotenos son tetraterpenos , lo que significa que se sintetizan bioquímicamente a partir de cuatro unidades de terpeno de 10 carbonos , que a su vez se formaron a partir de ocho unidades de isopreno de 5 carbonos . Los pasos intermedios son la creación de una molécula de fitoeno de 40 carbonos , la conversión a licopeno mediante desaturación y luego la creación de anillos de ionona en ambos extremos de la molécula. El β-caroteno tiene un anillo de β-ionona en ambos extremos, lo que significa que la molécula se puede dividir simétricamente para producir dos moléculas de retinol. El α-caroteno tiene un anillo de β-ionona en un extremo y un anillo de Ɛ-ionona en el otro, por lo que tiene la mitad de la capacidad de conversión del retinol. [12]

En la mayoría de las especies animales, el retinol se sintetiza a partir de la descomposición de la provitamina formada en las plantas, el β-caroteno. Primero, la enzima beta-caroteno 15,15'-dioxigenasa (BCO-1) escinde el β-caroteno en el doble enlace central, creando un epóxido. Luego, este epóxido es atacado por el agua, creando dos grupos hidroxilo en el centro de la estructura. La escisión se produce cuando estos alcoholes se oxidan a aldehídos utilizando NAD + . Luego, el retinal resultante se reduce rápidamente a retinol por la enzima retinol deshidrogenasa. [6] Las especies omnívoras, como perros, lobos, coyotes y zorros en general, son bajos productores de BCO-1. La enzima falta en los félidos (gatos), lo que significa que los requisitos de vitamina A se satisfacen a partir del contenido de ésteres de retinilo de los animales de presa. [16]
Síntesis industrial

El β-caroteno se puede extraer del hongo Blakeslea trispora , del alga marina Dunaliella salina o de la levadura genéticamente modificada Saccharomyces cerevisiae , comenzando con xilosa como sustrato. [101] La síntesis química utiliza un método desarrollado por BASF [102] [103] o una reacción de Grignard utilizada por Hoffman-La Roche . [104]
El mercado mundial de retinol sintético se destina principalmente a la alimentación animal, dejando aproximadamente el 13% para una combinación de alimentos, medicamentos recetados y suplementos dietéticos. [105] Los métodos industriales para la producción de retinol se basan en la síntesis química. La primera síntesis industrializada de retinol fue lograda por la empresa Hoffmann-La Roche en 1947. En las décadas siguientes, otras ocho empresas desarrollaron sus propios procesos. La β-ionona, sintetizada a partir de acetona, es el punto de partida esencial para todas las síntesis industriales. Cada proceso implica alargar la cadena de carbono insaturada. [105] El retinol puro es extremadamente sensible a la oxidación y se prepara y transporta a bajas temperaturas y atmósferas libres de oxígeno. Cuando se prepara como suplemento dietético o aditivo alimentario, el retinol se estabiliza como los derivados de éster acetato de retinilo o palmitato de retinilo . Antes de 1999, tres empresas, Roche, BASF y Rhone-Poulenc controlaban el 96% de las ventas mundiales de vitamina A. En 2001, la Comisión Europea impuso multas totales de 855,22 millones de euros a estas y otras cinco empresas por su participación en ocho cárteles distintos de reparto de mercado y fijación de precios que se remontan a 1989. [106] Roche vendió su división de vitaminas a DSM en 2003. DSM y BASF tienen la mayor parte de la producción industrial. [105] Una alternativa de biosíntesis utiliza especies de levadura genéticamente modificadas, Saccharomyces cerevisiae , para sintetizar retinal y retinol, utilizando xilosa como sustrato de partida. Esto se logró haciendo que la levadura sintetizara primero β-caroteno y luego la enzima de escisión β-caroteno 15,15'-dioxigenasa para producir retinal. [107]
Investigación
Cerebro
La investigación animal (en ratones), que es preclínica, también encontró que el ácido retinoide, el metabolito bioactivo de la vitamina A, tiene un efecto en las áreas del cerebro responsables de la memoria y el aprendizaje. [108]
Cáncer
Los metanálisis de ensayos de intervención y de observación para varios tipos de cáncer arrojan resultados contradictorios. La suplementación con β-caroteno no pareció reducir el riesgo de cáncer en general ni de cánceres específicos, como el cáncer de páncreas, colorrectal, de próstata, de mama, melanoma o de piel en general. [109] La suplementación con dosis altas de β-caroteno resultó inesperadamente en una mayor incidencia de cáncer de pulmón y de mortalidad total en personas que eran fumadoras. [12]
Para el retinol dietético, no se observaron efectos para la ingesta dietética alta y la supervivencia del cáncer de mama , [110] riesgo de cáncer de hígado , [111] riesgo de cáncer de vejiga [112] o riesgo de cáncer colorrectal , [113] [114] aunque la última revisión informó un menor riesgo para un mayor consumo de β-caroteno. [114] Por el contrario, se informó una asociación inversa entre la ingesta de retinol y el riesgo relativo de cáncer de esófago , [115] cáncer gástrico , [116] cáncer de ovario , [117] cáncer de páncreas , [118] cáncer de pulmón , [ 119] melanoma , [120] y cáncer de cuello uterino . [121] Para el cáncer de pulmón, también se observó una asociación inversa para la ingesta de β-caroteno, separada de los resultados del retinol. [119] Cuando se comparó la ingesta dietética alta con la ingesta dietética baja, las disminuciones en el riesgo relativo estuvieron en el rango de 15 a 20%. En el caso del cáncer gástrico, un metanálisis de ensayos de prevención informó una disminución del 29 % en el riesgo relativo con la suplementación con retinol a 1500 μg/día [122]
Trastorno del espectro alcohólico fetal
El trastorno del espectro alcohólico fetal (TEAF), anteriormente conocido como síndrome alcohólico fetal, se presenta como malformaciones craneofaciales, trastornos neuroconductuales y discapacidades mentales, todos atribuidos a la exposición de embriones humanos al alcohol durante el desarrollo fetal. [123] [124] El riesgo de TEAF depende de la cantidad consumida, la frecuencia de consumo y los puntos del embarazo en los que se consume el alcohol. [125] El etanol es un teratógeno conocido , es decir, causa defectos de nacimiento. El etanol es metabolizado por las enzimas alcohol deshidrogenasa en acetaldehído . [126] [127] La oxidación posterior del acetaldehído en acetato es realizada por enzimas aldehído deshidrogenasa . Dado que el ácido retinoico (AR) regula numerosos procesos embrionarios y de diferenciación, uno de los mecanismos propuestos para los efectos teratogénicos del etanol es una competencia por las enzimas necesarias para la biosíntesis del AR a partir de la vitamina A. La investigación animal demuestra que en el embrión, la competencia tiene lugar entre el acetaldehído y el retinaldehído por la actividad de la aldehído deshidrogenasa. En este modelo, el acetaldehído inhibe la producción de ácido retinoico por la retinaldehído deshidrogenasa. Los defectos de desarrollo inducidos por el etanol se pueden mejorar aumentando los niveles de retinol, retinaldehído o retinaldehído deshidrogenasa. Por lo tanto, la investigación animal apoya la reducción de la actividad del ácido retinoico como un desencadenante etiológico en la inducción del TEAF. [123] [124] [30] [128]
Malaria
Tanto la malaria como la DVA son comunes entre los niños pequeños en el África subsahariana. Se ha demostrado repetidamente que la suplementación con vitamina A a los niños en regiones donde la DVA es común reduce las tasas generales de mortalidad, especialmente por sarampión y diarrea. [129] En el caso de la malaria, los resultados de los ensayos clínicos son mixtos, ya sea que el tratamiento con vitamina A no redujo la incidencia de la probable fiebre palúdica, o bien no afectó a la incidencia, pero sí redujo la densidad de parásitos confirmada por portaobjetos y redujo el número de episodios febriles. [129] Se planteó la cuestión de si la malaria causa DVA, o si la DVA contribuye a la gravedad de la malaria, o si ambas cosas. Los investigadores propusieron varios mecanismos por los cuales la malaria (y otras infecciones) podrían contribuir a la DVA, incluida una reducción inducida por la fiebre en la síntesis de la proteína de unión a la retina (RBP) responsable del transporte de retinol desde el hígado al plasma y los tejidos, pero informaron que no encontraron evidencia de una depresión transitoria o restauración de la RBP plasmática o el retinol después de que se eliminara una infección palúdica. [129]
En la historia

En 1912, Frederick Gowland Hopkins demostró que otros factores accesorios desconocidos que se encuentran en la leche, además de los carbohidratos , las proteínas y las grasas, eran necesarios para el crecimiento de las ratas. Hopkins recibió un Premio Nobel por este descubrimiento en 1929. [7] [130] En 1913, una de estas sustancias fue descubierta de forma independiente por Elmer McCollum y Marguerite Davis en la Universidad de Wisconsin-Madison , y Lafayette Mendel y Thomas Burr Osborne en la Universidad de Yale . McCollum y Davis finalmente recibieron el crédito porque presentaron su artículo tres semanas antes que Mendel y Osborne. Ambos artículos aparecieron en el mismo número del Journal of Biological Chemistry en 1913. [131] Los "factores accesorios" fueron denominados "solubles en grasa" en 1918, y más tarde "vitamina A" en 1920. En 1919, Harry Steenbock (Universidad de Wisconsin-Madison) propuso una relación entre los pigmentos vegetales amarillos (β-caroteno) y la vitamina A. En 1931, el químico suizo Paul Karrer describió la estructura química de la vitamina A. [130] El ácido retinoico y el retinol fueron sintetizados por primera vez en 1946 y 1947 por dos químicos holandeses, David Adriaan van Dorp y Jozef Ferdinand Arens. [132] [133]

Durante la Segunda Guerra Mundial , los bombarderos alemanes atacaban de noche para evadir las defensas británicas. Para mantener en secreto para Alemania la invención en 1939 de un nuevo sistema de radar de interceptación aerotransportado , el Ministerio de Información británico dijo a los periódicos una afirmación no probada de que el éxito defensivo nocturno de los pilotos de la Real Fuerza Aérea se debía a una alta ingesta dietética de zanahorias ricas en β-caroteno, convenciendo con éxito a mucha gente. [134]
En 1967, George Wald compartió el Premio Nobel de Fisiología y Medicina por su trabajo sobre los procesos químicos visuales en el ojo. [135] Wald había demostrado en 1935 que las células fotorreceptoras del ojo contienen rodopsina, un cromóforo compuesto por la proteína opsina y 11- cis -retinal . Cuando es alcanzado por la luz, el 11- cis -retinal sufre fotoisomerización a todo-trans -retinal y a través de una cascada de transducción de señales envía una señal nerviosa al cerebro. El todo-trans -retinal se reduce a todo-trans -retinol y viaja de vuelta al epitelio pigmentario de la retina para reciclarse a 11- cis -retinal y reconjugarse a opsina. [7] [136] El trabajo de Wald fue la culminación de casi 60 años de investigación. En 1877, Franz Christian Boll identificó un pigmento sensible a la luz en los segmentos externos de las células de bastón de la retina que se desvanecía/blanqueaba cuando se exponía a la luz, pero se restauraba después de que cesaba la exposición a la luz. Sugirió que esta sustancia, mediante un proceso fotoquímico, transmitía la impresión de luz al cerebro. [7] La investigación fue retomada por Wilhelm Kühne , quien nombró al pigmento rodopsina, también conocido como "púrpura visual". Kühne confirmó que la rodopsina es extremadamente sensible a la luz y, por lo tanto, permite la visión en condiciones de poca luz, y que era esta descomposición química la que estimulaba los impulsos nerviosos al cerebro. [7] La investigación se estancó hasta después de la identificación de la "vitamina A liposoluble" como una sustancia dietética que se encuentra en la grasa de la leche pero no en la manteca de cerdo, que revertiría la ceguera nocturna y la xeroftalmia. En 1925, Fridericia y Holm demostraron que las ratas deficientes en vitamina A eran incapaces de regenerar la rodopsina después de ser trasladadas de una habitación iluminada a una oscura. [137]
Referencias
- ^ "Vitamina A". Sociedad Estadounidense de Farmacéuticos de Sistemas de Salud. Archivado desde el original el 30 de diciembre de 2016. Consultado el 8 de diciembre de 2016 .
- ^ "Aquasol A - inyección de palmitato de vitamina A, solución". DailyMed . 14 de agosto de 2020 . Consultado el 18 de enero de 2024 .
- ^ abc "Hoja informativa sobre la vitamina A para profesionales de la salud". Oficina de Suplementos Dietéticos, Institutos Nacionales de Salud de EE. UU. Marzo de 2021. Consultado el 8 de agosto de 2021 .
- ^ abcdefgh «Vitamina A». Centro de Información sobre Micronutrientes, Instituto Linus Pauling, Universidad Estatal de Oregón, Corvallis. 1 de julio de 2016. Consultado el 21 de diciembre de 2021 .
- ^ abcdefghijklmnopq Instituto de Medicina (2001). "Vitamina A". Ingesta dietética de referencia para vitamina A, vitamina K, arsénico, boro, cromo, cobre, yodo, hierro, manganeso, molibdeno, níquel, silicio, vanadio y zinc . Junta de Alimentos y Nutrición del Instituto de Medicina. págs. 82–161. ISBN 0-309-07290-5.
- ^ abcdefghijklmnop Blaner WS (2020). "Vitamina A". En Marriott BP, Birt DF, Stallings VA, Yates AA (eds.). Present Knowledge in Nutrition (undécima edición). Londres: Academic Press (Elsevier). págs. 73–92. ISBN 978-0-323-66162-1.
- ^ abcdef Wolf G (junio de 2001). "El descubrimiento de la función visual de la vitamina A". The Journal of Nutrition . 131 (6): 1647–1650. doi : 10.1093/jn/131.6.1647 . PMID 11385047.
- ^ abc Wu L, Guo X, Wang W, Medeiros DM, Clarke SL, Lucas EA, et al. (noviembre de 2016). "Aspectos moleculares de la β, β-caroteno-9', 10'-oxigenasa 2 en el metabolismo de los carotenoides y enfermedades". Experimental Biology and Medicine . 241 (17): 1879–1887. doi :10.1177/1535370216657900. PMC 5068469 . PMID 27390265.
- ^ ab Kedishvili NY (2016). "Síntesis y degradación del ácido retinoico". La bioquímica de la señalización retinoide II . Bioquímica subcelular. Vol. 81. págs. 127–161. doi :10.1007/978-94-024-0945-1_5. ISBN 978-94-024-0943-7. PMC 5551983 . PMID 27830503.
- ^ abc «Deficiencia de vitamina A» (PDF) . UNICEF . Archivado desde el original (PDF) el 12 de septiembre de 2016 . Consultado el 3 de junio de 2015 .
- ^ Lidén M, Eriksson U (mayo de 2006). "Comprensión del metabolismo del retinol: estructura y función de las deshidrogenasas del retinol". The Journal of Biological Chemistry . 281 (19): 13001–13004. doi : 10.1074/jbc.R500027200 . PMID 16428379.
- ^ abcdefghi von Lintig J (2020). "Carotenoides". En Marriott BP, Birt DF, Stallings VA, Yates AA (eds.). Present Knowledge in Nutrition (undécima edición). Londres: Academic Press (Elsevier). págs. 531–549. ISBN 978-0-323-66162-1.
- ^ ab Beckenbach L, Baron JM, Merk HF, Löffler H, Amann PM (2015). "Tratamiento de enfermedades de la piel con retinoides". Revista Europea de Dermatología . 25 (5): 384–391. doi : 10.1684/ejd.2015.2544 . PMID 26069148. S2CID 408725.
- ^ ab "Monografía de trifaroteno para profesionales". Drugs.com . 28 de octubre de 2019 . Consultado el 23 de mayo de 2021 .
- ^ ab Chelstowska S, Widjaja-Adhi MA, Silvaroli JA, Golczak M (octubre de 2016). "Base molecular para la absorción y almacenamiento de vitamina A en vertebrados". Nutrientes . 8 (11): 676. doi : 10.3390/nu8110676 . PMC 5133064 . PMID 27792183.
- ^ abcdef Green AS, Fascetti AJ (2016). "Satisfacer los requerimientos de vitamina A: eficacia e importancia del β-caroteno en especies animales". TheScientificWorldJournal . 2016 : 7393620. doi : 10.1155/2016/7393620 . PMC 5090096 . PMID 27833936.
- ^ Roberts C (marzo de 2020). "Regulación de la disponibilidad de ácido retinoico durante el desarrollo y la regeneración: el papel de las enzimas CYP26". Revista de biología del desarrollo . 8 (1): 6. doi : 10.3390/jdb8010006 . PMC 7151129 . PMID 32151018.
- ^ Isoherranen N, Zhong G (diciembre de 2019). "Importancia bioquímica y fisiológica de las hidroxilasas del ácido retinoico CYP26". Farmacología y terapéutica . 204 : 107400. doi :10.1016/j.pharmthera.2019.107400. PMC 6881548 . PMID 31419517.
- ^ abcd Whitcher JP, Srinivasan M, Upadhyay MP (2001). "Ceguera corneal: una perspectiva global". Boletín de la Organización Mundial de la Salud . 79 (3): 214–221. PMC 2566379 . PMID 11285665.
- ^ ab Combs GF (2008). Las vitaminas: aspectos fundamentales de la nutrición y la salud (3.ª ed.). Burlington, MA: Elsevier Academic Press. ISBN 978-0-12-183493-7.
- ^ ab Miller RE, Tredici TJ (1 de agosto de 1992). «Night Vision Manual for the Flight Surgeon». Departamento de Defensa de los Estados Unidos, Centro de Información Técnica de Defensa . Archivado desde el original el 4 de enero de 2022. Consultado el 4 de enero de 2022 .
- ^ abcd Akhtar S, Ahmed A, Randhawa MA, Atukorala S, Arlappa N, Ismail T, et al. (diciembre de 2013). "Prevalencia de la deficiencia de vitamina A en el sur de Asia: causas, resultados y posibles soluciones". Revista de salud, población y nutrición . 31 (4): 413–423. doi :10.3329/jhpn.v31i4.19975. PMC 3905635 . PMID 24592582.
- ^ abcd Imdad A, Mayo-Wilson E, Haykal MR, Regan A, Sidhu J, Smith A, et al. (marzo de 2022). "Suplementación con vitamina A para prevenir la morbilidad y la mortalidad en niños de seis meses a cinco años de edad". Base de Datos Cochrane de Revisiones Sistemáticas . 3 (11): CD008524. doi :10.1002/14651858.CD008524.pub4. PMC 8925277 . PMID 35294044.
- ^ Duester G (septiembre de 2008). "Síntesis y señalización del ácido retinoico durante la organogénesis temprana". Cell . 134 (6): 921–931. doi :10.1016/j.cell.2008.09.002. PMC 2632951 . PMID 18805086.
- ^ Stipanuk MH (2006). Aspectos bioquímicos, fisiológicos y moleculares de la nutrición humana (2.ª ed.). Filadelfia: Saunders. ISBN 9781416002093.
- ^ Metzler MA, Sandell LL (diciembre de 2016). "Metabolismo enzimático de la vitamina A en embriones de vertebrados en desarrollo". Nutrients . 8 (12): 812. doi : 10.3390/nu8120812 . PMC 5188467 . PMID 27983671.
- ^ ab Marlétaz F, Holland LZ, Laudet V, Schubert M (2006). "Señalización del ácido retinoico y la evolución de los cordados". Revista Internacional de Ciencias Biológicas . 2 (2): 38–47. doi :10.7150/ijbs.2.38. PMC 1458431 . PMID 16733532.
- ^ Pawlikowski B, Wragge J, Siegenthaler JA (julio de 2019). "Señalización del ácido retinoico en el desarrollo vascular". Genesis . 57 (7–8): e23287. doi :10.1002/dvg.23287. PMC 6684837 . PMID 30801891.
- ^ Wang S, Moise AR (julio de 2019). "Información reciente sobre el papel y la regulación de la señalización del ácido retinoico durante el desarrollo epicárdico". Genesis . 57 (7–8): e23303. doi :10.1002/dvg.23303. PMC 6682438 . PMID 31066193.
- ^ ab Shabtai Y, Fainsod A (abril de 2018). "Competencia entre la depuración de etanol y la biosíntesis de ácido retinoico en la inducción del síndrome de alcoholismo fetal". Bioquímica y biología celular . 96 (2): 148–60. doi :10.1139/bcb-2017-0132. PMID 28982012.
- ^ abc Draghici CC, Miulescu RG, Petca RC, Petca A, Dumitrașcu MC, Șandru F (mayo de 2021). "Efecto teratogénico de la isotretinoína tanto en mujeres como en hombres fértiles (revisión)". Medicina experimental y terapéutica . 21 (5): 534. doi :10.3892/etm.2021.9966. PMC 8014951 . PMID 33815607.
- ^ ab "Uso tópico de tretinoína durante el embarazo". Drugs.com . 1 de julio de 2019 . Consultado el 16 de enero de 2020 .
- ^ abcde Ross AC (noviembre de 2012). "Vitamina A y ácido retinoico en la inmunidad relacionada con las células T". The American Journal of Clinical Nutrition . 96 (5): 1166S–1172S. doi :10.3945/ajcn.112.034637. PMC 3471201 . PMID 23053562.
- ^ abcd Pino-Lagos K, Guo Y, Noelle RJ (2010). "Ácido retinoico: un factor clave en la inmunidad". BioFactors . 36 (6): 430–436. doi :10.1002/biof.117. PMC 3826167 . PMID 20803520.
- ^ abc Brown CC, Noelle RJ (mayo de 2015). "Ver a través de la oscuridad: nuevos conocimientos sobre las funciones de regulación inmunitaria de la vitamina A". Revista Europea de Inmunología . 45 (5): 1287–1295. doi :10.1002/eji.201344398. PMC 4426035 . PMID 25808452.
- ^ abc Guo Y, Brown C, Ortiz C, Noelle RJ (enero de 2015). "El destino, la función y la localización de los leucocitos están controlados por el ácido retinoico". Physiological Reviews . 95 (1): 125–148. doi :10.1152/physrev.00032.2013. PMC 4281589 . PMID 25540140.
- ^ abc Bono MR, Tejon G, Flores-Santibañez F, Fernandez D, Rosemblatt M, Sauma D (junio de 2016). "Ácido retinoico como modulador de la inmunidad de las células T". Nutrients . 8 (6): 349. doi : 10.3390/nu8060349 . PMC 4924190 . PMID 27304965.
- ^ Janeway C , Travers P, Walport M, Shlomchik M (2001). Inmunobiología (5.ª ed.). Nueva York y Londres: Garland Science. ISBN 0-8153-4101-6.
- ^ Omán RA, Kini AR (2020). "Desarrollo, cinética y funciones de leucocitos". En Keohane EM, Otto CN, Walenga JN (eds.). Hematología de Rodak: principios clínicos y aplicaciones (6ª ed.). San Luis, Misuri: Elsevier. págs. 117-135. ISBN 978-0-323-53045-3.
- ^ Cohn L, Hawrylowicz C, Ray A (2014). "Biología de los linfocitos". Middleton's Allergy: Principles and Practice (8.ª ed.). Filadelfia: Saunders. págs. 203-14. doi :10.1016/B978-0-323-08593-9.00013-9. ISBN 9780323085939.
- ^ Cañete A, Cano E, Muñoz-Chápuli R, Carmona R (febrero de 2017). "Papel de la vitamina A/ácido retinoico en la regulación de la hematopoyesis embrionaria y adulta". Nutrients . 9 (2): 159. doi : 10.3390/nu9020159 . PMC 5331590 . PMID 28230720.
- ^ ab Czarnewski P, Das S, Parigi SM, Villablanca EJ (enero de 2017). "Ácido retinoico y su papel en la modulación de la inmunidad innata intestinal". Nutrients . 9 (1): 68. doi : 10.3390/nu9010068 . PMC 5295112 . PMID 28098786.
- ^ abc Roche FC, Harris-Tryon TA (enero de 2021). "Iluminando el papel de la vitamina A en la inmunidad innata de la piel y el microbioma de la piel: una revisión narrativa". Nutrients . 13 (2): 302. doi : 10.3390/nu13020302 . PMC 7909803 . PMID 33494277.
- ^ "Composición de alimentos crudos, procesados y preparados" (PDF) . Base de datos nacional de nutrientes del USDA para referencia estándar, publicación 20 . USDA . Febrero de 2008. Archivado desde el original (PDF) el 2 de octubre de 2008.
- ^ "Resumen de los valores de referencia dietéticos para la población de la UE elaborados por el Panel de Productos Dietéticos, Nutrición y Alergias de la EFSA" (PDF) . Autoridad Europea de Seguridad Alimentaria (AESA). 2017.
- ^ ab "Niveles máximos de ingesta tolerables de vitaminas y minerales" (PDF) . Autoridad Europea de Seguridad Alimentaria. 2006.
- ^ Rodahl K, Moore T (julio de 1943). "El contenido de vitamina A y la toxicidad del hígado de oso y foca". The Biochemical Journal . 37 (2): 166–168. doi :10.1042/bj0370166. PMC 1257872 . PMID 16747610.
- ^ Schmitt C, Domangé B, Torrents R, de Haro L, Simon N (diciembre de 2020). "Hipervitaminosis A tras la ingestión de hígado de pescado: informe sobre 3 casos del Centro de Control de Envenenamientos de Marsella". Medicina ambiental y silvestre . 31 (4): 454–456. doi : 10.1016/j.wem.2020.06.003 . PMID 32861618. S2CID 221384282.
- ^ ab Imdad A, Ahmed Z, Bhutta ZA (septiembre de 2016). "Suplementación con vitamina A para la prevención de la morbilidad y la mortalidad en lactantes de uno a seis meses de edad". Base de datos Cochrane de revisiones sistemáticas . 9 (9): CD007480. doi :10.1002/14651858.CD007480.pub3. PMC 6457829. PMID 27681486 .
- ^ "Vitamina A 25 000 cápsulas blandas". NOW Foods . Consultado el 23 de diciembre de 2021 .
- ^ ab Instituto de Medicina (EE. UU.) Panel sobre compuestos relacionados con antioxidantes dietéticos (2000). "Beta-caroteno y otros carotenoides". Ingestas dietéticas de referencia para vitamina C, vitamina E, selenio y carotenoides . Washington, DC: The National Academies Press. págs. 325–382. doi :10.17226/9810. ISBN 978-0-309-06935-9PMID 25077263. Archivado desde el original el 2 de septiembre de 2017 . Consultado el 19 de diciembre de 2021 .
- ^ Alpha-Tocopherol BC (14 de abril de 1994). "El efecto de la vitamina E y el betacaroteno en la incidencia del cáncer de pulmón y otros tipos de cáncer en fumadores masculinos". New England Journal of Medicine . 330 (15): 1029–1035. doi :10.1056/NEJM199404143301501. ISSN 0028-4793. PMID 8127329.
- ^ Maharshak N, Shapiro J, Trau H (marzo de 2003). "Carotenodermia: una revisión de la literatura actual". Revista Internacional de Dermatología . 42 (3): 178–181. doi : 10.1046/j.1365-4362.2003.01657.x . PMID 12653910. S2CID 27934066.
- ^ Al Nasser Y, Jamal Z, Albugeaey M (2021). "Carotenemia". StatPearls . Treasure Island (Florida): StatPearls Publishing. doi :10.1007/s00253-001-0902-7. PMID 30521299. S2CID 22232461.
- ^ "Registro Federal del 27 de mayo de 2016, Etiquetado de alimentos: Revisión de las etiquetas de información nutricional y de suplementos" (PDF) .
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)" ( Base de datos de etiquetas de suplementos dietéticos) . Archivado desde el original el 7 de abril de 2020. Consultado el 18 de diciembre de 2021 .
- ^ abc "Orden de clasificación del contenido de vitamina A en los alimentos, equivalente de actividad de retinol (RAE) en ug por 100 g". FoodData Central, Departamento de Agricultura de EE. UU. 1 de octubre de 2021. Consultado el 20 de diciembre de 2021 .
- ^ "Base de datos nacional de nutrientes del USDA para referencia estándar, publicación 28" (PDF) . 28 de octubre de 2015. Consultado el 5 de febrero de 2022 .
- ^ "Vitamina A 25.000 UI (7.500 μg)". WonderLabs . Consultado el 26 de enero de 2022 .
- ^ "Vital Nutrients Vitamin A 7,500 RAE". Recetas puras . Consultado el 26 de enero de 2022 .
- ^ abcd «Número total de nutrientes en los vehículos alimentarios, según el estándar de fortificación de un país». Global Fortification Data Exchange . Consultado el 7 de enero de 2022 .
- ^ "Preguntas frecuentes: ¿Quién inventó el arroz dorado y cómo comenzó el proyecto?". Goldenrice.org .
- ^ LSU AgCenter Communications (2004). "El 'arroz dorado' podría ayudar a reducir la desnutrición". Archivado desde el original el 28 de septiembre de 2007.
- ^ Kettenburg AJ, Hanspach J, Abson DJ, Fischer J (2018). "De los desacuerdos al diálogo: desentrañando el debate sobre el arroz dorado". Sustainability Science . 13 (5): 1469–1482. Bibcode :2018SuSc...13.1469K. doi :10.1007/s11625-018-0577-y. PMC 6132390 . PMID 30220919.
- ^ Ye X, Al-Babili S, Klöti A, Zhang J, Lucca P, Beyer P, et al. (enero de 2000). "Ingeniería de la vía biosintética de la provitamina A (beta-caroteno) en el endospermo del arroz (sin carotenoides)". Science . 287 (5451): 303–305. Bibcode :2000Sci...287..303Y. doi :10.1126/science.287.5451.303. PMID 10634784. S2CID 40258379.
- ^ "El arroz dorado cumple con los estándares de seguridad alimentaria de tres agencias reguladoras líderes a nivel mundial". Instituto Internacional de Investigación del Arroz – IRRI . Consultado el 30 de mayo de 2018 .
- ^ Talavera C. "Filipinas aprueba el 'arroz dorado' transgénico". Philstar.com . Consultado el 21 de agosto de 2021 .
- ^ "Los filipinos pronto plantarán y comerán arroz dorado". Instituto de Investigación del Arroz de Filipinas . 23 de julio de 2021. Consultado el 21 de agosto de 2021 .
- ^ Servallos NJ (20 de abril de 2023). "SC emite un recurso contra el arroz dorado y la berenjena transgénicos". Philippine Star . Consultado el 22 de septiembre de 2023 .
- ^ "Tasa de cobertura de la suplementación con vitamina A (niños de 6 a 59 meses)". Our World in Data . Consultado el 6 de marzo de 2020 .
- ^ Suplementación con vitamina A: una década de progreso (PDF) . Nueva York: UNICEF. 2007. p. 3. ISBN 978-92-806-4150-9Archivado desde el original (PDF) el 31 de octubre de 2020 . Consultado el 23 de enero de 2011 .
- ^ ab Wirth JP, Petry N, Tanumihardjo SA, Rogers LM, McLean E, Greig A, et al. (febrero de 2017). "Programas de suplementación con vitamina A y evidencia a nivel de país de deficiencia de vitamina A". Nutrients . 9 (3): 190. doi : 10.3390/nu9030190 . PMC 5372853 . PMID 28245571.
- ^ "Prevalencia mundial de la deficiencia de vitamina A en poblaciones en riesgo 1995-2005" (PDF) . Base de datos mundial de la OMS sobre la deficiencia de vitamina A . Organización Mundial de la Salud . 2009.
- ^ Black RE, Allen LH, Bhutta ZA, Caulfield LE, de Onis M, Ezzati M, et al. (Grupo de estudio sobre desnutrición materna e infantil) (enero de 2008). «Desnutrición materna e infantil: exposición global y regional y consecuencias para la salud». Lancet . 371 (9608): 243–260. doi :10.1016/S0140-6736(07)61690-0. PMID 18207566. S2CID 3910132. Archivado desde el original el 16 de octubre de 2021.
- ^ Tanumihardjo SA (agosto de 2011). "Vitamina A: biomarcadores de nutrición para el desarrollo". The American Journal of Clinical Nutrition . 94 (2): 658S–665S. doi :10.3945/ajcn.110.005777. PMC 3142734 . PMID 21715511.
- ^ Saeed A, Dullaart RP, Schreuder TC, Blokzijl H, Faber KN (diciembre de 2017). "Alteración del metabolismo de la vitamina A en la enfermedad del hígado graso no alcohólico (NAFLD)". Nutrients . 10 (1): 29. doi : 10.3390/nu10010029 . PMC 5793257 . PMID 29286303.
- ^ ab Hensel P (2010). "Nutrición y enfermedades de la piel en medicina veterinaria". Clinics in Dermatology . 28 (6): 686–693. doi :10.1016/j.clindermatol.2010.03.031. PMID 21034992.
- ^ Clugston RD, Blaner WS (2014). "Metabolismo y acciones de la vitamina A (retinoide): lo que sabemos y lo que necesitamos saber sobre los anfibios". Zoo Biology . 33 (6): 527–535. doi :10.1002/zoo.21140. PMC 4685470 . PMID 24958673.
- ^ Shojadoost B, Yitbarek A, Alizadeh M, Kulkarni RR, Astill J, Boodhoo N, et al. (abril de 2021). "Revisión del centenario: efectos de las vitaminas A, D, E y C en el sistema inmunológico del pollo". Ciencia avícola . 100 (4): 100930. doi :10.1016/j.psj.2020.12.027. PMC 7900602 . PMID 33607314.
- ^ Semba RD (abril de 1999). "Vitamina A como terapia "antiinfecciosa", 1920-1940". The Journal of Nutrition . 129 (4): 783–791. doi : 10.1093/jn/129.4.783 . PMID 10203551.
- ^ "Normas para aceites de pescado CODEX STAN 329-2017" (PDF) . Comisión del CODEX Alimentarius, Organización Mundial de la Salud . 2017 . Consultado el 28 de enero de 2022 .
- ^ André A, Ruivo R, Gesto M, Castro LF, Santos MM (noviembre de 2014). "Metabolismo de retinoides en invertebrados: cuando la evolución se encuentra con la disrupción endocrina". Endocrinología general y comparada . 208 : 134–145. doi :10.1016/j.ygcen.2014.08.005. PMID 25132059. S2CID 44685529.
- ^ Gutierrez-Mazariegos J, Schubert M, Laudet V (2014). "Evolución de los receptores de ácido retinoico y señalización del ácido retinoico". La bioquímica de los receptores de ácido retinoico I: estructura, activación y función a nivel molecular . Bioquímica subcelular. Vol. 70. págs. 55–73. doi :10.1007/978-94-017-9050-5_4. ISBN . 978-94-017-9049-9. Número de identificación personal 24962881.
- ^ Albalat R (diciembre de 2009). "La maquinaria del ácido retinoico en invertebrados: elementos ancestrales e innovaciones en vertebrados". Endocrinología molecular y celular . 313 (1–2): 23–35. doi :10.1016/j.mce.2009.08.029. PMID 19737598. S2CID 41188476.
- ^ "Los 300 mejores de 2021". ClinCalc . Archivado desde el original el 15 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ "Vitamina A: estadísticas sobre el uso de medicamentos". ClinCalc . Consultado el 14 de enero de 2024 .
- ^ "Deficiencias de micronutrientes: vitamina A". Organización Mundial de la Salud. Archivado desde el original el 27 de enero de 2011. Consultado el 9 de abril de 2008 .
- ^ ab Nickle SB, Peterson N, Peterson M (abril de 2014). "Guía actualizada para médicos sobre los usos no indicados de la isotretinoína oral". The Journal of Clinical and Aesthetic Dermatology . 7 (4): 22–34. PMC 3990537 . PMID 24765227.
- ^ "Tretinoína". Sociedad Estadounidense de Farmacéuticos del Sistema de Salud. 22 de marzo de 2021. Consultado el 23 de diciembre de 2021 .
- ^ Merritt B, Burkhart CN, Morrell DS (junio de 2009). "Uso de isotretinoína para el acné vulgar". Anales pediátricos . 38 (6): 311–320. doi :10.3928/00904481-20090512-01. PMID 19588674.
- ^ Layton A (mayo de 2009). "El uso de isotretinoína en el acné". Dermato-Endocrinology . 1 (3): 162–169. doi :10.4161/derm.1.3.9364. PMC 2835909 . PMID 20436884.
- ^ Leyden J, Stein-Gold L, Weiss J (septiembre de 2017). "Por qué los retinoides tópicos son la base del tratamiento del acné". Dermatología y terapia . 7 (3): 293–304. doi :10.1007/s13555-017-0185-2. PMC 5574737 . PMID 28585191.
- ^ ab Kang S, Voorhees JJ. "Retinoides tópicos". En: Fitzpatrick's Dermatology in General Medicine , 7.ª ed., Wolff K, Goldsmith LA, Katz SI, et al. (Eds.), McGraw Hill, Nueva York 2008. pág. 2106.
- ^ Fernandez EM, Zaenglein A, Thiboutot D. "Metodologías para el tratamiento del acné". En: Formulación cosmética de productos para el cuidado de la piel , Taylor and Francis Group, Nueva York 2006. pág. 273.
- ^ Khalil S, Bardawil T, Stephan C, Darwiche N, Abbas O, Kibbi AG, et al. (diciembre de 2017). "Retinoides: un viaje desde las estructuras moleculares y los mecanismos de acción hasta los usos clínicos en dermatología y los efectos adversos". The Journal of Dermatological Treatment . 28 (8): 684–696. doi :10.1080/09546634.2017.1309349. PMID 28318351.
- ^ Kovitwanichkanont T, Driscoll T (septiembre de 2018). "Una revisión comparativa de los programas de gestión del riesgo de embarazo con isotretinoína en cuatro continentes". Revista Internacional de Dermatología . 57 (9): 1035–1046. doi :10.1111/ijd.13950. PMID 29508918. S2CID 3726217.
- ^ Scott LJ (noviembre de 2019). "Trifaroteno: primera aprobación". Drugs . 79 (17): 1905–1909. doi :10.1007/s40265-019-01218-6. PMID 31713811. S2CID 207964653.
- ^ Mukherjee S, Date A, Patravale V, Korting HC, Roeder A, Weindl G (2006). "Retinoides en el tratamiento del envejecimiento de la piel: una descripción general de la eficacia clínica y la seguridad". Intervenciones clínicas en el envejecimiento . 1 (4): 327–348. doi : 10.2147/ciia.2006.1.4.327 . PMC 2699641 . PMID 18046911.
- ^ Boehnlein J, Sakr A, Lichtin JL, Bronaugh RL (agosto de 1994). "Caracterización de la actividad de la esterasa y la alcohol deshidrogenasa en la piel. Metabolismo del palmitato de retinilo a retinol (vitamina A) durante la absorción percutánea". Pharmaceutical Research . 11 (8): 1155–1159. doi :10.1023/A:1018941016563. PMID 7971717. S2CID 25458156.
- ^ Villani A, Annunziata MC, Cinelli E, Donnarumma M, Milani M, Fabbrocini G (octubre de 2020). "Eficacia y seguridad de una nueva formulación de gel tópico que contiene retinol encapsulado en glicósferas y retinoato de hidroxipinacolona, un péptido antimicrobiano, ácido salicílico, ácido glicólico y niacinamida para el tratamiento del acné leve: resultados preliminares de un estudio prospectivo de 2 meses". Giornale Italiano di Dermatologia e Venereologia . 155 (5): 676–679. doi :10.23736/S0392-0488.20.06581-5. PMID 32869963. S2CID 221402891.
- ^ Sun L, Atkinson CA, Lee YG, Jin YS (noviembre de 2020). "Producción de β-caroteno de alto nivel a partir de xilosa por Saccharomyces cerevisiae modificada genéticamente sin sobreexpresión de una HMG1 truncada (tHMG1)". Biotecnología y bioingeniería . 117 (11): 3522–3532. doi :10.1002/bit.27508. OSTI 1651205. PMID 33616900. S2CID 222411819.
- ^ Wittig G.; Pommer H.: DBP 954247 , 1956
- ^ Wittig G.; Pommer H. (1959). Química. Abstr . 53: 2279
- ^ US 2609396, Inhoffen Hans Herloff & Pommer Horst, "Compuestos con el esqueleto de carbono de betacaroteno y proceso para su fabricación", publicado el 2 de septiembre de 1952
- ^ abc Parker GL, Smith LK, Baxendale IR (febrero de 2016). "Desarrollo de la síntesis industrial de vitamina A". Tetrahedron . 72 (13): 1645–1652. doi :10.1016/j.tet.2016.02.029.
- ^ "Fabricantes de vitaminas multados con una cantidad récord de 755,1 millones de dólares en un caso de fijación de precios". The New York Times . 21 de noviembre de 2001 . Consultado el 24 de marzo de 2022 .
- ^ Sun L, Kwak S, Jin YS (septiembre de 2019). "Producción de vitamina A mediante Saccharomyces cerevisiae modificado a partir de xilosa mediante extracción in situ en dos fases ". ACS Synthetic Biology . 8 (9): 2131–2140. doi :10.1021/acssynbio.9b00217. OSTI 1547320. PMID 31374167. S2CID 199389319.
- ^ Olson CR, Mello CV (abril de 2010). "Importancia de la vitamina A para la función cerebral, el comportamiento y el aprendizaje". Molecular Nutrition & Food Research . 54 (4): 489–495. doi :10.1002/mnfr.200900246. PMC 3169332 . PMID 20077419.
- ^ Druesne-Pecollo N, Latino-Martel P, Norat T, Barrandon E, Bertrais S, Galan P, et al. (julio de 2010). "Suplementación con betacaroteno y riesgo de cáncer: una revisión sistemática y metaanálisis de ensayos controlados aleatorizados". Revista internacional del cáncer . 127 (1): 172–84. doi : 10.1002/ijc.25008 . PMID 19876916. S2CID 24850769.
- ^ He J, Gu Y, Zhang S (diciembre de 2018). "Vitamina A y supervivencia del cáncer de mama: una revisión sistemática y un metanálisis". Clinical Breast Cancer . 18 (6): e1389–e400. doi :10.1016/j.clbc.2018.07.025. PMID 30190194. S2CID 52169953.
- ^ Leelakanok N, D'Cunha RR, Sutamtewagul G, Schweizer ML (junio de 2018). "Una revisión sistemática y un metanálisis de la asociación entre la ingesta de vitamina A, la vitamina A sérica y el riesgo de cáncer de hígado". Nutrición y salud . 24 (2): 121–31. doi :10.1177/0260106018777170. PMID 29792083. S2CID 43944154.
- ^ Tang JE, Wang RJ, Zhong H, Yu B, Chen Y (abril de 2014). "Vitamina A y riesgo de cáncer de vejiga: un metaanálisis de estudios epidemiológicos". Revista Mundial de Oncología Quirúrgica . 12 : 130. doi : 10.1186/1477-7819-12-130 . PMC 4030017 . PMID 24773914.
- ^ Liu Y, Yu Q, Zhu Z, Zhang J, Chen M, Tang P, et al. (enero de 2015). "Ingesta de vitaminas y suplementos multivitamínicos e incidencia de cáncer colorrectal: un metaanálisis de estudios de cohorte". Oncología médica . 32 (1): 434. doi :10.1007/s12032-014-0434-5. PMID 25491145. S2CID 25904916.
- ^ ab Xu X, Yu E, Liu L, Zhang W, Wei X, Gao X, et al. (noviembre de 2013). "Ingesta dietética de vitaminas A, C y E y riesgo de adenoma colorrectal: un metaanálisis de estudios observacionales". Revista Europea de Prevención del Cáncer . 22 (6): 529–39. doi :10.1097/CEJ.0b013e328364f1eb. PMID 24064545. S2CID 36958552.
- ^ Li K, Zhang B (agosto de 2020). "La asociación de la ingesta dietética de β-caroteno y vitamina A con el riesgo de cáncer de esófago: un metanálisis". Revista Española de Enfermedades Digestivas . 112 (8): 620–26. doi : 10.17235/reed.2020.6699/2019 . PMID 32543872. S2CID 219724574.
- ^ Wu Y, Ye Y, Shi Y, Li P, Xu J, Chen K, et al. (agosto de 2015). "Asociación entre la vitamina A, la ingesta de retinol y el nivel de retinol en sangre y el riesgo de cáncer gástrico: un metaanálisis". Nutrición clínica . 34 (4): 620–26. doi :10.1016/j.clnu.2014.06.007. PMID 25008141.
- ^ Wang Q, He C (abril de 2020). "Ingesta dietética de vitamina A y riesgo de cáncer de ovario: un metanálisis". Bioscience Reports . 40 (4). doi :10.1042/BSR20193979. PMC 7138903 . PMID 32149329.
- ^ Zhang T, Chen H, Qin S, Wang M, Wang X, Zhang X, et al. (diciembre de 2016). "La asociación entre la ingesta de vitamina A en la dieta y el riesgo de cáncer de páncreas: un metaanálisis de 11 estudios". Bioscience Reports . 36 (6). doi :10.1042/BSR20160341. PMC 5293573 . PMID 27756825.
- ^ ab Yu N, Su X, Wang Z, Dai B, Kang J (noviembre de 2015). "Asociación de la ingesta dietética de vitamina A y β-caroteno con el riesgo de cáncer de pulmón: un metaanálisis de 19 publicaciones". Nutrients . 7 (11): 9309–24. doi : 10.3390/nu7115463 . PMC 4663591 . PMID 26569298.
- ^ Zhang YP, Chu RX, Liu H (2014). "Ingesta de vitamina A y riesgo de melanoma: un metaanálisis". PLOS ONE . 9 (7): e102527. Bibcode :2014PLoSO...9j2527Z. doi : 10.1371/journal.pone.0102527 . PMC 4105469 . PMID 25048246.
- ^ Zhang X, Dai B, Zhang B, Wang Z (febrero de 2012). "Vitamina A y riesgo de cáncer de cuello uterino: un metaanálisis". Oncología ginecológica . 124 (2): 366–73. doi :10.1016/j.ygyno.2011.10.012. PMID 22005522.
- ^ Kong P, Cai Q, Geng Q, Wang J, Lan Y, Zhan Y, et al. (2014). "La ingesta de vitaminas reduce el riesgo de cáncer gástrico: metaanálisis y revisión sistemática de estudios aleatorizados y observacionales". PLOS ONE . 9 (12): e116060. Bibcode :2014PLoSO...9k6060K. doi : 10.1371/journal.pone.0116060 . PMC 4280145 . PMID 25549091.
- ^ ab Fainsod A, Bendelac-Kapon L, Shabtai Y (2020). "Trastorno del espectro alcohólico fetal: embriogénesis en condiciones de señalización reducida del ácido retinoico". La bioquímica de la señalización retinoide III . Bioquímica subcelular. Vol. 95. págs. 197–225. doi :10.1007/978-3-030-42282-0_8. ISBN 978-3-030-42280-6. Número de identificación personal 32297301. Número de identificación personal 215793789.
- ^ ab Petrelli B, Bendelac L, Hicks GG, Fainsod A (enero de 2019). "Información sobre la deficiencia de ácido retinoico y la inducción de malformaciones craneofaciales y microcefalia en el trastorno del espectro alcohólico fetal". Genesis . 57 (1): e23278. doi :10.1002/dvg.23278. PMID 30614633. S2CID 58603210.
- ^ "Exposición fetal al alcohol". Abril de 2015. Archivado desde el original el 10 de junio de 2015. Consultado el 16 de diciembre de 2021 .
- ^ Farrés J, Moreno A, Crosas B, Peralba JM, Allali-Hassani A, Hjelmqvist L, et al. (Septiembre de 1994). "Alcohol deshidrogenasa de clase IV (sigma sigma-ADH) del estómago humano. Secuencia de ADNc y relaciones estructura/función". Revista europea de bioquímica . 224 (2): 549–57. doi : 10.1111/j.1432-1033.1994.00549.x . PMID 7925371.
- ^ Edenberg HJ, McClintick JN (diciembre de 2018). "Alcohol deshidrogenasas, aldehído deshidrogenasas y trastornos por consumo de alcohol: una revisión crítica". Alcoholismo: investigación clínica y experimental . 42 (12): 2281–97. doi :10.1111/acer.13904. PMC 6286250 . PMID 30320893.
- ^ Shabtai Y, Bendelac L, Jubran H, Hirschberg J, Fainsod A (enero de 2018). "El acetaldehído inhibe la biosíntesis del ácido retinoico para mediar la teratogenicidad del alcohol". Scientific Reports . 8 (1): 347. Bibcode :2018NatSR...8..347S. doi :10.1038/s41598-017-18719-7. PMC 5762763 . PMID 29321611.
- ^ abc Sanjoaquin MA, Molyneux ME (junio de 2009). "Malaria y deficiencia de vitamina A en niños africanos: ¿un círculo vicioso?". Malaria Journal . 8 : 134. doi : 10.1186/1475-2875-8-134 . PMC 2702350 . PMID 19534807.
- ^ ab Semba RD (2012). "Sobre el 'descubrimiento' de la vitamina A". Anales de nutrición y metabolismo . 61 (3): 192–198. doi :10.1159/000343124. PMID 23183288. S2CID 27542506.
- ^ Rosenfeld L (abril de 1997). «Vitamina – vitamina. Los primeros años del descubrimiento». Química clínica . 43 (4): 680–685. doi : 10.1093/clinchem/43.4.680 . PMID 9105273.
- ^ Arens JF, Van Dorp DA (febrero de 1946). "Síntesis de algunos compuestos que poseen actividad de vitamina A". Nature . 157 (3981): 190–191. Bibcode :1946Natur.157..190A. doi :10.1038/157190a0. PMID 21015124. S2CID 27157783.
- ^ Van Dorp DA, Arens JF (agosto de 1947). "Síntesis de aldehído de vitamina A". Nature . 159 (4058): 189. Bibcode :1947Natur.160..189V. doi : 10.1038/160189a0 . PMID 20256189. S2CID 4137483.
- ^ Villazón L. "¿Las zanahorias realmente ayudan a ver en la oscuridad?". sciencefocus.com.
- ^ "El Premio Nobel de Fisiología o Medicina 1967". Fundación Nobel. Archivado desde el original el 4 de diciembre de 2013. Consultado el 28 de julio de 2007 .
- ^ Ebrey T, Koutalos Y (enero de 2001). "Fotorreceptores vertebrados". Progreso en la investigación de la retina y los ojos . 20 (1): 49–94. doi :10.1016/S1350-9462(00)00014-8. PMID 11070368. S2CID 2789591.
- ^ Fridericia LS, Holm E (junio de 1925). "Contribución experimental al estudio de la relación entre la ceguera nocturna y la desnutrición". American Journal of Physiology . 73 : 63–78. doi :10.1152/ajplegacy.1925.73.1.63.
Enlaces externos
- Vitamina A en los encabezados de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Publicaciones de la OMS sobre la deficiencia de vitamina A
