Fosfato
 | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Fosfato [1] | |||
| Otros nombres Ortofosfato Tetraoxofosfato(V) Tetraoxidofosfato(V) | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3903772 | |||
| EBICh | |||
| Araña química | |||
| 1997 | |||
| Malla | Fosfatos | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
| |||
| Propiedades | |||
| correos3− 4 | |||
| Masa molar | 94,9714 g mol −1 | ||
| Ácido conjugado | Fosfato monohidrógeno | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
En química , un fosfato es un anión , sal , grupo funcional o éster derivado de un ácido fosfórico . Su nombre más común es ortofosfato , un derivado del ácido ortofosfórico, también conocido como ácido fosfórico H3PO4 .
El ion fosfato u ortofosfato [PO
4]3−
Se deriva del ácido fosfórico mediante la eliminación de tres protones H+
La eliminación de un protón produce el ion fosfato de dihidrógeno [H
2correos
4]−
mientras que la eliminación de dos protones produce el ion fosfato de hidrógeno [HPO
4]2−
Estos nombres también se utilizan para las sales de esos aniones, como el dihidrogenofosfato de amonio y el fosfato trisódico .
- [CORREOS
4]3−
Fosfato u ortofosfato
En química orgánica , el fosfato u ortofosfato es un organofosfato , un éster del ácido ortofosfórico de la forma PO
4RR′R″ donde uno o más átomos de hidrógeno son reemplazados por grupos orgánicos . Un ejemplo es el fosfato de trimetilo , (CH
3)
3correos
4El término también se refiere al grupo funcional trivalente OP(O-)
3En dichos ésteres, los fosfatos pueden contener azufre en lugar de uno o más átomos de oxígeno ( tiofosfatos y organotiofosfatos ).
Los ortofosfatos son especialmente importantes entre los diversos fosfatos debido a sus funciones clave en la bioquímica , la biogeoquímica y la ecología , y su importancia económica para la agricultura y la industria. [2] La adición y eliminación de grupos fosfato ( fosforilación y desfosforilación ) son pasos clave en el metabolismo celular .
Los ortofosfatos pueden condensarse para formar pirofosfatos .
Propiedades químicas
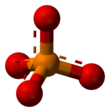
El ion fosfato tiene una masa molar de 94,97 g/mol y está formado por un átomo central de fósforo rodeado de cuatro átomos de oxígeno en una disposición tetraédrica . Es la base conjugada del ion fosfato de hidrógeno H(PO
4)2−
, que a su vez es la base conjugada del ion dihidrogenofosfato H
2(CORREOS
4)−
, que a su vez es la base conjugada del ácido ortofosfórico , H
3correos
4.
Muchos fosfatos son solubles en agua a temperatura y presión estándar . Los fosfatos de sodio, potasio, rubidio , cesio y amonio son solubles en agua. La mayoría de los demás fosfatos son sólo ligeramente solubles o insolubles en agua. Por regla general, los fosfatos de hidrógeno y dihidrógeno son ligeramente más solubles que los fosfatos correspondientes.
Equilibrios en solución

En solución acuosa, el ácido ortofosfórico y sus tres aniones derivados coexisten según los equilibrios de disociación y recombinación que se indican a continuación [3].
| Equilibrio | Constante de disociación K a [4] | pK a |
|---|---|---|
| H3PO4 ⇌ H2PO4−4+H + | pKa1 = 2,14 | |
| H2PO4−4 ⇌ HPO2−4+H + | pKa2 = 7,20 | |
| OHP2−4 ⇌ PO3−4+H + | pKa3 = 12,37 |
Los valores corresponden a 25 °C y fuerza iónica 0.
Los valores de p K a son los valores de pH donde la concentración de cada especie es igual a la de sus bases conjugadas . A pH 1 o inferior, el ácido fosfórico está prácticamente sin disociar. Alrededor de pH 4,7 (a medio camino entre los dos primeros valores de p K a ) el ion dihidrogenofosfato, [H
2correos
4]−
, es prácticamente la única especie presente. Alrededor de pH 9,8 (a medio camino entre el segundo y tercer valor de p K a ) el ion monohidrógeno fosfato, [HPO
4]2−
, es la única especie presente. A un pH de 13 o superior, el ácido se disocia completamente como ion fosfato (PO
4)3−
.
Esto significa que las sales de los iones mono y difosfato se pueden cristalizar selectivamente a partir de una solución acuosa ajustando el valor de pH a 4,7 o 9,8.
En efecto, H
3correos
4, yo
2(CORREOS
4)−
y H(PO
4)2−
se comportan como ácidos débiles separados porque los p K a sucesivos difieren en más de 4.
El fosfato puede formar muchos iones poliméricos como el pirofosfato ( P
2Oh
7)4−
, y trifosfato , (P
3Oh
10)5−
Los diversos iones metafosfato (que suelen ser polímeros lineales largos) tienen una fórmula empírica de (PO
3)−
y se encuentran en muchos compuestos.
Bioquímica de los fosfatos
En los sistemas biológicos , el fósforo se puede encontrar como aniones fosfato libres en solución ( fosfato inorgánico ) o unido a moléculas orgánicas como varios organofosforados .
El fosfato inorgánico generalmente se denota P i y a un pH fisiológico ( homeostático ) consiste principalmente en una mezcla de [HPO
4]2−
y [H
2correos
4]−
iones. A un pH neutro, como en el citosol (pH = 7,0), las concentraciones del ácido ortofosfórico y sus tres aniones tienen las proporciones
Por lo tanto, sólo [H
2correos
4]−
y [HPO
4]2−
Los iones están presentes en cantidades significativas en el citosol (62% [H
2correos
4]−
, 38% [HPO
4]2−
). En el líquido extracelular (pH = 7,4), esta proporción se invierte (61% [HPO
4]2−
, 39% [H
2correos
4]−
).
El fosfato inorgánico también puede estar presente como aniones pirofosfato [P
2Oh
7]4−
, que dan ortofosfato por hidrólisis :
- [PAG
2Oh
7]4−
+ H2O ⇌ 2 [HPO
4]2−
Los fosfatos orgánicos se encuentran comúnmente en forma de ésteres como nucleótidos (p. ej., AMP , ADP y ATP ) y en ADN y ARN . Los aniones ortofosfato libres pueden liberarse por la hidrólisis de los enlaces fosfoanhídrido en ATP o ADP. Estas reacciones de fosforilación y desfosforilación son el almacenamiento inmediato y la fuente de energía para muchos procesos metabólicos . El ATP y el ADP a menudo se denominan fosfatos de alta energía , al igual que los fosfágenos en el tejido muscular. Existen reacciones similares para los otros nucleósidos difosfatos y trifosfatos .
Huesos y dientes
Los fosfatos se encuentran en gran parte en los sistemas biológicos como material estructural de los huesos y los dientes. Estas estructuras están formadas por fosfato de calcio cristalino en forma de hidroxiapatita . El esmalte duro y denso de los dientes de los mamíferos puede contener fluoroapatita , un hidroxifosfato de calcio en el que algunos de los grupos hidroxilo han sido reemplazados por iones de flúor .
Usos en investigación médica y biológica
Los fosfatos son sales medicinales de fósforo. Algunos fosfatos, que ayudan a curar muchas infecciones del tracto urinario , se utilizan para hacer que la orina sea más ácida. Para evitar el desarrollo de cálculos de calcio en el tracto urinario, se utilizan algunos fosfatos. [5] Para los pacientes que no pueden obtener suficiente fósforo en su dieta diaria, los fosfatos se utilizan como suplementos dietéticos, generalmente debido a ciertos trastornos o enfermedades. [5] Los fosfatos inyectables solo pueden ser manipulados por proveedores de atención médica calificados. [5]
Metabolismo vegetal
Las plantas absorben fósforo a través de varias vías: la vía micorrízica arbuscular y la vía de absorción directa.
Efectos adversos para la salud
This article needs additional citations for verification. (July 2022) |
La hiperfosfatemia , o un nivel elevado de fosfatos en sangre, se asocia con una elevada mortalidad en la población general. La causa más común de hiperfosfatemia en personas, perros y gatos es la insuficiencia renal. En casos de hiperfosfatemia, se recomienda limitar el consumo de alimentos ricos en fosfato, como algunas carnes y productos lácteos, y alimentos con una alta relación fosfato-proteína, como refrescos, comida rápida, alimentos procesados, condimentos y otros productos que contengan aditivos de sales de fosfato. [6]
Los fosfatos inducen calcificación vascular y se encontró que una alta concentración de fosfatos en la sangre era un predictor de eventos cardiovasculares . [7]
Producción
Aparición geológica


Los fosfatos son la forma natural del elemento fósforo , que se encuentra en muchos minerales de fosfato . En mineralogía y geología, el término fosfato se refiere a una roca o mineral que contiene iones de fosfato. Los fosfatos inorgánicos se extraen para obtener fósforo para su uso en la agricultura y la industria. [2]
El mayor productor y exportador mundial de fosfatos es Marruecos . En América del Norte, los mayores depósitos se encuentran en la región de Bone Valley , en el centro de Florida , la región de Soda Springs , en el sureste de Idaho , y la costa de Carolina del Norte . Hay depósitos más pequeños en Montana , Tennessee , Georgia y Carolina del Sur . La pequeña nación insular de Nauru y su vecina isla de Banaba , que solían tener enormes depósitos de fosfato de la mejor calidad, han sido explotados en exceso. El fosfato de roca también se puede encontrar en Egipto, Israel, Palestina, el Sahara Occidental, la isla de Navassa , Túnez, Togo y Jordania, países que tienen grandes industrias de extracción de fosfato.
Las minas de fosforita se encuentran principalmente en:
- América del Norte : Estados Unidos, especialmente Florida, con depósitos menores en Carolina del Norte , Idaho y Tennessee.
- África : Marruecos , Argelia , Egipto , Níger , Senegal , Togo , Túnez , Mauritania
- Oriente Medio : Arabia Saudita , Jordania , Israel , Siria , Irán e Irak , en la ciudad de Akashat , cerca de la frontera con Jordania.
- Asia central : Kazajstán
- Oceanía : Australia , Makatea , Nauru y la isla Banaba
En 2007, al ritmo actual de consumo, se estimó que el suministro de fósforo se agotaría en 345 años. [8] Sin embargo, algunos científicos pensaban que el " pico de fósforo " se produciría en 30 años y Dana Cordell , del Institute for Sustainable Futures, dijo que "al ritmo actual, las reservas se agotarán en los próximos 50 a 100 años". [9] Las reservas se refieren a la cantidad que se supone recuperable a los precios actuales del mercado. En 2012, el USGS estimó las reservas mundiales en 71 mil millones de toneladas, mientras que en 2011 se extrajeron 0,19 mil millones de toneladas a nivel mundial. [10] El fósforo comprende el 0,1% en masa de la roca promedio [11] (mientras que, para tener una perspectiva, su concentración típica en la vegetación es del 0,03% al 0,2%), [12] y, en consecuencia, hay cuatrillones de toneladas de fósforo en la corteza terrestre de 3×10 19 toneladas, [13] aunque en una concentración predominantemente menor que los depósitos contabilizados como reservas, que están inventariados y son más baratos de extraer. Si se supone que los minerales de fosfato en la roca fosfórica son principalmente hidroxiapatita y fluoroapatita, los minerales de fosfato contienen aproximadamente un 18,5% de fósforo en peso. Si la roca fosfórica contiene alrededor del 20% de estos minerales, la roca fosfórica promedio tiene aproximadamente un 3,7% de fósforo en peso.
Algunos depósitos de roca fosfórica, como Mulberry en Florida, [14] se destacan por la inclusión de cantidades significativas de isótopos de uranio radiactivo. Esto es preocupante porque la radiactividad puede liberarse en las aguas superficiales [15] a partir de la aplicación del fertilizante fosfatado resultante .
En diciembre de 2012, Cominco Resources anunció un recurso actualizado conforme a JORC de su proyecto Hinda en Congo-Brazzaville de 531 millones de toneladas, lo que lo convierte en el depósito de fosfato medido e indicado más grande del mundo. [16]
Alrededor de 2018, Noruega descubrió depósitos de fosfato casi iguales a los del resto de la Tierra en conjunto. [17] [18]
En julio de 2022, China anunció cuotas a la exportación de fosfato. [19]
Los mayores importadores en millones de toneladas métricas de fosfato son Brasil (3,2), India (2,9) y Estados Unidos (1,6). [20]
Minería

Los tres principales países productores de fosfato (China, Marruecos y Estados Unidos) representan alrededor del 70% de la producción mundial.
| País | Producción (millones de kg) | Participación en la producción mundial (%) | Reservas (millones de kg) |
|---|---|---|---|
| Argelia | 1.300 | 0,54 | 2.200.000 |
| Australia | 2.700 | 1.17 | 1.100.000 |
| Brasil | 4.700 | 3.00 | 1.600.000 |
| Porcelana | 95.000 | 44,83 | 3.200.000 |
| Egipto | 5.000 | 2.47 | 2.800.000 |
| Finlandia | 995 | - | 1.000.000 |
| India | 1.480 | 0,49 | 46.000 |
| Irak | 200 | 0,09 | 430.000 |
| Israel | 2.810 | 1.48 | 57.000 |
| Jordán | 9.220 | 3.36 | 800.000 |
| Kazajstán | 1.500 | 0,72 | 260.000 |
| México | 558 | 0,76 | 30.000 |
| Marruecos y el Sahara Occidental | 35.500 | 13.45 | 50.000.000 |
| Perú | 4.000 | 1,79 | 210.000 |
| Rusia | 13.100 | 5.60 | 600.000 |
| Arabia Saudita | 6.500 | 1.48 | 1.400.000 |
| Senegal | 3.420 | 0,45 | 50.000 |
| Sudáfrica | 2.100 | 0,99 | 1.400.000 |
| Siria | 2.000 | 0,34 | 1.800.000 |
| Ir | 800 | 0,45 | 30.000 |
| Túnez | 4.110 | 1,79 | 100.000 |
| Uzbekistán | 900 | - | 100.000 |
| Estados Unidos | 23.300 | 12.37 | 1.000.000 |
| Vietnam | 4.650 | 1.21 | 30.000 |
| Otros países | 1.140 | 1.17 | 840.000 |
| Total | 227.000 | 100 | 71.000.000 |
Ecología
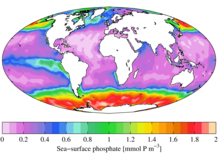

En términos ecológicos, debido a su importante papel en los sistemas biológicos, el fosfato es un recurso muy buscado. Una vez utilizado, suele ser un nutriente limitante en los entornos y su disponibilidad puede determinar la tasa de crecimiento de los organismos. Esto suele ser cierto en los entornos de agua dulce , mientras que el nitrógeno es más a menudo el nutriente limitante en los entornos marinos (agua de mar). La adición de altos niveles de fosfato a entornos y microambientes en los que normalmente es raro puede tener consecuencias ecológicas significativas. Por ejemplo, pueden producirse floraciones en las poblaciones de algunos organismos a expensas de otros y el colapso de poblaciones privadas de recursos como el oxígeno (véase eutrofización ). En el contexto de la contaminación, los fosfatos son un componente de los sólidos disueltos totales , un indicador importante de la calidad del agua, pero no todo el fósforo está en una forma molecular que las algas puedan descomponer y consumir. [22]
Se pueden encontrar precipitados de hidroxiapatita de calcio y calcita alrededor de las bacterias en la capa superficial del suelo aluvial . [23] Como los minerales arcillosos promueven la biomineralización, la presencia de bacterias y minerales arcillosos dio como resultado precipitados de hidroxiapatita de calcio y calcita. [23]
Los depósitos de fosfato pueden contener cantidades significativas de metales pesados naturales. Las operaciones mineras que procesan roca fosfórica pueden dejar pilas de relaves que contienen niveles elevados de cadmio , plomo , níquel , cobre , cromo y uranio . A menos que se gestionen con cuidado, estos productos de desecho pueden filtrar metales pesados en las aguas subterráneas o los estuarios cercanos. La absorción de estas sustancias por las plantas y la vida marina puede conducir a la concentración de metales pesados tóxicos en los productos alimenticios. [24]
Véase también
- Fosfato diamónico - (NH 4 ) 2 HPO 4
- Fosfato disódico – Na2HPO4
- Fertilizante
- Hipofosfito – H
2(CORREOS
2)− - Metafosfato – (PO
3)
norte - Fosfato monosódico – NaH 2 PO 4
- Compuestos organofosforados
- Cuenca de Ouled Abdoun
- Fosfato – OP(OR) 3 , como el fosfato de trifenilo
- Recubrimiento de conversión de fosfato
- Fosfato de sodio , una bebida de fuente de soda
- Fosfinato – OP(OR)R 2
- Fosfina – PR 3
- Óxido de fosfina – OPR 3
- Fosfinito – P(OR)R 2
- Fosfito – P(OR) 3
- Yeso fosforado
- Fosfonato – OP(OR) 2 R
- Fosfonito – P(OR) 2 R
- Fosforilación
- Polifosfato – (HPO
3)
norte - Pirofosfato – (P
2Oh
7)4− - Tripolifosfato de sodio – Na 5 P 3 O 10
Referencias
- ^ "Fosfatos – Base de datos de sustancias químicas públicas de PubChem". El proyecto PubChem . EE. UU.: Centro Nacional de Información Biotecnológica.
- ^ ab "Phosphate Primer". Instituto de Investigación Industrial y de Fosfatos de Florida . Universidad Politécnica de Florida. Archivado desde el original el 29 de agosto de 2017. Consultado el 30 de marzo de 2018 .
- ^ Campbell, Neil A .; Reece, Jane B. (2005). Biología (Séptima edición). San Francisco, California: Benjamin Cummings . pág. 65. ISBN 0-8053-7171-0.
- ^ Kipton J. Powell, Paul L. Brown, Robert H. Byrne, Tamás Gajda, Glenn Hefter, Staffan Sjöberg, Hans Wanner (2005): "Especiación química de metales pesados ambientalmente significativos con ligandos inorgánicos. Parte 1: El Hg2+
, Cl− , OH− , CO2−
3, ENTONCES2−
4, y PO3−
4sistemas acuosos". Química pura y aplicada , volumen 77, número 4, páginas 739–800. doi :10.1351/pac200577040739 - ^ abc "Suplemento de fosfato (vía oral, vía parenteral): descripción y nombres comerciales - Mayo Clinic" www.mayoclinic.org . Consultado el 20 de noviembre de 2020 .
- ^ Equipo de dietistas renales, Cómo reducir el fosfato en la dieta , Oxford University Hospitals NHS Foundation Trust, revisión de 2022
- ^ Ritz, Eberhard; Hahn, Kai; Ketteler, Markus; Kuhlmann, Martín K.; Mann, Johannes (enero de 2012). "Aditivos de fosfato en los alimentos: un riesgo para la salud". Deutsches Ärzteblatt Internacional . 109 (4): 49–55. doi :10.3238/arztebl.2012.0049. ISSN 1866-0452. PMC 3278747 . PMID 22334826.
- ^ Reilly, Michael (26 de mayo de 2007). "¿Cuánto durará?". New Scientist . 194 (2605): 38–9. Bibcode :2007NewSc.194...38R. doi :10.1016/S0262-4079(07)61508-5.
- ^ Leo Lewis (23 de junio de 2008). "Los científicos advierten de la falta de fósforo vital a medida que aumenta la demanda de biocombustibles". The Times . Archivado desde el original el 5 de septiembre de 2008.
- ^ Roca fosfórica del Servicio Geológico de Estados Unidos
- ^ "Muestras de suelo con fósforo" del Servicio Geológico de Estados Unidos (PDF) .
- ^ Floor Anthoni. "Abundancia de elementos". Seafriends.org.nz . Consultado el 10 de enero de 2013 .
- ^ American Geophysical Union , reunión de otoño de 2007, resumen n.° V33A-1161. Masa y composición de la corteza continental
- ^ Industria del fosfato en Florida central: Declaración de impacto ambiental. Vol. 2. Estados Unidos. Agencia de Protección Ambiental. 1979.
- ^ C. Michael Hogan (2010). "Contaminación del agua". En Mark McGinley y C. Cleveland (Washington, DC.: Consejo Nacional para la Ciencia y el Medio Ambiente ) (ed.). Enciclopedia de la Tierra . Archivado desde el original el 16 de septiembre de 2010.
- ^ "Anuncio actualizado de recursos de Hinda: ahora es el depósito de fosfato más grande del mundo (12/04/2012)". Cominco Resources . Archivado desde el original el 5 de octubre de 2016. Consultado el 3 de mayo de 2013 .
- ^ Bushuev, Mikhail (26 de enero de 2021). «La UE deposita sus esperanzas en las materias primas de Noruega» . Consultado el 2 de julio de 2023 .
- ^ "'Buenas noticias': la UE celebra el descubrimiento de un enorme yacimiento de roca fosfórica en Noruega". 29 de junio de 2023.
- ^ "China emite cuotas de fosfato para frenar las exportaciones de fertilizantes, según analistas". Reuters . 15 de julio de 2022.
- ^ "Principales países importadores de fertilizantes fosfatados".
- ^ "ROCA DE FOSFATO, usgs" (PDF) .
- ^ Hochanadel, Dave (10 de diciembre de 2010). "Un estudio descubre que una cantidad limitada de fósforo total en realidad alimenta a las algas". Lake Scientist . Consultado el 10 de junio de 2012 .
El fósforo biodisponible (fósforo que pueden utilizar las plantas y las bacterias) es solo una fracción del total, según Michael Brett, profesor de ingeniería de la UW...
- ^ ab Schmittner KE, Giresse P (1999). "Controles microambientales sobre la biomineralización: procesos superficiales de precipitación de apatita y calcita en suelos cuaternarios, Rosellón, Francia". Sedimentología . 46 (3): 463–76. Bibcode :1999Sedim..46..463S. doi :10.1046/j.1365-3091.1999.00224.x. S2CID 140680495.
- ^ Gnandi, K.; Tchangbedjil, G.; Killil, K.; Babal, G.; Abbel, E. (marzo de 2006). "El impacto de los relaves de minas de fosfato en la bioacumulación de metales pesados en peces marinos y crustáceos de la zona costera de Togo". Agua de mina y medio ambiente . 25 (1): 56–62. Bibcode :2006MWE....25...56G. doi :10.1007/s10230-006-0108-4. S2CID 129497587.
Enlaces externos
- El explorador de datos de minerales de EE. UU. proporciona gráficos de datos que cubren el consumo, la producción, las importaciones, las exportaciones y el precio del fosfato y otros 86 minerales.
- Fosfato: monografía sobre analitos – La Asociación de Bioquímica Clínica y Medicina de Laboratorio





![[H 2PO 4]− Fosfato de dihidrógeno](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/2-dihydrogenphosphate-3D-balls.png/209px-2-dihydrogenphosphate-3D-balls.png)
![[HPO 4]2− Fosfato de hidrógeno](http://upload.wikimedia.org/wikipedia/commons/thumb/8/87/1-hydrogenphosphate-3D-balls.png/169px-1-hydrogenphosphate-3D-balls.png)
![[PO 4]3− Fosfato u ortofosfato](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b0/0-phosphate-3D-balls.png/165px-0-phosphate-3D-balls.png)
![{\displaystyle K_{a1}={\frac {[{\ce {H+}}][{\ce {H2PO4-}}]}{[{\ce {H3PO4}}]}}\aproximadamente 7,5\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eed347325ee75e9e7cec75402ae9a0d68c5aca9a)
![{\displaystyle K_{a2}={\frac {[{\ce {H+}}][{\ce {HPO4^2-}}]}{[{\ce {H2PO4-}}]}}\aproximadamente 6,2\times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3795cf914ff31fa4feb59c417cc8ae8da71ef519)
![{\displaystyle K_{a3}={\frac {[{\ce {H+}}][{\ce {PO4^3-}}]}{[{\ce {HPO4^2-}}]}}\aproximadamente 2,14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90d1ae9985ce6207490cf9e7a6ab1f6d001a8a24)
![{\displaystyle {\begin{aligned}{\frac {[{\ce {H2PO4-}}]}{[{\ce {H3PO4}}]}}&\aproximadamente 7,5\times 10^{4}\\[4pt]{\frac {[{\ce {HPO4^2-}}]}{[{\ce {H2PO4-}}]}}&\aproximadamente 0,62\\[4pt]{\frac {[{\ce {PO4^3-}}]}{[{\ce {HPO4^2-}}]}}&\aproximadamente 2,14\times 10^{-6}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7bfb55f5ed7d0ba3805ba68970255099eca8291)

