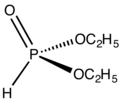
Éster de fosfito
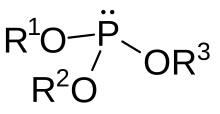
En química orgánica , un éster de fosfito u organofosfito generalmente se refiere a un compuesto organofosforado con la fórmula P(OR) 3 . Pueden considerarse como ésteres de un ácido fosforoso tautómero no observado , H 3 PO 3 , siendo el ejemplo más simple el trimetilfosfito , P(OCH 3 ) 3 . Algunos fosfitos pueden considerarse ésteres del tautómero dominante del ácido fosforoso (HP(O)(OH) 2 ). El representante más simple es el dimetilfosfito con la fórmula HP(O)(OCH 3 ) 2 . Ambas clases de fosfitos suelen ser líquidos incoloros.
Síntesis
- Del PCl3
Los ésteres de fosfito se preparan típicamente tratando el tricloruro de fósforo con un alcohol . En el caso de los alcoholes alquílicos , el ion cloruro desplazado puede atacar al fosfito, lo que provoca una desalquilación para dar un dialquilfosfito y un compuesto organoclorado . [1] [2] La reacción general es la siguiente:
- PCl3 + 3 C2H5OH → ( C2H5O ) 2P ( O ) H + 2HCl + C2H5Cl
Alternativamente, cuando la alcoholisis se lleva a cabo en presencia de aceptores de protones (normalmente una base de amina), se obtienen los derivados de trialquilo C 3 -simétricos: [3]
- PCl3 + 3 C2H5OH + 3 R3N → ( C2H5O ) 3P + 3 R3NHCl
Una base no es esencial cuando se utilizan alcoholes aromáticos como los fenoles, ya que no son susceptibles al ataque del cloruro, sin embargo cataliza la reacción de esterificación y, por lo tanto, a menudo se incluye. [4]
- Por transesterificación
Los ésteres de fosfito también se pueden preparar por transesterificación , ya que experimentan un intercambio de alcohol al calentarse con otros alcoholes. [5] Este proceso es reversible y se puede utilizar para producir fosfitos de alquilo mixtos. Alternativamente, si se utiliza el fosfito de un alcohol volátil, como el fosfito de trimetilo , entonces el subproducto ( metanol ) se puede eliminar por destilación, lo que permite que la reacción se complete.
Reacciones y aplicaciones de los tris(organo)fosfitos
Reacciones

Fosfito de tris(2,4-di-terc-butilfenilo) , un estabilizador ampliamente utilizado en polímeros
Los fosfitos se oxidan a ésteres de fosfato:
- P(O) 3 + [O] → OP(O) 3
Esta reacción sustenta el uso comercial de algunos ésteres de fosfito como estabilizadores en polímeros. [6]
Los ésteres de fosfito de alquilo se utilizan en la reacción de Perkow para la formación de fosfonatos de vinilo y en la reacción de Michaelis-Arbuzov para formar fosfonatos . Los ésteres de fosfito de arilo pueden no experimentar estas reacciones y, por lo tanto, se utilizan comúnmente como estabilizadores en polímeros que contienen halógenos, como el PVC .

Los ésteres de fosfito pueden utilizarse como agentes reductores en casos más especializados. Por ejemplo, se sabe que el trietilfosfito reduce ciertos hidroperóxidos a alcoholes formados por autooxidación [7] ( esquema ). En este proceso, el fosfito se convierte en un éster de fosfato . Este tipo de reacción también se utiliza en la síntesis total de Wender Taxol .
Catálisis homogénea
Los ésteres de fosfito son bases de Lewis y, por lo tanto, pueden formar complejos de coordinación con varios iones metálicos. Los ligandos de fosfito representativos incluyen trimetilfosfito ((MeO) 3 P), trietilfosfito ((EtO) 3 P), fosfito de trimetilolpropano y trifenilfosfito ((PhO) 3 P). Los fosfitos exhiben ángulos de cono de ligando más pequeños que la familia de ligandos de fosfina estructuralmente relacionada . Los ligandos de fosfito son componentes de catalizadores industriales para hidroformilación e hidrocianación . [8]

Química de HP(O)(OR)2
Los diorganofosfitos son derivados del fósforo (V) y pueden considerarse como diésteres del ácido fosforoso ((HO) 2 P(O)H). Presentan tautomería , sin embargo, el equilibrio favorece abrumadoramente la forma de la derecha (similar a los fosfonatos): [11] [12]
- (RO) 2POH ⇌ (RO) 2P (O)H
El enlace PH es el sitio de alta reactividad en estos compuestos (por ejemplo, en la reacción de Atherton-Todd y el acoplamiento de Hirao ), mientras que en los triorganofosfitos el par solitario en el fósforo es el sitio de alta reactividad. Sin embargo, los diorganofosfitos experimentan transesterificación.
Véase también
- Fosfinito P(OR)R 2
- Fosfonito P(OR) 2 R
- Éster orto CH(OR) 3
- Éster de borato B(OR) 3
Referencias
- ^ Malowan, John E. (1953). "Fosfito de dietilo". Síntesis inorgánica . Síntesis inorgánica. Vol. 4. págs. 58-60. doi :10.1002/9780470132357.ch19. ISBN 9780470132357.
- ^ Gerrard, W.; Whitbread, EGG (1952). "165. Interacción de haluros de hidrógeno y fosfitos de n-butilo". Journal of the Chemical Society (Resumen) : 914. doi :10.1039/JR9520000914.
- ^ AH Ford-Moore y BJ Perry (1963). "Triethyl Phosphite". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 955.
- ^ Mao, Mengmei; Zhang, Le; Yao, Hanlin; Wan, Li; Xin, Zhong (28 de abril de 2020). "Desarrollo y ampliación de la síntesis rápida de fosfitos de trifenilo en flujo continuo". ACS Omega . 5 (16): 9503–9509. doi :10.1021/acsomega.0c00716. PMC 7191834 . PMID 32363302.
- ^ Hoffmann, Friedrich W.; Ess, Richard J.; Usingef, Robert P. (noviembre de 1956). "La transesterificación de fosfitos de trialquilo con alcoholes alifáticos". Revista de la Sociedad Química Americana . 78 (22): 5817–5821. doi :10.1021/ja01603a026.
- ^ Rainer Wolf; Bansi Lal Kaul (2000). "Plásticos, aditivos". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a20_459. ISBN 3527306730.
- ^ JN Gardner; FE Carlon y O. Gnoj (1968). "Procedimiento de un solo paso para la preparación de α-cetoles terciarios a partir de las cetonas correspondientes". J. Org. Chem. 33 (8): 3294–3297. doi :10.1021/jo01272a055. PMID 5742870.
- ^ Aitor Gual; Cirilo Godard; Verónica de la Fuente; Sergio Castillón (2012). "Diseño y síntesis de ligandos de fosfito para catálisis homogénea". En Paul CJ Kamer; Piet WNM van Leeuwen (eds.). Ligandos de fósforo (III) en catálisis homogénea: diseño y síntesis . John Wiley e hijos. págs. 81-131. doi :10.1002/9781118299715.ch3. ISBN 9781118299715.
- ^ Cuny, Gregory D.; Buchwald, Stephen L. (1993). "Hidroformilación práctica, de alto rendimiento, regioselectiva y catalizada por rodio de α-olefinas funcionalizadas". Revista de la Sociedad Química Americana . 115 (5): 2066–2068. doi :10.1021/ja00058a079.
- ^ Van Rooy, Annemiek; Kamer, Paul CJ; Van Leeuwen, Piet WNM; Goubitz, Kees; Fraanje, Jan; Veldman, Nora; Spek, Anthony L. (1996). "Catalizadores de rodio voluminosos modificados con difosfito: hidroformilación y caracterización". Organometálicos . 15 (2): 835–847. doi :10.1021/OM950549K.
- ^ Guthrie, J. Peter (1979). "Equilibrios de tautomerización para el ácido fosforoso y sus ésteres etílicos, energías libres de formación de ácidos fosforosos y fosfónicos y sus ésteres etílicos, y valores de p Ka para la ionización del enlace P—H en ácido fosfónico y ésteres fosfónicos". Revista Canadiense de Química . 57 (2): 236–239. doi : 10.1139/v79-039 .
- ^ Janesko, Benjamin G.; Fisher, Henry C.; Bridle, Mark J.; Montchamp, Jean-Luc (29 de septiembre de 2015). "Tautomería de P(═O)H a P–OH: un estudio teórico y experimental". Revista de química orgánica . 80 (20). Sociedad Química Estadounidense (ACS): 10025–10032. doi :10.1021/acs.joc.5b01618. ISSN 0022-3263. PMID 26372089.