Metafosfato
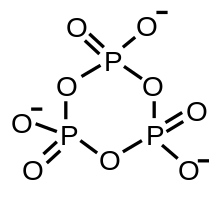
Un ion metafosfato es un oxianión que tiene la fórmula empírica PO−
3. [1] Se postuló por primera vez en 1955 [2] pero no se observó hasta 1979, cuando se detectó mediante espectrometría de masas. [3] El metafosfato es un intermediario en la hidrólisis de los ésteres de fosfato , pero es difícil de aislar, ya que se hidroliza fácilmente a partir de un ion de fosfato dihidrógeno ( [H
2correos
4]−
) y tiende a autorreaccionar en ausencia de agua para formar anillos o cadenas infinitas: [4] Estas especies también se denominan metafosfatos y generalmente son estables; algunas, como el trimetafosfato de sodio, se producen a escala industrial.
Los metafosfatos se pueden utilizar como alternativa al fósforo blanco en síntesis orgánicas. [5]
Véase también
Referencias
- ^ Averbuch-Pouchot, MT; Durif, A. (1996). Temas de química de fosfatos . World Scientific Pub Co Inc. ISBN 981-02-2634-9.
- ^ Butcher, WW; Westheimer, FH (mayo de 1955). "El gel de hidróxido de lantano promovió la hidrólisis de ésteres de fosfato". Revista de la Sociedad Química Estadounidense . 77 (9): 2420–2424. doi :10.1021/ja01614a018.
- ^ Harvan, Donald J.; Hass, J. Ronald; Busch, Kenneth L.; Bursey, Maurice M.; Ramirez, Fausto; Meyerson, Seymour (noviembre de 1979). "Observación directa del anión metafosfato monomérico". Journal of the American Chemical Society . 101 (24): 7409–7410. doi :10.1021/ja00518a050.
- ^ Regitz, Manfred; Maas, Gerhard (1981). "Compuestos de fósforo (V) de vida corta con número de coordinación 3". Química orgánica . 97 : 71–120. doi :10.1007/BFb0037041.
- ^ "Evitando el fósforo blanco". C&EN Global Enterprise . 96 (7): 7. 2018. doi :10.1021/cen-09607-scicon1. ISSN 2474-7408.