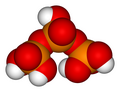
Ácidos fosfóricos y fosfatos

En química , un ácido fosfórico , en sentido general, es un oxoácido de fósforo en el que cada átomo de fósforo (P) está en estado de oxidación +5, y está unido a cuatro átomos de oxígeno (O), uno de ellos a través de un doble enlace , dispuestos como los vértices de un tetraedro . Dos o más de estos tetraedros PO4 pueden estar conectados por oxígenos compartidos con un solo enlace, formando cadenas lineales o ramificadas , ciclos o estructuras más complejas. Los átomos de oxígeno con un solo enlace que no se comparten se completan con átomos de hidrógeno ácidos . La fórmula general de un ácido fosfórico es H n +2−2 x P n O 3 n +1− x , donde n es el número de átomos de fósforo y x es el número de ciclos fundamentales en la estructura de la molécula, entre 0 y n +2/2 .

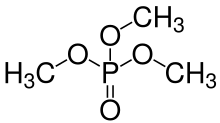
La eliminación de protones ( H + ) de los grupos hidroxilo k –OH deja aniones denominados genéricamente fosfatos (si k = n − 2 x + 2 ) o hidrogenofosfatos (si k está entre 1 y n − 2 x + 1 ), con fórmula general [H n −2 x +2− k P n O 3 n +1− x ] k − . El anión completamente disociado ( k = n − 2 x + 2 ) tiene fórmula [P n O 3 n − x +1 ] ( n −2 x +2)− . El término fosfato también se utiliza en química orgánica para los grupos funcionales que resultan cuando uno o más de los hidrógenos son reemplazados por enlaces a otros grupos.
Estos ácidos, junto con sus sales y ésteres , incluyen algunos de los compuestos más conocidos del fósforo, de gran importancia en bioquímica , mineralogía , agricultura , farmacia , industria química e investigación química .
Ácidos
Ácido fosfórico
El ácido fosfórico más simple y más común es el ácido ortofosfórico , H3PO4 . De hecho, el término ácido fosfórico a menudo se refiere específicamente a este compuesto (y esta es también la nomenclatura actual de la IUPAC ). [ cita requerida ]
Ácidos oligofosfóricos y polifosfóricos

Dos o más moléculas de ácido ortofosfórico pueden unirse por condensación para formar moléculas más grandes mediante la eliminación de agua . La condensación de unas pocas unidades produce los ácidos oligofosfóricos , mientras que las moléculas más grandes se denominan ácidos polifosfóricos . (Sin embargo, la distinción entre los dos términos no está bien definida).
Por ejemplo, los ácidos pirofosfórico , trifosfórico y tetrafosfórico se pueden obtener mediante las reacciones
La "columna vertebral" de una molécula de ácido polifosfórico es una cadena de átomos de P y O alternados. Cada unidad ortofosfórica adicional que se condensa agrega 1 átomo de H ( hidrógeno ) adicional, 1 átomo de P ( fósforo ) adicional y 3 átomos de O ( oxígeno ) adicionales. La fórmula general de un ácido polifosfórico es H n +2 P n O 3 n +1 o HO[−P(O)(OH)−O−] n H .
Los ácidos polifosfóricos se utilizan en síntesis orgánica para ciclizaciones y acilaciones ; una alternativa es el reactivo de Eaton . [1] [2] [3]
Ácido metafosfórico
El ácido metafosfórico ( HPO 3 ) es un sólido vítreo, delicuescente e incoloro, de densidad 2,2 a 2,5 g/cc, que sublima al calentarse. Es soluble en etanol. [4]
Ácidos fosfóricos cíclicos

Las unidades de ácido fosfórico pueden unirse entre sí en anillos (estructuras cíclicas). El compuesto más simple de este tipo es el ácido trimetafosfórico o ácido ciclotrifosfórico, que tiene la fórmula H 3 P 3 O 9 . Su estructura se muestra en la ilustración. Como los extremos están condensados, su fórmula tiene un H 2 O (agua) menos que el ácido tripolifosfórico.
La fórmula general de un ácido fosfórico es H n −2 x +2 P n O 3 n − x +1 , donde n es el número de átomos de fósforo y x es el número de ciclos fundamentales en la estructura de la molécula; es decir, el número mínimo de enlaces que habría que romper para eliminar todos los ciclos.
- Ácido tetrapolifosfórico H 6 P 4 O 13
- Ácido trimetafosfórico H 3 P 3 O 9
El caso límite de condensación interna, donde se comparten todos los átomos de oxígeno y no hay átomos de hidrógeno ( x = número +2/2 ) es un anhídrido P 2 n O 5 n , pentóxido de fósforo P 4 O 10 .
Fosfatos
La eliminación de los átomos de hidrógeno como protones H + convierte el ácido fosfórico en un anión fosfato. La eliminación parcial produce varios aniones de fosfato de hidrógeno.
Ortofosfato
Los aniones del ácido ortofosfórico H 3 PO 4 son ortofosfato (comúnmente llamado simplemente "fosfato") PO3−4, fosfato monohidrógeno HPO2−4, y fosfato de dihidrógeno H 2 PO−4.
Oligofosfatos y polifosfatos lineales
La disociación del ácido pirofosfórico H 4 P 2 O 7 genera cuatro aniones, [H 4− k P 2 O 7 ] k − , donde la carga k varía de 1 a 4. El último es el pirofosfato [P 2 O 7 ] 4− . Los pirofosfatos son en su mayoría solubles en agua.
De la misma manera, el ácido tripolifosfórico H 5 P 3 O 10 produce al menos cinco aniones [H 5− k P 3 O 10 ] k − , donde k varía de 1 a 5, incluido el tripolifosfato [P 3 O 10 ] 5− . El ácido tetrapolifosfórico H 6 P 4 O 13 produce al menos seis aniones, incluido el tetrapolifosfato [P 4 O 13 ] 6− , y así sucesivamente. Nótese que cada unidad fosfórica adicional agrega un átomo de P adicional, tres átomos de O adicionales y un átomo de hidrógeno adicional o una carga negativa adicional.
Los ácidos polifosfóricos ramificados dan lugar a aniones polifosfatos ramificados de forma similar. El ejemplo más simple de esto es el trifosfonofosfato [OP(OPO 3 ) 3 ] 9− y sus versiones parcialmente disociadas.
La fórmula general para dichos aniones polifosfato (no cíclicos), lineales o ramificados, es [H n +2− k P n O 3 n +1 ] k − , donde la carga k puede variar de 1 a n + 2 . Generalmente en una solución acuosa, el grado o porcentaje de disociación depende del pH de la solución.
Polifosfatos cíclicos
Las sales o ésteres de ácidos polifosfóricos cíclicos se denominan a menudo "metafosfatos". Los llamados trimetafosfatos en realidad tienen una mezcla de tamaños de anillos. Una fórmula general para estos compuestos cíclicos es [HPO 3 ] x donde x = número de unidades fosfóricas en la molécula.
Cuando los ácidos metafosfóricos pierden sus hidrógenos en forma de H + , se forman aniones cíclicos llamados metafosfatos . Un ejemplo de un compuesto con un anión de este tipo es el hexametafosfato de sodio ( Na6P6O18 ), utilizado como secuestrante y aditivo alimentario .
Propiedades químicas
Solubilidad
Estas series de ácidos fosfóricos son generalmente solubles en agua considerando la polaridad de las moléculas. Los fosfatos de amonio y alcalinos también son bastante solubles en agua. Las sales alcalinotérreas comienzan a volverse menos solubles y las sales de fosfato de varios otros metales son aún menos solubles.
Hidrólisis y condensación
En soluciones acuosas (soluciones de agua), el agua hidroliza gradualmente (en el transcurso de horas) los polifosfatos en fosfatos más pequeños y finalmente en ortofosfato, si se le suministra suficiente agua. Una temperatura más alta o condiciones ácidas pueden acelerar considerablemente las reacciones de hidrólisis . [5]
Por el contrario, los ácidos polifosfóricos o polifosfatos a menudo se forman deshidratando una solución de ácido fosfórico; en otras palabras, eliminando agua de ella, generalmente calentándola y evaporando el agua.
Usos
Los compuestos de orto-, piro- y tripolifosfato se han utilizado comúnmente en formulaciones de detergentes (es decir, limpiadores). Por ejemplo, consulte Tripolifosfato de sodio . A veces, el pirofosfato, tripolifosfato, tetrapolifosfato, etc. se denominan difosfato , trifosfato , tetrafosfato , etc., especialmente cuando forman parte de ésteres de fosfato en bioquímica . También se utilizan para el control de incrustaciones y corrosión por parte de los proveedores de agua potable . [6] Como inhibidores de corrosión, los polifosfatos funcionan formando una película protectora en la superficie interior de las tuberías. [7]
Ésteres de fosfato
Los grupos -OH en los ácidos fosfóricos también pueden condensarse con los grupos hidroxilo de los alcoholes para formar ésteres de fosfato . Dado que el ácido ortofosfórico tiene tres grupos -OH , puede esterificarse con una, dos o tres moléculas de alcohol para formar un mono-, di- o triéster. Vea la imagen de la estructura general de un orto- (o mono-) éster de fosfato a continuación a la izquierda, donde cualquiera de los grupos R puede ser un hidrógeno o un radical orgánico . También son posibles los ésteres de di- y tripoli- (o tri-)fosfato, etc. Cualquier grupo -OH en los fosfatos en estas moléculas de éster puede perder iones H + para formar aniones, nuevamente dependiendo del pH en una solución. En la bioquímica de los organismos vivos, hay muchos tipos de compuestos (mono)fosfato, difosfato y trifosfato (esencialmente ésteres ), muchos de los cuales juegan un papel significativo en el metabolismo, como el difosfato de adenosina (ADP) y el trifosfato (ATP) .

Véase también
Referencias
- ^ Harwood, Laurence M.; Hodgkinson, Leslie C.; Sutherland, James K.; Towers, Patrick (1984). "Síntesis de antraciclinonas. Parte 1. Alquilación regioselectiva de 5-hidroxiquinizarina". Revista Canadiense de Química . 62 (10): 1922–1925. doi : 10.1139/v84-329 .
- ^ Nakazawa, Koichi; Matsuura, Shin; Kusuda, Kosuke (1954). "Estudios sobre la Aplicación del Ácido Polifosfórico como Agente Condensante. II". Yakugaku Zasshi . 74 (5): 495–497. doi : 10.1248/yakushi1947.74.5_495 .
- ^ Eaton, PE; Carlson, GR; Lee, JT (1973). "Ácido pentóxido de fósforo-metanosulfónico. Alternativa conveniente al ácido polifosfórico". J. Org. Chem. 38 (23): 4071. doi :10.1021/jo00987a028.
- ^ Manual de química y física del CRC (49.ª ed.). Chemical Rubber Co. 1968. pág. B-226.
- ^ "Ácido fosfórico y fosfatos". Enciclopedia de tecnología química . Nueva York: The Interscience Encyclopedia, Inc. 1953. pág. 421.
- ^ "Polifosfatos para el control de la corrosión y las incrustaciones". Tramfloc, INC. Enero de 2009. Consultado el 23 de diciembre de 2010 .
- ^ "Inhibidores de corrosión de ortopolifosfato" (PDF) . Ingeniería gubernamental: The Journal for Public Infrastructure (septiembre-octubre de 2006): 48-49 . Consultado el 23 de diciembre de 2010 .
- ^ Parmar, Dixit; Sugiono, Erli; Raja, Sadiya; Rueping, Magnus (2014). "Guía de campo completa para la catálisis de metales y ácidos de Brønsted derivados de fosfato BINOL asimétricos: historia y clasificación por modo de activación; acidez de Brønsted, enlaces de hidrógeno, apareamiento iónico y fosfatos metálicos". Chemical Reviews . 114 (18): 9047–9153. doi : 10.1021/cr5001496 . PMID 25203602.
Lectura adicional
- Schröder HC, Kurz L, Muller WE, Lorenz B (marzo de 2000). "Polifosfato en el hueso" (PDF) . Biochemistry (Moscú) . 65 (3): 296–303. PMID 10739471. Archivado desde el original (PDF) el 25 de agosto de 2011.
Enlaces externos
- Determinación de polifosfatos mediante cromatografía iónica con detección de conductividad suprimida, nota de aplicación 71 de Dionex
- US 3044851, Young, Donald C., "Producción de fosfatos de amonio y productos derivados", publicada el 17 de julio de 1962, asignada a Collier Carbon & Chemical Co.
![{\displaystyle {\begin{aligned}{\ce {2 H3PO4}}&\longrightarrow {\ce {H4P2O7 + H2O}}\\[2pt]{\ce {H4P2O7 + H3PO4}}&\longrightarrow {\ce {H5P3O10 + H2O}}\\[2pt]{\ce {H5P3O10 + H3PO4}}&\longrightarrow {\ce {H6P4O13 + H2O}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4c24f45d2f63419fa9f3ec8c03563abe3532b13)