Electrólito
Un electrolito es una sustancia que conduce electricidad a través del movimiento de iones , pero no a través del movimiento de electrones . [1] [2] [3] Esto incluye la mayoría de las sales solubles , ácidos y bases , disueltas en un disolvente polar como el agua. Al disolverse, la sustancia se separa en cationes y aniones , que se dispersan uniformemente por todo el disolvente. [4] También existen electrolitos en estado sólido . En medicina y, a veces, en química, el término electrolito se refiere a la sustancia que se disuelve. [5] [6]
Eléctricamente, una solución de este tipo es neutra. Si se aplica un potencial eléctrico a dicha solución, los cationes de la solución son atraídos hacia el electrodo que tiene una abundancia de electrones , mientras que los aniones son atraídos hacia el electrodo que tiene un déficit de electrones. El movimiento de aniones y cationes en direcciones opuestas dentro de la solución equivale a una corriente. Algunos gases, como el cloruro de hidrógeno (HCl), en condiciones de alta temperatura o baja presión también pueden funcionar como electrolitos. [ aclaración necesaria ] Las soluciones electrolíticas también pueden resultar de la disolución de algunos polímeros biológicos (p. ej., ADN , polipéptidos ) o sintéticos (p. ej., sulfonato de poliestireno ), denominados " polielectrolitos ", que contienen grupos funcionales cargados . Una sustancia que se disocia en iones en solución o en la masa fundida adquiere la capacidad de conducir electricidad. El sodio , el potasio , el cloruro , el calcio , el magnesio y el fosfato en fase líquida son ejemplos de electrolitos.
En medicina, la reposición de electrolitos es necesaria cuando una persona tiene vómitos o diarrea prolongados y como respuesta a la sudoración debido a una actividad atlética extenuante. Existen soluciones comerciales de electrolitos, en particular para niños enfermos (como la solución de rehidratación oral , Suero Oral o Pedialyte ) y para deportistas ( bebidas deportivas ). El control de electrolitos es importante en el tratamiento de la anorexia y la bulimia .
En ciencia, los electrolitos son uno de los componentes principales de las celdas electroquímicas . [2]
En medicina clínica , las menciones a los electrolitos suelen hacer referencia metonímica a los iones y (especialmente) a sus concentraciones (en sangre, suero, orina u otros fluidos). Por lo tanto, las menciones a los niveles de electrolitos suelen referirse a las diversas concentraciones de iones, no a los volúmenes de fluidos.
Etimología
La palabra electrolito deriva del griego antiguo ήλεκτρο- ( ēlectro -), prefijo que originalmente significaba ámbar pero que en contextos modernos se relacionaba con la electricidad, y λυτός ( lytos ), que significa "capaz de desatarse o soltarse". [ cita requerida ]
Historia

En su tesis de 1884, Svante Arrhenius expuso su explicación de la disocia de las sales cristalinas sólidas en partículas cargadas apareadas cuando se disuelven, por la que ganó el Premio Nobel de Química en 1903. [7] [8] [9] [10] La explicación de Arrhenius fue que al formar una solución, la sal se disocia en partículas cargadas, a las que Michael Faraday (1791-1867) había dado el nombre de " iones " muchos años antes. La creencia de Faraday había sido que los iones se producían en el proceso de electrólisis . Arrhenius propuso que, incluso en ausencia de una corriente eléctrica, las soluciones de sales contenían iones. Por lo tanto, propuso que las reacciones químicas en solución eran reacciones entre iones. [8] [9] [10]
Poco después de la hipótesis de los iones de Arrhenius, Franz Hofmeister y Siegmund Lewith [11] [12] [13] descubrieron que los distintos tipos de iones mostraban efectos diferentes sobre cuestiones como la solubilidad de las proteínas. En muchos otros sistemas también se observa un orden consistente de estos distintos iones en función de la magnitud de su efecto. Desde entonces, esto se conoce como la serie de Hofmeister .
Si bien los orígenes de estos efectos no están del todo claros y han sido debatidos durante el siglo pasado, se ha sugerido que la densidad de carga de estos iones es importante [14] y, en realidad, podría tener explicaciones que se originaron en el trabajo de Charles-Augustin de Coulomb hace más de 200 años.
Formación
Las soluciones electrolíticas se forman normalmente cuando se coloca sal en un disolvente como el agua y los componentes individuales se disocian debido a las interacciones termodinámicas entre las moléculas del disolvente y del soluto, en un proceso llamado " solvatación ". Por ejemplo, cuando se coloca sal de mesa ( cloruro de sodio ), NaCl, en agua, la sal (un sólido) se disuelve en sus iones componentes, según la reacción de disociación: [ cita requerida ]
- NaCl (s) → Na + (acuoso) + Cl − (acuoso)
También es posible que las sustancias reaccionen con el agua y produzcan iones. Por ejemplo, el dióxido de carbono se disuelve en agua para producir una solución que contiene iones hidronio , carbonato e hidrogenocarbonato . [ cita requerida ]
Las sales fundidas también pueden ser electrolitos, como por ejemplo el cloruro de sodio fundido, que conduce la electricidad. En particular, los líquidos iónicos, que son sales fundidas con puntos de fusión inferiores a 100 °C, [15] son un tipo de electrolitos no acuosos altamente conductores y, por lo tanto, han encontrado cada vez más aplicaciones en pilas de combustible y baterías. [16]
Un electrolito en una solución puede describirse como "concentrado" si tiene una alta concentración de iones, o "diluido" si tiene una baja concentración. Si una gran proporción del soluto se disocia para formar iones libres, el electrolito es fuerte; si la mayor parte del soluto no se disocia, el electrolito es débil. Las propiedades de los electrolitos pueden aprovecharse mediante electrólisis para extraer los elementos constituyentes y los compuestos contenidos en la solución. [ cita requerida ]
Los metales alcalinotérreos forman hidróxidos que son electrolitos fuertes con solubilidad limitada en agua, debido a la fuerte atracción entre sus iones constituyentes. Esto limita su aplicación a situaciones donde se requiere alta solubilidad. [17]
En 2021, los investigadores descubrieron que el electrolito puede "facilitar sustancialmente los estudios de corrosión electroquímica en medios menos conductores". [18]
Importancia fisiológica
En fisiología , los iones primarios de los electrolitos son sodio (Na + ), potasio (K + ), calcio (Ca2 + ), magnesio (Mg2 + ), cloruro (Cl− ) , fosfato de hidrógeno (HPO42− ) e hidrogenocarbonato (HCO3− ) . [ 19] [ Verificación fallida ] Los símbolos de carga eléctrica de más (+) y menos ( − ) indican que la sustancia es de naturaleza iónica y tiene una distribución desequilibrada de electrones, resultado de la disociación química . El sodio es el principal electrolito que se encuentra en el líquido extracelular y el potasio es el principal electrolito intracelular; [20] ambos están involucrados en el equilibrio de líquidos y el control de la presión arterial . [21]
Todas las formas de vida multicelulares conocidas requieren un equilibrio electrolítico sutil y complejo entre los entornos intracelular y extracelular . [19] En particular, es importante mantener gradientes osmóticos precisos de electrolitos. Dichos gradientes afectan y regulan la hidratación del cuerpo, así como el pH de la sangre , y son fundamentales para la función nerviosa y muscular . Existen varios mecanismos en las especies vivas que mantienen las concentraciones de diferentes electrolitos bajo un estricto control. [22]
Tanto el tejido muscular como las neuronas se consideran tejidos eléctricos del cuerpo. Los músculos y las neuronas se activan por la actividad electrolítica entre el líquido extracelular o líquido intersticial y el líquido intracelular . Los electrolitos pueden entrar o salir de la membrana celular a través de estructuras proteínicas especializadas incrustadas en la membrana plasmática llamadas " canales iónicos ". Por ejemplo, la contracción muscular depende de la presencia de calcio (Ca 2+ ), sodio (Na + ) y potasio (K + ). Sin niveles suficientes de estos electrolitos clave, puede producirse debilidad muscular o contracciones musculares graves. [ cita requerida ] [23]
El equilibrio electrolítico se mantiene mediante la ingesta oral o, en casos de emergencia, intravenosa (IV) de sustancias que contienen electrolitos, y está regulado por hormonas , en general, los riñones eliminan los niveles excesivos. En los seres humanos, la homeostasis electrolítica está regulada por hormonas como las hormonas antidiuréticas , la aldosterona y las hormonas paratiroideas . Los trastornos electrolíticos graves , como la deshidratación y la sobrehidratación , pueden provocar complicaciones cardíacas y neurológicas y, a menos que se resuelvan rápidamente, darán lugar a una emergencia médica .
Medición
La medición de electrolitos es un procedimiento de diagnóstico que se realiza con frecuencia mediante análisis de sangre con electrodos selectivos de iones o análisis de orina por parte de tecnólogos médicos . La interpretación de estos valores carece de sentido sin un análisis de la historia clínica y, a menudo, es imposible sin mediciones paralelas de la función renal . Los electrolitos que se miden con mayor frecuencia son el sodio y el potasio. Los niveles de cloruro rara vez se miden, excepto para la interpretación de los gases en sangre arterial, ya que están inherentemente vinculados a los niveles de sodio. Una prueba importante que se realiza en la orina es la prueba de gravedad específica para determinar la aparición de un desequilibrio electrolítico . [ cita requerida ]
Rehidratación
Según un estudio financiado por el Gatorade Sports Science Institute , las bebidas electrolíticas que contienen sales de sodio y potasio reponen las concentraciones de agua y electrolitos del cuerpo después de la deshidratación causada por el ejercicio , el consumo excesivo de alcohol , la diaforesis (sudoración intensa), la diarrea, los vómitos, la intoxicación o la inanición; el estudio dice que los atletas que se ejercitan en condiciones extremas (durante tres o más horas de forma continua, por ejemplo, un maratón o un triatlón ) que no consumen electrolitos corren el riesgo de sufrir deshidratación (o hiponatremia ). [24] [ Necesita confirmación independiente ]
Se puede preparar una bebida casera de electrolitos utilizando agua, azúcar y sal en proporciones precisas . [25] Es importante incluir glucosa (azúcar) para utilizar el mecanismo de cotransporte de sodio y glucosa. También existen preparaciones comerciales disponibles [26] tanto para uso humano como veterinario.
Los electrolitos se encuentran comúnmente en jugos de frutas , bebidas deportivas, leche, nueces y muchas frutas y verduras (enteras o en forma de jugo) (por ejemplo, papas, aguacates ).
Electroquímica
Cuando se colocan electrodos en un electrolito y se aplica un voltaje , el electrolito conduce la electricidad. Los electrones solitarios normalmente no pueden pasar a través del electrolito; en cambio, se produce una reacción química en el cátodo , que proporciona electrones al electrolito. Otra reacción se produce en el ánodo , que consume electrones del electrolito. Como resultado, se desarrolla una nube de carga negativa en el electrolito alrededor del cátodo y una carga positiva alrededor del ánodo. Los iones en el electrolito neutralizan estas cargas, lo que permite que los electrones sigan fluyendo y que las reacciones continúen. [ cita requerida ]
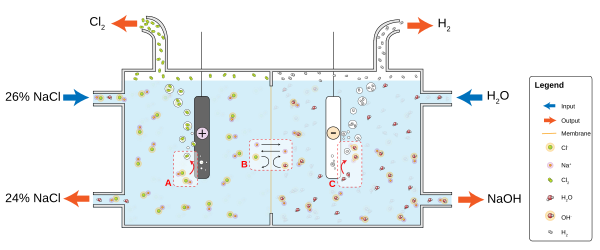
Por ejemplo, en una solución de sal de mesa común (cloruro de sodio, NaCl) en agua, la reacción del cátodo será
- 2H2O + 2e− → 2OH− + H2
y el gas hidrógeno burbujeará; la reacción del ánodo es
- 2 NaCl → 2 Na + + Cl 2 + 2e −
y el gas cloro se liberará en solución donde reacciona con los iones sodio e hidroxilo para producir hipoclorito de sodio - blanqueador doméstico . Los iones de sodio con carga positiva Na + reaccionarán hacia el cátodo, neutralizando la carga negativa de OH − allí, y los iones de hidróxido con carga negativa OH − reaccionarán hacia el ánodo, neutralizando la carga positiva de Na + allí. Sin los iones del electrolito, las cargas alrededor del electrodo ralentizarían el flujo continuo de electrones; la difusión de H + y OH − a través del agua al otro electrodo tarda más que el movimiento de los iones de sal mucho más frecuentes. Los electrolitos se disocian en el agua porque las moléculas de agua son dipolos y los dipolos se orientan de una manera energéticamente favorable para solvatar los iones.
En otros sistemas, las reacciones de los electrodos pueden involucrar tanto los metales de los electrodos como los iones del electrolito.
Los conductores electrolíticos se utilizan en dispositivos electrónicos donde la reacción química en una interfaz metal-electrolito produce efectos útiles.
- En las baterías se utilizan como electrodos dos materiales con distintas afinidades electrónicas; los electrones fluyen de un electrodo al otro fuera de la batería, mientras que dentro de la misma el circuito se cierra por los iones del electrolito. Aquí, las reacciones de los electrodos convierten la energía química en energía eléctrica. [27]
- En algunas celdas de combustible , un electrolito sólido o un conductor de protones conecta las placas eléctricamente mientras mantiene separados los gases combustibles de hidrógeno y oxígeno. [28]
- En los tanques de galvanoplastia , el electrolito deposita simultáneamente metal sobre el objeto a recubrir y conecta eléctricamente ese objeto en el circuito.
- En los medidores de horas de funcionamiento, dos delgadas columnas de mercurio están separadas por un pequeño espacio lleno de electrolito y, a medida que la carga pasa a través del dispositivo, el metal se disuelve en un lado y se plaquea en el otro, lo que hace que el espacio visible se mueva lentamente.
- En los condensadores electrolíticos se aprovecha el efecto químico para producir una capa dieléctrica o aislante extremadamente fina, mientras que la capa de electrolito se comporta como una placa del condensador.
- En algunos higrómetros la humedad del aire se detecta midiendo la conductividad de un electrolito casi seco.
- El vidrio caliente y ablandado es un conductor electrolítico y algunos fabricantes de vidrio mantienen el vidrio fundido pasando una gran corriente a través de él.
Electrolitos sólidos
Los electrolitos sólidos se pueden dividir principalmente en cuatro grupos que se describen a continuación.
Electrolitos en gel
Electrolitos en gel: se parecen mucho a los electrolitos líquidos. En esencia, son líquidos en un marco reticular flexible . A menudo se aplican diversos aditivos para aumentar la conductividad de dichos sistemas. [27] [29]
Electrolitos cerámicos
Electrolitos cerámicos sólidos: los iones migran a través de la fase cerámica por medio de huecos o intersticios dentro de la red . También existen electrolitos cerámicos vítreos .
Electrolitos poliméricos
Electrolitos poliméricos secos: se diferencian de los electrolitos líquidos y en gel en el sentido de que la sal se disuelve directamente en el medio sólido. Por lo general, se trata de un polímero con una constante dieléctrica relativamente alta ( PEO , PMMA , PAN , polifosfacenos , siloxanos , etc.) y una sal con baja energía reticular . Para aumentar la resistencia mecánica y la conductividad de dichos electrolitos, muy a menudo se fabrican compuestos y se introduce una fase cerámica inerte. Hay dos clases principales de dichos electrolitos: polímero en cerámica y cerámica en polímero. [30] [31] [32]
Electrolitos plásticos orgánicos
Cristales plásticos iónicos orgánicos: son un tipo de sales orgánicas que presentan mesofases (es decir, un estado de la materia intermedio entre líquido y sólido), en el que los iones móviles están desordenados orientacional o rotacionalmente mientras que sus centros se encuentran en los sitios ordenados en la estructura cristalina. [28] Tienen varias formas de desorden debido a una o más transiciones de fase sólido-sólido por debajo del punto de fusión y, por lo tanto, tienen propiedades plásticas y buena flexibilidad mecánica, así como un contacto interfacial electrodo-electrolito mejorado. En particular, los cristales plásticos iónicos orgánicos próticos (POIPC), [28] que son sales orgánicas próticas sólidas formadas por transferencia de protones de un ácido de Brønsted a una base de Brønsted y, en esencia, son líquidos iónicos próticos en estado fundido , han resultado ser prometedores conductores de protones en estado sólido para celdas de combustible . Los ejemplos incluyen perfluorobutanosulfonato de 1,2,4-triazolio [28] y metanosulfonato de imidazolio . [33]
Véase también
- Mecanizado electroquímico
- Elektrolytdatenbank Ratisbona
- Número de transporte de iones
- ITIES (interfaz entre dos soluciones electrolíticas inmiscibles)
- Puente de sal
- Electrolito fuerte
- Electrolito de soporte (electrolito de fondo)
- VTP
Referencias
- ^ Enderby JE, Neilson GW (1 de junio de 1981). «La estructura de las soluciones electrolíticas». Informes sobre el progreso en física . 44 (6): 593–653. doi :10.1088/0034-4885/44/6/001. ISSN 0034-4885. S2CID 250852242. Archivado desde el original el 18 de diciembre de 2021. Consultado el 18 de diciembre de 2021 .
- ^ ab Petrovic S (29 de octubre de 2020). Curso intensivo sobre tecnología de baterías: una introducción concisa. Springer. ISBN 978-3-030-57269-3.OCLC 1202758685 .
- ^ Winie T, Arof AK, Thomas S (18 de febrero de 2020). Electrolitos poliméricos: técnicas de caracterización y aplicaciones energéticas. John Wiley & Sons. ISBN 978-3-527-34200-6.
- ^ M Andreev, JJ de Pablo, A Chremos, JF Douglas (2018). "Influencia de la solvatación iónica en las propiedades de las soluciones electrolíticas". The Journal of Physical Chemistry B . 122 (14): 4029–4034. doi :10.1021/acs.jpcb.8b00518. PMID 29611710.
- ^ Wilkins LW (2007). Fluidos y electrolitos. Lippincott Williams & Wilkins. ISBN 978-1-58255-923-0.
- ^ "electrolito". Instituto Nacional del Cáncer . 2 de febrero de 2011. Archivado desde el original el 23 de abril de 2018. Consultado el 18 de diciembre de 2021 .
- ^ «El Premio Nobel de Química 1903». Archivado desde el original el 8 de julio de 2018. Consultado el 5 de enero de 2017 .
- ^ ab Harris W, Levey J, eds. (1975). The New Columbia Encyclopedia (4.ª ed.). Nueva York: Universidad de Columbia. pág. 155. ISBN 978-0-231035-729.
- ^ ab McHenry C, ed. (1992). La nueva Encyclopædia Britannica . vol. 1 (15 ed.). Chicago: Encyclopædia Britannica, Inc. p. 587. Bibcode : 1991neb..libro.......G. ISBN 978-085-229553-3.
- ^ ab Cillispie C, ed. (1970). Diccionario de biografía científica (1.ª ed.). Nueva York: Charles Scribner's Sons. págs. 296-302. ISBN 978-0-684101-125.
- ^ Franz Hofmeister (1888). "Zur Lehre Von Der Wirkung Der Salze". Arco de Naunyn-Schmiedeberg. Farmacéutico .
- ^ W. Kunz, J. Henle, BW Ninham (2004). "'Zur Lehre von der Wirkung der Salze' (sobre la ciencia del efecto de las sales): artículos históricos de Franz Hofmeister". Opinión actual en ciencia de interfases y coloides . 9 (1–2): 19–37. doi :10.1016/j.cocis.2004.05.005. Archivado desde el original el 20 de enero de 2022 . Consultado el 8 de noviembre de 2021 .
- ^ Gregory KP, Elliott GR, Robertson H, Kumar A, Wanless EJ, Webber GB, Craig VS, Andersson GG, Page AJ (2022). "Comprensión de los efectos de iones específicos y la serie de Hofmeister". Química física Química Física . 24 (21): 12682–12718. Bibcode :2022PCCP...2412682G. doi : 10.1039/D2CP00847E . PMID 35543205.
- ^ Kasimir P. Gregory, Erica J. Wanless, Grant B. Webber, Vince SJ Craig, Alister J. Page (2021). "Los orígenes electrostáticos de los efectos de iones específicos: cuantificación de la serie de Hofmeister para aniones". Química . 12 (45): 15007–15015. doi :10.1039/D1SC03568A. PMC 8612401. PMID 34976339. S2CID 244578563 .
- ^ Shi J, Sun X, Chunhe Y, Gao Q, Li Y (2002). 离子液体研究进展(PDF) .化学通报(en chino simplificado) (4): 243. ISSN 0441-3776. Archivado desde el original (PDF) el 2 de marzo de 2017 . Consultado el 1 de marzo de 2017 .
- ^ Jiangshui Luo, Jin Hu, Wolfgang Saak, Rüdiger Beckhaus, Gunther Wittstock, Ivo FJ Vankelecom, Carsten Agert, Olaf Conrad (2011). "Líquido iónico prótico y fundidos iónicos preparados a partir de ácido metanosulfónico y 1H-1,2,4-triazol como electrolitos de PEMFC de alta temperatura". Journal of Materials Chemistry . 21 (28): 10426–10436. doi :10.1039/C0JM04306K. S2CID 94400312.
- ^ Brown, Química: La ciencia central, 14ª edición, pág. 680.
- ^ Matějovský L, Staš M, Dumská K, Pospíšil M, Macák J (1 de enero de 2021). "Pruebas de corrosión electroquímica en un entorno de mezclas de etanol y gasolina de baja conductividad: Parte 1 - Pruebas de electrolitos de soporte". Revista de química electroanalítica . 880 : 114879. doi :10.1016/j.jelechem.2020.114879. ISSN 1572-6657. S2CID 229508133.
- ^ ab Alfarouk KO, Ahmed SB, Ahmed A, Elliott RL, Ibrahim ME, Ali HS, Wales CC, Nourwali I, Aljarbou AN, Bashir AH, Alhoufie ST, Alqahtani SS, Cardone RA, Fais S, Harguindey S, Reshkin SJ ( 7 de abril de 2020). "La interacción del pH desregulado y el desequilibrio electrolítico en el cáncer". Cánceres . 12 (4): 898. doi : 10.3390/cánceres12040898 . PMC 7226178 . PMID 32272658.
- ^ Ye S (, Tang Z ( (1986). 细胞膜钠泵及其临床意义.上海医学[Medicina de Shanghai] (en chino simplificado) (1): 1. Archivado desde el original el 3 de marzo de 2017. Consultado el 3 de marzo de 2017. .
- ^ Tu Z( (2004). 电解质紊乱对晚期肿瘤的治疗影响.中华中西医杂志[Revista china de medicina china y occidental] (en chino simplificado) (10). 92%, 92%, 98 %
左右.分...
- ^ Recursos abiertos para enfermería, Ernstmeyer K, Christman E (2021), "Capítulo 15 Fluidos y electrolitos", Fundamentos de enfermería [Internet] , Chippewa Valley Technical College , consultado el 28 de febrero de 2024
- ^ "Consecuencias reproductivas de las alteraciones electrolíticas en animales domésticos".
- ^ J, Estevez E, Baquero E, Mora-Rodriguez R (2008). "Rendimiento anaeróbico al rehidratarse con agua o bebidas deportivas disponibles comercialmente durante el ejercicio prolongado en el calor". Fisiología Aplicada, Nutrición y Metabolismo . 33 (2): 290–298. doi :10.1139/H07-188. PMID 18347684.
- ^ "Bebidas rehidratantes". Webmd.com. 28 de abril de 2008. Archivado desde el original el 23 de octubre de 2008. Consultado el 25 de diciembre de 2018 .
- ^ "Proveedores de sales de rehidratación oral". Rehydrate.org. 7 de octubre de 2014. Archivado desde el original el 7 de diciembre de 2014. Consultado el 4 de diciembre de 2014 .
- ^ ab Kamil Perzyna, Regina Borkowska, Jaroslaw Syzdek, Aldona Zalewska, Wladyslaw Wieczorek (2011). "El efecto del aditivo de tipo ácido de Lewis sobre las características del electrolito de gel de litio". Acta electroquímica . 57 : 58–65. doi :10.1016/j.electacta.2011.06.014.
- ^ abcd Jiangshui Luo, Annemette H. Jensen, Neil R. Brooks, Jeroen Sniekers, Martin Knipper, David Aili, Qingfeng Li, Bram Vanroy, Michael Wübbenhorst, Feng Yan, Luc Van Meervelt, Zhigang Shao, Jianhua Fang, Zheng-Hong Luo, Dirk E. De Vos, Koen Binnemans, Jan Fransaer (2015). "Perfluorobutanosulfonato de 1,2,4-triazolio como un electrolito de cristal plástico iónico orgánico prótico puro arquetípico para celdas de combustible de estado sólido". Energía y ciencia medioambiental . 8 (4): 1276–1291. doi :10.1039/C4EE02280G. S2CID 84176511.
- ^ "La revolución de las baterías de rollo a rollo". Ev World. Archivado desde el original el 10 de julio de 2011. Consultado el 20 de agosto de 2010 .
- ^ Syzdek J, Borkowska R, Perzyna K, Tarascon JM, Wieczorek W (2007). "Nuevos electrolitos poliméricos compuestos con rellenos inorgánicos modificados en la superficie". Journal of Power Sources . 173 (2): 712–720. Bibcode :2007JPS...173..712S. doi :10.1016/j.jpowsour.2007.05.061. ISSN 0378-7753.
- ^ Syzdek J, Armand M, Marcinek M, Zalewska A, Żukowska G, Wieczorek W (2010). "Estudios detallados sobre la modificación de los rellenos y su influencia en electrolitos poliméricos compuestos a base de poli(oxietileno)". Electrochimica Acta . 55 (4): 1314–1322. doi :10.1016/j.electacta.2009.04.025. ISSN 0013-4686.
- ^ Syzdek J, Armand M, Gizowska M, Marcinek M, Sasim E, Szafran M, Wieczorek W (2009). "Electrolitos poliméricos de cerámica en polímero versus polímero en cerámica: un enfoque novedoso". Revista de fuentes de energía . 194 (1): 66–72. Código Bib : 2009JPS...194...66S. doi :10.1016/j.jpowsour.2009.01.070. ISSN 0378-7753.
- ^ Jiangshui Luo, Olaf Conrad, Ivo FJ Vankelecom (2013). "Metansulfonato de imidazolio como conductor de protones a alta temperatura". Journal of Materials Chemistry A . 1 (6): 2238–2247. doi :10.1039/C2TA00713D. S2CID 96622511.
Enlaces externos
 Medios relacionados con Electrolitos en Wikimedia Commons
Medios relacionados con Electrolitos en Wikimedia Commons- Friedman HL (1960). "Teoría de la solución iónica de Mayer aplicada a mezclas de electrolitos". The Journal of Chemical Physics . 32 (4): 1134–1149. Bibcode :1960JChPh..32.1134F. doi : 10.1063/1.1730863 .
- Leaist DG, Lyons PA (1981). "Difusión multicomponente de electrolitos con disociación incompleta. Difusión en una solución tampón". The Journal of Physical Chemistry . 85 (12): 1756–1762. doi :10.1021/j150612a033.
- Kaminsky M (1957). "Interacción ion-disolvente y viscosidad de soluciones de electrolitos fuertes". Discusiones de la Faraday Society . 24 : 171. doi :10.1039/DF9572400171.
