Vasopresina
 | |
 | |
| Datos clínicos | |
|---|---|
| Pronunciación | / ˌ v eɪ z oʊ ˈ p r ɛ s ɪ n / |
| Otros nombres | Hormona antidiurética (ADH); vasopresina arginina (AVP); argipresina |
| Código ATC |
|
| Datos fisiológicos | |
| Tejidos de origen | Núcleo supraóptico ; núcleo paraventricular del hipotálamo |
| Tejidos diana | Todo el sistema |
| Receptores | V1A , V1B , V2 , OXTR |
| Agonistas | Felipresina , desmopresina |
| Antagonistas | Diuréticos |
| Metabolismo | Predominantemente en el hígado y los riñones. |
| Datos farmacocinéticos | |
| Unión de proteínas | 1% |
| Metabolismo | Predominantemente en el hígado y los riñones. |
| Vida media de eliminación | 10–20 minutos |
| Excreción | Orina |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
| Fórmula | C46H65N15O12S2 |
| Masa molar | 1 084,24 g· mol −1 |
| Modelo 3D ( JSmol ) |
|
| Densidad | 1,6 ± 0,1 g/ cm3 |
| |
| |
| Vicepresidente Adjunto | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | AVP , ADH, ARVP, AVP-NPII, AVRP, VP, gen AVP, AVP (gen), Prepro-AVP-NP II, gen de vasopresina arginina, gen de vasopresina, gen de prepro-arginina-vasopresina-neurofisina II, vasopresina-neurofisina II-copeptina, vasopresina-neurofisina 2-copeptina, prepro-AVP2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 192340; MGI : 88121; HomoloGene : 417; Tarjetas Gene : AVP; OMA :AVP - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La vasopresina humana , también llamada hormona antidiurética ( ADH ), vasopresina arginina ( AVP ) o argipresina , [5] es una hormona sintetizada a partir del gen AVP como prohormona peptídica en neuronas del hipotálamo , [6] y se convierte en AVP. Luego viaja por el axón que termina en la hipófisis posterior y se libera desde las vesículas hacia la circulación en respuesta a la hipertonicidad del líquido extracelular ( hiperosmolalidad ). La AVP tiene dos funciones principales. En primer lugar, aumenta la cantidad de agua libre de solutos reabsorbida de nuevo en la circulación desde el filtrado en los túbulos renales de las nefronas . En segundo lugar, la AVP contrae las arteriolas , lo que aumenta la resistencia vascular periférica y eleva la presión arterial . [7] [8] [9]
Es posible que exista una tercera función. Es posible que parte de la AVP se libere directamente en el cerebro desde el hipotálamo y que desempeñe un papel importante en el comportamiento social , la motivación sexual y los vínculos de pareja , así como en las respuestas maternas al estrés. [10]
La vasopresina induce la diferenciación de células madre en cardiomiocitos y promueve la homeostasis del músculo cardíaco. [11]
Tiene una vida media muy corta, entre 16 y 24 minutos. [9]
Fisiología
Función
La vasopresina regula la tonicidad de los líquidos corporales. Se libera desde la hipófisis posterior en respuesta a la hipertonicidad y hace que los riñones reabsorban agua libre de solutos y la devuelvan a la circulación desde los túbulos de la nefrona, devolviendo así la tonicidad de los líquidos corporales a la normalidad. Una consecuencia incidental de esta reabsorción renal de agua es la concentración de orina y la reducción del volumen de orina. La AVP liberada en altas concentraciones también puede aumentar la presión arterial al inducir una vasoconstricción moderada . [12]
La AVP también puede tener una variedad de efectos neurológicos en el cerebro. Puede influir en la formación de parejas en los topillos . Se ha demostrado que las distribuciones de alta densidad del receptor de vasopresina AVPr1a en las regiones ventrales del prosencéfalo de los topillos de pradera facilitan y coordinan los circuitos de recompensa durante la formación de la preferencia de pareja, lo que es fundamental para la formación de parejas. [13]
Una sustancia muy similar, la vasopresina lisina ( LVP ) o lipresina , tiene la misma función en los cerdos y su versión sintética se utilizó en la deficiencia de AVP humana, aunque ha sido reemplazada en gran medida por la desmopresina . [14]
Riñón
La vasopresina tiene tres efectos principales que son:
- Aumentar la permeabilidad al agua del túbulo contorneado distal (DCT) y los túbulos colectores corticales (CCT), así como el conducto colector medular externo e interno (OMCD e IMCD) en el riñón, permitiendo así la reabsorción de agua y la excreción de orina más concentrada, es decir, antidiuresis . Esto ocurre a través del aumento de la transcripción e inserción de canales de agua ( Aquaporina-2 ) en la membrana apical de las células epiteliales del túbulo colector y del conducto colector. [15] Las acuaporinas permiten que el agua se mueva por su gradiente osmótico y salga de la nefrona, aumentando la cantidad de agua reabsorbida del filtrado (formando orina) de regreso al torrente sanguíneo. Este efecto está mediado por los receptores V2 . La vasopresina también aumenta la concentración de calcio en las células del conducto colector, mediante la liberación episódica de los depósitos intracelulares. La vasopresina, que actúa a través de AMPc , también aumenta la transcripción del gen de acuaporina-2, aumentando así el número total de moléculas de acuaporina-2 en las células de los conductos colectores. [16]
- Aumentar la permeabilidad de la porción medular interna del conducto colector a la urea mediante la regulación de la expresión de los transportadores de urea en la superficie celular , [17] lo que facilita su reabsorción en el intersticio medular a medida que viaja por el gradiente de concentración creado al eliminar agua del túbulo de conexión , el conducto colector cortical y el conducto colector medular externo .
- Aumento agudo de la absorción de sodio a través del asa ascendente de Henle . Esto se suma a la multiplicación en contracorriente que ayuda a la reabsorción adecuada de agua más adelante en el túbulo distal y el conducto colector . [18]
La hormona vasopresina también estimula la actividad de NKCC2 . La vasopresina estimula la reabsorción de cloruro de sodio en la rama ascendente gruesa de la nefrona activando las vías de señalización. La vasopresina aumenta el tráfico de NKCC2 a la membrana y fosforila algunos sitios de serina y treonina en el extremo N-terminal citoplasmático de NKCC2 ubicado en la membrana, lo que aumenta su actividad. El aumento de la actividad de NKCC2 ayuda a la reabsorción de agua en el conducto colector a través de los canales de acuaporina 2 al crear un filtrado hipoosmótico. [19] [20]
Sistema nervioso central
La vasopresina liberada en el cerebro puede tener varias acciones:
- La vasopresina es liberada en el cerebro a un ritmo circadiano por las neuronas del núcleo supraquiasmático . [21]
- La vasopresina liberada por la hipófisis posterior se asocia con náuseas. [22]
- Evidencias recientes sugieren que la vasopresina puede tener efectos analgésicos. Se ha descubierto que los efectos analgésicos de la vasopresina dependen tanto del estrés como del sexo. [23]
Regulación
Regulación genética
La vasopresina está regulada por la expresión del gen AVP , que es gestionada por los principales genes controlados por el reloj. En este circuito circadiano conocido como bucle de retroalimentación de transcripción-traducción (TTFL), la proteína Per2 se acumula y es fosforilada por CK1E . Per2 posteriormente inhibe los factores de transcripción Clock y BMAL1 para reducir los niveles de proteína Per2 en la célula. [24] Al mismo tiempo, Per2 también inhibe los factores de transcripción del gen AVP para regular su expresión, la expresión de vasopresina y otros productos del gen AVP . [25]
Muchos factores influyen en la secreción de vasopresina:
- El etanol (alcohol) reduce la secreción dependiente de calcio de AVP al bloquear los canales de calcio dependientes de voltaje en las terminales nerviosas neurohipofisarias de ratas. [26]
- La angiotensina II estimula la secreción de AVP, de acuerdo con sus efectos presores y provolumétricos generales en el cuerpo. [27]
- El péptido natriurético auricular inhibe la secreción de AVP, en parte al inhibir la estimulación de la secreción de AVP inducida por angiotensina II. [27]
- El cortisol inhibe la secreción de la hormona antidiurética. [28]
Producción y secreción
El estímulo fisiológico para la secreción de vasopresina es el aumento de la osmolalidad del plasma, controlado por el hipotálamo. Una disminución del volumen de sangre arterial (como puede ocurrir en la cirrosis , la nefrosis y la insuficiencia cardíaca ) estimula la secreción, incluso en caso de osmolalidad reducida del plasma: reemplaza a la osmolalidad, pero con un efecto más leve. En otras palabras, la descarga de barorreceptores cuando el volumen de sangre arterial es bajo estimula la secreción de vasopresina a pesar de la presencia de hipoosmolalidad (hiponatremia). [29]
La AVP que se mide en la sangre periférica se deriva casi en su totalidad de la secreción de la glándula pituitaria posterior (excepto en casos de tumores secretores de AVP). La vasopresina es producida por neuronas neurosecretoras magnocelulares en el núcleo paraventricular del hipotálamo (PVN) y el núcleo supraóptico (SON). Luego viaja a lo largo del axón a través del infundíbulo dentro de gránulos neurosecretores que se encuentran dentro de los cuerpos de Herring, hinchazones localizadas de los axones y terminales nerviosos. Estos llevan el péptido directamente a la glándula pituitaria posterior, donde se almacena hasta que se libera en la sangre.
Existen otras fuentes de AVP, más allá de las neuronas magnocelulares hipotalámicas. Por ejemplo, la AVP también es sintetizada por neuronas neurosecretoras parvocelulares del PVN, transportada y liberada en la eminencia media , desde donde viaja a través del sistema portal hipofisario hasta la hipófisis anterior, donde estimula a las células corticotrópicas sinérgicamente con CRH para producir ACTH (por sí misma es un secretagogo débil). [30]
Vasopresina durante la cirugía y la anestesia
La concentración de vasopresina se utiliza para medir el estrés quirúrgico para la evaluación de las técnicas quirúrgicas. La concentración plasmática de vasopresina aumenta con estímulos nocivos , [31] [32] predominantemente durante la cirugía abdominal, [33] [34] [35] especialmente en la manipulación intestinal, la tracción de vísceras, [36] [37] [38] así como la insuflación abdominal con dióxido de carbono durante la cirugía laparoscópica. [39] [40]
Receptores
Tipos de receptores AVP y sus acciones:
| Tipo | Sistema de segundo mensajero | Ubicaciones | Comportamiento | Agonistas | Antagonistas |
|---|---|---|---|---|---|
| AVPR1A | Fosfatidilinositol / calcio | Hígado , riñón , vasculatura periférica, cerebro. | Vasoconstricción , degradación del glucógeno , [41] agregación plaquetaria y liberación del factor VIII y del factor von Willebrand ; reconocimiento social, [42] tau circadiana [43] | Felipresina | |
| AVPR1B o AVPR3 | Fosfatidilinositol / calcio | Glándula pituitaria , cerebro | Secreción de hormona adrenocorticotrópica en respuesta al estrés; [44] interpretación social de las señales olfativas [45] | ||
| AVPR2 | Adenilato ciclasa / AMPc | Membrana basolateral de las células que recubren los conductos colectores de los riñones (especialmente los conductos colectores corticales y medulares externos) | Inserción de canales de acuaporina-2 (AQP2) (canales de agua). Esto permite que el agua se reabsorba siguiendo un gradiente osmótico, por lo que la orina está más concentrada. Liberación del factor de von Willebrand y expresión superficial de P-selectina a través de la exocitosis de los cuerpos de Weibel-Palade de las células endoteliales [46] [47] | AVP, desmopresina | Diuréticos "-vaptan", es decir tolvaptán |
Estructura y relación con la oxitocina

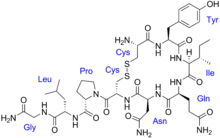
Las vasopresinas son péptidos que constan de nueve aminoácidos (nonapéptidos). La secuencia de aminoácidos de la vasopresina arginina (argipresina) es Cys - Tyr - Phe - Gln - Asn - Cys - Pro - Arg - Gly -NH 2 , con los residuos de cisteína formando un enlace disulfuro y el extremo C de la secuencia convertido en una amida primaria . [48] La vasopresina lisina (lipresina) tiene una lisina en lugar de la arginina como el octavo aminoácido, y se encuentra en cerdos y algunos animales relacionados, mientras que la vasopresina arginina se encuentra en humanos. [49]
La estructura de la oxitocina es muy similar a la de las vasopresinas: también es un nonapéptido con un puente disulfuro y su secuencia de aminoácidos difiere sólo en dos posiciones. Los dos genes están ubicados en el mismo cromosoma separados por una distancia relativamente pequeña de menos de 15.000 bases en la mayoría de las especies. Las neuronas magnocelulares que secretan vasopresina están adyacentes a las neuronas magnocelulares que secretan oxitocina, y son similares en muchos aspectos. La similitud de los dos péptidos puede causar algunas reacciones cruzadas: la oxitocina tiene una ligera función antidiurética, y altos niveles de AVP pueden causar contracciones uterinas. [50] [51]
Comparación de las familias de neuropéptidos vasopresina y oxitocina:
| Familia de la vasopresina en vertebrados | ||
|---|---|---|
| Cis-Tyr- Phe -Gln-Asn-Cys-Pro- Arg -Gly- NH2 | Argipresina (AVP, ADH) | La mayoría de los mamíferos |
| Cis-Tyr-Phe-Gln-Asn-Cys-Pro-Lys-Gly- NH2 | Lipresina (LVP) | Cerdos , hipopótamos , jabalíes y algunos marsupiales. |
| Cis-Fe-Fe-Gln-Asn-Cis-Pro-Arg-Gly-NH 2 | Fenipresina | Algunos marsupiales |
| Cis-Tyr- Ile -Gln-Asn-Cys-Pro- Arg -Gly- NH2 | Vasotocina † | No mamíferos |
| Familia de oxitocina de vertebrados | ||
| Cis-Tyr- Ile -Gln-Asn-Cys-Pro- Leu -Gly-NH 2 | Oxitocina (OXT) | La mayoría de los mamíferos, peces rata |
| Cis-Tyr-Ile-Gln-Asn-Cys-Pro-Pro-Gly-NH 2 | Prol- Oxitocina | Algunos monos del Nuevo Mundo , musarañas arbóreas del norte |
| Cis-Tyr-Ile-Gln-Asn-Cys-Pro-Ile-Gly- NH2 | Mesotocina | La mayoría de los marsupiales, todas las aves , reptiles , anfibios , peces pulmonados , celacantos. |
| Cis-Tyr-Ile-Gln-Ser-Cys-Pro-Ile-Gly-NH 2 | Seritocina | Ranas |
| Cis-Tyr-Ile-Ser-Asn-Cys-Pro-Ile-Gly- NH2 | Isotocina | Peces óseos |
| Cis-Tyr-Ile-Ser-Asn-Cys-Pro-Gln-Gly- NH2 | Glumitocina | patines |
| Cis-Tyr-Ile-Asn/Gln-Asn-Cys-Pro-Leu/Val-Gly-NH 2 | Varias tocinas | Tiburones |
| Superfamilia VP/OT de invertebrados | ||
| Cis-Leu-Ile-Thr-Asn-Cys-Pro-Arg-Gly- NH2 | Inotocina | Langosta |
| Cis-Fe-Val-Arg-Asn-Cys-Pro-Thr-Gly- NH2 | Annetocina | Lombriz |
| Cis-Fe-Ile-Arg-Asn-Cys-Pro-Lys-Gly- NH2 | Lys-connopresina | Geografía y caracol cónico imperial , caracol de estanque , liebre marina , sanguijuela |
| Cis-Ile-Ile-Arg-Asn-Cys-Pro-Arg-Gly- NH2 | Arg-Connopresina | Caracol cono rayado |
| Cis-Tyr-Fe-Arg-Asn-Cys-Pro-Ile-Gly- NH2 | Cefalotocina | Pulpo |
| Cis-Fe-Trp-Thr-Ser-Cys-Pro-Ile-Gly- NH2 | Octopresina | Pulpo |
| †La vasotocina es el progenitor evolutivo de todas las hormonas neurohipofisarias de los vertebrados. [52] | ||
Uso médico
La vasopresina se utiliza para controlar la deficiencia de hormona antidiurética. La vasopresina se utiliza para tratar la diabetes insípida relacionada con niveles bajos de hormona antidiurética. Está disponible como Pressyn. [53]
La vasopresina tiene usos no aprobados y se utiliza en el tratamiento del shock vasodilatador, sangrado gastrointestinal, taquicardia ventricular y fibrilación ventricular.
Los agonistas de la vasopresina se utilizan terapéuticamente en diversas afecciones, y su análogo sintético de acción prolongada , la desmopresina, se utiliza en afecciones que presentan una baja secreción de vasopresina, así como para el control del sangrado (en algunas formas de la enfermedad de von Willebrand y en la hemofilia A leve ) y en casos extremos de enuresis en niños. La terlipresina y análogos relacionados se utilizan como vasoconstrictores en ciertas afecciones. El uso de análogos de la vasopresina para las varices esofágicas comenzó en 1970. [54]
Las infusiones de vasopresina también se utilizan como terapia de segunda línea para pacientes con shock séptico que no responden a la reanimación con líquidos o infusiones de catecolaminas (p. ej., dopamina o norepinefrina ) para aumentar la presión arterial mientras se ahorra el uso de catecolaminas. Estas argipresinas tienen una vida media de eliminación mucho más corta (alrededor de 20 minutos) en comparación con las vasopresinas sintéticas no argininas con una vida media de eliminación mucho más larga de muchas horas. Además, las argipresinas actúan sobre los receptores V1a, V1b y V2, lo que en consecuencia conduce a una mayor TFGe y una menor resistencia vascular en los pulmones. Actualmente, varias vasopresinas argininas inyectables se encuentran en uso clínico en los Estados Unidos y en Europa.
Farmacocinética
La vasopresina se administra a través de un dispositivo intravenoso , inyección intramuscular o inyección subcutánea . La duración de la acción depende del modo de administración y varía de treinta minutos a dos horas. Tiene una vida media de diez a veinte minutos. Se distribuye ampliamente por todo el cuerpo y permanece en el líquido extracelular . Se degrada por el hígado y se excreta a través de los riñones . [53] Las vasopresinas argininas para uso en choque séptico están destinadas solo para uso intravenoso.
Efectos secundarios
Los efectos secundarios más frecuentes durante el tratamiento con vasopresina son mareos , angina de pecho, dolor torácico, calambres abdominales, ardor de estómago , náuseas , vómitos , temblores, fiebre , intoxicación hídrica , sensación de palpitaciones en la cabeza, diarrea , sudoración, palidez y flatulencia . Las reacciones adversas más graves son el infarto de miocardio y la hipersensibilidad . [53]
Contraindicaciones
El uso de vasopresina lisina está contraindicado en presencia de hipersensibilidad a las proteínas de carne de res o de cerdo, aumento de BUN e insuficiencia renal crónica . Se recomienda su uso con precaución en casos de poliuria perioperatoria , sensibilidad al fármaco, asma, convulsiones, insuficiencia cardíaca, estado comatoso, migrañas y enfermedad cardiovascular. [53]
Interacciones
- alcohol - puede disminuir el efecto antidiurético
- La carbamazepina , la cloropropamida , el clofibrato , los antidepresivos tricíclicos y la fludrocortisona pueden aumentar el efecto diurético.
- El litio , la demeclociclina , la heparina o la noradrenalina pueden reducir el efecto antidiurético.
- El efecto vasopresor puede ser mayor con el uso simultáneo de medicamentos bloqueadores ganglionares [53]
Deficiencia
La disminución de la liberación de AVP (neurogénica, es decir, debido a intoxicación alcohólica o tumor) o la disminución de la sensibilidad renal a la AVP (nefrogénica, es decir, por mutación del receptor V2 o AQP) conduce a diabetes insípida , una afección que se caracteriza por hipernatremia (aumento de la concentración de sodio en sangre ), poliuria (producción excesiva de orina) y polidipsia (sed).
Exceso
El síndrome de secreción inadecuada de hormona antidiurética (SIADH) a su vez puede ser causado por una serie de problemas. Algunas formas de cáncer pueden causar SIADH, en particular el carcinoma de pulmón de células pequeñas, pero también una serie de otros tumores. Una variedad de enfermedades que afectan al cerebro o al pulmón (infecciones, hemorragias) pueden ser la causa del SIADH. Una serie de medicamentos se han asociado con el SIADH, como ciertos antidepresivos ( inhibidores de la recaptación de serotonina y antidepresivos tricíclicos ), el anticonvulsivo carbamazepina , la oxitocina (utilizada para inducir y estimular el parto) y el fármaco de quimioterapia vincristina . También se ha asociado con las fluoroquinolonas (incluidas la ciprofloxacina y la moxifloxacina ). [9] Finalmente, puede ocurrir sin una explicación clara. [55] La hiponatremia se puede tratar farmacéuticamente mediante el uso de antagonistas del receptor de vasopresina . [55]
Historia
La vasopresina fue dilucidada y sintetizada por primera vez por Vincent du Vigneaud .
Estudios en animales
La evidencia de un efecto de la AVP sobre la monogamia frente a la poligamia proviene de estudios experimentales en varias especies, que indican que la distribución precisa de vasopresina y receptores de vasopresina en el cerebro está asociada con patrones típicos de la especie de comportamiento social. En particular, existen diferencias consistentes entre especies monógamas y polígamas en la distribución de receptores de AVP, y a veces en la distribución de axones que contienen vasopresina, incluso cuando se comparan especies estrechamente relacionadas. [56]
Estudios humanos
Se ha demostrado que la vasopresina tiene efectos nootrópicos sobre la percepción del dolor y la función cognitiva. [57] La vasopresina también desempeña un papel en el autismo , el trastorno depresivo mayor , el trastorno bipolar y la esquizofrenia . [58]
Véase también
- Síndrome de secreción inadecuada de hormona antidiurética (SIADH)
- Oxitocina
- Receptor de vasopresina
- Antagonistas del receptor de vasopresina
- Copeptina
- Pituitaria anterior
- Hipotálamo
- Péptido natriurético auricular : cuando la aurícula se estira, se considera que la presión arterial aumenta y se excreta sodio para reducir la presión arterial.
- Sistema renina-angiotensina : Cuando el flujo sanguíneo a través del aparato yuxtaglomerular disminuye, la presión arterial se considera baja y la corteza suprarrenal secreta aldosterona para aumentar la reabsorción de sodio en el conducto colector, aumentando así la presión arterial.
- Reflejo de Bainbridge : en respuesta al estiramiento de la pared de la aurícula derecha, la frecuencia cardíaca aumenta, lo que reduce la presión arterial venosa.
- Barorreflejo : Cuando los receptores de estiramiento en el arco aórtico y el seno carotídeo aumentan, se considera que la presión arterial está elevada y la frecuencia cardíaca disminuye hasta reducir la presión arterial.
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000101200 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000037727 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ Anderson DA (2012). Diccionario médico ilustrado de Dorland (32.ª edición). Elsevier. ISBN 978-1-4160-6257-8.
- ^ Sukhov RR, Walker LC, Rance NE, Price DL, Young WS 3rd (1993). "Expresión génica de vasopresina y oxitocina en el hipotálamo humano". Revista de neurología comparada . 337 (2): 295–306. doi :10.1002/cne.903370210. PMC 9883978 . PMID 8277003. S2CID 35174328.
- ^ Marieb E (2014). Anatomía y fisiología . Glenview, IL: Pearson Education, Inc. ISBN 978-0-321-86158-0.
- ^ Caldwell HK, Young WS III (2006). "Oxitocina y vasopresina: implicaciones genéticas y conductuales" (PDF) . En Lajtha A, Lim R (eds.). Manual de neuroquímica y neurobiología molecular: proteínas y péptidos neuroactivos (3.ª ed.). Berlín: Springer. págs. 573–607. ISBN 978-0-387-30348-2.
- ^ abc Babar SM (octubre de 2013). "SIADH asociado con ciprofloxacino". Anales de farmacoterapia . 47 (10): 1359–63. doi :10.1177/1060028013502457. PMID 24259701. S2CID 36759747.
- ^ Insel TR (marzo de 2010). "El desafío de la traducción en la neurociencia social: una revisión de la oxitocina, la vasopresina y el comportamiento afiliativo". Neuron . 65 (6): 768–79. doi :10.1016/j.neuron.2010.03.005. PMC 2847497 . PMID 20346754.
- ^ Costa A, Rossi E, Scicchitano BM, Coletti D, Moresi V, Adamo S (septiembre de 2014). "Hormonas neurohipofisarias: nuevos actores del desarrollo y la homeostasis del músculo estriado". revisión. Revista Europea de Miología Traslacional . 24 (3): 3790. doi :10.4081/bam.2014.3.217. PMC 4756744 . PMID 26913138.
- ^ Cuzzo B, Padala SA, Lappin SL (2024). "Fisiología, vasopresina". StatPearls . StatPearls Publishing. PMID 30252325.
- ^ Lim MM, Young LJ (2004). "Circuitos neuronales dependientes de vasopresina que subyacen a la formación de vínculos de pareja en el ratón de pradera monógamo". Neurociencia . 125 (1): 35–45. doi :10.1016/j.neuroscience.2003.12.008. PMID 15051143. S2CID 16210017.
- ^ Chapman IM, Profesor de Medicina, Disciplina de Medicina, Universidad de Adelaida, Royal Adelaide Hospital. "Diabetes insípida central". MSD . Merck & Co. Inc.
- ^ Boron WR, Boulpaep EL (5 de mayo de 2016). Fisiología médica (tercera edición). Filadelfia, PA: Elsevier. ISBN 978-1-4557-4377-3.OCLC 951680737 .
- ^ Wilson JL, Miranda CA, Knepper MA (2013). "Vasopresina y regulación de la acuaporina-2". Nefrología clínica y experimental . 17 (6): 10.1007/s10157-013–0789-5. doi :10.1007/s10157-013-0789-5. PMC 3775849 . PMID 23584881.
- ^ Sands JM, Blount MA, Klein JD (2011). "Regulación del transporte renal de urea por vasopresina". Transacciones de la Asociación Clínica y Climatológica Estadounidense . 122 : 82–92. PMC 3116377. PMID 21686211 .
- ^ Knepper MA, Kim GH, Fernández-Llama P, Ecelbarger CA (marzo de 1999). "Regulación del transporte de rama ascendente gruesa por vasopresina". Revista de la Sociedad Americana de Nefrología . 10 (3): 628–34. doi : 10.1681/ASN.V103628 . PMID 10073614.
- ^ Rieg T, Tang T, Uchida S, Hammond HK, Fenton RA, Vallon V (enero de 2013). "La adenilil ciclasa 6 mejora la expresión de NKCC2 y media la fosforilación inducida por vasopresina de NKCC2 y NCC". Am. J. Pathol . 182 (1): 96–106. doi :10.1016/j.ajpath.2012.09.014. PMC 3532715. PMID 23123217 .
- ^ Ares GR, Caceres PS, Ortiz PA (diciembre de 2011). "Regulación molecular de NKCC2 en la rama ascendente gruesa". Am. J. Physiol. Renal Physiol . 301 (6): F1143–59. doi :10.1152/ajprenal.00396.2011. PMC 3233874. PMID 21900458 .
- ^ Forsling ML, Montgomery H, Halpin D, Windle RJ, Treacher DF (mayo de 1998). "Patrones diarios de secreción de hormonas neurohipofisarias en el hombre: efecto de la edad". Fisiología experimental . 83 (3): 409–18. doi : 10.1113/expphysiol.1998.sp004124 . PMID 9639350. S2CID 2295415.
- ^ Magtanong E (2017). "¿Qué son las náuseas? Un análisis histórico de las opiniones cambiantes". Auton Neurosci . 202 : 5–17. doi :10.1016/j.autneu.2016.07.003. PMC 5203950 . PMID 27450627.
- ^ Wiltshire T, Maixner W, Diatchenko L (diciembre de 2011). "Relájate, no sentirás el dolor". Nature Neuroscience . 14 (12): 1496–7. doi :10.1038/nn.2987. PMID 22119947. S2CID 205434100.
- ^ Dunlap JC (enero de 1999). "Bases moleculares de los relojes circadianos". Cell . 96 (2): 271–90. doi : 10.1016/s0092-8674(00)80566-8 . PMID 9988221. S2CID 14991100.
- ^ Jin X, Shearman LP, Weaver DR, Zylka MJ, de Vries GJ, Reppert SM (enero de 1999). "Un mecanismo molecular que regula la salida rítmica del reloj circadiano supraquiasmático". Cell . 96 (1): 57–68. doi : 10.1016/s0092-8674(00)80959-9 . PMID 9989497. S2CID 6916996.
- ^ Wang XM, Dayanithi G, Lemos JR, Nordmann JJ, Treistman SN (noviembre de 1991). "Las corrientes de calcio y la liberación de péptidos de las terminales neurohipofisarias son inhibidas por el etanol". The Journal of Pharmacology and Experimental Therapeutics . 259 (2): 705–11. PMID 1941619.
- ^ ab Matsukawa T, Miyamoto T (marzo de 2011). "La secreción de vasopresina arginina estimulada por angiotensina II es inhibida por el péptido natriurético auricular en humanos". American Journal of Physiology. Fisiología reguladora, integradora y comparativa . 300 (3): R624–9. doi :10.1152/ajpregu.00324.2010. PMID 21123762.
- ^ Collège des enseignants d'endocrinologie, diabète et maladie (30 de enero de 2012). Endocrinología, diabétología y enfermedades metabólicas . Elsevier Masson. ISBN 978-2-294-72233-2.
- ^ Garrahy A, Thompston CJ (2019). "Principios generales, diabetes, metabolismo, obesidad, hormonas gastrointestinales, envejecimiento, toxicología endocrina". Enciclopedia de enfermedades endocrinas . 1 (2): 969–974.
- ^ Salata RA, Jarrett DB, Verbalis JG, Robinson AG (marzo de 1988). "Estimulación de la hormona adrenocorticotropina (ACTH) por vasopresina en humanos. Bioensayo in vivo del factor liberador de corticotropina (CRF) que proporciona evidencia de la mediación del CRF en el ritmo diurno de ACTH". The Journal of Clinical Investigation . 81 (3): 766–74. doi :10.1172/JCI113382. PMC 442524 . PMID 2830315.
- ^ Day TA, Sibbald JR (junio de 1990). "Los estímulos somáticos nocivos excitan las células neurosecretoras de vasopresina a través del grupo de células A1". The American Journal of Physiology . 258 (6 Pt 2): R1516-20. doi :10.1152/ajpregu.1990.258.6.R1516. PMID 2360697.
- ^ Höglund OV, Hagman R, Olsson K, Olsson U, Lagerstedt AS (octubre de 2014). "Cambios intraoperatorios en la presión arterial, frecuencia cardíaca, vasopresina plasmática y noradrenalina urinaria durante la ovariohisterectomía electiva en perros: repetibilidad en la extirpación del primer y segundo ovario". Cirugía veterinaria . 43 (7): 852–9. doi :10.1111/j.1532-950X.2014.12264.x. PMID 25130060.
- ^ Goldmann A, Hoehne C, Fritz GA, Unger J, Ahlers O, Nachtigall I, et al. (septiembre de 2008). "Anestesia combinada vs. anestesia con isoflurano/fentanilo para cirugía abdominal mayor: efectos sobre las hormonas y la hemodinámica". Medical Science Monitor . 14 (9): CR445-52. PMID 18758414.
- ^ Furuya K, Shimizu R, Hirabayashi Y, Ishii R, Fukuda H (mayo de 1993). "Respuestas de la hormona del estrés a la cirugía intraabdominal mayor durante e inmediatamente después de la anestesia con óxido nitroso y sevoflurano en pacientes ancianos". Revista Canadiense de Anestesia . 40 (5 Pt 1): 435–9. doi : 10.1007/BF03009513 . PMID 8390330.
- ^ Haas M, Glick SM (mayo de 1978). "Vasopresina plasmática radioinmunoensayable asociada con cirugía". Archivos de Cirugía . 113 (5): 597–600. doi :10.1001/archsurg.1978.01370170059011. PMID 646620.
- ^ Nussey SS, Page SR, Ang VT, Jenkins JS (marzo de 1988). "La respuesta de la oxitocina plasmática al estrés quirúrgico". Endocrinología clínica . 28 (3): 277–82. doi :10.1111/j.1365-2265.1988.tb01213.x. PMID 3168310. S2CID 37668345.
- ^ Melville RJ, Forsling ML, Frizis HI, LeQuesne LP (diciembre de 1985). "Estímulo para la liberación de vasopresina durante operaciones intraabdominales electivas". The British Journal of Surgery . 72 (12): 979–82. doi :10.1002/bjs.1800721215. PMID 4084755. S2CID 43764321.
- ^ Moran WH, Miltenberger FW, Shuayb WA, Zimmermann B (julio de 1964). "La relación entre la secreción de la hormona antidiurética y el estrés quirúrgico". Surgery . 56 : 99–108. PMID 14175989.
- ^ Gutt CN, Oniu T, Mehrabi A, Schemmer P, Kashfi A, Kraus T, et al. (2004). "Complicaciones circulatorias y respiratorias de la insuflación de dióxido de carbono". Cirugía digestiva . 21 (2): 95–105. doi : 10.1159/000077038 . PMID: 15010588. S2CID: 3369276. ProQuest : 223606053.
- ^ Nguyen NT, Wolfe BM (febrero de 2005). "Los efectos fisiológicos del neumoperitoneo en los obesos mórbidos". Anales de Cirugía . 241 (2): 219–226. doi :10.1097/01.sla.0000151791.93571.70. PMC 1356906 . PMID 15650630.
- ^ Alberts B, Bray D, Hopkin K, Johnson AD, Lewis J, Roberts K (2014). Biología celular esencial . Garland Science. ISBN 978-0-8153-4455-1.
- ^ Bielsky IF, Hu SB, Szegda KL, Westphal H, Young LJ (marzo de 2004). "Deterioro profundo en el reconocimiento social y reducción de la conducta ansiosa en ratones knock out del receptor de vasopresina V1a". Neuropsicofarmacología . 29 (3): 483–93. doi : 10.1038/sj.npp.1300360 . PMID 14647484.
- ^ Wersinger SR, Caldwell HK, Martinez L, Gold P, Hu SB, Young WS (agosto de 2007). "Los ratones knock out del receptor de vasopresina 1a tienen un déficit olfativo sutil pero una agresividad normal". Genes, cerebro y comportamiento . 6 (6): 540–51. doi : 10.1111/j.1601-183X.2006.00281.x . PMID 17083331. S2CID 29923520.
- ^ Lolait SJ, Stewart LQ, Jessop DS, Young WS, O'Carroll AM (febrero de 2007). "La respuesta del eje hipotálamo-hipofisario-adrenal al estrés en ratones que carecen de receptores de vasopresina V1b funcionales". Endocrinología . 148 (2): 849–56. doi :10.1210/en.2006-1309. PMC 2040022 . PMID 17122081.
- ^ Wersinger SR, Kelliher KR, Zufall F, Lolait SJ, O'Carroll AM, Young WS (diciembre de 2004). "La motivación social se reduce en ratones sin receptor de vasopresina 1b a pesar de un rendimiento normal en una tarea de discriminación olfativa". Hormones and Behavior . 46 (5): 638–45. doi :10.1016/j.yhbeh.2004.07.004. PMID 15555506. S2CID 38444963.
- ^ Kanwar S, Woodman RC, Poon MC, Murohara T, Lefer AM, Davenpeck KL, et al. (octubre de 1995). "La desmopresina induce la expresión de P-selectina endotelial y el rodamiento leucocitario en las vénulas poscapilares". Blood . 86 (7): 2760–6. doi : 10.1182/blood.V86.7.2760.2760 . PMID 7545469.
- ^ Kaufmann JE, Oksche A, Wollheim CB, Günther G, Rosenthal W, Vischer UM (julio de 2000). "La secreción del factor von Willebrand inducida por vasopresina de las células endoteliales implica receptores V2 y AMPc". The Journal of Clinical Investigation . 106 (1): 107–16. doi :10.1172/JCI9516. PMC 314363 . PMID 10880054.
- ^ Burtis CA, Ashwood ER, Bruns DE (2012). Tietz Textbook of Clinical Chemistry and Molecular Diagnostics (5.ª ed.). Elsevier Health Sciences . pág. 1833. ISBN 978-1-4557-5942-2.
- ^ Donaldson D (1994). "Poliuria y trastornos de la sed". En Williams DL, Marks V (eds.). Fundamentos científicos de la bioquímica en la práctica clínica (2.ª ed.). Butterworth-Heinemann . págs. 76–102. doi :10.1016/B978-0-7506-0167-2.50010-8. ISBN 978-0-7506-0167-2.
- ^ Li C, Wang W, Summer SN, Westfall TD, Brooks DP, Falk S, et al. (febrero de 2008). "Mecanismos moleculares del efecto antidiurético de la oxitocina". Revista de la Sociedad Americana de Nefrología . 19 (2): 225–32. doi :10.1681/ASN.2007010029. PMC 2396735 . PMID 18057218.
- ^ Joo KW, Jeon US, Kim GH, Park J, Oh YK, Kim YS, et al. (octubre de 2004). "La acción antidiurética de la oxitocina se asocia con una mayor excreción urinaria de acuaporina-2". Nefrología, diálisis, trasplante . 19 (10): 2480–6. doi :10.1093/ndt/gfh413. PMID 15280526.
- ^ Acher R, Chauvet J (julio de 1995). "La cascada reguladora endocrina neurohipofisaria: precursores, mediadores, receptores y efectores". Frontiers in Neuroendocrinology . 16 (3): 237–89. doi :10.1006/frne.1995.1009. PMID 7556852. S2CID 12739464.
- ^ abcde "Vasopresina" (PDF) . Compañía FA Davis. 2017 . Consultado el 13 de marzo de 2017 .[ enlace muerto ]
- ^ Baum S, Nusbaum M (marzo de 1971). "El control de la hemorragia gastrointestinal mediante infusión arterial mesentérica selectiva de vasopresina". Radiología . 98 (3): 497–505. doi :10.1148/98.3.497. PMID 5101576.
- ^ ab Verbalis JG, Goldsmith SR, Greenberg A, Schrier RW, Sterns RH (noviembre de 2007). "Pautas para el tratamiento de la hiponatremia 2007: recomendaciones del panel de expertos". The American Journal of Medicine . 120 (11 Suppl 1): S1–21. CiteSeerX 10.1.1.499.7585 . doi :10.1016/j.amjmed.2007.09.001. PMID 17981159.
- ^ Young LJ (octubre de 2009). "La neuroendocrinología del cerebro social". Frontiers in Neuroendocrinology . 30 (4): 425–8. doi :10.1016/j.yfrne.2009.06.002. PMID 19596026. S2CID 31960688.
- ^ Mavani GP, DeVita MV, Michelis MF (2015). "Una revisión de las acciones no presoras y no antidiuréticas de la hormona vasopresina". Frontiers in Medicine . 2 : 19. doi : 10.3389/fmed.2015.00019 . PMC 4371647 . PMID 25853137.
- ^ Iovino M, Messana T, De Pergola G, Iovino E, Dicuonzo F, Guastamacchia E, et al. (2018). "El papel de las hormonas neurohipofisarias vasopresina y oxitocina en los trastornos neuropsiquiátricos". Objetivos farmacológicos para los trastornos endocrinos, metabólicos e inmunitarios . 18 (4): 341–347. doi :10.2174/1871530318666180220104900. PMID 29468985. S2CID 3465601.
Lectura adicional
- Rector FC, Brenner BM (2004). Brenner & Rector's the Kidney (7.ª ed.). Filadelfia: Saunders. ISBN 978-0-7216-0164-9Archivado desde el original el 3 de marzo de 2016. Consultado el 8 de diciembre de 2008 .