Leptospirosis
| Leptospirosis | |
|---|---|
| Otros nombres | Fiebre de las ratas, [1] fiebre de campo, [2] fiebre amarilla del cazador de ratas, [3] fiebre pretibial [4] |
 | |
| Leptospira aumentada 200 veces con un microscopio de campo oscuro | |
| Especialidad | Enfermedad infecciosa |
| Síntomas | Ninguno, dolores de cabeza , dolores musculares , fiebre [5] |
| Complicaciones | Sangrado de los pulmones , meningitis , insuficiencia renal [5] [6] |
| Inicio habitual | De una a dos semanas [7] |
| Causas | La leptospira se propaga generalmente por roedores [8] |
| Factores de riesgo | Exposición a animales infectados, especialmente a su orina, o a agua dulce o suelo húmedo contaminado con orina infecciosa [8] |
| Método de diagnóstico | Análisis de sangre para detectar anticuerpos contra la bacteria o su ADN [5] |
| Diagnóstico diferencial | Malaria , fiebre entérica , rickettsiosis , dengue [9] |
| Prevención | Equipo de protección personal , medidas de higiene, doxiciclina [7] |
| Tratamiento | Doxiciclina , penicilina , ceftriaxona [8] |
| Pronóstico | Riesgo de muerte ~7,5% [10] |
| Frecuencia | Un millón de personas al año [7] [11] |
| Fallecidos | 58.900 al año [11] |
La leptospirosis es una infección de la sangre causada por la bacteria Leptospira [8] que puede infectar a humanos, perros, roedores y muchos otros animales salvajes y domésticos. [8] Los signos y síntomas pueden variar desde ninguno a leve ( dolores de cabeza , dolores musculares y fiebre ) a severos ( hemorragia en los pulmones o meningitis ). [5] La enfermedad de Weil ( / ˈv aɪ l z / VILES ), [12] la forma aguda y grave de leptospirosis, hace que el individuo infectado presente ictericia ( la piel y los ojos se vuelven amarillos), desarrolle insuficiencia renal y sangre. [6] El sangrado de los pulmones asociado con la leptospirosis se conoce como síndrome de hemorragia pulmonar grave . [5]
Más de diez tipos genéticos de Leptospira causan enfermedades en los humanos. [13] Tanto los animales salvajes como los domésticos pueden transmitir la enfermedad, más comúnmente los roedores. [8] La bacteria se transmite a los humanos a través de la orina o las heces de los animales , o el agua o el suelo contaminados con orina y heces de animales, que entran en contacto con los ojos, la boca, la nariz o las heridas en la piel. [8] En los países en desarrollo, la enfermedad se presenta con mayor frecuencia en el control de plagas, los agricultores y las personas de bajos ingresos que viven en áreas con malas condiciones sanitarias. [5] En los países desarrollados, se presenta durante fuertes lluvias y es un riesgo para los controladores de plagas, los trabajadores de aguas residuales [14] y los que participan en actividades al aire libre en áreas cálidas y húmedas. [5] El diagnóstico se realiza típicamente mediante la prueba de anticuerpos contra la bacteria o encontrando ADN bacteriano en la sangre. [5]
Las medidas para prevenir la enfermedad incluyen el uso de equipo de protección para bloquear el contacto cuando se trabaja con animales potencialmente infectados, el lavado después del contacto y la reducción de roedores en áreas donde la gente vive y trabaja. [7] El antibiótico doxiciclina es eficaz para prevenir la infección por leptospirosis. [7] Las vacunas humanas tienen una utilidad limitada; [15] las vacunas para otros animales están más ampliamente disponibles. [16] El tratamiento cuando se está infectado es con antibióticos como doxiciclina, penicilina o ceftriaxona . [8] El riesgo general de muerte es del 5 al 10%. [10] Sin embargo, cuando los pulmones están involucrados, el riesgo de muerte aumenta al rango del 50 al 70%. [8]
Se estima que cada año se producen un millón de casos graves de leptospirosis en humanos, que causan alrededor de 58.900 muertes. [11] La enfermedad es más común en las zonas tropicales del mundo, pero puede ocurrir en cualquier lugar. [7] Los brotes pueden surgir después de fuertes lluvias. [7] La enfermedad fue descrita por primera vez por el médico Adolf Weil en 1886 en Alemania. [17] [18] Los animales infectados pueden no presentar síntomas, o presentar síntomas leves o graves. [19] Estos pueden variar según el tipo de animal. [16] [19] En algunos animales , la Leptospira vive en el tracto reproductivo, lo que lleva a la transmisión durante el apareamiento. [16]
Signos y síntomas


Los síntomas de la leptospirosis suelen aparecer una o dos semanas después de la infección, [7] pero el período de incubación puede durar hasta un mes. [21] La enfermedad es bifásica en la mayoría de los casos sintomáticos. Los síntomas de la primera fase (fase aguda o leptospirémica) duran de cinco a siete días. En la segunda fase (fase inmunitaria), los síntomas se resuelven a medida que se producen anticuerpos contra la bacteria. [8] En la segunda fase se desarrollan síntomas adicionales. [22] Las fases de la enfermedad pueden no estar diferenciadas, especialmente en pacientes con enfermedad grave. [23] El 90% de los infectados experimentan síntomas leves, mientras que el 10% padece leptospirosis grave. [24]
La infección por leptospira en humanos causa una variedad de síntomas , aunque algunas personas infectadas pueden no tener ninguno. La enfermedad comienza repentinamente con fiebre acompañada de escalofríos, dolor de cabeza intenso, dolores musculares severos y dolor abdominal. [5] [21] Un dolor de cabeza provocado por leptospirosis causa dolor punzante y se localiza característicamente en las regiones temporal o frontal bilateral de la cabeza . La persona también puede tener dolor detrás de los ojos y sensibilidad a la luz . El dolor muscular generalmente involucra el músculo de la pantorrilla y la espalda baja. El rasgo más característico de la leptospirosis es la sufusión conjuntival ( conjuntivitis sin exudado ) que rara vez se encuentra en otras enfermedades febriles . Otros hallazgos característicos en el ojo incluyen sangrado subconjuntival e ictericia . Rara vez se encuentra una erupción en la leptospirosis. Cuando se encuentra una, se deben considerar diagnósticos alternativos como la fiebre del dengue y la fiebre chikungunya . La tos seca se observa en el 20-57% de las personas con leptospirosis. Por lo tanto, esta característica clínica puede inducir a error al médico a diagnosticar la enfermedad como una enfermedad respiratoria. Además, con frecuencia se presentan síntomas gastrointestinales como náuseas , vómitos, dolor abdominal y diarrea. Los vómitos y la diarrea pueden contribuir a la deshidratación . El dolor abdominal puede deberse a una colecistitis alitiásica o a una inflamación del páncreas . [21] En raras ocasiones, los ganglios linfáticos , el hígado y el bazo pueden estar agrandados y ser palpables. [8]
Los síntomas se resolverán en uno a tres días. [7] Después de esto, comienza la fase inmunitaria, que puede durar de cuatro a 30 días y puede incluir complicaciones en el cerebro o en los riñones. [25] El sello distintivo de la segunda fase es la inflamación de las membranas que cubren el cerebro . [7] Los signos y síntomas de la meningitis incluyen dolor de cabeza intenso y rigidez del cuello. [7] La afectación renal se asocia con una producción de orina reducida o ausente. [7]
La forma clásica de leptospirosis grave, conocida como enfermedad de Weil, se caracteriza por daño hepático (que causa ictericia), insuficiencia renal y hemorragia, que ocurre en el 5-10% de los infectados. [7] También puede ocurrir daño pulmonar y cerebral. Para aquellos con signos de inflamación de las membranas que cubren el cerebro y el cerebro mismo , puede ocurrir un nivel alterado de conciencia . Una variedad de problemas neurológicos como parálisis de la mitad del cuerpo , inflamación completa de toda una sección horizontal de la médula espinal y síndrome de Guillain-Barré son las complicaciones. También se pueden encontrar signos de sangrado como petequias , equimosis , sangrado nasal , heces negruzcas debido al sangrado en el estómago , vómitos con sangre y sangrado de los pulmones . La prolongación del tiempo de protrombina en las pruebas de coagulación se asocia con una manifestación de sangrado grave. Sin embargo, el recuento bajo de plaquetas no se asocia con sangrado grave. [21] La hemorragia pulmonar es una hemorragia alveolar (sangrado en los alvéolos de los pulmones) que produce tos masiva con sangre y causa síndrome de dificultad respiratoria aguda , en el que el riesgo de muerte es superior al 50%. [21] En raras ocasiones, pueden producirse inflamación de los músculos del corazón , inflamación de las membranas que cubren el corazón , anomalías en el marcapasos natural del corazón y ritmos cardíacos anormales . [8]
Causa
Bacteria
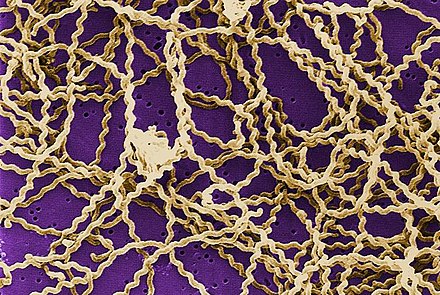
La leptospirosis es causada por bacterias espiroquetas que pertenecen al género Leptospira , que son aeróbicas , [8] helicoidales dextrógiras , [13] y de 6 a 20 micrómetros de largo. [7] Al igual que las bacterias Gram-negativas , Leptospira tiene una membrana externa tachonada con lipopolisacárido (LPS) en la superficie, una membrana interna y una capa de pared celular de peptidoglicano . Sin embargo, a diferencia de las bacterias Gram-negativas, la capa de peptidoglicano en Leptospira se encuentra más cerca de la membrana interna que de la externa. Esto da como resultado una membrana externa fluida asociada vagamente con la pared celular. [26] Además, Leptospira tiene un flagelo ubicado en el periplasma , asociado con el movimiento estilo sacacorchos. [7] Los quimiorreceptores en los polos de las bacterias detectan varios sustratos y cambian la dirección de su movimiento. [13] Las bacterias se visualizan tradicionalmente utilizando microscopía de campo oscuro sin tinción. [7]
Se han identificado un total de 66 especies de Leptospira . Según su secuencia genómica, se dividen en dos clados y cuatro subclados: P1, P2, S1 y S2. [27] Los 19 miembros del subclado P1 incluyen las 8 especies que pueden causar enfermedades graves en humanos: L. alexanderi , L. borgpetersenii , L. interrogans , L. kirschneri , L. mayottensis , L. noguchii , L. santarosai y L. weilii . [13] [27] El clado P2 comprende 21 especies que pueden causar enfermedades leves en humanos. Las 26 especies restantes comprenden los subclados S1 y S2, que incluyen "saprófitos" conocidos por consumir materia en descomposición ( nutrición saprotrófica ). [27] Las Leptospira patógenas no se multiplican en el medio ambiente. La leptospira necesita una humedad elevada para sobrevivir, pero puede permanecer viva en entornos como agua estancada o suelo contaminado. La bacteria puede morir a temperaturas de 50 °C (122 °F) y puede inactivarse con etanol al 70 %, hipoclorito de sodio al 1 % , formaldehído , detergentes y ácidos. [28]
Las leptospiras también se clasifican en función de su serovar . La diversa composición de azúcar del lipopolisacárido en la superficie de las bacterias es responsable de la diferencia antigénica entre los serovares. [13] Se reconocen alrededor de 300 serovares patógenos de Leptospira . Los serovares antigénicamente relacionados (que pertenecen al mismo serogrupo) pueden pertenecer a diferentes especies debido a la transferencia horizontal de genes biosintéticos de LPS entre diferentes especies. Actualmente, la prueba de absorción de aglutinación cruzada y la hibridación ADN-ADN se utilizan para clasificar las especies de Leptospira , pero requieren mucho tiempo. Por lo tanto, la secuenciación genómica total podría reemplazar potencialmente estos dos métodos como el nuevo estándar de oro para clasificar las especies de Leptospira . [13]
Transmisión

Las bacterias se pueden encontrar en estanques, ríos, charcos, alcantarillas, campos agrícolas y suelo húmedo. [7] Se han encontrado leptospiras patógenas en forma de biopelículas acuáticas , que pueden ayudar a la supervivencia en el medio ambiente. [29]
El número de casos de leptospirosis está directamente relacionado con la cantidad de lluvia, lo que hace que la enfermedad sea estacional en climas templados y durante todo el año en climas tropicales. [7] El riesgo de contraer leptospirosis depende del riesgo de transmisión de la enfermedad en la comunidad y de la frecuencia de exposición. [21] En las zonas rurales, la agricultura y la ganadería son los principales factores de riesgo para contraer leptospirosis. [5] La vivienda deficiente y el saneamiento inadecuado también aumentan el riesgo de infección. [21] En las zonas tropicales y semitropicales, la enfermedad a menudo se propaga después de fuertes lluvias o después de inundaciones. [7]
Las leptospiras se encuentran principalmente en mamíferos. [5] Sin embargo, se ha demostrado que los reptiles y los animales de sangre fría como ranas, serpientes, tortugas y sapos tienen la infección. [16] Se desconoce si existen reservorios de infección humana. [21] [16] Las ratas, ratones y topos son huéspedes primarios importantes , pero otros mamíferos, incluidos perros, ciervos, conejos, erizos, vacas, ovejas, cerdos, mapaches, zarigüeyas y zorrillos, también pueden transmitir la enfermedad. [16] En África, se han identificado varios huéspedes silvestres como portadores, entre ellos la mangosta rayada , el zorro egipcio , el ciervo ruso y las musarañas . [30] Existen varios mecanismos por los cuales los animales pueden infectarse entre sí. Los perros pueden lamer la orina de un animal infectado de la hierba o el suelo , o beber de un charco infectado. Los perros domésticos que no pueden salir de casa han contraído leptospirosis, aparentemente por lamer la orina de ratones infectados en la casa. [31] La leptospirosis también puede transmitirse a través del semen de animales infectados. [16] La presencia constante de bacterias en la orina de los animales puede durar años. [16]
Los humanos son huéspedes accidentales de Leptospira . [5] Los humanos se infectan a través del contacto con agua o tierra húmeda que contiene orina y heces de animales infectados. [7] Las bacterias ingresan a través de cortes, abrasiones, [7] ingestión de alimentos contaminados o contacto con la membrana mucosa del cuerpo (por ejemplo, boca, nariz y ojos). [32] Las ocupaciones con riesgo de contraer leptospirosis incluyen agricultores, pescadores, recolectores de basura y trabajadores de aguas residuales. [5] La enfermedad también está relacionada con el turismo de aventura y las actividades recreativas. [5] Es común entre los entusiastas de los deportes acuáticos en áreas específicas, incluidos triatlones , rafting , piragüismo y natación, ya que la inmersión prolongada en el agua promueve la entrada de la bacteria. [5] Sin embargo, es poco probable que Leptospira penetre en la piel intacta. [8] No se sabe que la enfermedad se propague entre humanos, y la diseminación bacteriana en el período de recuperación es extremadamente rara en humanos. [8] Una vez que los humanos se infectan, la eliminación de bacterias de los riñones suele persistir hasta 60 días. [28]
En raras ocasiones, la leptospirosis puede transmitirse a través de un trasplante de órgano. [33] También es posible la infección a través de la placenta durante el embarazo. [34] [35] [36] Puede causar aborto espontáneo e infección en los bebés . [37] También se ha informado de la transmisión de leptospirosis a través del consumo de carne cruda de animales salvajes (por ejemplo, pacientes psiquiátricos con alotriofagia). [38]
Patogenesia

Cuando los animales ingieren las bacterias, estas circulan en el torrente sanguíneo y luego se alojan en los riñones a través de los capilares glomerulares o peritubulares . Las bacterias luego pasan a los lúmenes de los túbulos renales y colonizan el borde en cepillo y el túbulo contorneado proximal . Esto provoca la eliminación continua de bacterias en la orina sin que el animal experimente efectos nocivos significativos. Esta relación entre el animal y las bacterias se conoce como relación comensal y el animal se conoce como huésped reservorio . [21]
Los humanos son huéspedes accidentales de Leptospira . [5] La patogenia de la leptospirosis sigue siendo poco conocida a pesar de los esfuerzos de investigación. [7] [32] Las bacterias ingresan al cuerpo humano a través de brechas en la piel o la membrana mucosa, luego al torrente sanguíneo. Las bacterias luego se adhieren a las células endoteliales de los vasos sanguíneos y la matriz extracelular (red compleja de proteínas y carbohidratos presente entre las células). Las bacterias usan sus flagelos para moverse entre las capas celulares. Se unen a células como fibroblastos , macrófagos , células endoteliales y células epiteliales renales. También se unen a varias proteínas humanas como proteínas del complemento, trombina , fibrinógeno y plasminógeno usando proteínas de superficie similares a inmunoglobulinas (Lig) leptospirales como LigB y LipL32, cuyos genes se encuentran en todas las especies patógenas. [13] [32]
A través del sistema inmune innato , las células endoteliales de los capilares en el cuerpo humano se activan por la presencia de estas bacterias. Las células endoteliales producen citocinas y péptidos antimicrobianos contra las bacterias. Estos productos regulan la cascada de coagulación y los movimientos de los glóbulos blancos. [13] Los macrófagos presentes en los humanos son capaces de engullir Leptospira . Sin embargo, Leptospira puede residir y proliferar en la matriz citoplasmática después de ser ingerida por los macrófagos. [13] Las personas con leptospirosis grave pueden experimentar un alto nivel de citocinas como la interleucina 6 , el factor de necrosis tumoral alfa (TNF-α) y la interleucina 10. El alto nivel de citocinas causa síntomas similares a la sepsis que ponen en peligro la vida en lugar de ayudar a combatir la infección. [24] Se ha descubierto que quienes tienen un alto riesgo de sepsis durante una infección de leptospirosis tienen el genotipo HLA-DQ6 , posiblemente debido a la activación del superantígeno , que daña los órganos corporales. [21]
El LPS de Leptospira solo activa el receptor tipo Toll 2 (TLR2) en los monocitos de los seres humanos. La molécula de lípido A de la bacteria no es reconocida por los receptores TLR4 humanos . Por lo tanto, la falta de reconocimiento de Leptospira por los receptores TLR4 probablemente contribuya al proceso de la enfermedad de leptospirosis en los seres humanos. [13]
Aunque existen varios mecanismos en el cuerpo humano para luchar contra las bacterias, Leptospira está bien adaptada a una condición inflamatoria como esta creada por ella. En el torrente sanguíneo, puede activar el plasminógeno del huésped para convertirlo en plasmina que descompone la matriz extracelular, degrada los coágulos de fibrina y las proteínas complementarias ( C3b y C5 ) para evitar la opsonización . También puede reclutar reguladores del complemento como el factor H , la proteína de unión a C4b , la proteína de unión similar al factor H y la vitronectina para evitar la activación del complejo de ataque de membrana en su superficie. También secreta proteasas para degradar las proteínas del complemento como C3 . Puede unirse a la trombina que disminuye la formación de fibrina. La formación reducida de fibrina aumenta el riesgo de sangrado. [13] Leptospira también secreta esfingomielinasa y hemolisina que se dirigen a los glóbulos rojos. [7]
La leptospira se propaga rápidamente a todos los órganos a través del torrente sanguíneo. [13] Afectan principalmente al hígado. Invaden los espacios entre los hepatocitos , provocando apoptosis. Los hepatocitos dañados y las uniones intercelulares de los hepatocitos provocan fugas de bilis al torrente sanguíneo, lo que provoca niveles elevados de bilirrubina , lo que da lugar a ictericia. Se han descrito sinusoides hepáticos congestionados y espacios perisinusoidales . Mientras tanto, en los pulmones, se pueden encontrar petequias o sangrado franco en el tabique alveolar y los espacios entre los alvéolos. [21] La leptospira secreta toxinas que causan insuficiencia renal leve a grave o nefritis intersticial . [32] La insuficiencia renal puede recuperarse por completo o provocar atrofia y fibrosis . [21] En raras ocasiones, se encuentran inflamaciones de los músculos del corazón, las arterias coronarias y la aorta . [25]
Diagnóstico


Pruebas de laboratorio
En el caso de las personas infectadas, un hemograma completo puede mostrar un recuento elevado de glóbulos blancos y un recuento bajo de plaquetas. Cuando se presenta un recuento bajo de hemoglobina junto con un recuento bajo de glóbulos blancos y trombocitopenia , se debe considerar la supresión de la médula ósea . [21] La velocidad de sedimentación globular y la proteína C reactiva también pueden estar elevadas. [8]
Los riñones suelen estar implicados en la leptospirosis. Los niveles de urea y creatinina en sangre estarán elevados. La leptospirosis aumenta la excreción de potasio en la orina, lo que conduce a un nivel bajo de potasio [21] y un nivel bajo de sodio en la sangre. [8] [21] El análisis de orina puede revelar la presencia de proteínas , glóbulos blancos y hematuria microscópica . [8] Debido a que las bacterias se asientan en los riñones, los cultivos de orina serán positivos para leptospirosis a partir de la segunda semana de enfermedad hasta los 30 días de infección. [8]
En las personas con afectación hepática, las transaminasas y la bilirrubina directa están elevadas en las pruebas de función hepática . El serogrupo Icterohaemorrhagiae se asocia con ictericia y niveles elevados de bilirrubina. La anemia hemolítica contribuye a la ictericia. Una característica de la leptospirosis es la anemia hemolítica aguda y la hiperbilirrubinemia conjugada , especialmente en pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa . [21] Se encuentran niveles anormales de amilasa y lipasa sérica (asociados con pancreatitis) en aquellos que son ingresados en el hospital debido a leptospirosis. La función renal deteriorada con un aclaramiento de creatinina inferior a 50 ml/min se asocia con enzimas pancreáticas elevadas. [21]
En aquellos pacientes con dolor de cabeza intenso que presentan signos de meningitis, se puede intentar una punción lumbar . Si hay infección, el examen del líquido cefalorraquídeo (LCR) muestra un predominio linfocítico con un recuento celular de aproximadamente 500/mm 3 , proteínas entre 50 y 100 mg/mL y niveles normales de glucosa. Estos hallazgos son compatibles con una meningitis aséptica . [21]
Pruebas serológicas
La detección rápida de Leptospira se puede realizar cuantificando los anticuerpos IgM mediante un ensayo inmunoabsorbente ligado a enzimas (ELISA) . Por lo general, se utiliza el antígeno de L. biflexa para detectar los anticuerpos IgM. Esta prueba puede determinar rápidamente el diagnóstico y ayudar en el tratamiento temprano. Sin embargo, la especificidad de la prueba depende del tipo de antígeno utilizado y de la presencia de anticuerpos de infecciones anteriores. La presencia de otras enfermedades, como la infección por el virus de Epstein-Barr , la hepatitis viral y la infección por citomegalovirus , puede causar resultados falsos positivos. [21] Se han desarrollado otras pruebas de detección rápida, como las tiras reactivas, las pruebas de látex y las pruebas de aglutinación en portaobjetos. [8]
La prueba de aglutinación microscópica (MAT) es la prueba de referencia para el diagnóstico de leptospirosis. [21] MAT es una prueba donde se mezclan diluciones seriadas de sueros de pacientes con diferentes serovares de Leptospira . Luego, la mezcla se examina bajo un microscopio de campo oscuro para buscar aglutinación . La dilución más alta donde ocurre el 50% de aglutinación es el resultado. [21] Los títulos de MAT de 1:100 a 1:800 son diagnósticos de leptospirosis. [8] Un aumento de cuatro veces o más en el título de dos sueros tomados al inicio de los síntomas y de tres a diez días del inicio de la enfermedad confirma el diagnóstico. Durante la fase aguda de la enfermedad, MAT no es específica para detectar un serotipo de Leptospira debido a la reactividad cruzada entre los serovares. [21] En la fase de convalecencia , MAT es más específica para detectar los tipos de serovar. [21] La MAT requiere un panel de antígenos vivos y requiere un trabajo laborioso. [25]
Pruebas moleculares
El ADN de leptospiras se puede amplificar mediante la reacción en cadena de la polimerasa (PCR) a partir de muestras de suero, orina, humor acuoso , LCR y autopsias. [21] Detecta la presencia de bacterias más rápido que la MAT durante los primeros días de infección sin esperar la aparición de anticuerpos. [25] Como la PCR detecta la presencia de ADN de leptospiras en la sangre, es útil incluso cuando la bacteria muere con antibióticos. [39]
Imágenes
En aquellos que tienen compromiso pulmonar, una radiografía de tórax puede mostrar opacidades alveolares difusas. [21]
Criterios de diagnóstico
En 1982, la Organización Mundial de la Salud (OMS) propuso los criterios de Faine para el diagnóstico de la leptospirosis. Consta de tres partes: A (hallazgos clínicos), B (factores epidemiológicos) y C (hallazgos de laboratorio y datos bacteriológicos). Dado que los criterios originales de Faine solo incluían el cultivo y la MAT en la parte C, que es difícil y compleja de realizar, en 2004 se propusieron los criterios de Faine modificados para incluir las pruebas ELISA y de aglutinación en portaobjetos, que son más fáciles de realizar. En 2012, se propusieron los criterios de Faine modificados (con enmiendas) para incluir la falta de aliento y la tos con sangre en el diagnóstico. En 2013, la India recomendó los criterios de Faine modificados para el diagnóstico de la leptospirosis. [40]
Prevención


Las tasas de leptospirosis se pueden reducir mejorando las condiciones de vivienda, infraestructura y saneamiento. Las iniciativas de eliminación de roedores y los proyectos de mitigación de inundaciones también pueden ayudar a prevenirla. [21] El uso adecuado de equipos de protección personal (EPP) por parte de personas con alto riesgo de exposición ocupacional puede prevenir las infecciones por leptospirosis en la mayoría de los casos. [21]
No existe una vacuna humana adecuada para su uso en todo el mundo. [15] Solo unos pocos países como Cuba, Japón, Francia y China han aprobado el uso de vacunas inactivadas con efectos protectores limitados. [15] [41] Se han reportado efectos secundarios como náuseas, enrojecimiento en el lugar de la inyección e hinchazón después de la inyección de la vacuna. Dado que la inmunidad inducida por un serovar de Leptospira solo protege contra ese específico, se han desarrollado vacunas trivalentes . [21] Sin embargo, no confieren inmunidad duradera a los humanos o animales. [13] Las vacunas para otros animales están más ampliamente disponibles. [16]
La doxiciclina se administra una vez a la semana como profilaxis y es eficaz para reducir la tasa de infecciones por leptospirosis entre personas de alto riesgo en zonas propensas a inundaciones. [42] En un estudio, redujo el número de casos de leptospirosis en personal militar que realizaba ejercicios en la selva. En otro estudio, redujo el número de casos sintomáticos después de la exposición a la leptospirosis bajo fuertes lluvias en zonas endémicas . [21]
La prevención de la leptospirosis de fuentes ambientales como vías fluviales contaminadas, suelo, alcantarillas y campos agrícolas, es la desinfección utilizada por microorganismos efectivos , que se mezclan con bolas de barro bokashi para las vías fluviales y alcantarillas infectadas.
Tratamiento
La mayoría de los casos de leptospira se resuelven espontáneamente. El inicio temprano de la administración de antibióticos puede prevenir la progresión a una enfermedad grave. Por lo tanto, en entornos con recursos limitados, se pueden iniciar antibióticos una vez que se sospecha leptospirosis después de la anamnesis y el examen. [21]
En el caso de la leptospirosis leve, las recomendaciones de antibióticos como doxiciclina, azitromicina , ampicilina y amoxicilina se basaron únicamente en pruebas in vitro . [8] En 2001, la OMS recomendó doxiciclina oral (2 mg/kg hasta 100 mg cada 12 horas) durante cinco a siete días para aquellos con leptospirosis leve. La tetraciclina , la ampicilina y la amoxicilina también se pueden utilizar en estos casos. [43] Sin embargo, en áreas donde tanto la rickettsia como la leptospirosis son endémicas, la azitromicina y la doxiciclina son los fármacos de elección. [8] La doxiciclina no se utiliza en casos en los que el paciente sufre daño hepático, ya que se ha relacionado con hepatotoxicidad. [44]
Según un estudio de 1988, se recomienda la bencilpenicilina intravenosa (IV) (también conocida como penicilina G) para el tratamiento de la leptospirosis grave. [8] La bencilpenicilina intravenosa (30 mg/kg hasta 1,2 g cada seis horas) se utiliza durante cinco a siete días. La amoxicilina, la ampicilina y la eritromicina también se pueden utilizar para los casos graves. [43] La ceftriaxona (1 g IV cada 24 horas durante siete días) también es eficaz para la leptospirosis grave. [21] [8] [45] La cefotaxima (1 g IV cada seis horas durante siete días) y la doxiciclina (200 mg inicialmente seguidos de 100 mg IV cada 12 horas durante siete días) son igualmente eficaces que la bencilpenicilina (1,5 millones de unidades IV cada seis horas durante siete días). [8] [46] Por lo tanto, no hay evidencia de diferencias en la reducción de muertes cuando se compara la bencilpenicilina con ceftriaxona o cefotaxima. [8] Otro estudio realizado en 2007 tampoco mostró diferencias en la eficacia entre la doxiciclina (200 mg inicialmente seguidos de 100 mg por vía oral cada 12 horas durante siete días) o la azitromicina (2 g el primer día seguidos de 1 g diario durante dos días más) para la sospecha de leptospirosis. No hubo diferencias en la resolución de la fiebre y la azitromicina se tolera mejor que la doxiciclina. [47] [48] [49]
A los pacientes ambulatorios se les administra doxiciclina o azitromicina. La doxiciclina puede acortar la duración de la leptospirosis en dos días, mejorar los síntomas y prevenir la eliminación de organismos en la orina. La azitromicina y la amoxicilina se administran a mujeres embarazadas y niños. [21] En raras ocasiones, puede desarrollarse una reacción de Jarisch-Herxheimer en las primeras horas después de la administración de antibióticos. [8] Sin embargo, según un metaanálisis realizado en 2012, el beneficio de los antibióticos en el tratamiento de la leptospirosis no estaba claro, aunque el uso de antibióticos puede reducir la duración de la enfermedad de dos a cuatro días. [8] [48] Otro metaanálisis realizado en 2013 llegó a una conclusión similar. [8] [49]
En el caso de las personas con leptospirosis grave, incluida la pérdida de potasio con disfunción renal elevada, la hidratación intravenosa y los suplementos de potasio pueden prevenir la deshidratación y la hipocalemia . Cuando se produce insuficiencia renal aguda , el inicio temprano de la hemodiálisis o la diálisis peritoneal puede ayudar a mejorar la supervivencia. En el caso de las personas con insuficiencia respiratoria, la intubación traqueal con un volumen corriente bajo mejora las tasas de supervivencia. [21]
Se ha propuesto que los corticosteroides suprimen la inflamación en la leptospirosis porque la infección por Leptospira puede inducir la liberación de señales químicas que promueven la inflamación de los vasos sanguíneos en los pulmones. Sin embargo, no hay evidencia suficiente para determinar si el uso de corticosteroides es beneficioso. [8] [50]
Pronóstico
El riesgo general de muerte por leptospirosis es del 5 al 10 %. [10] En el caso de las personas con ictericia, la letalidad puede aumentar hasta el 15 %. [28] En el caso de las personas infectadas que presentan confusión y signos neurológicos, existe un alto riesgo de muerte. [21] Otros factores que aumentan el riesgo de muerte incluyen la reducción de la producción de orina, la edad de más de 36 años y la insuficiencia respiratoria. [21] Con la atención adecuada, la mayoría de las personas infectadas se recuperarán por completo. Las personas con insuficiencia renal aguda pueden desarrollar un deterioro renal leve persistente después de recuperarse. [21] En las personas con afectación pulmonar grave, el riesgo de muerte es del 50 al 70 %. [8] El treinta por ciento de las personas con leptospirosis aguda se quejaron de síntomas duraderos caracterizados por debilidad, dolor muscular y dolores de cabeza. [21]
Complicaciones oculares
Los problemas oculares pueden ocurrir en el 10% de aquellos que se recuperaron de la leptospirosis [28] en el rango de dos semanas a algunos años después de la infección. Lo más común es que las complicaciones oculares puedan ocurrir a los seis meses después de la infección. Esto se debe al privilegio inmunológico del ojo que lo protege del daño inmunológico durante la fase inicial de la infección por leptospira. [51] Estas complicaciones pueden variar desde uveítis anterior leve a panuveítis grave (que afecta las tres capas vasculares del ojo). [28] La uveítis ocurre más comúnmente en hombres jóvenes a de mediana edad y en aquellos que trabajan en la agricultura. [51] En hasta el 80% de los infectados, se puede encontrar ADN de Leptospira en el humor acuoso del ojo. [21] Los problemas oculares generalmente tienen un buen pronóstico después del tratamiento o son autolimitantes. [28] En la uveítis anterior, solo se necesitan esteroides tópicos y midriáticos (un agente que causa dilatación de la pupila), mientras que en la panuveítis, se requieren corticosteroides perioculares. [51] La uveítis leptospiral se caracteriza por hipopión , cataratas de rápida maduración , membranas vítreas flotantes, hiperemia del disco y vasculitis retiniana . [51] [52] [53]
Epidemiología

Se estima que anualmente se producen un millón de casos graves de leptospirosis, con 58.900 muertes. Los casos graves representan entre el 5 y el 15 % de todos los casos de leptospirosis. [11] La leptospirosis se encuentra tanto en áreas urbanas como rurales en regiones tropicales , subtropicales y templadas . [10] La carga de salud global por leptospirosis se puede medir por años de vida ajustados por discapacidad (AVAD). La puntuación es de 42 por 100.000 personas por año, que es más que otras enfermedades como la rabia y la filariasis . [7]
La enfermedad se observa de forma persistente en partes de Asia, Oceanía, el Caribe, América Latina y África. [28] La Antártida es el único lugar que no se ve afectado por la leptospirosis. [28] En los Estados Unidos, se producen entre 100 y 150 casos de leptospirosis al año. [54] En 1994, la leptospirosis dejó de ser una enfermedad de declaración obligatoria en los Estados Unidos, excepto en 36 estados/territorios donde es prevalente, como Hawái, Texas, California y Puerto Rico. [55] Alrededor del 50% de los casos notificados se produjeron en Puerto Rico. En enero de 2013, la leptospirosis se restableció como una enfermedad de declaración obligatoria a nivel nacional en los Estados Unidos. [54] La investigación sobre la epidemiología de la leptospirosis en grupos de alto riesgo y factores de riesgo es limitada en la India. [56]
Las tasas globales de leptospirosis han sido subestimadas porque la mayoría de los países afectados carecen de notificación o la notificación no es obligatoria. [21] La distinción de los signos clínicos de la leptospirosis de otras enfermedades y la falta de servicios de diagnóstico de laboratorio son otros problemas. [57] El estado socioeconómico de gran parte de la población mundial está estrechamente vinculado a la desnutrición; la falta posterior de micronutrientes puede conducir a un mayor riesgo de infección y muerte debido a la infección por leptospirosis. [58] Los micronutrientes como el hierro , el calcio y el magnesio representan áreas importantes para la investigación futura. [58]
Historia
La enfermedad fue descrita por primera vez por Adolf Weil en 1886 cuando informó una "enfermedad infecciosa aguda con agrandamiento del bazo, ictericia y nefritis ". [18] Antes de la descripción de Weil, la enfermedad era conocida como " ictericia de los arrozales " en el texto chino antiguo, "fiebre de otoño", "fiebre de siete días", [59] y " fiebre nanukayami " [60] en Japón; en Europa y Australia, la enfermedad estaba asociada con ciertas ocupaciones y se le daban nombres como "enfermedad del cortador de caña", "enfermedad del porquerizo" y " Schlammfieber " (fiebre del barro). [59] Se la ha conocido históricamente como "ictericia negra", [61] o "fiebre de las granjas lecheras" en Nueva Zelanda. [62] La leptospirosis fue postulada como la causa de una epidemia entre los nativos americanos a lo largo de la costa de lo que ahora es Nueva Inglaterra durante 1616-1619. Lo más probable es que la enfermedad haya sido traída al Nuevo Mundo por los europeos. [63]
Leptospira fue observada por primera vez en 1907 en un corte de tejido renal post mortem por Arthur Stimson utilizando la técnica de tinción por deposición de plata . Llamó al organismo Spirocheta interrogans porque las bacterias se parecían a un signo de interrogación. [59] [64] En 1908, un grupo de investigación japonés dirigido por Ryukichi Inada y Yutaka Ito identificó por primera vez esta bacteria como el agente causante de la leptospirosis [65] y notó su presencia en ratas en 1916. [66] Los trabajadores de las minas de carbón japonesas contraían leptospirosis con frecuencia. En Japón, el organismo se denominó Spirocheta icterohaemorrhagiae . El grupo japonés también experimentó con los primeros estudios de inmunización con leptospiras en cobayas. Demostraron que al inyectar a los cobayas infectados sueros de humanos o cabras convalecientes, se podía proporcionar inmunidad pasiva a los cobayas. En 1917, el grupo japonés descubrió que las ratas eran portadoras de leptospirosis. [59] Sin saber del trabajo del grupo japonés, dos grupos alemanes publicaron de forma independiente y casi simultánea su primera demostración de transmisión de infección por leptospira en conejillos de indias en octubre de 1915. Llamaron al organismo Spirochaeta nodosa y Spirochaeta Icterogenes respectivamente. [59]
La leptospirosis fue posteriormente reconocida como una enfermedad de todas las especies de mamíferos. En 1933, trabajadores holandeses informaron del aislamiento de Leptospira canicola que infecta específicamente a los perros. En 1940, la cepa que infecta específicamente al ganado fue reportada por primera vez en Rusia. [59] En 1942, se registró que los soldados en Fort Bragg , Carolina del Norte , tenían una enfermedad infecciosa que les causaba un sarpullido en las tibias . Más tarde se supo que esta enfermedad era causada por leptospirosis. [21] En la década de 1950, el número de serotipos que infectaban a varios mamíferos se había expandido significativamente. En la década de 1980, la leptospirosis fue reconocida como una enfermedad veterinaria de gran importancia económica. [59]
En 1982, había cerca de 200 serovares de Leptospira disponibles para su clasificación. El subcomité de taxonomía de Leptospira del Comité Internacional de Bacteriología Sistemática propuso clasificar estos serovares en dos grandes grupos: L. interrogans que contiene serovares patógenos y L. biflexa que contiene serovares saprofitos. [59] En 1979, se propuso la familia leptospiral de Leptospiraceae . En el mismo año, Leptospira illini fue reclasificada como el nuevo género Leptonema . [59] En 2002, se acuñó el término "síndrome de Lepthangamushi" para describir una serie de síntomas superpuestos de leptospirosis con fiebre hemorrágica por Hantavirus con síndrome renal y tifus de matorrales causado por Orientia tsutsugamushi . [67] [68] En 2005, Leptospira parva fue clasificada como Turneriella . [59] Con la tecnología de hibridación ADN-ADN , L. interrogans se dividió en siete especies. Desde entonces se han descubierto más especies de Leptospira . [59] La OMS estableció el Grupo de Referencia de Epidemiología de la Carga de Leptospirosis (LERG) para revisar los últimos datos epidemiológicos de la enfermedad, formular un modelo de transmisión de la enfermedad e identificar lagunas en el conocimiento y la investigación. La primera reunión se celebró en 2009. En 2011, el LERG estimó que la tasa anual mundial de leptospirosis es de cinco a 14 casos por cada 100.000 habitantes. [21]
Otros animales


Los animales infectados pueden no presentar síntomas, presentar síntomas leves o graves; [19] los síntomas que se presentan pueden variar según el tipo de animal. [16] [19] En algunos animales, las bacterias viven en el tracto reproductivo, lo que lleva a la transmisión durante el apareamiento. [16]
Los animales también presentan características clínicas similares en comparación con los humanos. Los signos clínicos pueden aparecer en 5 a 15 días en los perros. El período de incubación puede prolongarse en los gatos. La leptospirosis puede causar abortos después de 2 a 12 semanas en el ganado y de 1 a 4 semanas de infección en los cerdos. La enfermedad tiende a ser más leve en los huéspedes reservorios. Los órganos más comúnmente afectados son los riñones, el hígado y el sistema reproductivo, pero otros órganos pueden verse afectados. [28] En los perros, los signos clínicos agudos incluyen fiebre, pérdida de apetito , escalofríos, dolor muscular, debilidad y síntomas urinarios. También pueden presentarse vómitos, diarrea y dolor abdominal. Se pueden ver petequias y equimosis en las membranas mucosas. También se puede ver sangrado de los pulmones en los perros. En presentaciones crónicas, el perro afectado puede no tener síntomas. En los animales que han muerto de leptospirosis, sus riñones pueden estar hinchados con manchas grises y blancas, moteado o cicatrices. Su hígado puede estar agrandado con áreas de muerte celular . Se pueden encontrar petequias y equimosis en varios órganos. [28] [69] También son posibles la inflamación de los vasos sanguíneos , la inflamación del corazón, las capas meníngeas que cubren el cerebro y la médula espinal y la uveítis . [16] La uveítis recurrente equina (URE) es la enfermedad más común asociada con la infección por Leptospira en caballos en América del Norte y puede provocar ceguera. [70] [71] La URE es una enfermedad autoinmune que implica anticuerpos contra las proteínas LruA y LruB de Leptospira que reaccionan de forma cruzada con las proteínas oculares. [70] Se puede recuperar Leptospira viva del líquido acuoso o vítreo de muchos caballos con URE asociada a Leptospira . [71] El riesgo de muerte o discapacidad en animales infectados varía según la especie y la edad de los animales. En cerdos y ganado adultos, los signos reproductivos son los signos más comunes de leptospirosis. Hasta el 40% de las vacas pueden tener un aborto espontáneo. Los animales más jóvenes suelen desarrollar una enfermedad más grave. Alrededor del 80% de los perros pueden sobrevivir con tratamiento, pero la tasa de supervivencia se reduce si los pulmones están afectados. [28]
Las pruebas de ELISA y aglutinación microscópica son las más utilizadas para diagnosticar la leptospirosis en animales. Las bacterias se pueden detectar en sangre, orina y leche o en muestras de hígado, riñón u otros tejidos mediante técnicas de inmunofluorescencia o inmunohistoquímica o reacción en cadena de la polimerasa. La tinción de plata o la tinción de plata inmunogold se utilizan para detectar Leptospira en secciones de tejido. Los organismos se tiñen mal con la tinción de Gram . La microscopía de campo oscuro se puede utilizar para detectar Leptospira en fluidos corporales, pero no es sensible ni específica para detectar el organismo. Un cultivo positivo para leptospirosis es definitivo, pero la disponibilidad es limitada y los resultados del cultivo pueden tardar entre 13 y 26 semanas en obtenerse, lo que limita su utilidad. Se prefieren muestras pareadas de casos agudos y convalecientes para el diagnóstico serológico de leptospirosis en animales. Una muestra serológica positiva de un feto abortado también es diagnóstica de leptospirosis. [28]
Se han utilizado diversos antibióticos, como doxiciclina, penicilinas, dihidroestreptomicina y estreptomicina , para tratar la leptospirosis en animales. En casos graves, puede ser necesaria la fluidoterapia, la transfusión sanguínea y la asistencia respiratoria. En el caso de los caballos con ERU, el tratamiento principal es con fármacos antiinflamatorios. [28] [16]
Existen vacunas contra la leptospirosis para animales como cerdos, perros, ganado vacuno, ovejas y cabras. Las vacunas para el ganado vacuno suelen contener los serotipos Hardjo y Pomona de Leptospira , mientras que las vacunas para los perros suelen contener los serotipos Icterohaemorrhagiae y Canicola. Las vacunas que contienen varios serotipos no funcionan tan bien para el ganado vacuno como las vacunas que contienen un solo serotipo, pero las vacunas multivalentes siguen vendiéndose. [16] El aislamiento de los animales infectados y los antibióticos profilácticos también son eficaces para prevenir la transmisión de la leptospirosis entre animales. El control ambiental y el saneamiento también reducen las tasas de transmisión. [28] [16]
Referencias
 Este artículo fue enviado a WikiJournal of Medicine para su revisión académica externa por pares en 2019 (informes de los revisores). El contenido actualizado fue reintegrado a la página de Wikipedia bajo una licencia CC-BY-SA-3.0 ( 2022 ). La versión de registro revisada es: Siang Ching Raymond Chieng; et al. (21 de junio de 2022). "Leptospirosis". WikiJournal of Medicine . 9 (1): 2. doi : 10.15347/WJM/2022.002 . ISSN 2002-4436. Wikidata Q100400590.
Este artículo fue enviado a WikiJournal of Medicine para su revisión académica externa por pares en 2019 (informes de los revisores). El contenido actualizado fue reintegrado a la página de Wikipedia bajo una licencia CC-BY-SA-3.0 ( 2022 ). La versión de registro revisada es: Siang Ching Raymond Chieng; et al. (21 de junio de 2022). "Leptospirosis". WikiJournal of Medicine . 9 (1): 2. doi : 10.15347/WJM/2022.002 . ISSN 2002-4436. Wikidata Q100400590.
- ^ Berger S (2018). Leptospirosis: situación mundial. GIDEON Informatics Inc. pág. 7. ISBN 978-1-4988-2031-8.
- ^ Diccionario médico de Mosby (novena edición). Elsevier Health Sciences . 2013. pág. 697. ISBN 978-0-323-11258-1Archivado desde el original el 8 de septiembre de 2017 . Consultado el 21 de febrero de 2016 .
- ^ McKay JE (2001). Atención integral de la salud de los perros . Minnetonka, MN.: Creative Pub. International . pág. 97. ISBN. 978-1-55971-783-0.
- ^ James WD, Elston DM, Berger TG, Andrews GC (2006). Enfermedades de la piel de Andrews: dermatología clínica . Saunders Elsevier . ISBN 978-0-7216-2921-6.:290
- ^ abcdefghijklmnop Soo ZM, Khan NA, Siddiqui R (enero de 2020). "Leptospirosis: importancia creciente en los países en desarrollo". Acta Trópica . 201 : 105183. doi : 10.1016/j.actatropica.2019.105183 . PMID 31542372.
- ^ ab McBride AJ, Athanazio DA, Reis MG, Ko AI (octubre de 2005). "Leptospirosis". Opinión Actual en Enfermedades Infecciosas . 18 (5): 376–86. doi :10.1097/01.qco.0000178824.05715.2c. PMID 16148523. S2CID 220576544.
- ^ abcdefghijklmnopqrstu vwx Karpagam KB, Ganesh B (enero de 2020). "Leptospirosis: una infección zoonótica tropical desatendida de importancia para la salud pública: una revisión actualizada". Revista Europea de Microbiología Clínica y Enfermedades Infecciosas . 39 (5): 835–846. doi :10.1007/s10096-019-03797-4. PMID 31898795. S2CID 209669669.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af Lane AB, Dore MM (2016). "Leptospirosis: una revisión clínica del diagnóstico, tratamiento y prevención basados en evidencia". Revista mundial de enfermedades infecciosas clínicas . 6 (4): 61. doi : 10.5495/wjcid.v6.i4.61 . ISSN 2220-3176.
- ^ Farrar J, Hotez P, Junghanss T, Kang G, Lalloo D, White NJ (2013). Enfermedades tropicales de Manson, libro electrónico. Elsevier Health Sciences. pág. 438. ISBN 978-0-7020-5306-1Archivado desde el original el 8 de septiembre de 2017 . Consultado el 2 de septiembre de 2017 .
- ^ abcd Evangelista KV, Coburn J (septiembre de 2010). "Leptospira como un patógeno emergente: una revisión de su biología, patogénesis y respuestas inmunes del huésped". Future Microbiology . 5 (9): 1413–25. doi :10.2217/fmb.10.102. PMC 3037011 . PMID 20860485.
- ^ abcd Costa F, Hagan JE, Calcagno J, Kane M, Torgerson P, Martinez-Silveira MS, et al. (2015). "Morbilidad y mortalidad global de la leptospirosis: una revisión sistemática". PLOS Neglected Tropical Diseases . 9 (9): e0003898. doi : 10.1371/journal.pntd.0003898 . PMC 4574773 . PMID 26379143.
- ^ "Ratas / Jardinería RHS". www.rhs.org.uk .
- ^ abcdefghijklm Picardeau M (mayo de 2017). "Virulencia del agente zoonótico de la leptospirosis: ¿todavía es tierra desconocida?". Nature Reviews. Microbiología . 15 (5): 297–307. doi :10.1038/nrmicro.2017.5. PMID 28260786. S2CID 11626842.
- ^ Chan, OY; Chia, SE; Nadarajah, N.; Sng, EH (16 de octubre de 1987). "Riesgo de leptospirosis en trabajadores de limpieza pública y alcantarillado". Anales de la Academia de Medicina, Singapur . 16 (4): 586–90. PMID 3446001.
- ^ abc Teixeira AF; Fernandes LG; Cavenague MF; et al. (2019). "Vacunas contra la leptospira con adyuvante: desafíos y desarrollo futuro de nuevas vacunas contra la leptospirosis". Vacuna . 37 (30): 3961–73. doi :10.1016/j.vaccine.2019.05.087. PMID 31186193. S2CID 186204949.
- ^ abcdefghijklmno Ellis WA (2015). "Leptospirosis animal". Leptospira y leptospirosis . Temas actuales en microbiología e inmunología. Vol. 387. págs. 99-137. doi :10.1007/978-3-662-45059-8_6. ISBN 978-3-662-45058-1. Número de identificación personal 25388134.
- ^ Slack A (julio de 2010). "Leptospirosis". Australian Family Physician . 39 (7): 495–8. PMID 20628664.
- ^ ab Weil A (1886). "Über eine eigenthümliche, mit Milztumor, Icterus und Nephritis einhergehende, agudo Infektionskrankheit" [Sobre una extraña enfermedad infecciosa aguda, acompañada de hinchazón del bazo, ictericia y nefritis]. Deutsches Archiv für Klinische Medizin (en alemán). 39 : 209–232. OCLC 1040554855.
- ^ abcd "Leptospirosis" (PDF) . Centro para la Seguridad Alimentaria y la Salud Pública . Octubre de 2013. Archivado (PDF) desde el original el 24 de noviembre de 2014 . Consultado el 8 de noviembre de 2014 .
- ^ abcdefghijkl Chieng Raymond, Siang Ching (2022). "Leptospirosis". WikiRevista de Medicina . 9 (1). doi : 10.15347/WJM/2022.002 . S2CID 250435398.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an ao Haake DA, Levett PN (25 de mayo de 2015). "Leptospirosis en humanos". En Adler B (ed.). Leptospira y Leptospirosis . Temas actuales en microbiología e inmunología. vol. 387. Saltador. págs. 65–97. doi :10.1007/978-3-662-45059-8_5. ISBN 978-3-662-45058-1. PMC 4442676 . PMID 25388133.
- ^ "Ficha informativa sobre la leptospirosis". Centro Europeo para la Prevención y el Control de Enfermedades . 16 de julio de 2010. Consultado el 5 de septiembre de 2020 .
- ^ Waggoner JJ, Pinsky BA (octubre de 2016). "Diagnóstico molecular de la leptospirosis humana". Current Opinion in Infectious Diseases . 29 (5): 440–5. doi :10.1097/QCO.0000000000000295. PMC 5127924 . PMID 27537829.
- ^ ab Cagliero J, Villanueva SY, Matsui M (20 de junio de 2018). "Fisiopatología de la leptospirosis: en la tormenta de las citocinas". Frontiers in Cellular and Infection Microbiology . 8 (204): 204. doi : 10.3389/fcimb.2018.00204 . PMC 6019470 . PMID 29974037.
- ^ abcd Bennett JE, Raphael D, Martin JB, Bart JC (2015). "223". Principios y práctica de enfermedades infecciosas de Mandell, Douglas y Bennett (octava edición). Elsevier . págs. 2541–2549. ISBN 978-1-4557-4801-3.
- ^ Cameron CE (2015). "Estructura, fisiología y metabolismo de las leptospiras". Leptospira y leptospirosis . Temas actuales en microbiología e inmunología. Vol. 387. págs. 21–41. doi :10.1007/978-3-662-45059-8_3. ISBN 978-3-662-45058-1. Número de identificación personal 25388131.
- ^ abc Caimi K, Ruybal P (febrero de 2020). "Leptospira spp., un género en etapa de diversidad y expansión de datos genómicos". Infección, genética y evolución . 81 : 104241. Bibcode :2020InfGE..8104241C. doi :10.1016/j.meegid.2020.104241. PMID 32061688. S2CID 211135356.
- ^ abcdefghijklmn Spickler AR, Leedom Larson KR (octubre de 2013). "Leptospirosis (hoja informativa)" (PDF) . Centro para la Seguridad Alimentaria y la Salud Pública. Archivado (PDF) del original el 24 de noviembre de 2014. Consultado el 15 de marzo de 2019 .
- ^ Barragan V, Olivas S, Keim P, Pearson T (octubre de 2017). "Brechas críticas de conocimiento en nuestra comprensión del ciclo ambiental y la transmisión de Leptospira spp". Microbiología aplicada y ambiental . 83 (19). Código Bibliográfico :2017ApEnM..83E1190B. doi :10.1128/AEM.01190-17. PMC 5601346 . PMID 28754706.
- ^ Allan KJ, Biggs HM, Halliday JE, Kazwala RR, Maro VP, Cleaveland S, Crump JA (2015). "Epidemiología de la leptospirosis en África: una revisión sistemática de una zoonosis desatendida y un paradigma para 'Una Salud' en África". PLOS Neglected Tropical Diseases . 9 (9): e0003899. doi : 10.1371/journal.pntd.0003899 . PMC 4569256 . PMID 26368568.
- ^ Rodríguez-Morales AJ, Castañeda-Hernández DM (2014). "Espiroquetas: Leptospira". Enciclopedia de seguridad alimentaria . 2 : 189-193. doi :10.1016/B978-0-12-378612-8.00131-1. ISBN 978-0-12-378613-5.
- ^ abcd Chin VK, Basir R, Nordin SA, Abdullah M, Sekawi Z (marzo de 2019). "Patología y evasión inmunitaria del huésped durante la leptospirosis humana: una revisión" (PDF) . Microbiología internacional . 23 (2): 127–136. doi :10.1007/s10123-019-00067-3. PMID 30875033. S2CID 78095369.
- ^ Song AT, Abas L, Andrade LC, Andraus W, D'Albuquerque LA, Abdala E (febrero de 2016). "Un primer informe de leptospirosis después del trasplante de hígado". Trasplante de Enfermedades Infecciosas . 18 (1): 137–140. doi :10.1111/tid.12490. PMID 26671230. S2CID 3548455.
- ^ Puliyath G, Singh S (octubre de 2012). "Leptospirosis en el embarazo". Revista Europea de Microbiología Clínica y Enfermedades Infecciosas . 31 (10): 2491–2496. doi :10.1007/s10096-012-1625-7. PMID 22549729. S2CID 14033595.
- ^ Carles G, Montoya E, Joly F, Peneau C (1995). "[Leptospirosis y embarazo. Once casos en la Guyana Francesa]". Journal de Gynécologie, Obstétrique et Biologie de la Reproduction . 24 (4): 418–421. PMID 7650320.
- ^ Koe SL, Tan KT, Tan TC (febrero de 2014). "Leptospirosis en el embarazo con cambios patológicos en la cardiotocografía fetal". Revista Médica de Singapur . 55 (2): e20-24. doi :10.11622/smedj.2013194. PMC 4291937 . PMID 24712035.
- ^ Shaked Y, Shpilberg O, Samra D, Samra Y (agosto de 1993). "Leptospirosis en el embarazo y su efecto en el feto: informe de caso y revisión". Enfermedades infecciosas clínicas . 17 (2): 241–243. doi :10.1093/clinids/17.2.241. PMID 8399874.
- ^ Fabiani A, Dal Bo E, Di Bella S, Gabrielli M, Bologna A, Albert U, Sanson G (5 de julio de 2021). "Pica (alotrofagia): ¿un factor de riesgo subestimado de leptospirosis grave (enfermedad de Weil)? Informe de un shock séptico por leptospira tratado con éxito con ECMO". Informes de enfermedades infecciosas . 13 (3): 619–626. doi : 10.3390/idr13030058 . ISSN 2036-7449. PMC 8293114 . PMID 34287302.
- ^ Alison BL, Michael MD (25 de noviembre de 2016). "Leptospirosis: una revisión clínica del diagnóstico, tratamiento y prevención basados en evidencia". Revista mundial de enfermedades infecciosas clínicas . 6 (4): 61–66. doi : 10.5495/wjcid.v6.i4.61 .
- ^ Kumar SS (2013). "7" (PDF) . Directrices indias para el diagnóstico y el tratamiento de la leptospirosis humana . India. págs. 23–29. Archivado desde el original (PDF) el 25 de diciembre de 2016. Consultado el 16 de noviembre de 2019 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ Xu Y; Ye Q (2018). "Vacunas contra la leptospirosis humana en China". Vacunas e inmunoterapias humanas . 14 (4): 984–93. doi :10.1080/21645515.2017.1405884. PMC 5893195 . PMID 29148958.
- ^ Abd Rahim MA, Zaki AM, Atil A, Azme MH, Him NA, Rahim SS, Jeffree MS, Ahmad N, Hassan MR. "Eficacia de la profilaxis con antibióticos para la leptospirosis en adultos: una revisión sistemática". Revista Malaya de Ciencias Aplicadas . 3 (2): 46–56 . Consultado el 1 de marzo de 2020 .
- ^ ab Organización Mundial de la Salud (2001). Estrategias recomendadas por la OMS para la prevención y el control de las enfermedades transmisibles . Organización Mundial de la Salud. pág. 104. hdl : 10665/67088 .
- ^ "Doxiciclina". LiverTox: información clínica y de investigación sobre la lesión hepática inducida por fármacos. Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales. 6 de febrero de 2012. PMID 31643675 – vía PubMed.
- ^ Panaphut T, Domrongkitchaiporn S, Vibhagool A, Thinkamrop B, Susaengrat W (junio de 2003). "Ceftriaxona en comparación con penicilina g sódica para el tratamiento de la leptospirosis grave". Enfermedades infecciosas clínicas . 36 (12): 1507–13. doi : 10.1086/375226 . PMID 12802748.
- ^ Suputtamongkol Y, Niwattayakul K, Suttinont C, Losuwanaluk K, Limpaiboon R, Chierakul W, et al. (noviembre de 2004). "Un ensayo abierto, aleatorizado y controlado de penicilina, doxiciclina y cefotaxima para pacientes con leptospirosis grave". Enfermedades infecciosas clínicas . 39 (10): 1417–24. doi : 10.1086/425001 . PMID 15546074.
- ^ Phimda K, Hoontrakul S, Suttinont C, Chareonwat S, Losuwanaluk K, Chueasuwanchai S, et al. (septiembre de 2007). "Doxiciclina versus azitromicina para el tratamiento de la leptospirosis y el tifus de los matorrales". Agentes antimicrobianos y quimioterapia . 51 (9): 3259–63. doi :10.1128/AAC.00508-07. PMC 2043199. PMID 17638700 .
- ^ ab Brett-Major DM, Coldren R (febrero de 2012). "Antibióticos para la leptospirosis". Base de datos Cochrane de revisiones sistemáticas (2): CD008264. doi :10.1002/14651858.CD008264.pub2. PMC 11299142. PMID 22336839. S2CID 44941071 .
- ^ ab Charan J, Saxena D, Mulla S, Yadav P (mayo de 2013). "Antibióticos para el tratamiento de la leptospirosis: revisión sistemática y metaanálisis de ensayos controlados". Revista internacional de medicina preventiva . 4 (5): 501–10. PMC 3733179 . PMID 23930159.
- ^ Rodrigo C, Lakshitha de Silva N, Goonaratne R, Samarasekara K, Wijesinghe I, Parththipan B, Rajapakse S (diciembre de 2014). "Corticosteroides en dosis altas en leptospirosis grave: una revisión sistemática". Transacciones de la Royal Society of Tropical Medicine and Hygiene . 108 (12): 743–50. doi :10.1093/trstmh/tru148. PMID 25266477.
- ^ abcd Verma A; Stevenson B (7 de septiembre de 2012). "Uveítis leptospiral: ¡hay más de lo que parece!". Zoonosis y salud pública . 59 (s2): 132–41. doi : 10.1111/j.1863-2378.2011.01445.x . PMID 22958257. S2CID 37444586.
- ^ Sivakumar R; Balakrishnan V; Gowri P (2018). "Uveítis leptospiral: utilidad de los signos clínicos como predictores diagnósticos". Inmunología ocular e inflamación . 26 (4): 569–76. doi :10.1080/09273948.2016.1217341. PMID 27598430. S2CID 21683688.
- ^ Rathinam SR; Rathakrishnan S (septiembre de 2020). "Maduración rápida de catarata unilateral en leptospirosis". Revista India de Oftalmología . 68 (9): 1977–79. doi : 10.4103/ijo.IJO_535_20 . PMC 7690476 . PMID 32823447.
- ^ ab «Healthcare Workers – Technical Information for Leptospirosis» (Trabajadores de la salud: información técnica sobre la leptospirosis). Centros para el Control y la Prevención de Enfermedades (CDC). 9 de noviembre de 2017. Archivado desde el original el 11 de enero de 2019. Consultado el 28 de abril de 2019 .
- ^ Guerra MA (septiembre de 2013). "Leptospirosis: perspectivas de salud pública". Biologicals . 41 (5): 295–7. doi :10.1016/j.biologicals.2013.06.010. PMC 4629849 . PMID 23850378.
- ^ Moola, Sandeep; Beri, Deepti; Salam, Abdul; Jagnoor, Jagnoor; Teja, Arun; Bhaumik, Soumyadeep (julio de 2021). "Prevalencia de leptospirosis y factores de riesgo en la India: mapas de brechas de evidencia". Médico Tropical . 51 (3): 415–421. doi :10.1177/00494755211005203. ISSN 1758-1133. PMID 33832378. S2CID 233191847.
- ^ "OMS | Grupo de Referencia de Epidemiología de la Carga de Leptospirosis (LERG)". www.who.int . Archivado desde el original el 17 de noviembre de 2017 . Consultado el 30 de noviembre de 2017 .
- ^ ab Herman HS, Mehta S, Cárdenas WB, Stewart-Ibarra AM, Finkelstein JL (julio de 2016). "Micronutrientes y leptospirosis: una revisión de la evidencia actual". PLOS Neglected Tropical Diseases . 10 (7): e0004652. doi : 10.1371/journal.pntd.0004652 . PMC 4936698 . PMID 27387046.
- ^ abcdefghijk Adler B (2015). "Historia de la leptospirosis y la leptospira". Leptospira y leptospirosis . Temas actuales en microbiología e inmunología. Vol. 387. págs. 1–9. doi :10.1007/978-3-662-45059-8_1. ISBN 978-3-662-45058-1. Número de identificación personal 25388129.
- ^ Diccionario médico ilustrado de Dorland. Filadelfia: Elsevier/Saunders . 2012. pág. 1231. ISBN 978-1-4557-0985-4Archivado desde el original el 8 de septiembre de 2017 . Consultado el 21 de febrero de 2016 .
- ^ Clapham D (2004). Pequeños suministros de agua: una guía práctica. Routledge . p. 125. ISBN 978-1-134-45749-6Archivado desde el original el 8 de septiembre de 2017 . Consultado el 21 de febrero de 2016 .
- ^ Christmas BW, Tennent RB, Lindsay PG (mayo de 1974). "Fiebre en las granjas lecheras de Nueva Zelanda: un brote local de leptospirosis humana". The New Zealand Medical Journal . 79 (514): 901–4. PMID 4527727.
- ^ Marr JS, Cathey JT (febrero de 2010). "Nueva hipótesis sobre la causa de la epidemia entre los nativos americanos, Nueva Inglaterra, 1616-1619". Enfermedades infecciosas emergentes . 16 (2): 281–6. doi :10.3201/eid1602.090276. PMC 2957993 . PMID 20113559.
- ^ Stimson AM (1907). "Nota sobre un organismo encontrado en tejido de fiebre amarilla". Public Health Reports . 22 (18): 541. doi :10.2307/4559008. JSTOR 4559008.
- ^ Inada R, Ito Y (1908). "Un informe sobre el descubrimiento del organismo causal (una nueva especie de espiroqueta) de la enfermedad de Weil". Tokyo Ijishinshi . 1915 : 351–60.
- ^ Inada R, Ido Y, Hoki R, Kaneko R, Ito H (marzo de 1916). "La etiología, el modo de infección y la terapia específica de la enfermedad de Weil (espiroquetosis icterohomorrágica)". Revista de medicina experimental . 23 (3): 377–402. doi :10.1084/jem.23.3.377. PMC 2125418 . PMID 19867994.
- ^ Paniz-Mondolfi AE, Rodriguez-Morales AJ, Blohm G, Marquez M, Villamil-Gomez WE (julio de 2016). "Síndrome de ChikDenMaZika: el desafío de diagnosticar infecciones arbovirales en medio de epidemias concurrentes". Anales de Microbiología Clínica y Antimicrobianos . 15 (1): 42. doi : 10.1186/s12941-016-0157-x . PMC 4957883 . PMID 27449770.
- ^ «284184004: Síndrome (trastorno) de Lepthangamushi». Archivado desde el original el 18 de noviembre de 2019. Consultado el 18 de noviembre de 2019 .
- ^ Klopfleisch R, Kohn B, Plog S, Weingart C, Nöckler K, Mayer-Scholl A, Gruber AD (diciembre de 2010). "Un síndrome hemorrágico pulmonar emergente en perros: ¿similar al síndrome hemorrágico pulmonar por leptospira humana?". Medicina Veterinaria Internacional . 2010 : 928541. doi : 10.4061/2010/928541 . PMC 3025382. PMID 21274452 .
- ^ ab Zuerner RL (2015). "Respuesta del huésped a la infección por Leptospira". Leptospira y leptospirosis . Temas actuales en microbiología e inmunología. Vol. 387. págs. 223–50. doi :10.1007/978-3-662-45059-8_9. ISBN 978-3-662-45058-1. Número de identificación personal 25388137.
- ^ ab Divers TJ, Chang YF, Irby NL, Smith JL, Carter CN (mayo de 2019). "Leptospirosis: una enfermedad infecciosa importante en caballos norteamericanos". Revista veterinaria equina . 51 (3): 287–292. doi :10.1111/evj.13069. PMID 30629756. S2CID 58578433.
Enlaces externos
- "Leptospirosis". Centro para el Control y la Prevención de Enfermedades de Estados Unidos. 21 de noviembre de 2018.
- "Leptospira". Navegador de taxonomía del NCBI. 171.