Manganeso
El manganeso es un elemento químico ; su símbolo es Mn y su número atómico es 25. Es un metal duro, quebradizo y plateado, que a menudo se encuentra en minerales en combinación con el hierro . El manganeso se aisló por primera vez en la década de 1770. Es un metal de transición con una variedad multifacética de usos en aleaciones industriales, particularmente en aceros inoxidables . Mejora la resistencia, la trabajabilidad y la resistencia al desgaste. El óxido de manganeso se utiliza como agente oxidante; como aditivo para caucho; y en la fabricación de vidrio, fertilizantes y cerámica. El sulfato de manganeso se puede utilizar como fungicida.
El manganeso también es un elemento esencial de la dieta humana, importante en el metabolismo de los macronutrientes, la formación ósea y los sistemas de defensa contra los radicales libres . Es un componente crítico en docenas de proteínas y enzimas. [7] Se encuentra principalmente en los huesos, pero también en el hígado, los riñones y el cerebro. [8] En el cerebro humano, el manganeso está unido a las metaloproteínas de manganeso , más notablemente a la glutamina sintetasa en los astrocitos .
Se utiliza en el laboratorio en forma de permanganato de potasio , una sal violeta oscura . Se encuentra en los sitios activos de algunas enzimas . [9] De particular interés es el uso de un grupo Mn-O , el complejo generador de oxígeno , en la producción de oxígeno por las plantas.
Características
Propiedades físicas
El manganeso es un metal de color gris plateado que se parece al hierro. Es duro y muy frágil, difícil de fundir, pero fácil de oxidar. [10] El manganeso y sus iones comunes son paramagnéticos . [11] El manganeso se empaña lentamente en el aire y se oxida ("se oxida") como el hierro en agua que contiene oxígeno disuelto. [12]
Isótopos
El manganeso natural está compuesto por un isótopo estable , el 55 Mn. Se han aislado y descrito varios radioisótopos , cuyo peso atómico varía de 46 u ( 46 Mn ) a 72 u ( 72 Mn ). Los más estables son el 53 Mn con una vida media de 3,7 millones de años, el 54 Mn con una vida media de 312,2 días y el 52 Mn con una vida media de 5,591 días. Todos los isótopos radiactivos restantes tienen vidas medias de menos de tres horas y la mayoría de menos de un minuto. El modo de desintegración principal en los isótopos más ligeros que el isótopo estable más abundante, el 55 Mn, es la captura de electrones y el modo principal en los isótopos más pesados es la desintegración beta . [13] El manganeso también tiene tres estados meta . [13]
El manganeso es parte del grupo de elementos del hierro, que se cree que se sintetizan en grandes estrellas poco antes de la explosión de una supernova . [14] El 53 Mn se desintegra en 53 Cr con una vida media de 3,7 millones de años. Debido a su vida media relativamente corta, el 53 Mn es relativamente raro, producido por el impacto de los rayos cósmicos en el hierro . [15] Los contenidos isotópicos de manganeso se combinan típicamente con los contenidos isotópicos de cromo y han encontrado aplicación en la geología isotópica y la datación radiométrica . Las proporciones isotópicas Mn–Cr refuerzan la evidencia de 26 Al y 107 Pd para la historia temprana del Sistema Solar . Las variaciones en las proporciones 53 Cr/ 52 Cr y Mn/Cr de varios meteoritos sugieren una proporción inicial 53 Mn/ 55 Mn, lo que indica que la composición isotópica Mn–Cr debe ser el resultado de la desintegración in situ de 53 Mn en cuerpos planetarios diferenciados. Por lo tanto, el 53 Mn proporciona evidencia adicional de procesos nucleosintéticos inmediatamente antes de la coalescencia del Sistema Solar. [16]
Alótropos
 | 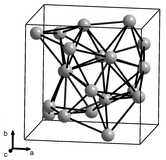 |
Se conocen cuatro alótropos (formas estructurales) del manganeso sólido, denominados α, β, γ y δ, que se presentan a temperaturas cada vez más altas. Todos son metálicos, estables a presión estándar y tienen una red cristalina cúbica, pero varían ampliamente en sus estructuras atómicas. [17] [18] [19]
El alfa manganeso (α-Mn) es la fase de equilibrio a temperatura ambiente. Tiene una red cúbica centrada en el cuerpo y es inusual entre los metales elementales por tener una celda unitaria muy compleja, con 58 átomos por celda (29 átomos por celda unitaria primitiva) en cuatro tipos diferentes de sitios. [20] [17] Es paramagnético a temperatura ambiente y antiferromagnético a temperaturas inferiores a 95 K (−178 °C). [21]

El beta manganeso (β-Mn) se forma cuando se calienta por encima de la temperatura de transición de 973 K (700 °C; 1290 °F). Tiene una estructura cúbica primitiva con 20 átomos por celda unitaria en dos tipos de sitios, que es tan compleja como la de cualquier otro metal elemental. [22] Se obtiene fácilmente como una fase metaestable a temperatura ambiente mediante un enfriamiento rápido. No muestra ordenamiento magnético , permaneciendo paramagnético hasta la temperatura más baja medida (1,1 K). [22] [23] [24]
El manganeso gamma (γ-Mn) se forma cuando se calienta a temperaturas superiores a 1370 K (1100 °C; 2010 °F). Tiene una estructura cúbica simple centrada en las caras (cuatro átomos por celda unitaria). Cuando se enfría a temperatura ambiente se convierte en β-Mn, pero se puede estabilizar a temperatura ambiente al alearlo con al menos un 5 por ciento de otros elementos (como C, Fe, Ni, Cu, Pd o Au), y estas aleaciones estabilizadas por soluto se distorsionan en una estructura tetragonal centrada en las caras . [25] [24]
El deltamanganeso (δ-Mn) se forma cuando se calienta a temperaturas superiores a 1406 K (1130 °C; 2070 °F) y es estable hasta el punto de fusión del manganeso de 1519 K (1250 °C; 2270 °F). Tiene una estructura cúbica centrada en el cuerpo (dos átomos por celda unitaria cúbica). [18] [24]
Compuestos químicos

Los estados de oxidación más comunes del manganeso son +2, +3, +4, +6 y +7, aunque se han observado todos los estados de oxidación de −3 a +7 excepto –2. El manganeso en estado de oxidación +7 está representado por sales del anión permanganato MnO de color púrpura intenso.−4El permanganato de potasio es un reactivo de laboratorio de uso común debido a sus propiedades oxidantes; se utiliza como medicamento tópico (por ejemplo, en el tratamiento de enfermedades de los peces). Las soluciones de permanganato de potasio estuvieron entre los primeros colorantes y fijadores que se utilizaron en la preparación de células y tejidos biológicos para la microscopía electrónica. [27]
Aparte de varias sales de permanganato, Mn(VII) está representado por el derivado inestable y volátil Mn2O7 . Los oxihaluros ( MnO3F y MnO3Cl ) son agentes oxidantes potentes . [10] El ejemplo más destacado de Mn en el estado de oxidación +6 es el anión verde manganato , [MnO4 ] 2− . Las sales de manganato son intermediarios en la extracción de manganeso de sus minerales. Los compuestos con estados de oxidación +5 son algo esquivos y a menudo se encuentran asociados a un ligando de óxido (O2− ) o nitruro ( N3− ). [28] Un ejemplo es el anión azul hipomanganato [MnO4 ] 3− . [ 29]
El Mn(IV) es un tanto enigmático porque es común en la naturaleza pero mucho más raro en la química sintética. El mineral de Mn más común, la pirolusita , es MnO2 . Es el pigmento marrón oscuro de muchos dibujos rupestres [30] pero también es un ingrediente común en las baterías de celdas secas . [31] Los complejos de Mn(IV) son bien conocidos, pero requieren ligandos elaborados . Los complejos Mn(IV)-OH son un intermediario en algunas enzimas , incluido el centro de evolución de oxígeno (OEC) en las plantas. [32]
Los derivados simples Mn 3+ son poco frecuentes, pero pueden estabilizarse con ligandos básicos adecuados. El acetato de manganeso (III) es un oxidante útil en la síntesis orgánica . Los compuestos sólidos de manganeso (III) se caracterizan por su color rojo púrpura intenso y una preferencia por la coordinación octaédrica distorsionada resultante del efecto Jahn-Teller . [33]

Un estado de oxidación particularmente común para el manganeso en solución acuosa es +2, que tiene un color rosa pálido. Se conocen muchos compuestos de manganeso (II), como los complejos acuosos derivados del sulfato de manganeso (II) (MnSO 4 ) y el cloruro de manganeso (II) (MnCl 2 ). Este estado de oxidación también se observa en el mineral rodocrosita ( carbonato de manganeso (II) ). El manganeso (II) existe comúnmente con un espín alto, S = 5/2 estado fundamental debido a la alta energía de apareamiento para el manganeso (II). No hay transiciones d–d permitidas por el espín en el manganeso (II), lo que explica su color tenue. [34]
| Estados de oxidación del manganeso [35] | |
|---|---|
| -3 | Mn(CO2)(NO3) 3 |
| -1 | HMn(CO2) 5 |
| 0 | Minnesota 2(CO) 10 |
| +1 | MnC 5yo 4es 3(CO) 3 |
| +2 | Cloruro de magnesio 2, MnCO 3, MnO |
| +3 | MnF 3, Mn(OAc) 3, Mn 2Oh 3 |
| +4 | MnO 2 |
| +5 | K 3MnO 4 |
| +6 | K 2MnO 4 |
| +7 | Kmno 4, Mn 2Oh 7 |
| Los estados de oxidación comunes están en negrita. | |
Compuestos de organomanganeso
El manganeso forma una gran variedad de derivados organometálicos, es decir, compuestos con enlaces Mn-C. Los derivados organometálicos incluyen numerosos ejemplos de Mn en sus estados de oxidación más bajos, es decir, Mn(−III) hasta Mn(I). Esta área de la química organometálica es atractiva porque el Mn es económico y de toxicidad relativamente baja. [36]
De mayor interés comercial es el "MMT", metilciclopentadienil manganeso tricarbonilo , que se utiliza como un compuesto antidetonante añadido a la gasolina (gasolina) en algunos países. Presenta Mn(I). En consonancia con otros aspectos de la química del Mn(II), el manganoceno ( Mn(C 5 H 5 ) 2 ) tiene un alto espín. Por el contrario, su metal vecino, el hierro, forma un derivado estable al aire y de bajo espín en forma de ferroceno ( Fe(C 5 H 5 ) 2 ). Cuando se realiza bajo una atmósfera de monóxido de carbono , la reducción de las sales de Mn(II) da lugar al decacarbonilo de dimanganeso Mn 2 (CO) 10 , un sólido naranja y volátil. La estabilidad al aire de este compuesto de Mn(0) (y sus numerosos derivados) refleja las potentes propiedades aceptoras de electrones del monóxido de carbono. Muchos complejos de alquenos y complejos de alquinos se derivan del Mn 2 (CO) 10 . [ cita requerida ]
En Mn(CH 3 ) 2 (dmpe) 2 , Mn(II) tiene un espín bajo, lo que contrasta con el carácter de espín alto de su precursor, MnBr 2 (dmpe) 2 ( dmpe = (CH 3 ) 2 PCH 2 CH 2 P(CH 3 ) 2 ). [37] Los derivados polialquílicos y poliarílicos del manganeso a menudo existen en estados de oxidación más altos, lo que refleja las propiedades de liberación de electrones de los ligandos alquilo y arilo. Un ejemplo es [Mn(CH 3 ) 6 ] 2− . [ cita requerida ]
Historia
El origen del nombre manganeso es complejo. En la antigüedad, se identificaron dos minerales negros de las regiones de los Magnetes (o bien Magnesia , situada dentro de la Grecia moderna, o Magnesia ad Sipylum , situada dentro de la Turquía moderna). [38] Ambos se llamaban magnes por su lugar de origen, pero se consideraba que diferían en el sexo. El magnes masculino atraía el hierro, y era el mineral de hierro que ahora se conoce como piedra imán o magnetita , y que probablemente nos dio el término imán . El mineral magnes femenino no atraía el hierro, pero se utilizaba para decolorar el vidrio. Este magnes femenino se llamó más tarde magnesia , conocido ahora en los tiempos modernos como pirolusita o dióxido de manganeso . [39] Ni este mineral ni el manganeso elemental son magnéticos. En el siglo XVI, los fabricantes de vidrio llamaban al dióxido de manganeso manganesum (nótese las dos N en lugar de una), posiblemente como una corrupción y concatenación de dos palabras, ya que los alquimistas y fabricantes de vidrio finalmente tuvieron que diferenciar una magnesia nigra (el mineral negro) de la magnesia alba (un mineral blanco, también de Magnesia, también útil en la fabricación de vidrio). Michele Mercati llamó a la magnesia nigra manganesa , y finalmente el metal aislado de ella se conoció como manganeso ( en alemán : Mangan ). El nombre magnesia finalmente se usó para referirse solo a la magnesia alba blanca (óxido de magnesio), que proporcionó el nombre magnesio para el elemento libre cuando se aisló mucho más tarde. [40]

El dióxido de manganeso, abundante en la naturaleza, se ha utilizado desde hace mucho tiempo como pigmento. Las pinturas rupestres de Gargas , que tienen entre 30.000 y 24.000 años de antigüedad, están hechas de pigmentos minerales de MnO2 . [ 42]
Los fabricantes de vidrio egipcios y romanos utilizaban compuestos de manganeso para añadir o quitar color al vidrio. [43] Su uso como "jabón de fabricantes de vidrio" continuó durante la Edad Media hasta los tiempos modernos y es evidente en el vidrio del siglo XIV de Venecia . [44]

Debido a que se utilizaba en la fabricación de vidrio, el dióxido de manganeso estaba disponible para experimentos de alquimistas, los primeros químicos. Ignatius Gottfried Kaim (1770) y Johann Glauber (siglo XVII) descubrieron que el dióxido de manganeso podía convertirse en permanganato , un reactivo de laboratorio útil. [45] Kaim también puede haber reducido el dióxido de manganeso para aislar el metal, pero eso es incierto. [46] A mediados del siglo XVIII, el químico sueco Carl Wilhelm Scheele utilizó dióxido de manganeso para producir cloro . Primero, se hizo reaccionar ácido clorhídrico , o una mezcla de ácido sulfúrico diluido y cloruro de sodio con dióxido de manganeso, y más tarde se utilizó ácido clorhídrico del proceso Leblanc y el dióxido de manganeso se recicló mediante el proceso Weldon . La producción de agentes blanqueadores de cloro e hipoclorito fue un gran consumidor de minerales de manganeso. [ cita requerida ]
Scheele y otros eran conscientes de que la pirolusita (forma mineral del dióxido de manganeso) contenía un nuevo elemento. Johan Gottlieb Gahn aisló una muestra impura de metal manganeso en 1774, lo que hizo reduciendo el dióxido con carbono . [47]
El contenido de manganeso de algunos minerales de hierro utilizados en Grecia dio lugar a especulaciones de que el acero producido a partir de ese mineral contiene manganeso adicional, lo que hace que el acero espartano sea excepcionalmente duro. [48] A principios del siglo XIX, el manganeso se utilizó en la fabricación de acero y se concedieron varias patentes. En 1816, se documentó que el hierro aleado con manganeso era más duro pero no más frágil. En 1837, el académico británico James Couper notó una asociación entre la fuerte exposición de los mineros al manganeso y una forma de enfermedad de Parkinson . [49] En 1912, se concedieron patentes en los Estados Unidos para proteger las armas de fuego contra el óxido y la corrosión con recubrimientos de conversión electroquímica de fosfato de manganeso, y el proceso ha tenido un uso generalizado desde entonces. [50]
La invención de la pila Leclanché en 1866 y la posterior mejora de las baterías que contenían dióxido de manganeso como despolarizador catódico aumentaron la demanda de dióxido de manganeso. Hasta el desarrollo de las baterías con níquel-cadmio y litio, la mayoría de las baterías contenían manganeso. La batería de zinc-carbono y la batería alcalina normalmente utilizan dióxido de manganeso producido industrialmente porque el dióxido de manganeso que se produce naturalmente contiene impurezas. En el siglo XX, el dióxido de manganeso se utilizó ampliamente como catódico para baterías secas desechables comerciales, tanto de tipo estándar (zinc-carbono) como alcalinas. [51]
El manganeso es esencial para la producción de hierro y acero en virtud de sus propiedades fijadoras de azufre , desoxidantes y de aleación . [52] Esta aplicación fue reconocida por primera vez por el metalúrgico británico Robert Forester Mushet (1811-1891) quien, en 1856, introdujo el elemento en forma de Spiegeleisen .
Aparición
El manganeso comprende alrededor de 1000 ppm (0,1%) de la corteza terrestre y es el duodécimo elemento más abundante. [8] El suelo contiene entre 7000 ppm de manganeso con un promedio de 440 ppm. [8] La atmósfera contiene 0,01 μg/m 3 . [8] El manganeso se presenta principalmente como pirolusita ( MnO 2 ), braunita (Mn 2+ Mn 3+ 6 )SiO 12 ), [53] psilomelano (Ba,H 2 O) 2 Mn 5 O 10 , y en menor medida como rodocrosita ( MnCO 3 ).
 |  |  |  |  |
| Mineral de manganeso | Psilomelano (mineral de manganeso) | Spiegeleisen es una aleación de hierro con un contenido de manganeso de aproximadamente el 15%. | Dendritas de óxido de manganeso en piedra caliza de Solnhofen , Alemania: una especie de pseudofósil . La escala está en mm. | Mineral rodocrosita ( carbonato de manganeso (II) ) |

El mineral de manganeso más importante es la pirolusita ( MnO 2 ). Otros minerales de manganeso económicamente importantes suelen mostrar una estrecha relación espacial con los minerales de hierro, como la esfalrita . [10] [54] Los recursos terrestres son grandes pero están distribuidos de forma irregular. Alrededor del 80% de los recursos mundiales de manganeso conocidos se encuentran en Sudáfrica; otros depósitos importantes de manganeso se encuentran en Ucrania, Australia, India, China, Gabón y Brasil. [52] Según una estimación de 1978, el fondo del océano tiene 500 mil millones de toneladas de nódulos de manganeso . [55] Los intentos de encontrar métodos económicamente viables para la recolección de nódulos de manganeso se abandonaron en la década de 1970. [56]
En Sudáfrica, la mayoría de los yacimientos identificados se encuentran cerca de Hotazel , en la provincia del Cabo del Norte (campos de manganeso de Kalahari), con una estimación de 15 mil millones de toneladas en 2011. En 2011, Sudáfrica produjo 3,4 millones de toneladas, superando a todas las demás naciones. [57]
El manganeso se extrae principalmente en Sudáfrica, Australia, China, Gabón, Brasil, India, Kazajstán, Ghana, Ucrania y Malasia. [58]
Producción
Para la producción de ferromanganeso , el mineral de manganeso se mezcla con mineral de hierro y carbono, y luego se reduce en un alto horno o en un horno de arco eléctrico. [59] El ferromanganeso resultante tiene un contenido de manganeso del 30 al 80%. [10] El manganeso puro utilizado para la producción de aleaciones sin hierro se produce mediante la lixiviación del mineral de manganeso con ácido sulfúrico y un proceso posterior de electroobtención . [60]

Un proceso de extracción más progresivo implica la reducción directa (de baja calidad) del mineral de manganeso mediante lixiviación en pilas . Esto se hace filtrando gas natural a través del fondo de la pila; el gas natural proporciona el calor (debe ser al menos de 850 °C) y el agente reductor (monóxido de carbono). Esto reduce todo el mineral de manganeso a óxido de manganeso (MnO), que es una forma lixiviable. Luego, el mineral pasa por un circuito de molienda para reducir el tamaño de partícula del mineral a entre 150 y 250 μm, lo que aumenta el área de superficie para facilitar la lixiviación. Luego, el mineral se agrega a un tanque de lixiviación de ácido sulfúrico y hierro ferroso (Fe 2+ ) en una proporción de 1,6:1. El hierro reacciona con el dióxido de manganeso (MnO 2 ) para formar hidróxido de hierro (FeO(OH)) y manganeso elemental (Mn). [ cita requerida ]
Este proceso permite recuperar aproximadamente el 92% del manganeso. Para una mayor purificación, el manganeso puede enviarse a una planta de electroobtención . [61]
Medio ambiente oceánico
En 1972, el Proyecto Azorian de la CIA , a través del multimillonario Howard Hughes , encargó el barco Hughes Glomar Explorer con la tapadera de recolectar nódulos de manganeso del fondo del mar. [62] Eso desencadenó una oleada de actividad para recolectar nódulos de manganeso, lo que en realidad no fue práctico hasta la década de 2020. La verdadera misión del Hughes Glomar Explorer era rescatar un submarino soviético hundido , el K-129 , con el objetivo de recuperar libros de códigos soviéticos. [63]
Un recurso abundante de manganeso en forma de nódulos de manganeso que se encuentran en el fondo del océano. [64] Estos nódulos, que están compuestos por un 29% de manganeso, [65] se encuentran a lo largo del fondo del océano . Los impactos ambientales de la recolección de nódulos son de interés. [66] [67]
El manganeso disuelto (dMn) se encuentra en todos los océanos del mundo, el 90% del cual se origina en respiraderos hidrotermales. [68] El Mn particulado se desarrolla en columnas flotantes sobre una fuente de ventilación activa, mientras que el dMn se comporta de manera conservadora. [69] Las concentraciones de Mn varían entre las columnas de agua del océano. En la superficie, el dMn se eleva debido a la entrada de fuentes externas como ríos, polvo y sedimentos de la plataforma. Los sedimentos costeros normalmente tienen concentraciones más bajas de Mn, pero pueden aumentar debido a descargas antropogénicas de industrias como la minería y la fabricación de acero, que ingresan al océano a través de los aportes de los ríos. Las concentraciones de dMn en la superficie también pueden elevarse biológicamente a través de la fotosíntesis y físicamente a partir de afloramientos costeros y corrientes superficiales impulsadas por el viento. El ciclo interno, como la fotorreducción de la radiación UV, también puede elevar los niveles al acelerar la disolución de los óxidos de Mn y la eliminación oxidativa, lo que evita que el Mn se hunda a aguas más profundas. [70] Los niveles elevados a profundidades medias pueden ocurrir cerca de las dorsales oceánicas y de los respiraderos hidrotermales. Los respiraderos hidrotermales liberan fluido enriquecido con dMn en el agua. El dMn puede entonces viajar hasta 4.000 km debido a las cápsulas microbianas presentes, impidiendo el intercambio con partículas, reduciendo las tasas de hundimiento. Las concentraciones de Mn disuelto son incluso más altas cuando los niveles de oxígeno son bajos. En general, las concentraciones de dMn son normalmente más altas en las regiones costeras y disminuyen cuando se desplazan mar adentro. [70]
Suelos
El manganeso se presenta en los suelos en tres estados de oxidación: el catión divalente, Mn2 + y como óxidos e hidróxidos de color marrón-negro que contienen Mn (III, IV), como MnOOH y MnO2 . El pH del suelo y las condiciones de oxidación-reducción afectan cuál de estas tres formas de Mn es dominante en un suelo determinado. A valores de pH inferiores a 6 o en condiciones anaeróbicas, domina el Mn(II), mientras que en condiciones más alcalinas y aeróbicas, predominan los óxidos e hidróxidos de Mn(III, IV). Estos efectos de la acidez del suelo y el estado de aireación sobre la forma de Mn pueden ser modificados o controlados por la actividad microbiana. La respiración microbiana puede causar tanto la oxidación de Mn2 + a los óxidos, como puede causar la reducción de los óxidos al catión divalente. [71]
Los óxidos de Mn(III,IV) existen como manchas de color marrón-negro y pequeños nódulos en partículas de arena, limo y arcilla. Estos recubrimientos superficiales en otras partículas del suelo tienen una gran área superficial y llevan carga negativa. Los sitios cargados pueden adsorber y retener varios cationes, especialmente metales pesados (por ejemplo, Cr 3+ , Cu 2+ , Zn 2+ y Pb 2+ ). Además, los óxidos pueden adsorber ácidos orgánicos y otros compuestos. La adsorción de los metales y compuestos orgánicos puede hacer que se oxiden mientras que los óxidos de Mn(III,IV) se reducen a Mn 2+ (por ejemplo, Cr 3+ a Cr(VI) y la hidroquinona incolora a polímeros de quinona de color té ). [72]
Aplicaciones
Acero

El manganeso es esencial para la producción de hierro y acero en virtud de sus propiedades fijadoras de azufre , desoxidantes y de aleación . El manganeso no tiene un sustituto satisfactorio en estas aplicaciones en la metalurgia. [52] La fabricación de acero , [73] incluido su componente de fabricación de hierro, ha representado la mayor parte de la demanda de manganeso, actualmente en el rango del 85% al 90% de la demanda total. [60] El manganeso es un componente clave del acero inoxidable de bajo costo . [74] [75] A menudo, el ferromanganeso (generalmente alrededor del 80% de manganeso) es el intermedio en los procesos modernos.
Pequeñas cantidades de manganeso mejoran la trabajabilidad del acero a altas temperaturas formando un sulfuro de alto punto de fusión y evitando la formación de un sulfuro de hierro líquido en los límites de grano. Si el contenido de manganeso alcanza el 4%, la fragilización del acero se convierte en una característica dominante. La fragilización disminuye a concentraciones más altas de manganeso y alcanza un nivel aceptable al 8%. El acero que contiene entre un 8 y un 15% de manganeso tiene una alta resistencia a la tracción de hasta 863 MPa. [76] [77] El acero con un 12% de manganeso fue descubierto en 1882 por Robert Hadfield y todavía se conoce como acero Hadfield (mangalloy) . Se utilizó para cascos de acero militares británicos y más tarde por el ejército estadounidense. [78]
Aleaciones de aluminio
El manganeso se utiliza en la producción de aleaciones con aluminio. El aluminio con aproximadamente un 1,5% de manganeso tiene una mayor resistencia a la corrosión a través de granos que absorben impurezas que darían lugar a corrosión galvánica . [79] Las aleaciones de aluminio resistentes a la corrosión 3004 y 3104 (entre un 0,8 y un 1,5% de manganeso) se utilizan para la mayoría de las latas de bebidas . [80] Antes de 2000, se utilizaban más de 1,6 millones de toneladas de esas aleaciones; con un 1% de manganeso, esto consumía 16.000 toneladas de manganeso. [ verificación fallida ] [80]
Baterías
El óxido de manganeso (IV) se utilizó en el tipo original de batería seca como aceptor de electrones del cinc, y es el material negruzco de las pilas de linterna de tipo carbono-cinc. El dióxido de manganeso se reduce al óxido-hidróxido de manganeso MnO(OH) durante la descarga, lo que evita la formación de hidrógeno en el ánodo de la batería. [81]
- MnO2 + H2O + e− → MnO (OH) + OH−
El mismo material también funciona en las baterías alcalinas más nuevas (normalmente celdas de batería), que utilizan la misma reacción básica, pero una mezcla de electrolitos diferente. En 2002, se utilizaron más de 230.000 toneladas de dióxido de manganeso para este propósito. [51] [81]

Resistencias
Las aleaciones de cobre y manganeso, como la manganina , se encuentran comúnmente en resistencias de derivación de elementos metálicos que se utilizan para medir cantidades relativamente grandes de corriente. Estas aleaciones tienen un coeficiente de resistencia de temperatura muy bajo y son resistentes al azufre. Esto hace que las aleaciones sean particularmente útiles en entornos industriales y automotrices hostiles. [82]
Fertilizantes y aditivos alimentarios
El óxido y el sulfato de manganeso son componentes de los fertilizantes. En el año 2000, se estima que se utilizaron 20.000 toneladas de estos compuestos en fertilizantes sólo en los Estados Unidos. Una cantidad comparable de compuestos de Mn también se utilizó en piensos para animales. [83]
Nicho
El metilciclopentadienil manganeso tricarbonilo es un aditivo presente en algunas gasolinas sin plomo para aumentar el octanaje y reducir el golpeteo del motor . [84]
El óxido de manganeso (IV) (dióxido de manganeso, MnO 2 ) se utiliza como reactivo en química orgánica para la oxidación de alcoholes bencílicos (donde el grupo hidroxilo está adyacente a un anillo aromático ). El dióxido de manganeso se ha utilizado desde la antigüedad para oxidar y neutralizar el tinte verdoso del vidrio a partir de trazas de contaminación con hierro. [44] El MnO 2 también se utiliza en la fabricación de oxígeno y cloro y en el secado de pinturas negras. En algunas preparaciones, es un pigmento marrón para pintura y es un componente de la sombra natural . [85]
El manganeso tetravalente se utiliza como activador en fósforos emisores de luz roja . Si bien se conocen muchos compuestos que muestran luminiscencia , [86] la mayoría no se utilizan en aplicaciones comerciales debido a su baja eficiencia o a su emisión de luz roja intensa. [87] [88] Sin embargo, se informó que varios fluoruros activados con Mn 4+ eran posibles fósforos emisores de luz roja para LED de color blanco cálido. [89] [90] Pero hasta el día de hoy, solo K 2 SiF 6 :Mn 4+ está disponible comercialmente para su uso en LED de color blanco cálido . [91]
El metal se utiliza ocasionalmente en monedas; hasta el año 2000, la única moneda de los Estados Unidos que utilizaba manganeso era la de níquel "de guerra" de 1942 a 1945. [92] Tradicionalmente se utilizaba una aleación de 75% de cobre y 25% de níquel para la producción de monedas de níquel. Sin embargo, debido a la escasez de níquel metálico durante la guerra, se sustituyó por plata y manganeso más disponibles, lo que dio como resultado una aleación de 56% de cobre, 35% de plata y 9% de manganeso. Desde el año 2000, las monedas de dólar , por ejemplo el dólar de Sacagawea y las monedas presidenciales de 1 dólar , están hechas de un latón que contiene un 7% de manganeso con un núcleo de cobre puro. [93] En ambos casos de níquel y dólar, el uso de manganeso en la moneda fue duplicar las propiedades electromagnéticas de una moneda anterior de tamaño y valor idénticos en los mecanismos de las máquinas expendedoras. En el caso de las monedas de dólar estadounidense posteriores, la aleación de manganeso tenía como objetivo duplicar las propiedades de la aleación de cobre y níquel utilizada en el dólar Susan B. Anthony anterior .
Los compuestos de manganeso se han utilizado como pigmentos y para colorear cerámica y vidrio. El color marrón de la cerámica es a veces el resultado de compuestos de manganeso. [94] En la industria del vidrio, los compuestos de manganeso se utilizan para dos efectos. El manganeso (III) reacciona con el hierro (II) para reducir el color verde intenso del vidrio formando hierro (III) menos coloreado y manganeso (II) ligeramente rosado, compensando el color residual del hierro (III). [44] Se utilizan mayores cantidades de manganeso para producir vidrio de color rosa. En 2009, Mas Subramanian y asociados en la Universidad Estatal de Oregón descubrieron que el manganeso se puede combinar con itrio e indio para formar un pigmento azul intenso , no tóxico, inerte y resistente a la decoloración , YInMn Blue , [95] el primer pigmento azul nuevo descubierto en 200 años. [96]
Bioquímica

Muchas clases de enzimas contienen cofactores de manganeso, incluyendo oxidorreductasas , transferasas , hidrolasas , liasas , isomerasas y ligasas . Otras enzimas que contienen manganeso son la arginasa y una superóxido dismutasa que contiene Mn ( Mn-SOD ). Algunas transcriptasas inversas de muchos retrovirus (aunque no lentivirus como el VIH ) contienen manganeso. Los polipéptidos que contienen manganeso son la toxina de la difteria , las lectinas y las integrinas . [97]
El complejo generador de oxígeno (OEC), que contiene cuatro átomos de manganeso, es una parte del fotosistema II contenido en las membranas tilacoides de los cloroplastos. El OEC es responsable de la fotooxidación terminal del agua durante las reacciones luminosas de la fotosíntesis , es decir, es el catalizador que produce el O 2 producido por las plantas. [98] [99]
Salud y nutrición humana
El manganeso es un elemento esencial de la dieta humana y está presente como coenzima en varios procesos biológicos, que incluyen el metabolismo de macronutrientes, la formación ósea y los sistemas de defensa contra radicales libres . El manganeso es un componente crítico en docenas de proteínas y enzimas. [7] El cuerpo humano contiene alrededor de 12 mg de manganeso, principalmente en los huesos. El resto del tejido blando se concentra en el hígado y los riñones. [8] En el cerebro humano, el manganeso está unido a las metaloproteínas de manganeso , más notablemente a la glutamina sintetasa en los astrocitos . [100]
| Hombres | Hembras | ||
|---|---|---|---|
| Edad | IA (mg/día) | Edad | IA (mg/día) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| Embarazada: 2 | |||
| lactancia: 2,6 | |||
Regulación
El Instituto de Medicina de los Estados Unidos (IOM) actualizó los Requerimientos Promedio Estimados (EAR) y las Ingestas Dietéticas Recomendadas (RDA) para minerales en 2001. En el caso del manganeso, no había suficiente información para establecer EAR y RDA, por lo que las necesidades se describen como estimaciones de Ingestas Adecuadas (IA). En cuanto a la seguridad, el IOM establece Niveles Máximos de Ingesta Tolerables (UL) para vitaminas y minerales cuando hay evidencia suficiente. En el caso del manganeso, el UL para adultos se establece en 11 mg/día. En conjunto, los EAR, RDA, AI y UL se denominan Ingestas Dietéticas de Referencia (DRI). [101] La deficiencia de manganeso es rara. [102]
La Autoridad Europea de Seguridad Alimentaria (AESA) se refiere al conjunto colectivo de información como Valores Dietéticos de Referencia, con Ingesta de Referencia Poblacional (PRI) en lugar de RDA, y Requerimiento Promedio en lugar de EAR. La IA y el UL se definen de la misma manera que en los Estados Unidos. Para personas de 15 años o más, la IA se establece en 3,0 mg/día. Las IA para el embarazo y la lactancia son de 3,0 mg/día. Para niños de 1 a 14 años, las IA aumentan con la edad de 0,5 a 2,0 mg/día. Las IA para adultos son más altas que las RDA de EE. UU. [103] La AESA revisó la misma cuestión de seguridad y decidió que no había suficiente información para establecer un UL. [104]
Para los fines del etiquetado de alimentos y suplementos dietéticos en los EE. UU., la cantidad en una porción se expresa como un porcentaje del valor diario (% VD). Para los fines del etiquetado de manganeso, el 100 % del valor diario era 2,0 mg, pero a partir del 27 de mayo de 2016 se revisó a 2,3 mg para que coincidiera con la dosis diaria recomendada. [105] [106] Se proporciona una tabla de los valores diarios antiguos y nuevos para adultos en Ingesta diaria de referencia .
La exposición o ingesta excesiva puede provocar una afección conocida como manganismo , un trastorno neurodegenerativo que causa muerte neuronal dopaminérgica y síntomas similares a la enfermedad de Parkinson . [8] [107]
Deficiencia
La deficiencia de manganeso en los seres humanos, que es poco frecuente, provoca diversos problemas médicos. La deficiencia de manganeso provoca deformaciones óseas en los animales e inhibe la producción de colágeno en la cicatrización de heridas. [108]
Exposición
En el agua
El manganeso presente en el agua tiene una biodisponibilidad mayor que el manganeso presente en la dieta. Según los resultados de un estudio de 2010, [109] los niveles más altos de exposición al manganeso en el agua potable están asociados con un mayor deterioro intelectual y una reducción del coeficiente intelectual en los niños en edad escolar. Se ha planteado la hipótesis de que la exposición a largo plazo debido a la inhalación del manganeso presente de forma natural en el agua de la ducha pone en riesgo a hasta 8,7 millones de estadounidenses. [110] Sin embargo, los datos indican que el cuerpo humano puede recuperarse de ciertos efectos adversos de la sobreexposición al manganeso si se detiene la exposición y el cuerpo puede eliminar el exceso. [111]
Los niveles de Mn pueden aumentar en el agua de mar cuando ocurren períodos hipóxicos. [112] Desde 1990 ha habido informes de acumulación de Mn en organismos marinos, incluidos peces, crustáceos, moluscos y equinodermos. Los tejidos específicos son objetivos en diferentes especies, incluidas las branquias, el cerebro, la sangre, los riñones y el hígado / hepatopáncreas . Se han informado efectos fisiológicos en estas especies. El Mn puede afectar la renovación de los inmunocitos y su funcionalidad, como la fagocitosis y la activación de la profenoloxidasa , suprimiendo los sistemas inmunológicos de los organismos. Esto hace que los organismos sean más susceptibles a las infecciones. A medida que ocurre el cambio climático, las distribuciones de patógenos aumentan y, para que los organismos sobrevivan y se defiendan contra estos patógenos, necesitan un sistema inmunológico saludable y fuerte. Si sus sistemas se ven comprometidos por altos niveles de Mn, no podrán luchar contra estos patógenos y morirán. [68]
Gasolina

El metilciclopentadienil manganeso tricarbonil (MMT) es un aditivo desarrollado para reemplazar los compuestos de plomo en las gasolinas y mejorar el índice de octano . El MMT se utiliza solo en unos pocos países. Los combustibles que contienen manganeso tienden a formar carburos de manganeso, que dañan las válvulas de escape .
Aire
En comparación con 1953, los niveles de manganeso en el aire han disminuido. [113] En general, la exposición a concentraciones de Mn en el aire ambiente superiores a 5 μg Mn/m 3 puede provocar síntomas inducidos por Mn. El aumento de la expresión de la proteína ferroportina en células de riñón embrionario humano (HEK293) se asocia con una disminución de la concentración intracelular de Mn y una citotoxicidad atenuada , caracterizada por la reversión de la absorción de glutamato reducida por Mn y una disminución de la fuga de lactato deshidrogenasa . [114]
Regulación
La exposición al manganeso en Estados Unidos está regulada por la Administración de Seguridad y Salud Ocupacional (OSHA). [115] Las personas pueden estar expuestas al manganeso en el lugar de trabajo al respirarlo o tragarlo. La OSHA ha establecido el límite legal ( límite de exposición permisible ) para la exposición al manganeso en el lugar de trabajo en 5 mg/m 3 durante una jornada laboral de 8 horas. El Instituto Nacional para la Seguridad y Salud Ocupacional (NIOSH) ha establecido un límite de exposición recomendado (REL) de 1 mg/m 3 durante una jornada laboral de 8 horas y un límite a corto plazo de 3 mg/m 3 . En niveles de 500 mg/m 3 , el manganeso es inmediatamente peligroso para la vida y la salud . [116]
Salud y seguridad
El manganeso es esencial para la salud humana, aunque en cantidades de miligramos.
La concentración máxima segura actual según las normas de la EPA de EE. UU. es de 50 μg Mn/L. [117]
Manganismo
La sobreexposición al manganeso se asocia con mayor frecuencia al manganismo , un trastorno neurológico poco común asociado con la ingestión o inhalación excesiva de manganeso. Históricamente, las personas empleadas en la producción o procesamiento de aleaciones de manganeso [118] [119] han estado en riesgo de desarrollar manganismo; sin embargo, las regulaciones de salud y seguridad protegen a los trabajadores en las naciones desarrolladas. [115] El trastorno fue descrito por primera vez en 1837 por el académico británico John Couper, quien estudió a dos pacientes que eran molinillos de manganeso. [49]
El manganismo es un trastorno bifásico. En sus primeras etapas, una persona intoxicada puede experimentar depresión, cambios de humor, conductas compulsivas y psicosis. Los síntomas neurológicos tempranos dan paso al manganismo en etapa tardía, que se asemeja a la enfermedad de Parkinson . Los síntomas incluyen debilidad, habla monótona y lenta, rostro inexpresivo, temblor, marcha inclinada hacia adelante, incapacidad para caminar hacia atrás sin caerse, rigidez y problemas generales con la destreza, la marcha y el equilibrio. [49] [120] A diferencia de la enfermedad de Parkinson , el manganismo no está asociado con la pérdida del sentido del olfato y los pacientes generalmente no responden al tratamiento con L-DOPA . [121] Los síntomas del manganismo en etapa tardía se vuelven más graves con el tiempo incluso si se elimina la fuente de exposición y los niveles de manganeso en el cerebro vuelven a la normalidad. [120]
Se ha demostrado que la exposición crónica al manganeso produce una enfermedad similar al parkinsonismo caracterizada por anomalías del movimiento. [122] Esta afección no responde a las terapias típicas utilizadas en el tratamiento de la EP , lo que sugiere una vía alternativa a la pérdida dopaminérgica típica dentro de la sustancia negra . [122] El manganeso puede acumularse en los ganglios basales , lo que lleva a los movimientos anormales. [123] Una mutación del gen SLC30A10, un transportador de eflujo de manganeso necesario para disminuir el Mn intracelular, se ha relacionado con el desarrollo de esta enfermedad similar al parkinsonismo. [124] Los cuerpos de Lewy típicos de la EP no se ven en el parkinsonismo inducido por Mn. [123]
Los experimentos con animales han permitido examinar las consecuencias de la sobreexposición al manganeso en condiciones controladas. En ratas (no agresivas), el manganeso induce un comportamiento de matanza de ratones. [125]
Toxicidad
| Peligros | |
|---|---|
| Etiquetado SGA : | |
| H401 | |
| P273 , P501 [126] | |
| NFPA 704 (rombo cortafuegos) | |
Los compuestos de manganeso son menos tóxicos que los de otros metales comunes, como el níquel y el cobre . [127] Sin embargo, la exposición a polvos y humos de manganeso no debe superar el valor máximo de 5 mg/m3 incluso durante períodos cortos debido a su nivel de toxicidad. [128] El envenenamiento por manganeso se ha relacionado con el deterioro de las habilidades motoras y los trastornos cognitivos . [129]
Enfermedades neurodegenerativas
Una proteína llamada DMT1 es el principal transportador en la absorción de manganeso desde el intestino y puede ser el principal transportador de manganeso a través de la barrera hematoencefálica . DMT1 también transporta manganeso inhalado a través del epitelio nasal . El mecanismo propuesto para la toxicidad del manganeso es que la desregulación conduce al estrés oxidativo , disfunción mitocondrial , excitotoxicidad mediada por glutamato y agregación de proteínas. [130]
Véase también
- Exportador de manganeso , proteína transportadora de membrana
- Lista de países según producción de manganeso
- Parkerización
Referencias
- ^ "Pesos atómicos estándar: manganeso". CIAAW . 2017.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcdef Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ ab Erikson, Keith M.; Ascher, Michael (2019). "Capítulo 10. Manganeso: su papel en la enfermedad y la salud". En Sigel, Astrid; Freisinger, Eva; Sigel, Roland KO; Carver, Peggy L. (eds.). Metales esenciales en medicina: uso terapéutico y toxicidad de iones metálicos en la clínica . Iones metálicos en las ciencias de la vida. Vol. 19. Berlín: de Gruyter GmbH. págs. 253–266. doi :10.1515/9783110527872-016. ISBN . 978-3-11-052691-2. Número de identificación personal 30855111. Número de identificación personal 73725546.
- ^ abcdef Emsley, John (2001). "Manganeso". Los elementos básicos de la naturaleza: una guía de la A a la Z de los elementos. Oxford, Reino Unido: Oxford University Press. págs. 249–253. ISBN 978-0-19-850340-8.
- ^ Roth, Jerome; Ponzoni, Silvia; Aschner, Michael (2013). "Homeostasis y transporte del manganeso". En Banci, Lucia (ed.). Metalómica y la célula . Iones metálicos en las ciencias de la vida. Vol. 12. Springer. págs. 169–201. doi :10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5560-4. PMC 6542352 . PMID 23595673.Libro electrónico ISBN 978-94-007-5561-1 .
- ^ abcd Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Mangan". Lehrbuch der Anorganischen Chemie (en alemán) (91-100 ed.). Walter de Gruyter. págs. 1110-1117. ISBN 978-3-11-007511-3.
- ^ Lide, David R. (2004). Susceptibilidad magnética de los elementos y compuestos inorgánicos, en Handbook of Chemistry and Physics. CRC press. ISBN 978-0-8493-0485-9Archivado desde el original el 17 de diciembre de 2019 . Consultado el 7 de septiembre de 2019 .
- ^ Manganeso en la Enciclopedia Británica
- ^ ab Audi, G.; Kondev, FG; Wang, M.; Huang, WJ; Naimi, S. (2017). "La evaluación NUBASE2016 de las propiedades nucleares" (PDF) . Chinese Physics C . 41 (3): 030001. Bibcode :2017ChPhC..41c0001A. doi :10.1088/1674-1137/41/3/030001.
- ^ Clery, Daniel (4 de junio de 2020). «Las explosiones más brillantes de la galaxia se vuelven nucleares con un detonante inesperado: pares de estrellas muertas». Science . Consultado el 26 de julio de 2021 .
- ^ Schaefer, Jeorg; Faestermann, Thomas; Herzog, Gregorio F.; Knie, Klaus; Korschinek, Gunther; Masarik, Jozef; Meier, Astrid; Poutivtsev, Michail; Rugel, Georg; Schlüchter, Christian; Serifiddin, Feride; Winckler, Gisela (2006). "Manganeso terrestre-53: un nuevo monitor de los procesos de la superficie de la Tierra". Cartas sobre ciencias planetarias y de la Tierra . 251 (3–4): 334–345. Código Bib : 2006E y PSL.251..334S. doi :10.1016/j.epsl.2006.09.016.
- ^
- Birck, J.; Rotaru, M.; Allègre, C. (1999). "Evolución 53Mn-53Cr del sistema solar primitivo". Geochimica et Cosmochimica Acta . 63 (23–24): 4111–4117. Código Bib : 1999GeCoA..63.4111B. doi :10.1016/S0016-7037(99)00312-9.
- Lugmair, G.; Shukolyukov, A. (1998). "Escalas temporales del sistema solar temprano según la sistemática 53Mn-53Cr". Geochimica et Cosmochimica Acta . 62 (16): 2863–2886. Código Bibliográfico :1998GeCoA..62.2863L. doi :10.1016/S0016-7037(98)00189-6.
- Shukolyukov, Alexander; Lugmair, Günter W. (2000). "Sobre la heterogeneidad del 53Mn en el sistema solar primitivo". Space Science Reviews . 92 : 225–236. Bibcode :2000SSRv...92..225S. doi :10.1023/A:1005243228503.
- Trinquier, A.; Birck, J.; Allègre, C.; Göpel, C.; Ulfbeck, D. (2008). "Revisión de la sistemática 53Mn-53Cr del Sistema Solar temprano". Geochimica et Cosmochimica Acta . 72 (20): 5146–5163. Código Bib : 2008GeCoA..72.5146T. doi :10.1016/j.gca.2008.03.023.
- ^ abc Young, DA (1975). «Diagramas de fases de los elementos». Sistema Internacional de Información Nuclear . LNL: 15. Consultado el 30 de enero de 2023 .
- ^ ab Dhananjayan, N.; Banerjee, T. (1969). Modificaciones cristalográficas del manganeso y sus características de transformación. Capítulo 1 de: Estructura del manganeso electrodepositado. CSIR-NML. págs. 3–28.
- ^ Kemmitt, RDW; Peacock, RD (1973). La química del manganeso, el tecnecio y el renio. Textos de Pérgamo sobre química inorgánica . Saint Louis: Elsevier Science. pág. 778. ISBN 978-1-4831-3806-0.OCLC 961064866 .
- ^ Bradley, AJ; Thewlis, J. (1927). "La estructura cristalina del α-manganeso". Actas de la Royal Society de Londres, Serie A . 115 (771): 456–471. Bibcode :1927RSPSA.115..456B. doi : 10.1098/rspa.1927.0103 . ISSN 0950-1207.
- ^ Lawson, AC; Larson, Allen C.; Aronson, MC; et al. (1994). "Orden magnético y cristalográfico en α-manganeso". J. Appl. Phys . 76 (10): 7049–7051. Bibcode :1994JAP....76.7049L. doi :10.1063/1.358024. ISSN 0021-8979.
- ^ ab Prior, Timothy J; Nguyen-Manh, Duc; Couper, Victoria J; Battle, Peter D (2004). "Ferromagnetismo en la estructura del beta-manganeso: Fe 1,5 Pd 0,5 Mo 3 N". Revista de Física: Materia Condensada . 16 (13): 2273–2281. Bibcode :2004JPCM...16.2273P. doi :10.1088/0953-8984/16/13/008. ISSN 0953-8984. S2CID 250784683.
- ^ Funahashi, S.; Kohara, T. (1984). "Dispersión difusa de neutrones en β-manganeso". J. Appl. Phys . 55 (6): 2048–2050. Código Bibliográfico :1984JAP....55.2048F. doi :10.1063/1.333561. ISSN 0021-8979.
- ^ abc Duschanek, H.; Mohn, P.; Schwarz, K. (1989). "Generalización antiferromagnética y ferromagnética del método del momento de espín fijo para el gamma-manganeso". Physica B: Condensed Matter . 161 (1–3): 139–142. doi :10.1016/0921-4526(89)90120-8. ISSN 0921-4526.
- ^ Bacon, GE; Cowlam, N (1970). "Un estudio de algunas aleaciones de gamma-manganeso por difracción de neutrones". Journal of Physics C: Solid State Physics . 3 (3): 675–686. Bibcode :1970JPhC....3..675B. doi :10.1088/0022-3719/3/3/023. ISSN 0022-3719.
- ^ "Cap. 20". Química inorgánica de Shriver y Atkins . Oxford University Press. 2010. ISBN 978-0-19-923617-6.
- ^ Luft, JH (1956). "Permanganato: un nuevo fijador para microscopía electrónica". Revista de citología biofísica y bioquímica . 2 (6): 799–802. doi :10.1083/jcb.2.6.799. PMC 2224005 . PMID 13398447.
- ^
- Man, Wai-Lun; Lam, William WY; Lau, Tai-Chu (2014). "Reactividad de complejos de nitrilo de rutenio (VI), osmio (VI) y manganeso (V) que contienen base de Schiff y ligandos aniónicos simples". Accounts of Chemical Research . 47 (2): 427–439. doi :10.1021/ar400147y. PMID 24047467.
- Goldberg, David P. (2007). "Corrolazinas: nuevas fronteras en la estabilidad y reactividad de los metaloporfirinoides de alta valencia". Accounts of Chemical Research . 40 (7): 626–634. doi :10.1021/ar700039y. PMID 17580977.
- ^ Greenwood y Earnshaw 1984, págs. 1221–22.
- ^ Hola, Peter J.; Anastasakis, Konstantinos; De Jong, Wiebren; Van Hoesel, Annelies; Roebroeks, Wil; Soressi, María (2016). "Selección y uso de dióxido de manganeso por los neandertales". Informes científicos . 6 : 22159. doi : 10.1038/srep22159. PMC 4770591 . PMID 26922901.
- ^ Greenwood y Earnshaw 1984, págs. 1218–20.
- ^ Yano, Junko; Yachandra, Vittal (2014). "Clúster Mn4Ca en la fotosíntesis: dónde y cómo se oxida el agua a dioxígeno". Chemical Reviews . 114 (8): 4175–4205. doi :10.1021/cr4004874. PMC 4002066 . PMID 24684576.
- ^ Arslan, Evrim; Lalancette, Roger A.; Bernal, Ivan (2017). "Un estudio histórico y científico de las propiedades de los tris-acetilacetonatos de metal(III)". Struct Chem . 28 : 201–212. doi :10.1007/s11224-016-0864-0.
- ^ Rayner-Canham, Geoffrey; Overton, Tina (2003). Química inorgánica descriptiva . Macmillan. pág. 491. ISBN. 0-7167-4620-4..
- ^ Schmidt, Max (1968). "VII. Grupo Neben". Anorganische Chemie II (en alemán). Wissenschaftsverlag. págs. 100-109.
- ^ Kadassery, Karthika J.; MacMillan, Samantha N.; Lacy, David C. (2019). "Resurgimiento de la química del organomanganeso(I). Complejos bidentados de fosfina-fenol(ato) de manganeso(I)". Química inorgánica . 58 (16): 10527–10535. doi :10.1021/acs.inorgchem.9b00941. PMID 31247867.
- ^ Girolami, Gregory S.; Wilkinson, Geoffrey; Thornton-Pett, Mark; Hursthouse, Michael B. (1983). "Complejos de hidrido, alquilo y etileno 1,2-bis(dimetilfosfino)etano de manganeso y las estructuras cristalinas de MnBr2(dmpe)2, [Mn(AlH4)(dmpe)2]2 y MnMe2(dmpe)2". Revista de la Sociedad Química Americana . 105 (22): 6752–6753. doi :10.1021/ja00360a054.
- ^ languagehat (28 de mayo de 2005). "MAGNET". languagehat.com . Consultado el 18 de junio de 2020 .
- ^ Plinio el Viejo . "Capítulo 25—EL IMÁN: TRES REMEDIOS". Historia natural de Plinio. LIBRO XXXVI. HISTORIA NATURAL DE LAS PIEDRAS.
- ^ Calvert, JB (24 de enero de 2003). «Cromo y manganeso». Archivado desde el original el 31 de diciembre de 2016. Consultado el 10 de diciembre de 2022 .
- ^ Chalmin, Emilie; Menu, Michel; Vignaud, Colette (2003). "Análisis de la pintura rupestre y la tecnología de los pintores paleolíticos". Measurement Science and Technology . 14 (9): 1590–1597. doi :10.1088/0957-0233/14/9/310. S2CID 250842390.
- ^ Chalmin, E.; Vignaud, C.; Salomon, H.; Farges, F.; Susini, J.; Menu, M. (2006). "Minerales descubiertos en pigmentos negros paleolíticos mediante microscopía electrónica de transmisión y microabsorción de rayos X en la estructura cercana al borde" (PDF) . Applied Physics A . 83 (12): 213–218. Bibcode :2006ApPhA..83..213C. doi :10.1007/s00339-006-3510-7. hdl :2268/67458. S2CID 9221234.
- ^ Sayre, EV; Smith, RW (1961). "Categorías compositivas del vidrio antiguo". Science . 133 (3467): 1824–1826. Bibcode :1961Sci...133.1824S. doi :10.1126/science.133.3467.1824. PMID 17818999. S2CID 25198686.
- ^ abc Mccray, W. Patrick (1998). "La fabricación de vidrio en la Italia del Renacimiento: la innovación del cristal veneciano". JOM . 50 (5): 14–19. Bibcode :1998JOM....50e..14M. doi :10.1007/s11837-998-0024-0. S2CID 111314824.
- ^ Rancke-Madsen, E. (1975). "El descubrimiento de un elemento". Centaurus . 19 (4): 299–313. Bibcode :1975Cent...19..299R. doi :10.1111/j.1600-0498.1975.tb00329.x.
- ^ Miśkowiec, Paweł (2022). "Juego de nombres: la historia de los nombres de los elementos químicos, parte 1, desde la antigüedad hasta finales del siglo XVIII". Fundamentos de la química . 25 : 29–51. doi : 10.1007/s10698-022-09448-5 .
- ^ Hadfield, Robert (1927). "El manganeso metálico y sus propiedades: también minerales, y la producción de ferromanganeso y su historia". Revista del Instituto del Hierro y el Acero . 115 (1): 251–252.
- ^ Alessio, L.; Campagna, M.; Lucchini, R. (2007). "Del plomo al manganeso pasando por el mercurio: mitología, ciencia y lecciones para la prevención". American Journal of Industrial Medicine . 50 (11): 779–787. doi :10.1002/ajim.20524. PMID 17918211.
- ^ abc Couper, John (1837). "Sobre los efectos del óxido negro de manganeso cuando se inhala en los pulmones". Br. Ann. Med. Pharm. Vital. Stat. Gen. Sci . 1 : 41–42.
- ^ Olsen, Sverre E.; Tangstad, Merete; Lindstad, Tor (2007). "Historia de los omanganeses". Producción de Ferroaleaciones de Manganeso . Prensa Académica Tapir. págs. 11-12. ISBN 978-82-519-2191-6.
- ^ ab Preisler, Eberhard (1980). "Moderne Verfahren der Großchemie: Braunstein". Chemie en unserer Zeit (en alemán). 14 (5): 137-148. doi :10.1002/ciuz.19800140502.
- ^ abcd Resúmenes de productos minerales 2009 (informe). División de Recursos Hídricos, Servicio Geológico de Estados Unidos. 2009. doi :10.3133/mineral2009.
- ^ Bhattacharyya, PK; Dasgupta, Somnath; Fukuoka, M.; Roy Supriya (1984). "Geoquímica de la braunita y fases asociadas en minerales de manganeso no calcáreos metamorfoseados de la India". Contribuciones a la mineralogía y la petrología . 87 (1): 65–71. Bibcode :1984CoMP...87...65B. doi :10.1007/BF00371403. S2CID 129495326.
- ^ Cocinero, Nigel J.; Ciobanu, Cristiana L.; Pring, Allan; Skinner, William; Shimizu, Masaaki; Danyushevsky, Leonid; Saini-Eidukat, Bernhardt; Melcher, Frank (2009). "Trazas y elementos menores en esfalerita: un estudio de LA-ICPMS". Geochimica et Cosmochimica Acta . 73 (16): 4761–4791. Código Bib : 2009GeCoA..73.4761C. doi :10.1016/j.gca.2009.05.045.
- ^ Wang, X; Schröder, HC; Wiens, M; Schlossmacher, U; Müller, WEG (2009). "Nódulos polimetálicos/manganeso: caracterización microestructural de biopelículas microbianas exolitobiónicas y endolitobiónicas mediante microscopía electrónica de barrido". Micron . 40 (3): 350–358. doi :10.1016/j.micron.2008.10.005. PMID 19027306.
- ^ Naciones Unidas (1978). "Nódulos de manganeso: dimensiones y perspectivas". Geología marina . Biblioteca del Foro de Recursos Naturales. 41 (3–4). Springer: 343. Bibcode :1981MGeol..41..343C. doi :10.1016/0025-3227(81)90092-X. ISBN 978-90-277-0500-6.OCLC 4515098 .
- ^ "Minería de manganeso en Sudáfrica: descripción general". MBendi Information Services. Archivado desde el original el 5 de febrero de 2016. Consultado el 10 de diciembre de 2022 .
- ^ Elliott, R; Coley, K; Mostaghel, S; Barati, M (2018). "Revisión del procesamiento de manganeso para la producción de aceros TRIP/TWIP, parte 1: práctica actual y fundamentos del procesamiento". JOM . 70 (5): 680–690. Bibcode :2018JOM....70e.680E. doi :10.1007/s11837-018-2769-4. S2CID 139950857.
- ^ Corathers, LA; Machamer, JF (2006). "Manganeso". Minerales y rocas industriales: productos básicos, mercados y usos (7.ª ed.). SME. págs. 631–636. ISBN 978-0-87335-233-8.
- ^ ab Zhang, Wensheng; Cheng, Chu Yong (2007). "Revisión de la metalurgia del manganeso. Parte I: Lixiviación de minerales/materiales secundarios y recuperación de dióxido de manganeso electrolítico/químico". Hidrometalurgia . 89 (3–4): 137–159. Código Bibliográfico :2007HydMe..89..137Z. doi :10.1016/j.hydromet.2007.08.010.
- ^ Chow, Norman; Nacu, Anca; Warkentin, Doug; Aksenov, Igor y Teh, Hoe (2010). "Recuperación de manganeso a partir de recursos de baja calidad: programa de pruebas metalúrgicas a escala de laboratorio completado" (PDF) . Kemetco Research Inc. Archivado desde el original (PDF) el 2 de febrero de 2012.
- ^ "El secreto de la CIA en el fondo del océano". BBC News . 19 de febrero de 2018 . Consultado el 3 de mayo de 2018 .
- ^ "Proyecto Azorian: La historia desclasificada de la CIA sobre el Glomar Explorer". Archivo de Seguridad Nacional de la Universidad George Washington. 12 de febrero de 2010. Consultado el 18 de septiembre de 2013 .
- ^ Hein, James R. (enero de 2016). Enciclopedia de geociencias marinas: nódulos de manganeso. Springer. págs. 408–412 . Consultado el 2 de febrero de 2021 .
- ^ Autoridad Internacional de los Fondos Marinos. «Nódulos polimetálicos» (PDF) . isa.org . Autoridad Internacional de los Fondos Marinos. Archivado desde el original (PDF) el 23 de octubre de 2021 . Consultado el 2 de febrero de 2021 .
- ^ Oebius, Horst U; Becker, Hermann J; Rolinski, Susanne; Jankowski, Jacek A (enero de 2001). "Parametrización y evaluación de los impactos ambientales marinos producidos por la minería de nódulos de manganeso en aguas profundas". Investigación en aguas profundas, parte II: estudios temáticos en oceanografía . 48 (17–18): 3453–3467. Bibcode :2001DSRII..48.3453O. doi :10.1016/s0967-0645(01)00052-2. ISSN 0967-0645.
- ^ Thompson, Kirsten F.; Miller, Kathryn A.; Currie, Duncan; Johnston, Paul; Santillo, David (2018). "Minería de los fondos marinos y enfoques para la gobernanza de los fondos marinos profundos". Frontiers in Marine Science . 5 . doi : 10.3389/fmars.2018.00480 . hdl : 10871/130176 . S2CID 54465407.
- ^ ab Hernroth, Bodil; Tassidis, Helena; Baden, Susanne P. (marzo de 2020). "Inmunosupresión de organismos acuáticos expuestos a niveles elevados de manganeso: de la perspectiva global a la molecular". Inmunología comparada y del desarrollo . 104 : 103536. doi : 10.1016/j.dci.2019.103536. ISSN 0145-305X. PMID 31705914. S2CID 207935992.
- ^ Ray, Durbar; Babu, EVSSK; Surya Prakash, L. (1 de enero de 2017). "Naturaleza de las partículas suspendidas en la columna hidrotermal en la dorsal de Carlsberg de 3°40'N: una comparación con la materia suspendida en las profundidades oceánicas". Current Science . 112 (1): 139. doi : 10.18520/cs/v112/i01/139-146 . ISSN 0011-3891.
- ^ ab Sim, Nari; Orians, Kristin J. (octubre de 2019). "Variabilidad anual del manganeso disuelto en el noreste del Pacífico a lo largo de la línea P: 2010-2013". Química marina . 216 : 103702. Bibcode :2019MarCh.21603702S. doi :10.1016/j.marchem.2019.103702. ISSN 0304-4203. S2CID 203151735.
- ^ Bartlett, Richmond; Ross, Donald (2005). "Química de los procesos redox en suelos". En Tabatabai, MA; Sparks, DL (eds.). Procesos químicos en suelos . Serie de libros de la SSSA, núm. 8. Madison, Wisconsin: Soil Science Society of America. págs. 461–487. LCCN 2005924447.
- ^ Dixon, Joe B.; White, G. Norman (2002). "Óxidos de manganeso". En Dixon, JB; Schulze, DG (eds.). Mineralogía del suelo con aplicaciones ambientales . Serie de libros SSSA n.º 7. Madison, Wisconsin: Soil Science Society of America. págs. 367–386. LCCN 2002100258.
- ^ Verhoeven, John D. (2007). Metalurgia del acero para no metalúrgicos . Materials Park, Ohio: ASM International. pp. 56–57. ISBN 978-0-87170-858-8.
- ^ Manganeso USGS 2006
- ^ Dastur, YN; Leslie, WC (1981). "Mecanismo de endurecimiento por trabajo en acero al manganeso Hadfield". Metallurgical Transactions A . 12 (5): 749–759. Bibcode :1981MTA....12..749D. doi :10.1007/BF02648339. S2CID 136550117.
- ^ Stansbie, John Henry (2007). Hierro y acero. Leer libros. Págs. 351–352. ISBN 978-1-4086-2616-0.
- ^ Brady, George S.; Clauser, Henry R.; Vaccari. John A. (2002). Manual de materiales: una enciclopedia para gerentes, profesionales técnicos, gerentes de compras y producción, técnicos y supervisores. Nueva York, NY: McGraw-Hill. págs. 585–587. ISBN 978-0-07-136076-0.
- ^ Tweedale, Geoffrey (1985). "Sir Robert Abbott Hadfield FRS (1858–1940) y el descubrimiento del acero al manganeso Geoffrey Tweedale". Notas y registros de la Royal Society de Londres . 40 (1): 63–74. doi :10.1098/rsnr.1985.0004. JSTOR 531536. S2CID 73176861.
- ^ "Las propiedades químicas del aluminio 2024 permiten". Metal Suppliers Online, LLC . Consultado el 30 de abril de 2009 .
- ^ ab Kaufman, John Gilbert (2000). "Aplicaciones para aleaciones y temples de aluminio". Introducción a las aleaciones y temples de aluminio . ASM International. págs. 93–94. ISBN 978-0-87170-689-8.
- ^ ab Dell, RM (2000). "Baterías: cincuenta años de desarrollo de materiales". Solid State Ionics . 134 (1–2): 139–158. doi :10.1016/S0167-2738(00)00722-0.
- ^ "WSK1216" (PDF) . vishay . Vishay Intertechnology . Consultado el 30 de abril de 2022 .
- ^ Reidies, Arno H. (2000). "Compuestos de manganeso". Ullmann's Encyclopedia of Industrial Chemistry . doi :10.1002/14356007.a16_123. ISBN 9783527303854.
- ^ "Comentarios de la EPA sobre el MMT de aditivos para gasolina". epa.gov . EPA. 5 de octubre de 2015 . Consultado el 25 de junio de 2023 .
- ^ Shorter Oxford English Dictionary (quinta edición). Oxford University Press. 2002. ISBN 978-0-19-860457-0
Tierra de color marrón rojizo que contiene óxidos de hierro y manganeso y es más oscura que el ocre y el siena, utilizada para fabricar diversos pigmentos
. - ^ Chen, Daquin; Zhou, Yang; Zhong, Jiasong (2016). "Una revisión sobre activadores de Mn 4+ en sólidos para diodos emisores de luz blanca cálida". RSC Advances . 6 (89): 86285–86296. Bibcode :2016RSCAd...686285C. doi :10.1039/C6RA19584A.
- ^ Baur, Florian; Jüstel, Thomas (2016). "Dependencia de las propiedades ópticas de A2Ge4O9 (A=K,Rb) activado con Mn4 + en la temperatura y el entorno químico". Journal of Luminescence . 177 : 354–360 . Código Bibliográfico :2016JLum..177..354B. doi : 10.1016/j.jlumin.2016.04.046.
- ^ Jansen, T.; Gorobez, J.; Kirm, M.; Brik, MG; Vielhauer, S.; Oja, M.; Khaidukov, NM; Makhov, VN; Jüstel, T. (1 de enero de 2018). "Fotoluminiscencia de banda estrecha en rojo intenso de granate inverso Y2Mg3Ge3O12:Mn4+,Li+ para LED de alta potencia convertidos en fósforo". ECS Journal of Solid State Science and Technology . 7 (1): R3086–R3092. doi : 10.1149/2.0121801jss . S2CID 103724310.
- ^ Jansen, Thomas; Baur, Florian; Jüstel, Thomas (2017). "Emisión roja de K2NbF7:Mn4+ y K2TaF7 : Mn4 + para aplicaciones LED de luz blanca cálida ". Journal of Luminescence . 192 : 644–652. Código Bibliográfico :2017JLum..192..644J. doi :10.1016/j.jlumin.2017.07.061.
- ^ Zhou, Zhi; Zhou, Nan; Xia, Mao; Yokoyama, Meiso; Hintzen, HT (Bert) (6 de octubre de 2016). "Progreso de la investigación y perspectivas de aplicación de materiales luminiscentes activados por metales de transición Mn 4+ ". Revista de Química de Materiales C. 4 (39): 9143–9161. doi :10.1039/c6tc02496c.
- ^ "Sistema de fósforo LED TriGain que utiliza fluoruros complejos dopados con Mn4+ rojos" (PDF) . GE Global Research . Consultado el 10 de diciembre de 2022 .
- ^ Kuwahara, Raymond T.; Skinner III, Robert B.; Skinner Jr., Robert B. (2001). "Monedas de níquel en los Estados Unidos". Revista occidental de medicina . 175 (2): 112–114. doi :10.1136/ewjm.175.2.112. PMC 1071501 . PMID 11483555.
- ^ "Diseño del dólar de Sacagawea". Casa de la Moneda de los Estados Unidos. Archivado desde el original el 22 de abril de 2021. Consultado el 4 de mayo de 2009 .
- ^ Shepard, Anna Osler (1956). "Pinturas de manganeso y hierro-manganeso". Cerámica para el arqueólogo . Carnegie Institution de Washington. pp. 40–42. ISBN 978-0-87279-620-1.
- ^ Li, Jun; Lorger, Simon; Stalick, Judith K.; Sleight, Arthur W.; Subramanian, MA (3 de octubre de 2016). "De la serendipia al diseño racional: ajuste del cromóforo bipiramidal trigonal azul Mn 3+ a violeta y púrpura mediante la aplicación de presión química". Química inorgánica . 55 (19): 9798–9804. doi :10.1021/acs.inorgchem.6b01639. ISSN 0020-1669. PMID 27622607.
- ^ Silverman, Elian (28 de junio de 2018). "¿Cómo se descubre un pigmento azul nuevo? Por accidente". TED Ideas . Consultado el 26 de junio de 2024 .
- ^ Rice, Derek B.; Massie, Allyssa A.; Jackson, Timothy A. (2017). "Intermediarios de manganeso y oxígeno en la activación de enlaces O-O y reacciones de transferencia de átomos de hidrógeno". Accounts of Chemical Research . 50 (11): 2706–2717. doi :10.1021/acs.accounts.7b00343. PMID 29064667.
- ^ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (mayo de 2011). "Estructura cristalina del fotosistema II que desprende oxígeno con una resolución de 1,9 Å" (PDF) . Nature . 473 (7345): 55–60. Bibcode :2011Natur.473...55U. doi :10.1038/nature09913. PMID 21499260. S2CID 205224374.
- ^ Dismukes, G. Charles; Willigen, Rogier T. van (2006). "Manganeso: el complejo que desarrolla oxígeno y modelos". Manganeso: el complejo que desarrolla oxígeno y modelos Basado en parte en el artículo Manganeso: complejo que desarrolla oxígeno y modelos de Lars-Erik Andréasson y Tore Vänngård que apareció en la Enciclopedia de química inorgánica, primera edición, Primera edición . Enciclopedia de química inorgánica . doi :10.1002/0470862106.ia128. ISBN 978-0470860786.
- ^ Takeda, A. (2003). "Acción del manganeso en la función cerebral". Brain Research Reviews . 41 (1): 79–87. doi :10.1016/S0165-0173(02)00234-5. PMID 12505649. S2CID 1922613.
- ^ ab Instituto de Medicina (EE. UU.) Panel sobre micronutrientes (2001). "Manganeso". Ingestas dietéticas de referencia para vitamina A, vitamina K, arsénico, boro, cromo, cromo, yodo, hierro, manganeso, molibdeno, níquel, silicio, vanadio y cromo . National Academy Press. págs. 394–419. ISBN 978-0-309-07279-3. Número de identificación personal 25057538.
- ^ Véase "Manganeso". Centro de Información sobre Micronutrientes . Instituto Linus Pauling de la Universidad Estatal de Oregón . 23 de abril de 2014.
- ^ "Resumen de los valores de referencia dietéticos para la población de la UE elaborados por el Panel de Productos Dietéticos, Nutrición y Alergias de la EFSA" (PDF) . 2017.
- ^ Niveles máximos de ingesta tolerables de vitaminas y minerales (PDF) , Autoridad Europea de Seguridad Alimentaria, 2006
- ^ "Registro Federal del 27 de mayo de 2016, Etiquetado de alimentos: Revisión de las etiquetas de información nutricional y de suplementos. Página FR 33982" (PDF) .
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)" ( Base de datos de etiquetas de suplementos dietéticos (DSLD)) . Archivado desde el original el 7 de abril de 2020. Consultado el 16 de mayo de 2020 .
- ^ Silva Avila, Daiana; Luiz Puntel, Robson; Aschner, Michael (2013). "Manganeso en la salud y la enfermedad". En Astrid Sigel; Helmut Sigel; Roland KO Sigel (eds.). Interrelaciones entre iones metálicos esenciales y enfermedades humanas . Iones metálicos en las ciencias de la vida. Vol. 13. Springer. págs. 199–227. doi :10.1007/978-94-007-7500-8_7. ISBN 978-94-007-7499-5. PMC 6589086 . PMID 24470093.
- ^ Wang, Cui-Yue; Xia, Wei-Hao; Wang, Lin; Wang, Zhen-Yong (1 de noviembre de 2021). "La deficiencia de manganeso induce discondroplasia tibial aviar al inhibir la proliferación y diferenciación de los condrocitos". Investigación en Ciencias Veterinarias . 140 : 164–170. doi :10.1016/j.rvsc.2021.08.018. PMID 34481207.
- ^ Bouchard, M. F; Sauvé, S; Barbeau, B; Legrand, M; Bouffard, T; Limoges, E; Bellinger, D. C; Mergler, D (2011). "Deterioro intelectual en niños en edad escolar expuestos al manganeso del agua potable". Environmental Health Perspectives . 119 (1): 138–143. doi :10.1289/ehp.1002321. PMC 3018493 . PMID 20855239.
- ^ Barceloux, Donald; Barceloux, Donald (1999). "Manganeso". Toxicología clínica . 37 (2): 293–307. doi :10.1081/CLT-100102427. PMID 10382563.
- ^ Devenyi, A. G; Barron, T. F; Mamourian, A. C (1994). "Distonía, ganglios basales hiperintensos y niveles elevados de manganeso en sangre total en el síndrome de Alagille". Gastroenterología . 106 (4): 1068–71. doi :10.1016/0016-5085(94)90769-2. PMID 8143974. S2CID 2711273.
- ^ Hernroth, Bodil; Krång, Anna-Sara; Baden, Susanne (febrero de 2015). "Supresión bacteriostática en la cigala (Nephrops norvegicus) expuesta a manganeso o hipoxia bajo presión de acidificación del océano". Toxicología acuática . 159 : 217–224. Bibcode :2015AqTox.159..217H. doi :10.1016/j.aquatox.2014.11.025. ISSN 0166-445X. PMID 25553539.
- ^ Agencia para Sustancias Tóxicas y el Registro de Enfermedades (2012) 6. Potencial de exposición humana, en Perfil toxicológico del manganeso, Atlanta, GA: Departamento de Salud y Servicios Humanos de EE. UU.
- ^ Yin, Z.; Jiang, H.; Lee, ES; Ni, M.; Erikson, KM; Milatovic, D.; Bowman, AB; Aschner, M. (2010). "La ferroportina es una proteína sensible al manganeso que disminuye la citotoxicidad y la acumulación de manganeso" (PDF) . Journal of Neurochemistry . 112 (5): 1190–8. doi :10.1111/j.1471-4159.2009.06534.x. PMC 2819584 . PMID 20002294.
- ^ ab "Temas de seguridad y salud: compuestos de manganeso (como Mn)". Administración de Seguridad y Salud Ocupacional de Estados Unidos .
- ^ "Guía de bolsillo de NIOSH sobre peligros químicos: compuestos de manganeso y humos (como Mn)". Centros para el Control y la Prevención de Enfermedades . Consultado el 19 de noviembre de 2015 .
- ^ "Contaminantes del agua potable". EPA de EE. UU . . Consultado el 2 de febrero de 2015 .
- ^ Baselt, R. (2008) Disposición de fármacos y productos químicos tóxicos en el hombre , 8.ª edición, Biomedical Publications, Foster City, CA, págs. 883–886, ISBN 0-9626523-7-7 .
- ^ Normandin, Louise; Hazell, AS (2002). "Neurotoxicidad del manganeso: una actualización de los mecanismos fisiopatológicos". Enfermedades cerebrales metabólicas . 17 (4): 375–87. doi :10.1023/A:1021970120965. PMID 12602514. S2CID 23679769.
- ^ ab Cersosimo, MG; Koller, WC (2007). "El diagnóstico del parkinsonismo inducido por manganeso". Neurotoxicología . 27 (3): 340–346. doi :10.1016/j.neuro.2005.10.006. PMID 16325915.
- ^ Lu, CS; Huang, CC; Chu, NS; Calne, DB (1994). "Fracaso de levodopa en manganismo crónico". Neurología . 44 (9): 1600–1602. doi :10.1212/WNL.44.9.1600. PMID 7936281. S2CID 38040913.
- ^ ab Guilarte TR, Gonzales KK (agosto de 2015). "El parkinsonismo inducido por manganeso no es enfermedad de Parkinson idiopática: evidencia ambiental y genética". Toxicological Sciences (Revisión). 146 (2): 204–12. doi :10.1093/toxsci/kfv099. PMC 4607750. PMID 26220508 .
- ^ ab Kwakye GF, Paoliello MM, Mukhopadhyay S, Bowman AB, Aschner M (julio de 2015). "Parkinsonismo inducido por manganeso y enfermedad de Parkinson: características compartidas y distinguibles". Int J Environ Res Public Health (revisión). 12 (7): 7519–40. doi : 10.3390/ijerph120707519 . PMC 4515672. PMID 26154659 .
- ^ Peres TV, Schettinger MR, Chen P, Carvalho F, Avila DS, Bowman AB, Aschner M (noviembre de 2016). "Neurotoxicidad inducida por manganeso: una revisión de sus consecuencias conductuales y estrategias neuroprotectoras". BMC Pharmacology & Toxicology (Revisión). 17 (1): 57. doi : 10.1186/s40360-016-0099-0 . PMC 5097420. PMID 27814772 .
- ^ Lazrishvili, I.; et al. (2016). "La carga de manganeso induce un comportamiento de matanza de ratones en ratas no agresivas". Revista de física y química biológica . 16 (3): 137–141. doi :10.4024/31LA14L.jbpc.16.03.
- ^ "Ficha de datos de seguridad". Sigma-Aldrich . Consultado el 26 de julio de 2021 .
- ^ Hasan, Heather (2008). Manganeso. The Rosen Publishing Group. pág. 31. ISBN 978-1-4042-1408-8.
- ^ "Antecedentes químicos del manganeso". Instituto Metcalf de Informes Marinos y Ambientales de la Universidad de Rhode Island. Abril de 2006. Archivado desde el original el 28 de agosto de 2006. Consultado el 30 de abril de 2008 .
- ^ "Resumen de toxicidad del sistema de información de evaluación de riesgos para el manganeso". Laboratorio Nacional de Oak Ridge . Consultado el 23 de abril de 2008 .
- ^ Prabhakaran, K.; Ghosh, D.; Chapman, GD; Gunasekar, PG (2008). "Mecanismo molecular de la toxicidad dopaminérgica inducida por la exposición al manganeso". Boletín de investigación cerebral . 76 (4): 361–367. doi :10.1016/j.brainresbull.2008.03.004. ISSN 0361-9230. PMID 18502311. S2CID 206339744.
Fuentes
- Greenwood, Norman N. ; Earnshaw, Alan (1984). Química de los elementos. Oxford: Pergamon Press . ISBN 978-0-08-022057-4.
Enlaces externos
- Inventario Nacional de Contaminantes – Hoja informativa sobre manganeso y compuestos
- Instituto Internacional del Manganeso
- Página temática sobre manganeso de NIOSH
- Manganeso en la tabla periódica de vídeos (Universidad de Nottingham)
- Todo sobre las dendritas de manganeso
- Escoria de horno de arco eléctrico (EAF)








