Fiebre tifoidea
| Fiebre tifoidea | |
|---|---|
| Otros nombres | Fiebre entérica, fiebre lenta |
 | |
| Agente causal: Salmonella enterica variante serológica Typhi (mostrada bajo el microscopio con tinción flagelar) | |
| Especialidad | Enfermedades infecciosas |
| Síntomas | Fiebre que comienza baja y aumenta diariamente, posiblemente alcanzando hasta 104,9 °F (40,5 °C) Dolor de cabeza, debilidad y fatiga, dolores musculares, sudoración, tos seca, pérdida de apetito, pérdida de peso, dolor de estómago, diarrea o estreñimiento, sarpullido, estómago hinchado (agrandamiento del hígado o bazo) |
| Inicio habitual | 1–2 semanas después de la ingestión |
| Duración | Generalmente, entre 7 y 10 días después de que comienza el tratamiento con antibióticos. Puede ser más prolongado si hay complicaciones o resistencia a los medicamentos. |
| Causas | Infección gastrointestinal por Salmonella enterica serotipo Typhi |
| Factores de riesgo | Vivir o viajar a áreas donde se ha establecido la fiebre tifoidea; trabajar como microbiólogo clínico manipulando bacterias de Salmonella Typhi; tener contacto cercano con alguien que esté infectado o haya sido infectado recientemente con fiebre tifoidea; beber agua contaminada por aguas residuales que contienen Salmonella Typhi |
| Prevención | Se puede prevenir con vacunas. Se suele recomendar a quienes viajan a regiones con mayor prevalencia de fiebre tifoidea que se vacunen antes de viajar. |
| Tratamiento | Antibióticos, hidratación, cirugía en casos extremos. Cuarentena para evitar exponer a otros (no es algo habitual en la actualidad). |
| Pronóstico | Es probable que la enfermedad se recupere sin complicaciones si se administran los antibióticos adecuados y se diagnostica a tiempo. Si la cepa que causa la infección es resistente a múltiples fármacos o extremadamente resistente a ellos, el pronóstico es más difícil de determinar. Entre los casos agudos no tratados, el 10% eliminará bacterias durante tres meses después de la aparición inicial de los síntomas, y entre el 2 y el 5% se convertirán en portadores crónicos de fiebre tifoidea. [1] Algunos portadores se diagnostican mediante una muestra de tejido positiva. Los portadores crónicos son, por definición, asintomáticos. [1] |
La fiebre tifoidea , también conocida simplemente como tifoidea , es una enfermedad causada por la bacteria Salmonella enterica serotipo Typhi, también llamada Salmonella typhi . [2] [3] Los síntomas varían de leves a graves, y generalmente comienzan de seis a 30 días después de la exposición. [4] [5] A menudo hay un inicio gradual de fiebre alta durante varios días. [4] Esto suele ir acompañado de debilidad, dolor abdominal , estreñimiento , dolores de cabeza y vómitos leves. [6] [5] [7] Algunas personas desarrollan una erupción cutánea con manchas de color rosa . [5] En casos graves, las personas pueden experimentar confusión. [7] Sin tratamiento, los síntomas pueden durar semanas o meses. [5] La diarrea puede ser grave, pero es poco común. [7] Otras personas pueden ser portadoras sin verse afectadas, pero siguen siendo contagiosas. [8] La fiebre tifoidea es un tipo de fiebre entérica , junto con la fiebre paratifoidea . [2] Se cree que Salmonella enterica Typhi infecta y se replica solo en humanos. [9]
La fiebre tifoidea es causada por la bacteria Salmonella enterica subsp. enterica serovar Typhi que crece en los intestinos , placas de Peyer , ganglios linfáticos mesentéricos , bazo , hígado , vesícula biliar , médula ósea y sangre . [5] [7] La fiebre tifoidea se transmite al comer o beber alimentos o agua contaminados con las heces de una persona infectada. [8] Los factores de riesgo incluyen el acceso limitado a agua potable y saneamiento deficiente . [2] Aquellos que aún no han estado expuestos a ella e ingieren agua potable o alimentos contaminados tienen mayor riesgo de desarrollar síntomas. [7] Solo los humanos pueden infectarse; no se conocen reservorios animales. [8] Salmonella Typhi, que causa fiebre tifoidea, es diferente de las otras bacterias Salmonella que generalmente causan salmonelosis , un tipo común de intoxicación alimentaria. [10]
El diagnóstico se realiza mediante el cultivo e identificación de S. enterica typhi a partir de muestras de pacientes o detectando una respuesta inmune al patógeno a partir de muestras de sangre . [5] [2] [11] Recientemente, nuevos avances en la recopilación y análisis de datos a gran escala han permitido a los investigadores desarrollar mejores diagnósticos, como la detección de abundancias cambiantes de pequeñas moléculas en la sangre que pueden indicar específicamente fiebre tifoidea. [12] Las herramientas de diagnóstico en regiones donde la fiebre tifoidea es más prevalente son bastante limitadas en su precisión y especificidad, y el tiempo requerido para un diagnóstico adecuado, la creciente propagación de la resistencia a los antibióticos y el costo de las pruebas también son dificultades para los sistemas de atención médica con recursos insuficientes. [9]
Una vacuna contra la fiebre tifoidea puede prevenir entre el 40% y el 90% de los casos durante los dos primeros años. [13] La vacuna puede tener algún efecto durante hasta siete años. [2] Para las personas con alto riesgo o las personas que viajan a zonas donde es común, se recomienda la vacunación. [8] Otras medidas para prevenirla incluyen proporcionar agua potable , buen saneamiento y lavarse las manos . [5] [8] Hasta que se confirme que la infección ha desaparecido, la persona infectada no debe preparar comida para otras personas. [5] La fiebre tifoidea se trata con antibióticos como la azitromicina , las fluoroquinolonas o las cefalosporinas de tercera generación . [2] Se ha ido desarrollando resistencia a estos antibióticos, lo que ha dificultado el tratamiento. [2] [14] [15]
En 2015, se notificaron 12,5 millones de nuevos casos de fiebre tifoidea. [16] La enfermedad es más común en la India. [2] Los niños son los más afectados. [2] [8] La fiebre tifoidea disminuyó en el mundo desarrollado en la década de 1940 como resultado de la mejora del saneamiento y el uso de antibióticos. [8] Cada año se notifican unos 400 casos en los EE. UU. y se estima que 6000 personas padecen fiebre tifoidea. [7] [17] En 2015, provocó unas 149 000 muertes en todo el mundo, frente a las 181 000 de 1990. [18] [19] Sin tratamiento, el riesgo de muerte puede llegar al 20 %. [8] Con tratamiento, es de entre el 1 % y el 4 %. [2] [8]
El tifus es una enfermedad distinta, causada por especies bacterianas no relacionadas. [20] Debido a que sus síntomas son similares, no se las reconoció como enfermedades distintas hasta el siglo XIX. "Tifoidea" significa "parecida al tifus". [21]
Signos y síntomas
Clásicamente, la evolución de la fiebre tifoidea no tratada tiene tres etapas distintas, cada una de las cuales dura aproximadamente una semana. En el transcurso de estas etapas, el paciente se vuelve exhausto y demacrado. [22]
- En la primera semana, la temperatura corporal aumenta lentamente y se observan fluctuaciones de fiebre con bradicardia relativa ( signo de Faget ), malestar , dolor de cabeza y tos. Se observa hemorragia nasal ( epistaxis ) en una cuarta parte de los casos y también es posible el dolor abdominal. Se produce una disminución en el número de glóbulos blancos circulantes ( leucopenia ) con eosinopenia y linfocitosis relativa ; los hemocultivos son positivos para S. enterica subsp. enterica serovar Typhi. La prueba de Widal suele ser negativa. [23]
- En la segunda semana, la persona suele estar demasiado cansada para levantarse, con fiebre alta en meseta alrededor de 40 °C (104 °F) y bradicardia (disociación esfigmotérmica o signo de Faget), clásicamente con una onda de pulso dicrótica . Puede ocurrir delirio , en el que el paciente suele estar tranquilo, pero a veces se agita. Este delirio ha dado a la fiebre tifoidea el apodo de "fiebre nerviosa". Aparecen manchas rosadas en la parte inferior del tórax y el abdomen en aproximadamente un tercio de los pacientes. Se escuchan roncus (sonidos respiratorios estertores) en la base de los pulmones. El abdomen está distendido y doloroso en el cuadrante inferior derecho, donde se puede escuchar un sonido retumbante. Puede haber diarrea en esta etapa, pero el estreñimiento también es común. El bazo y el hígado están agrandados ( hepatoesplenomegalia ) y sensibles, y las transaminasas hepáticas están elevadas. La prueba de Widal es fuertemente positiva, con anticuerpos antiO y antiH. Los hemocultivos a veces siguen siendo positivos. [ cita requerida ]
- En la tercera semana de fiebre tifoidea, las posibles complicaciones incluyen:
- La fiebre sigue siendo muy alta y oscila muy poco durante 24 horas. Se produce deshidratación y desnutrición, y el paciente presenta delirios. Un tercio de los afectados desarrolla una erupción macular en el tronco.
- Se produce una hemorragia intestinal debido al sangrado en las placas de Peyer congestionadas ; esto puede ser muy grave, pero generalmente no es mortal.
- La perforación intestinal en el íleon distal es una complicación muy grave y a menudo mortal. Puede ocurrir sin síntomas alarmantes hasta que se produce una septicemia o una peritonitis difusa .
- Enfermedades respiratorias como neumonía y bronquitis aguda.
- Encefalitis
- Síntomas neuropsiquiátricos (descritos como "delirio murmurante" o "vigilia en coma"), con tirones de ropa de cama u objetos imaginarios.
- Abscesos metastásicos, colecistitis , endocarditis y osteítis .
- A veces se observa un recuento bajo de plaquetas ( trombocitopenia ). [24]
Causas

Bacteria
La bacteria gramnegativa que causa la fiebre tifoidea es Salmonella enterica subsp. enterica serovar Typhi. Según el esquema de subtipificación MLST, los dos tipos de secuencia principales de S. Typhi son ST1 y ST2, que están ampliamente distribuidos a nivel mundial. [25] El análisis filogeográfico global mostró el predominio de un haplotipo 58 (H58), que probablemente se originó en la India a fines de la década de 1980 y ahora se está extendiendo por todo el mundo con resistencia a múltiples fármacos . [26] En 2016 se informó sobre un esquema de genotipificación más detallado que ahora se está utilizando ampliamente. Este esquema reclasificó la nomenclatura de H58 al genotipo 4.3.1. [27]
Transmisión
A diferencia de otras cepas de Salmonella , los humanos son los únicos portadores conocidos de la fiebre tifoidea. [28] S. enterica subsp. enterica serovar Typhi se transmite por vía fecal-oral de personas infectadas y de portadores asintomáticos de la bacteria. [28] Un portador humano asintomático es alguien que todavía excreta bacterias tifoideas en las heces un año después de la etapa aguda de la infección. [28]

Diagnóstico
El diagnóstico se realiza mediante cualquier cultivo de sangre , médula ósea o heces y con la prueba de Widal (demostración de anticuerpos contra antígenos O-somáticos y H-flagelares de Salmonella ). En epidemias y en países menos ricos, después de excluir malaria , disentería o neumonía , generalmente se realiza un período de prueba terapéutico con cloranfenicol mientras se esperan los resultados de la prueba de Widal y de los cultivos de sangre y heces. [29]
Prueba de Widal

La prueba de Widal se utiliza para identificar anticuerpos específicos en el suero de personas con fiebre tifoidea mediante interacciones antígeno-anticuerpo. [30]
En esta prueba, el suero se mezcla con una suspensión bacteriana muerta de Salmonella con antígenos específicos. Si el suero del paciente contiene anticuerpos contra esos antígenos, estos se adhieren a ellos, formando grumos. Si no se produce grumos, la prueba es negativa. La prueba de Widal requiere mucho tiempo y es propensa a dar falsos positivos significativos. También puede dar falsos negativos en personas recientemente infectadas. Pero a diferencia de la prueba de Typhidot, la prueba de Widal cuantifica la muestra con títulos . [31]
Pruebas de diagnóstico rápido
Las pruebas de diagnóstico rápido como Tubex, Typhidot y Test-It han demostrado una precisión diagnóstica moderada. [32]
Tifidot
Typhidot se basa en la presencia de anticuerpos IgM e IgG específicos contra un antígeno OMP específico de 50 Kd . Esta prueba se realiza en una membrana de nitrato de celulosa donde se fija una proteína de membrana externa específica de S. typhi como líneas de prueba fijas. Identifica por separado los anticuerpos IgM e IgG. La IgM muestra una infección reciente; la IgG significa una infección remota. [ cita requerida ]
La almohadilla de muestra de este kit contiene oro coloidal anti-IgG humana o anti-IgM humana. Si la muestra contiene anticuerpos IgG e IgM contra esos antígenos, reaccionarán y se volverán rojos. La prueba de tifus se vuelve positiva dentro de los 2-3 días posteriores a la infección. [ cita requerida ]
Dos bandas de colores indican una prueba positiva. Una sola banda de control indica una prueba negativa. Una sola primera línea fija o ninguna banda en absoluto indica una prueba no válida. La mayor limitación de Typhidot es que no es cuantitativa, solo positiva o negativa. [33]
Prueba de Tubex
La prueba Tubex contiene dos tipos de partículas: partículas magnéticas marrones recubiertas de antígeno y partículas indicadoras azules recubiertas de anticuerpo O9. Durante la prueba, si hay anticuerpos presentes en el suero, se unirán a las partículas magnéticas marrones y se asentarán en la base, mientras que las partículas indicadoras azules permanecerán en la solución, produciendo un color azul, lo que significa que la prueba es positiva. [ cita requerida ]
Si el suero no contiene anticuerpos, las partículas azules se adhieren a las partículas marrones y se depositan en el fondo, produciendo una solución incolora, lo que significa que la prueba es negativa. [34]
Prevención

El saneamiento y la higiene son importantes para prevenir la fiebre tifoidea. Esta enfermedad solo se puede propagar en entornos en los que las heces humanas pueden entrar en contacto con los alimentos o el agua potable. La preparación cuidadosa de los alimentos y el lavado de las manos son cruciales para prevenir la fiebre tifoidea. La industrialización contribuyó en gran medida a la eliminación de la fiebre tifoidea, ya que eliminó los riesgos para la salud pública asociados con la presencia de estiércol de caballo en las calles públicas, lo que dio lugar a una gran cantidad de moscas [35] , que son vectores de muchos patógenos, incluida la Salmonella spp. [36] Según las estadísticas de los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos , la cloración del agua potable ha provocado una disminución drástica de la transmisión de la fiebre tifoidea [37] .
Vacunación
Existen dos vacunas contra la fiebre tifoidea autorizadas para su uso en la prevención de la fiebre tifoidea: [13] la vacuna Ty21a oral viva (vendida como Vivotif por Crucell Switzerland AG) y la vacuna polisacárida inyectable contra la fiebre tifoidea (vendida como Typhim Vi por Sanofi Pasteur y Typherix por GlaxoSmithKline ). Ambas son eficaces y se recomiendan para quienes viajan a zonas donde la fiebre tifoidea es endémica. Se recomiendan dosis de refuerzo cada cinco años para la vacuna oral y cada dos años para la forma inyectable. [13] Una vacuna de células enteras muertas más antigua todavía se utiliza en países donde no están disponibles las preparaciones más nuevas, pero esta vacuna ya no se recomienda para su uso porque tiene más efectos secundarios (principalmente dolor e inflamación en el lugar de la inyección). [38]

Para ayudar a disminuir las tasas de fiebre tifoidea en los países en desarrollo , la Organización Mundial de la Salud (OMS) aprobó el uso de un programa de vacunación a partir de 1999. La vacunación ha demostrado ser eficaz para controlar los brotes en áreas de alta incidencia y también es muy rentable: los precios normalmente son inferiores a un dólar estadounidense por dosis. Como el precio es bajo, las comunidades afectadas por la pobreza están más dispuestas a aprovechar las ventajas de las vacunas. [39] Aunque los programas de vacunación contra la fiebre tifoidea han demostrado ser eficaces, por sí solos no pueden eliminar la fiebre tifoidea. [39] La combinación de vacunas con esfuerzos de salud pública es la única forma comprobada de controlar esta enfermedad. [39]
Desde la década de 1990, la OMS ha recomendado dos vacunas contra la fiebre tifoidea. La vacuna ViPS se administra mediante inyección y la Ty21a, mediante cápsulas. Se recomienda que solo las personas mayores de dos años se vacunen con la vacuna ViPS, y requiere una revacunación después de 2 a 3 años, con una eficacia del 55% al 72%. La vacuna Ty21a se recomienda para personas de cinco años o más, con una duración de 5 a 7 años y una eficacia del 51% al 67%. Las dos vacunas han demostrado ser seguras y eficaces para el control de enfermedades epidémicas en múltiples regiones. [39]
También está disponible una versión de la vacuna combinada con una vacuna contra la hepatitis A. [40]
Los resultados de un ensayo de fase 3 de la vacuna conjugada contra la fiebre tifoidea (TCV) en diciembre de 2019 informaron un 81 % menos de casos entre los niños. [41] [42]
Tratamiento
Terapia de rehidratación oral
El redescubrimiento de la terapia de rehidratación oral en la década de 1960 proporcionó una forma sencilla de prevenir muchas de las muertes por enfermedades diarreicas en general. [43]
Antibióticos
Cuando la resistencia es poco común, el tratamiento de elección es una fluoroquinolona como la ciprofloxacina . [44] [45] De lo contrario, una cefalosporina de tercera generación como la ceftriaxona o la cefotaxima es la primera opción. [46] [47] [48] [49] La cefixima es una alternativa oral adecuada. [50] [51]
La fiebre tifoidea, tratada adecuadamente, no es mortal en la mayoría de los casos. Los antibióticos como ampicilina , cloranfenicol, trimetoprima-sulfametoxazol , amoxicilina y ciprofloxacino se han utilizado comúnmente para tratarla. [52] El tratamiento con antibióticos reduce la tasa de letalidad a aproximadamente el 1%. [53]
Sin tratamiento, algunos pacientes desarrollan fiebre sostenida, bradicardia, hepatoesplenomegalia, síntomas abdominales y, ocasionalmente, neumonía. En pacientes de piel blanca, aparecen manchas rosadas, que se desvanecen con la presión, en la piel del tronco en hasta el 20% de los casos. En la tercera semana, los casos no tratados pueden desarrollar complicaciones gastrointestinales y cerebrales, que pueden resultar fatales en el 10%–20% de los casos. Las tasas de letalidad más altas se reportan en niños menores de 4 años. Alrededor del 2%–5% de los que contraen fiebre tifoidea se convierten en portadores crónicos, ya que las bacterias persisten en el tracto biliar después de que los síntomas se han resuelto. [54]
Cirugía
En general, se indica cirugía si se produce una perforación intestinal . Un estudio encontró una tasa de mortalidad a los 30 días del 9% (8/88) y de infecciones del sitio quirúrgico del 67% (59/88), y la carga de la enfermedad recae predominantemente en los países de bajos recursos. [55]
Para el tratamiento quirúrgico, la mayoría de los cirujanos prefieren el cierre simple de la perforación con drenaje del peritoneo . La resección del intestino delgado está indicada para pacientes con perforaciones múltiples. Si el tratamiento antibiótico no logra erradicar el estado de portador hepatobiliar , se debe resecar la vesícula biliar. La colecistectomía a veces es exitosa, especialmente en pacientes con cálculos biliares , pero no siempre logra erradicar el estado de portador debido a la persistencia de la infección hepática . [56] [57]
Resistencia
Como la resistencia a la ampicilina, el cloranfenicol, el trimetoprima-sulfametoxazol y la estreptomicina es ahora común, estos agentes ya no se utilizan como tratamiento de primera línea de la fiebre tifoidea. [58] La fiebre tifoidea resistente a estos agentes se conoce como fiebre tifoidea resistente a múltiples fármacos. [59]
La resistencia a la ciprofloxacina es un problema creciente, especialmente en el subcontinente indio y el sudeste asiático . Muchos centros están pasando de la ciprofloxacina a la ceftriaxona como primera opción para el tratamiento de la presunta fiebre tifoidea originada en Sudamérica, India, Pakistán, Bangladesh, Tailandia o Vietnam. Además, se ha sugerido que la azitromicina es mejor para tratar la fiebre tifoidea resistente que los fármacos fluoroquinolónicos y la ceftriaxona. [45] La azitromicina se puede tomar por vía oral y es menos costosa que la ceftriaxona, que se administra mediante inyección. [60]
Existe un problema aparte con las pruebas de laboratorio para detectar la susceptibilidad reducida a la ciprofloxacina; las recomendaciones actuales son que los aislamientos se deben analizar simultáneamente contra la ciprofloxacina (CIP) y contra el ácido nalidíxico (NAL), que los aislamientos sensibles tanto a la CIP como al NAL se deben informar como "sensibles a la ciprofloxacina", y que los aislamientos sensibles a la CIP pero no al NAL se deben informar como "sensibilidad reducida a la ciprofloxacina". Pero un análisis de 271 aislamientos encontró que alrededor del 18% de los aislamientos con una susceptibilidad reducida a las fluoroquinolonas , la clase a la que pertenece la CIP ( CMI 0,125–1,0 mg/L), no se detectarían con este método. [61]
Epidemiología
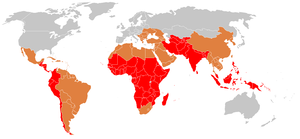
En 2000, la fiebre tifoidea causó aproximadamente 21,7 millones de enfermedades y 217 000 muertes. [11] Se presenta con mayor frecuencia en niños y adultos jóvenes de entre 5 y 19 años. [62] En 2013, resultó en alrededor de 161 000 muertes, en comparación con las 181 000 de 1990. [19] Los bebés, niños y adolescentes en el centro-sur y el sudeste asiático tienen las tasas más altas de fiebre tifoidea. [63] También se informan brotes con frecuencia en África subsahariana y el sudeste asiático. [64] [65] [66] En 2000, más del 90 % de la morbilidad y mortalidad por fiebre tifoidea se produjo en Asia. [67] En los EE. UU., ocurren alrededor de 400 casos cada año, el 75 % de los cuales se adquieren durante viajes internacionales. [68] [69]
Antes de la era de los antibióticos, la tasa de letalidad de la fiebre tifoidea era del 10% al 20%. Hoy, con un tratamiento rápido, es inferior al 1%, [70] pero entre el 3% y el 5% de las personas infectadas desarrollan una infección crónica en la vesícula biliar. [71] Dado que S. enterica subsp. enterica serovar Typhi está restringida a los humanos, estos portadores crónicos se convierten en el reservorio crucial, que puede persistir durante décadas para una mayor propagación de la enfermedad, lo que complica aún más su identificación y tratamiento. [57] Últimamente, el estudio de S. enterica subsp. enterica serovar Typhi asociado con un gran brote y un portador a nivel del genoma proporciona una nueva perspectiva sobre la patogénesis del patógeno. [72] [73]
En los países industrializados, las mejoras en el saneamiento del agua y en la manipulación de los alimentos han reducido el número de casos de fiebre tifoidea. [74] Los países del tercer mundo tienen las tasas más altas. Estas zonas carecen de acceso a agua potable, sistemas de saneamiento adecuados e instalaciones sanitarias adecuadas. En estas zonas, no se espera que en un futuro próximo se pueda acceder a las necesidades básicas de salud pública. [75]
En 2004-2005, un brote en la República Democrática del Congo provocó más de 42.000 casos y 214 muertes. [62] Desde noviembre de 2016, Pakistán ha sufrido un brote de fiebre tifoidea extremadamente resistente a los medicamentos (XDR). [76]
En Europa, un informe basado en datos de 2017 recuperados del Sistema Europeo de Vigilancia (TESSy) sobre la distribución de casos confirmados de fiebre tifoidea y paratifoidea encontró que 22 países de la UE/EEE notificaron un total de 1.098 casos, el 90,9% de los cuales estaban relacionados con viajes, principalmente adquiridos durante viajes al sur de Asia . [77]
Brotes

- Peste de Atenas (sospechosa) [79]
- Epidemias de cocoliztli (sospechosas) [80]
- Brote de "fiebre ardiente" entre los indígenas americanos . Entre 1607 y 1624, el 85% de la población del río James murió a causa de una epidemia de tifus. La Organización Mundial de la Salud estima que el número de muertos fue superior a 6.000 durante ese período. [81]
- Brote de fiebre tifoidea en Maidstone , Kent, en 1897-1898: se registraron 1.847 pacientes. Este brote es notable porque fue la primera vez que se utilizó una vacuna contra la fiebre tifoidea durante un brote civil. La vacuna de Almoth Edward Wright se ofreció a 200 profesionales sanitarios y, de las 84 personas que recibieron la vacuna, ninguna desarrolló fiebre tifoidea, mientras que 4 que no habían sido vacunadas enfermaron. [82]
- Ejército estadounidense en la guerra hispanoamericana : los registros gubernamentales estiman que más de 21.000 soldados tuvieron fiebre tifoidea, lo que provocó 2.200 muertes. [82]
- En 1902, los invitados a los banquetes de los alcaldes en Southampton y Winchester, Inglaterra, enfermaron y cuatro murieron, incluido el decano de Winchester , después de consumir ostras. La infección se debió a ostras procedentes de Emsworth , donde los bancos de ostras habían sido contaminados con aguas residuales. [83] [84]
- Barrio de Jamaica Plain , Boston, en 1908, vinculado al reparto de leche. Véase la sección de historia, "transportistas", para más detalles. [85]
- Brote entre neoyorquinos de clase alta que empleaban a Mary Mallon : 51 casos y 3 muertes entre 1907 y 1915. [86] [87]
- Aberdeen , Escocia, en el verano de 1964: el origen del brote se remonta a carne de res enlatada contaminada procedente de Argentina que se vendió en los mercados. Más de 500 pacientes fueron puestos en cuarentena en el hospital durante un mínimo de cuatro semanas y el brote se contuvo sin que se produjeran muertes. [88]
- Dusambé , Tayikistán, en 1996-1997: 10.677 casos notificados, 108 muertes. [78]
- Kinshasa , República Democrática del Congo, en 2004: 43.000 casos y más de 200 muertes. [82] Un estudio prospectivo de muestras recogidas en la misma región entre 2007 y 2011 reveló que aproximadamente un tercio de las muestras obtenidas de pacientes eran resistentes a múltiples antibióticos. [89]
- Kampala , Uganda en 2015: 10.230 casos notificados. [78]
Historia
Descripciones tempranas
La plaga de Atenas , durante la Guerra del Peloponeso , fue probablemente un brote de fiebre tifoidea. [82] Durante la guerra, los atenienses se retiraron a una ciudad amurallada para escapar del ataque de los espartanos . Esta afluencia masiva de humanos en un espacio concentrado abrumó el suministro de agua y la infraestructura de desechos, probablemente provocando condiciones insalubres a medida que el agua dulce se volvió más difícil de obtener y los desechos se volvieron más difíciles de recolectar y eliminar más allá de los muros de la ciudad. [82] En 2006, el examen de los restos de un lugar de enterramiento masivo de Atenas de la época de la plaga (~430 a. C.) reveló que se detectaron fragmentos de ADN similares al ADN de S. Typhi actual , mientras que Yersinia pestis (peste), Rickettsia prowazekii (tifus), Mycobacterium tuberculosis , virus de la viruela vacuna y Bartonella henselae no se detectaron en ninguno de los restos analizados. [79]
Es posible que el emperador romano Augusto César tuviera un absceso hepático o fiebre tifoidea y sobreviviera usando baños de hielo y compresas frías como medio de tratamiento para su fiebre. [82] Hay una estatua del médico griego, Antonio Musa , [90] que trató su fiebre. [91]
Definición y evidencia de transmisión
A los médicos franceses Pierre-Fidele Bretonneau y Pierre-Charles-Alexandre Louis se les atribuye la descripción de la fiebre tifoidea como una enfermedad específica, única del tifus . Ambos médicos realizaron autopsias a personas que murieron en París debido a la fiebre e indicaron que muchas tenían lesiones en las placas de Peyer que se correlacionaban con síntomas distintos antes de la muerte. [82] Los médicos británicos eran escépticos sobre la diferenciación entre la fiebre tifoidea y el tifus porque ambas eran endémicas en Gran Bretaña en ese momento. Sin embargo, en Francia solo la fiebre tifoidea circulaba en la población. [82] Pierre-Charles-Alexandre Louis también realizó estudios de casos y análisis estadísticos para demostrar que la fiebre tifoidea era contagiosa y que las personas que ya tenían la enfermedad parecían estar protegidas. [82] Posteriormente, varios médicos estadounidenses confirmaron estos hallazgos, y luego Sir William Jenner convenció a los escépticos restantes de que la fiebre tifoidea es una enfermedad específica reconocible por lesiones en las placas de Peyer al examinar sesenta y seis autopsias de pacientes con fiebre y concluir que los síntomas de dolores de cabeza, diarrea, erupciones cutáneas y dolor abdominal estaban presentes solo en pacientes en los que se encontró que tenían lesiones intestinales después de la muerte; estas observaciones solidificaron la asociación de la enfermedad con el tracto intestinal y dieron la primera pista sobre la ruta de transmisión. [82]
En 1847, William Budd se enteró de una epidemia de fiebre tifoidea en Clifton e identificó que los 13 de los 34 residentes que habían contraído la enfermedad obtenían su agua potable del mismo pozo. [82] Cabe destacar que esta observación se produjo dos años antes de que John Snow publicara por primera vez una versión temprana de su teoría de que el agua contaminada era el conducto principal para la transmisión del cólera . Budd más tarde se convirtió en oficial de salud de Bristol y garantizó un suministro de agua limpia, y documentó más evidencia de la fiebre tifoidea como una enfermedad transmitida por el agua a lo largo de su carrera. [82]
Causa
El científico polaco Tadeusz Browicz describió un bacilo corto en los órganos y heces de las víctimas de la fiebre tifoidea en 1874. [92] Browicz pudo aislar y cultivar los bacilos, pero no llegó a insinuar o demostrar que causaban la enfermedad. [82]
En abril de 1880, tres meses antes de la publicación de Eberth, Edwin Klebs describió bacilos cortos y filamentosos en las placas de Peyer de las víctimas de la fiebre tifoidea. [93] Se especuló sobre el papel de la bacteria en la enfermedad, pero no se confirmó. [82]
En 1880, Karl Joseph Eberth describió un bacilo que sospechaba que era la causa de la fiebre tifoidea. [94] [95] [96] A Eberth se le atribuye el descubrimiento definitivo de la bacteria al aislar con éxito la misma bacteria de 18 de 40 víctimas de fiebre tifoidea y al no descubrir la bacteria presente en ninguna víctima "de control" de otras enfermedades. [82] En 1884, el patólogo Georg Theodor August Gaffky (1850-1918) confirmó los hallazgos de Eberth. [97] Gaffky aisló la misma bacteria que Eberth del bazo de una víctima de fiebre tifoidea y pudo cultivar la bacteria en medios sólidos. [82] El organismo recibió nombres como bacilo de Eberth, Eberthella Typhi y bacilo de Gaffky-Eberth. [82] Hoy en día, el bacilo que causa la fiebre tifoidea se conoce con el nombre científico de Salmonella enterica serovar Typhi. [98]
Cloración del agua
La mayoría de los países desarrollados tuvieron tasas decrecientes de fiebre tifoidea a lo largo de la primera mitad del siglo XX debido a las vacunas y los avances en el saneamiento público y la higiene. En 1893 se intentó clorar el suministro de agua en Hamburgo , Alemania y en 1897 Maidstone , Inglaterra, fue la primera ciudad en tener todo su suministro de agua clorado. [99] En 1905, después de un brote de fiebre tifoidea, la ciudad de Lincoln, Inglaterra , instituyó la cloración permanente del agua. [100] La primera desinfección permanente de agua potable en los EE. UU. se realizó en 1908 en el suministro de agua de Jersey City, Nueva Jersey . El crédito por la decisión de construir el sistema de cloración se le ha dado a John L. Leal . [101] La instalación de cloración fue diseñada por George W. Fuller . [102]
Los brotes en grupos militares itinerantes llevaron a la creación de la bolsa Lyster en 1915; una bolsa con un grifo que se puede colgar de un árbol o un poste, llenar con agua y viene con una tableta de cloración para dejar caer en el agua. [82] La bolsa Lyster fue esencial para la supervivencia de los soldados estadounidenses en la Guerra de Vietnam . [82]
Transmisión directa y portadores
Hubo varios casos en los que los repartidores de leche propagaron la fiebre tifoidea en las comunidades a las que servían. Aunque la fiebre tifoidea no se transmite a través de la leche en sí, hubo varios ejemplos de distribuidores de leche en muchos lugares que diluían la leche con agua contaminada o limpiaban las botellas de vidrio en las que se colocaba la leche con agua contaminada. [82] [85] Boston tuvo dos casos de este tipo a principios del siglo XX. [85] En 1899 hubo 24 casos de fiebre tifoidea atribuidos a un solo lechero, cuya esposa había muerto de fiebre tifoidea una semana antes del brote. [85] En 1908, JJ Fallon, que también era lechero, murió de fiebre tifoidea. [85] Tras su muerte y la confirmación del diagnóstico de fiebre tifoidea, la ciudad realizó una investigación de los síntomas y casos de fiebre tifoidea a lo largo de su ruta y encontró evidencia de un brote significativo. Un mes después de que se informara por primera vez sobre el brote, el Boston Globe publicó una breve declaración en la que declaraba que el brote había terminado, afirmando que "en Jamaica Plain hay un ligero aumento, con un total de 272 casos. En toda la ciudad hay un total de 348 casos". [85] Se informó de al menos una muerte durante este brote: la señora Sophia S. Engstrom, de 46 años. [85] La fiebre tifoidea siguió asolando el barrio de Jamaica Plain en particular durante 1908, y se informó de la muerte de varias personas más debido a la fiebre tifoidea, aunque estos casos no estaban vinculados explícitamente al brote. [85] El barrio de Jamaica Plain en ese momento era el hogar de muchos inmigrantes pobres y de clase trabajadora, en su mayoría de Irlanda . [103]
La portadora más notoria de la fiebre tifoidea, pero de ninguna manera la más destructiva, fue Mary Mallon , conocida como Mary Tifoidea. [104] [87] Aunque en ese momento se conocían otros casos de propagación de fiebre tifoidea de persona a persona, el concepto de un portador asintomático, que era capaz de transmitir la enfermedad, solo se había hipotetizado y aún no se había identificado o probado. [82] Mary Mallon se convirtió en el primer ejemplo conocido de un portador asintomático de una enfermedad infecciosa, lo que convirtió a la fiebre tifoidea en la primera enfermedad conocida que se transmite a través de huéspedes asintomáticos. [82] Los casos y muertes causados por Mallon fueron principalmente familias de clase alta en la ciudad de Nueva York. [82] En el momento del mandato de Mallon como cocinero personal para familias de clase alta, la ciudad de Nueva York informaba de 3.000 a 4.500 casos de fiebre tifoidea al año. [82] En el verano de 1906, dos hijas de una familia adinerada y las criadas que trabajaban en su casa enfermaron de fiebre tifoidea. [82] Después de investigar las fuentes de agua de su casa y descartar la contaminación del agua, la familia contrató al ingeniero civil George Soper para que realizara una investigación de la posible fuente de fiebre tifoidea en el hogar. [82] Soper se describió a sí mismo como un "luchador contra las epidemias". [82] Su investigación descartó muchas fuentes de alimentos y lo llevó a preguntarse si la cocinera que la familia contrató justo antes del brote en su hogar, Mallon, era la fuente. [82] Como ella ya se había ido y había comenzado a trabajar en otro lugar, procedió a rastrearla para obtener una muestra de heces. [82] Cuando finalmente pudo conocer a Mallon en persona, la describió diciendo "Mary tenía una buena figura y podría haber sido llamada atlética si no hubiera sido un poco demasiado pesada". [86] En los relatos sobre la persecución de Mallon por parte de Soper, su único remordimiento parece ser que no se le dio suficiente crédito por su incansable búsqueda y publicación de su información de identificación personal, afirmando que los medios "me roban todo el crédito que pertenece al descubrimiento del primer portador de fiebre tifoidea que se encontró en Estados Unidos". [86] Finalmente, se sospechó que 51 casos y 3 muertes fueron causados por Mallon. [105] [87]
En 1924, la ciudad de Portland, Oregón , experimentó un brote de fiebre tifoidea, que consistió en 26 casos y 5 muertes, todas ellas debidas a hemorragia intestinal . [106] Se concluyó que todos los casos se debieron a un solo trabajador de una granja lechera, que estaba eliminando grandes cantidades del patógeno tifoideo en su orina. [106] La identificación errónea de la enfermedad, debido a resultados inexactos de la prueba de Widal, retrasó la identificación del portador y el tratamiento adecuado. [106] En última instancia, se necesitaron cuatro muestras de diferentes secreciones de todos los trabajadores lecheros para identificar con éxito al portador. [106] Tras el descubrimiento, el trabajador lechero fue puesto en cuarentena a la fuerza durante siete semanas y se tomaron muestras regulares, la mayoría de las veces las muestras de heces no arrojaron tifoidea y, a menudo, la orina arrojaba el patógeno. [106] Se informó que el portador tenía 72 años y parecía tener excelente salud sin síntomas. [106] El tratamiento farmacéutico disminuyó la cantidad de bacterias secretadas, sin embargo, la infección nunca se eliminó por completo de la orina, y el portador fue liberado "con órdenes de no volver a manipular alimentos para consumo humano". [106] En el momento de la liberación, los autores señalaron que "durante más de cincuenta años se ha ganado la vida principalmente ordeñando vacas y sabe poco de otras formas de trabajo, por lo que se debe esperar que sea necesaria una vigilancia más estrecha para asegurarse de que no vuelva a ejercer esta ocupación". [106]
En general, a principios del siglo XX la profesión médica comenzó a identificar a los portadores de la enfermedad y a encontrar evidencia de transmisión independientemente de la contaminación del agua. [82] En una publicación de la Asociación Médica Estadounidense de 1933 , el tratamiento de los médicos a los portadores asintomáticos se resume mejor en la línea inicial "Los portadores de bacilos tifoideos son una amenaza". [107] En la misma publicación, se da la primera estimación oficial de portadores de tifoidea: entre el 2 y el 5 % de todos los pacientes de tifoidea, y se distingue entre portadores temporales y portadores crónicos. [107] Los autores estiman además que hay entre cuatro y cinco mujeres portadoras crónicas por cada hombre portador, aunque no ofrecieron datos para explicar esta afirmación de una diferencia de género en la tasa de portadores de tifoidea. [107] En cuanto al tratamiento, los autores sugieren: "Cuando se los reconozca, se les debe instruir sobre la eliminación de los excrementos, así como sobre la importancia de la higiene personal. Se les debe prohibir que manipulen alimentos o bebidas destinados a otros, y sus movimientos y paraderos deben ser informados a los funcionarios de salud pública". [107]

En la actualidad, los portadores de la fiebre tifoidea existen en todo el mundo, pero es probable que la mayor incidencia de infección asintomática se produzca en los países del sur y sudeste de Asia y en el África subsahariana. [1] [108] El departamento de salud pública del condado de Los Ángeles hace un seguimiento de los portadores de la fiebre tifoidea e informa anualmente sobre la cantidad de portadores identificados en el condado; entre 2006 y 2016, se identificaron entre 0 y 4 casos nuevos de portadores de la fiebre tifoidea por año. [1] Los casos de fiebre tifoidea deben notificarse en el plazo de un día laborable a partir de la identificación. A partir de 2018, los portadores crónicos de la fiebre tifoidea deben firmar un "Acuerdo de portador" y deben hacerse pruebas de diseminación de la fiebre tifoidea dos veces al año, idealmente cada 6 meses. [109] Los portadores pueden quedar exentos de sus acuerdos una vez que cumplan con los requisitos de "liberación", en función de la finalización de un plan de tratamiento personalizado diseñado con profesionales médicos. [109] Requisitos de liberación de portadores fecales o de vesícula biliar: 6 muestras negativas consecutivas de heces y orina presentadas en intervalos de 1 mes o más comenzando al menos 7 días después de completar la terapia. [109] Requisitos de liberación de portadores urinarios o renales: 6 muestras negativas consecutivas de orina presentadas en intervalos de 1 mes o más comenzando al menos 7 días después de completar la terapia. [109]
Debido a la naturaleza de los casos asintomáticos, quedan muchas preguntas sobre cómo las personas pueden tolerar la infección durante largos períodos de tiempo, cómo identificar dichos casos y las opciones eficientes para el tratamiento. Los investigadores están trabajando actualmente para comprender la infección asintomática con especies de Salmonella mediante el estudio de infecciones en animales de laboratorio, lo que en última instancia conducirá a mejores opciones de prevención y tratamiento para los portadores de tifoidea. En 2002, John Gunn describió la capacidad de Salmonella sp. para formar biopelículas en cálculos biliares en ratones, proporcionando un modelo para estudiar el transporte en la vesícula biliar. [110] Denise Monack y Stanley Falkow describieron un modelo de ratón de infección intestinal y sistémica asintomática en 2004, y Monack continuó demostrando que una subpoblación de superpropagadores es responsable de la mayoría de la transmisión a nuevos huéspedes, siguiendo la regla 80/20 de transmisión de enfermedades, y que la microbiota intestinal probablemente juega un papel en la transmisión. [111] [112] El modelo de ratón de Monack permite el transporte a largo plazo de Salmonella en los ganglios linfáticos mesentéricos , el bazo y el hígado . [111]
Desarrollo de vacunas

El bacteriólogo británico Almroth Edward Wright fue el primero en desarrollar una vacuna eficaz contra la fiebre tifoidea en la Escuela de Medicina del Ejército en Netley , Hampshire . Fue introducida en 1896 y utilizada con éxito por los británicos durante la Segunda Guerra de los Bóers en Sudáfrica. [113] En ese momento, la fiebre tifoidea a menudo mataba a más soldados en la guerra de los que se perdían debido al combate enemigo. Wright siguió desarrollando su vacuna en un departamento de investigación recién inaugurado en la Escuela de Medicina del Hospital St Mary en Londres a partir de 1902, donde estableció un método para medir las sustancias protectoras ( opsonina ) en la sangre humana. [114] La versión de Wright de la vacuna contra la fiebre tifoidea se produjo cultivando la bacteria a temperatura corporal en caldo, y luego calentando las bacterias a 60 °C para "inactivar por calor" el patógeno, matándolo, mientras se mantenían intactos los antígenos de superficie . Las bacterias muertas por calor luego se inyectaron en un paciente. [82] Para demostrar la eficacia de la vacuna, Wright recolectó muestras de suero de los pacientes varias semanas después de la vacunación y analizó la capacidad del suero para aglutinar bacterias vivas de la fiebre tifoidea. Un resultado "positivo" se manifestó por la acumulación de bacterias, lo que indicaba que el cuerpo estaba produciendo antisuero (ahora llamados anticuerpos ) contra el patógeno. [82]
Citando el ejemplo de la Segunda Guerra de los Bóers, durante la cual muchos soldados murieron por enfermedades fácilmente prevenibles, Wright convenció al Ejército británico de que se debían producir 10 millones de dosis de vacunas para las tropas que se enviaban al Frente Occidental , salvando así hasta medio millón de vidas durante la Primera Guerra Mundial . [115] El Ejército británico fue el único combatiente al estallar la guerra que tenía a sus tropas completamente inmunizadas contra la bacteria. Por primera vez, sus bajas debido al combate excedieron a las causadas por enfermedades. [116]
En 1909, Frederick F. Russell , un médico del ejército de los EE. UU. , adoptó la vacuna contra la fiebre tifoidea de Wright para su uso en el ejército y, dos años más tarde, su programa de vacunación se convirtió en el primero en el que se inmunizó a todo un ejército. Eliminó la fiebre tifoidea como causa importante de morbilidad y mortalidad en el ejército de los EE. UU. [117] La vacunación contra la fiebre tifoidea para los miembros del ejército estadounidense se volvió obligatoria en 1911. [82] Antes de la vacuna, la tasa de fiebre tifoidea en el ejército era de 14 000 o más por cada 100 000 soldados. Para la Primera Guerra Mundial, la tasa de fiebre tifoidea en los soldados estadounidenses era de 37 por cada 100 000. [82]
Durante la Segunda Guerra Mundial, el ejército de los Estados Unidos autorizó el uso de una vacuna trivalente que contenía patógenos de la fiebre tifoidea, Paratyphi A y Paratyphi B inactivados por calor. [82]
En 1934, el descubrimiento del antígeno capsular Vi por Arthur Felix y la señorita SR Margaret Pitt permitió el desarrollo de la vacuna del antígeno Vi más segura, que se usa ampliamente en la actualidad. [118] Arthur Felix y Margaret Pitt también aislaron la cepa Ty2, que se convirtió en la cepa parental de Ty21a , la cepa que se usa como vacuna viva atenuada para la fiebre tifoidea en la actualidad. [119]
Antibióticos y resistencia
El cloranfenicol fue aislado de Streptomyces por David Gotlieb durante la década de 1940. [82] En 1948, los médicos del ejército estadounidense probaron su eficacia en el tratamiento de pacientes con fiebre tifoidea en Kuala Lumpur , Malasia. [82] Los individuos que recibieron un tratamiento completo eliminaron la infección, mientras que los pacientes que recibieron una dosis más baja tuvieron una recaída. [82] Los portadores asintomáticos continuaron eliminando bacilos a pesar del tratamiento con cloranfenicol; solo los pacientes enfermos mejoraron con cloranfenicol. [82] La resistencia al cloranfenicol se volvió frecuente en el sudeste asiático en la década de 1950, y hoy en día el cloranfenicol solo se usa como último recurso debido a la alta prevalencia de resistencia. [82]
Terminología
La enfermedad ha recibido diversos nombres, a menudo asociados a síntomas como fiebre gástrica, fiebre entérica, tifus abdominal, fiebre remitente infantil, fiebre lenta, fiebre nerviosa, fiebre pitogénica, [120] fiebre de drenaje y fiebre baja. [121]
Sociedad y cultura
Personas notables
- El emperador Augusto de Roma (se sospecha según el registro histórico, pero no se confirma) [82] sobrevivió.
- Alberto, príncipe consorte , esposo de la reina Victoria del Reino Unido, murió 24 días después de que se le registrara por primera vez que se sentía "horriblemente enfermo". [82] Murió el 14 de diciembre de 1861 después de sufrir pérdida de apetito, insomnio, fiebre, escalofríos, sudoración profusa, vómitos, manchas de sarpullido, delirios, incapacidad para reconocer a los miembros de la familia, empeoramiento del sarpullido en el abdomen, un cambio en el color de la lengua y, finalmente, un estado de fatiga extrema. [82] El médico que lo atendió, William Jenner , un experto en fiebre tifoidea en ese momento, lo diagnosticó. [122]
- Eduardo VII del Reino Unido, hijo de la reina Victoria , mientras todavía era príncipe de Gales, sufrió un caso casi fatal de fiebre tifoidea. [123]
- El zar Nicolás II de Rusia sobrevivió, la enfermedad duró alrededor de 1900-1901. [124] [ fuente autopublicada ]
- La reina Guillermina de los Países Bajos pudo haber tenido un aborto en 1902 debido a una infección tifoidea a la que sobrevivió. [125] [126]
- William Henry Harrison , el noveno presidente de los Estados Unidos de América , murió a los 32 días de su mandato, en 1841. Este es el mandato más corto cumplido por un presidente de los Estados Unidos.
- Wilbur Wright , coinventor del avión junto con su hermano Orville, murió de fiebre tifoidea en 1912 a la edad de 45 años. Orville contrajo la fiebre tifoidea en 1896, época en la que Wilbur le leía en voz alta libros de Otto Lilienthal , un pionero alemán del vuelo humano. Esto dio inicio a los dos hombres en su propia búsqueda de la creación de un avión.
- Stephen A. Douglas , oponente político de Abraham Lincoln en 1858 y 1860, murió de fiebre tifoidea el 3 de junio de 1861.
- Ignacio Zaragoza , general y político mexicano, murió a los 33 años de fiebre tifoidea el 8 de septiembre de 1862.
- Franz Schubert , compositor y letrista, murió de fiebre tifoidea a los 31 años el 19 de noviembre de 1828.
- William Wallace Lincoln , hijo del presidente estadounidense Abraham y Mary Todd Lincoln, murió de fiebre tifoidea en 1862. [127]
- La princesa Leopoldina de Brasil , hija del emperador Pedro II , murió de fiebre tifoidea en 1871. [128]
- Martha Bulloch Roosevelt , madre del presidente Theodore Roosevelt y abuela paterna de Eleanor Roosevelt , murió de fiebre tifoidea en 1884.
- Mary Mallon , "María Tifoidea" – ver la sección de historia, "portadores" para más detalles
- Leland Stanford Jr. , hijo del magnate y político estadounidense A. Leland Stanford y epónimo de la Universidad Leland Stanford Junior , murió de fiebre tifoidea en 1884 a la edad de 15 años. [129]
- Tres de los cinco hijos de Louis Pasteur murieron de fiebre tifoidea. [82]
- Gerard Manley Hopkins , poeta inglés, murió de fiebre tifoidea en 1889. [130]
- Lizzie van Zyl , niña sudafricana reclusa del campo de concentración de Bloemfontein durante la Segunda Guerra Bóer , murió de fiebre tifoidea en 1901.
- El Dr. HJH 'Tup' Scott , capitán del equipo de cricket australiano que realizó una gira por Inglaterra en 1886, murió de fiebre tifoidea en 1910. [131]
- Arnold Bennett , novelista inglés, murió en 1932 de fiebre tifoidea, dos meses después de beber un vaso de agua en un hotel de París para demostrar que era seguro. [132]
- Hakaru Hashimoto , científico médico japonés, murió de fiebre tifoidea en 1934. [133]
- John Buford , oficial de caballería de la Unión durante la Guerra Civil, murió de fiebre tifoidea el 16 de diciembre de 1863.
Referencias
- ^ abcde "FIEBRE TIFOIDEA AGUDA Y PORTADORA" (PDF) . Control de enfermedades transmisibles agudas: Informe anual de morbilidad de 2016 . 2016. pág. 133 – vía Departamento de Salud Pública del Condado de Los Ángeles.
- ^ abcdefghij Wain J, Hendriksen RS, Mikoleit ML, Keddy KH, Ochiai RL (marzo de 2015). "Fiebre tifoidea". Lanceta . 385 (9973): 1136–45. doi :10.1016/s0140-6736(13)62708-7. PMID 25458731. S2CID 2409150.
- ^ Mathur R, Oh H, Zhang D, Park SG, Seo J, Koblansky A, et al. (octubre de 2012). "Un modelo de ratón de infección por Salmonella Typhi". Cell . 151 (3): 590–602. doi :10.1016/j.cell.2012.08.042. ISSN 0092-8674. PMC 3500584 . PMID 23101627.
- ^ ab Newton AE (2014). "3 enfermedades infecciosas relacionadas con los viajes". Información sanitaria de los CDC para viajes internacionales 2014: el libro amarillo . Oup USA. ISBN 978-0-19-994849-9. Archivado desde el original el 2 de julio de 2015.
- ^ abcdefgh «Fiebre tifoidea». cdc.gov . 14 de mayo de 2013. Archivado desde el original el 6 de junio de 2016 . Consultado el 28 de marzo de 2015 .
- ^ "Fiebre tifoidea". www.who.int . Consultado el 18 de mayo de 2024 .
- ^ abcdef «Fiebre tifoidea». cdc.gov . 14 de mayo de 2013. Archivado desde el original el 2 de abril de 2015 . Consultado el 28 de marzo de 2015 .
- ^ abcdefghi «Vacunas contra la fiebre tifoidea: documento de posición de la OMS» (PDF) . Relevé Épidémiologique Hebdomadaire . 83 (6): 49–59. Febrero de 2008. PMID 18260212. Archivado desde el original (PDF) el 2 de abril de 2015.
- ^ ab Pitzer VE, Meiring J, Martineau FP, Watson CH, Kang G, Basnyat B, et al. (octubre de 2019). "La carga invisible: diagnóstico y lucha contra la fiebre tifoidea en Asia y África". Enfermedades infecciosas clínicas . 69 (Supl 5): S395–S401. doi :10.1093/cid/ciz611. PMC 6792124 . PMID 31612938.
- ^ "Fiebre tifoidea: causas, síntomas y tratamiento".
- ^ ab Crump JA, Mintz ED (enero de 2010). "Tendencias mundiales en la fiebre tifoidea y paratifoidea". Clinical Infectious Diseases . 50 (2): 241–6. doi :10.1086/649541. PMC 2798017 . PMID 20014951.
- ^ Näsström E, Parry CM, Thieu NT, Maude RR, de Jong HK, Fukushima M, et al. (2017). Metabolitos de diagnóstico reproducibles en plasma de pacientes con fiebre tifoidea en Asia y África. Universidad de Umeå, instituciones de Kemiska. OCLC 1234663430.
- ^ abc Milligan R, Paul M, Richardson M, Neuberger A (mayo de 2018). "Vacunas para prevenir la fiebre tifoidea". Base de datos Cochrane de revisiones sistemáticas . 2018 (5): CD001261. doi :10.1002/14651858.CD001261.pub4. PMC 6494485. PMID 29851031 .
- ^ Chatham-Stephens K, Medalla F, Hughes M, Appiah GD, Aubert RD, Caidi H, et al. (enero de 2019). "Aparición de infecciones por Salmonella Typhi extremadamente resistentes a los medicamentos entre viajeros hacia o desde Pakistán – Estados Unidos, 2016-2018". MMWR. Informe semanal de morbilidad y mortalidad . 68 (1): 11–13. doi :10.15585/mmwr.mm6801a3. PMC 6342547 . PMID 30629573.
- ^ Kuehn R, Stoesser N, Eyre D, Darton TC, Basnyat B, Parry CM (24 de noviembre de 2022). "Tratamiento de la fiebre entérica (fiebre tifoidea y paratifoidea) con cefalosporinas". Base de Datos Cochrane de Revisiones Sistemáticas . 2022 (11): CD010452. doi :10.1002/14651858.CD010452.pub2. PMC 9686137. PMID 36420914.
- ^ Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (Colaboradores de incidencia y prevalencia de enfermedades y lesiones del GBD 2015) (octubre de 2016). "Incidencia, prevalencia y años vividos con discapacidad a nivel mundial, regional y nacional para 310 enfermedades y lesiones, 1990-2015: un análisis sistemático para el Estudio de la carga mundial de enfermedades de 2015". Lancet . 388 (10053): 1545–1602. doi :10.1016/S0140-6736(16)31678-6. PMC 5055577 . PMID 27733282.
- ^ Jackson BR, Iqbal S, Mahon B (marzo de 2015). "Recomendaciones actualizadas para el uso de la vacuna contra la fiebre tifoidea: Comité Asesor sobre Prácticas de Inmunización, Estados Unidos, 2015". MMWR. Informe semanal de morbilidad y mortalidad . 64 (11): 305–8. PMC 4584884. PMID 25811680 .
- ^ Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (Colaboradores de GBD 2015 Mortality and Causes of Death) (octubre de 2016). "Esperanza de vida global, regional y nacional, mortalidad por todas las causas y mortalidad por causas específicas para 249 causas de muerte, 1980-2015: un análisis sistemático para el Estudio de la Carga Global de Enfermedades 2015". Lancet . 388 (10053): 1459–1544. doi :10.1016/s0140-6736(16)31012-1. PMC 5388903 . PMID 27733281.
- ^ ab Abubakar II, Tillmann T, Banerjee A, et al. (Colaboradores de GBD 2013 Mortality and Causes of Death) (enero de 2015). "Mortalidad global, regional y nacional por todas las causas y por causas específicas según la edad y el sexo para 240 causas de muerte, 1990-2013: un análisis sistemático para el Estudio de la Carga Global de Enfermedades 2013". Lancet . 385 (9963): 117–71. doi :10.1016/S0140-6736(14)61682-2. PMC 4340604 . PMID 25530442.
- ^ Cunha BA (marzo de 2004). "Osler sobre la fiebre tifoidea: diferenciando la fiebre tifoidea del tifus y la malaria". Clínicas de enfermedades infecciosas de Norteamérica . 18 (1): 111–25. doi :10.1016/S0891-5520(03)00094-1. PMID 15081508.
- ^ Evans AS, Brachman PS (2013). Infecciones bacterianas en humanos: epidemiología y control. Springer. pág. 839. ISBN 978-1-4615-5327-4.
- ^ "Fiebre tifoidea". Diccionario Merriam Webster. Archivado desde el original el 2013-07-02 . Consultado el 2013-06-24 .
- ^ Kumar P, Kumar R (marzo de 2017). "Fiebre entérica". Revista india de pediatría . 84 (3): 227–230. doi :10.1007/s12098-016-2246-4. PMID 27796818. S2CID 3825885.
- ^ "Fiebre tifoidea: Enciclopedia Médica MedlinePlus". medlineplus.gov . Consultado el 21 de abril de 2020 .
- ^ Yap KP, Ho WS, Gan HM, Chai LC, Thong KL (2016). "MLST global de Salmonella Typhi revisitado en la era posgenómica: conservación genética, estructura poblacional y genómica comparativa de tipos de secuencias raras". Frontiers in Microbiology . 7 : 270. doi : 10.3389/fmicb.2016.00270 . PMC 4774407 . PMID 26973639.
- ^ Wong VK, Baker S, Pickard DJ, Parkhill J, Page AJ, Feasey NA, et al. (junio de 2015). "El análisis filogeográfico del clado H58 resistente a múltiples fármacos dominante de Salmonella Typhi identifica eventos de transmisión intercontinental e intracontinental". Nature Genetics . 47 (6): 632–9. doi :10.1038/ng.3281. PMC 4921243 . PMID 25961941.
- ^ Wong VK, Baker S, Connor TR, Pickard D, Page AJ, Dave J, et al. (octubre de 2016). "Un marco de genotipado extendido para Salmonella enterica serovar Typhi, la causa de la fiebre tifoidea humana". Nature Communications . 7 (1): 12827. Bibcode :2016NatCo...712827W. doi : 10.1038/ncomms12827 . PMC 5059462 . PMID 27703135.
- ^ abc Eng SK, Pusparajah P, Ab Mutalib NS, Ser HL, Chan KG, Lee LH (junio de 2015). "Salmonella: una revisión sobre patogénesis, epidemiología y resistencia a los antibióticos". Frontiers in Life Science . 8 (3): 284–293. doi : 10.1080/21553769.2015.1051243 .
- ^ Ryan KJ, Ray CG, eds. (2004). Microbiología médica Sherris (4.ª ed.). McGraw Hill. ISBN 978-0-8385-8529-0.
- ^ Mawazo A, Bwire GM, Matee MI (5 de junio de 2019). "Rendimiento de la prueba de Widal y el cultivo de heces en el diagnóstico de fiebre tifoidea entre pacientes sospechosos en Dar es Salaam, Tanzania". BMC Research Notes . 12 (1): 316. doi : 10.1186/s13104-019-4340-y . ISSN 1756-0500. PMC 6551910 . PMID 31167646.
- ^ Feasey NA, Gordon MA (2014). "Infecciones por Salmonella". En Farrar J, Hotez P, Junghanss T, Kang G, Lalloo D, White NJ (eds.). Enfermedades infecciosas tropicales de Manson (23.ª ed.). Saunders Ltd. págs. 337–348.e2. doi :10.1016/B978-0-7020-5101-2.00026-1. ISBN 978-0-7020-5101-2.
- ^ Wijedoru L, Mallett S, Parry CM, et al. (Grupo Cochrane de Enfermedades Infecciosas) (mayo de 2017). "Pruebas de diagnóstico rápido para la fiebre tifoidea y paratifoidea (entérica)". Base de Datos Cochrane de Revisiones Sistemáticas . 2017 (5): CD008892. doi :10.1002/14651858.CD008892.pub2. PMC 5458098. PMID 28545155.
- ^ Lim PL, Tam FC, Cheong YM, Jegathesan M (agosto de 1998). "Prueba de un solo paso de 2 minutos para detectar anticuerpos específicos de la fiebre tifoidea basada en la separación de partículas en tubos". Journal of Clinical Microbiology . 36 (8): 2271–8. doi :10.1128/JCM.36.8.2271-2278.1998. PMC 105030 . PMID 9666004.
- ^ "TYPHIDOT Rapid IgG/IgM (Combo)" (PDF) . Reszon Diagnostics International . Consultado el 14 de noviembre de 2019 .
- ^ "La gran crisis del estiércol de caballo de 1894". Archivado desde el original el 25 de mayo de 2015.
- ^ Cirillo VJ (2006). ""Esponjas aladas": moscas domésticas como portadoras de fiebre tifoidea en campamentos militares del siglo XIX y principios del XX". Perspectivas en biología y medicina . 49 (1): 52–63. doi :10.1353/pbm.2006.0005. PMID 16489276. S2CID 41428479.
- ^ "Historia del tratamiento del agua potable | Agua potable | Agua saludable | CDC". www.cdc.gov . 2018-10-10 . Consultado el 2020-04-21 .
- ^ Marathe SA, Lahiri A, Negi VD, Chakravortty D (2012). "Fiebre tifoidea y desarrollo de vacunas: una pregunta parcialmente respondida". Revista India de Investigación Médica . 135 (2): 161–9. PMC 3336846 . PMID 22446857.
- ^ abcd Date KA, Bentsi-Enchill A, Marks F, Fox K (junio de 2015). "Estrategias de vacunación contra la fiebre tifoidea". Vaccine . 33 (Supl 3): C55-61. doi :10.1016/j.vaccine.2015.04.028. PMC 10644681 . PMID 25902360.
- ^ "Vivaxim Solución inyectable". NPS MedicineWise . Archivado desde el original el 1 de octubre de 2015. Consultado el 10 de abril de 2017 .
- ^ Gallagher J (4 de diciembre de 2019). «La vacuna contra la fiebre tifoidea funciona fantásticamente bien». BBC News . Consultado el 17 de enero de 2020 .
- ^ Shakya M, Colin-Jones R, Theiss-Nyland K, Voysey M, Pant D, Smith N, et al. (diciembre de 2019). "Análisis de eficacia de fase 3 de un ensayo de vacuna conjugada contra la fiebre tifoidea en Nepal". The New England Journal of Medicine . 381 (23): 2209–2218. doi : 10.1056/NEJMoa1905047 . PMC 6785806 . PMID 31800986.
- ^ "UpToDate". www.uptodate.com . Consultado el 21 de abril de 2020 .
- ^ Parry CM, Beeching NJ (junio de 2009). "Tratamiento de la fiebre entérica". BMJ . 338 : b1159. doi :10.1136/bmj.b1159. PMID 19493937. S2CID 3264721.
- ^ ab Effa EE, Lassi ZS, Critchley JA, Garner P, Sinclair D, Olliaro PL, et al. (octubre de 2011). "Fluoroquinolonas para el tratamiento de la fiebre tifoidea y paratifoidea (fiebre entérica)". Base de Datos Cochrane de Revisiones Sistemáticas . 2011 (10): CD004530. doi :10.1002/14651858.CD004530.pub4. PMC 6532575. PMID 21975746 .
- ^ Soe GB, Overturf GD (1987). "Tratamiento de la fiebre tifoidea y otras salmonelosis sistémicas con cefotaxima, ceftriaxona, cefoperazona y otras cefalosporinas más nuevas". Reseñas de enfermedades infecciosas . 9 (4): 719–36. doi :10.1093/clinids/9.4.719. JSTOR 4454162. PMID 3125577.
- ^ Wallace MR, Yousif AA, Mahroos GA, Mapes T, Threlfall EJ, Rowe B, et al. (diciembre de 1993). "Ciprofloxacino versus ceftriaxona en el tratamiento de la fiebre tifoidea multirresistente". Revista Europea de Microbiología Clínica y Enfermedades Infecciosas . 12 (12): 907–10. doi :10.1007/BF01992163. PMID 8187784. S2CID 19358454.
- ^ Dutta P, Mitra U, Dutta S, De A, Chatterjee MK, Bhattacharya SK (junio de 2001). "Terapia con ceftriaxona en el fracaso del tratamiento con ciprofloxacino en la fiebre tifoidea en niños". The Indian Journal of Medical Research . 113 : 210–3. PMID 11816954.
- ^ Коваленко АН, et al. (2011). "Особенности клиники, диагностики и лечения брюшного тифа у лиц молодого возраста". Voen.-meditsinskii Zhurnal . 332 (1): 33–39.
- ^ Bhutta ZA, Khan IA, Molla AM (noviembre de 1994). "Terapia de la fiebre tifoidea resistente a múltiples fármacos con cefixima oral frente a ceftriaxona intravenosa". The Pediatric Infectious Disease Journal . 13 (11): 990–4. doi :10.1097/00006454-199411000-00010. PMID 7845753.
- ^ Cao XT, Kneen R, Nguyen TA, Truong DL, White NJ, Parry CM (marzo de 1999). "Un estudio comparativo de ofloxacino y cefixima para el tratamiento de la fiebre tifoidea en niños. El Grupo de Estudio de la Fiebre Tifoidea del Centro Pediátrico Dong Nai". The Pediatric Infectious Disease Journal . 18 (3): 245–8. doi :10.1097/00006454-199903000-00007. PMID 10093945.
- ^ Barón S et al.
- ^ "Enfermedades diarreicas". Organización Mundial de la Salud . Febrero de 2009. Archivado desde el original el 2 de noviembre de 2011. Consultado el 25 de abril de 2013 .
- ^ "OMS | Fiebre tifoidea". www.who.int . Archivado desde el original el 27 de julio de 2017 . Consultado el 10 de agosto de 2017 .
- ^ Anyomih TK, Drake TM, Glasbey J, Fitzgerald JE, Ots R, et al. (GlobalSurg Collaborative) (octubre de 2018). "Manejo y resultados después de la cirugía para la fiebre tifoidea gastrointestinal: un estudio de cohorte multicéntrico, prospectivo e internacional". Revista mundial de cirugía . 42 (10): 3179–3188. doi :10.1007/s00268-018-4624-8. PMC 6132852 . PMID 29725797.
- ^ Waddington CS, Darton TC, Pollard AJ (enero de 2014). "El desafío de la fiebre entérica". The Journal of Infection . Temas de actualidad sobre infecciones e inmunidad en niños: artículos de la décima reunión anual del IIC, Oxford, Reino Unido, 2012. 68 (Supl. 1): S38-50. doi :10.1016/j.jinf.2013.09.013. PMID 24119827.
- ^ ab Gonzalez-Escobedo G, Marshall JM, Gunn JS (enero de 2011). "Infección crónica y aguda de la vesícula biliar por Salmonella Typhi: comprensión del estado de portador". Nature Reviews. Microbiology . 9 (1): 9–14. doi :10.1038/nrmicro2490. PMC 3255095 . PMID 21113180.
- ^ "Fiebre tifoidea extremadamente resistente a los medicamentos en Pakistán: vigilancia, nivel 1, tome las precauciones habituales - Avisos de salud para viajeros | Salud del viajero | CDC". wwwnc.cdc.gov . Consultado el 21 de abril de 2020 .
- ^ Zaki SA, Karande S (mayo de 2011). "Fiebre tifoidea resistente a múltiples fármacos: una revisión". Revista de infecciones en países en desarrollo . 5 (05): 324–37. doi : 10.3855/jidc.1405 . PMID 21628808.
- ^ Gibani MM, Britto C, Pollard AJ (octubre de 2018). "Fiebre tifoidea y paratifoidea: un llamado a la acción". Current Opinion in Infectious Diseases . 31 (5): 440–448. doi :10.1097/QCO.0000000000000479. PMC 6319573 . PMID 30138141.
- ^ Cooke FJ, Wain J, Threlfall EJ (agosto de 2006). "Resistencia a las fluoroquinolonas en Salmonella Typhi". BMJ . 333 (7563): 353–4. doi :10.1136/bmj.333.7563.353-b. PMC 1539082 . PMID 16902221.
- ^ ab "Fiebre tifoidea". Organización Mundial de la Salud. Archivado desde el original el 2011-11-02 . Consultado el 2007-08-28 .
- ^ Crump JA, Luby SP, Mintz ED (mayo de 2004). "La carga mundial de la fiebre tifoidea". Boletín de la Organización Mundial de la Salud . 82 (5): 346–53. PMC 2622843 . PMID 15298225.
- ^ Muyembe-Tamfum JJ, Veyi J, Kaswa M, Lunguya O, Verhaegen J, Boelaert M (enero de 2009). "Un brote de peritonitis causado por Salmonella Typhi multirresistente en Kinshasa, República Democrática del Congo". Medicina de viajes y enfermedades infecciosas . 7 (1): 40–3. doi :10.1016/j.tmaid.2008.12.006. PMID 19174300.
- ^ Baddam R, Kumar N, Thong KL, Ngoi ST, Teh CS, Yap KP, et al. (julio de 2012). "Estructura genética fina de una cepa de Salmonella enterica serovar Typhi asociada con el brote de fiebre tifoidea de 2005 en Kelantan, Malasia". Journal of Bacteriology . 194 (13): 3565–6. doi :10.1128/jb.00581-12. PMC 3434757 . PMID 22689247.
- ^ Yap KP, Teh CS, Baddam R, Chai LC, Kumar N, Avasthi TS, et al. (septiembre de 2012). "Información a partir de la secuencia del genoma de una cepa de Salmonella enterica serovar Typhi asociada a un caso esporádico de fiebre tifoidea en Malasia". Journal of Bacteriology . 194 (18): 5124–5. doi :10.1128/jb.01062-12. PMC 3430317 . PMID 22933756.
- ^ "OMS | Estudio de la fiebre tifoidea en cinco países asiáticos: carga de morbilidad e implicaciones para los controles". Archivado desde el original el 14 de julio de 2008.
- ^ Matano LM, Morris HG, Wood BM, Meredith TC, Walker S (diciembre de 2016). "Aceleración del descubrimiento de compuestos antibacterianos mediante el cribado de células completas dirigido por vías". Química bioorgánica y medicinal . 24 (24): 6307–6314. doi :10.1016/j.bmc.2016.08.003. PMC 5180449 . PMID 27594549.
- ^ "Fiebre tifoidea" (PDF) . Departamento de Salud de Florida . 23 de diciembre de 2013.
- ^ Heymann, David L. , ed. (2008), Manual de control de enfermedades transmisibles , Washington, DC : Asociación Estadounidense de Salud Pública , pág. 665. ISBN 978-0-87553-189-2 .
- ^ Levine MM, Black RE, Lanata C (diciembre de 1982). "Estimación precisa del número de portadores crónicos de Salmonella typhi en Santiago de Chile, un área endémica". The Journal of Infectious Diseases . 146 (6): 724–6. doi :10.1093/infdis/146.6.724. PMID 7142746.
- ^ Yap KP, Gan HM, Teh CS, Baddam R, Chai LC, Kumar N, et al. (noviembre de 2012). "Secuencia genómica y análisis patogénico comparativo de una cepa de Salmonella enterica Serovar Typhi asociada con un portador de fiebre tifoidea en Malasia". Journal of Bacteriology . 194 (21): 5970–1. doi :10.1128/jb.01416-12. PMC 3486090 . PMID 23045488.
- ^ Yap KP, Gan HM, Teh CS, Chai LC, Thong KL (noviembre de 2014). "La genómica comparativa de cepas de Salmonella enterica serovar Typhi estrechamente relacionadas revela la dinámica del genoma y la adquisición de nuevos elementos patógenos". BMC Genomics . 15 (1): 1007. doi : 10.1186/1471-2164-15-1007 . PMC 4289253 . PMID 25412680.
- ^ Crump JA, Sjölund-Karlsson M, Gordon MA, Parry CM (octubre de 2015). "Epidemiología, presentación clínica, diagnóstico de laboratorio, resistencia a los antimicrobianos y tratamiento antimicrobiano de las infecciones invasivas por Salmonella". Clinical Microbiology Reviews . 28 (4): 901–37. doi :10.1128/CMR.00002-15. PMC 4503790 . PMID 26180063.
- ^ Khan MI, Pach A, Khan GM, Bajracharya D, Sahastrabuddhe S, Bhutta W, et al. (junio de 2015). "Introducción de la vacuna contra la fiebre tifoidea: un proyecto piloto de implementación basado en evidencia en Nepal y Pakistán". Vaccine . 33 (Supl 3): C62-7. doi :10.1016/j.vaccine.2015.03.087. PMID 25937612.
- ^ "Fiebre tifoidea extremadamente resistente a los medicamentos en Pakistán". Centros para el Control y la Prevención de Enfermedades . 30 de septiembre de 2019.
- ^ "Fiebre tifoidea y paratifoidea: Informe epidemiológico anual de 2017" (PDF) . Centro Europeo para la Prevención y el Control de Enfermedades. Octubre de 2020. Consultado el 20 de julio de 2021 .
- ^ abc Appiah GD, Chung A, Bentsi-Enchill AD, Kim S, Crump JA, Mogasale V, et al. (junio de 2020). "Brotes de fiebre tifoidea, 1989-2018: implicaciones para la prevención y el control". The American Journal of Tropical Medicine and Hygiene . 102 (6): 1296–1305. doi :10.4269/ajtmh.19-0624. PMC 7253085 . PMID 32228795.
- ^ ab Papagrigorakis MJ, Yapijakis C, Synodinos PN, Baziotopoulou-Valavani E (mayo de 2006). "El examen de ADN de pulpa dental antigua incrimina la fiebre tifoidea como causa probable de la plaga de Atenas". Revista internacional de enfermedades infecciosas . 10 (3): 206–14. doi : 10.1016/j.ijid.2005.09.001 . PMID 16412683.
- ^ Vågene Å, et al. (2018). "Genomas de Salmonella enterica de víctimas de una importante epidemia del siglo XVI en México". Nature Ecology & Evolution . 2 (3): 520–528. Bibcode :2018NatEE...2..520V. doi :10.1038/s41559-017-0446-6. PMID 29335577. S2CID 3358440.
- ^ "Enfermedad y muerte en los primeros tiempos de Estados Unidos: Sociedad Histórica del Área de Tully". tullyhistoricalsociety.org . Consultado el 29 de junio de 2021 .
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar Adler R, Mara E (2016). Fiebre tifoidea: una historia. Jefferson, Carolina del Norte: McFarland & Company. ISBN 978-0-7864-9781-2.OCLC 934938999 .
- ^ "Ostras de Emsworth". Asociación Empresarial de Emsworth. 10 de febrero de 2019. Archivado desde el original el 3 de febrero de 2016.
- ^ Bulstrode HT (1903). Informe del Dr. H. Timbrell Bulstrode a la Junta de Gobierno Local sobre la presunta fiebre tifoidea transmitida por ostras y otras enfermedades que siguieron a los banquetes de alcaldes en Winchester y Southampton, y sobre la fiebre tifoidea que se produjo simultáneamente en otros lugares y que también se atribuyó a las ostras (Informe). Londres: HMSO. pág. 1.
- ^ abcdefgh "Lechero de fiebre tifoidea". ¿Recuerdas Jamaica Plain? . 2007-11-05 . Consultado el 2021-06-24 .
- ^ abc Soper GA (octubre de 1939). "La curiosa carrera de María Tifoidea". Boletín de la Academia de Medicina de Nueva York . 15 (10): 698–712. ISSN 0028-7091. PMC 1911442 . PMID 19312127.
- ^ abc "Short Wave: Typhoid Mary: lecciones de una cuarentena infame en Apple Podcasts". Apple Podcasts . Consultado el 28 de junio de 2021 .
- ^ "La fiebre tifoidea dejó a la ciudad 'bajo asedio'". 2008-06-26 . Consultado el 2021-06-29 .
- ^ Lunguya O, Lejon V, Phoba MF, Bertrand S, Vanhoof R, Verhaegen J, et al. (15 de noviembre de 2012). Ryan ET (ed.). "Salmonella typhi en la República Democrática del Congo: aumento de la susceptibilidad a las fluoroquinolonas". PLOS Neglected Tropical Diseases . 6 (11): e1921. doi : 10.1371/journal.pntd.0001921 . PMC 3499407 . PMID 23166855.
- ^ Platner SB, Ashby T (2002). Diccionario topográfico de la antigua Roma . Oxford University Press. ISBN 9780199256495.
- ^ Yapijakis C (2009). "Hipócrates de Cos, el padre de la medicina clínica, y Asclepiades de Bitinia, el padre de la medicina molecular. Revisión". In Vivo (Atenas, Grecia) . 23 (4): 507–514. PMID 19567383.
El médico griego Antonio Musa curó notablemente al emperador Augusto de la fiebre tifoidea con baños fríos .
- ^ Stachura J, Gałazka K (diciembre de 2003). "Historia y estado actual de la patología gastroenterológica polaca". Revista de fisiología y farmacología . 54 (Supl. 3): 183–92. PMID 15075472.
- ^ "La fiebre tifoidea considerada un problema de medicina científica". JAMA: The Journal of the American Medical Association . 71 (10): 847. 1918-09-07. doi :10.1001/jama.1918.02600360063023. hdl : 2027/coo1.ark:/13960/t9d516735 . ISSN 0098-7484.
- ^ Eberth CJ (1880). "Die Organismen in den Organen bei Typhus abdominalis" [Organismos en los órganos [internos] en casos de tifus abdominalis]. Archiv für pathologische Anatomie und Physiologie (en alemán). 81 : 58–74.
- ^ Eberth CJ (1881). "Neue Untersuchungen über den Bacillus des Abdominaltyphus" [Nuevas investigaciones sobre los bacilos de la fiebre tifoidea abdominal]. Archiv für pathologische Anatomie und Physiologie (en alemán). 83 : 486–501.
- ↑ Los hallazgos de Eberth fueron verificados por Robert Koch Koch R (1881). "Zur Untersuchung von patogen Organismen" [Sobre la investigación de organismos patógenos]. Mitteilungen aus dem Kaiserlichen Gesundheitsamte (en alemán). 1 : 1–49. Archivado desde el original el 23 de abril de 2017.
- ^ Gaffky G (1884). "Zur aetiologie des abdominaltyphus" [Sobre la etiología del tifus abdominal]. Mitteillungen aus dem Kaiserlichen Gesundheitsamt (en alemán). 2 : 372–420. Archivado desde el original el 23 de abril de 2017.
- ^ Wertheim HF, Horby P, Woodall JP (2012). Atlas de enfermedades infecciosas humanas (1.ª ed.). Nueva York, NY: John Wiley & Sons. ISBN 978-1-4443-5467-6.OCLC 897547171 .
- ^ "Epidemia de fiebre tifoidea en Maidstone". Journal of the Sanitary Institute . 18 : 388. Octubre de 1897.
- ^ "¿Un milagro para la salud pública?" . Consultado el 17 de diciembre de 2012 .
- ^ Leal JL (1909). "La planta de esterilización de la Jersey City Water Supply Company en Boonton, Nueva Jersey". Actas de la American Water Works Association . págs. 100–9.
- ^ Fuller GW (1909). "Descripción del proceso y la planta de la Jersey City Water Supply Company para la esterilización del agua del embalse de Boonton". Actas de la American Water Works Association . págs. 110–34.
- ^ Von Hoffman A (1996). Vinculaciones locales: la creación de un barrio urbano estadounidense, 1850 a 1920. Johns Hopkins University Press. OCLC 1036707621.
- ^ "Nova: La mujer más peligrosa de Estados Unidos". PBS . Archivado desde el original el 26 de abril de 2010.
- ^ Klein C. "10 cosas que quizás no sepas sobre 'María Tifoidea'". HISTORIA . Consultado el 28 de junio de 2021 .
- ^ abcdefgh Sears HJ, Garhart RW, Mack DW (octubre de 1924). "Una epidemia de fiebre tifoidea transmitida por la leche cuyo origen se remonta a un portador urinario". Revista estadounidense de salud pública . 14 (10): 848–54. doi :10.2105/ajph.14.10.848. PMC 1355026 . PMID 18011334.
- ^ abcd "Portadores de fiebre tifoidea y su tratamiento". Revista de la Asociación Médica Estadounidense . 100 (23): 1866. 1933-06-10. doi :10.1001/jama.1933.02740230044012. ISSN 0002-9955.
- ^ Stanaway JD, Reiner RC, Blacker BF, Goldberg EM, Khalil IA, Troeger CE, et al. (abril de 2019). "La carga mundial de fiebres tifoideas y paratifoideas: un análisis sistemático para el Estudio de la carga mundial de enfermedades 2017". The Lancet. Enfermedades infecciosas . 19 (4): 369–381. doi :10.1016/S1473-3099(18)30685-6. PMC 6437314 . PMID 30792131.
- ^ abcd "Manual de control de enfermedades transmisibles agudas (B-73): portador de fiebre tifoidea" (PDF) . Departamento de Salud Pública de Los Ángeles . Junio de 2018 . Consultado el 27 de junio de 2021 .
- ^ Prouty AM, Schwesinger WH, Gunn JS (mayo de 2002). "Formación de biopelículas e interacción con las superficies de los cálculos biliares por Salmonella spp". Infección e inmunidad . 70 (5): 2640–9. doi :10.1128/iai.70.5.2640-2649.2002. PMC 127943 . PMID 11953406.
- ^ ab Monack DM, Bouley DM, Falkow S (enero de 2004). "Salmonella typhimurium persiste dentro de los macrófagos en los ganglios linfáticos mesentéricos de ratones Nramp1+/+ infectados crónicamente y puede reactivarse mediante neutralización con IFNgamma". The Journal of Experimental Medicine . 199 (2): 231–41. doi :10.1084/jem.20031319. PMC 2211772 . PMID 14734525.
- ^ Lawley TD, Bouley DM, Hoy YE, Gerke C, Relman DA, Monack DM (enero de 2008). "La transmisión del hospedador de Salmonella enterica serovar Typhimurium está controlada por factores de virulencia y la microbiota intestinal autóctona". Infección e inmunidad . 76 (1): 403–16. doi :10.1128/iai.01189-07. PMC 2223630 . PMID 17967858.
- ^ "Sir Almroth Edward Wright". Encyclopædia Britannica . Archivado desde el original el 11 de noviembre de 2013.
- ^ Wright AE, Douglas SR (31 de enero de 1904). "Una investigación experimental del papel de los fluidos sanguíneos en relación con la fagocitosis". Actas de la Royal Society de Londres . 72 (477–486): 357–370. doi :10.1098/rspl.1903.0062. ISSN 0370-1662. S2CID 84388525.
- ^ "Catálogo de la Biblioteca y Archivo". Royal Society . Consultado el 1 de noviembre de 2010 .[ enlace muerto permanente ]
- ^ "Las lecciones médicas de la Primera Guerra Mundial subrayan la necesidad de seguir desarrollando medicamentos antimicrobianos". MinnPost . 2014-11-11. Archivado desde el original el 30 de enero de 2016 . Consultado el 8 de septiembre de 2017 .
- ^ USAMRMC: 50 años de dedicación al combatiente 1958–2008 (PDF) . Comando de Investigación y Material Médico del Ejército de los EE. UU. (2008). 2008. pág. 5. ASIN B003WYKJNY. Archivado desde el original (PDF) el 14 de febrero de 2013. Consultado el 27 de marzo de 2013 .
- ^ Felix A, Pitt RM (julio de 1934). "Un nuevo antígeno de B. Typhosus". The Lancet . 224 (5787): 186–191. doi :10.1016/S0140-6736(00)44360-6.
- ^ Craigie J (1 de noviembre de 1957). "Arthur Felix, 1887–1956". Memorias biográficas de miembros de la Royal Society . 3 : 53–79. doi :10.1098/rsbm.1957.0005. S2CID 72753150.
- ^ "Fiebre tifoidea". Centro de Enfermedades Infecciosas Emergentes y Reemergentes . Universidad de Washington. Archivado desde el original el 8 de diciembre de 2019. Consultado el 8 de diciembre de 2019 .
- ^ "FIEBRE TIFOIDEA O FIEBRE DE DRENAJE Y CÓMO PREVENIR SU PROPAGACIÓN". The Warwick Examiner and Times . 6 de abril de 1878 . Consultado el 13 de abril de 2020 .
- ^ Darby E (1983). El culto al príncipe consorte. Nicola Smith. New Haven: Yale University Press. ISBN 0-300-03015-0.OCLC 10432279 .
- ^ Matthew HC (septiembre de 2004). «Eduardo VII (1841–1910)». Oxford Dictionary of National Biography (edición en línea). Oxford University Press (publicado en mayo de 2006). doi :10.1093/ref:odnb/32975. Archivado desde el original el 2 de marzo de 2016. (Se requiere suscripción o membresía a una biblioteca pública del Reino Unido).
- ^ "Nicolás II - En la corte del último zar - Capítulo 1, Parte 2, La emperatriz Alejandra". www.alexanderpalace.org . Consultado el 21 de junio de 2021 .
- ^ "Hoogleraar heeft aanwijzingen voor abortus bij Wilhelmina: 'Monarchie hing aan zijden draadje' (El profesor tiene indicación de aborto Wilhelmina: la monarquía pendía de un hilo)". RTL Nieuws (en holandés). 2023-04-19.
- ^ Trudy Dehue. "Ovo-feto-bebé: una nueva historia del embarazo". Fundación Holandesa para la Literatura . Archivado desde el original el 2024-03-17 . Consultado el 2023-12-06 .
- ^ Dennis B (29 de septiembre de 2011). «La muerte de Willie Lincoln: una agonía privada para un presidente que enfrenta una nación de dolor». The Washington Post . ISSN 0190-8286. Archivado desde el original el 1 de abril de 2017. Consultado el 12 de marzo de 2017 .
- ^ "Maldiçãp, febre e alucinações: a melancólica morte de Leopoldina de Bragança". aventurasnahistoria.uol.com.br . 7 de junio de 2020 . Consultado el 3 de febrero de 2022 .
- ^ "Una historia de Stanford". Universidad de Stanford . Consultado el 4 de julio de 2018 .
- ^ Ruggles E (1944). Gerard Manley Hopkins: Una vida . Norton.
- ^ Scott BF (23 de septiembre de 1910). «Scott, Henry James Herbert (1858–1910)». Diccionario australiano de biografías: Henry James Herbert Scott. Centro Nacional de Biografías, Universidad Nacional de Australia. Archivado desde el original el 21 de febrero de 2011.
- ^ "Paja para el silencio". The Spectator . Vol. 203. FC Westley. 1959. ISSN 0038-6952. OCLC 1766325.
- ^ Hakaru Hashimoto#Biografía
Lectura adicional
- Adler R ME (2016). Fiebre tifoidea: una historia . Jefferson, Carolina del Norte: McFarland & Company Inc. ISBN 978-0-7864-9781-2.
- Centros para el Control y la Prevención de Enfermedades (30 de marzo de 2021). «Fiebre tifoidea y paratifoidea: información para profesionales de la salud» . Consultado el 27 de junio de 2021 .
- Colaboradores de GBD 2017 sobre fiebre tifoidea y paratifoidea (abril de 2019). "La carga mundial de fiebre tifoidea y paratifoidea: un análisis sistemático para el Estudio de la carga mundial de enfermedad 2017". The Lancet Infectious Diseases . 19 (4): 369–381. doi :10.1016/S1473-3099(18)30685-6. PMC 6437314 . PMID 30792131.
- Servicio Nacional de Salud (18 de junio de 2018). «Fiebre tifoidea: descripción general» . Consultado el 27 de junio de 2021 .
- Agencia de Salud Pública de Canadá (2010). «Fichas de datos de seguridad de patógenos: sustancias infecciosas – Salmonella enterica spp.» . Consultado el 28 de junio de 2021 .
- Fiebre tifoidea: hoja informativa. 31 de enero de 2018. Consultado el 27 de junio de 2021 .