Resistencia a los medicamentos
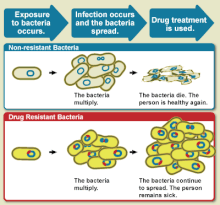
La resistencia a los medicamentos es la reducción de la eficacia de un medicamento, como un antimicrobiano o un antineoplásico, para tratar una enfermedad o afección. [1] El término se utiliza en el contexto de la resistencia que los patógenos o los cánceres han "adquirido", es decir, la resistencia ha evolucionado. La resistencia a los antimicrobianos y a los antineoplásicos suponen un reto para la atención clínica e impulsan la investigación. Cuando un organismo es resistente a más de un fármaco, se dice que es multirresistente .
El desarrollo de la resistencia a los antibióticos se debe, en particular, a que los fármacos actúan únicamente sobre moléculas bacterianas específicas (casi siempre proteínas). Como el fármaco es tan específico, cualquier mutación en estas moléculas interferirá con su efecto destructivo o lo anulará, lo que dará lugar a la resistencia a los antibióticos. [2] Además, existe una creciente preocupación por el abuso de antibióticos en la ganadería, que sólo en la Unión Europea representa el triple del volumen dispensado a los seres humanos, lo que conduce al desarrollo de bacterias superresistentes. [3] [4]
Las bacterias son capaces no solo de alterar la enzima a la que se dirigen los antibióticos, sino también de utilizar enzimas para modificar el antibiótico en sí y, por lo tanto, neutralizarlo. Algunos ejemplos de patógenos que alteran la enzima diana son Staphylococcus aureus , enterococos resistentes a la vancomicina y Streptococcus resistente a los macrólidos , mientras que algunos ejemplos de microbios modificadores de antibióticos son Pseudomonas aeruginosa y Acinetobacter baumannii resistente a los aminoglucósidos . [5]
En resumen, la falta de un esfuerzo concertado por parte de los gobiernos y la industria farmacéutica, junto con la capacidad innata de los microbios para desarrollar resistencia a un ritmo que supera el desarrollo de nuevos medicamentos, sugiere que las estrategias existentes para desarrollar terapias antimicrobianas viables y de largo plazo están condenadas al fracaso. Sin estrategias alternativas, la adquisición de resistencia a los medicamentos por parte de microorganismos patógenos se perfila como una de las amenazas más importantes para la salud pública que enfrenta la humanidad en el siglo XXI. [6] Algunas de las mejores fuentes alternativas para reducir la posibilidad de resistencia a los antibióticos son los probióticos, los prebióticos, las fibras dietéticas, las enzimas, los ácidos orgánicos y los fitogénicos. [7] [8]
Tipos
La resistencia a los fármacos, toxinas o sustancias químicas es una consecuencia de la evolución y es una respuesta a las presiones impuestas a cualquier organismo vivo. Los organismos individuales varían en su sensibilidad al fármaco utilizado y algunos con mayor aptitud pueden ser capaces de sobrevivir al tratamiento farmacológico. En consecuencia, los rasgos de resistencia a los fármacos se heredan por los descendientes posteriores, lo que da como resultado una población que es más resistente a los fármacos. A menos que el fármaco utilizado haga imposible la reproducción sexual o la división celular o la transferencia horizontal de genes en toda la población objetivo, inevitablemente se producirá resistencia al fármaco. Esto se puede ver en tumores cancerosos donde algunas células pueden desarrollar resistencia a los fármacos utilizados en la quimioterapia . [9] La quimioterapia hace que los fibroblastos cercanos a los tumores produzcan grandes cantidades de la proteína WNT16 B. Esta proteína estimula el crecimiento de células cancerosas que son resistentes a los fármacos. [10] También se ha demostrado que los microARN afectan a la resistencia a los fármacos adquirida en las células cancerosas y esto se puede utilizar con fines terapéuticos. [11] La malaria en 2012 se ha convertido en una amenaza resurgente en el sudeste asiático y el África subsahariana , y las cepas de Plasmodium falciparum resistentes a los medicamentos están planteando enormes problemas para las autoridades sanitarias. [12] [13] La lepra ha mostrado una resistencia creciente a la dapsona .
Existe un proceso rápido de intercambio de resistencia entre organismos unicelulares , denominado transferencia horizontal de genes, en el que hay un intercambio directo de genes, particularmente en el estado de biopelícula . [14] Los hongos utilizan un método asexual similar , denominado " parasexualidad ". Se pueden encontrar ejemplos de cepas resistentes a los fármacos en microorganismos [15] como bacterias y virus, parásitos tanto endo- como ecto- , plantas, hongos, artrópodos , [16] [17] mamíferos, [18] aves, [19] reptiles, [20] peces y anfibios. [20]
En el entorno doméstico, pueden surgir cepas de organismos resistentes a los medicamentos a partir de actividades aparentemente seguras como el uso de cloro , [21] cepillado de dientes y enjuague bucal, [22] el uso de antibióticos, desinfectantes y detergentes, champús y jabones, particularmente jabones antibacterianos, [23] [24] lavado de manos, [25] aerosoles de superficies, aplicación de desodorantes , bloqueadores solares y cualquier producto cosmético o de cuidado de la salud, insecticidas y baños. [26] Los químicos contenidos en estas preparaciones, además de dañar a los organismos beneficiosos, pueden dirigirse intencional o inadvertidamente a organismos que tienen el potencial de desarrollar resistencia. [27]
Mecanismos
Los cuatro mecanismos principales por los cuales los microorganismos exhiben resistencia a los antimicrobianos son: [28] [29]
- Inactivación o modificación de fármacos: por ejemplo, desactivación enzimática de la penicilina G en algunas bacterias resistentes a la penicilina mediante la producción de β-lactamasas .
- Alteración del sitio diana: por ejemplo, alteración de PBP (el sitio diana de unión de las penicilinas) en SAMR y otras bacterias resistentes a la penicilina.
- Alteración de la vía metabólica: por ejemplo, algunas bacterias resistentes a las sulfamidas no requieren ácido paraaminobenzoico (PABA), un precursor importante para la síntesis de ácido fólico y ácidos nucleicos en bacterias inhibidas por las sulfamidas. En cambio, al igual que las células de los mamíferos, recurren a la utilización de ácido fólico preformado.
- Reducción de la acumulación de fármacos: disminuyendo la permeabilidad del fármaco y/o aumentando el eflujo activo (bombeo) de los fármacos a través de la superficie celular.
Mecanismos de resistencia adquirida a los fármacos
[30] [31]
| Mecanismo | Agente antimicrobiano | Acción de los fármacos | Mecanismo de resistencia |
|---|---|---|---|
| Destruir la droga | Aminoglucósido Antibióticos betalactámicos (penicilina y cefalosporina) Cloranfenicol | Se une a la subunidad 30S del ribosoma, inhibiendo la síntesis de proteínas. Se une a las proteínas que se unen a la penicilina, inhibiendo la síntesis de peptidoglicano. Se une a la subunidad 50S del ribosoma, inhibiendo la formación de enlaces peptídicos. | Los plásmidos codifican enzimas que alteran químicamente el fármaco (por ejemplo, mediante acetilación o fosforilación), inactivándolo así. El plásmido codifica la beta-lactamasa, que abre el anillo beta-lactámico, inactivándolo. El plásmido codifica una enzima que acetila el fármaco, inactivándolo así. |
| Altera el objetivo del fármaco | Aminoglucósidos Antibióticos betalactámicos (penicilina y cefalosporina) Eritromicina Quinolonas Rifampicina Trimetoprima | Se une a la subunidad 30S del ribosoma, inhibiendo la síntesis de proteínas. Se une a las proteínas que se unen a la penicilina, inhibiendo la síntesis de peptidoglicano. Se une a la subunidad 50S del ribosoma, inhibiendo la síntesis de proteínas. Se une a la ADN topoisomerasa, una enzima esencial para la síntesis de ADN. Se une a la ARN polimerasa; inhibiendo el inicio de la síntesis de ARN. Inhibe la enzima dihidrofolato reduce, bloqueando la vía del ácido fólico | Las bacterias producen ribosomas 30S alterados que no se unen al fármaco. Las bacterias producen proteínas de unión a la penicilina alteradas, que no se unen al fármaco. Las bacterias producen una forma de ribosoma 50S que no se une al fármaco. Las bacterias producen una topoisomerasa de ADN alterada que no se une al fármaco. Las bacterias producen una polimerasa alterada que no se une al fármaco. Las bacterias producen una enzima alterada que no se une al fármaco. |
| Inhibe la entrada del fármaco o lo elimina. | Penicilina Eritromicina Tetraciclina | Se une a las proteínas que se unen a la penicilina, inhibiendo la síntesis de peptidoglicano. Se une a la subunidad 50S del ribosoma, inhibiendo la síntesis de proteínas. Se une a la subunidad 30S del ribosoma e inhibe la síntesis de proteínas al bloquear el ARNt. | Las bacterias cambian la forma de las proteínas porinas de la membrana externa, impidiendo que el fármaco entre en la célula. Nuevo sistema de transporte de membrana evita que el fármaco entre en la célula. Un nuevo sistema de transporte de membrana bombea el fármaco fuera de la célula. |
Costo metabólico
El costo biológico es una medida del aumento del metabolismo energético necesario para lograr una función. [32]
La resistencia a los fármacos tiene un alto coste metabólico en los patógenos [32] para los que este concepto es relevante (bacterias, [33] endoparásitos y células tumorales). En los virus, un "costo" equivalente es la complejidad genómica. El alto coste metabólico significa que, en ausencia de antibióticos, un patógeno resistente tendrá una menor aptitud evolutiva en comparación con los patógenos susceptibles. [34] Esta es una de las razones por las que las adaptaciones de resistencia a los fármacos rara vez se observan en entornos donde no hay antibióticos. Sin embargo, en presencia de antibióticos, la ventaja de supervivencia conferida compensa el alto coste metabólico y permite que las cepas resistentes proliferen. [ cita requerida ]
Tratamiento
En los seres humanos, el gen ABCB1 codifica la MDR1 (p-glicoproteína), que es un transportador clave de medicamentos a nivel celular. Si la MDR1 se sobreexpresa, aumenta la resistencia a los medicamentos. [35] Por lo tanto, se pueden controlar los niveles de ABCB1. [35] En pacientes con altos niveles de expresión de ABCB1, se han utilizado tratamientos secundarios, como la metformina, junto con el tratamiento farmacológico primario con cierto éxito. [35]
Para la resistencia a los antibióticos , que representa un problema generalizado en la actualidad, se utilizan medicamentos diseñados para bloquear los mecanismos de resistencia bacteriana a los antibióticos. Por ejemplo, la resistencia bacteriana contra los antibióticos betalactámicos (como la penicilina y las cefalosporinas ) se puede evitar utilizando antibióticos como la nafcilina que no son susceptibles a la destrucción por ciertas betalactamasas (el grupo de enzimas responsables de descomponer las betalactamasas). [36] La resistencia bacteriana a las betalactamasas también se puede tratar administrando antibióticos betalactámicos con medicamentos que bloqueen las betalactamasas como el ácido clavulánico para que los antibióticos puedan funcionar sin ser destruidos primero por las bacterias. [37] Los investigadores han reconocido la necesidad de nuevos medicamentos que inhiban las bombas de eflujo bacterianas , que causan resistencia a múltiples antibióticos como las betalactamasas , las quinolonas , el cloranfenicol y la trimetoprima al enviar moléculas de esos antibióticos fuera de la célula bacteriana. [38] [39] A veces se puede utilizar una combinación de diferentes clases de antibióticos de forma sinérgica, es decir, trabajan juntos para combatir eficazmente las bacterias que pueden ser resistentes a uno de los antibióticos por sí solo. [40]
La destrucción de las bacterias resistentes también se puede lograr mediante terapia de fagos , en la que se utiliza un bacteriófago específico (virus que mata bacterias). [41]
Véase también
- Resistencia a los antibióticos
- Bacterioterapia fecal
- Administración masiva de medicamentos
- Resistencia a múltiples fármacos
- Farmacoepidemiología
- Factores físicos que afectan la vida microbiana
- Proteína pequeña resistente a múltiples fármacos
- Eleftheria terrae
Referencias
- ^ Alfarouk, KO; Stock, CM; Taylor, S; Walsh, M; Muddathir, AK; Verduzco, D; Bashir, AH; Mohammed, OY; Elhassan, GO; Harguindey, S; Reshkin, SJ; Ibrahim, ME; Rauch, C (2015). "Resistencia a la quimioterapia contra el cáncer: fracaso en la respuesta farmacológica de ADME a P-gp". Cancer Cell International . 15 : 71. doi : 10.1186/s12935-015-0221-1 . PMC 4502609 . PMID 26180516.
- ^ "Resistencia a los antibióticos y evolución". detectingdesign.com . [ verificación necesaria ]
- ^ Harvey, Fiona (16 de octubre de 2016). «El uso de los antibióticos más potentes alcanza niveles récord en las granjas europeas». The Guardian . Consultado el 1 de octubre de 2018 . [ verificación necesaria ]
- ^ Duckenfield, Joan (30 de diciembre de 2011). "Resistencia a los antibióticos debido a las prácticas agrícolas modernas: una perspectiva ética". Revista de ética agrícola y medioambiental . 26 (2): 333–350. doi :10.1007/s10806-011-9370-y. ISSN 1187-7863. S2CID 55736918. [ verificación necesaria ]
- ^ Fisher, Jed F.; Mobashery, Shahriar (2010). "Enzimología de la resistencia bacteriana". Productos naturales integrales II. Volumen 8: Enzimas y mecanismos enzimáticos . Elsevier. págs. 443–201. doi :10.1016/B978-008045382-8.00161-1. ISBN 978-0-08-045382-8. [ verificación necesaria ]
- ^ Instituto de Medicina (EE. UU.) Foro sobre infecciones emergentes; Knobler, SL; Lemon, SM; Najafi, M.; Burroughs, T. (2003). "Resumen y evaluación". Lectura: El fenómeno de resistencia en microbios y vectores de enfermedades infecciosas: implicaciones para la salud humana y estrategias de contención -- Resumen del taller - The National Academies Press. doi :10.17226/10651. ISBN 978-0-309-08854-1. Número de identificación personal 22649806. [ verificación necesaria ]
- ^ Jha, Rajesh; Das, Razib; Oak, Sophia; Mishra, Pravin (2020). "Probióticos (microbios de alimentación directa) en la nutrición avícola y sus efectos en la utilización de nutrientes, el crecimiento y el rendimiento de la postura, y la salud intestinal: una revisión sistemática". Animales . 10 (10): 1863. doi : 10.3390/ani10101863 . PMC 7602066 . PMID 33066185.
- ^ Jha, Rajesh; Mishra, Pravin (19 de abril de 2021). "Fibra dietética en la nutrición avícola y sus efectos en la utilización de nutrientes, el rendimiento, la salud intestinal y el medio ambiente: una revisión". Revista de ciencia y biotecnología animal . 12 (1): 51. doi : 10.1186/s40104-021-00576-0 . ISSN 2049-1891. PMC 8054369 . PMID 33866972.
- ^ "Tolerancia y resistencia a los fármacos". Manual Merck, versión para el consumidor .
- ^ "La quimioterapia se 'socava' a sí misma mediante una respuesta descontrolada", BBC News , 5 de agosto de 2012.
- ^ Ghasabi M, Mansoori B, Mohammadi A, Duijf PH, Shomali N, Shirafkan N, Mokhtarzadeh A, Baradaran B (2019). "MicroARN en la resistencia a los fármacos contra el cáncer: evidencia básica y aplicaciones clínicas". Journal of Cellular Physiology . x (3): 2152–2168. doi :10.1002/jcp.26810. PMID 30146724. S2CID 52092652.
- ^ McGrath, Matt (5 de abril de 2012). "La resistencia se ha extendido y la lucha contra la malaria es 'comprometida'". BBC News .
- ^ Morelle R (20 de octubre de 2015). «La malaria resistente a los medicamentos puede infectar a los mosquitos africanos». BBC News . Consultado el 21 de octubre de 2015 .
- ^ Molin S, Tolker-Nielsen T (junio de 2003). "La transferencia de genes se produce con mayor eficiencia en las biopelículas e induce una mayor estabilización de la estructura de la biopelícula". Current Opinion in Biotechnology . 14 (3): 255–61. doi :10.1016/S0958-1669(03)00036-3. PMID 12849777.
- ^ "Mecanismos de acción y resistencia a los fármacos". tulane.edu .
- ^ Brun LO, Wilson JT, Daynes P (marzo de 1983). "Resistencia al etión en la garrapata del ganado (Boophilus microplus) en Nueva Caledonia" (PDF) . Revista internacional de gestión de plagas . 29 (1): 16–22. doi :10.1080/09670878309370763.
- ^ "Artículo de revisión sobre la resistencia del escarabajo de la patata a los insecticidas". potatoesbeetle.org . Consultado el 1 de octubre de 2018 .
- ^ Lund M (1972). "Resistencia de los roedores a los rodenticidas anticoagulantes, con especial referencia a Dinamarca". Boletín de la Organización Mundial de la Salud . 47 (5): 611–8. PMC 2480843 . PMID 4540680.
- ^ Shefte N, Bruggers RL, Schafer EW (abril de 1982). "Repelencia y toxicidad de tres productos químicos para el control de aves en cuatro especies de aves africanas que se alimentan de granos". The Journal of Wildlife Management . 46 (2): 453–7. doi :10.2307/3808656. JSTOR 3808656.
- ^ ab "Reptiles Magazine, su fuente de artículos sobre el cuidado y la crianza de reptiles y herpetos, y artículos para aficionados". reptilechannel.com . Archivado desde el original el 3 de enero de 2011.
- ^ "Cómo funciona el blanqueador doméstico para matar las bacterias". physorg.com .
- ^ "Compete50 Los productos completos para el cuidado bucal". Archivado desde el original el 2010-04-03 . Consultado el 2010-07-18 .
- ^ "La verdad sobre la limpieza: jabón antibacteriano frente a jabón normal". CBC News . Archivado desde el original el 6 de agosto de 2011.
- ^ "¿Debería prohibirse el jabón antibacteriano?". HowStuffWorks . 2007-11-07.
- ^ Weber DJ, Rutala WA (octubre de 2006). "Uso de germicidas en el hogar y en el ámbito sanitario: ¿existe una relación entre el uso de germicidas y la resistencia a los antibióticos?". Control de infecciones y epidemiología hospitalaria . 27 (10): 1107–19. doi :10.1086/507964. PMID 17006819. S2CID 20734025.
- ^ Yoon KS, Kwon DH, Strycharz JP, Hollingsworth CS, Lee SH, Clark JM (noviembre de 2008). "Análisis bioquímico y molecular de la resistencia a la deltametrina en la chinche de cama común (Hemiptera: Cimicidae)". Journal of Medical Entomology . 45 (6): 1092–101. doi :10.1603/0022-2585(2008)45[1092:BAMAOD]2.0.CO;2. PMID 19058634. S2CID 27422270.
- ^ "Productos de limpieza antibacterianos". Departamento de Salud y Servicios Humanos de Australia. Archivado desde el original el 4 de marzo de 2015. Consultado el 1 de octubre de 2018 .
- ^ Li XZ, Nikaido H (agosto de 2009). "Resistencia a fármacos mediada por eflujo en bacterias: una actualización". Drugs . 69 (12): 1555–623. doi :10.2165/11317030-000000000-00000. PMC 2847397 . PMID 19678712.
- ^ Sandhu P, Akhter Y (enero de 2018). "Evolución de la aptitud estructural y aspectos multifuncionales de los transportadores de la familia RND micobacteriana". Archivos de Microbiología . 200 (1): 19–31. doi :10.1007/s00203-017-1434-6. PMID 28951954. S2CID 13656026.
- ^ Catherine A. Ingraham, John L. Ingraham (2000). Introducción a la microbiología, segunda edición .
- ^ Catherine A. Ingraham, John L. Ingraham (2000). Introducción a la microbiología .
- ^ ab Gillespie SH, McHugh TD (septiembre de 1997). "El coste biológico de la resistencia a los antimicrobianos". Trends Microbiol . 5 (9): 337–9. doi :10.1016/S0966-842X(97)01101-3. PMID 9294886.
- ^ Wichelhaus TA, Böddinghaus B, Besier S, Schäfer V, Brade V, Ludwig A (noviembre de 2002). "Costo biológico de la resistencia a la rifampicina desde la perspectiva de Staphylococcus aureus". Agentes antimicrobianos y quimioterapia . 46 (11): 3381–5. doi :10.1128/AAC.46.11.3381-3385.2002. PMC 128759. PMID 12384339 .
- ^ Händel, Nadine; Schuurmans, J. Merijn; Brul, Stanley; ter Kuile, Benno H. (agosto de 2013). "Compensación de los costos metabólicos de la resistencia a los antibióticos mediante adaptación fisiológica en Escherichia coli". Agentes antimicrobianos y quimioterapia . 57 (8): 3752–3762. doi :10.1128/AAC.02096-12. ISSN 0066-4804. PMC 3719774 . PMID 23716056.
- ^ abc Ramos-Peñafiel C, Olarte-Carrillo I, Cerón-Maldonado R, Rozen-Fuller E, Kassack-Ipiña JJ, Meléndez-Mier G, Collazo-Jaloma J, Martínez-Tovar A (septiembre de 2018). "Efecto de la metformina sobre la supervivencia de pacientes con LLA que expresan altos niveles del gen de resistencia al fármaco ABCB1". Revista de medicina traslacional . 16 (1): 245. doi : 10.1186/s12967-018-1620-6 . PMC 6122769 . PMID 30176891.
- ^ Barber M, Waterworth PM (agosto de 1964). "Penicilinas y cefalosporinas resistentes a la penicilinasa". British Medical Journal . 2 (5405): 344–9. doi :10.1136/bmj.2.5405.344. PMC 1816326 . PMID 14160224.
- ^ Bush K (enero de 1988). "Inhibidores de beta-lactamasa del laboratorio a la clínica". Clinical Microbiology Reviews . 1 (1): 109–23. doi :10.1128/CMR.1.1.109. PMC 358033 . PMID 3060240.
- ^ Webber MA, Piddock LJ (enero de 2003). "La importancia de las bombas de eflujo en la resistencia bacteriana a los antibióticos". The Journal of Antimicrobial Chemotherapy . 51 (1): 9–11. doi : 10.1093/jac/dkg050 . PMID 12493781.
- ^ Tegos GP, Haynes M, Strouse JJ, Khan MM, Bologa CG, Oprea TI, Sklar LA (2011). "Inhibición de la bomba de eflujo microbiano: tácticas y estrategias". Current Pharmaceutical Design . 17 (13): 1291–302. doi :10.2174/138161211795703726. PMC 3717411 . PMID 21470111.
- ^ Glew RH, Millering RS, Wennersten C (junio de 1975). "Actividad sinérgica comparativa de nafcilina, oxacilina y meticilina en combinación con gentamicina contra". Agentes antimicrobianos y quimioterapia . 7 (6): 828–32. doi :10.1128/aac.7.6.828. PMC 429234. PMID 1155924 .
- ^ Lin, Derek M; Koskella, Britt; Lin, Henry C (2017). "Terapia con fagos: una alternativa a los antibióticos en la era de la resistencia a múltiples fármacos". Revista mundial de farmacología y terapéutica gastrointestinal . 8 (3): 162–173. doi : 10.4292/wjgpt.v8.i3.162 . ISSN 2150-5349. PMC 5547374 . PMID 28828194.
Enlaces externos
- CARGA de la resistencia y la enfermedad en las naciones europeas: un proyecto de la UE para estimar la carga financiera de la resistencia a los antibióticos en los hospitales europeos
- Merck - Tolerancia y resistencia
- Base de datos de cosméticos
- Herramienta para detectar mutaciones de resistencia a fármacos del virus de la hepatitis C (HCMV)
- La lucha contra la resistencia a los medicamentos: un artículo informativo sobre la resistencia a múltiples fármacos
- La batalla contra los microbios: la lucha contra la resistencia a los antibióticos
- MDRIpred: un servidor web para predecir inhibidores contra M. tuberculosis tolerante a fármacos, publicado en Chemistry Central Journal
- CancerDR: Base de datos sobre resistencia a fármacos contra el cáncer. Scientific Reports 3, 1445