Biopelícula
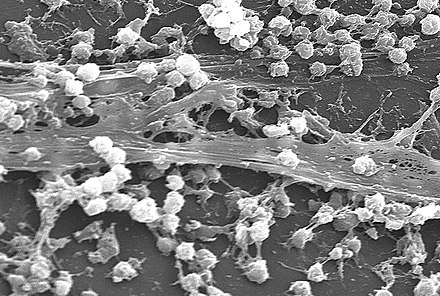

Agregado de microorganismos en el que las células, frecuentemente incrustadas dentro de una matriz autoproducida de sustancias poliméricas extracelulares (SPE), se adhieren entre sí y/o a una superficie.
- Una biopelícula es un sistema que puede adaptarse internamente a las condiciones ambientales por parte de sus habitantes.
- La matriz autoproducida de sustancias poliméricas extracelulares , también denominada limo, es un conglomerado polimérico generalmente compuesto de biopolímeros extracelulares en diversas formas estructurales. [1]
Una biopelícula es una comunidad sintrófica de microorganismos en la que las células se adhieren entre sí y, a menudo, también a una superficie. [2] [3] Estas células adherentes se incrustan dentro de una matriz extracelular viscosa que está compuesta de sustancias poliméricas extracelulares (EPS). [2] [3] Las células dentro de la biopelícula producen los componentes de EPS, que son típicamente una combinación polimérica de polisacáridos extracelulares , proteínas , lípidos y ADN . [2] [3] [4] Debido a que tienen una estructura tridimensional y representan un estilo de vida comunitario para los microorganismos, se han descrito metafóricamente como "ciudades para microbios". [5] [6]
Las biopelículas pueden formarse en superficies vivas (bióticas) o no vivas (abióticas) y pueden ser comunes en entornos naturales, industriales y hospitalarios. [3] [7] Pueden constituir un microbioma o ser una parte de él. Las células microbianas que crecen en una biopelícula son fisiológicamente distintas de las células planctónicas del mismo organismo, que, por el contrario, son células individuales que pueden flotar o nadar en un medio líquido. [8] Las biopelículas pueden formarse en los dientes de la mayoría de los animales como placa dental , donde pueden causar caries y enfermedades de las encías .
Los microbios forman una biopelícula en respuesta a una serie de factores diferentes, [9] que pueden incluir el reconocimiento celular de sitios de unión específicos o no específicos en una superficie, señales nutricionales o, en algunos casos, por la exposición de células planctónicas a concentraciones subinhibitorias de antibióticos . [10] [11] Una célula que cambia al modo de crecimiento de biopelícula experimenta un cambio fenotípico en el comportamiento en el que grandes conjuntos de genes se regulan de manera diferencial . [12]
Una biopelícula también puede considerarse un hidrogel , que es un polímero complejo que contiene muchas veces su peso seco en agua. Las biopelículas no son solo capas de limo bacteriano sino sistemas biológicos; las bacterias se organizan en una comunidad funcional coordinada. Las biopelículas pueden adherirse a una superficie como un diente o una roca, y pueden incluir una sola especie o un grupo diverso de microorganismos. Las subpoblaciones de células dentro de la biopelícula se diferencian para realizar varias actividades para la motilidad, la producción de matriz y la esporulación, lo que respalda el éxito general de la biopelícula. [13] Las bacterias de la biopelícula pueden compartir nutrientes y están protegidas de factores dañinos en el medio ambiente, como la desecación, los antibióticos y el sistema inmunológico del cuerpo del huésped. Una biopelícula generalmente comienza a formarse cuando una bacteria planctónica que nada libremente se adhiere a una superficie. [14] [ página necesaria ]
Origen y formación
Origen de las biopelículas
Se cree que las biopelículas surgieron durante la Tierra primitiva como un mecanismo de defensa para los procariotas, ya que las condiciones en ese momento eran demasiado duras para su supervivencia. Se pueden encontrar muy temprano en los registros fósiles de la Tierra (hace unos 3.250 millones de años) tanto como arqueas como bacterias, y comúnmente protegen a las células procariotas proporcionándoles homeostasis, lo que fomenta el desarrollo de interacciones complejas entre las células de la biopelícula. [3]
Formación de biopelículas
La formación de una biopelícula comienza con la unión de microorganismos que flotan libremente a una superficie. [8] [5] Las primeras bacterias colonizadoras de una biopelícula pueden adherirse a la superficie inicialmente por las débiles fuerzas de van der Waals y los efectos hidrofóbicos. [15] [16] Si los colonos no se separan inmediatamente de la superficie, pueden anclarse de forma más permanente utilizando estructuras de adhesión celular como pili . Un grupo único de Archaea que habitan aguas subterráneas anóxicas tiene estructuras similares llamadas hami . Cada hamus es un tubo largo con tres accesorios de gancho que se utilizan para unirse entre sí o a una superficie, lo que permite que se desarrolle una comunidad. [17] [18] La arqueona hipertermófila Pyrobaculum calidifontis produce pili agrupados que son homólogos a los filamentos bacterianos TasA, un componente principal de la matriz extracelular en las biopelículas bacterianas, que contribuyen a la estabilidad de la biopelícula. [19] Los homólogos de TasA están codificados por muchas otras arqueas, lo que sugiere similitudes mecanísticas y una conexión evolutiva entre las biopelículas bacterianas y arqueales. [19]

La hidrofobicidad también puede afectar la capacidad de las bacterias para formar biopelículas. Las bacterias con mayor hidrofobicidad tienen una repulsión reducida entre el sustrato y la bacteria. [21] Algunas especies de bacterias no pueden adherirse a una superficie por sí solas con éxito debido a su movilidad limitada, pero sí pueden anclarse a la matriz o directamente a otras bacterias colonizadoras anteriores. Las bacterias inmóviles no pueden reconocer superficies ni agregarse entre sí con tanta facilidad como las bacterias móviles. [21]
Durante la colonización de la superficie, las células bacterianas pueden comunicarse mediante productos de detección de quórum (QS), como la N-acil homoserina lactona (AHL). Una vez que ha comenzado la colonización, la biopelícula crece mediante una combinación de división celular y reclutamiento. Las matrices de polisacáridos suelen envolver las biopelículas bacterianas. Los exopolisacáridos de la matriz pueden atrapar autoinductores de QS dentro de la biopelícula para evitar la detección de depredadores y garantizar la supervivencia bacteriana. [22] Además de los polisacáridos, estas matrices también pueden contener material del entorno circundante, incluidos, entre otros, minerales, partículas de suelo y componentes sanguíneos, como eritrocitos y fibrina. [21] La etapa final de la formación de la biopelícula se conoce como desarrollo, y es la etapa en la que se establece la biopelícula y solo puede cambiar de forma y tamaño. [ cita requerida ]
El desarrollo de una biopelícula puede permitir que una colonia (o colonias) de células agregadas sean cada vez más tolerantes [23] o resistentes a los antibióticos . Se ha demostrado que la comunicación entre células o la detección de quórum intervienen en la formación de biopelículas en varias especies bacterianas. [24]
Desarrollo

Las biopelículas son el producto de un proceso de desarrollo microbiano . [27] El proceso se resume en cinco etapas principales de desarrollo de la biopelícula, como se muestra en el diagrama siguiente: [28]

Dispersión
La dispersión de células de la colonia de biopelículas es una etapa esencial del ciclo de vida de la biopelícula. La dispersión permite que las biopelículas se propaguen y colonicen nuevas superficies. Las enzimas que degradan la matriz extracelular de la biopelícula, como la dispersina B y la desoxirribonucleasa , pueden contribuir a la dispersión de la biopelícula. [29] [30] Las enzimas que degradan la matriz de la biopelícula pueden ser útiles como agentes anti-biopelícula. [31] [32] La evidencia ha demostrado que un mensajero de ácidos grasos, el ácido cis -2-decenoico , es capaz de inducir la dispersión e inhibir el crecimiento de colonias de biopelículas. Secretado por Pseudomonas aeruginosa , este compuesto induce células cicloheteromórficas en varias especies de bacterias y la levadura Candida albicans . [33] También se ha demostrado que el óxido nítrico desencadena la dispersión de biopelículas de varias especies de bacterias [34] [35] en concentraciones subtóxicas. El óxido nítrico tiene potencial como tratamiento para pacientes que tienen infecciones crónicas causadas por biopelículas. [36]
En general, se suponía que las células dispersadas de las biopelículas pasan inmediatamente a la fase de crecimiento planctónico. Sin embargo, los estudios han demostrado que la fisiología de las células dispersas de las biopelículas de Pseudomonas aeruginosa es muy diferente de la de las células planctónicas y de la biopelícula. [37] [38] Por lo tanto, el proceso de dispersión es una etapa única durante la transición de la biopelícula al estilo de vida planctónico en las bacterias. Se ha descubierto que las células dispersas son altamente virulentas contra los macrófagos y Caenorhabditis elegans , pero muy sensibles al estrés por hierro, en comparación con las células planctónicas. [37]
Además, las biopelículas de Pseudomonas aeruginosa experimentan dinámicas espaciotemporales distintas durante la dispersión o desmontaje de la biopelícula, con consecuencias contrastantes en la recolonización y la diseminación de enfermedades. [39] La dispersión de la biopelícula indujo a las bacterias a activar genes de dispersión para salir activamente de las biopelículas como células individuales a velocidades constantes, pero no pudieron recolonizar superficies frescas. Por el contrario, el desmontaje de la biopelícula por degradación de un exopolisacárido de la biopelícula liberó agregados inmóviles a altas velocidades iniciales, lo que permitió a las bacterias recolonizar superficies frescas y causar infecciones en los huéspedes de manera eficiente. Por lo tanto, la dispersión de la biopelícula es más compleja de lo que se pensaba anteriormente, donde las poblaciones bacterianas que adoptan un comportamiento distinto después de la salida de la biopelícula pueden ser la clave para la supervivencia de las especies bacterianas y la diseminación de enfermedades.

Propiedades
Las biopelículas se encuentran generalmente en sustratos sólidos sumergidos o expuestos a una solución acuosa , aunque pueden formarse como esteras flotantes en superficies líquidas y también en la superficie de las hojas, particularmente en climas de alta humedad. Si se le proporcionan suficientes recursos para crecer, una biopelícula crecerá rápidamente hasta volverse macroscópica (visible a simple vista). Las biopelículas pueden contener muchos tipos diferentes de microorganismos, por ejemplo, bacterias, arqueas , protozoos , hongos y algas ; cada grupo realiza funciones metabólicas especializadas . Sin embargo, algunos organismos formarán películas de una sola especie en determinadas condiciones. La estructura social (cooperación/competencia) dentro de una biopelícula depende en gran medida de las diferentes especies presentes. [40]
Matriz extracelular

La matriz EPS está formada por exopolisacáridos , proteínas y ácidos nucleicos. [41] [42] [43] Una gran proporción de los EPS está más o menos fuertemente hidratada, sin embargo, también se producen EPS hidrófobos; un ejemplo es la celulosa [44] que es producida por una variedad de microorganismos. Esta matriz encierra las células en su interior y facilita la comunicación entre ellas a través de señales bioquímicas, así como el intercambio de genes. La matriz EPS también atrapa enzimas extracelulares y las mantiene cerca de las células. Por lo tanto, la matriz representa un sistema de digestión externo y permite microconsorcios sinérgicos estables de diferentes especies. [45] Se ha descubierto que algunas biopelículas contienen canales de agua que ayudan a distribuir nutrientes y moléculas de señalización. [46] Esta matriz es lo suficientemente fuerte como para que, en determinadas condiciones, las biopelículas puedan fosilizarse ( estromatolitos ).
Las bacterias que viven en una biopelícula suelen tener propiedades significativamente diferentes de las bacterias que flotan libremente de la misma especie, ya que el entorno denso y protegido de la película les permite cooperar e interactuar de diversas formas. [47] Un beneficio de este entorno es una mayor resistencia a los detergentes y antibióticos , ya que la densa matriz extracelular y la capa exterior de células protegen el interior de la comunidad. [48] [49] En algunos casos, la resistencia a los antibióticos puede aumentar hasta 5000 veces. [50] La transferencia lateral de genes a menudo se facilita dentro de biopelículas bacterianas y arqueales [51] y puede conducir a una estructura de biopelícula más estable. [52] El ADN extracelular es un componente estructural importante de muchas biopelículas microbianas diferentes. [53] La degradación enzimática del ADN extracelular puede debilitar la estructura de la biopelícula y liberar células microbianas de la superficie.
Sin embargo, las biopelículas no siempre son menos susceptibles a los antibióticos. Por ejemplo, la forma de biopelícula de Pseudomonas aeruginosa no tiene mayor resistencia a los antimicrobianos que las células planctónicas en fase estacionaria, aunque cuando la biopelícula se compara con las células planctónicas en fase logarítmica, la biopelícula sí tiene mayor resistencia a los antimicrobianos. Esta resistencia a los antibióticos tanto en las células en fase estacionaria como en las biopelículas puede deberse a la presencia de células persistentes . [54]
Hábitats


Las biopelículas son omnipresentes en la vida orgánica. Casi todas las especies de microorganismos tienen mecanismos por los cuales pueden adherirse a superficies y entre sí. Las biopelículas se forman en prácticamente cualquier superficie que no se desprenda en ambientes acuosos o húmedos no estériles . Las biopelículas pueden crecer en los ambientes más extremos: desde, por ejemplo, las aguas extremadamente calientes y salobres de fuentes termales que van desde muy ácidas a muy alcalinas, hasta los glaciares congelados .
Las biopelículas se pueden encontrar en rocas y guijarros en el fondo de la mayoría de los arroyos o ríos y, a menudo, se forman en las superficies de charcos de agua estancada . Las biopelículas son componentes importantes de las cadenas alimentarias en ríos y arroyos y son pastadas por los invertebrados acuáticos de los que se alimentan muchos peces. Las biopelículas se encuentran en la superficie y en el interior de las plantas. Pueden contribuir a la enfermedad de los cultivos o, como en el caso de los rizobios fijadores de nitrógeno en los nódulos de las raíces , existir simbióticamente con la planta . [55] Los ejemplos de enfermedades de los cultivos relacionadas con las biopelículas incluyen el cancro de los cítricos, la enfermedad de Pierce de las uvas y la mancha bacteriana de plantas como los pimientos y los tomates. [56]
Filtros de percolación
Los filtros de percolación en las plantas de tratamiento de aguas residuales son eliminadores muy eficaces de contaminantes del licor cloacal sedimentado. Funcionan haciendo gotear el líquido sobre un lecho de material duro que está diseñado para tener una superficie muy grande. En la superficie del medio se desarrolla una biopelícula compleja que absorbe, adsorbe y metaboliza los contaminantes. La biopelícula crece rápidamente y cuando se vuelve demasiado espesa para retener su adherencia al medio, se lava y es reemplazada por una película recién formada. La película lavada ("desprendida") se sedimenta fuera de la corriente de líquido para dejar un efluente altamente purificado. [57]
Filtro de arena lento
Los filtros de arena lentos se utilizan en la purificación del agua para tratar el agua cruda y producir un producto potable. Funcionan mediante la formación de una biopelícula llamada capa hipogea o Schmutzdecke en los primeros milímetros de la capa de arena fina. La Schmutzdecke se forma en los primeros 10 a 20 días de funcionamiento [58] y está compuesta por bacterias , hongos, protozoos , rotíferos y una variedad de larvas de insectos acuáticos. A medida que una biopelícula epigea envejece, tienden a desarrollarse más algas y pueden estar presentes organismos acuáticos más grandes, incluidos algunos briozoos , caracoles y gusanos anélidos . La biopelícula superficial es la capa que proporciona la purificación efectiva en el tratamiento del agua potable, y la arena subyacente proporciona el medio de soporte para esta capa de tratamiento biológico. A medida que el agua pasa a través de la capa hipogea, las partículas de materia extraña quedan atrapadas en la matriz mucilaginosa y se adsorbe material orgánico soluble . Los contaminantes son metabolizados por las bacterias, hongos y protozoos. El agua producida a partir de un filtro de arena lento ejemplar es de excelente calidad, con una reducción del recuento de células bacterianas del 90 al 99 %. [59]
Rizosfera
Los microbios beneficiosos para las plantas se pueden clasificar como rizobacterias promotoras del crecimiento de las plantas . [60] Estos promotores del crecimiento de las plantas colonizan las raíces de las plantas y proporcionan una amplia gama de funciones beneficiosas para su huésped, incluyendo la fijación de nitrógeno, la supresión de patógenos, propiedades antifúngicas y la descomposición de materiales orgánicos. [61] Una de estas funciones es la defensa contra bacterias y hongos patógenos transmitidos por el suelo mediante resistencia sistémica inducida (ISR) [62] o respuestas sistémicas inducidas desencadenadas por microbios patógenos (resistencia sistémica adquirida inducida por patógenos). [63] Los exudados de las plantas actúan como señales químicas para que las bacterias específicas del huésped colonicen. [64] Los pasos de colonización de las rizobacterias incluyen atracciones, reconocimiento, adherencia, colonización y crecimiento. [61] Las bacterias que han demostrado ser beneficiosas y forman biopelículas incluyen Bacillus , Pseudomonas y Azospirillum . [65] [66] Las biopelículas en la rizosfera a menudo resultan en resistencias sistémicas inducidas por patógenos o plantas. Las propiedades moleculares en la superficie de la bacteria causan una respuesta inmune en la planta huésped. [64] Estas moléculas asociadas a microbios interactúan con receptores en la superficie de las células vegetales y activan una respuesta bioquímica que se cree que incluye varios genes diferentes en varios loci. [64] Varias otras moléculas de señalización se han vinculado tanto a respuestas sistémicas inducidas como a respuestas sistémicas inducidas por patógenos, como el ácido jasmónico y el etileno. [61] Componentes de la envoltura celular como flagelos bacterianos y lipopolisacáridos, que son reconocidos por las células vegetales como componentes de patógenos. [67] También se ha demostrado que ciertos metabolitos de hierro producidos por Pseudomonas crean una respuesta sistémica inducida. [64] Esta función de la biopelícula ayuda a las plantas a desarrollar una resistencia más fuerte a los patógenos.
Las plantas que han sido colonizadas por PGPR formando una biopelícula han adquirido resistencias sistémicas y están preparadas para la defensa contra los patógenos. Esto significa que se han expresado los genes necesarios para la producción de proteínas que trabajan para defender a la planta contra los patógenos, y la planta tiene una "reserva" de compuestos para liberar para luchar contra los patógenos. [64] Un sistema de defensa preparado responde mucho más rápido a la infección inducida por patógenos y puede ser capaz de desviar a los patógenos antes de que puedan establecerse. [68] Las plantas aumentan la producción de lignina, reforzando las paredes celulares y dificultando la penetración de los patógenos en la célula, al mismo tiempo que cortan los nutrientes a las células ya infectadas, deteniendo eficazmente la invasión. [61] Producen compuestos antimicrobianos como fitoalexinas, quitinasas e inhibidores de proteinasas, que impiden el crecimiento de patógenos. [63] Estas funciones de supresión de enfermedades y resistencia a patógenos conducen en última instancia a un aumento de la producción agrícola y a una disminución del uso de pesticidas, herbicidas y fungicidas químicos porque hay una menor cantidad de pérdidas de cultivos debido a enfermedades. [69] La resistencia sistémica inducida y la resistencia sistémica adquirida inducida por patógenos son funciones potenciales de las biopelículas en la rizosfera y deben tenerse en cuenta cuando se aplican a las prácticas agrícolas de la nueva era debido a su efecto en la supresión de enfermedades sin el uso de productos químicos peligrosos.
Intestino de los mamíferos
Estudios realizados en 2003 descubrieron que el sistema inmunológico favorece el desarrollo de biopelículas en el intestino grueso. Esto se vio respaldado principalmente por el hecho de que las dos moléculas producidas con mayor abundancia por el sistema inmunológico también favorecen la producción de biopelículas y están asociadas con las biopelículas desarrolladas en el intestino. Esto es especialmente importante porque el apéndice contiene una gran cantidad de estas biopelículas bacterianas. [70] Este descubrimiento ayuda a distinguir la posible función del apéndice y la idea de que el apéndice puede ayudar a reinocular el intestino con una buena flora intestinal. Sin embargo, los estados modificados o alterados de las biopelículas en el intestino se han relacionado con enfermedades como la enfermedad inflamatoria intestinal y el cáncer colorrectal . [71]
Entorno humano
En el entorno humano, las biopelículas pueden crecer en las duchas muy fácilmente, ya que proporcionan un entorno húmedo y cálido para que prosperen. Pueden formarse dentro de las tuberías de agua y alcantarillado y causar obstrucciones y corrosión . En pisos y mostradores, pueden dificultar la higiene en las áreas de preparación de alimentos. En el suelo, pueden causar bioobstrucciones . En los sistemas de agua de enfriamiento o calentamiento, se sabe que reducen la transferencia de calor. [72] Las biopelículas en los sistemas de ingeniería marina, como las tuberías de la industria del petróleo y el gas en alta mar, [73] pueden provocar problemas de corrosión importantes. La corrosión se debe principalmente a factores abióticos; sin embargo, al menos el 20% de la corrosión es causada por microorganismos que están adheridos a la subsuperficie del metal (es decir, corrosión influenciada por microbios ).
Incrustaciones en los barcos
La adhesión bacteriana a los cascos de los barcos sirve como base para la bioincrustación de los buques de navegación marítima. Una vez que se forma una película de bacterias, es más fácil que otros organismos marinos, como los percebes, se adhieran a ella. Esta incrustación puede reducir la velocidad máxima del buque hasta en un 20%, prolongando los viajes y consumiendo combustible. El tiempo que pasan en dique seco para reacondicionamiento y repintado reduce la productividad de los activos de transporte marítimo, y la vida útil de los buques también se reduce debido a la corrosión y la eliminación mecánica (raspado) de los organismos marinos de los cascos de los barcos.
Estromatolitos
Los estromatolitos son estructuras de acreción en capas que se forman en aguas poco profundas mediante la captura, unión y cementación de granos sedimentarios por biopelículas microbianas, especialmente de cianobacterias . Los estromatolitos incluyen algunos de los registros más antiguos de vida en la Tierra y todavía se están formando en la actualidad.
Placa dental
En el cuerpo humano, las biopelículas están presentes en los dientes en forma de placa dental , donde pueden causar caries y enfermedades de las encías . Estas biopelículas pueden estar en un estado no calcificado que se puede eliminar con instrumentos dentales, o en un estado calcificado que es más difícil de eliminar. Las técnicas de eliminación también pueden incluir antimicrobianos . [74]
La placa dental es una biopelícula oral que se adhiere a los dientes y está formada por muchas especies de bacterias y hongos (como Streptococcus mutans y Candida albicans ), incrustadas en polímeros salivales y productos extracelulares microbianos. La acumulación de microorganismos somete a los dientes y tejidos gingivales a altas concentraciones de metabolitos bacterianos que dan lugar a enfermedades dentales. [75] La biopelícula en la superficie de los dientes está frecuentemente sujeta a estrés oxidativo [76] y estrés ácido. [77] Los carbohidratos de la dieta pueden causar una disminución drástica del pH en las biopelículas orales a valores de 4 y menores (estrés ácido). [77] Un pH de 4 a una temperatura corporal de 37 °C provoca la despurinización del ADN, dejando sitios apurínicos (AP) en el ADN, [78] especialmente pérdida de guanina. [79]
La biopelícula de placa dental puede provocar caries dentales si se permite que se desarrolle con el tiempo. Un cambio ecológico que se aleje de las poblaciones equilibradas dentro de la biopelícula dental es impulsado por ciertas poblaciones microbiológicas (cariogénicas) que comienzan a dominar cuando el entorno las favorece. El cambio a una población microbiológica acidogénica , acidúrica y cariogénica se desarrolla y se mantiene mediante el consumo frecuente de carbohidratos dietéticos fermentables . El cambio de actividad resultante en la biopelícula (y la producción de ácido resultante dentro de la biopelícula, en la superficie del diente) se asocia con un desequilibrio de desmineralización sobre remineralización, lo que lleva a una pérdida neta de minerales dentro de los tejidos duros dentales ( esmalte y luego dentina ), siendo el síntoma una lesión cariosa o cavidad. Al evitar que la biopelícula de placa dental madure o al devolverla a un estado no cariogénico, se pueden prevenir y detener las caries dentales. [80] [81] Esto se puede lograr a través del paso conductual de reducir el suministro de carbohidratos fermentables (es decir, la ingesta de azúcar) y la eliminación frecuente de la biopelícula (es decir, el cepillado de dientes ). [80]
Comunicación intercelular
Un sistema de señalización de detección de quórum de feromonas peptídicas en S. mutans incluye el péptido estimulante de la competencia (CSP) que controla la competencia genética. [82] [83] La competencia genética es la capacidad de una célula de absorber el ADN liberado por otra célula. La competencia puede conducir a la transformación genética, una forma de interacción sexual, favorecida en condiciones de alta densidad celular y/o estrés donde existe una oportunidad máxima de interacción entre la célula competente y el ADN liberado de las células donantes cercanas. Este sistema se expresa de manera óptima cuando las células de S. mutans residen en una biopelícula en crecimiento activo. Las células de S. mutans cultivadas en biopelícula se transforman genéticamente a una tasa de 10 a 600 veces mayor que las S. mutans que crecen como células planctónicas que flotan libremente suspendidas en líquido. [82]
Cuando la biopelícula que contiene S. mutans y estreptococos orales relacionados se somete a estrés ácido, se induce el regulón de competencia, lo que genera resistencia a ser destruido por el ácido. [77] Como señalaron Michod et al., la transformación en patógenos bacterianos probablemente proporciona una reparación recombinatoria eficaz y eficiente de los daños en el ADN. [84] Parece que S. mutans puede sobrevivir al estrés ácido frecuente en las biopelículas orales, en parte, a través de la reparación recombinatoria proporcionada por la competencia y la transformación.
Interacciones depredador-presa
Las interacciones depredador - presa entre biopelículas y bacterívoros, como el nematodo que habita en el suelo Caenorhabditis elegans , se han estudiado ampliamente. A través de la producción de una matriz pegajosa y la formación de agregados, las biopelículas de Yersinia pestis pueden impedir la alimentación al obstruir la boca de C. elegans . [85] Además, las biopelículas de Pseudomonas aeruginosa pueden impedir la movilidad deslizante de C. elegans , denominada "fenotipo de pantano", lo que da como resultado el atrapamiento de C. elegans dentro de las biopelículas y evita la exploración de los nematodos para alimentarse de biopelículas susceptibles. [86] Esto redujo significativamente la capacidad del depredador para alimentarse y reproducirse, promoviendo así la supervivencia de las biopelículas. Las biopelículas de Pseudomonas aeruginosa también pueden enmascarar sus firmas químicas, donde redujeron la difusión de moléculas de detección de quórum en el medio ambiente y evitaron la detección de C. elegans . [87]
Diversidad taxonómica
Muchas bacterias diferentes forman biopelículas, incluidas las grampositivas (por ejemplo, Bacillus spp., Listeria monocytogenes , Staphylococcus spp. y bacterias de ácido láctico , incluidas Lactobacillus plantarum y Lactococcus lactis ) y las gramnegativas (por ejemplo, Escherichia coli o Pseudomonas aeruginosa ). [88] Las cianobacterias también forman biopelículas en entornos acuáticos. [89]
Las biopelículas están formadas por bacterias que colonizan las plantas, por ejemplo, Pseudomonas putida , Pseudomonas fluorescens y pseudomonas relacionadas, que son bacterias comunes asociadas a las plantas que se encuentran en las hojas, las raíces y en el suelo, y la mayoría de sus aislamientos naturales forman biopelículas. [90] Varios simbiontes fijadores de nitrógeno de las legumbres, como Rhizobium leguminosarum y Sinorhizobium meliloti, forman biopelículas en las raíces de las legumbres y otras superficies inertes. [90]
Además de las bacterias, las biopelículas también son generadas por arqueas [51] y por una variedad de organismos eucariotas , incluidos hongos, por ejemplo, Cryptococcus laurentii [91] y microalgas . Entre las microalgas, uno de los principales progenitores de las biopelículas son las diatomeas , que colonizan ambientes tanto dulces como marinos en todo el mundo. [92] [93]
Para otras especies en biopelículas asociadas a enfermedades y biopelículas que surgen de eucariotas , consulte a continuación.
Enfermedades infecciosas
Se ha descubierto que las biopelículas están implicadas en una amplia variedad de infecciones microbianas en el cuerpo, según una estimación del 80% de todas las infecciones. [94] Los procesos infecciosos en los que se han implicado las biopelículas incluyen problemas comunes como vaginosis bacteriana , infecciones del tracto urinario , infecciones del catéter , infecciones del oído medio , formación de placa dental , [95] gingivitis , recubrimiento de lentes de contacto , [96] y procesos menos comunes pero más letales como endocarditis , infecciones en fibrosis quística e infecciones de dispositivos permanentes como prótesis articulares , válvulas cardíacas y disco intervertebral. [97] [98] [99] La primera evidencia visual de una biopelícula se registró después de una cirugía de columna. [100] Se encontró que en ausencia de presentación clínica de infección, las bacterias impregnadas podrían formar una biopelícula alrededor de un implante, y esta biopelícula puede permanecer sin detectar a través de métodos de diagnóstico contemporáneos, incluido el hisopado. La biopelícula de implantes se encuentra frecuentemente presente en casos de pseudoartrosis "aséptica". [100] [101] [102] Además, se ha observado que las biopelículas bacterianas pueden perjudicar la cicatrización de heridas cutáneas y reducir la eficacia de los antibacterianos tópicos para curar o tratar heridas cutáneas infectadas. [103] Se cree que la diversidad de células de P. aeruginosa dentro de una biopelícula dificulta el tratamiento de los pulmones infectados de personas con fibrosis quística. [13] La detección temprana de biopelículas en heridas es crucial para el tratamiento exitoso de heridas crónicas. Aunque se han desarrollado muchas técnicas para identificar bacterias planctónicas en heridas viables, pocas han podido identificar biopelículas bacterianas de manera rápida y precisa. Se necesitan estudios futuros para encontrar medios de identificar y monitorear la colonización de biopelículas en la cama del paciente para permitir el inicio oportuno del tratamiento. [104]
Se ha demostrado que las biopelículas están presentes en el tejido extirpado del 80% de los pacientes sometidos a cirugía por sinusitis crónica . Se demostró que los pacientes con biopelículas habían sido despojados de cilios y células caliciformes , a diferencia de los controles sin biopelículas que tenían morfología normal de cilios y células caliciformes. [105] También se encontraron biopelículas en muestras de dos de los 10 controles sanos mencionados. Las especies de bacterias de los cultivos intraoperatorios no correspondían a las especies de bacterias en la biopelícula en el tejido del paciente respectivo. En otras palabras, los cultivos fueron negativos aunque las bacterias estaban presentes. [106] Se están desarrollando nuevas técnicas de tinción para diferenciar las células bacterianas que crecen en animales vivos, por ejemplo, de tejidos con inflamaciones alérgicas. [107]
Las investigaciones han demostrado que los niveles subterapéuticos de antibióticos β-lactámicos inducen la formación de biopelículas en Staphylococcus aureus . Este nivel subterapéutico de antibiótico puede ser resultado del uso de antibióticos como promotores del crecimiento en la agricultura o durante el curso normal de la terapia con antibióticos. La formación de biopelículas inducida por meticilina de bajo nivel fue inhibida por la DNasa, lo que sugiere que los niveles subterapéuticos de antibiótico también inducen la liberación de ADN extracelular. [108] Además, desde un punto de vista evolutivo, la creación de la tragedia de los comunes en microbios patógenos puede proporcionar formas terapéuticas avanzadas para infecciones crónicas causadas por biopelículas a través de tramposos invasores modificados genéticamente que pueden invadir "cooperadores" de tipo salvaje de bacterias patógenas hasta que las poblaciones de cooperadores se extingan o la población general de "cooperadores y tramposos" se extinga. [109]
Pseudomonas aeruginosa
P. aeruginosa representa un organismo modelo de biopelícula de uso común, ya que está involucrado en diferentes tipos de infecciones crónicas asociadas a biopelículas. [41] Los ejemplos de tales infecciones incluyen heridas crónicas, otitis media crónica, prostatitis crónica e infecciones pulmonares crónicas en pacientes con fibrosis quística (FQ). Alrededor del 80% de los pacientes con FQ tienen infección pulmonar crónica, causada principalmente por P. aeruginosa que crece en biopelículas no adheridas a la superficie rodeadas de PMN . [110] La infección permanece presente a pesar de la terapia antibiótica agresiva y es una causa común de muerte en pacientes con FQ debido al daño inflamatorio constante a los pulmones. [41] En pacientes con FQ, una terapia para tratar el desarrollo temprano de biopelículas es emplear DNasa para debilitar estructuralmente la biopelícula. [4] [111]
La formación de biopelículas de P. aeruginosa , junto con otras bacterias, se encuentra en el 90% de las infecciones de heridas crónicas, lo que conduce a una mala cicatrización y a un alto costo del tratamiento estimado en más de US$25 mil millones cada año en los Estados Unidos . [112] Para minimizar la infección por P. aeruginosa , las células epiteliales del huésped secretan péptidos antimicrobianos , como la lactoferrina , para prevenir la formación de biopelículas. [113]
Neumonía por estreptococo
Streptococcus pneumoniae es la principal causa de neumonía y meningitis adquiridas en la comunidad en niños y ancianos, y de sepsis en personas infectadas por el VIH. Cuando S. pneumoniae crece en biopelículas, se expresan genes específicos que responden al estrés oxidativo e inducen competencia. [114] La formación de una biopelícula depende del péptido estimulante de la competencia (CSP). El CSP también funciona como un péptido de detección de quórum. No solo induce la formación de biopelículas, sino que también aumenta la virulencia en la neumonía y la meningitis.
Se ha propuesto que el desarrollo de la competencia y la formación de biopelículas es una adaptación de S. pneumoniae para sobrevivir a las defensas del huésped. [84] En particular, los leucocitos polimorfonucleares del huésped producen una explosión oxidativa para defenderse de las bacterias invasoras, y esta respuesta puede matar a las bacterias dañando su ADN. Las S. pneumoniae competentes en una biopelícula tienen la ventaja de supervivencia de que pueden absorber más fácilmente el ADN transformante de las células cercanas en la biopelícula para usarlo en la reparación recombinatoria de los daños oxidativos en su ADN. Las S. pneumoniae competentes también pueden secretar una enzima (mureína hidrolasa) que destruye las células no competentes (fratricida) haciendo que el ADN se libere al medio circundante para su posible uso por parte de las células competentes. [115]
El péptido antimicrobiano de insectos cecropina A puede destruir células de E. coli uropatógenas formadoras de biopelículas planctónicas y sésiles , ya sea solo o cuando se combina con el antibiótico ácido nalidíxico , eliminando sinérgicamente la infección in vivo (en el insecto huésped Galleria mellonella ) sin citotoxicidad fuera del objetivo. El mecanismo de acción multiobjetivo implica la permeabilización de la membrana externa seguida de la disrupción de la biopelícula desencadenada por la inhibición de la actividad de la bomba de eflujo e interacciones con ácidos nucleicos extracelulares e intracelulares. [116]
Escherichia coli
Las biopelículas de Escherichia coli son responsables de muchas enfermedades infecciosas intestinales. [117] El grupo extraintestinal de E. coli (ExPEC) es el grupo bacteriano dominante que ataca el sistema urinario , lo que conduce a infecciones del tracto urinario . [118] La formación de biopelículas de estas E. coli patógenas es difícil de erradicar debido a la complejidad de su estructura de agregación, y tiene una contribución significativa al desarrollo de complicaciones médicas agresivas, aumento en la tasa de hospitalización y costo del tratamiento. [119] [120] El desarrollo de biopelículas de E. coli es una causa principal común de infecciones del tracto urinario (ITU) en los hospitales a través de su contribución al desarrollo de infecciones asociadas a dispositivos médicos . Las infecciones del tracto urinario asociadas a catéteres (CAUTI) representan la infección adquirida en el hospital más comúndebido a la formación de la biopelícula patógena de E. coli dentro de los catéteres. [121]
Estafilococo áureo
El patógeno Staphylococcus aureus puede atacar la piel y los pulmones, lo que provoca infecciones cutáneas y neumonía . [122] [123] Además, la red de infecciones por biopelículas de S. aureus desempeña un papel fundamental a la hora de impedir que las células inmunitarias, como los macrófagos, eliminen y destruyan las células bacterianas. [124] Además, la formación de biopelículas por bacterias, como S. aureus , no solo desarrolla resistencia a los antibióticos , sino que también desarrolla resistencia interna a los péptidos antimicrobianos (AMP) , lo que impide la inhibición del patógeno y mantiene su supervivencia. [125]
Serratia marcescens
Serratia marcescens es un patógeno oportunista bastante común que puede formar biopelículas en diversas superficies, incluidos dispositivos médicos como catéteres e implantes, así como entornos naturales como el suelo y el agua. La formación de biopelículas por parte de S. marcescens es una preocupación grave debido a su capacidad de adherirse a las superficies y colonizarlas, protegiéndose de las respuestas inmunitarias del huésped y de los agentes antimicrobianos. Esta fortaleza hace que las infecciones causadas por S. marcescens sean difíciles de tratar, especialmente en hospitales donde la bacteria puede causar infecciones graves y específicas.
Las investigaciones sugieren que la formación de biopelículas por S. marcescens es un proceso controlado tanto por señales de nutrientes como por el sistema de detección de quórum. [126] La detección de quórum influye en la capacidad de la bacteria para adherirse a superficies y establecer biopelículas maduras, mientras que la disponibilidad de nutrientes específicos puede mejorar o inhibir el desarrollo de la biopelícula.
S. marcescens crea biopelículas que finalmente se convierten en una estructura altamente porosa y similar a un filamento compuesta de cadenas de células, filamentos y grupos de células. Las investigaciones han demostrado que las biopelículas de S. marcescens presentan una organización estructural compleja, incluida la formación de microcolonias y canales que facilitan el intercambio de nutrientes y desechos. La producción de sustancias poliméricas extracelulares (SPE) es un factor clave en el desarrollo de biopelículas, que contribuye a la adhesión y resistencia de la bacteria a los agentes antimicrobianos. Además de su papel en las infecciones asociadas a la atención médica, las biopelículas de S. marcescens se han relacionado con el deterioro de los equipos y procesos industriales. Por ejemplo, el crecimiento de biopelículas en torres de refrigeración puede provocar bioincrustaciones y reducir la eficiencia.
Los esfuerzos para controlar y prevenir la formación de biopelículas por S. marcescens implican el uso de recubrimientos antimicrobianos en dispositivos médicos, el desarrollo de disruptores de biopelículas específicos y protocolos de esterilización mejorados. Es fundamental realizar más investigaciones sobre los mecanismos moleculares que rigen la formación y la persistencia de biopelículas de S. marcescens para desarrollar estrategias efectivas para combatir sus riesgos asociados. Se ha estudiado el uso de compuestos de indol para su uso como protección contra la formación de biopelículas. [127]
Usos e impacto
En medicina
Se sugiere que alrededor de dos tercios de las infecciones bacterianas en humanos involucran biopelículas. [50] [128] Las infecciones asociadas con el crecimiento de biopelículas generalmente son difíciles de erradicar. [129] Esto se debe principalmente al hecho de que las biopelículas maduras muestran tolerancia a los antimicrobianos y evasiones de la respuesta inmune. [130] [41] Las biopelículas a menudo se forman en las superficies inertes de dispositivos implantados como catéteres, válvulas cardíacas protésicas y dispositivos intrauterinos. [131] Algunas de las infecciones más difíciles de tratar son las asociadas con el uso de dispositivos médicos. [50] [101]
La industria de dispositivos biomédicos y productos relacionados con la ingeniería de tejidos, que se encuentra en rápida expansión a nivel mundial, ya genera 180 mil millones de dólares por año, pero sigue sufriendo la colonización microbiana. Independientemente de la sofisticación, las infecciones microbianas pueden desarrollarse en todos los dispositivos médicos y construcciones de ingeniería de tejidos. [130] Entre el 60 y el 70 % de las infecciones adquiridas en el hospital están asociadas con la implantación de un dispositivo biomédico. [130] Esto da lugar a 2 millones de casos al año en los EE. UU., lo que le cuesta al sistema de salud más de 5 mil millones de dólares en gastos de atención médica adicionales. [130]
El nivel de resistencia a los antibióticos en una biopelícula es mucho mayor que el de las bacterias que no forman parte de ella, y puede ser hasta 5.000 veces mayor. [50] La matriz extracelular de la biopelícula se considera uno de los principales factores que pueden reducir la penetración de antibióticos en la estructura de una biopelícula y contribuye a la resistencia a los antibióticos. [132] Además, se ha demostrado que la evolución de la resistencia a los antibióticos puede verse afectada por el estilo de vida de la biopelícula. [133] La terapia con bacteriófagos puede dispersar la biopelícula generada por bacterias resistentes a los antibióticos. [134]
Se ha demostrado que la introducción de una pequeña corriente eléctrica en el líquido que rodea una biopelícula, junto con pequeñas cantidades de antibiótico, puede reducir el nivel de resistencia a los antibióticos a niveles de bacterias que no forman parte de la biopelícula. Esto se denomina efecto bioeléctrico . [50] [135] La aplicación de una pequeña corriente continua por sí sola puede hacer que una biopelícula se desprenda de su superficie. [50] Un estudio demostró que el tipo de corriente utilizada no afectaba al efecto bioeléctrico. [135]
En la industria
Las biopelículas también se pueden aprovechar con fines constructivos. Por ejemplo, muchas plantas de tratamiento de aguas residuales incluyen una etapa de tratamiento secundario en la que las aguas residuales pasan sobre biopelículas cultivadas en filtros, que extraen y digieren compuestos orgánicos. En dichas biopelículas, las bacterias son las principales responsables de la eliminación de materia orgánica ( DBO ), mientras que los protozoos y rotíferos son los principales responsables de la eliminación de sólidos suspendidos (SS), incluidos patógenos y otros microorganismos. Los filtros de arena lentos dependen del desarrollo de biopelículas de la misma manera para filtrar el agua superficial de fuentes de lagos, manantiales o ríos para beber. Lo que se considera agua limpia es efectivamente un material de desecho para estos organismos microcelulares. Las biopelículas pueden ayudar a eliminar el petróleo de los océanos o sistemas marinos contaminados. El petróleo se elimina mediante las actividades de degradación de hidrocarburos de las comunidades de bacterias hidrocarbonoclásticas (HCB). [136] Las biopelículas se utilizan en celdas de combustible microbianas (MFC) para generar electricidad a partir de una variedad de materiales de partida, incluidos desechos orgánicos complejos y biomasa renovable. [7] [137] [138] Las biopelículas también son relevantes para la mejora de la disolución de metales en la industria de biolixiviación , [139] y la agregación de contaminantes microplásticos para su eliminación conveniente del medio ambiente. [140] [141]
Industria alimentaria
Las biopelículas se han vuelto problemáticas en varias industrias alimentarias debido a su capacidad de formarse en plantas y durante procesos industriales. [142] Las bacterias pueden sobrevivir largos periodos de tiempo en el agua, el estiércol animal y el suelo, provocando la formación de biopelículas en las plantas o en el equipo de procesamiento. [143] La acumulación de biopelículas puede afectar el flujo de calor a través de una superficie y aumentar la corrosión superficial y la resistencia a la fricción de los fluidos. [144] Estos pueden provocar una pérdida de energía en un sistema y una pérdida general de productos. [144] Junto con los problemas económicos, la formación de biopelículas en los alimentos plantea un riesgo para la salud de los consumidores debido a la capacidad de hacer que los alimentos sean más resistentes a los desinfectantes. [142] Como resultado, de 1996 a 2010 los Centros para el Control y la Prevención de Enfermedades estimaron 48 millones de enfermedades transmitidas por alimentos por año. [142] Las biopelículas se han relacionado con aproximadamente el 80% de las infecciones bacterianas en los Estados Unidos. [142]
En los productos , los microorganismos se adhieren a las superficies y se desarrollan biopelículas internamente. [142] Durante el proceso de lavado, las biopelículas resisten la higienización y permiten que las bacterias se propaguen por los productos, [142] especialmente a través de los utensilios de cocina. [145] Este problema también se encuentra en los alimentos listos para comer, porque los alimentos pasan por procedimientos de limpieza limitados antes del consumo [142] Debido a la perecibilidad de los productos lácteos y las limitaciones en los procedimientos de limpieza, que resultan en la acumulación de bacterias, los productos lácteos son susceptibles a la formación de biopelículas y contaminación. [142] [144] Las bacterias pueden estropear los productos más fácilmente y los productos contaminados plantean un riesgo para la salud de los consumidores. Una especie de bacteria que se puede encontrar en varias industrias y es una de las principales causas de enfermedades transmitidas por los alimentos es la Salmonella . [146] Se pueden encontrar grandes cantidades de contaminación por Salmonella en la industria de procesamiento de aves de corral, ya que aproximadamente el 50% de las cepas de Salmonella pueden producir biopelículas en las granjas avícolas. [142] La salmonela aumenta el riesgo de enfermedades transmitidas por los alimentos cuando los productos avícolas no se limpian y cocinan correctamente. La salmonela también se encuentra en la industria de los mariscos, donde se forman biopelículas a partir de patógenos transmitidos por los mariscos en los propios mariscos, así como en el agua. [146] Los productos de camarón se ven comúnmente afectados por la salmonela debido a técnicas de procesamiento y manipulación antihigiénicas . [146] Las prácticas de preparación de camarones y otros productos del mar pueden permitir la acumulación de bacterias en los productos. [146]
Se están probando nuevas formas de procedimientos de limpieza para reducir la formación de biopelículas en estos procesos, lo que conducirá a industrias de procesamiento de alimentos más seguras y productivas. Estas nuevas formas de procedimientos de limpieza también tienen un profundo efecto sobre el medio ambiente, a menudo liberando gases tóxicos en los depósitos de agua subterránea. [144] Como respuesta a los métodos agresivos empleados para controlar la formación de biopelículas, hay una serie de nuevas tecnologías y productos químicos bajo investigación que pueden prevenir la proliferación o la adhesión de microbios secretores de biopelículas. Las últimas biomoléculas propuestas que presentan una marcada actividad anti-biopelícula incluyen una gama de metabolitos como los ramnolípidos bacterianos [147] e incluso alcaloides derivados de plantas [148] y animales . [149]
En acuicultura

En la acuicultura de mariscos y algas , las especies microbianas bioincrustantes tienden a bloquear redes y jaulas y, en última instancia, compiten con las especies cultivadas por el espacio y el alimento. [150] Las biopelículas bacterianas inician el proceso de colonización creando microambientes que son más favorables para las especies bioincrustantes. En el entorno marino, las biopelículas podrían reducir la eficiencia hidrodinámica de los barcos y las hélices, provocar bloqueos en las tuberías y el mal funcionamiento de los sensores, y aumentar el peso de los aparatos desplegados en agua de mar. [151] Numerosos estudios han demostrado que la biopelícula puede ser un reservorio de bacterias potencialmente patógenas en la acuicultura de agua dulce. [152] [153] [154] [155] Además, las biopelículas son importantes para establecer infecciones en los peces. [156] Como se mencionó anteriormente, las biopelículas pueden ser difíciles de eliminar incluso cuando se utilizan antibióticos o productos químicos en dosis altas. [157] [158] El papel que desempeña la biopelícula como reservorio de patógenos bacterianos de peces no se ha explorado en detalle, pero sin duda merece ser estudiado.
Eucariota
Junto con las bacterias, las biopelículas suelen ser iniciadas y producidas por microbios eucariotas. Las biopelículas producidas por eucariotas suelen estar ocupadas por bacterias y otros eucariotas por igual, sin embargo, la superficie se cultiva y el EPS es secretado inicialmente por el eucariota. [91] [92] [159] Se sabe que tanto los hongos como las microalgas forman biopelículas de esta manera. Las biopelículas de origen fúngico son aspectos importantes de la infección humana y la patogenicidad fúngica, ya que la infección fúngica es más resistente a los antimicóticos. [160] [161]
En el medio ambiente, las biopelículas fúngicas son un área de investigación en curso. Un área clave de investigación son las biopelículas fúngicas en las plantas. Por ejemplo, en el suelo, se ha demostrado que los hongos asociados a las plantas, incluidas las micorrizas, descomponen la materia orgánica y protegen a las plantas de los patógenos bacterianos. [162]
Las biopelículas en ambientes acuáticos suelen estar formadas por diatomeas . Se desconoce el propósito exacto de estas biopelículas, sin embargo, hay evidencia de que los EPS producidos por las diatomeas facilitan tanto el estrés por frío como por salinidad. [93] [163] Estos eucariotas interactúan con una amplia gama de otros organismos dentro de una región conocida como la ficosfera , pero lo más importante son las bacterias asociadas con las diatomeas, ya que se ha demostrado que, aunque las diatomeas excretan EPS, solo lo hacen cuando interactúan con ciertas especies de bacterias. [164] [165]
Transferencia horizontal de genes
La transferencia horizontal de genes es la transferencia lateral de material genético entre organismos celulares. Ocurre con frecuencia en procariotas y con menor frecuencia en eucariotas. En las bacterias, la transferencia horizontal de genes puede ocurrir a través de la transformación (captación de ADN que flota libremente en el ambiente), la transducción (captación de ADN mediada por virus) o la conjugación (transferencia de ADN entre estructuras de pili de dos bacterias adyacentes). [166] Estudios recientes también han descubierto otros mecanismos, como la transmisión por vesículas de membrana o agentes de transferencia de genes. [167] Las biopelículas promueven la transferencia horizontal de genes de diversas formas.

Se ha demostrado que la conjugación bacteriana acelera la formación de biopelículas en entornos difíciles debido a las conexiones robustas establecidas por los pili conjugativos . [168] Estas conexiones a menudo pueden fomentar eventos de transferencia entre especies debido a la heterogeneidad diversa de muchas biopelículas. Además, las biopelículas están confinadas estructuralmente por una matriz de polisacáridos, lo que proporciona los requisitos espaciales cercanos para la conjugación. La transformación también se observa con frecuencia en biopelículas. La autólisis bacteriana es un mecanismo clave en la regulación estructural de la biopelícula, que proporciona una fuente abundante de ADN competente preparado para la absorción transformativa. [169] [167] En algunos casos, la detección de quórum entre biopelículas puede mejorar la competencia del eADN flotante libre, lo que promueve aún más la transformación. [167] La transferencia de genes Stx a través de portadores de bacteriófagos se ha observado dentro de biopelículas, lo que sugiere que las biopelículas también son un entorno adecuado para la transducción. [167] La HGT de vesículas de membrana ocurre cuando vesículas de membrana liberadas (que contienen información genética) se fusionan con una bacteria receptora y liberan material genético en el citoplasma de la bacteria. [167] Investigaciones recientes han revelado que la HGT de vesículas de membrana puede promover la formación de biopelículas de una sola cepa, aunque aún se desconoce el papel que desempeña la HGT de vesículas de membrana en la formación de biopelículas de múltiples cepas. [167] Los GTA, o agentes de transferencia genética, son partículas similares a fagos producidas por la bacteria huésped y contienen fragmentos de ADN aleatorios del genoma de la bacteria huésped. [167] La HGT dentro de las biopelículas puede conferir resistencia a los antibióticos o mayor patogenicidad en la población de las biopelículas, promoviendo la homeostasis de la biopelícula. [167]
Ejemplos
Los plásmidos conjugativos pueden codificar proteínas asociadas a la biopelícula, como PtgA, PrgB o PrgC, que promueven la adhesión celular (necesaria para la formación temprana de la biopelícula). [170] Los genes que codifican fimbrias de tipo III se encuentran en pOLA52 ( plásmido de Klebsiella pneumoniae ) que promueven la formación de biopelículas dependiente de pili conjugativo. [170]
La transformación ocurre comúnmente dentro de las biopelículas. Un fenómeno llamado fratricidio se puede observar entre las especies de estreptococos en el que se liberan enzimas que degradan la pared celular, lisando las bacterias vecinas y liberando su ADN. Este ADN puede luego ser absorbido por las bacterias supervivientes (transformación). [170] Los péptidos estimulantes de la competencia también pueden desempeñar un papel importante en la formación de biopelículas entre S. pneumoniae y S. mutans . [170] Entre V. cholerae , el propio pilus de competencia promueve la agregación celular a través de interacciones pilus-pilus al comienzo de la formación de la biopelícula. [170]
La invasión de fagos puede desempeñar un papel en los ciclos de vida de las biopelículas, lisando las bacterias y liberando su eADN, que fortalece las estructuras de la biopelícula y puede ser absorbido por las bacterias vecinas en la transformación. [170] La destrucción de la biopelícula causada por el fago Rac de E. coli y el profago Pf4 de P. aeruginosa provoca el desprendimiento de células de la biopelícula. [170] El desprendimiento es un fenómeno de la biopelícula que requiere más estudio, pero se plantea la hipótesis de que prolifera las especies bacterianas que componen la biopelícula.
Se ha observado que la HGT de vesículas de membrana ocurre en ambientes marinos, entre Neisseria gonorrhoeae , Pseudomonas aeruginosa , Helicobacter pylori y entre muchas otras especies bacterianas. [170] Aunque se ha demostrado que la HGT de vesículas de membrana es un factor que contribuye a la formación de biopelículas, aún se requiere investigación para demostrar que la HGT mediada por vesículas de membrana ocurre dentro de las biopelículas. [167] [170] También se ha demostrado que la HGT de vesículas de membrana modula las interacciones fago-bacteria en células resistentes a fagos SPP1 de Bacillus subtilis (que carecen de la proteína receptora SPP1). Tras la exposición a vesículas que contienen receptores, se produce la transducción de pBT163 (un plásmido que codifica cat), lo que da como resultado la expresión de la proteína receptora SPP1, abriendo las bacterias receptivas a una futura infección por fagos. [170]
Investigaciones recientes han demostrado que la especie arqueal H. volcanii tiene algunos fenotipos de biopelículas similares a las biopelículas bacterianas, como la diferenciación y la HGT, que requieren contacto célula-célula e involucran la formación de puentes citosólicos y eventos de fusión celular. [171]
Dispositivos de cultivo
Existe una amplia variedad de dispositivos de cultivo de biopelículas para imitar entornos naturales o industriales. Si bien es importante considerar que la plataforma experimental particular para la investigación de biopelículas determina qué tipo de biopelícula se cultiva y los datos que se pueden extraer. Estos dispositivos se pueden agrupar en los siguientes: [172]
- Sistemas de microplacas (MTP) y MBEC Assay® [anteriormente Calgary Biofilm Device (CBD)]
- Prueba de anillo de biopelícula archivada el 26 de octubre de 2021 en Wayback Machine (BRT) o prueba de anillo de biopelícula clínica (cBRT)
- Dispositivo Robbins o dispositivo Robbins modificado (como el MPMR-10PMMA o el reactor de biopelícula Bio-inLine)
- Reactor de biopelícula de flujo por goteo®
- dispositivos rotatorios (como el reactor de biofilm CDC®, el reactor de disco rotatorio, el reactor anular de biofilm, el reactor de biofilm de superficies industriales o el fermentador de película de profundidad constante)
- Cámaras de flujo o celdas de flujo (como la celda de flujo de evaluación de cupones, la celda de flujo de transmisión y la celda de flujo capilar de BioSurface Technologies)
- Enfoques microfluídicos, como el modelo microfluídico de "dispersión de biopelícula y luego recolonización" (BDR) bacteriano tridimensional [39]
Véase también
- Amiloide : agregado proteico insoluble con morfología fibrilar.
- Nanocables bacterianos : apéndices conductores de electricidad producidos por varias bacterias
- Fábrica de biopelículas : el uso de biopelículas microbianas para la producción químicaPáginas que muestran descripciones breves de los objetivos de redireccionamiento
- Prevención de biopelículas : impedir que los microbios se adhieran a una superficie
- Biomineralización : Proceso mediante el cual los organismos vivos producen minerales.
- Centro de Ingeniería de Biopelículas : instituto interdisciplinario de investigación, educación y transferencia de tecnología de la Universidad Estatal de MontanaPáginas que muestran descripciones de wikidata como alternativa
- Curli : una fibra extracelular proteínica producida por bacterias entéricas.
- Floc (biofilm) – Tipo de suspensión de agregado microbiano
- Inteligencia microbiana : comportamiento adaptativo de organismos microscópicos, incluidas bacterias y protistas.
- Estera microbiana : lámina de microorganismos de varias capas
- Terapia con fagos : uso terapéutico de bacteriófagos para tratar infecciones bacterianas
- Biopelícula fototrófica : comunidades microbianas que incluyen microorganismos que utilizan la luz como fuente de energía.
- Estromatolito : Estructura sedimentaria estratificada formada por el crecimiento de bacterias o algas.
Referencias
- ^ Vert M, Doi Y, Hellwich KH, Hess M, Hodge P, Kubisa P, et al. (2012). "Terminología para polímeros biorelacionados y aplicaciones (Recomendaciones IUPAC 2012)". Química pura y aplicada . 84 (2): 377–410. doi : 10.1351/PAC-REC-10-12-04 .
- ^ abc López D, Vlamakis H, Kolter R (julio de 2010). "Biofilms". Cold Spring Harbor Perspectives in Biology . 2 (7): a000398. doi :10.1101/cshperspect.a000398. PMC 2890205 . PMID 20519345.
- ^ abcde Hall-Stoodley L, Costerton JW, Stoodley P (febrero de 2004). "Biopelículas bacterianas: del entorno natural a las enfermedades infecciosas". Nature Reviews. Microbiología . 2 (2): 95–108. doi :10.1038/nrmicro821. PMID 15040259. S2CID 9107205.
- ^ ab Aggarwal S, Stewart PS, Hozalski RM (enero de 2016). "La fuerza cohesiva de la biopelícula como base para la recalcitrancia de la biopelícula: ¿las biopelículas bacterianas están sobrediseñadas?". Microbiology Insights . 8 (Supl 2): 29–32. doi :10.4137/MBI.S31444. PMC 4718087 . PMID 26819559.
- ^ ab Watnick P, Kolter R (mayo de 2000). "Biofilm, ciudad de microbios". Revista de bacteriología . 182 (10): 2675–9. doi :10.1128/jb.182.10.2675-2679.2000. PMC 101960 . PMID 10781532.
- ^ "Códigos de construcción para ciudades bacterianas | Revista Quanta". Revista Quanta . Archivado desde el original el 26 de julio de 2017. Consultado el 25 de julio de 2017 .
- ^ ab Lear G, Lewis GD, eds. (2012). Biopelículas microbianas: investigación y aplicaciones actuales . Caister Academic Press . ISBN 978-1-904455-96-7.
- ^ ab O'Toole GA, Kolter R (mayo de 1998). "La iniciación de la formación de biopelículas en Pseudomonas fluorescens WCS365 se produce a través de múltiples vías de señalización convergentes: un análisis genético". Microbiología molecular . 28 (3): 449–61. doi : 10.1046/j.1365-2958.1998.00797.x . PMID 9632250. S2CID 43897816.
- ^ O'Toole GA, Kolter R (octubre de 1998). "La motilidad flagelar y espasmódica es necesaria para el desarrollo de biopelículas de Pseudomonas aeruginosa". Microbiología molecular . 30 (2): 295–304. doi : 10.1046/j.1365-2958.1998.01062.x . PMID 9791175. S2CID 25140899.
- ^ Karatan E, Watnick P (junio de 2009). "Señales, redes reguladoras y materiales que forman y destruyen biopelículas bacterianas". Microbiology and Molecular Biology Reviews . 73 (2): 310–47. doi :10.1128/MMBR.00041-08. PMC 2698413 . PMID 19487730.
- ^ Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang Z, Jones RA, Miller SI (agosto de 2005). "Los antibióticos aminoglucósidos inducen la formación de biopelículas bacterianas". Nature . 436 (7054): 1171–5. Bibcode :2005Natur.436.1171H. doi :10.1038/nature03912. PMID 16121184. S2CID 4404961.(fuente primaria)
- ^ An D, Parsek MR (junio de 2007). "La promesa y el peligro del perfil transcripcional en comunidades de biopelículas". Current Opinion in Microbiology . 10 (3): 292–6. doi :10.1016/j.mib.2007.05.011. PMID 17573234.
- ^ ab Momeni B (junio de 2018). "División del trabajo: cómo los microbios dividen su responsabilidad". Current Biology . 28 (12): R697–R699. Bibcode :2018CBio...28.R697M. doi : 10.1016/j.cub.2018.05.024 . PMID 29920261. S2CID 49315067.
- ^ Caso C, Funke B, Tortora G. Microbiología: una introducción (décima ed.).
- ^ Briandet R, Herry J, Bellon-Fontaine M (agosto de 2001). "Determinación de los componentes de tensión superficial de van der Waals, donador de electrones y aceptor de electrones de biopelículas microbianas estáticas Gram-positivas". Colloids Surf B . 21 (4): 299–310. doi :10.1016/S0927-7765(00)00213-7. PMID 11397632.
- ^ Takahashi H, Suda T, Tanaka Y, Kimura B (junio de 2010). "La hidrofobicidad celular de Listeria monocytogenes implica la adhesión inicial y la formación de biopelículas en la superficie del cloruro de polivinilo". Lett. Appl. Microbiol . 50 (6): 618–25. doi : 10.1111/j.1472-765X.2010.02842.x . PMID 20438621. S2CID 24880220.
- ^ "7: Archaea". Biology LibreTexts . 6 de febrero de 2018. Archivado desde el original el 23 de septiembre de 2020 . Consultado el 10 de agosto de 2020 .
- ^ Madigan M (2019). Biología de microorganismos de Brock (decimoquinta edición global). Pearson. pág. 86. ISBN 978-1-292-23510-3.
- ^ ab Wang F, Cvirkaite-Krupovic V, Krupovic M, Egelman EH (junio de 2022). "Los pili arqueales de Pyrobaculum calidifontis revelan similitudes entre las biopelículas arqueales y bacterianas". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 119 (26): e2207037119. Bibcode :2022PNAS..11907037W. doi : 10.1073/pnas.2207037119 . PMC 9245690 . PMID 35727984.
- ^ "Golden Dome Cave" Archivado el 13 de diciembre de 2022 en Wayback Machine . Servicio de Parques Nacionales. 6 de noviembre de 2021. Consultado el 11 de febrero de 2024.
- ^ abc Donlan RM (2002). "Biofilms: vida microbiana en superficies". Enfermedades infecciosas emergentes . 8 (9): 881–890. doi :10.3201/eid0809.020063. PMC 2732559 . PMID 12194761.
- ^ Li S, Liu SY, Chan SY, Chua SL (enero de 2022). "La matriz de biopelícula oculta los quimioatrayentes de detección de quórum bacteriano para evitar la detección de depredadores". The ISME Journal . 16 (5): 1388–1396. Bibcode :2022ISMEJ..16.1388L. doi :10.1038/s41396-022-01190-2. PMC 9038794 . PMID 35034106.
- ^ Ciofu O, Tolker-Nielsen T (2019). "Tolerancia y resistencia de las biopelículas de Pseudomonas aeruginosa a los agentes antimicrobianos: cómo P. aeruginosa puede escapar de los antibióticos". Frontiers in Microbiology . 10 : 913. doi : 10.3389/fmicb.2019.00913 . PMC 6509751 . PMID 31130925.
- ^ Sakuragi Y, Kolter R (julio de 2007). "Regulación por detección de quórum de los genes de la matriz del biofilm (pel) de Pseudomonas aeruginosa". Journal of Bacteriology . 189 (14): 5383–6. doi : 10.1128/JB.00137-07 . PMC 1951888 . PMID 17496081.
- ^ ab Rapacka-Zdonczyk A, Wozniak A, Nakonieczna J, Grinholc M (febrero de 2021). "Desarrollo de la tolerancia al fototratamiento antimicrobiano: por qué importa la metodología". Revista internacional de ciencias moleculares . 22 (4). MDPI AG: 2224. doi : 10.3390/ijms22042224 . PMC 7926562 . PMID 33672375.
 El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional Archivada el 16 de octubre de 2017 en Wayback Machine .
El material fue copiado de esta fuente, que está disponible bajo una Licencia Creative Commons Atribución 4.0 Internacional Archivada el 16 de octubre de 2017 en Wayback Machine . - ^ Hall CW, Mah TF (mayo de 2017). "Mecanismos moleculares de resistencia y tolerancia a antibióticos basados en biopelículas en bacterias patógenas". FEMS Microbiology Reviews . 41 (3). Oxford University Press (OUP): 276–301. doi : 10.1093/femsre/fux010 . PMID 28369412.
- ^ O'Toole G, Kaplan HB, Kolter R (2000). "Formación de biopelículas como desarrollo microbiano". Revisión anual de microbiología . 54 : 49–79. doi : 10.1146/annurev.micro.54.1.49 . PMID 11018124.
- ^ ab Monroe D (noviembre de 2007). "Buscando grietas en la armadura de las biopelículas bacterianas". PLOS Biology . 5 (11): e307. doi : 10.1371/journal.pbio.0050307 . PMC 2071939 . PMID 18001153.
- ^ Kaplan JB, Ragunath C, Ramasubbu N, Fine DH (agosto de 2003). "Desprendimiento de células de biofilm de Actinobacillus actinomycetemcomitans por una actividad beta-hexosaminidasa endógena". Journal of Bacteriology . 185 (16): 4693–8. doi :10.1128/JB.185.16.4693-4698.2003. PMC 166467 . PMID 12896987.
- ^ Izano EA, Amarante MA, Kher WB, Kaplan JB (enero de 2008). "Funciones diferenciales del polisacárido de superficie de poli-N-acetilglucosamina y el ADN extracelular en biopelículas de Staphylococcus aureus y Staphylococcus epidermidis". Applied and Environmental Microbiology . 74 (2): 470–6. Bibcode :2008ApEnM..74..470I. doi :10.1128/AEM.02073-07. PMC 2223269 . PMID 18039822.
- ^ Kaplan JB, Ragunath C, Velliyagounder K, Fine DH, Ramasubbu N (julio de 2004). "Desprendimiento enzimático de biopelículas de Staphylococcus epidermidis". Agentes antimicrobianos y quimioterapia . 48 (7): 2633–6. doi :10.1128 / AAC.48.7.2633-2636.2004. PMC 434209. PMID 15215120.
- ^ Xavier JB, Picioreanu C, Rani SA, van Loosdrecht MC, Stewart PS (diciembre de 2005). "Estrategias de control de biopelículas basadas en la disrupción enzimática de la matriz de sustancias poliméricas extracelulares: un estudio de modelado". Microbiología . 151 (Pt 12): 3817–32. doi : 10.1099/mic.0.28165-0 . PMID 16339929.
- ^ Davies DG, Marques CN (marzo de 2009). "Un mensajero de ácidos grasos es responsable de inducir la dispersión en biopelículas microbianas". Journal of Bacteriology . 191 (5): 1393–403. doi :10.1128/JB.01214-08. PMC 2648214 . PMID 19074399.
- ^ Barraud N, Hassett DJ, Hwang SH, Rice SA, Kjelleberg S, Webb JS (2006). "Participación del óxido nítrico en la dispersión de biopelículas de Pseudomonas aeruginosa". Journal of Bacteriology . 188 (21): 7344–7353. doi :10.1128/jb.00779-06. PMC 1636254 . PMID 17050922.
- ^ Barraud N, Storey MV, Moore ZP, Webb JS, Rice SA, Kjelleberg S (2009). "Dispersión mediada por óxido nítrico en biopelículas de una o varias especies de microorganismos clínica e industrialmente relevantes". Microbial Biotechnology . 2 (3): 370–378. doi :10.1111/j.1751-7915.2009.00098.x. PMC 3815757 . PMID 21261931.
- ^ "Dispersión de biopelículas en fibrosis quística mediante óxido nítrico en dosis bajas". Universidad de Southampton. Archivado desde el original el 8 de diciembre de 2013. Consultado el 20 de enero de 2012 .
- ^ ab Chua SL, Liu Y, Yam JK, Tolker-Nielsen T, Kjelleberg S, Givskov M, et al. (2014). "Las células dispersas representan una etapa distinta en la transición de la biopelícula bacteriana a los estilos de vida planctónicos". Nature Communications . 5 : 4462. Bibcode :2014NatCo...5.4462C. doi : 10.1038/ncomms5462 . PMID 25042103.
- ^ Chua SL, Hultqvist LD, Yuan M, Rybtke M, Nielsen TE, Givskov M, et al. (agosto de 2015). "Generación y caracterización in vitro e in vivo de células dispersas en biopelículas de Pseudomonas aeruginosa mediante manipulación de c-di-GMP". Nat Protoc . 10 (8): 1165–80. doi :10.1038/nprot.2015.067. hdl : 10356/84100 . PMID 26158442. S2CID 20235088.
- ^ ab Ma Y, Deng Y, Hua H, Khoo BL, Chua SL (agosto de 2023). "Dinámica de poblaciones bacterianas distintas y diseminación de enfermedades después de la dispersión y desmontaje de biopelículas". The ISME Journal . 17 (8): 1290–1302. Bibcode :2023ISMEJ..17.1290M. doi :10.1038/s41396-023-01446-5. PMC 10356768 . PMID 37270584.
- ^ Nadell CD, Xavier JB, Foster KR (enero de 2009). "La sociobiología de las biopelículas". FEMS Microbiology Reviews . 33 (1): 206–24. doi : 10.1111/j.1574-6976.2008.00150.x . PMID 19067751.
- ^ abcd Rybtke M, Hultqvist LD, Givskov M, Tolker-Nielsen T (noviembre de 2015). "Infecciones por biopelículas de Pseudomonas aeruginosa: estructura de la comunidad, tolerancia a los antimicrobianos y respuesta inmunitaria". Journal of Molecular Biology . 427 (23): 3628–45. doi :10.1016/j.jmb.2015.08.016. PMID 26319792.
- ^ Danese PN, Pratt LA, Kolter R (junio de 2000). "La producción de exopolisacáridos es necesaria para el desarrollo de la arquitectura de la biopelícula de Escherichia coli K-12". Journal of Bacteriology . 182 (12): 3593–6. doi :10.1128/jb.182.12.3593-3596.2000. PMC 101973 . PMID 10852895.
- ^ Branda SS, Chu F, Kearns DB, Losick R, Kolter R (febrero de 2006). "Un componente proteico importante de la matriz del biofilm de Bacillus subtilis". Microbiología molecular . 59 (4): 1229–38. doi : 10.1111/j.1365-2958.2005.05020.x . PMID 16430696. S2CID 3041295.
- ^ Choong FX, Bäck M, Fahlén S, Johansson LB, Melican K, Rhen M, et al. (23 de noviembre de 2016). "Biopelículas de Salmonella utilizando oligotiofenos luminiscentes". npj Biofilms and Microbiomes . 2 : 16024. doi :10.1038/npjbiofilms.2016.24. PMC 5515270 . PMID 28721253.
- ^ Flemming HC, Wingender J, Szewzyk U, Steinberg P, Rice SA, Kjelleberg S (agosto de 2016). "Biopelículas: una forma emergente de vida bacteriana". Nature Reviews. Microbiología . 14 (9): 563–75. doi :10.1038/nrmicro.2016.94. PMID 27510863. S2CID 4384131.
- ^ Stoodley P, Debeer D, Lewandowski Z (agosto de 1994). "Flujo de líquido en sistemas de biopelícula". Microbiología aplicada y ambiental . 60 (8): 2711–6. Bibcode :1994ApEnM..60.2711S. doi :10.1128/aem.60.8.2711-2716.1994. PMC 201713 . PMID 16349345.
- ^ Vlamakis H, Aguilar C, Losick R, Kolter R (abril de 2008). "Control del destino celular mediante la formación de una comunidad bacteriana arquitectónicamente compleja". Genes & Development . 22 (7): 945–53. doi :10.1101/gad.1645008. PMC 2279205 . PMID 18381896.
- ^ Stewart PS, Costerton JW (julio de 2001). "Resistencia a los antibióticos de las bacterias en biopelículas". Lancet . 358 (9276): 135–8. doi :10.1016/S0140-6736(01)05321-1. PMID 11463434. S2CID 46125592.
- ^ Pandey R, Mishra SK, Shrestha A (2021). "Caracterización de los patógenos ESKAPE con especial referencia a la resistencia a múltiples fármacos y la producción de biopelículas en un hospital nepalí". Infect Drug Resist . 14 : 2201–2212. doi : 10.2147/IDR.S306688 . PMC 8214009 . PMID 34163185.
- ^ abcdef Del Pozo JL, Rouse MS, Patel R (septiembre de 2008). "Efecto bioeléctrico y biopelículas bacterianas. Una revisión sistemática". The International Journal of Artificial Organs . 31 (9): 786–795. doi :10.1177/039139880803100906. PMC 3910516 . PMID 18924090.
- ^ ab Chimileski S, Franklin MJ, Papke RT (agosto de 2014). "Las biopelículas formadas por la arqueona Haloferax volcanii exhiben diferenciación celular y motilidad social, y facilitan la transferencia horizontal de genes". BMC Biology . 12 : 65. doi : 10.1186/s12915-014-0065-5 . PMC 4180959 . PMID 25124934.
- ^ Molin S, Tolker-Nielsen T (junio de 2003). "La transferencia de genes se produce con mayor eficiencia en las biopelículas e induce una mayor estabilización de la estructura de la biopelícula". Current Opinion in Biotechnology . 14 (3): 255–61. doi :10.1016/S0958-1669(03)00036-3. PMID 12849777.
- ^ Jakubovics NS, Shields RC, Rajarajan N, Burgess JG (diciembre de 2013). "Vida después de la muerte: el papel crítico del ADN extracelular en las biopelículas microbianas". Letters in Applied Microbiology . 57 (6): 467–75. doi : 10.1111/lam.12134 . PMID 23848166. S2CID 206168952.
- ^ Spoering AL, Lewis K (diciembre de 2001). "Las biopelículas y las células planctónicas de Pseudomonas aeruginosa tienen una resistencia similar a la eliminación por antimicrobianos". Journal of Bacteriology . 183 (23): 6746–51. doi :10.1128/JB.183.23.6746-6751.2001. PMC 95513 . PMID 11698361.
- ^ "Introducción a las biopelículas: efectos deseables e indeseables de las biopelículas". Archivado desde el original el 22 de junio de 2008.(fuente primaria)
- ^ Andersen PC, Brodbeck BV, Oden S, Shriner A, Leite B (septiembre de 2007). "Influencia de la química del fluido xilemático en el crecimiento planctónico, la formación de biopelículas y la agregación de Xylella fastidiosa". FEMS Microbiology Letters . 274 (2): 210–7. doi : 10.1111/j.1574-6968.2007.00827.x . PMID 17610515.
- ^ "Procesos de tratamiento biológico de aguas residuales; tratamiento secundario". Universidad de Staffordshire. Archivado desde el original el 18 de abril de 2011. Consultado el 13 de diciembre de 2019 .
- ^ Centro de Tecnología de Agua y Saneamiento Asequible, Manual del filtro de bioarena: diseño, construcción e instalación", julio de 2007.
- ^ "Filtración lenta con arena" (PDF) . Resumen técnico . 14 . Morgantown, WV: National Drinking Water Clearinghouse (EE. UU.). Junio de 2000. Archivado desde el original (PDF) el 6 de abril de 2016.
- ^ Kloepper JW (1988). "Rizobacterias promotoras del crecimiento de plantas en canola (colza)". Enfermedades de las plantas . 72 (1): 42. doi :10.1094/pd-72-0042. ISSN 0191-2917.
- ^ abcd Nihorimbere V, Cawoy H, Seyer A, Brunelle A, Thonart P, Ongena M (enero de 2012). "Impacto de los factores de la rizosfera en la firma de lipopéptidos cíclicos de la cepa beneficiosa para las plantas Bacillus amyloliquefaciens S499". FEMS Microbiology Ecology . 79 (1): 176–91. Bibcode :2012FEMME..79..176N. doi : 10.1111/j.1574-6941.2011.01208.x . PMID 22029651.
- ^ Choudhary DK, Johri BN (septiembre de 2009). "Interacciones de Bacillus spp. y plantas, con especial referencia a la resistencia sistémica inducida (ISR)". Investigación microbiológica . 164 (5): 493–513. doi : 10.1016/j.micres.2008.08.007 . PMID 18845426.
- ^ ab van Loon LC (5 de junio de 2007). "Respuestas de las plantas a las rizobacterias promotoras del crecimiento de las plantas". Revista Europea de Patología Vegetal . 119 (3): 243–254. Bibcode :2007EJPP..119..243V. doi : 10.1007/s10658-007-9165-1 . ISSN 0929-1873.
- ^ abcde Van Wees SC, Van der Ent S, Pieterse CM (agosto de 2008). "Respuestas inmunes de las plantas desencadenadas por microbios beneficiosos". Current Opinion in Plant Biology . 11 (4): 443–8. Bibcode :2008COPB...11..443V. doi :10.1016/j.pbi.2008.05.005. hdl : 1874/30010 . PMID 18585955. S2CID 25880745.
- ^ Holguin G, Bashan Y (diciembre de 1996). "La fijación de nitrógeno por Cd de Azospirillum brasilense se promueve cuando se cultiva conjuntamente con una bacteria de la rizosfera de manglares (Staphylococcus sp.)". Soil Biology and Biochemistry . 28 (12): 1651–1660. Bibcode :1996SBiBi..28.1651H. doi :10.1016/s0038-0717(96)00251-9. ISSN 0038-0717.
- ^ Babalola OO (noviembre de 2010). "Bacterias beneficiosas de importancia agrícola". Biotechnology Letters . 32 (11): 1559–70. doi :10.1007/s10529-010-0347-0. PMID 20635120. S2CID 13518392.
- ^ Bakker PA, Pieterse CM, van Loon LC (febrero de 2007). "Resistencia sistémica inducida por Pseudomonas spp. fluorescentes". Fitopatología . 97 (2): 239–43. doi : 10.1094/phyto-97-2-0239 . PMID 18944381.
- ^ Bent E (2006). "Resistencia sistémica inducida mediada por rizobacterias promotoras del crecimiento de las plantas (PGPR) y hongos (PGPF)". Resistencia sistémica inducida y multigénica en plantas . Springer US. págs. 225–258. doi :10.1007/0-387-23266-4_10. ISBN 978-0-387-23265-2.
- ^ Lynch JM, Brimecombe MJ, De Leij FA (21 de agosto de 2001), "Rhizosphere", eLS , John Wiley & Sons, Ltd, doi :10.1038/npg.els.0000403, ISBN 0-470-01617-5
- ^ Randal Bollinger R, Barbas AS, Bush EL, Lin SS, Parker W (diciembre de 2007). "Las biopelículas en el intestino grueso sugieren una función aparente del apéndice vermiforme humano". Journal of Theoretical Biology . 249 (4): 826–31. Bibcode :2007JThBi.249..826R. doi :10.1016/j.jtbi.2007.08.032. PMID 17936308.
- ^ Buret AG, Motta JP, Allain T, Ferraz J, Wallace JL (enero de 2019). "Liberación de patobiontes de las biopelículas de la microbiota intestinal disbiótica en enfermedades inflamatorias intestinales: ¿un papel para el hierro?". Journal of Biomedical Science . 26 (1): 1. doi : 10.1186/s12929-018-0495-4 . PMC 6317250 . PMID 30602371.
- ^ Characklis WG, Nevimons MJ, Picologlou BF (1981). "Influencia de las biopelículas contaminantes en la transferencia de calor". Ingeniería de transferencia de calor . 3 (1): 23–37. Código Bibliográfico :1981HTrEn...3...23C. doi :10.1080/01457638108939572. Archivado desde el original el 19 de agosto de 2022 . Consultado el 19 de diciembre de 2022 .
- ^ Schwermer CU, Lavik G, Abed RM, Dunsmore B, Ferdelman TG, Stoodley P, et al. (mayo de 2008). "Impacto del nitrato en la estructura y función de las comunidades de biopelículas bacterianas en tuberías utilizadas para la inyección de agua de mar en yacimientos petrolíferos". Microbiología aplicada y ambiental . 74 (9): 2841–51. Bibcode :2008ApEnM..74.2841S. doi :10.1128/AEM.02027-07. PMC 2394879 . PMID 18344353.
- ^ Chandki R, Banthia P, Banthia R (abril de 2011). "Biofilms: Un hogar microbiano". Revista de la Sociedad India de Periodontología . 15 (2): 111–4. doi : 10.4103/0972-124X.84377 . PMC 3183659 . PMID 21976832.
- ^ Augustin M, Chifiriuc CB, Lazăr V, Stănescu R, Burlibașa M, Ispas DC (diciembre de 2010). "Biopelículas microbianas en odontología en referencia a la rehabilitación implantoprotésica". Revista de Chirurgie Oro-maxilo-facială și Implantologie (en rumano). 1 (1): 9–13. ISSN 2069-3850. 8 . Consultado el 3 de junio de 2012 .[ enlace muerto permanente ] (la página web tiene un botón de traducción)
- ^ Marquis RE (septiembre de 1995). "Metabolismo del oxígeno, estrés oxidativo y fisiología ácido-base de las biopelículas de placa dental". Journal of Industrial Microbiology . 15 (3): 198–207. doi : 10.1007/bf01569826 . PMID 8519478. S2CID 19959528.
- ^ abc Lemos JA, Abranches J, Burne RA (enero de 2005). "Respuestas de los estreptococos cariogénicos a las tensiones ambientales" (PDF) . Current Issues in Molecular Biology . 7 (1): 95–107. PMID 15580782. Archivado desde el original (PDF) el 7 de abril de 2014. Consultado el 3 de abril de 2014 .
- ^ Tamm C, Hodes ME, Chargaff E (marzo de 1952). "La formación de ácido apurínico a partir del ácido desoxirribonucleico del timo de ternera". The Journal of Biological Chemistry . 195 (1): 49–63. doi : 10.1016/S0021-9258(19)50874-2 . PMID 14938354.
- ^ Freese EB (abril de 1961). "Transiciones y transversiones inducidas por agentes depurinantes". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 47 (4): 540–5. Bibcode :1961PNAS...47..540B. doi : 10.1073/pnas.47.4.540 . PMC 221484 . PMID 13701660.
- ^ ab Pennwell, "Tecnología de cepillos de dientes, dentífricos y eliminación de biopelículas dentales". Academia Dental de Educación Física Consultado el 12 de enero de 2022
- ^ Fejerskov O (2015). Patología de la caries dental. En: Caries dental: la enfermedad y su manejo clínico . Oxford (Reino Unido): Wiley Blackwell. págs. 7–9. ISBN 978-1-4051-3889-5.
- ^ ab Li YH, Lau PC, Lee JH, Ellen RP, Cvitkovitch DG (febrero de 2001). "Transformación genética natural de Streptococcus mutans que crece en biopelículas". J. Bacteriol . 183 (3): 897–908. doi :10.1128/JB.183.3.897-908.2001. PMC 94956 . PMID 11208787.
- ^ Senadheera D, Cvitkovitch DG (2008). "Detección de quórum y formación de biopelículas por Streptococcus mutans". Transducción de señales bacterianas: redes y dianas farmacológicas . Avances en medicina y biología experimental. Vol. 631. págs. 178–88. doi :10.1007/978-0-387-78885-2_12. ISBN. 978-0-387-78884-5. Número de identificación personal 18792689.
- ^ ab Michod RE, Bernstein H, Nedelcu AM (mayo de 2008). "Valor adaptativo del sexo en patógenos microbianos". Infect. Genet. Evol . 8 (3): 267–85. Bibcode :2008InfGE...8..267M. doi :10.1016/j.meegid.2008.01.002. PMID 18295550.http://www.hummingbirds.arizona.edu/Faculty/Michod/Downloads/IGE%20review%20sex.pdf Archivado el 11 de mayo de 2020 en Wayback Machine .
- ^ Atkinson S, Goldstone RJ, Joshua GW, Chang CY, Patrick HL, Cámara M, et al. (enero de 2011). "El desarrollo de biopelículas en Caenorhabditis elegans por Yersinia se ve facilitado por la represión dependiente de la detección de quórum de la secreción de tipo III". PLOS Pathogens . 7 (1): e1001250. doi : 10.1371/journal.ppat.1001250 . PMC 3017118 . PMID 21253572.
- ^ Chan SY, Liu SY, Seng Z, Chua SL (septiembre de 2020). "La matriz de biopelícula altera la motilidad y el comportamiento depredador de los nematodos". The ISME Journal . 15 (1): 260–269. doi :10.1038/s41396-020-00779-9. PMC 7852553 . PMID 32958848.
- ^ Li S, Liu SY, Chan SY, Chua SL (mayo de 2022). "La matriz de biopelícula oculta los quimioatrayentes de detección de quórum bacteriano para evitar la detección de depredadores". The ISME Journal . 16 (5): 1388–1396. Bibcode :2022ISMEJ..16.1388L. doi :10.1038/s41396-022-01190-2. PMC 9038794 . PMID 35034106.
- ^ Abee T, Kovács AT, Kuipers OP, van der Veen S (abril de 2011). "Formación y dispersión de biopelículas en bacterias Gram-positivas" (PDF) . Current Opinion in Biotechnology . 22 (2): 172–9. doi :10.1016/j.copbio.2010.10.016. hdl : 11370/999da2a4-d509-471b-bab5-085dac6ff681 . PMID: 21109420. S2CID: 22024410. Archivado (PDF) del original el 23 de julio de 2018. Consultado el 21 de diciembre de 2018 .
- ^ Rossi F, De Philippis R (abril de 2015). "El papel de los exopolisacáridos de las cianobacterias en biopelículas fototróficas y en tapetes microbianos complejos". Life . 5 (2): 1218–38. Bibcode :2015Life....5.1218R. doi : 10.3390/life5021218 . PMC 4500136 . PMID 25837843.
- ^ ab Danhorn T, Fuqua C (2007). "Formación de biopelículas por bacterias asociadas a plantas". Revisión anual de microbiología . 61 : 401–22. doi :10.1146/annurev.micro.61.080706.093316. PMID 17506679.
- ^ ab Joubert LM, Wolfaardt GM, Botha A (agosto de 2006). "Los exopolímeros microbianos vinculan al depredador y a la presa en un sistema de biopelícula de levadura modelo". Microb. Ecol . 52 (2): 187–97. Bibcode :2006MicEc..52..187J. doi :10.1007/s00248-006-9063-7. PMID 16897306. S2CID 20431229.
- ^ ab Van Colen C, Underwood GC, Serôdio J, Paterson DM (2014). "Ecología de las biopelículas microbianas intermareales: mecanismos, patrones y futuras necesidades de investigación". Journal of Sea Research . 92 : 2–5. Bibcode :2014JSR....92....2V. doi :10.1016/j.seares.2014.07.003.
- ^ ab Aslam SN, Cresswell-Maynard T, Thomas DN, Underwood GJ (diciembre de 2012). "Producción y caracterización de los carbohidratos intracelulares y extracelulares y sustancias poliméricas (EPS) de tres especies de diatomeas del hielo marino, y evidencia de un papel crioprotector para las EPS". J. Phycol . 48 (6): 1494–509. Bibcode :2012JPcgy..48.1494A. doi : 10.1111/jpy.12004 . PMID 27009999. S2CID 9226690.
- ^ "Investigación sobre biopelículas microbianas (PA-03-047)". NIH, Instituto Nacional del Corazón, los Pulmones y la Sangre. 20 de diciembre de 2002. Archivado desde el original el 10 de diciembre de 2006. Consultado el 12 de octubre de 2006 .
- ^ Rogers A (2008). Microbiología oral molecular . Caister Academic Press. págs. 88-91. ISBN. 978-1-904455-24-0.
- ^ Imamura Y, Chandra J, Mukherjee PK, Lattif AA, Szczotka-Flynn LB, Pearlman E, et al. (enero de 2008). "Biopelículas de Fusarium y Candida albicans en lentes de contacto blandas: desarrollo de modelos, influencia del tipo de lente y susceptibilidad a las soluciones para el cuidado de las lentes". Agentes antimicrobianos y quimioterapia . 52 (1): 171–82. doi :10.1128/AAC.00387-07. PMC 2223913. PMID 17999966 .
- ^ Capoor MN, Ruzicka F, Schmitz JE, James GA, Machackova T, Jancalek R, et al. (3 de abril de 2017). "La biopelícula de Propionibacterium acnes está presente en los discos intervertebrales de pacientes sometidos a microdiscectomía". PLOS ONE . 12 (4): e0174518. Bibcode :2017PLoSO..1274518C. doi : 10.1371/journal.pone.0174518 . PMC 5378350 . PMID 28369127.
- ^ Lewis K (abril de 2001). "El enigma de la resistencia de las biopelículas". Agentes antimicrobianos y quimioterapia . 45 (4): 999–1007. doi :10.1128/AAC.45.4.999-1007.2001. PMC 90417. PMID 11257008 .
- ^ Parsek MR, Singh PK (2003). "Biopelículas bacterianas: un vínculo emergente con la patogénesis de enfermedades". Revisión anual de microbiología . 57 : 677–701. doi :10.1146/annurev.micro.57.030502.090720. PMID 14527295.
- ^ ab Agarwal A, Mooney M, Agarwal AG, Jayaswal D, Saakyan G, Goel V, et al. (2020). "Alta prevalencia de biopelículas en implantes recuperados de casos de pseudoartrosis aséptica". Cirugía de columna e investigación relacionada . 5 (2): 104–108. doi : 10.22603/ssrr.2020-0147 . PMC 8026210 . PMID 33842718.
- ^ ab Curran N (20 de noviembre de 2020). "Nuevo estudio, el primero en capturar visualmente la arquitectura de la biopelícula en implantes recuperados de pacientes vivos". Spinal News International . Archivado desde el original el 23 de noviembre de 2020. Consultado el 24 de noviembre de 2020 .
- ^ "biofilm". 22 de diciembre de 2020. Archivado desde el original el 22 de enero de 2021 . Consultado el 22 de diciembre de 2020 .
- ^ Davis SC, Ricotti C, Cazzaniga A, Welsh E, Eaglstein WH, Mertz PM (2008). "Evidencia microscópica y fisiológica de colonización de heridas asociada a biopelículas in vivo". Reparación y regeneración de heridas . 16 (1): 23–9. doi :10.1111/j.1524-475X.2007.00303.x. PMID 18211576. S2CID 205669081.
- ^ Vyas KS, Wong LK (enero de 2016). "Detección de biopelícula en heridas como indicador temprano de riesgo de infección tisular y cronicidad de heridas". Anales de cirugía plástica . 76 (1): 127–31. doi :10.1097/SAP.0000000000000440. PMID 25774966. S2CID 42078581.
- ^ Sanclement J, Webster P, Thomas J, Ramadan H (2005). "Biopelículas bacterianas en muestras quirúrgicas de pacientes con rinosinusitis crónica". The Laryngoscope . 115 (4): 578–82. doi :10.1097/01.mlg.0000161346.30752.18. PMID 15805862. S2CID 25830188.
- ^ Sanderson AR, Leid JG, Hunsaker D (julio de 2006). "Biopelículas bacterianas en la mucosa sinusal de sujetos humanos con rinosinusitis crónica". The Laryngoscope . 116 (7): 1121–6. doi : 10.1097/01.mlg.0000221954.05467.54 . PMID 16826045. S2CID 24785016.
- ^ Leevy WM, Gammon ST, Jiang H, Johnson JR, Maxwell DJ, Jackson EN, et al. (diciembre de 2006). "Imágenes ópticas de infecciones bacterianas en ratones vivos utilizando una sonda molecular fluorescente de infrarrojo cercano". Journal of the American Chemical Society . 128 (51): 16476–7. doi :10.1021/ja0665592. PMC 2531239 . PMID 17177377.
- ^ Kaplan JB, Izano EA, Gopal P, Karwacki MT, Kim S, Bose JL, et al. (2012). "Niveles bajos de antibióticos β-lactámicos inducen la liberación de ADN extracelular y la formación de biopelículas en Staphylococcus aureus". mBio . 3 (4): e00198-12. doi :10.1128/mBio.00198-12. PMC 3419523 . PMID 22851659.
- ^ Ibrahim AM (2015). La tragedia de los comunes y el dilema del prisionero pueden mejorar nuestra comprensión de la teoría de la vida y brindarnos métodos terapéuticos avanzados (Informe). doi :10.13140/RG.2.1.2327.9842.
- ^ Ciofu O, Tolker-Nielsen T, Jensen PØ, Wang H, Høiby N (mayo de 2015). "Resistencia a los antimicrobianos, infecciones del tracto respiratorio y papel de las biopelículas en las infecciones pulmonares en pacientes con fibrosis quística". Advanced Drug Delivery Reviews . 85 : 7–23. doi :10.1016/j.addr.2014.11.017. PMID 25477303.
- ^ Whitchurch CB, Tolker-Nielsen T, Ragas PC, Mattick JS (febrero de 2002). "ADN extracelular necesario para la formación de biopelículas bacterianas". Science . 295 (5559): 1487. doi :10.1126/science.295.5559.1487. PMID 11859186.
- ^ Sen CK, Gordillo GM, Roy S, Kirsner R, Lambert L, Hunt TK, et al. (noviembre de 2009). "Heridas en la piel humana: una amenaza importante y creciente para la salud pública y la economía". Reparación y regeneración de heridas . 17 (6): 763–771. doi :10.1111/j.1524-475X.2009.00543.x. PMC 2810192 . PMID 19903300.
- ^ Singh PK, Parsek MR, Greenberg EP, Welsh MJ (mayo de 2002). "Un componente de la inmunidad innata previene el desarrollo de biopelículas bacterianas". Nature . 417 (6888): 552–555. Bibcode :2002Natur.417..552S. doi :10.1038/417552a. PMID 12037568. S2CID 4423528.
- ^ Oggioni MR, Trappetti C, Kadioglu A, Cassone M, Iannelli F, Ricci S, et al. (septiembre de 2006). "Cambio de vida planctónica a sésil: un evento importante en la patogénesis neumocócica". Microbiología molecular . 61 (5): 1196–210. doi :10.1111/j.1365-2958.2006.05310.x. PMC 1618759 . PMID 16925554.
- ^ Wei H, Håvarstein LS (agosto de 2012). "El fratricidio es esencial para una transferencia de genes eficiente entre neumococos en biopelículas". Appl. Environ. Microbiol . 78 (16): 5897–905. Bibcode :2012ApEnM..78.5897W. doi :10.1128/AEM.01343-12. PMC 3406168 . PMID 22706053.
- ^ Kalsy M, Tonk M, Hardt M, Dobrindt U, Zdybicka-Barabas A, Cytrynska M, et al. (2020). "El péptido antimicrobiano de insectos cecropina A altera las biopelículas de Escherichia coli uropatógenas". npj Biofilms and Microbiomes . 6 (1): 6. doi : 10.1038/s41522-020-0116-3 . PMC 7016129 . PMID 32051417.
- ^ Sturbelle RT, de Avila LF, Roos TB, Borchardt JL, da Conceição R, Dellagostin OA, et al. (noviembre de 2015). "El papel de la detección de quórum en los factores de virulencia de Escherichia coli (ETEC)". Microbiología Veterinaria . 180 (3–4): 245–252. doi :10.1016/j.vetmic.2015.08.015. PMID 26386492.
- ^ Vogeleer P, Tremblay YD, Mafu AA, Jacques M, Harel J (2014). "Vida en el exterior: papel de las biopelículas en la persistencia ambiental de Escherichia coli productora de toxina Shiga". Frontiers in Microbiology . 5 : 317. doi : 10.3389/fmicb.2014.00317 . PMC 4076661 . PMID 25071733.
- ^ Danese PN, Pratt LA, Kolter R (junio de 2000). "La producción de exopolisacáridos es necesaria para el desarrollo de la arquitectura de la biopelícula de Escherichia coli K-12". Journal of Bacteriology . 182 (12): 3593–3596. doi :10.1128/JB.182.12.3593-3596.2000. PMC 101973 . PMID 10852895.
- ^ Niranjan V, Malini A (junio de 2014). "Patrón de resistencia a los antimicrobianos en Escherichia coli que causa infección del tracto urinario entre pacientes hospitalizados". The Indian Journal of Medical Research . 139 (6): 945–948. PMC 4165009 . PMID 25109731.
- ^ Reisner A, Maierl M, Jörger M, Krause R, Berger D, Haid A, et al. (marzo de 2014). "Las fimbrias de tipo 1 contribuyen a las infecciones del tracto urinario asociadas a catéteres causadas por Escherichia coli". Journal of Bacteriology . 196 (5): 931–939. doi :10.1128/JB.00985-13. PMC 3957706 . PMID 24336940.
- ^ Kobayashi SD, Malachowa N, Whitney AR, Braughton KR, Gardner DJ, Long D, et al. (septiembre de 2011). "Análisis comparativo de los determinantes de virulencia de USA300 en un modelo de conejo de infección de piel y tejidos blandos". The Journal of Infectious Diseases . 204 (6): 937–941. doi :10.1093/infdis/jir441. PMC 3156927 . PMID 21849291.
- ^ Kitur K, Parker D, Nieto P, Ahn DS, Cohen TS, Chung S, et al. (abril de 2015). "La necroptosis inducida por toxinas es un mecanismo importante del daño pulmonar causado por Staphylococcus aureus". PLOS Pathogens . 11 (4): e1004820. doi : 10.1371/journal.ppat.1004820 . PMC 4399879 . PMID 25880560.
- ^ Thurlow LR, Hanke ML, Fritz T, Angle A, Aldrich A, Williams SH, et al. (junio de 2011). "Las biopelículas de Staphylococcus aureus previenen la fagocitosis de los macrófagos y atenúan la inflamación in vivo". Journal of Immunology . 186 (11): 6585–6596. doi :10.4049/jimmunol.1002794. PMC 3110737 . PMID 21525381.
- ^ Craft KM, Nguyen JM, Berg LJ, Townsend SD (agosto de 2019). "Staphylococcus aureus resistente a la meticilina (MRSA): resistencia a los antibióticos y fenotipo de biopelícula". MedChemComm . 10 (8): 1231–1241. doi :10.1039/c9md00044e. PMC 6748282 . PMID 31534648.
- ^ Rice SA, Koh KS, Queck SY, Labbate M, Lam KW, Kjelleberg S (2005). "La formación de biopelículas y el desprendimiento en Serratia marcescens están controlados por detección de quórum y señales de nutrientes". Journal of Bacteriology . 187 (10): 3477–3485. doi :10.1128/JB.187.10.3477-3485.2005. PMC 1111991 . PMID 15866935.
- ^ Sethupathy S, Sathiyamoorthi E, Kim Y, Lee J, Lee J (2020). "Propiedades antivirulentas y antibiofilm de los indoles contra Serratia marcescens". Frontiers in Microbiology . 11 . doi : 10.3389/fmicb.2020.584812 . PMC 7662412 . PMID 33193228.
- ^ Lazar V (diciembre de 2011). "Detección de quórum en biopelículas: ¿cómo destruir las ciudadelas bacterianas o su cohesión/poder?". Anaerobe . 17 (6): 280–5. doi :10.1016/j.anaerobe.2011.03.023. PMID 21497662.
- ^ Bjarnsholt T, Jensen PØ, Moser C, Høiby N (2011). Infecciones por biopelículas . Nueva York: Springer. ISBN 978-1-4419-6083-2.OCLC 682907381 .
- ^ abcd Bryers JD (mayo de 2008). "Biopelículas médicas". Biotecnología y bioingeniería . 100 (1): 1–18. doi :10.1002/bit.21838. PMC 2706312 . PMID 18366134.
- ^ Auler ME, Morreira D, Rodrigues FF, Abr Ao MS, Margarido PF, Matsumoto FE, et al. (febrero de 2010). "Formación de biopelículas en dispositivos intrauterinos en pacientes con candidiasis vulvovaginal recurrente". Micología Médica . 48 (1): 211–6. doi : 10.3109/13693780902856626 . PMID 20055746.
- ^ Vuotto C, Longo F, Balice MP, Donelli G, Varaldo PE (septiembre de 2014). "Resistencia a los antibióticos relacionada con la formación de biopelículas en Klebsiella pneumoniae". Patógenos . 3 (3): 743–758. doi : 10.3390/pathogens3030743 . PMC 4243439 . PMID 25438022.
- ^ Santos-Lopez A, Marshall CW, Scribner MR, Snyder DJ, Cooper VS (septiembre de 2019). "Las vías evolutivas hacia la resistencia a los antibióticos dependen de la estructura ambiental y el estilo de vida bacteriano". eLife . 8 : e47612. doi : 10.7554/eLife.47612 . PMC 6814407 . PMID 31516122.
- ^ Pai L, Patil S, Liu S, Wen F (2023). "Un campo de batalla en crecimiento en la guerra contra la resistencia antimicrobiana inducida por biopelículas: perspectivas extraídas de revisiones sobre la resistencia a los antibióticos". Front Cell Infect Microbiol . 13 : 1327069. doi : 10.3389/fcimb.2023.1327069 . PMC 10770264 . PMID 38188636.
- ^ ab Kim YW, Subramanian S, Gerasopoulos K, Ben-Yoav H, Wu HC, Quan D, et al. (2015). "Efecto de la energía eléctrica en la eficacia del tratamiento de biopelículas utilizando el efecto bioeléctrico". npj Biofilms and Microbiomes . 1 : 15016. doi :10.1038/npjbiofilms.2015.16. PMC 5515217 . PMID 28721233.
- ^ Martins dos Santos VA, Yakimov MM, Timmis KN, Golyshin PN (2008). "Información genómica sobre la biodegradación del petróleo en sistemas marinos". En Díaz E (ed.). Biodegradación microbiana: genómica y biología molecular. Horizon Scientific Press. pp. 1971. ISBN 978-1-904455-17-2.
- ^ Wang VB, Chua SL, Cai Z, Sivakumar K, Zhang Q, Kjelleberg S, et al. (marzo de 2014). "Un consorcio microbiano sinérgico estable para la eliminación simultánea de colorantes azoicos y la generación de bioelectricidad". Tecnología de recursos biológicos . 155 : 71–76. Código Bibliográfico :2014BiTec.155...71W. doi :10.1016/j.biortech.2013.12.078. PMID 24434696.
- ^ Wang VB, Chua SL, Cao B, Seviour T, Nesatyy VJ, Marsili E, et al. (2013). "Ingeniería de la vía de biosíntesis de PQS para la mejora de la producción de bioelectricidad en células de combustible microbianas de Pseudomonas aeruginosa". PLOS ONE . 8 (5): e63129. Bibcode :2013PLoSO...863129W. doi : 10.1371/journal.pone.0063129 . PMC 3659106 . PMID 23700414.
- ^ Vera M, Schippers A, Sand W (septiembre de 2013). "Progreso en la biolixiviación: fundamentos y mecanismos de la oxidación bacteriana de sulfuro de metal, parte A". Appl. Microbiol. Biotechnol . 97 (17): 7529–41. doi :10.1007/s00253-013-4954-2. PMID 23720034. S2CID 17677624.
- ^ Chan SY, Wong MW, Kwan BT, Fang JK, Chua SL (12 de octubre de 2022). "Enfoque combinatorio microbiano-enzimático para capturar y liberar microplásticos". Environmental Science & Technology Letters . 9 (11): 975–982. Bibcode :2022EnSTL...9..975C. doi :10.1021/acs.estlett.2c00558. ISSN 2328-8930. S2CID 252892619.
- ^ Liu SY, Leung MM, Fang JK, Chua SL (15 de enero de 2021). "Ingeniería de un mecanismo de 'atrapar y liberar' microbiano para la eliminación de microplásticos". Revista de ingeniería química . 404 : 127079. Bibcode :2021ChEnJ.40427079L. doi :10.1016/j.cej.2020.127079. hdl : 10397/88307 . ISSN 1385-8947. S2CID 224972583.
- ^ abcdefghi Srey S, Jahid ID, Ha SD (junio de 2013). "Formación de biopelículas en las industrias alimentarias: un problema de seguridad alimentaria". Control de alimentos . 31 (2): 572–585. doi :10.1016/j.foodcont.2012.12.001. ISSN 0956-7135.
- ^ T. Tarver, "Biopelículas: una amenaza para la seguridad alimentaria – IFT.org", Ift.org, 2016.
- ^ abcd Kumar CG, Anand SK (junio de 1998). "Importancia de las biopelículas microbianas en la industria alimentaria: una revisión". Revista internacional de microbiología alimentaria . 42 (1–2): 9–27. doi :10.1016/s0168-1605(98)00060-9. PMID 9706794.
- ^ Kwok TY, Ma Y, Chua SL (abril de 2022). "La dispersión de biopelículas inducida por corte mecánico conduce a una mayor diseminación de patógenos transmitidos por los alimentos". Microbiología de los alimentos . 102 : 103914. doi :10.1016/j.fm.2021.103914. hdl : 10397/100037 . PMID 34809940. S2CID 244234814.
- ^ abcd Mizan F (2015). "Biopelículas microbianas en mariscos: un desafío para la higiene alimentaria". Microbiología de los alimentos . 49 : 41–55. doi :10.1016/j.fm.2015.01.009. PMID 25846914.
- ^ De Araujo LV, Abreu F, Lins U, Santa Anna LM, Nitschke M, Freire DM (enero de 2011). "El ramnolípido y la surfactina inhiben la adhesión de Listeria monocytogenes". Investigación alimentaria internacional . 44 (1): 481–488. doi :10.1016/j.foodres.2010.09.002.
- ^ Wang X, Yao X, Zhu Z, Tang T, Dai K, Sadovskaya I, et al. (julio de 2009). "Efecto de la berberina en la formación de biopelículas de Staphylococcus epidermidis". Revista internacional de agentes antimicrobianos . 34 (1): 60–6. doi :10.1016/j.ijantimicag.2008.10.033. PMID 19157797.
- ^ Carvalho DB, Fox EG, Santos DG, Sousa JS, Freire DM, Nogueira FC, et al. (julio de 2019). "Los alcaloides del veneno de las hormigas de fuego inhiben la formación de biopelículas". Toxins . 11 (7): 420. doi : 10.3390/toxins11070420 . PMC 6669452 . PMID 31323790.
- ^ Braithwaite RA, McEvoy LA (2004). "Biogenización marina en piscifactorías y su remediación". Advances in Marine Biology . 47 : 215–252. doi :10.1016/S0065-2881(04)47003-5. ISBN 978-0-12-026148-2. Número de identificación personal 15596168.
- ^ Qian PY, Lau SC, Dahms HU, Dobretsov S, Harder T (2007). "Biopelículas marinas como mediadores de la colonización por macroorganismos marinos: implicaciones para la lucha contra las incrustaciones y la acuicultura". Biotecnología marina . 9 (4): 399–410. Bibcode :2007MarBt...9..399Q. doi :10.1007/s10126-007-9001-9. PMID 17497196. S2CID 7614961.
- ^ Cai W, De La Fuente L, Arias CR (septiembre de 2013). "Formación de biopelículas por el patógeno de peces Flavobacterium columnare: desarrollo y parámetros que afectan la adhesión a la superficie". Applied and Environmental Microbiology . 79 (18): 5633–42. Bibcode :2013ApEnM..79.5633C. doi :10.1128/AEM.01192-13. PMC 3754160 . PMID 23851087.
- ^ King RK, Flick Jr GJ, Pierson D, Smith SA, Boardman GD, Coale Jr CW (2004). "Identificación de patógenos bacterianos en biopelículas de sistemas de acuicultura de recirculación". Revista de tecnología de productos alimenticios acuáticos . 13 (1): 125–133. Código Bibliográfico :2004JAFPT..13a.125K. doi :10.1300/j030v13n01_11. S2CID 83791439.
- ^ Bourne DG, Høj L, Webster NS, Swan J, Hall MR (2006). "Desarrollo de biopelículas dentro de un tanque de crianza de larvas de la langosta tropical, Panulirus ornatus". Acuicultura . 260 (1–4): 27–38. Bibcode :2006Aquac.260...27B. doi :10.1016/j.aquaculture.2006.06.023.
- ^ Wietz M, Hall MR, Høj L (julio de 2009). "Efectos de la ozonización del agua de mar en el desarrollo de biopelículas en tanques de acuicultura". Microbiología sistemática y aplicada . 32 (4): 266–77. Bibcode :2009SyApM..32..266W. doi :10.1016/j.syapm.2009.04.001. PMID 19446976.
- ^ Liu YS, Deng Y, Chen CK, Khoo BL, Chua SL (junio de 2022). "Detección rápida de microorganismos en una plataforma de microfluidos para infecciones de peces". Journal of Hazardous Materials . 431 : 128572. Bibcode :2022JHzM..43128572L. doi :10.1016/j.jhazmat.2022.128572. PMID 35278965. S2CID 247136872.
- ^ Karunasagar I, Pai R, Malathi G (1994). "Mortalidad masiva de larvas de Penaeus monodon debido a infección por Vibrio harveyi resistente a antibióticos". Acuicultura . 128 (3–4): 203–209. Código Bibliográfico :1994Aquac.128..203K. doi :10.1016/0044-8486(94)90309-3.
- ^ Lawrence JR, Korber DR, Hoyle BD, Costerton JW, Caldwell DE (octubre de 1991). "Corte óptico de biopelículas microbianas". Journal of Bacteriology . 173 (20): 6558–67. doi :10.1128/jb.173.20.6558-6567.1991. PMC 208993 . PMID 1917879.
- ^ Cooksey K, Wigglesworth-Cooksey B (1995). "Adhesión de bacterias y diatomeas a superficies en el mar: una revisión". Ecología microbiana acuática . 9 (1): 87–96. doi : 10.3354/ame009087 .
- ^ Fanning S, Mitchell AP (2012). "Biopelículas fúngicas". PLOS Pathog . 8 (4): e1002585. doi : 10.1371/journal.ppat.1002585 . PMC 3320593 . PMID 22496639.
- ^ Chandra J, Kuhn DM, Mukherjee PK, Hoyer LL, McCormick T, Ghannoum MA (septiembre de 2001). "Formación de biopelículas por el patógeno fúngico Candida albicans: desarrollo, arquitectura y resistencia a fármacos". J. Bacteriol . 183 (18): 5385–94. doi :10.1128/jb.183.18.5385-5394.2001. PMC 95423 . PMID 11514524.
- ^ Burmølle M, Kjøller A, Sørenses S (2012). Lear G, Gavin L, Lewis G (eds.). Biopelículas microbianas: investigación y aplicaciones actuales . Horizon Scientific Press. págs. 61–71. ISBN 978-1-904455-96-7.
- ^ Steele DJ, Franklin DJ, Underwood GJ (septiembre de 2014). "Protección de las células frente al estrés salino mediante sustancias poliméricas extracelulares en biopelículas de diatomeas". Bioincrustaciones . 30 (8): 987–98. Bibcode :2014Biofo..30..987S. doi :10.1080/08927014.2014.960859. PMC 4706044 . PMID 25268215.
- ^ Windler M, Leinweber K, Bartulos CR, Philipp B, Kroth PG (abril de 2015). "La formación de biopelículas y cápsulas de la diatomea Achnanthidium minutissimum se ve afectada por una bacteria". J. Phycol . 51 (2): 343–55. Bibcode :2015JPcgy..51..343W. doi :10.1111/jpy.12280. PMID 26986529. S2CID 1446573.
- ^ Buhmann M, Kroth PG, Schleheck D (febrero de 2012). "Comunidades de biopelículas fotoautotróficas-heterotróficas: una incubadora de laboratorio diseñada para el crecimiento de diatomeas y bacterias axénicas en biopelículas de especies mixtas definidas". Environ Microbiol Rep . 4 (1): 133–40. Bibcode :2012EnvMR...4..133B. doi :10.1111/j.1758-2229.2011.00315.x. PMID 23757240.
- ^ Thomas CM, Nielsen KM (septiembre de 2005). "Mecanismos y barreras para la transferencia horizontal de genes entre bacterias". Nature Reviews. Microbiology . 3 (9): 711–721. doi :10.1038/nrmicro1234. PMID 16138099. S2CID 1231127.
- ^ abcdefghi Luo A, Wang F, Sun D, Liu X, Xin B (2022). "Formación, desarrollo e interacciones entre especies en biopelículas". Frontiers in Microbiology . 12 : 757327. doi : 10.3389/fmicb.2021.757327 . PMC 8764401 . PMID 35058893.
- ^ Patkowski JB, Dahlberg T, Amin H, Gahlot DK, Vijayrajratnam S, Vogel JP, et al. (abril de 2023). "La adaptabilidad biomecánica del pilus F acelera la diseminación conjugativa de la resistencia a los antimicrobianos y la formación de biopelículas". Nature Communications . 14 (1): 1879. doi :10.1038/s41467-023-37600-y. PMC 10076315 . PMID 37019921.
- ^ Thomas VC, Hancock LE (septiembre de 2009). "Suicidio y fratricidio en biopelículas bacterianas". The International Journal of Artificial Organs . 32 (9): 537–544. doi :10.1177/039139880903200902. PMID 19851979. S2CID 201969291.
- ^ abcdefghij Abe K, Nomura N, Suzuki S (mayo de 2020). "Biopelículas: puntos críticos de transferencia horizontal de genes (HGT) en entornos acuáticos, con especial atención a un nuevo mecanismo de HGT". FEMS Microbiology Ecology . 96 (5). doi :10.1093/femsec/fiaa031. PMC 7189800 . PMID 32109282.
- ^ Chimileski S, Franklin MJ, Papke RT (agosto de 2014). "Las biopelículas formadas por la arqueona Haloferax volcanii exhiben diferenciación celular y motilidad social, y facilitan la transferencia horizontal de genes". BMC Biology . 12 (1): 65. doi : 10.1186/s12915-014-0065-5 . PMC 4180959 . PMID 25124934.
- ^ Azeredo J, Azevedo NF, Briandet R, Cerca N, Coenye T, Costa AR, et al. (mayo de 2017). "Revisión crítica de los métodos de biopelícula". Critical Reviews in Microbiology . 43 (3): 313–351. doi : 10.1080/1040841X.2016.1208146 . hdl : 1822/45004 . PMID 27868469. S2CID 3991858.
Lectura adicional
- Allison DG (2000). Estructura comunitaria y cooperación en biopelículas . Cambridge, Reino Unido: Cambridge University Press. ISBN 978-0-521-79302-5.
- Lynch JF, Lappin-Scott HM, Costerton JW (2003). Biopelículas microbianas . Cambridge, Reino Unido: Cambridge University Press. ISBN 978-0-521-54212-8.
- Fratamico M (2009). Biopelículas en las industrias de alimentos y bebidas . Woodhead Publishing Limited. ISBN 978-1-84569-477-7.
Enlaces externos
- Una animación TED-ED sobre la biología básica de las biopelículas: Las junglas microbianas por todas partes (y por ti) por Scott Chimileski y Roberto Kolter
- Análisis del espesor, proporción orgánica y mineral de los biofilms para decidir una estrategia de tratamiento
- Archivo de biopelículas de investigación y noticias sobre biopelículas Archivado el 9 de octubre de 2010 en Wayback Machine.
- "¿Por qué sigo enfermo?" - La película, 2012: documental sobre biopelículas: el papel silencioso de las biopelículas en las enfermedades crónicas
- Entrevistas en video HD sobre biopelículas, antibióticos, etc. con expertos, youtube.com: ADRSupport/biofilm

