Hipopituitarismo
| Hipopituitarismo | |
|---|---|
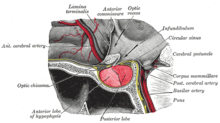 | |
| La glándula pituitaria en una lámina de la Anatomía de Gray (1918). El lóbulo anterior está a la izquierda y el lóbulo posterior a la derecha, ambos en rojo. | |
| Especialidad | Endocrinología |
El hipopituitarismo es la secreción disminuida ( hipo ) de una o más de las ocho hormonas que normalmente produce la glándula pituitaria en la base del cerebro . [1] [2] Si hay una secreción disminuida de una hormona pituitaria específica, la afección se conoce como hipopituitarismo selectivo. [3] Si hay una secreción disminuida de la mayoría o de todas las hormonas pituitarias, se utiliza el término panhipopituitarismo ( pan significa "todas"). [4]
Los signos y síntomas del hipopituitarismo varían, dependiendo de qué hormonas se secretan de forma insuficiente y de la causa subyacente de la anomalía. El diagnóstico de hipopituitarismo se realiza mediante análisis de sangre , pero a menudo se necesitan exploraciones específicas y otras investigaciones para encontrar la causa subyacente, como tumores de la hipófisis, y el tratamiento ideal. La mayoría de las hormonas controladas por las secreciones de la hipófisis se pueden reemplazar con comprimidos o inyecciones. El hipopituitarismo es una enfermedad rara , pero puede estar significativamente infradiagnosticada en personas con traumatismo craneoencefálico previo . [1] La primera descripción de la afección fue realizada en 1914 por el médico alemán Dr. Morris Simmonds . [5]
Signos y síntomas
Las hormonas de la hipófisis tienen diferentes acciones en el cuerpo, y los síntomas del hipopituitarismo dependen, por lo tanto, de qué hormona sea deficiente. Los síntomas pueden ser sutiles y, a menudo, se atribuyen inicialmente a otras causas. [1] [6] En la mayoría de los casos, hay deficiencia de tres o más hormonas. [7] El problema más común es la insuficiencia de la hormona folículo estimulante (FSH) y/o la hormona luteinizante (LH), que conduce a anomalías de las hormonas sexuales . La deficiencia de la hormona del crecimiento es más común en personas con un tumor subyacente que en aquellas con otras causas. [1] [7]
A veces, hay síntomas adicionales que surgen de la causa subyacente; por ejemplo, si el hipopituitarismo se debe a un tumor productor de hormona de crecimiento, puede haber síntomas de acromegalia (agrandamiento de manos y pies, rasgos faciales toscos), y si el tumor se extiende al nervio óptico o al quiasma óptico , puede haber defectos del campo visual . Los dolores de cabeza también pueden acompañar a los tumores pituitarios, [1] así como la apoplejía pituitaria (infarto o hemorragia de un tumor pituitario) y la hipofisitis linfocítica ( inflamación autoinmune de la pituitaria). [8] La apoplejía, además de los dolores de cabeza repentinos y la pérdida visual que empeora rápidamente, también puede estar asociada con visión doble que resulta de la compresión de los nervios en el seno cavernoso adyacente que controla los músculos oculares . [9]
La insuficiencia pituitaria produce muchos cambios en la piel, el cabello y las uñas como resultado de la ausencia de acción de la hormona pituitaria en estos sitios. [10]
Complicaciones
Varias deficiencias hormonales asociadas con el hipopituitarismo pueden conducir a enfermedades secundarias. Por ejemplo, la deficiencia de la hormona del crecimiento se asocia con la obesidad, el colesterol elevado y el síndrome metabólico , y la deficiencia de estradiol puede conducir a la osteoporosis. Si bien el tratamiento eficaz de las deficiencias hormonales subyacentes puede mejorar estos riesgos, a menudo es necesario tratarlas directamente. [6]
Pituitaria anterior

La deficiencia de todas las hormonas de la hipófisis anterior es más común que la deficiencia de hormonas individuales.
La deficiencia de la hormona luteinizante (LH) y la hormona folículo estimulante (FSH), conocidas en conjunto como gonadotropinas , provoca síntomas diferentes en hombres y mujeres. Las mujeres experimentan oligo o amenorrea ( menstruaciones poco frecuentes/ligeras o ausentes respectivamente) e infertilidad . Los hombres pierden vello facial, escrotal y del tronco, además de presentar disminución de la masa muscular y anemia . Ambos sexos pueden experimentar una disminución de la libido y pérdida de la función sexual , y tienen un mayor riesgo de osteoporosis (fragilidad ósea). La falta de LH/FSH en los niños se asocia con un retraso de la pubertad. [1] [6]
La deficiencia de la hormona del crecimiento (GH) provoca una disminución de la masa muscular, obesidad central (aumento de la grasa corporal alrededor de la cintura) y deterioro de la atención y la memoria. Los niños sufren retraso del crecimiento y baja estatura . [1] [6]
La deficiencia de hormona adrenocorticotrópica (ACTH) conduce a una insuficiencia suprarrenal , una falta de producción de glucocorticoides como el cortisol por la glándula suprarrenal . Si el problema es crónico, los síntomas consisten en fatiga , pérdida de peso , retraso del crecimiento (en niños), retraso de la pubertad (en adolescentes), hipoglucemia (niveles bajos de azúcar en sangre), anemia e hiponatremia (niveles bajos de sodio). Si el inicio es abrupto, puede producirse colapso, shock y vómitos . [1] [6] La deficiencia de ACTH es muy similar a la enfermedad de Addison primaria , que es una deficiencia de cortisol como resultado de un daño directo a las glándulas suprarrenales; esta última forma, sin embargo, a menudo conduce a hiperpigmentación de la piel, que no ocurre en la deficiencia de ACTH. [11]
La deficiencia de hormona estimulante de la tiroides (TSH) conduce al hipotiroidismo (falta de producción de tiroxina (T4) y triyodotironina (T3) en la tiroides ). Los síntomas típicos son cansancio, intolerancia al frío , estreñimiento , aumento de peso , caída del cabello y lentitud de pensamiento, así como una frecuencia cardíaca más lenta y presión arterial baja . En los niños, el hipotiroidismo conduce a un retraso del crecimiento y, en formas congénitas extremas, a un síndrome llamado cretinismo . [1] [6]
La prolactina (PRL) desempeña un papel en la lactancia materna , y la incapacidad de amamantar puede indicar niveles anormalmente bajos de prolactina. [8]
Pituitaria posterior
La deficiencia de hormona antidiurética (ADH) conduce al síndrome de diabetes insípida (no relacionada con la diabetes mellitus ): incapacidad para concentrar la orina , lo que lleva a poliuria (producción de grandes cantidades de orina clara) que es baja en solutos , deshidratación y, en compensación, sed extrema y necesidad constante de beber ( polidipsia ), así como hipernatremia (niveles altos de sodio en la sangre). [12] La deficiencia de ADH puede estar enmascarada si hay deficiencia de ACTH, y los síntomas solo aparecen cuando se ha reemplazado el cortisol. [8]
La deficiencia de oxitocina (OXT) generalmente causa pocos síntomas, [1] sin embargo puede conducir a desarrollos sociales anormales debido a su papel complejo como neuropéptido social. [13]
Causas
| Tipo | Causas [1] [6] [8] [14] | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tumores | La mayoría de los casos de hipopituitarismo se deben a adenomas hipofisarios que comprimen el tejido normal de la glándula y, rara vez, a otros tumores cerebrales fuera de la glándula ( craneofaringioma , meningioma , cordoma , ependimoma , glioma o metástasis de cáncer en otras partes del cuerpo). | ||||||||||||||||||
| Infección, inflamación e infiltración. | La hipófisis también puede verse afectada por infecciones del cerebro ( absceso cerebral , meningitis , encefalitis ) o de la propia glándula, o puede estar infiltrada por células anormales ( neurosarcoidosis , histiocitosis ) o por exceso de hierro ( hemocromatosis ). El síndrome de la silla turca vacía es la desaparición inexplicable del tejido hipofisario, probablemente debida a una presión externa. La hipofisitis autoinmune o linfocítica se produce cuando el sistema inmunitario ataca directamente a la hipófisis. | ||||||||||||||||||
| Vascular | A medida que el embarazo llega a su fin , la glándula pituitaria de la mujer embarazada es vulnerable a la presión arterial baja , como puede ser consecuencia de una hemorragia ; el daño hipofisario debido al sangrado después del parto se denomina síndrome de Sheehan . La apoplejía hipofisaria es una hemorragia o infarto (pérdida del suministro de sangre) de la pituitaria. Cada vez se reconocen más otras formas de accidente cerebrovascular como causa de hipopituitarismo. | ||||||||||||||||||
| Radiación | El hipopituitarismo inducido por radiación afecta principalmente a la hormona del crecimiento y a las hormonas gonadales . [15] Por el contrario, las deficiencias de la hormona adrenocorticotrópica (ACTH) y de la hormona estimulante de la tiroides (TSH) son las menos comunes entre las personas con hipopituitarismo inducido por radiación. [15] Los cambios en la secreción de prolactina suelen ser leves y la deficiencia de vasopresina parece ser muy rara como consecuencia de la radiación. [15] | ||||||||||||||||||
| Otros físicos | Las causas físicas externas del hipopituitarismo incluyen traumatismo craneoencefálico , hemorragia subaracnoidea , neurocirugía y radiación ionizante (por ejemplo, radioterapia para un tumor cerebral previo). También se sabe que las mordeduras de víboras de Russell causan hipopituitarismo en aproximadamente el 29 % de los casos. | ||||||||||||||||||
| Congénito | El hipopituitarismo congénito (presente al nacer) puede ser el resultado de complicaciones en torno al parto o puede ser el resultado de un desarrollo insuficiente ( hipoplasia ) de la glándula, a veces en el contexto de anomalías genéticas específicas. Las mutaciones pueden causar un desarrollo insuficiente de la glándula o una disminución de su función. Las formas de deficiencia combinada de la hormona pituitaria ("CPHD") incluyen:
El síndrome de Kallmann causa deficiencia de gonadotropinas únicamente. El síndrome de Bardet-Biedl y el síndrome de Prader-Willi se han asociado con deficiencias de hormonas hipofisarias. |
Fisiopatología
La glándula pituitaria está situada en la base del cerebro y está conectada íntimamente con el hipotálamo . Está formada por dos lóbulos: la hipófisis posterior, que consiste en tejido nervioso que se ramifica desde el hipotálamo, y la hipófisis anterior, que consiste en epitelio productor de hormonas . La hipófisis posterior secreta hormona antidiurética , que regula la osmolaridad de la sangre, y oxitocina , que provoca contracciones del útero en el parto y participa en la lactancia materna . [14]
La hipófisis se desarrolla en la tercera semana de embriogénesis a partir de interacciones entre la parte del diencéfalo del cerebro y la cavidad nasal. Las células cerebrales secretan FGF-8 , Wnt5a y BMP-4 , y las de la cavidad oral, BMP-2 . Juntas, estas señales celulares estimulan a un grupo de células de la cavidad oral para formar la bolsa de Rathke , que se independiza de la cavidad nasal y se desarrolla en la hipófisis anterior; este proceso incluye la supresión de la producción de una proteína llamada Sonic hedgehog por las células de la bolsa de Rathke. [16] Las células luego se diferencian aún más en las diversas células productoras de hormonas de la hipófisis. Esto requiere factores de transcripción particulares que inducen la expresión de genes particulares. Se ha descubierto que algunos de estos factores de transcripción son deficientes en algunas formas de deficiencias hormonales hipofisarias combinadas (CPHD) raras en la infancia. Estos son HESX1 , PROP1 , POU1F1 , LHX3 , LHX4 , TBX19 , SOX2 y SOX3 . Cada factor de transcripción actúa en grupos particulares de células. Por lo tanto, varias mutaciones genéticas están asociadas con deficiencias hormonales específicas. [16] [17] Por ejemplo, las mutaciones de POU1F1 (también conocidas como Pit-1) causan deficiencias específicas en la hormona del crecimiento, prolactina y TSH. [14] [16] [17] Además de la pituitaria, algunos de los factores de transcripción también son necesarios para el desarrollo de otros órganos; por lo tanto, algunas de estas mutaciones también están asociadas con defectos de nacimiento específicos. [16] [17]
| Tiroides | Suprarrenal | Góndolas | Crecimiento | Mamario | |
|---|---|---|---|---|---|
| Hormona liberadora | TRH | CRH | GnRH | GRH-Reino Unido | Dopamina (inhibidor) |
| Células pituitarias | Tirotropo | Corticotropo | Gonadotropo | Somatotropo | Lactotropo |
| Hormona pituitaria | hormona estimulante de tiroides | ACTH | LH y FSH | G.H. | Prolactina |
| Órgano terminal | Tiroides | Suprarrenal | Testículos u ovarios | Hígado | Glándula mamaria |
| Producto | Tiroxina | Cortisol | Testosterona , estradiol | IGF-1 | Leche (sin comentarios) |
La mayoría de las hormonas de la hipófisis anterior forman parte de un eje regulado por el hipotálamo . El hipotálamo secreta una serie de hormonas liberadoras , a menudo según un ritmo circadiano , en los vasos sanguíneos que irrigan la hipófisis anterior ; la mayoría de ellas son estimulantes ( hormona liberadora de tirotropina , hormona liberadora de corticotropina , hormona liberadora de gonadotropina y hormona liberadora de hormona del crecimiento ), aparte de la dopamina , que suprime la producción de prolactina. [18] En respuesta a la tasa de hormona liberadora, la hipófisis anterior produce sus hormonas (TSH, ACTH, LH, FSH, GH) que a su vez estimulan las glándulas hormonales efectoras del cuerpo, mientras que la prolactina (PRL) actúa directamente sobre la glándula mamaria . Una vez que las glándulas efectoras producen suficientes hormonas (tiroxina, cortisol, estradiol o testosterona e IGF-1), tanto el hipotálamo como las células pituitarias detectan su abundancia y reducen su secreción de hormonas estimulantes. Las hormonas de la hipófisis posterior se producen en el hipotálamo y son transportadas por terminaciones nerviosas al lóbulo posterior; su sistema de retroalimentación está, por tanto, ubicado en el hipotálamo, pero un daño en las terminaciones nerviosas aún conduciría a una deficiencia en la liberación de hormonas. [1]
A menos que el daño hipofisario sea causado por un tumor que produce en exceso una hormona en particular, es la falta de hormonas hipofisarias lo que provoca los síntomas descritos anteriormente, y un exceso de una hormona en particular indicaría la presencia de un tumor. La excepción a esta regla es la prolactina: si un tumor comprime el tallo hipofisario , una disminución del suministro de sangre significa que las células lactotropas , que producen prolactina, no están recibiendo dopamina y, por lo tanto, producen un exceso de prolactina. Por lo tanto, las elevaciones leves de prolactina se atribuyen a la compresión del tallo. Sin embargo, los niveles muy altos de prolactina apuntan con más fuerza hacia un prolactinoma (tumor secretor de prolactina). [6] [19]
Diagnóstico

El diagnóstico de hipopituitarismo se realiza mediante análisis de sangre . Para confirmar la presencia de una deficiencia hormonal se utilizan dos tipos de análisis de sangre: los niveles basales, en los que se toman muestras de sangre, generalmente por la mañana, sin ningún tipo de estimulación, y los análisis dinámicos, en los que se toman muestras de sangre después de la inyección de una sustancia estimulante. La medición de ACTH y hormona de crecimiento generalmente requiere una prueba dinámica, mientras que las otras hormonas (LH/FSH, prolactina, TSH) generalmente se pueden analizar con niveles basales. No existe una prueba directa adecuada para los niveles de ADH, pero la deficiencia de ADH se puede confirmar indirectamente; los niveles de oxitocina no se miden de manera rutinaria. [1]
En general, el hallazgo de una combinación de una hormona hipofisaria baja junto con una hormona baja de la glándula efectora es indicativo de hipopituitarismo. [14] Ocasionalmente, la hormona hipofisaria puede ser normal pero la hormona de la glándula efectora puede estar disminuida; en este caso, la pituitaria no responde apropiadamente a los cambios de la hormona efectora, y la combinación de hallazgos todavía es sugestiva de hipopituitarismo. [6]
Pruebas basales
Los niveles de LH/FSH pueden verse suprimidos por un nivel elevado de prolactina y, por lo tanto, no son interpretables a menos que la prolactina sea baja o normal. En los hombres, la combinación de niveles bajos de LH y FSH en combinación con un nivel bajo de testosterona confirma la deficiencia de LH/FSH; un nivel alto de testosterona indicaría una fuente en otra parte del cuerpo (como un tumor secretor de testosterona). En las mujeres, el diagnóstico de deficiencia de LH/FSH depende de si la mujer ha pasado por la menopausia . Antes de la menopausia, los períodos menstruales anormales junto con niveles bajos de estradiol y LH/FSH confirman un problema hipofisario; después de la menopausia (cuando los niveles de LH/FSH están normalmente elevados y los ovarios producen menos estradiol), un nivel inapropiadamente bajo de LH/FSH por sí solo es suficiente. [1] Son posibles las pruebas de estimulación con GnRH, pero no se recomienda su uso. [6] [8]
En el caso de la TSH, las mediciones basales suelen ser suficientes, así como las mediciones de tiroxina para garantizar que la hipófisis no esté simplemente suprimiendo la producción de TSH en respuesta al hipertiroidismo (una glándula tiroides hiperactiva). Una prueba de estimulación con hormona liberadora de tirotropina (TRH) no se considera útil. [8] La prolactina se puede medir por nivel basal y es necesaria para la interpretación de los resultados de LH y FSH, además de la confirmación del hipopituitarismo o el diagnóstico de un tumor secretor de prolactina. [1]
Pruebas de estimulación
La deficiencia de la hormona del crecimiento es casi segura si todas las demás pruebas hipofisarias también son anormales y los niveles del factor de crecimiento similar a la insulina 1 (IGF-1) están disminuidos. Si este no es el caso, los niveles de IGF-1 son poco predictivos de la presencia de deficiencia de GH; entonces se requiere una prueba de estimulación con la prueba de tolerancia a la insulina . Esto se realiza administrando insulina para reducir el azúcar en sangre a un nivel por debajo de 2,2 mmol/L . Una vez que esto ocurre, se miden los niveles de hormona del crecimiento. Si son bajos a pesar del efecto estimulante de los niveles bajos de azúcar en sangre, se confirma la deficiencia de hormona del crecimiento. La prueba no está exenta de riesgos, especialmente en aquellos propensos a convulsiones o se sabe que tienen enfermedad cardíaca , y causa los síntomas desagradables de hipoglucemia . [1] [6] Las pruebas alternativas (como la prueba de estimulación de la hormona liberadora de hormona del crecimiento ) son menos útiles, aunque se puede utilizar una prueba de estimulación con arginina para el diagnóstico, especialmente en situaciones en las que se piensa que una prueba de tolerancia a la insulina es demasiado peligrosa. [20] Si se sospecha deficiencia de GH y todas las demás hormonas pituitarias son normales, se necesitan dos pruebas de estimulación diferentes para confirmarlo. [8]
Si los niveles de cortisol matinales son superiores a 500 nmol/L , es poco probable que haya deficiencia de ACTH, mientras que un nivel inferior a 100 es indicativo. Los niveles entre 100 y 500 requieren una prueba de estimulación. [6] Esto también se hace con la prueba de tolerancia a la insulina. Un nivel de cortisol superior a 500 después de alcanzar un nivel bajo de azúcar en sangre descarta la deficiencia de ACTH, mientras que los niveles más bajos confirman el diagnóstico. Una prueba de estimulación similar con hormona liberadora de corticotropina (CRH) no es lo suficientemente sensible para los fines de la investigación. Si la prueba de tolerancia a la insulina arroja un resultado anormal, se puede realizar una prueba adicional que mida la respuesta de las glándulas suprarrenales a la ACTH sintética (la prueba de estimulación con ACTH ) para confirmar el diagnóstico. [21] La prueba de estimulación con metirapona es una alternativa. [21] Algunos sugieren que una prueba de estimulación con ACTH es suficiente como investigación de primera línea, y que una prueba de tolerancia a la insulina solo es necesaria si la prueba de ACTH es equívoca. [6] [8] La prueba de tolerancia a la insulina se desaconseja en niños. [6] Ninguna de las pruebas para detectar la deficiencia de ACTH es perfecta, y puede ser necesario realizar más pruebas después de un período de tiempo si los resultados iniciales no son concluyentes. [1]
Los síntomas de la diabetes insípida deben dar lugar a una prueba formal de privación de líquidos para evaluar la respuesta del cuerpo a la deshidratación, que normalmente provoca la concentración de la orina y el aumento de la osmolaridad de la sangre. Si estos parámetros no cambian, se administra desmopresina (un análogo de la ADH). Si la orina se concentra y la osmolaridad de la sangre disminuye, hay una falta de ADH debido a la falta de función hipofisaria ("diabetes insípida craneal"). Por el contrario, no hay cambios si los riñones no responden a la ADH debido a un problema diferente ("diabetes insípida nefrogénica"). [1]
Investigaciones adicionales
Si una de estas pruebas muestra una deficiencia de hormonas producidas por la hipófisis, la resonancia magnética (RM) de la hipófisis es el primer paso para identificar una causa subyacente. La RM puede mostrar varios tumores y puede ayudar a delinear otras causas. Los tumores menores de 1 cm se denominan microadenomas y las lesiones más grandes se denominan macroadenomas . [1] Se puede utilizar una tomografía computarizada con contraste radiológico si no se dispone de RM. [8] Se recomienda una prueba formal del campo visual por perimetría , ya que esto mostraría evidencia de compresión del nervio óptico por un tumor. [8]
Otras pruebas que pueden ayudar en el diagnóstico de hipopituitarismo, especialmente si no se encuentra tumor en la resonancia magnética, son la ferritina (elevada en la hemocromatosis), los niveles de enzima convertidora de angiotensina (ECA) (a menudo elevados en la sarcoidosis) y la gonadotropina coriónica humana (a menudo elevada en tumores de origen de células germinales ). Si se sospecha una causa genética, se pueden realizar pruebas genéticas . [8]
Tratamiento
El tratamiento del hipopituitarismo es triple: eliminar la causa subyacente, tratar las deficiencias hormonales y abordar cualquier otra repercusión que surja de las deficiencias hormonales. [1]
Causa subyacente
Los tumores hipofisarios requieren tratamiento cuando causan síntomas específicos, como dolores de cabeza, defectos del campo visual o secreción excesiva de hormonas. La cirugía transesfenoidal (extirpación del tumor mediante una operación a través de la nariz y los senos esfenoidales ) puede, además de abordar los síntomas relacionados con el tumor, también mejorar la función hipofisaria, aunque a veces la glándula sufre más daños como resultado de la cirugía. Cuando el tumor se extirpa mediante craneotomía (apertura del cráneo), la recuperación es menos probable, pero a veces esta es la única forma adecuada de abordar el tumor. [1] [19] Después de la cirugía, puede llevar algún tiempo hasta que los niveles hormonales cambien significativamente. Por lo tanto, se realizan nuevas pruebas de los niveles hormonales hipofisarios entre 2 y 3 meses después. [6]
Los prolactinomas pueden responder al tratamiento con agonistas de la dopamina (medicamentos que imitan la acción de la dopamina en las células lactotropas, generalmente bromocriptina o cabergolina) . Este enfoque puede mejorar la secreción de hormonas hipofisarias en más de la mitad de los casos y hacer innecesario el tratamiento complementario. [1] [6] [19] [22]
Otras causas subyacentes específicas se tratan de la forma habitual. Por ejemplo, la hemocromatosis se trata mediante la extracción periódica de una cantidad fija de sangre. Con el tiempo, esto reduce los niveles de hierro en el cuerpo y mejora la función de los órganos en los que se ha acumulado el hierro. [23]
Reemplazo hormonal
La mayoría de las hormonas hipofisarias pueden reemplazarse indirectamente administrando los productos de las glándulas efectoras: hidrocortisona (cortisol) para la insuficiencia suprarrenal, levotiroxina para el hipotiroidismo, testosterona para el hipogonadismo masculino y estradiol para el hipogonadismo femenino (generalmente con un progestágeno para inhibir los efectos no deseados en el útero ). La hormona del crecimiento está disponible en forma sintética, pero debe administrarse por vía parenteral (por inyección). La hormona antidiurética puede reemplazarse con tabletas de desmopresina (DDAVP) o aerosol nasal . Generalmente, la dosis más baja de la medicación de reemplazo se utiliza para restablecer el bienestar y corregir los resultados alterados, ya que las dosis excesivas causarían efectos secundarios o complicaciones. [1] [6] [8] A quienes requieren hidrocortisona generalmente se les indica que aumenten su dosis en eventos físicamente estresantes como lesiones, hospitalización y trabajo dental, ya que estos son momentos en los que la dosis suplementaria normal puede ser inadecuada, lo que pone al paciente en riesgo de crisis suprarrenal . [6] [14]
En general, es necesario un seguimiento a largo plazo por parte de especialistas en endocrinología en el caso de personas con hipopituitarismo conocido. Además de garantizar que se esté utilizando el tratamiento correcto y en las dosis adecuadas, esto también brinda la oportunidad de abordar nuevos síntomas y complicaciones del tratamiento. [6] [8]
En personas (tanto hombres como mujeres) que padecen infertilidad surgen situaciones difíciles en caso de deficiencias del eje hipotálamo-hipófisis-gonadal ; la infertilidad en el hipopituitarismo puede tratarse con infusiones subcutáneas de FSH, gonadotropina coriónica humana –que imita la acción de la LH– y ocasionalmente GnRH. [1] [6] [8]
Pronóstico
Varios estudios han demostrado que el hipopituitarismo se asocia con un mayor riesgo de enfermedad cardiovascular y algunos también con un mayor riesgo de muerte de alrededor del 50% al 150% de la población normal. [6] [14] Ha sido difícil establecer qué deficiencia hormonal es responsable de este riesgo, ya que casi todos los pacientes estudiados tenían deficiencia de hormona de crecimiento. [8] Los estudios tampoco responden a la pregunta de si el hipopituitarismo en sí mismo causa el aumento de la mortalidad, o si parte del riesgo se debe atribuir a los tratamientos, algunos de los cuales (como la suplementación con hormonas sexuales) tienen un efecto adverso reconocido sobre el riesgo cardiovascular. [8]
El estudio más amplio realizado hasta la fecha siguió a más de mil personas durante ocho años y mostró un riesgo de muerte un 87% mayor en comparación con la población normal . Los predictores de un mayor riesgo fueron: sexo femenino, ausencia de tratamiento para la deficiencia de hormonas sexuales, edad más joven en el momento del diagnóstico y diagnóstico de craneofaringioma . Además de la enfermedad cardiovascular, este estudio también mostró un mayor riesgo de muerte por enfermedad pulmonar. [8] [24]
La calidad de vida puede verse significativamente reducida, incluso en aquellas personas que reciben una terapia médica óptima. Muchas personas manifiestan problemas tanto físicos como psicológicos. Es probable que las terapias de reemplazo que se utilizan habitualmente no imiten por completo los niveles naturales de hormonas en el cuerpo. [6] Los costos de salud siguen siendo aproximadamente el doble de los de la población normal. [6]
El hipopituitarismo suele ser permanente y requiere tratamiento de por vida con uno o más medicamentos.
Epidemiología
Sólo existe un estudio que ha medido la prevalencia (número total de casos en una población) y la incidencia (número anual de casos nuevos) de hipopituitarismo. [1] Este estudio se llevó a cabo en el norte de España y utilizó registros hospitalarios en una población bien definida. El estudio mostró que 45,5 personas de cada 100.000 habían sido diagnosticadas de hipopituitarismo, con 4,2 casos nuevos por año. [7] El 61% se debió a tumores de la glándula pituitaria, el 9% a otro tipo de lesiones y el 19% a otras causas; en el 11% no se pudo identificar la causa. [1] [7]
Estudios recientes han demostrado que las personas con una lesión cerebral traumática previa , hemorragia subaracnoidea espontánea (un tipo de accidente cerebrovascular) o radioterapia que afecta la cabeza tienen un mayor riesgo de hipopituitarismo. [25] Después de una lesión cerebral traumática, hasta una cuarta parte tiene deficiencias persistentes de la hormona pituitaria. [26] Muchas de estas personas pueden tener síntomas sutiles o no específicos que no están relacionados con problemas hipofisarios sino que se atribuyen a su condición previa. Por lo tanto, es posible que muchos casos de hipopituitarismo permanezcan sin diagnosticar, y que la incidencia anual aumentaría a 31 por 100.000 anualmente si se hicieran pruebas a las personas de estos grupos de riesgo. [1]
Historia
La hipófisis era conocida por los antiguos, como Galeno , y se propusieron varias teorías sobre su papel en el cuerpo, pero las pistas principales sobre la función real de la glándula no se avanzaron hasta finales del siglo XIX, cuando se describió la acromegalia debido a tumores hipofisarios. [27] El primer informe conocido de hipopituitarismo fue realizado por el médico y patólogo alemán Dr. Morris Simmonds . Describió la condición en la autopsia de una mujer de 46 años que había tenido fiebre puerperal severa once años antes, y posteriormente tuvo amenorrea, debilidad, signos de envejecimiento rápido y anemia. La glándula pituitaria era muy pequeña y había pocos restos tanto de la pituitaria anterior como de la posterior. [1] [5] El epónimo síndrome de Simmonds se usa con poca frecuencia para el hipopituitarismo adquirido, especialmente cuando predomina la caquexia (mala salud general y desnutrición). [28] [29] La mayoría de las causas clásicas del hipopituitarismo se describieron en el siglo XX; a principios del siglo XXI se reconoció lo común que podía ser el hipopituitarismo en víctimas anteriores de traumatismos craneoencefálicos. [1]
Hasta la década de 1950, el diagnóstico de la enfermedad hipofisaria se basaba en las características clínicas y el examen del campo visual, a veces ayudado por la neumoencefalografía y la tomografía de rayos X. Sin embargo, el campo de la cirugía hipofisaria se desarrolló durante esta época. El mayor avance en el diagnóstico llegó con el descubrimiento del radioinmunoensayo por Rosalyn Yalow y Solomon Berson a finales de la década de 1950. [30] Esto permitió la medición directa de las hormonas de la hipófisis, que como resultado de sus bajas concentraciones en sangre habían sido previamente difíciles de medir. [27] Las pruebas de estimulación se desarrollaron en la década de 1960, y en 1973 se introdujo la prueba del triple bolo , una prueba que combinaba pruebas de estimulación con insulina, GnRH y TRH. [31] La obtención de imágenes de la hipófisis, y por lo tanto la identificación de tumores y otras causas estructurales, mejoraron radicalmente con la introducción de la tomografía computarizada a finales de la década de 1970 y la resonancia magnética en la década de 1980. [27]
Referencias
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac Schneider HJ, Aimaretti G, Kreitschmann-Andermahr I, Stalla GK, Ghigo E (abril de 2007). "Hipopituitarismo". Lanceta . 369 (9571): 1461–70. doi :10.1016/S0140-6736(07)60673-4. PMID 17467517. S2CID 208789791.
- ^ "Hipopituitarismo" en el Diccionario médico de Dorland
- ^ Ignatavicius, Donna; Workman, Linda (2015). Enfermería médico-quirúrgica: atención colaborativa centrada en el paciente (8.ª ed.). Saunders. pp. 1266–67. ISBN 9781455772551.
- ^ "Panhipopituitarismo" en el Diccionario médico de Dorland
- ^ ab Simmonds, M. (febrero de 1914). "Ueber Hypophysisschwund mit tödlichem Ausgang" [Acerca de la hipófisis con desenlace fatal]. Deutsche Medizinische Wochenschrift (en alemán). 40 (7): 322–323. doi :10.1055/s-0029-1190185. S2CID 76080976.
- ^ abcdefghijklmnopqrstu vw van Aken MO, Lamberts SW (2005). "Diagnóstico y tratamiento del hipopituitarismo: una actualización". Pituitaria . 8 (3–4): 183–91. doi :10.1007/s11102-006-6039-z. PMID 16508719. S2CID 581096.
- ^ abcd Regal M, Páramo C, Sierra SM, García-Mayor RV (diciembre de 2001). "Prevalencia e incidencia de hipopituitarismo en una población adulta caucásica en el noroeste de España". Clínico. Endocrinol . 55 (6): 735–40. doi :10.1046/j.1365-2265.2001.01406.x. PMID 11895214. S2CID 41502818.
- ^ abcdefghijklmnopq Prabhakar VK, Shalet SM (abril de 2006). "Etiología, diagnóstico y tratamiento del hipopituitarismo en la vida adulta". Postgrad Med J . 82 (966): 259–66. doi :10.1136/pgmj.2005.039768. PMC 2585697 . PMID 16597813.
- ^ Rajasekaran S, Vanderpump M, Baldeweg S, et al. (Enero de 2011). "Directrices del Reino Unido para el tratamiento de la apoplejía hipofisaria". Clin Endocrinol . 74 (1): 9–20. doi : 10.1111/j.1365-2265.2010.03913.x . PMID 21044119. S2CID 52867017.
- ^ James W, Berger T, Elston D (2005). Enfermedades de la piel de Andrews: dermatología clínica (10.ª ed.). Saunders. pág. 501. ISBN 978-0-7216-2921-6.
- ^ Arlt W, Allolio B (mayo de 2003). "Insuficiencia suprarrenal". Lancet . 361 (9372): 1881–93. doi :10.1016/S0140-6736(03)13492-7. PMID 12788587. S2CID 7506593.
- ^ Maghnie M (2003). "Diabetes insípida". Horm. Res . 59 (Supl. 1): 42–54. doi :10.1159/000067844. PMID 12566720. S2CID 24638358.
- ^ Lee, Heon-Jin; Macbeth, Abbe H.; Pagani, Jerome; Young, W. Scott (junio de 2009). "Oxitocina: el gran facilitador de la vida". Progreso en neurobiología . 88 (2): 127–151. doi :10.1016/j.pneurobio.2009.04.001. PMC 2689929 . PMID 19482229.
- ^ abcdefg Melmed S, Jameson JL (2005). "Trastornos de la hipófisis anterior y el hipotálamo". En Kasper DL, Braunwald E, Fauci AS, et al. (eds.). Harrison's Principles of Internal Medicine (16.ª ed.). Nueva York: McGraw-Hill. págs. 2076–97. ISBN 978-0-07-139140-5.
- ^ abc Fernández A, Brada M, Zabuliene L, Karavitaki N, Wass JA (septiembre de 2009). "Hipotuitarismo inducido por radiación". Endocr. Relacionado. Cáncer . 16 (3): 733–72. doi : 10.1677/ERC-08-0231 . PMID 19498038.
- ^ abcd Cohen LE, Radovick S (agosto de 2002). "Base molecular de las deficiencias combinadas de hormonas hipofisarias". Endocr. Rev. 23 ( 4): 431–42. doi : 10.1210/er.2001-0030 . PMID 12202459.
- ^ abc Kelberman D, Dattani MT (agosto de 2007). "Desarrollo hipotalámico y pituitario: nuevos conocimientos sobre la etiología". euros. J. Endocrinol . 157 (Suplemento 1): T3-14. doi : 10.1530/EJE-07-0156 . PMID 17785694.
- ^ Guillemin R (enero de 2005). "Hormonas hipotalámicas, también conocidas como factores liberadores hipotalámicos". J. Endocrinol . 184 (1): 11–28. doi : 10.1677/joe.1.05883 . PMID 15642779.
- ^ abc Arafah BM, Nasrallah MP (diciembre de 2001). "Tumores hipofisarios: fisiopatología, manifestaciones clínicas y tratamiento". Endocr. Relat. Cancer . 8 (4): 287–305. CiteSeerX 10.1.1.577.5564 . doi :10.1677/erc.0.0080287. PMID 11733226.
- ^ Kaushal K, Shalet SM (2007). "Definición del estado de la hormona del crecimiento en adultos con hipopituitarismo". Horm. Res . 68 (4): 185–94. doi : 10.1159/000101286 . PMID: 17389809.
- ^ ab Dorin RI, Qualls CR, Crapo LM (2003). "Diagnóstico de la insuficiencia suprarrenal". Ann. Intern. Med . 139 (3): 194–204. doi :10.7326/0003-4819-139-3-200308050-00017. PMID 12899587.
- ^ Schlechte JA (noviembre de 2003). "Prolactinoma". N. inglés. J. Med . 349 (21): 2035–41. doi :10.1056/NEJMcp025334. PMID 14627789.
- ^ Pietrangelo A (junio de 2004). "Hemocromatosis hereditaria: una nueva mirada a una vieja enfermedad". N. Engl. J. Med . 350 (23): 2383–97. doi :10.1056/NEJMra031573. PMID 15175440.
- ^ Tomlinson JW, Holden N, Hills RK, et al. (febrero de 2001). "Asociación entre mortalidad prematura e hipopituitarismo". Lancet . 357 (9254): 425–31. doi :10.1016/S0140-6736(00)04006-X. PMID 11273062. S2CID 54290598.
- ^ Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A (septiembre de 2007). "Disfunción hipotálamo-hipofisaria después de una lesión cerebral traumática y una hemorragia subaracnoidea aneurismática: una revisión sistemática". Revista de la Asociación Médica Estadounidense . 298 (12): 1429–38. doi : 10.1001/jama.298.12.1429 . PMID: 17895459.
- ^ Behan LA, Phillips J, Thompson CJ, Agha A (julio de 2008). "Trastornos neuroendocrinos después de una lesión cerebral traumática". J. Neurol. Neurosurg. Psychiatry . 79 (7): 753–59. doi :10.1136/jnnp.2007.132837. PMID 18559460. S2CID 12153361.
- ^ abc Sellwood RA, Welbourn RB, Friesen SR (1990). Historia de la cirugía endocrina . Nueva York: Praeger Publishers. ISBN 978-0-275-92586-4.[ página necesaria ]
- ^ synd/2008 en ¿Quién le puso nombre?
- ^ "Enfermedad de Simmonds" en el Diccionario médico de Dorland
- ^ Yalow RS, Berson SA (julio de 1960). "Inmunoensayo de insulina plasmática endógena en el hombre". J. Clin. Invest . 39 (7): 1157–75. doi :10.1172/JCI104130. PMC 441860. PMID 13846364 .
- ^ Harsoulis P, Marshall JC, Kuku SF, Burke CW, London DR, Fraser TR (noviembre de 1973). "Prueba combinada para la evaluación de la función de la hipófisis anterior". Br Med J . 4 (5888): 326–29. doi :10.1136/bmj.4.5888.326. PMC 1587416 . PMID 4202260.