Célula T
| Célula T | |
|---|---|
 Animación de células T | |
 Micrografía electrónica de barrido de un glóbulo rojo (izquierda), una plaqueta (centro) y un linfocito T (derecha); coloreada | |
| Detalles | |
| Sistema | Sistema inmunitario |
| Identificadores | |
| latín | linfocito T |
| Malla | D013601 |
| El | H2.00.04.1.02007 |
| FMA | 62870 |
| Términos anatómicos de microanatomía [editar en Wikidata] | |
Las células T son uno de los tipos importantes de glóbulos blancos del sistema inmunológico y desempeñan un papel central en la respuesta inmunitaria adaptativa . Las células T se pueden distinguir de otros linfocitos por la presencia de un receptor de células T (TCR) en su superficie celular .
Las células T nacen de las células madre hematopoyéticas , [1] que se encuentran en la médula ósea . Las células T en desarrollo luego migran a la glándula del timo para desarrollarse (o madurar). Las células T derivan su nombre del timo . [2] [3] Después de la migración al timo, las células precursoras maduran en varios tipos distintos de células T. La diferenciación de las células T también continúa después de que han salido del timo. Grupos de subtipos específicos y diferenciados de células T tienen una variedad de funciones importantes en el control y la configuración de la respuesta inmunitaria .
Una de estas funciones es la muerte celular mediada por el sistema inmunitario, y la llevan a cabo dos subtipos principales: las células T CD8+ "asesinas" (citotóxicas) y las células T CD4+ "auxiliares" . (Se llaman así por la presencia de las proteínas de superficie celular CD8 o CD4 ). Las células T CD8+, también conocidas como "células T asesinas", son citotóxicas , es decir, pueden matar directamente las células infectadas por virus, así como las células cancerosas. Las células T CD8+ también pueden utilizar pequeñas proteínas de señalización, conocidas como citocinas , para reclutar otros tipos de células al montar una respuesta inmunitaria. Una población diferente de células T, las células T CD4+, funcionan como "células auxiliares". A diferencia de las células T asesinas CD8+, las células T auxiliares CD4+ (TH ) funcionan activando aún más las células B de memoria y las células T citotóxicas, lo que conduce a una respuesta inmunitaria más grande. La respuesta inmune adaptativa específica regulada por la célula T depende de su subtipo (como T-helper1, T-helper2, T-helper17, célula T reguladora), [4] que se distingue por los tipos de citocinas que secretan. [2]
Las células T reguladoras son otra población distinta de células T que proporcionan el mecanismo crítico de tolerancia , por el cual las células inmunes pueden distinguir las células invasoras de las "propias". Esto evita que las células inmunes reaccionen de manera inapropiada contra las propias células, lo que se conoce como una respuesta " autoinmune ". Por esta razón, estas células T reguladoras también se han denominado células T "supresoras". Estas mismas células T reguladoras también pueden ser cooptadas por las células cancerosas para evitar el reconocimiento de las células tumorales y una respuesta inmune contra ellas.
Desarrollo
Origen, desarrollo temprano y migración al timo
Todas las células T se originan a partir de células madre hematopoyéticas (HSC) c-kit + Sca1 + que residen en la médula ósea. En algunos casos, el origen puede ser el hígado fetal durante el desarrollo embrionario . Las HSC luego se diferencian en progenitores multipotentes (MPP) que conservan el potencial de convertirse en células mieloides y linfoides . El proceso de diferenciación luego procede a un progenitor linfoide común (CLP), que solo puede diferenciarse en células T, B o NK. [5] Estas células CLP luego migran a través de la sangre al timo, donde se injertan:. De ahora en adelante se conocen como timocitos , la etapa inmadura de una célula T.
Las primeras células que llegan al timo se denominan comúnmente doble negativas , ya que no expresan ni el correceptor CD4 ni el CD8 . Las células CLP recién llegadas son células CD4 − CD8 − CD44 + CD25 − ckit + , y se denominan células progenitoras tímicas tempranas (ETP). [6] Estas células luego experimentarán una ronda de división y regularán negativamente c-kit y se denominan células doble negativas uno (DN1). Para convertirse en células T, los timocitos deben experimentar múltiples etapas DN, así como selección positiva y selección negativa.
Los timocitos doblemente negativos se pueden identificar por la expresión superficial de CD2 , CD5 y CD7 . Durante las etapas de doble negatividad, la expresión de CD34 se detiene y se expresa CD1 . La expresión de CD4 y CD8 los convierte en doblemente positivos y maduran en células CD4+ o CD8+.
Desarrollo de TCR
Un paso fundamental en la maduración de las células T es la creación de un receptor de células T (TCR) funcional. Cada célula T madura contendrá en última instancia un TCR único que reacciona a un patrón aleatorio, lo que permite al sistema inmunitario reconocer muchos tipos diferentes de patógenos . Este proceso es esencial para desarrollar inmunidad a amenazas que el sistema inmunitario no ha encontrado antes, ya que debido a la variación aleatoria siempre habrá al menos un TCR que coincida con cualquier nuevo patógeno.
Un timocito sólo puede convertirse en una célula T activa cuando sobrevive al proceso de desarrollo de un TCR funcional. El TCR consta de dos componentes principales, las cadenas alfa y beta. Ambas contienen elementos aleatorios diseñados para producir una amplia variedad de TCR diferentes, pero debido a esta enorme variedad deben probarse para asegurarse de que funcionan. Primero, los timocitos intentan crear una cadena beta funcional, probándola contra una cadena alfa "simulada". Luego intentan crear una cadena alfa funcional. Una vez que se ha producido un TCR funcional, las células deben probar si su TCR identificará las amenazas correctamente, y para hacer esto es necesario reconocer el complejo mayor de histocompatibilidad (MHC) del cuerpo en un proceso conocido como selección positiva. El timocito también debe asegurarse de no reaccionar adversamente a los antígenos "propios" , llamado selección negativa. Si tanto la selección positiva como la negativa tienen éxito, el TCR se vuelve completamente operativo y el timocito se convierte en una célula T.
Selección de la cadena β del TCR
En la etapa DN2 (CD44 + CD25 + ), las células regulan positivamente los genes de recombinación RAG1 y RAG2 y reorganizan el locus TCRβ , combinando la recombinación VDJ y los genes de la región constante en un intento de crear una cadena TCRβ funcional. A medida que el timocito en desarrollo progresa hasta la etapa DN3 (CD44 − CD25 + ), el timocito expresa una cadena α invariante llamada pre-Tα junto con el gen TCRβ. Si la cadena β reorganizada se empareja con éxito con la cadena α invariante, se producen señales que detienen la reorganización de la cadena β (y silencian el alelo alternativo). [7] Aunque estas señales requieren el pre-TCR en la superficie celular, son independientes de la unión del ligando al pre-TCR. Si las cadenas se aparean con éxito, se forma un pre-TCR y la célula regula negativamente el CD25 y se denomina célula DN4 (CD25 − CD44 − ). Estas células experimentan una ronda de proliferación y comienzan a reorganizar el locus TCRα durante la etapa de doble positividad .
Selección positiva
El proceso de selección positiva dura de 3 a 4 días y ocurre en la corteza tímica. [8] Los timocitos doblemente positivos (CD4 + /CD8 + ) migran profundamente a la corteza tímica , donde se les presentan antígenos propios . Estos antígenos propios son expresados por las células epiteliales corticales tímicas en moléculas MHC, que residen en la superficie de las células epiteliales corticales. Solo los timocitos que interactúan bien con MHC-I o MHC-II recibirán una "señal de supervivencia" vital, mientras que aquellos que no pueden interactuar con la suficiente fuerza no recibirán ninguna señal y morirán por negligencia. Este proceso asegura que los timocitos supervivientes tendrán una "afinidad por MHC", lo que significa que pueden cumplir funciones útiles en el cuerpo, respondiendo a las moléculas MHC para ayudar a las respuestas inmunitarias. La gran mayoría de los timocitos en desarrollo no pasarán la selección positiva y morirán durante este proceso. [9]
El destino de un timocito se determina durante la selección positiva. Las células doblemente positivas (CD4 + /CD8 + ) que interactúan bien con las moléculas del MHC de clase II se convertirán con el tiempo en células CD4 + "auxiliares", mientras que los timocitos que interactúan bien con las moléculas del MHC de clase I madurarán hasta convertirse en células CD8 + "asesinas". Un timocito se convierte en una célula CD4 + al regular negativamente la expresión de sus receptores de superficie celular CD8. Si la célula no pierde su señal, seguirá regulando negativamente CD8 y se convertirá en una CD4 + ; tanto las células CD8 + como las CD4 + son ahora células positivas simples . [10]
Este proceso no filtra los timocitos que pueden causar autoinmunidad . Las células potencialmente autoinmunes se eliminan mediante el siguiente proceso de selección negativa, que ocurre en la médula tímica.
Selección negativa
La selección negativa elimina los timocitos que son capaces de unirse fuertemente con moléculas MHC "propias". Los timocitos que sobreviven a la selección positiva migran hacia el límite de la corteza y la médula en el timo. Mientras están en la médula, se les presenta nuevamente un autoantígeno presentado en el complejo MHC de células epiteliales tímicas medulares (mTEC). [11] Las mTEC deben ser reguladoras autoinmunes positivas (AIRE + ) para expresar adecuadamente los autoantígenos de todos los tejidos del cuerpo en sus péptidos MHC de clase I. Algunas mTEC son fagocitadas por células dendríticas tímicas ; esto las convierte en células presentadoras de antígenos (APC) AIRE − , lo que permite la presentación de autoantígenos en moléculas MHC de clase II (las células CD4 + seleccionadas positivamente deben interactuar con estas moléculas MHC de clase II, por lo tanto, las APC, que poseen MHC de clase II, deben estar presentes para la selección negativa de células T CD4 + ). Los timocitos que interactúan con demasiada fuerza con el autoantígeno reciben una señal apoptótica que conduce a la muerte celular. Sin embargo, algunas de estas células son seleccionadas para convertirse en células Treg . Las células restantes salen del timo como células T maduras vírgenes , también conocidas como emigrantes tímicos recientes. [12] Este proceso es un componente importante de la tolerancia central y sirve para prevenir la formación de células T autorreactivas que son capaces de inducir enfermedades autoinmunes en el huésped.
Resumen del desarrollo del TCR
La β-selección es el primer punto de control, donde los timocitos que son capaces de formar un pre-TCR funcional (con una cadena alfa invariable y una cadena beta funcional) pueden continuar su desarrollo en el timo. A continuación, la selección positiva comprueba que los timocitos han reorganizado con éxito su locus TCRα y son capaces de reconocer las moléculas del CMH con la afinidad adecuada. La selección negativa en la médula elimina entonces a los timocitos que se unen con demasiada fuerza a los autoantígenos expresados en las moléculas del CMH. Estos procesos de selección permiten la tolerancia del sistema inmunológico hacia sí mismos. Las células T vírgenes típicas que abandonan el timo (a través de la unión corticomedular) son autorrestringidas, autotolerantes y positivas simples.
Producción tímica
Alrededor del 98% de los timocitos mueren durante los procesos de desarrollo en el timo al no superar la selección positiva o la selección negativa, mientras que el 2% restante sobrevive y abandona el timo para convertirse en células T inmunocompetentes maduras. [13] El timo aporta menos células a medida que una persona envejece. A medida que el timo se encoge alrededor de un 3% [14] al año durante la mediana edad, se produce una caída correspondiente en la producción tímica de células T vírgenes, lo que deja que la expansión y regeneración de células T periféricas desempeñen un papel más importante en la protección de las personas mayores.
Tipos de células T
Las células T se agrupan en una serie de subconjuntos según su función. Las células T CD4 y CD8 se seleccionan en el timo, pero sufren una mayor diferenciación en la periferia hasta convertirse en células especializadas que tienen funciones diferentes. Los subconjuntos de células T se definieron inicialmente por su función, pero también tienen patrones de expresión de genes o proteínas asociados.
Células T adaptativas convencionales
Células T CD4+ auxiliares

Las células T colaboradoras (células T ) ayudan a otros linfocitos, incluida la maduración de las células B en células plasmáticas y células B de memoria , y la activación de las células T citotóxicas y los macrófagos . Estas células también se conocen como células T CD4 + , ya que expresan la glucoproteína CD4 en sus superficies. Las células T colaboradoras se activan cuando se les presentan antígenos peptídicos por moléculas MHC de clase II , que se expresan en la superficie de las células presentadoras de antígenos (APC). Una vez activadas, se dividen rápidamente y secretan citocinas que regulan o ayudan a la respuesta inmunitaria. Estas células pueden diferenciarse en uno de varios subtipos, que tienen diferentes funciones. Las citocinas dirigen a las células T hacia subtipos particulares. [15]
| Tipo de célula | Citocinas producidas | Factor de transcripción clave | Papel en la defensa inmunológica | Enfermedades relacionadas |
|---|---|---|---|---|
| El 1 | IFNγ , IL-2 | Tbet | Produce una respuesta inflamatoria, clave para la defensa contra bacterias intracelulares, virus y cáncer. | EM, diabetes tipo 1 |
| Th2 | IL-4, IL-5, IL-13 | GATA-3 | Inmunológicamente importante contra patógenos extracelulares, como infecciones por gusanos. | Asma y otras enfermedades alérgicas |
| Th17 | IL-17F, IL-17A, IL-22 | RORγt | Defensa contra patógenos intestinales y en barreras mucosas. | Esclerosis múltiple, artritis reumatoide, psoriasis |
| Th9 [16] [17] | IL-9 | IRF4, PU.1 | Defensa contra helmintos (gusanos parásitos) e inflamación alérgica dependiente de células. | Esclerosis múltiple |
| Tfh | IL-21, IL-4 | Bcl-6 | Ayuda a las células B a producir anticuerpos. | Asma y otras enfermedades alérgicas |
| Th22 [18] [17] | IL-22 | AHR | Patogenia de las enfermedades alérgicas de las vías respiratorias y predominantemente antiinflamatorias | Enfermedad de Crohn, Artritis reumatoide, Tumores |
Células T CD8+ citotóxicas
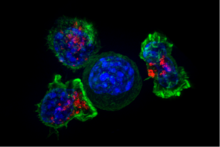
Las células T citotóxicas (células T C , CTL, células T asesinas, células T asesinas) destruyen las células infectadas por virus y las células tumorales, y también están implicadas en el rechazo de trasplantes . Estas células se definen por la expresión de la proteína CD8 en su superficie celular. Las células T citotóxicas reconocen sus objetivos uniéndose a péptidos cortos (de 8 a 11 aminoácidos de longitud) asociados con moléculas MHC de clase I , presentes en la superficie de todas las células nucleadas. Las células T citotóxicas también producen las citocinas clave IL-2 e IFNγ. Estas citocinas influyen en las funciones efectoras de otras células, en particular los macrófagos y las células NK.
Células T de memoria
Las células T vírgenes a antígenos se expanden y se diferencian en células T de memoria y efectoras después de que encuentran su antígeno cognado dentro del contexto de una molécula MHC en la superficie de una célula presentadora de antígeno profesional (por ejemplo, una célula dendrítica). Debe estar presente una coestimulación adecuada en el momento del encuentro con el antígeno para que se produzca este proceso. Históricamente, se pensaba que las células T de memoria pertenecían a los subtipos de efector o de memoria central, cada uno con su propio conjunto distintivo de marcadores de superficie celular (ver más abajo). [19] Posteriormente, se descubrieron numerosas poblaciones nuevas de células T de memoria, incluidas las células T de memoria residentes en el tejido (Trm), las células madre de memoria TSCM y las células T de memoria virtual. El único tema unificador para todos los subtipos de células T de memoria es que tienen una vida larga y pueden expandirse rápidamente a grandes cantidades de células T efectoras tras la reexposición a su antígeno cognado. Por este mecanismo, proporcionan al sistema inmunológico "memoria" contra patógenos encontrados previamente. Las células T de memoria pueden ser CD4 + o CD8 + y generalmente expresan CD45RO . [20]
Subtipos de células T de memoria:
- Las células T de memoria central (células T CM ) expresan CD45RO, receptor de quimiocina CC tipo 7 (CCR7) y L-selectina (CD62L). Las células T de memoria central también tienen una expresión intermedia a alta de CD44 . Esta subpoblación de memoria se encuentra comúnmente en los ganglios linfáticos y en la circulación periférica. (Nota: la expresión de CD44 se usa generalmente para distinguir las células T murinas ingenuas de las células T de memoria).
- Las células T de memoria efectoras ( células T EM y células T EMRA ) expresan CD45RO pero carecen de expresión de CCR7 y L-selectina . También tienen una expresión intermedia a alta de CD44 . Estas células T de memoria carecen de receptores de localización en los ganglios linfáticos y, por lo tanto, se encuentran en la circulación periférica y los tejidos. [21] T EMRA significa células de memoria efectoras diferenciadas terminalmente que reexpresan CD45RA, que es un marcador que se encuentra generalmente en las células T vírgenes. [22]
- Las células T de memoria residentes en los tejidos (T RM ) ocupan los tejidos (piel, pulmón, etc.) sin recircular. Un marcador de superficie celular que se ha asociado con las T RM es el αeβ7 interno, también conocido como CD103. [23]
- Las células T de memoria virtual (T VM ) se diferencian de los otros subconjuntos de células de memoria en que no se originan después de un fuerte evento de expansión clonal. Por lo tanto, aunque esta población en su conjunto es abundante dentro de la circulación periférica, los clones individuales de células T de memoria virtual residen en frecuencias relativamente bajas. Una teoría es que la proliferación homeostática da lugar a esta población de células T. Aunque las células T de memoria virtual CD8 fueron las primeras en describirse, [24] ahora se sabe que también existen células de memoria virtual CD4. [25]
Células T CD4+ reguladoras
Las células T reguladoras son fundamentales para el mantenimiento de la tolerancia inmunológica . Su función principal es anular la inmunidad mediada por células T hacia el final de una reacción inmunitaria y suprimir las células T autorreactivas que escaparon al proceso de selección negativa en el timo.
Se han descrito dos clases principales de células T reg CD4 + : células T reg FOXP3 + y células T reg FOXP3− .
Las células T reguladoras pueden desarrollarse durante el desarrollo normal en el timo, y entonces se conocen como células Treg tímicas, o pueden inducirse periféricamente y se denominan células Treg de origen periférico. Estos dos subconjuntos se denominaban anteriormente "de origen natural" y "adaptativos" (o "inducidos"), respectivamente. [26] Ambos subconjuntos requieren la expresión del factor de transcripción FOXP3, que se puede utilizar para identificar las células. Las mutaciones del gen FOXP3 pueden impedir el desarrollo de las células T reguladoras, lo que provoca la enfermedad autoinmune mortal IPEX .
Varios otros tipos de células T tienen actividad supresora, pero no expresan FOXP3 de forma constitutiva. Entre ellas se encuentran las células Tr1 y Th3 , que se cree que se originan durante una respuesta inmunitaria y actúan produciendo moléculas supresoras. Las células Tr1 están asociadas con IL-10, y las células Th3 están asociadas con TGF-beta . Recientemente, se han añadido a esta lista las células Th17 . [27]
Células T de tipo innato
Las células T innatas o no convencionales representan algunos subconjuntos de células T que se comportan de manera diferente en la inmunidad. Desencadenan respuestas inmunitarias rápidas, independientemente de la expresión del complejo mayor de histocompatibilidad (CMH), a diferencia de sus contrapartes convencionales (células T auxiliares CD4 y células T citotóxicas CD8), que dependen del reconocimiento de antígenos peptídicos en el contexto de la molécula del CMH. En general, existen tres grandes poblaciones de células T no convencionales: células NKT, células MAIT y células T gammadelta. En la actualidad, sus funciones ya están bien establecidas en el contexto de las infecciones y el cáncer. [28] Además, estos subconjuntos de células T se están traduciendo en muchas terapias contra neoplasias malignas como la leucemia, por ejemplo. [29]
Célula T asesina natural
Las células T asesinas naturales (células NKT, que no deben confundirse con las células asesinas naturales del sistema inmunitario innato) sirven de puente entre el sistema inmunitario adaptativo y el sistema inmunitario innato . A diferencia de las células T convencionales, que reconocen antígenos peptídicos proteicos presentados por moléculas del complejo mayor de histocompatibilidad (CMH), las células NKT reconocen antígenos glucolipídicos presentados por CD1d . Una vez activadas, estas células pueden realizar funciones atribuidas tanto a las células T auxiliares como a las citotóxicas: producción de citocinas y liberación de moléculas citolíticas/destructoras de células. También pueden reconocer y eliminar algunas células tumorales y células infectadas con virus del herpes. [30]
Células T invariantes asociadas a las mucosas
Las células T invariantes asociadas a las mucosas (MAIT) muestran cualidades innatas , similares a las de los efectores. [31] [32] En los seres humanos, las células MAIT se encuentran en la sangre, el hígado, los pulmones y las mucosas , defendiendo contra la actividad microbiana y las infecciones. [31] La proteína similar al MHC de clase I , MR1 , es responsable de presentar metabolitos de vitamina B producidos por bacterias a las células MAIT. [33] [34] [35] Después de la presentación del antígeno extraño por MR1, las células MAIT secretan citocinas proinflamatorias y son capaces de lisar las células infectadas por bacterias. [31] [35] Las células MAIT también se pueden activar a través de la señalización independiente de MR1. [35] Además de poseer funciones similares a las innatas, este subconjunto de células T respalda la respuesta inmunitaria adaptativa y tiene un fenotipo similar a la memoria. [31] Además, se cree que las células MAIT desempeñan un papel en enfermedades autoinmunes , como la esclerosis múltiple , la artritis y la enfermedad inflamatoria intestinal , [36] [37] aunque todavía no se ha publicado evidencia definitiva. [38] [39] [40] [41]
Células T gamma delta
Las células T gamma delta (células T γδ) representan un pequeño subconjunto de células T que poseen un TCR γδ en lugar del TCR αβ en la superficie celular. La mayoría de las células T expresan cadenas TCR αβ. Este grupo de células T es mucho menos común en humanos y ratones (alrededor del 2% de las células T totales) y se encuentran principalmente en la mucosa intestinal , dentro de una población de linfocitos intraepiteliales . En conejos, ovejas y pollos, la cantidad de células T γδ puede ser tan alta como el 60% de las células T totales. Las moléculas antigénicas que activan las células T γδ aún son en su mayoría desconocidas. Sin embargo, las células T γδ no están restringidas por MHC y parecen ser capaces de reconocer proteínas completas en lugar de requerir que las moléculas de MHC presenten péptidos en las APC . Algunas células T γδ murinas reconocen moléculas de MHC de clase IB. Las células T γδ humanas que utilizan los fragmentos de los genes Vγ9 y Vδ2 constituyen la principal población de células T γδ en la sangre periférica. Estas células son únicas porque responden específica y rápidamente a un conjunto de precursores isoprenoides fosforilados no peptídicos , denominados colectivamente fosfoantígenos , que son producidos por prácticamente todas las células vivas. Los fosfoantígenos más comunes de las células animales y humanas (incluidas las células cancerosas) son el pirofosfato de isopentenilo (IPP) y su isómero pirofosfato de dimetilalilo (DMPP). Muchos microbios producen el compuesto activo hidroxi-DMAPP ( HMB-PP ) y los conjugados mononucleotídicos correspondientes, además de IPP y DMAPP. Las células vegetales producen ambos tipos de fosfoantígenos. Los fármacos que activan las células T Vγ9/Vδ2 humanas comprenden fosfoantígenos sintéticos y aminobisfosfonatos , que regulan positivamente el IPP/DMAPP endógeno.
Activación
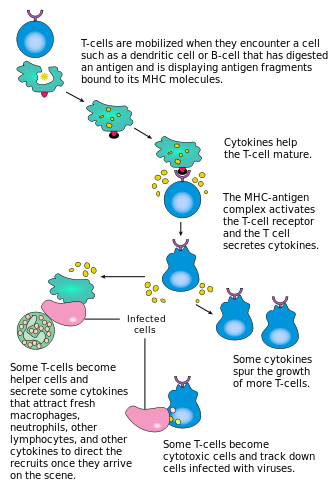
La activación de las células T CD4 + ocurre a través de la interacción simultánea del receptor de células T y una molécula coestimuladora (como CD28 o ICOS ) en la célula T por el péptido del complejo mayor de histocompatibilidad (MHCII) y las moléculas coestimuladoras en la APC . Ambos son necesarios para la producción de una respuesta inmune efectiva; en ausencia de coestimulación , la señalización del receptor de células T por sí sola produce anergia . Las vías de señalización posteriores a las moléculas coestimuladoras generalmente involucran la vía PI3K, que genera PIP3 en la membrana plasmática y recluta moléculas de señalización que contienen el dominio PH, como PDK1 , que son esenciales para la activación de PKC-θ y la eventual producción de IL-2 . La respuesta óptima de las células T CD8 + depende de la señalización CD4 + . [43] Las células CD4 + son útiles en la activación antigénica inicial de las células T CD8+ ingenuas y en el mantenimiento de las células T CD8 + de memoria después de una infección aguda. Por lo tanto, la activación de las células T CD4 + puede ser beneficiosa para la acción de las células T CD8 + . [44] [45] [46]
La primera señal es proporcionada por la unión del receptor de células T a su péptido cognado presentado en MHCII en una APC. MHCII está restringido a las llamadas células presentadoras de antígenos profesionales , como las células dendríticas, las células B y los macrófagos, por nombrar algunos. Los péptidos presentados a las células T CD8 + por las moléculas MHC de clase I tienen una longitud de 8 a 13 aminoácidos; los péptidos presentados a las células CD4 + por las moléculas MHC de clase II son más largos, generalmente de 12 a 25 aminoácidos de longitud, [47] ya que los extremos de la hendidura de unión de la molécula MHC de clase II están abiertos.
La segunda señal proviene de la coestimulación, en la que los receptores de superficie en el APC son inducidos por un número relativamente pequeño de estímulos, generalmente productos de patógenos, pero a veces productos de degradación de las células, como cuerpos necróticos o proteínas de choque térmico . El único receptor coestimulador expresado constitutivamente por células T vírgenes es CD28, por lo que la coestimulación para estas células proviene de las proteínas CD80 y CD86 , que juntas constituyen la proteína B7 (B7.1 y B7.2, respectivamente) en el APC. Otros receptores se expresan tras la activación de la célula T, como OX40 e ICOS, pero estos dependen en gran medida de CD28 para su expresión. La segunda señal autoriza a la célula T a responder a un antígeno. Sin él, la célula T se vuelve anérgica y se le hace más difícil activarse en el futuro. Este mecanismo evita respuestas inapropiadas a lo propio, ya que los péptidos propios normalmente no se presentarán con la coestimulación adecuada. Una vez que una célula T ha sido activada apropiadamente (es decir, ha recibido la señal uno y la señal dos), altera su expresión de superficie celular de una variedad de proteínas. Los marcadores de activación de células T incluyen CD69, CD71 y CD25 (también un marcador para células Treg) y HLA-DR (un marcador de activación de células T humanas). La expresión de CTLA-4 también está regulada al alza en las células T activadas, que a su vez compiten con CD28 para unirse a las proteínas B7. Este es un mecanismo de punto de control para prevenir la sobreactivación de la célula T. Las células T activadas también cambian su perfil de glicosilación de la superficie celular. [48]
El receptor de células T existe como un complejo de varias proteínas. El receptor de células T real está compuesto de dos cadenas de péptidos separadas, que se producen a partir de los genes independientes del receptor de células T alfa y beta ( TCRα y TCRβ ). Las otras proteínas en el complejo son las proteínas CD3 : heterodímeros CD3εγ y CD3εδ y, lo más importante, un homodímero CD3ζ, que tiene un total de seis motivos ITAM . Los motivos ITAM en el CD3ζ pueden ser fosforilados por Lck y, a su vez, reclutar ZAP-70 . Lck y/o ZAP-70 también pueden fosforilar las tirosinas en muchas otras moléculas, entre ellas CD28, LAT y SLP-76 , lo que permite la agregación de complejos de señalización alrededor de estas proteínas.
El LAT fosforilado recluta a SLP-76 a la membrana, donde puede entonces traer PLC-γ , VAV1 , Itk y potencialmente PI3K . PLC-γ escinde PI(4,5)P2 en la hoja interna de la membrana para crear los intermediarios activos diacilglicerol ( DAG ), inositol-1,4,5-trifosfato ( IP3 ); PI3K también actúa sobre PIP2, fosforilándolo para producir fosfatidilinositol-3,4,5-trifosfato (PIP3). DAG se une y activa algunas PKC. La más importante en las células T es PKC-θ, crítica para activar los factores de transcripción NF-κB y AP-1. IP3 es liberado de la membrana por PLC-γ y difunde rápidamente para activar los receptores del canal de calcio en el RE , lo que induce la liberación de calcio al citosol. El bajo nivel de calcio en el retículo endoplásmico provoca la agrupación de STIM1 en la membrana del RE y conduce a la activación de los canales CRAC de la membrana celular que permiten que fluya calcio adicional al citosol desde el espacio extracelular. Este calcio citosólico agregado se une a la calmodulina, que luego puede activar la calcineurina . La calcineurina, a su vez, activa NFAT , que luego se transloca al núcleo. NFAT es un factor de transcripción que activa la transcripción de un conjunto pleiotrópico de genes, el más notable, IL-2, una citocina que promueve la proliferación a largo plazo de células T activadas.
PLC-γ también puede iniciar la vía NF-κB . DAG activa PKC-θ, que luego fosforila CARMA1, lo que hace que se despliegue y funcione como un andamio. Los dominios citosólicos se unen a un adaptador BCL10 a través de dominios CARD (dominios de activación y reclutamiento de caspasa); que luego se une a TRAF6, que está ubiquitinado en K63. : 513–523 [49] Esta forma de ubiquitinación no conduce a la degradación de las proteínas objetivo. En cambio, sirve para reclutar NEMO, IKKα y -β, y TAB1-2/TAK1. [50] TAK 1 fosforila IKK-β, que luego fosforila IκB permitiendo la ubiquitinación K48: conduce a la degradación proteasomal. Rel A y p50 pueden luego ingresar al núcleo y unirse al elemento de respuesta NF-κB. Esto, junto con la señalización NFAT, permite la activación completa del gen IL-2. [49]
Si bien en la mayoría de los casos la activación depende del reconocimiento del antígeno por parte del TCR, se han descrito vías alternativas para la activación. Por ejemplo, se ha demostrado que las células T citotóxicas se activan cuando son atacadas por otras células T CD8, lo que lleva a la tolerización de estas últimas. [51]
En la primavera de 2014, el experimento de activación de células T en el espacio (TCAS) se lanzó a la Estación Espacial Internacional en la misión SpaceX CRS-3 para estudiar cómo "las deficiencias en el sistema inmunológico humano se ven afectadas por un entorno de microgravedad". [52]
La activación de las células T está modulada por especies reactivas de oxígeno . [53]
Discriminación de antígenos
Una característica única de las células T es su capacidad de discriminar entre células sanas y anormales (por ejemplo, infectadas o cancerosas) en el cuerpo. [54] Las células sanas suelen expresar una gran cantidad de pMHC de origen propio en su superficie celular y, aunque el receptor de antígeno de la célula T puede interactuar con al menos un subconjunto de estos pMHC de origen propio, la célula T generalmente ignora estas células sanas. Sin embargo, cuando estas mismas células contienen incluso cantidades mínimas de pMHC derivado de patógenos, las células T pueden activarse e iniciar respuestas inmunitarias. La capacidad de las células T de ignorar las células sanas pero responder cuando estas mismas células contienen pMHC derivado de patógenos (o cáncer) se conoce como discriminación de antígenos. Los mecanismos moleculares que subyacen a este proceso son controvertidos. [54] [55]
Importancia clínica
Deficiencia
.jpg/440px-HIV-infected_T_cell_(6813384933).jpg)
Las causas de la deficiencia de células T incluyen la linfocitopenia de células T y/o defectos en la función de células T individuales. La insuficiencia completa de la función de las células T puede ser resultado de condiciones hereditarias como la inmunodeficiencia combinada grave (SCID), el síndrome de Omenn y la hipoplasia de cartílago y cabello . [56] Las causas de las insuficiencias parciales de la función de las células T incluyen el síndrome de inmunodeficiencia adquirida (SIDA) y condiciones hereditarias como el síndrome de DiGeorge (DGS), los síndromes de rotura cromosómica (CBS) y los trastornos combinados de células B y células T como la ataxia-telangiectasia (AT) y el síndrome de Wiskott-Aldrich (WAS). [56]
Los principales patógenos de preocupación en las deficiencias de células T son los patógenos intracelulares , incluidos el virus del herpes simple , Mycobacterium y Listeria . [57] Además, las infecciones fúngicas también son más comunes y graves en las deficiencias de células T. [57]
Cáncer
El cáncer de células T se denomina linfoma de células T y representa quizás uno de cada diez casos de linfoma no Hodgkin . [58] Las principales formas de linfoma de células T son:
- Linfoma extranodal de células T
- Linfomas cutáneos de células T : síndrome de Sézary y micosis fungoide
- Linfoma anaplásico de células grandes
- Linfoma angioinmunoblástico de células T
Agotamiento
Se ha sugerido que esta sección se divida en otro artículo titulado Agotamiento de las células T. ( Discutir ) (mayo de 2023) |
El agotamiento de las células T es un término mal definido o ambiguo. [59] [60] Existen tres enfoques para su definición. [59] "El primer enfoque define principalmente como agotadas las células que presentan la misma disfunción celular (típicamente, la ausencia de una respuesta efectora esperada). El segundo enfoque define principalmente como agotadas las células que son producidas por una causa dada (típicamente, pero no necesariamente, la exposición crónica a un antígeno). Finalmente, el tercer enfoque define principalmente como agotadas las células que presentan los mismos marcadores moleculares (típicamente, la proteína de muerte celular programada 1 [PD-1])". [59]
Las células T disfuncionales se caracterizan por una pérdida progresiva de función, cambios en los perfiles transcripcionales y expresión sostenida de receptores inhibidores. Al principio, las células pierden su capacidad de producir IL-2 y TNFα , a lo que le sigue la pérdida de la alta capacidad proliferativa y el potencial citotóxico, y finalmente conduce a su eliminación. Las células T agotadas generalmente indican niveles más altos de CD43 , CD69 y receptores inhibidores combinados con una menor expresión de CD62L y CD127 . El agotamiento puede desarrollarse durante infecciones crónicas, sepsis y cáncer. [61] Las células T agotadas conservan su agotamiento funcional incluso después de la exposición repetida al antígeno. [62]
Durante la infección crónica y la sepsis
El agotamiento de las células T puede ser provocado por varios factores como la exposición persistente a antígenos y la falta de ayuda de las células T CD4. [63] La exposición a antígenos también tiene efecto en el curso del agotamiento porque un tiempo de exposición más prolongado y una carga viral más alta aumentan la gravedad del agotamiento de las células T. Se necesita al menos 2 a 4 semanas de exposición para establecer el agotamiento. [64] Otro factor capaz de inducir el agotamiento son los receptores inhibidores, incluida la proteína de muerte celular programada 1 (PD1), CTLA-4 , la proteína de membrana de células T-3 (TIM3) y la proteína del gen de activación de linfocitos 3 (LAG3). [65] [66] Las moléculas solubles como las citocinas IL-10 o TGF-β también pueden desencadenar el agotamiento. [67] [68] Los últimos factores conocidos que pueden desempeñar un papel en el agotamiento de las células T son las células reguladoras. Las células Treg pueden ser una fuente de IL-10 y TGF-β y, por lo tanto, pueden desempeñar un papel en el agotamiento de las células T. [69] Además, el agotamiento de las células T se revierte después del agotamiento de las células Treg y el bloqueo de PD1. [70] El agotamiento de las células T también puede ocurrir durante la sepsis como resultado de la tormenta de citocinas. Más tarde, después del encuentro séptico inicial, las citocinas antiinflamatorias y las proteínas proapoptóticas toman el control para proteger al cuerpo del daño. La sepsis también conlleva una alta carga de antígenos e inflamación. En esta etapa de la sepsis, el agotamiento de las células T aumenta. [71] [72] Actualmente, existen estudios que apuntan a utilizar bloqueos de receptores inhibidores en el tratamiento de la sepsis. [73] [74] [75]
Durante el trasplante
Mientras que durante la infección se puede desarrollar un agotamiento de las células T tras la exposición persistente al antígeno después del trasplante de injerto, surge una situación similar con la presencia de aloantígeno. [76] Se ha demostrado que la respuesta de las células T disminuye con el tiempo después del trasplante de riñón. [77] Estos datos sugieren que el agotamiento de las células T juega un papel importante en la tolerancia de un injerto principalmente por el agotamiento de las células T CD8 alorreactivas. [72] [78] Varios estudios mostraron un efecto positivo de la infección crónica en la aceptación del injerto y su supervivencia a largo plazo mediada en parte por el agotamiento de las células T. [79] [80] [81] También se ha demostrado que el agotamiento de las células T del receptor proporciona condiciones suficientes para la transferencia de células NK . [82] Aunque hay datos que muestran que la inducción del agotamiento de las células T puede ser beneficiosa para el trasplante, también conlleva desventajas entre las que se pueden contar un mayor número de infecciones y el riesgo de desarrollo de tumores. [83]
Durante el cáncer
Durante el cáncer, el agotamiento de las células T desempeña un papel en la protección del tumor. Según las investigaciones, algunas células asociadas al cáncer, así como las propias células tumorales, pueden inducir activamente el agotamiento de las células T en el sitio del tumor. [84] [85] [86] El agotamiento de las células T también puede desempeñar un papel en las recaídas del cáncer, como se demostró en la leucemia. [87] Algunos estudios han sugerido que es posible predecir la recaída de la leucemia basándose en la expresión de los receptores inhibidores PD-1 y TIM-3 por las células T. [88] Muchos experimentos y ensayos clínicos se han centrado en los bloqueadores de los puntos de control inmunitarios en la terapia del cáncer, y algunos de ellos se han aprobado como terapias válidas que ahora se utilizan clínicamente. [89] Los receptores inhibidores a los que se dirigen estos procedimientos médicos son vitales en el agotamiento de las células T y su bloqueo puede revertir estos cambios. [90]
Véase también
- Receptor de antígeno quimérico de células T
- Reubicación específica del intestino
- Inmunoblasto
- Inmunosenescencia
- Célula parafolicular también llamada célula C
Referencias
- ^ "5. Células madre hematopoyéticas". Información sobre células madre . Bethesda, MD: Institutos Nacionales de Salud, Departamento de Salud y Servicios Humanos de EE. UU. 17 de junio de 2001. Archivado desde el original el 29 de octubre de 2016. Consultado el 21 de diciembre de 2021 .
- ^ ab Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Células T colaboradoras y activación de linfocitos". Biología molecular de la célula (4.ª ed.). Garland Science.
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Células T colaboradoras y activación de linfocitos". Molecular Biology of the Cell (4.ª ed.). Garland Science. pág. 1367.
Las células T... derivan su [nombre] de los órganos en los que se desarrollan. Las células T se desarrollan [maduran] en el timo.
- ^ Luckheeram RV, Zhou R, Verma AD, Xia B (2012). "Células CD4⁺T: diferenciación y funciones". Inmunología clínica y del desarrollo . 2012 : 925135. doi : 10.1155/2012/925135 . PMC 3312336. PMID 22474485 .
- ^ Kondo M (diciembre de 2016). "Un nicho para controlar tanto el mantenimiento como la pérdida de la pluripotencia en las células madre hematopoyéticas". Inmunidad . 45 (6): 1177–1179. doi : 10.1016/j.immuni.2016.12.003 . PMID 28002722.
- ^ Osborne LC, Dhanji S, Snow JW, Priatel JJ, Ma MC, Miners MJ, et al. (marzo de 2007). "Memoria de células T CD8 y respuestas primarias de células T CD4 deterioradas en ratones mutantes alfa de IL-7R". The Journal of Experimental Medicine . 204 (3): 619–631. doi :10.1084/jem.20061871. PMC 2137912 . PMID 17325202.
- ^ Murphy, Kenneth (2011). Inmunobiología de Janeway (8.ª ed.). Garland Science. págs. 301–305. ISBN 9780815342434.
- ^ Ross JO, Melichar HJ, Au-Yeung BB, Herzmark P, Weiss A, Robey EA (junio de 2014). "Distinct phase in the positive selection of CD8+ T cells distinct by intrathymic migrants and T-cell receptor signaling patterns" (Fases distintas en la selección positiva de células T CD8+ distinguidas por la migración intratímica y los patrones de señalización del receptor de células T). Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 111 (25): E2550–E2558. Bibcode :2014PNAS..111E2550R. doi : 10.1073/pnas.1408482111 . PMC 4078834 . PMID 24927565.
- ^ Starr TK, Jameson SC, Hogquist KA (1 de enero de 2003). "Selección positiva y negativa de células T". Revisión anual de inmunología . 21 (1): 139–176. doi :10.1146/annurev.immunol.21.120601.141107. PMID 12414722.
- ^ Zerrahn J, Held W, Raulet DH (marzo de 1997). "La reactividad del MHC del repertorio de células T antes de la selección positiva y negativa". Cell . 88 (5): 627–636. doi : 10.1016/S0092-8674(00)81905-4 . PMID 9054502. S2CID 15983629.
- ^ Hinterberger M, Aichinger M, Prazeres da Costa O, Voehringer D, Hoffmann R, Klein L (junio de 2010). "Función autónoma de las células epiteliales tímicas medulares en la tolerancia central de las células T CD4(+)" (PDF) . Nature Immunology . 11 (6): 512–519. doi :10.1038/ni.1874. PMID 20431619. S2CID 33154019.
- ^ Pekalski ML, García AR, Ferreira RC, Rainbow DB, Smyth DJ, Mashar M, Brady J, Savinykh N, Dopico XC, Mahmood S, Duley S, Stevens HE, Walker NM, Cutler AJ, Waldron-Lynch F, Dunger DB, Shannon-Lowe C, Coles AJ, Jones JL, Wallace C, Todd JA, Wicker LS (agosto de 2017). "Los emigrantes tímicos recientes neonatales y adultos producen IL-8 y expresan los receptores de complemento CR1 y CR2". JCI Insight . 2 (16). doi :10.1172/jci.insight.93739. PMC 5621870 . PMID 28814669.
- ^ Murphy, Kenneth (2011). Inmunobiología de Janeway (8.ª ed.). Garland Science. pág. 297. ISBN 9780815342434.
- ^ Haynes BF, Markert ML, Sempowski GD, Patel DD, Hale LP (2000). "El papel del timo en la reconstitución inmunitaria en el envejecimiento, el trasplante de médula ósea y la infección por VIH-1". Annu. Rev. Immunol . 18 : 529–560. doi :10.1146/annurev.immunol.18.1.529. PMID 10837068.
- ^ Gutcher I, Becher B (2007). "Citocinas derivadas de APC y polarización de células T en la inflamación autoinmune". J. Clin. Invest . 117 (5): 1119–27. doi :10.1172/JCI31720. PMC 1857272 . PMID 17476341.
- ^ Wang W, Sung N, Gilman-Sachs A, Kwak-Kim J (18 de agosto de 2020). "Perfiles de células T auxiliares (Th) en el embarazo y pérdidas recurrentes del embarazo: células Th1/Th2/Th9/Th17/Th22/Tfh". Frontiers in Immunology . 11 : 2025. doi : 10.3389/fimmu.2020.02025 . PMC 7461801 . PMID 32973809.
- ^ ab Saravia J, Chapman NM, Chi H (julio de 2019). "Diferenciación de células T colaboradoras". Inmunología celular y molecular . 16 (7): 634–643. doi :10.1038/s41423-019-0220-6. PMC 6804569. PMID 30867582 .
- ^ Jia L, Wu C (2014). "La biología y las funciones de las células Th22". Diferenciación de las células T colaboradoras y su función . Avances en medicina experimental y biología. Vol. 841. págs. 209-230. doi :10.1007/978-94-017-9487-9_8. ISBN 978-94-017-9486-2. Número de identificación personal 25261209.
- ^ Sallusto F, Lenig D, Förster R, Lipp M, Lanzavecchia A (1999). "Dos subconjuntos de linfocitos T de memoria con potenciales de búsqueda y funciones efectoras distintos". Nature . 401 (6754): 708–712. Bibcode :1999Natur.401..708S. doi :10.1038/44385. PMID 10537110. S2CID 4378970.
- ^ Akbar AN, Terry L, Timms A, Beverley PC, Janossy G (abril de 1988). "La pérdida de CD45R y la ganancia de reactividad de UCHL1 es una característica de las células T activadas". J. Immunol . 140 (7): 2171–8. doi : 10.4049/jimmunol.140.7.2171 . PMID 2965180. S2CID 22340282.
- ^ Willinger T, Freeman T, Hasegawa H, McMichael AJ, Callan MF (2005). "Las firmas moleculares distinguen la memoria central humana de los subconjuntos de células T CD8 de memoria efectora" (PDF) . Journal of Immunology . 175 (9): 5895–903. doi : 10.4049/jimmunol.175.9.5895 . PMID 16237082. S2CID 16412760.
- ^ Koch S, Larbi A, Derhovanessian E, Özcelik D, Naumova E, Pawelec G (2008). "Análisis citométrico de flujo multiparamétrico de subconjuntos de células T CD4 y CD8 en personas jóvenes y mayores". Inmunidad y envejecimiento . 5 (6): 6. doi : 10.1186/1742-4933-5-6 . PMC 2515281 . PMID 18657274.
- ^ Shin H, Iwasaki A (septiembre de 2013). "Células T de memoria residentes en tejidos". Revisiones inmunológicas . 255 (1): 165–81. doi :10.1111/imr.12087. PMC 3748618 . PMID 23947354.
- ^ Lee YJ, Jameson SC, Hogquist KA (2011). "Memoria alternativa en el linaje de células T CD8". Tendencias en Inmunología . 32 (2): 50–56. doi :10.1016/j.it.2010.12.004. PMC 3039080 . PMID 21288770.
- ^ Marusina AI, Ono Y, Merleev AA, Shimoda M, Ogawa H, Wang EA, Kondo K, Olney L, Luxardi G, Miyamura Y, Yilma TD, Villalobos IB, Bergstrom JW, Kronenberg DG, Soulika AM, Adamopoulos IE, Maverakis E (2017). "Memoria virtual CD4+: las células T sin experiencia en antígenos residen en los compartimentos de células T ingenuas, reguladoras y de memoria a frecuencias similares, implicaciones para la autoinmunidad". Journal of Autoimmunity . 77 : 76–88. doi :10.1016/j.jaut.2016.11.001. PMC 6066671 . PMID 27894837.
- ^ Abbas AK, Benoist C, Bluestone JA, Campbell DJ, Ghosh S, Hori S, Jiang S, Kuchroo VK, Mathis D, Roncarolo MG, Rudensky A, Sakaguchi S, Shevach EM, Vignali DA, Ziegler SF (2013). "Células T reguladoras: recomendaciones para simplificar la nomenclatura". Nat. Inmunol . 14 (4): 307–8. doi : 10.1038/ni.2554 . PMID 23507634. S2CID 11294516.
- ^ Singh B, Schwartz JA, Sandrock C, Bellemore SM, Nikoopour E (2013). "Modulación de enfermedades autoinmunes por células T auxiliares reguladoras productoras de interleucina (IL)-17 (Th17)". Indian J. Med. Res . 138 (5): 591–4. PMC 3928692. PMID 24434314 .
- ^ Godfrey DI, Uldrich AP, McCluskey J, Rossjohn J, Moody DB (noviembre de 2015). "La creciente familia de células T no convencionales". Nature Immunology . 16 (11): 1114–1123. doi :10.1038/ni.3298. PMID 26482978. S2CID 30992456.
- ^ de Araújo ND, Gama FM, de Souza Barros M, Ribeiro TL, Alves FS, Xabregas LA, et al. (2021). "Traducción de células T no convencionales y sus funciones en la inmunidad antitumoral de la leucemia". Revista de investigación inmunológica . 2021 : 6633824. doi : 10.1155/2021/6633824 . PMC 7808823. PMID 33506055 .
- ^ Mallevaey T, Fontaine J, Breuilh L, Paget C, Castro-Keller A, Vendeville C, Capron M, Leite-de-Moraes M, Trottein F, Faveeuw C (mayo de 2007). "Las células T asesinas naturales invariantes y no invariantes ejercen funciones reguladoras opuestas en la respuesta inmunitaria durante la esquistosomiasis murina". Infección e inmunidad . 75 (5): 2171–80. doi :10.1128/IAI.01178-06. PMC 1865739 . PMID 17353286.
- ^ abcd Napier RJ, Adams EJ, Gold MC, Lewinsohn DM (6 de julio de 2015). "El papel de las células T invariantes asociadas a las mucosas en la inmunidad antimicrobiana". Frontiers in Immunology . 6 : 344. doi : 10.3389/fimmu.2015.00344 . PMC 4492155 . PMID 26217338.
- ^ Gold MC, Lewinsohn DM (agosto de 2011). "Células T invariantes asociadas a las mucosas y la respuesta inmunitaria a la infección". Microbes and Infection . 13 (8–9): 742–8. doi :10.1016/j.micinf.2011.03.007. PMC 3130845 . PMID 21458588.
- ^ Eckle SB, Corbett AJ, Keller AN, Chen Z, Godfrey DI, Liu L, Mak JY, Fairlie DP, Rossjohn J, McCluskey J (diciembre de 2015). "Reconocimiento de precursores y subproductos de vitamina B por células T invariantes asociadas a las mucosas". The Journal of Biological Chemistry . 290 (51): 30204–11. doi : 10.1074/jbc.R115.685990 . PMC 4683245 . PMID 26468291.
- ^ Ussher JE, Klenerman P, Willberg CB (8 de octubre de 2014). "Células T invariantes asociadas a las mucosas: nuevos actores en la inmunidad antibacteriana". Frontiers in Immunology . 5 : 450. doi : 10.3389/fimmu.2014.00450 . PMC 4189401 . PMID 25339949.
- ^ abc Howson LJ, Salio M, Cerundolo V (16 de junio de 2015). "Células T invariantes asociadas a las mucosas restringidas por MR1 y su activación durante enfermedades infecciosas". Frontiers in Immunology . 6 : 303. doi : 10.3389/fimmu.2015.00303 . PMC 4468870 . PMID 26136743.
- ^ Hinks TS (mayo de 2016). "Células T invariantes asociadas a las mucosas en autoinmunidad, enfermedades inmunomediadas y enfermedades de las vías respiratorias". Inmunología . 148 (1): 1–12. doi :10.1111/imm.12582. PMC 4819138 . PMID 26778581.
- ^ Bianchini E, De Biasi S, Simone AM, Ferraro D, Sola P, Cossarizza A, Pinti M (marzo de 2017). "Células T asesinas naturales invariantes y células T invariantes asociadas a la mucosa en la esclerosis múltiple". Immunology Letters . 183 : 1–7. doi :10.1016/j.imlet.2017.01.009. PMID 28119072.
- ^ Serriari NE, Eoche M, Lamotte L, Lion J, Fumery M, Marcelo P, Chatelain D, Barre A, Nguyen-Khac E, Lantz O, Dupas JL, Treiner E (mayo de 2014). "Las células T invariantes innatas asociadas a la mucosa (MAIT) se activan en las enfermedades inflamatorias del intestino". Inmunología Clínica y Experimental . 176 (2): 266–74. doi :10.1111/cei.12277. PMC 3992039 . PMID 24450998.
- ^ Huang S, Martin E, Kim S, Yu L, Soudais C, Fremont DH, Lantz O, Hansen TH (mayo de 2009). "La presentación del antígeno MR1 a las células T invariantes asociadas a las mucosas fue altamente conservada en la evolución". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (20): 8290–5. Bibcode :2009PNAS..106.8290H. doi : 10.1073/pnas.0903196106 . PMC 2688861 . PMID 19416870.
- ^ Chua WJ, Hansen TH (noviembre de 2010). "Bacterias, células T invariantes asociadas a las mucosas y MR1". Inmunología y biología celular . 88 (8): 767–9. doi : 10.1038/icb.2010.104 . PMID 20733595. S2CID 27717815.
- ^ Kjer-Nielsen L, Patel O, Corbett AJ, Le Nours J, Meehan B, Liu L, Bhati M, Chen Z, Kostenko L, Reantragoon R, Williamson NA, Purcell AW, Dudek NL, McConville MJ, O'Hair RA , Khairallah GN, Godfrey DI, Fairlie DP, Rossjohn J, McCluskey J (noviembre de 2012). "MR1 presenta metabolitos microbianos de la vitamina B a las células MAIT" (PDF) . Naturaleza . 491 (7426): 717–23. Código Bib :2012Natur.491..717K. doi : 10.1038/naturaleza11605. PMID 23051753. S2CID 4419703.
- ^ El folleto de recursos del NIAID "Comprensión del sistema inmunológico (pdf)".
- ^ Williams MA, Bevan MJ (1 de enero de 2007). "Diferenciación de CTL efectores y de memoria". Revisión anual de inmunología . 25 (1): 171–92. doi :10.1146/annurev.immunol.25.022106.141548. PMID 17129182.
- ^ Janssen EM, Lemmens EE, Wolfe T, Christen U, von Herrath MG, Schoenberger SP (febrero de 2003). "Las células T CD4+ son necesarias para la expansión secundaria y la memoria en los linfocitos T CD8+". Nature . 421 (6925): 852–6. Bibcode :2003Natur.421..852J. doi :10.1038/nature01441. PMID 12594515. S2CID 574770.
- ^ Shedlock DJ, Shen H (abril de 2003). "Requisitos de que las células T CD4 ayuden a generar una memoria funcional de las células T CD8". Science . 300 (5617): 337–9. Bibcode :2003Sci...300..337S. doi :10.1126/science.1082305. PMID 12690201. S2CID 38040377.
- ^ Sun JC, Williams MA, Bevan MJ (septiembre de 2004). "Las células T CD4+ son necesarias para el mantenimiento, no la programación, de las células T CD8+ de memoria después de una infección aguda". Nature Immunology . 5 (9): 927–33. doi :10.1038/ni1105. PMC 2776074 . PMID 15300249.
- ^ Jennifer Rolland y Robyn O'Hehir, "Desactivación de las células T: péptidos para el tratamiento de enfermedades alérgicas", Today's life science publishing, 1999, página 32
- ^ Maverakis E, Kim K, Shimoda M, Gershwin M, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (2015). "Glicanos en el sistema inmunológico y la teoría de los glicanos alterados de la autoinmunidad". J Autoimmun . 57 (6): 1–13. doi :10.1016/j.jaut.2014.12.002. PMC 4340844 . PMID 25578468.
- ^ ab Tatham P, Gomperts BD, Kramer IM (2003). Transducción de señales . Ámsterdam: Elsevier Academic Press. ISBN 978-0-12-289632-3.
- ^ Wu H, Arron JR (noviembre de 2003). "TRAF6, un puente molecular que abarca la inmunidad adaptativa, la inmunidad innata y la osteoinmunología". BioEssays . 25 (11): 1096–105. doi :10.1002/bies.10352. PMID 14579250. S2CID 28521713.
- ^ Milstein O, Hagin D, Lask A, Reich-Zeliger S, Shezen E, Ophir E, Eidelstein Y, Afik R, Antebi YE, Dustin ML, Reisner Y (enero de 2011). "Los CTL responden con activación y secreción de gránulos cuando sirven como objetivos para el reconocimiento de células T". Blood . 117 (3): 1042–52. doi :10.1182/blood-2010-05-283770. PMC 3035066 . PMID 21045195.
- ^ Graham W (14 de abril de 2014). "SpaceX está lista para el lanzamiento de la CRS-3 Dragon y nuevos hitos". NASAspaceflight.com . Consultado el 14 de abril de 2014 .
- ^ Belikov AV, Schraven B, Simeoni L (octubre de 2015). "Células T y especies reactivas de oxígeno". Revista de Ciencias Biomédicas . 22 : 85. doi : 10.1186/s12929-015-0194-3 . PMC 4608155 . PMID 26471060.
- ^ ab Feinerman O, Germain RN, Altan-Bonnet G (2008). "Desafíos cuantitativos en la comprensión de la discriminación de ligandos por parte de las células T de la cadena alfa". Mol. Immunol . 45 (3): 619–31. doi :10.1016/j.molimm.2007.03.028. PMC 2131735. PMID 17825415 .
- ^ Dushek O, van der Merwe PA (2014). "Un modelo de discriminación de antígenos mediante la reunificación inducida". Trends Immunol . 35 (4): 153–8. doi :10.1016/j.it.2014.02.002. PMC 3989030 . PMID 24636916.
- ^ Trastornos de las células T en eMedicine
- ^ ab Jones J, Bannister BA, Gillespie SH, eds. (2006). Infección: microbiología y tratamiento. Wiley-Blackwell. pág. 435. ISBN 978-1-4051-2665-6.
- ^ "Los linfomas" (PDF) . The Leukemia & Lymphoma Society. Mayo de 2006. pág. 2. Consultado el 7 de abril de 2008 .
- ^ abc Kaminski H, Lemoine M, Pradeu T (septiembre de 2021). "Agotamiento inmunológico: ¿cómo hacer operativo un concepto dispar?". PLOS Pathogens . 17 (9): e1009892. doi : 10.1371/journal.ppat.1009892 . PMC 8460019 . PMID 34555119.
- ^ Blank CU, Haining WN, Held W, Hogan PG, Kallies A, Lugli E, et al. (noviembre de 2019). "Definición del 'agotamiento de células T'". Nature Reviews. Inmunología . 19 (11): 665–674. doi :10.1038/s41577-019-0221-9. PMC 7286441 . PMID 31570879.
- ^ Yi JS, Cox MA, Zajac AJ (abril de 2010). "Agotamiento de células T: características, causas y conversión". Inmunología . 129 (4): 474–81. doi :10.1111/j.1365-2567.2010.03255.x. PMC 2842494 . PMID 20201977.
- ^ Wang Q, Pan W, Liu Y, Luo J, Zhu D, Lu Y, Feng X, Yang X, Dittmer U, Lu M, Yang D, Liu J (2018). "Las células T CD8+ específicas del virus de la hepatitis B mantienen el agotamiento funcional después de la reexposición al antígeno en un entorno inmunológico de activación aguda". Front Immunol . 9 : 219. doi : 10.3389/fimmu.2018.00219 . PMC 5816053 . PMID 29483916.
- ^ Matloubian M, Concepcion RJ, Ahmed R (diciembre de 1994). "Las células T CD4+ son necesarias para mantener las respuestas de las células T citotóxicas CD8+ durante la infección viral crónica". Journal of Virology . 68 (12): 8056–63. doi :10.1128/JVI.68.12.8056-8063.1994. PMC 237269 . PMID 7966595.
- ^ Angelosanto JM, Blackburn SD, Crawford A, Wherry EJ (agosto de 2012). "Pérdida progresiva del potencial de memoria de las células T y compromiso con el agotamiento durante la infección viral crónica". Journal of Virology . 86 (15): 8161–70. doi :10.1128/JVI.00889-12. PMC 3421680 . PMID 22623779.
- ^ Wherry EJ (junio de 2011). "Agotamiento de células T". Nature Immunology . 12 (6): 492–9. doi :10.1038/ni.2035. PMID 21739672. S2CID 11052693.
- ^ Okagawa T, Konnai S, Nishimori A, Maekawa N, Goto S, Ikebuchi R, Kohara J, Suzuki Y, Yamada S, Kato Y, Murata S, Ohashi K (junio de 2018). "+ Células T durante la infección por el virus de la leucemia bovina". Investigación Veterinaria . 49 (1): 50. doi : 10.1186/s13567-018-0543-9 . PMC 6006750 . PMID 29914540.
- ^ Brooks DG, Trifilo MJ, Edelmann KH, Teyton L, McGavern DB, Oldstone MB (noviembre de 2006). "La interleucina-10 determina la eliminación o persistencia viral in vivo". Nature Medicine . 12 (11): 1301–9. doi :10.1038/nm1492. PMC 2535582 . PMID 17041596.
- ^ Tinoco R, Alcalde V, Yang Y, Sauer K, Zuniga EI (julio de 2009). "La señalización del factor de crecimiento transformante beta intrínseco a la célula media la eliminación de células T CD8+ específicas del virus y la persistencia viral in vivo". Inmunidad . 31 (1): 145–57. doi :10.1016/j.immuni.2009.06.015. PMC 3039716 . PMID 19604493.
- ^ Veiga-Parga T, Sehrawat S, Rouse BT (septiembre de 2013). "El papel de las células T reguladoras durante la infección viral". Revisiones inmunológicas . 255 (1): 182–96. doi :10.1111/imr.12085. PMC 3748387 . PMID 23947355.
- ^ Penaloza-MacMaster P, Kamphorst AO, Wieland A, Araki K, Iyer SS, West EE, O'Mara L, Yang S, Konieczny BT, Sharpe AH, Freeman GJ, Rudensky AY, Ahmed R (agosto de 2014). "Interacción entre las células T reguladoras y PD-1 en la modulación del agotamiento de las células T y el control viral durante la infección crónica por LCMV". The Journal of Experimental Medicine . 211 (9): 1905–18. doi :10.1084/jem.20132577. PMC 4144726 . PMID 25113973.
- ^ Otto GP, Sossdorf M, Claus RA, Rödel J, Menge K, Reinhart K, Bauer M, Riedemann NC (julio de 2011). "La fase tardía de la sepsis se caracteriza por una mayor carga microbiológica y una mayor tasa de mortalidad". Cuidados críticos . 15 (4): R183. doi : 10.1186/cc10332 . PMC 3387626 . PMID 21798063.
- ^ ab Boomer JS, To K, Chang KC, Takasu O, Osborne DF, Walton AH, Bricker TL, Jarman SD, Kreisel D, Krupnick AS, Srivastava A, Swanson PE, Green JM, Hotchkiss RS (diciembre de 2011). "Inmunosupresión en pacientes que mueren de sepsis y fallo multiorgánico". JAMA . 306 (23): 2594–605. doi :10.1001/jama.2011.1829. PMC 3361243 . PMID 22187279.
- ^ Shindo Y, McDonough JS, Chang KC, Ramachandra M, Sasikumar PG, Hotchkiss RS (febrero de 2017). "El péptido anti-PD-L1 mejora la supervivencia en la sepsis". The Journal of Surgical Research . 208 : 33–39. doi :10.1016/j.jss.2016.08.099. PMC 5535083 . PMID 27993215.
- ^ Patera AC, Drewry AM, Chang K, Beiter ER, Osborne D, Hotchkiss RS (diciembre de 2016). "Ciencia de primera línea: los defectos en la función inmunitaria en pacientes con sepsis están asociados con la expresión de PD-1 o PD-L1 y pueden restaurarse mediante anticuerpos dirigidos a PD-1 o PD-L1". Journal of Leukocyte Biology . 100 (6): 1239–1254. doi :10.1189/jlb.4hi0616-255r. PMC 5110001 . PMID 27671246.
- ^ Wei Z, Li P, Yao Y, Deng H, Yi S, Zhang C, Wu H, Xie X, Xia M, He R, Yang XP, Tang ZH (julio de 2018). "La alfa-lactosa revierte la lesión hepática mediante el bloqueo de la apoptosis de CD8 mediada por Tim-3 en la sepsis". Inmunología clínica . 192 : 78–84. doi :10.1016/j.clim.2018.04.010. PMID 29689313. S2CID 21657071.
- ^ Wells AD, Li XC, Strom TB, Turka LA (mayo de 2001). "El papel de la eliminación de células T periféricas en la tolerancia al trasplante". Philosophical Transactions of the Royal Society of London. Serie B, Ciencias Biológicas . 356 (1409): 617–23. doi :10.1098/rstb.2001.0845. PMC 1088449 . PMID 11375065.
- ^ Halloran PF, Chang J, Famulski K, Hidalgo LG, Salazar ID, Merino Lopez M, Matas A, Picton M, de Freitas D, Bromberg J, Serón D, Sellarés J, Einecke G, Reeve J (julio de 2015). "Desaparición del rechazo mediado por células T a pesar del rechazo continuo mediado por anticuerpos en los receptores tardíos de trasplante renal". Revista de la Sociedad Americana de Nefrología . 26 (7): 1711–20. doi :10.1681/ASN.2014060588. PMC 4483591 . PMID 25377077.
- ^ Steger U, Denecke C, Sawitzki B, Karim M, Jones ND, Wood KJ (mayo de 2008). "Diferenciación exhaustiva de células T CD8+ alorreactivas: fundamental para determinar la aceptación o el rechazo del injerto" (PDF) . Trasplante . 85 (9): 1339–47. doi :10.1097/TP.0b013e31816dd64a. PMID 18475193. S2CID 33409478.
- ^ de Mare-Bredemeijer EL, Shi XL, Mancham S, van Gent R, van der Heide-Mulder M, de Boer R, Heemskerk MH, de Jonge J, van der Laan LJ, Metselaar HJ, Kwekkeboom J (agosto de 2015). "La expresión de CD244 inducida por citomegalovirus después de un trasplante de hígado se asocia con hiporrespuesta de células T CD8 + al aloantígeno". Revista de Inmunología . 195 (4): 1838–48. doi : 10.4049/jimmunol.1500440 . PMID 26170387.
- ^ Gassa A, Jian F, Kalkavan H, Duhan V, Honke N, Shaabani N, Friedrich SK, Dolff S, Wahlers T, Kribben A, Hardt C, Lang PA, Witzke O, Lang KS (2016). "IL-10 induce el agotamiento de las células T durante el trasplante de corazones infectados por virus". Fisiología celular y bioquímica . 38 (3): 1171–81. doi : 10.1159/000443067 . PMID 26963287.
- ^ Shi XL, de Mare-Bredemeijer EL, Tapirdamaz Ö, Hansen BE, van Gent R, van Campenhout MJ, Mancham S, Litjens NH, Betjes MG, van der Eijk AA, Xia Q, van der Laan LJ, de Jonge J, Metselaar HJ, Kwekkeboom J (septiembre de 2015). "La infección primaria por CMV se asocia con hiporreactividad de células T específicas del donante y menos rechazos agudos tardíos después del trasplante de hígado". Revista americana de trasplantes . 15 (9): 2431–42. doi : 10.1111/ajt.13288 . PMID 25943855. S2CID 5348557.
- ^ Williams RL, Cooley S, Bachanova V, Blazar BR, Weisdorf DJ, Miller JS, Verneris MR (marzo de 2018). "Agotamiento de las células T receptoras y transferencia adoptiva exitosa de células asesinas naturales haploidénticas". Biología del trasplante de sangre y médula ósea . 24 (3): 618–622. doi :10.1016/j.bbmt.2017.11.022. PMC 5826878 . PMID 29197679.
- ^ Woo SR, Turnis ME, Goldberg MV, Bankoti J, Selby M, Nirschl CJ, Bettini ML, Gravano DM, Vogel P, Liu CL, Tangsombatvisit S, Grosso JF, Netto G, Smeltzer MP, Chaux A, Utz PJ, Workman CJ, Pardoll DM, Korman AJ, Drake CG, Vignali DA (febrero de 2012). "Las moléculas inmunoinhibidoras LAG-3 y PD-1 regulan sinérgicamente la función de las células T para promover el escape inmunológico tumoral". Investigación del cáncer . 72 (4): 917–27. doi :10.1158/0008-5472.CAN-11-1620. PMC 3288154 . PMID 22186141.
- ^ Zelle-Rieser C, Thangavadivel S, Biedermann R, Brunner A, Stoitzner P, Willenbacher E, et al. (noviembre de 2016). "Las células T en el mieloma múltiple muestran características de agotamiento y senescencia en el sitio del tumor". Journal of Hematology & Oncology . 9 (1): 116. doi : 10.1186/s13045-016-0345-3 . PMC 5093947 . PMID 27809856.
- ^ Lakins MA, Ghorani E, Munir H, Martins CP, Shields JD (marzo de 2018). "Los fibroblastos asociados al cáncer inducen la eliminación específica de antígeno de las células T CD8+ para proteger las células tumorales". Nature Communications . 9 (1): 948. Bibcode :2018NatCo...9..948L. doi :10.1038/s41467-018-03347-0. PMC 5838096 . PMID 29507342.
- ^ Conforti L (febrero de 2012). "La red de canales iónicos en los linfocitos T, un objetivo para la inmunoterapia". Inmunología clínica . 142 (2): 105–106. doi :10.1016/j.clim.2011.11.009. PMID 22189042.
- ^ Liu L, Chang YJ, Xu LP, Zhang XH, Wang Y, Liu KY, Huang XJ (mayo de 2018). "El agotamiento de las células T caracterizado por una actividad citotóxica restringida de MHC de clase I y II comprometida se asocia con una recaída aguda de leucemia linfoblástica B después del trasplante alogénico de células madre hematopoyéticas". Inmunología clínica . 190 : 32–40. doi :10.1016/j.clim.2018.02.009. PMID 29477343.
- ^ Kong Y, Zhang J, Claxton DF, Ehmann WC, Rybka WB, Zhu L, et al. (julio de 2015). "Las células T PD-1(hi)TIM-3(+) se asocian con la recaída de la leucemia y la predicen en pacientes con leucemia mieloide aguda después de un trasplante alogénico de células madre". Blood Cancer Journal . 5 (7): e330. doi :10.1038/bcj.2015.58. PMC 4526784 . PMID 26230954.
- ^ "Inhibidores de puntos de control inmunitario e inmunoterapias aprobados por la FDA de EE. UU." Agencia de redacción médica | 香港醫學作家 | MediPR | MediPaper Hong Kong . 2018-08-21 . Consultado el 2018-09-22 .
- ^ Bhadra R, Gigley JP, Weiss LM, Khan IA (mayo de 2011). "Control de la reactivación de Toxoplasma mediante el rescate de la respuesta disfuncional de las células T CD8+ mediante el bloqueo de PD-1-PDL-1". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 108 (22): 9196–9201. Bibcode :2011PNAS..108.9196B. doi : 10.1073/pnas.1015298108 . PMC 3107287 . PMID 21576466.
Lectura adicional
- Janeway Jr CA, Travers P, Walport M, Shlomchik MJ (2001). Inmunobiología 5: el sistema inmunológico en la salud y la enfermedad (5.ª ed.). Nueva York: Garland Science. ISBN 978-0-8153-3642-6.
- "El sistema inmunitario" (PDF) . Instituto Nacional de Alergias y Enfermedades Infecciosas . Septiembre de 2003. Archivado desde el original (PDF) el 25 de junio de 2009.
