Reducción de costes
En química orgánica , umpolung ( en alemán: [ˈʔʊmˌpoːlʊŋ] ) o inversión de polaridad es la modificación química de un grupo funcional con el objetivo de invertir la polaridad de ese grupo. [1] [2] Esta modificación permite reacciones secundarias de este grupo funcional que de otro modo no serían posibles. [3] El concepto fue introducido por D. Seebach (de ahí la palabra alemana umpolung para polaridad invertida) y EJ Corey . El análisis de polaridad durante el análisis retrosintético le dice a un químico cuándo se requieren tácticas de umpolung para sintetizar una molécula objetivo.
Introducción
La gran mayoría de las moléculas orgánicas importantes contienen heteroátomos, que polarizan los esqueletos carbonados en virtud de su electronegatividad. Por lo tanto, en las reacciones orgánicas estándar, la mayoría de los nuevos enlaces se forman entre átomos de polaridad opuesta. Este puede considerarse el modo "normal" de reactividad.
Una consecuencia de esta polarización natural de las moléculas es que los esqueletos de carbono sustituidos con heteroátomos 1,3 y 1,5 son extremadamente fáciles de sintetizar ( reacción aldólica , condensación de Claisen , reacción de Michael , reordenamiento de Claisen , reacción de Diels-Alder ), mientras que los patrones de sustitución de heteroátomos 1,2, 1,4 y 1,6 son más difíciles de acceder a través de la reactividad "normal". Por lo tanto, es importante comprender y desarrollar métodos para inducir el umpolung en las reacciones orgánicas.
Ejemplos
El método más simple para obtener patrones de sustitución de heteroátomos 1,2, 1,4 y 1,6 es comenzar con ellos. Los procesos bioquímicos e industriales pueden proporcionar fuentes económicas de sustancias químicas que tienen patrones de sustitución normalmente inaccesibles. Por ejemplo, los aminoácidos, el ácido oxálico, el ácido succínico, el ácido adípico, el ácido tartárico y la glucosa son abundantes y proporcionan patrones de sustitución no rutinarios.
Umpolung de tipo cianuro
El reactivo canónico de umpolung es el ion cianuro . El ion cianuro es inusual en el sentido de que se esperaría que un carbono triplemente enlazado a un nitrógeno tuviera una polaridad (+) debido a la mayor electronegatividad del átomo de nitrógeno. Sin embargo, la carga negativa del ion cianuro se localiza en el carbono, lo que le da una carga formal (-). Esta ambivalencia química da como resultado umpolung en muchas reacciones en las que interviene el cianuro.
Por ejemplo, el cianuro es un catalizador clave en la condensación de benzoína , un ejemplo clásico de inversión de polaridad.

El resultado neto de la reacción de la benzoína es que se ha formado un enlace entre dos carbonos que normalmente son electrófilos.
Carbenos N-heterocíclicos

Los carbenos N-heterocíclicos son similares al cianuro en reactividad. Al igual que el cianuro, tienen una ambivalencia química inusual, que les permite provocar umpolung en las reacciones en las que participan. El carbeno tiene seis electrones: dos en cada uno de los enlaces simples carbono-nitrógeno, dos en su orbital sp2 - hibridado y un orbital p vacío. El par solitario sp2 actúa como donante de electrones, mientras que el orbital p vacío es capaz de actuar como aceptor de electrones.
En este ejemplo, el carbono β del éster α,β-insaturado 1 actúa formalmente como un nucleófilo, [4] mientras que normalmente se esperaría que fuera un aceptor de Michael .

Este carbeno reacciona con el éster α,β-insaturado 1 en la posición β formando el enolato intermedio 2. A través de la tautomerización, 2b puede desplazar el átomo de bromo terminal a 3. Una reacción de eliminación regenera el carbeno y libera el producto 4 .
A modo de comparación: en la reacción de Baylis-Hillman, el mismo átomo de carbono β electrófilo es atacado por un reactivo, pero el resultado es la activación de la posición α de la enona como nucleófilo.
Pirofosfato de tiamina
Los procesos biológicos pueden emplear una reactividad de umpolung similar a la del cianuro sin tener que depender del ion cianuro tóxico. El pirofosfato de tiamina (TPP) (que es en sí mismo un carbeno N-heterocíclico ) cumple una función funcionalmente idéntica. El anillo de tiazolio en el TPP se desprotona dentro del núcleo hidrofóbico de la enzima, [5] lo que da como resultado un carbeno que es capaz de umpolung.
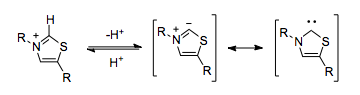
Las enzimas que utilizan TPP como cofactor pueden catalizar la reactividad de umpolung, como la descarboxilación del piruvato.
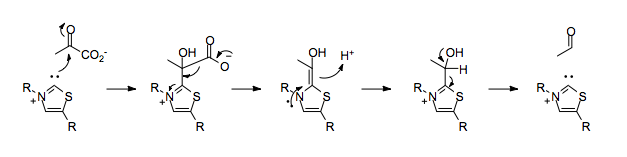
En ausencia de TPP, la descarboxilación del piruvato daría lugar a la colocación de una carga negativa en el carbono carbonílico, lo que iría en contra de la polarización normal del doble enlace carbono-oxígeno.
Anillos de 3 miembros
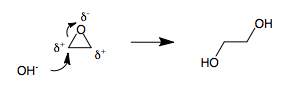
Los anillos de 3 miembros son fracciones tensas en la química orgánica. Cuando un anillo de 3 miembros contiene un heteroátomo, como en un epóxido o en un intermedio de bromonio , los tres átomos del anillo se polarizan. Es imposible asignar polaridades (+) y (-) a un anillo de 3 miembros sin tener dos átomos adyacentes con la misma polaridad. Por lo tanto, siempre que un nucleófilo abre un anillo polarizado de 3 miembros, inevitablemente se produce una umpolung. [6] Por ejemplo, la apertura de óxido de etileno con hidróxido conduce al etilenglicol .
Química de la retransmisión de aniones/retransmisión de carbonilo
La química del ditiano es un ejemplo clásico de inversión de polaridad. Esto se puede observar en la reacción de Corey-Seebach .
Por lo general, el átomo de oxígeno del grupo carbonilo es más electronegativo que el átomo de carbono y, por lo tanto, el grupo carbonilo reacciona como electrófilo en el carbono. Esta polaridad se puede invertir cuando el grupo carbonilo se convierte en un ditiano o un tioacetal . En la terminología de los sintones , el grupo carbonilo ordinario es un catión acilo y el ditiano es un anión acilo enmascarado .
Cuando el ditiano se deriva de un aldehído como el acetaldehído, el protón acilo puede ser abstraído por n -butillitio en THF a bajas temperaturas. El 2-litio-1,3-ditiano así generado reacciona como un nucleófilo en desplazamiento nucleofílico con haluros de alquilo como el bromuro de bencilo , con otros compuestos carbonílicos como la ciclohexanona u oxiranos como el fenilepoxietano, que se muestran a continuación. Después de la hidrólisis del grupo ditiano, los productos finales de la reacción son α-alquil-cetonas o α-hidroxi-cetonas . Un reactivo común para la hidrólisis del ditiano es el (bis(trifluoroacetoxi)yodo)benceno .

La química del ditiano abre el camino a muchas nuevas transformaciones químicas. Un ejemplo se encuentra en la llamada química de relevo de aniones en la que una carga negativa de un grupo funcional aniónico resultante de una reacción orgánica se transfiere a una ubicación diferente dentro del mismo marco de carbono y está disponible para la reacción secundaria. [7] En este ejemplo de una reacción de múltiples componentes, tanto el formaldehído ( 1 ) como el isopropilaldehído ( 8 ) se convierten en ditianos 3 y 9 con 1,3-propanoditiol . El sulfuro 3 primero se silila por reacción con terc -butillitio y luego cloruro de trimetilsililo 4 y luego se elimina el segundo protón acilo y reacciona con (−)- epiclorhidrina ópticamente activa 6 reemplazando al cloro. Este compuesto sirve como sustrato para la reacción con el otro ditiano 9 al producto de apertura del anillo de oxirano 10 . Bajo la influencia de la base polar HMPA , el 10 se reorganiza en un reordenamiento 1,4-Brook al éter sililo 11 reactivando el grupo ditiano del formaldehído como anión (de ahí el concepto de relevo de aniones). Este grupo ditiano reacciona con el oxirano 12 al alcohol 13 y en el paso final los grupos sulfuro se eliminan con (bis(trifluoroacetoxi)yodo)benceno .
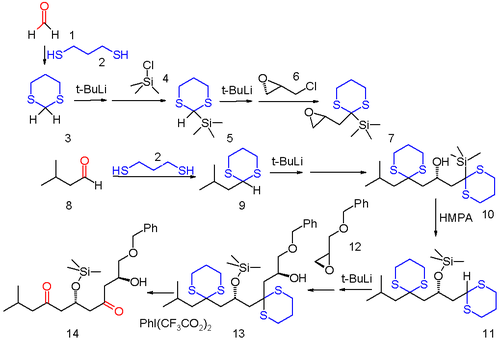
La táctica de la química del relevo de aniones se ha aplicado elegantemente en la síntesis total de moléculas complejas de actividad biológica significativa, como la espongistatina 2 [8] y la mandelalida A. [9] [10]
Formación de enlaces oxidativos
Es posible formar un enlace entre dos carbonos de polaridad (-) utilizando un oxidante como el yodo . En esta síntesis total de enterolactona , [11] la relación 1,4- de los sustituyentes de oxígeno se ensambla mediante el homoacoplamiento oxidativo de un enolato de carboxilato utilizando yodo como oxidante.
Reducción de amina
Por lo general, el átomo de nitrógeno en el grupo amina reacciona como un nucleófilo a través de su par solitario . Esta polaridad se puede invertir cuando una amina primaria o secundaria se sustituye con un buen grupo saliente (como un átomo de halógeno o un grupo alcoxi ). El compuesto N-sustituido resultante puede comportarse como un electrófilo en el átomo de nitrógeno y reaccionar con un nucleófilo como, por ejemplo, en la aminación electrófila de carbaniones . [12]
Reducción de hidrazona
Recientemente, C.-J. Li et al. han convertido varios carbonilos en sustitutos de reactivos organometálicos mediante la umpolung de hidrazona. En presencia de un catalizador, de manera similar a los reactivos organometálicos, las hidrazonas pueden sufrir adiciones nucleofílicas, adiciones conjugadas y acoplamientos cruzados catalizados por metales de transición con varios electrófilos para formar nuevos enlaces CC. [13]
Referencias
- ^ Seebach, D. (1979). "Métodos de reactividad Umpolung". Angewandte Chemie Edición Internacional en inglés . 18 (4): 239–258. doi :10.1002/anie.197902393.
- ^ Gröbel, BT; Seebach, D. (1977). "Reducción de la reactividad de compuestos carbonílicos mediante reactivos que contienen azufre". Síntesis . 1977 (6): 357. doi :10.1055/s-1977-24412. S2CID 95705677.
- ^ Seebach, D.; Corey, EJ (1975). "Generación y aplicaciones sintéticas de 2-litio-1,3-ditianos". The Journal of Organic Chemistry . 40 (2): 231. doi :10.1021/jo00890a018.
- ^ Fischer, C.; Smith, SW; Powell, DA; Fu, GC (2006). "Umpolung de los aceptores de Michael catalizados por carbenos N-heterocíclicos". Revista de la Sociedad Química Americana . 128 (5): 1472–1473. doi :10.1021/ja058222q. PMC 2553003 . PMID 16448117.
- ^ Washabaugh, MW; Jencks, WP (1988). "Intercambio de protones de C(2) de tiazolio: correlaciones entre estructura y reactividad y pKa de tiamina C(2)-H revisitadas". Bioquímica . 27 (14): 5044–5053. doi :10.1021/bi00414a015. PMID 2844248.
- ^ Clayden, Jonathan (2012). Química orgánica (2.ª ed.). Oxford University Press . pág. 720.
- ^ Smith AB, III, Xian M. (2006). "Química de relevo de aniones: una táctica eficaz para la síntesis orientada a la diversidad". Revista de la Sociedad Química Estadounidense . 128 (1): 66–67. doi :10.1021/ja057059w. PMID 16390124.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Smith AB, III., Lin Q., Doughty VA, Zhuang L., McBriar MD, Kerns JK, Brook CS, Murase N., Nakayama K. (2001). "Las espongistatinas: productos naturales arquitectónicamente complejos. Segunda parte: síntesis de la subunidad C(29–51), ensamblaje de fragmentos y elaboración final de (+)-espongistatina 2". Angewandte Chemie International Edition . 40 (1): 196–199. doi :10.1002/1521-3773(20010105)40:1<196::AID-ANIE196>3.0.CO;2-T. PMID 11169711.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Nguyen MH, Imanishi M., Kurogi T., Smith AB, III. (2016). "Síntesis total de (−)-mandelalida A aprovechando la química de retransmisión aniónica (ARC): identificación de un protocolo de acoplamiento cruzado ARC/CuCN de tipo II". Revista de la Sociedad Química Estadounidense . 138 (11): 3675–3678. doi :10.1021/jacs.6b01731. PMC 4819492. PMID 26954306 .
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Nguyen MH, Imanishi M., Kurogi T., Wan, X., Ishmael, J., McPhail, K., Smith AB, III. (2018). "Acceso sintético a la familia de macrólidos mandelalida: desarrollo de una estrategia química de retransmisión aniónica". Revista de química orgánica . 83 (8): 4287–4306. doi :10.1021/acs.joc.8b00268. PMC 5910188 . PMID 29480727.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Belletire, JL; Fremont, SL (1986). "Acoplamiento oxidativo". Tetrahedron Letters . 27 (2): 127. doi :10.1016/S0040-4039(00)83958-1.
- ^ Erdik, E.; Ay, M. (1989). "Aminación electrofílica de carbaniones". Chemical Reviews . 89 (8): 1947–1980. doi :10.1021/cr00098a014.
- ^ Dai, XJ; Li, CC; Li, C.-J. (2021). "Umpolung de carbonilo como sustituto de reactivo organometálico". Chemical Society Reviews . 50 (19): 10733–10742. doi :10.1039/D1CS00418B. PMID 34382626. S2CID 236989985.
Enlaces externos
- IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "umpolung". doi :10.1351/goldbook.U06551


