Reordenamiento de Brook

En química orgánica, el reordenamiento de Brook se refiere a cualquier migración de sililo de carbono [1, n ] a oxígeno. El químico canadiense Adrian Gibbs Brook (1924-2013) observó por primera vez el reordenamiento a fines de la década de 1950, por lo que la reacción recibió su nombre. [1] Estas migraciones se pueden promover de varias maneras diferentes, incluidas las térmicas, fotolíticas o en condiciones básicas/ácidas. [2] En la dirección directa, estas migraciones de sililo producen éteres de sililo como productos, lo que se debe a la estabilidad del enlace oxígeno-silicio.
Los sustituyentes sililo pueden ser alifáticos o aromáticos , y si el silicio es un centro de quiralidad , la migración ocurre con retención en este centro. Esta migración ocurre a través de un estado de transición donde el silicio es penta- coordinado y tiene una carga negativa parcial. [3] Si hay un centro de quiralidad en el centro de carbono al que está unido el grupo sililo, entonces ocurre una inversión en este centro. Como ejemplo, si se desprotona (trimetilsilil)metanol, ocurriría un reordenamiento [1,2]-Brook.
Mecanismo de reacción
El mecanismo de reacción para este reordenamiento depende de las condiciones empleadas para afectar el reordenamiento y la naturaleza del material de partida. [2] Los reordenamientos aniónicos son los reordenamientos de Brook más comunes observados, y sus mecanismos se pueden dividir en dos categorías generales. La primera categoría comienza con la abstracción de protones de un grupo hidroxilo cercano por una base . Esto genera un alcóxido que luego actúa como un nucleófilo y ataca al átomo de silicio en una reacción de desplazamiento nucleofílico , con el grupo metileno actuando como el grupo saliente . El carbanión generado luego es protonado por la especie HB para formar el producto. En el caso en que la base utilizada se consume en la reacción (es decir, butillitio ), entonces el carbanión puede actuar como una base para desprotonar más material de partida para generar el producto final.
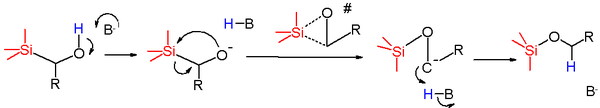
El estado de transición propuesto para este paso de reacción es un anillo de tres miembros, con una importante acumulación de carga negativa en el átomo de carbono y el átomo de silicio, como lo demuestran los estudios de sigma y rho de Hammett . Esta reacción generalmente procede con una energía de activación baja y una gran entropía negativa de activación . Esto respalda aún más el estado de transición cíclico de tres miembros, ya que este sería considerablemente más ordenado que el estado fundamental del material de partida. La reacción procede con retención general en el centro de silicio, como se demuestra con un ciclo de Walden (que se muestra a continuación). Esto respalda un silicio pentacoordinado como parte del mecanismo, ya que la geometría bipiramidal trigonal alrededor del silicio con uno de los O o C axial y el otro ecuatorial explicaría la retención observada en la configuración en el centro de silicio. Este mecanismo también procede con inversión en el centro de carbono.
Se sabe que esta reacción es reversible. Dependiendo de las estabilidades relativas del carbanión y del oxianión formados, un éter sililo es perfectamente capaz de reorganizarse en una especie con el silicio unido al átomo de carbono y el alcohol libre presente. Esto se denominaría reorganización de Retro-Brook.
La segunda categoría de reordenamientos aniónicos de Brook implica un ataque nucleofílico en un centro hibridado sp2 para generar un oxianión a dos átomos de distancia del átomo de silicio. Este puede sufrir un ataque intramolecular por parte del oxianión para producir el éter sililo, pero el destino final del carbanión a menudo depende del sustrato en cuestión. Por ejemplo, intentar realizar una reacción de Wittig en un acilsilano da como resultado la formación de un éter enólico sililo en lugar del alqueno esperado, debido a la eliminación por parte del carbanión en lugar de la protonación, como se vio anteriormente.

Se ha demostrado que la reorganización de Brook ocurre con retención de la configuración en el centro de silicio, como se demuestra en el siguiente ciclo de Walden:

Se sabía que todos los pasos de este ciclo se llevaban a cabo con retención de la configuración, excepto el ataque del reactivo de litio (que se realizaba por inversión) y el reordenamiento de Brook, que se estaba investigando. Al comenzar con un silicio quiral de configuración conocida, se podía determinar la estereoquímica de la reacción observando la rotación específica del silano recuperado. Dado que se sabe que el ataque del reactivo de litio se realiza con inversión, el silano recuperado debería ser el enantiómero opuesto del silano de partida (inversión simple) si el reordenamiento de Brook se realiza con retención, y el mismo enantiómero si la reacción se realiza con inversión (doble inversión). Experimentalmente, el silano recuperado era el enantiómero opuesto, lo que demuestra que la reacción se produjo con retención en el centro de silicio.
Alcance
Los reordenamientos de Brook son conocidos en acilsilanos . [4] Más allá de eso, los acilsilanos son bien conocidos por su hidrólisis en solución básica a un silanol y un aldehído . Esto ocurre a través de un reordenamiento de Brook iniciado por el ataque en el grupo carbonilo . Una reacción relacionada, que implica un ataque inicial en el centro de silicio, provoca la migración de uno de los grupos de silicio al carbono carbonilo, lo que inicia un reordenamiento de Brook. Si el grupo de silicio era quiral, el producto final es un éter de sililo quiral, ya que la migración ocurre de forma estereoespecífica .
Se conocen reordenamientos análogos al reordenamiento de Brook para muchos otros tipos de átomos. Entre ellos se incluyen el nitrógeno , el fósforo [5] y el azufre como componente nucleofílico, y el boro y el germanio, análogos conocidos como componentes electrófilos.
Referencias
- ^ Brook, AG (1958). "Isomería de algunos α-hidroxisilanos a éteres silílicos". J. Am. Chem. Soc . 80 (8): 1886–1889. doi :10.1021/ja01541a026.
- ^ ab Brook, AG; Bassindale, AR (1980). "Capítulo 9. Reordenamientos moleculares de compuestos de organosilicio". Reordenamientos en estados fundamental y excitado, vol . 2. Nueva York: Academic Press. págs. 149–221. ISBN 9781483218724.
- ^ Brook, AG (1974). "Reordenamientos moleculares de compuestos de organosilicio". Acc. Chem. Res . 7 (3): 77–84. doi :10.1021/ar50075a003.
- ^ Patrocinio, Amauri F. y Moran, Paulo JS Acilsilanos y sus aplicaciones en química orgánica . J. Braz. Chem. Soc., 2001, vol. 12, n.º 1, p. 07-31. ISSN 0103-5053. Artículo en línea
- ^ Engel, Robert; Cohen, JamieLee Iolani (2004). Síntesis de enlaces carbono-fósforo (2ª ed.). Prensa CRC . ISBN 0-8493-1617-0. Número de serie LCCN 2003060796.
{{cite book}}: CS1 maint: varios nombres: lista de autores ( enlace )