Éter de sililo

Los éteres de sililo son un grupo de compuestos químicos que contienen un átomo de silicio unido covalentemente a un grupo alcoxi . La estructura general es R 1 R 2 R 3 Si−O−R 4 donde R 4 es un grupo alquilo o un grupo arilo . Los éteres de sililo se utilizan habitualmente como grupos protectores de alcoholes en síntesis orgánica . Dado que R 1 R 2 R 3 pueden ser combinaciones de grupos diferentes que se pueden variar para proporcionar varios éteres de sililo, este grupo de compuestos químicos proporciona un amplio espectro de selectividad para la química de grupos protectores. Los éteres de sililo comunes son: trimetilsililo ( TMS ), terc -butildifenilsililo (TBDPS), terc -butildimetilsililo ( TBS/TBDMS ) y triisopropilsililo ( TIPS ). Son especialmente útiles porque se pueden instalar y eliminar de forma muy selectiva en condiciones suaves.
Éteres de sililo comunes
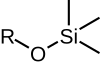 |  |  |  | 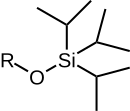 |
| RO(TMS) | RO(TES) | RO(TBS)/RO(TBDMS) | RO(TBDPS) | RO(CONSEJOS) |
| Éter trimetilsilílico | Éter trietilsilílico | éter terc -butildimetilsilílico | éter terc -butildifenilsilílico | Éter triisopropilsilílico |
Formación
Comúnmente, la sililación de alcoholes requiere un cloruro de sililo y una base de amina. Un procedimiento confiable y rápido es el protocolo de Corey en el que el alcohol se hace reaccionar con un cloruro de sililo e imidazol a alta concentración en DMF . [1] Si se reemplaza el DMF por diclorometano, la reacción es algo más lenta, pero se simplifica la purificación del compuesto. Una base impedida común para usar con triflatos de sililo es la 2,6-lutidina . [2] Los alcoholes primarios se pueden proteger en menos de una hora, mientras que algunos alcoholes impedidos pueden requerir días de tiempo de reacción.
Cuando se utiliza cloruro de sililo, no se requieren precauciones especiales, salvo la exclusión de grandes cantidades de agua. Se puede emplear un exceso de cloruro de sililo, pero no es necesario. Si se utiliza un exceso de reactivo, el producto requerirá cromatografía flash para eliminar el exceso de silanol y siloxano .
A veces se utilizan triflato de sililo y una base de amina impedida . Los triflatos de sililo son más reactivos que sus cloruros correspondientes, por lo que se pueden utilizar para instalar grupos sililo en posiciones impedidas . El triflato de sililo es más reactivo y también convierte cetonas en éteres enólicos de sililo . Los triflatos de sililo son sensibles al agua y deben procesarse en condiciones de atmósfera inerte . La purificación implica la adición de un ácido acuoso como una solución saturada de cloruro de amonio . El agua extingue el reactivo de sililo restante y protona las bases de amina antes de eliminarlas de la mezcla de reacción. Después de la extracción, el producto se puede purificar mediante cromatografía flash.
Las cetonas reaccionan con hidrosilanos en presencia de catalizadores metálicos. [3] [4]
Eliminación
La reacción con ácidos o fluoruros, como el fluoruro de tetra-n-butilamonio , elimina el grupo sililo cuando ya no se necesita protección. Los sustituyentes más grandes aumentan la resistencia a la hidrólisis , pero también dificultan la introducción del grupo sililo. [5]
En medios ácidos, la resistencia relativa es:
- TMS (1) < TES (64) < TBS (20 000) < TIPS (700 000) < TBDPS (5 000 000)
En medios básicos la resistencia relativa es:
- TMS (1) < TES (10-100) < TBS~TBDPS (20 000) < TIPS (100 000)
Monoprotección de dioles simétricos
Es posible monosililar un diol simétrico, aunque se sabe que esto puede resultar problemático en ocasiones. Por ejemplo, se informó de la siguiente monosililación: [6]
Sin embargo, resulta que esta reacción es difícil de repetir. Si la reacción se controlara únicamente por termodinámica, y si el dianión tiene una reactividad similar a la del monoanión, entonces se esperaría una mezcla estadística correspondiente de diol disililado:monosililado:no sililado 1:2:1. Sin embargo, la reacción en THF se vuelve selectiva por dos factores: 1. la desprotonación cinética del primer anión y 2. la insolubilidad del monoanión. En la adición inicial de TBSCl, solo hay una pequeña cantidad de monoanión en solución y el resto está en suspensión. Esta pequeña porción reacciona y cambia el equilibrio del monoanión para atraer más a la solución, lo que permite obtener altos rendimientos del compuesto mono-TBS. En algunos casos, se pueden obtener resultados superiores con butillitio : [7]
Un tercer método utiliza una mezcla de DMF y DIPEA . [8]
Alternativamente, se puede utilizar un exceso (4 eq) del diol, forzando la reacción hacia la monoprotección.
Desprotección selectiva
La desprotección selectiva de los grupos sililo es posible en muchos casos. Por ejemplo, en la síntesis de taxol : [9]
Los éteres de sililo se diferencian principalmente en función de su composición estérica o electrónica. En general, las desprotecciones ácidas desprotegen más rápidamente a los grupos sililo menos impedidos, siendo el volumen estérico en silicio más significativo que el volumen estérico en oxígeno. Las desprotecciones basadas en fluoruro desprotegen a los grupos sililo pobres en electrones más rápidamente que a los grupos sililo ricos en electrones. Existe cierta evidencia de que algunas desprotecciones de sililo se producen a través de especies de silicio hipervalentes .
La desprotección selectiva de los éteres de sililo ha sido ampliamente revisada. [10] [11] Aunque se han logrado desprotecciones selectivas bajo muchas condiciones diferentes, algunos procedimientos, que se describen a continuación, son más confiables. Una desprotección selectiva probablemente será exitosa si existe una diferencia sustancial en la estérica (por ejemplo, TBS primario vs. TBS secundario o TES primario vs. TBS primario) o electrónica (por ejemplo, TBDPS primario vs. TBS primario). Desafortunadamente, inevitablemente se requiere cierta optimización y a menudo es necesario ejecutar desprotecciones a mitad de camino y reciclar material.
- Algunas condiciones ácidas comunes
- 100 mol% 10-CSA ( ácido alcanforsulfónico ) en MeOH, temperatura ambiente; una "ráfaga" de ácido desprotege los grupos TBS primarios en diez minutos.
- 10 mol% 10-CSA, 1:1 MeOH:DCM, −20 o 0 °C; desprotege un grupo TBS primario en dos horas a 0; si se reemplaza CSA por PPTS , la velocidad es aproximadamente diez veces más lenta; con p-TsOH , aproximadamente diez veces más rápida; la mezcla de solventes es crucial.
- 4:1:1 v/v/v AcOH:THF:agua, temperatura ambiente; esto es muy lento, pero puede ser muy selectivo.
- Algunas condiciones básicas comunes
- HF-piridina, 10:1 THF:piridina, 0 °C; una excelente desprotección; elimina grupos TBS primarios en ocho horas; las reacciones que utilizan HF deben realizarse en recipientes de plástico.
- TBAF, THF o 1:1 TBAF /AcOH, THF; los grupos TBDPS y TBS se pueden desproteger en presencia de otro en diferentes condiciones. [12]
Solicitud
![[icono]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/1c/Wiki_letter_w_cropped.svg/20px-Wiki_letter_w_cropped.svg.png) | Esta sección está vacía. Puedes ayudarnos agregándole algo. ( Junio 2023 ) |
Referencias
- ^ Corey, EJ; Venkateswarlu, A. "Protección de grupos hidroxilo como derivados de terc -butildimetilsililo". J. Am. Chem. Soc. 1972 , 94 , 6190–6191. doi :10.1021/ja00772a043
- ^ Corey, EJ; Cho, H.; Rücker C.; Hua, DH "Estudios con trialquilsililtriflatos: nuevas síntesis y aplicaciones". Tetrahedron Lett. 1981 , 22 , 3455–3458. doi :10.1016/S0040-4039(01)81930-4
- ^ Hayashi, T.; Hayashi, C.; Uozumi, Y. Tetraedro: Asimetría 1995 , 6 , 2503.
- ^ Hayashi, Tamio; Hayashi, Chihiro; Uozumi, Yasuhiro (1 de octubre de 1995). "Hidrosililación asimétrica catalítica de cetonas con nuevos ligandos quirales de ferrocenilfosfina-imina". Tetrahedron: Asymmetry . 6 (10): 2503–2506. doi :10.1016/0957-4166(95)00326-K. ISSN 0957-4166.
- ^ Greene, TW; Wuts, PGM (1999). Grupos protectores en síntesis orgánica . Nueva York: John Wiley & Sons. pág. 114. ISBN. 9780471160199.
- ^ McDougal, PG; Rico, JG; Oh, Y.-I.; Condon, BD "Un procedimiento conveniente para la monosililación de 1, n -dioles simétricos". J. Org. Chem. 1986 , 51 , 3388–3390. doi :10.1021/jo00367a033
- ^ Roush, WR; Gillis, HR; Essenfeld, AP "Reacciones intramoleculares de Diels-Alder catalizadas por ácido fluorhídrico" J. Org. Chem. 1983 , 49 , 4674–4682. doi :10.1021/jo00198a018
- ^ Hu, L.; Liu, B.; Yu, C. Tetraedro Lett. 2000, 41, 4281. doi :10.1016/S0040-4039(00)00626-2
- ^ Holton, RA et al. "Primera síntesis total de taxol. 2. Finalización de los anillos C y D". J. Am. Chem. Soc. 1994 , 116 , 1599–1600. doi :10.1021/ja00083a067
- ^ Nelson, TD; Crouch, RD "Desprotección selectiva de éteres de sililo". Síntesis 1996 , 1031–1069. doi :10.1055/s-1996-4350
- ^ Crouch, RD "Monodesprotección selectiva de éteres de bis-sililo". Tetrahedron 2004 , 60 , 5833–5871. doi :10.1016/j.tet.2004.04.042
- ^ Higashibayashi, S.; Shinko, K.; Ishizu, T.; Hashimoto, K.; Shirahama, H.; Nakata, M. "Desprotección selectiva de éteres de t -butildifenilsililo en presencia de éteres de t -butildimetilsililo mediante fluoruro de tetrabutilamonio, ácido acético y agua". Synlett 2000 , 1306–1308. doi :10.1055/s-2000-7158
Enlaces externos
- Ejemplo de desprotección del éter silícico TBS
- Ejemplo de desprotección de éter silílico TBDMS
- Protección del grupo hidroxilo a base de silicio
- Formación de éter sililo en carbohidratos.


