Carbeno persistente

Un carbeno persistente (también conocido como carbeno estable ) es una molécula orgánica cuya estructura de resonancia natural tiene un átomo de carbono con octeto incompleto (un carbeno ), pero no exhibe la tremenda inestabilidad típicamente asociada con tales fracciones. Los ejemplos más conocidos y, con diferencia, el subgrupo más grande son los carbenos N -heterocíclicos (NHC) [1] (a veces llamados carbenos de Arduengo ), en los que los átomos de nitrógeno flanquean el carbeno formal.
El análisis teórico moderno sugiere que el término "carbeno persistente" es, de hecho, un nombre inapropiado . Los carbenos persistentes, de hecho, no tienen una estructura electrónica de carbeno en su estado fundamental , sino un iluro estabilizado por resonancia aromática o protección estérica . La excitación a una estructura de carbeno explica entonces la dimerización similar a la del carbeno que algunos carbenos persistentes experimentan a lo largo de los días.
Los carbenos persistentes en general, y los carbenos de Arduengo en particular, son ligandos populares en la química organometálica .
Historia
Evidencia temprana
En 1957, Ronald Breslow propuso que un carbeno nucleofílico relativamente estable , un derivado tiazol-2-ilideno de la vitamina B 1 (tiamina), era el catalizador involucrado en la condensación de benzoína que produce furoína a partir de furfural . [2] [3] En este ciclo, el anillo de tiazolio de la vitamina intercambia un átomo de hidrógeno (unido al carbono 2 del anillo) por un residuo de furfural. En agua deuterada , se encontró que el protón C2- se intercambiaba rápidamente por un deuterón en un equilibrio estadístico . [4]
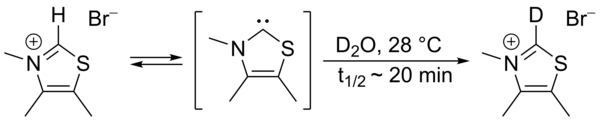
Se propuso que este intercambio se llevaría a cabo mediante la intermediación de un tiazol-2-ilideno. En 2012 se informó del aislamiento del denominado intermediario de Breslow . [5] [6]
En 1960, Hans-Werner Wanzlick y colaboradores conjeturaron que los carbenos derivados del dihidroimidazol-2-ilideno se producían por pirólisis al vacío de los compuestos correspondientes de 2-triclorometil dihidroimidazol con pérdida de cloroformo . [7] [8] [9] Conjeturaron que el carbeno existía en equilibrio con su dímero , un derivado de tetraaminoetileno , el llamado equilibrio de Wanzlick . Esta conjetura fue desafiada por Lemal y colaboradores en 1964, quienes presentaron evidencia de que el dímero no se disociaba; [10] y por Winberg en 1965. [11] Sin embargo, experimentos posteriores de Denk, Herrmann y otros han confirmado este equilibrio, aunque en circunstancias específicas. [12] [13]
Aislamiento de carbenos persistentes
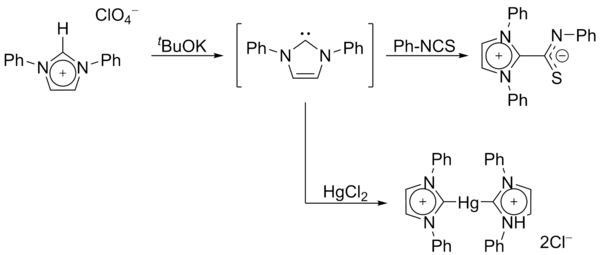
En 1970, el grupo de Wanzlick generó carbenos de imidazol-2-ilideno mediante la desprotonación de una sal de imidazolio . [14] Wanzlick, así como Roald Hoffmann , [9] [15] propusieron que estos carbenos basados en imidazol deberían ser más estables que sus análogos 4,5-dihidro, debido a la aromaticidad de tipo Hückel . Sin embargo, Wanzlick no aisló los imidazol-2-ilidenos, sino sus compuestos de coordinación con mercurio e isotiocianato :
En 1988, Guy Bertrand y otros aislaron un fosfinocarbeno . Estas especies pueden representarse como un λ 3 -fosfinocarbeno o un λ 5 - fosfacetileno : [16] [17]

Estos compuestos se denominaron "carbenos push-pull" en referencia a las afinidades electrónicas contrastantes de los átomos de fósforo y silicio. Presentan reactividad tanto carbénica como alquínica . No se ha obtenido una estructura de rayos X de esta molécula y en el momento de la publicación persistían algunas dudas sobre su naturaleza carbénica exacta.
En 1991, Arduengo y sus colaboradores cristalizaron un diaminocarbeno mediante desprotonación de un catión imidazolio: [18]

Este carbeno, precursor de una gran familia de carbenos con el núcleo de imidazol-2-ilideno, es indefinidamente estable a temperatura ambiente en ausencia de oxígeno y humedad. Se funde a 240–241 °C sin descomponerse. El espectro de RMN de 13 C muestra una señal a 211 ppm para el átomo de carbeno. [19] La estructura de rayos X reveló longitudes de enlace N–C más largas en el anillo del carbeno que en el compuesto de imidazolio original, lo que indica que había muy poco carácter de doble enlace en estos enlaces. [20]
El primer carbeno ilídico estable al aire, un miembro clorado de la familia imidazol-2-ilideno, se obtuvo en 1997. [21]
En 2000, Bertrand obtuvo carbenos adicionales del tipo fosfanilo, incluido el (fosfanil)(trifluorometil)carbeno, estable en solución a -30 °C [22] y un (amino)(aril)carbeno moderadamente estable con solo un heteroátomo adyacente al átomo carbénico. [23] [24]
Estabilización a través de orbitales adyacentes

En la concepción moderna, el orbital p superficialmente desocupado en un carbeno (meta)estable no está, de hecho, completamente vacío. En cambio, las estructuras de Lewis del carbeno están en resonancia con enlaces dativos hacia orbitales adyacentes de pares solitarios o de enlace pi . [25]

Los primeros investigadores atribuyeron la estabilidad de los carbenos de Arduengo a los voluminosos sustituyentes N - adamantilo , que impiden la dimerización del carbeno. Pero la sustitución de los grupos N -adamantilo por grupos metilo también produce 1,3,4,5-tetrametilimidazol-2-ilideno (Me 4 ImC:), un NHC termodinámicamente estable y sin impedimentos. [26]

En 1995, el grupo de Arduengo obtuvo un derivado carbeno del dihidroimidazol-2-ilideno , lo que demuestra que la estabilidad no surge de la aromaticidad de la cadena principal de imidazol conjugado . [27] Al año siguiente, el primer carbeno persistente acíclico demostró que la estabilidad ni siquiera requiere una cadena principal cíclica. [28] Los derivados sin impedimentos de los carbenos hidrogenados [29] [30] y acíclicos [30] [31] [32] dimerizaron, lo que sugiere que Me 4 ImC: podría ser excepcional, en lugar de paradigmático. Pero el comportamiento de los carbenos acíclicos ofreció una pista tentadora sobre el mecanismo de estabilización. [ cita requerida ]
A diferencia de los derivados cíclicos, los carbenos acíclicos son flexibles y los enlaces al átomo carbénico admiten la rotación. Pero la rotación del enlace en el compuesto parecía obstaculizada , lo que sugiere un carácter de doble enlace que colocaría la carga positiva en los átomos de nitrógeno adyacentes mientras se preserva la regla del octeto . [28] De hecho, la mayoría de los carbenos persistentes están estabilizados por dos centros de nitrógeno flanqueantes. Los valores atípicos incluyen un aminotiocarbeno y un aminooxicarbeno, que utilizan otros heteroátomos , [33] [34] y bis(diisopropilamino)ciclopropenilideno estable a temperatura ambiente, en el que el átomo de carbeno está conectado a dos átomos de carbono en un anillo de ciclopropenilideno aromático de tres miembros . [35]
Clases de carbenos estables
Los siguientes son ejemplos de las clases de carbenos estables aislados hasta la fecha:
Imidazol-2-ilidenos
Los primeros carbenos estables que se aislaron se basaban en un anillo de imidazol , al que se le había eliminado el hidrógeno del carbono 2 del anillo (entre los dos átomos de nitrógeno) y se habían reemplazado los otros hidrógenos por varios grupos. Estos imidazol-2-ilidenos siguen siendo la familia de carbenos persistentes más estable y mejor estudiada y comprendida. [ cita requerida ]
Se ha sintetizado una gama considerable de imidazol-2-ilidenos, incluidos aquellos en los que las posiciones 1,3 se han funcionalizado con sustituyentes alquilo , arilo , [26] alquiloxi, alquilamino, alquilfosfino [36] e incluso quirales : [36]
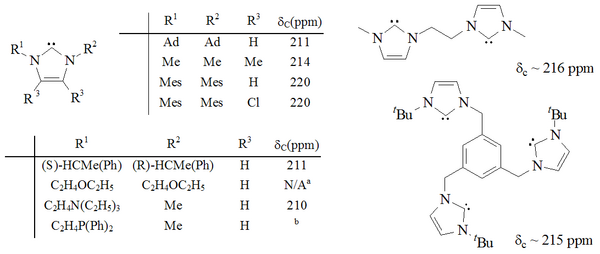

(Observe la estructura 3D con un visor externo).
En particular, la sustitución de dos átomos de cloro por los dos hidrógenos en las posiciones 4 y 5 del anillo produjo el primer carbeno estable al aire. [21] Su estabilidad adicional probablemente resulta del efecto de atracción de electrones de los sustituyentes de cloro , que reducen la densidad de electrones en el átomo de carbono que lleva el par solitario , a través de la inducción a través de la cadena principal sigma.
También se han sintetizado moléculas que contienen dos e incluso tres grupos imidazol-2-ilideno. [37] [38]
Los carbenos basados en imidazol son termodinámicamente estables y generalmente tienen valores de desplazamiento químico de RMN de 13 C de diagnóstico entre 210 y 230 ppm para el carbono carbénico. Por lo general, las estructuras de rayos X de estas moléculas muestran ángulos de enlace N–C–N de 101–102°. [ cita requerida ]
Triazol-5-ilidenos
Dependiendo de la disposición de los tres átomos de nitrógeno en el triazol-5-ilideno, hay dos isómeros posibles, a saber, 1,2,3-triazol-5-ilidenos y 1,2,4-triazol-5-ilidenos.

Los triazol-5-ilidenos basados en el anillo 1,2,4-triazol se muestran en la imagen de abajo y fueron preparados por primera vez por Enders y colaboradores [39] mediante pirólisis al vacío a través de la pérdida de metanol de los 2-metoxitriazoles. Solo se ha informado de una gama limitada de estas moléculas, y la molécula sustituida con trifenilo está disponible comercialmente.

Los carbenos basados en triazol son termodinámicamente estables y tienen valores de desplazamiento químico de RMN de 13 C de diagnóstico entre 210 y 220 ppm para el carbono carbénico. La estructura de rayos X del carbeno sustituido con trifenilo anterior muestra un ángulo de enlace N–C–N de alrededor de 101°. El precursor 5-metoxitriazol de este carbeno se obtuvo mediante el tratamiento de una sal de triazolio con metóxido de sodio, que ataca como nucleófilo . [39] Esto puede indicar que estos carbenos son menos aromáticos que los imidazol-2-ilidenos, ya que los precursores de imidazolio no reaccionan con los nucleófilos debido a la pérdida de aromaticidad resultante. [ cita requerida ]
Otros diaminocarbenos
Las dos familias anteriores pueden considerarse casos especiales de una clase más amplia de compuestos que tienen un átomo de carbeno que une dos átomos de nitrógeno. Una variedad de estos diaminocarbenos ha sido preparada principalmente por el grupo de investigación de Roger Alder . En algunos de estos compuestos, la unidad N–C–N es miembro de un anillo no aromático de cinco o seis miembros, [27] [29] [40] incluido un ejemplo bicíclico. En otros ejemplos, los nitrógenos adyacentes están conectados solo a través del átomo de carbeno, y pueden o no ser parte de anillos separados. [28] [31] [32]

A diferencia de los imidazol-2-ilidenos aromáticos o los triazol-5-ilidenos, estos carbenos parecen no ser termodinámicamente estables, como lo demuestra la dimerización de algunos ejemplos cíclicos y acíclicos sin obstáculos. [29] [31] Los estudios [30] sugieren que estos carbenos se dimerizan a través de la dimerización catalizada por ácido (como en el equilibrio de Wanzlick ).
Los diaminocarbenos tienen valores de desplazamiento químico de RMN de 13 C de entre 230 y 270 ppm para el átomo de carbeno. La estructura de rayos X del dihidroimidazol-2-ilideno muestra un ángulo de enlace N–C–N de aproximadamente 106°, mientras que el ángulo del carbeno acíclico es de 121°, ambos mayores que los observados para el imidazol-2-ilideno.
Heteroaminocarbenos
Existen varias variantes de los carbenos estables anteriores donde uno de los átomos de nitrógeno adyacentes al centro del carbeno (los nitrógenos α) ha sido reemplazado por un heteroátomo alternativo, como oxígeno, azufre o fósforo . [16] [17] [33] [34]
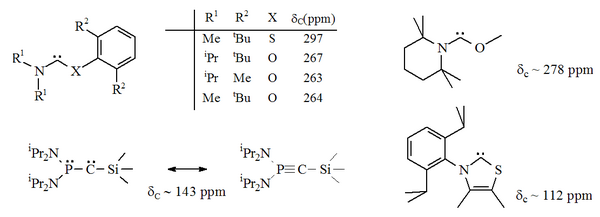
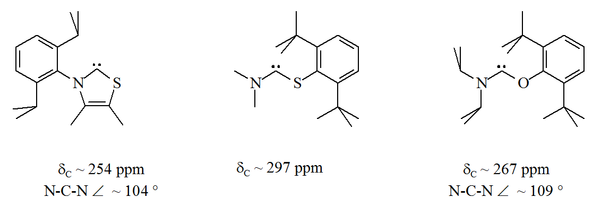
En particular, la sustitución formal de azufre por uno de los nitrógenos en imidazol produciría el compuesto heterocíclico aromático tiazol . Se ha preparado un carbeno basado en tiazol (análogo al carbeno postulado por Breslow) [41] y se ha caracterizado por cristalografía de rayos X. [33] Se han preparado otros aminocarbenos no aromáticos con átomos de O, S y P adyacentes (es decir, alfa) al centro del carbeno, por ejemplo, se han caracterizado carbenos basados en tio y oxiiminio por cristalografía de rayos X. [34]
Dado que el oxígeno y el azufre son divalentes , la protección estérica del centro carbénico es limitada, especialmente cuando la unidad N–C–X es parte de un anillo. Estos carbenos acíclicos tienen valores de desplazamiento químico de RMN de 13 C de diagnóstico entre 250 y 300 ppm para el carbono carbénico, más abajo en el campo que cualquier otro tipo de carbeno estable. Las estructuras de rayos X han mostrado ángulos de enlace N–C–X de alrededor de 104° y 109° respectivamente. [ cita requerida ]
Se espera que los carbenos que se derivan formalmente de imidazol-2-ilidenos por sustitución de azufre, oxígeno u otros calcógenos por ambos α-nitrógenos sean inestables, ya que tienen el potencial de disociarse en un alquino (R 1 C≡CR 2 ) y un dicalcogenuro de carbono (X 1 =C=X 2 ). [42] [43]
Carbenos no amino
Se propone que la reacción del disulfuro de carbono (CS 2 ) con derivados de acetileno deficientes en electrones produce carbenos transitorios de 1,3-ditiolio (es decir, donde X 1 = X 2 = S), que luego se dimerizan para dar derivados de tetratiafulveno . Por lo tanto, es posible que se esté produciendo lo inverso de este proceso en carbenos similares. [42] [43]
Los carbenos de Bertrand
En los carbenos persistentes de Bertrand, el carbono insaturado está unido a un fósforo y un silicio . [44] Sin embargo, estos compuestos parecen exhibir algunas propiedades alquínicas, y cuando se publicó, la naturaleza carbénica exacta de estos aceites rojos estaba en debate. [17]
Otros carbenos nucleofílicos
Un carbeno N -heterocíclico estable [45] tiene una estructura análoga a la borazina con un átomo de boro reemplazado por un grupo metileno . Esto da como resultado un compuesto plano de seis electrones.

Ciclopropenilidenos
Otra familia de carbenos se basa en un núcleo de ciclopropenilideno , un anillo de tres carbonos con un doble enlace entre los dos átomos adyacentes al carbénico. Esta familia está ejemplificada por el bis(diisopropilamino)ciclopropenilideno. [35]
Carbenos en estado triplete
Los carbenos persistentes tienden a existir en el estado singlete , dimerizando cuando se los fuerza a pasar a estados triplete. Sin embargo, Hideo Tomioka y sus colaboradores utilizaron la deslocalización electrónica para producir un carbeno triplete comparativamente estable (bis(9-antril)carbeno) en 2001. Tiene una vida media inusualmente larga de 19 minutos. [46] [47]
Aunque la figura siguiente muestra las dos partes de la molécula en un plano, la geometría molecular coloca las dos partes aromáticas en posiciones ortogonales entre sí.

En 2006, el mismo grupo informó sobre un carbeno triplete con una vida media de 40 minutos. [48] Este carbeno se prepara mediante una descomposición fotoquímica de un precursor de diazometano con luz de 300 nm en benceno con expulsión de gas nitrógeno .
Nuevamente, la figura que se muestra a continuación no es una representación adecuada de la estructura molecular real: ambos anillos de fenilo están ubicados ortogonalmente entre sí. El carbono del carbeno tiene una hibridación sp- , y los dos orbitales p ortogonales restantes se conjugan con uno de los anillos aromáticos.
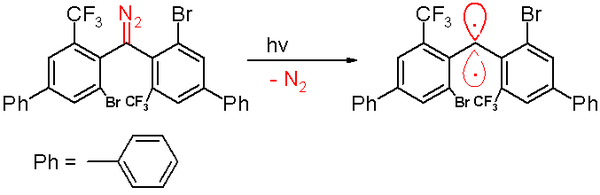
La exposición al oxígeno (un dirradical triplete) convierte este carbeno en la benzofenona correspondiente . El compuesto difenilmetano se forma cuando queda atrapado por el ciclohexa-1,4-dieno . Al igual que con los otros carbenos, esta especie contiene sustituyentes grandes y voluminosos, a saber, bromo y los grupos trifluorometilo en los anillos de fenilo, que protegen al carbeno y previenen o ralentizan el proceso de dimerización a un 1,1,2,2-tetra(fenil)alqueno. Según simulaciones por computadora , se afirma que la distancia del átomo de carbono divalente a sus vecinos es de 138 picómetros con un ángulo de enlace de 158,8°. Los planos de los grupos fenilo están casi en ángulos rectos entre sí (el ángulo diedro es de 85,7°).
Carbenos mesoiónicos
Los carbenos mesoiónicos (MIC) son similares a los carbenos N -heterocíclicos (NHC), excepto que las estructuras de resonancia canónicas con el carbeno representado no se pueden dibujar sin agregar cargas adicionales. Los carbenos mesoiónicos también se conocen como carbenos N -heterocíclicos anormales (aNHC) o carbenos N -heterocíclicos remotos (rNHC). Se pueden aislar diversos carbenos libres que son estables a temperatura ambiente. Otros carbenos libres no son estables y son susceptibles a vías de descomposición intermolecular. [ cita requerida ]
Propiedades químicas
Basicidad y nucleofilia
Los imidazol-2-ilidenos son bases fuertes, con p K a ≈ 24 para el ácido conjugado en dimetilsulfóxido (DMSO): [49]

Sin embargo, trabajos posteriores demostraron que los diaminocarbenos desprotonarán el solvente DMSO y el anión resultante reaccionará con la sal de amidinio resultante.
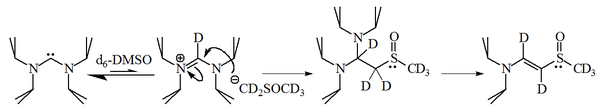
La reacción de imidazol-2-ilidenos con 1-bromohexano dio el 90% del aducto 2-sustituido, con sólo el 10% del alqueno correspondiente , lo que indica que estas moléculas también son razonablemente nucleófilas .
Se han examinado los valores de p K a para los ácidos conjugados de varias familias de NHC en solución acuosa. Los valores de pKa de los iones de triazolio se encuentran en el rango de 16,5 a 17,8, [50] alrededor de 3 unidades de p K a más ácidos que los iones de imidazolio relacionados. [51]
Dimerización
En un tiempo, se creía que los carbenos estables dimerizaban de forma reversible a través del llamado equilibrio de Wanzlick . Sin embargo, los imidazol-2-ilidenos y los triazol-5-ilidenos son termodinámicamente estables y no dimerizan, y se han almacenado en solución en ausencia de agua y aire durante años. Esto se debe presumiblemente a la naturaleza aromática de estos carbenos, que se pierde al dimerizarse. De hecho, los imidazol-2-ilidenos son tan estables termodinámicamente que solo en condiciones muy restringidas estos carbenos se ven obligados a dimerizarse.
Chen y Taton [52] crearon un diimidazol-2-ilideno doblemente unido mediante la desprotonación de la sal de diimidazolio respectiva. Solo la desprotonación de la sal de diimidazolio doblemente unida con el puente metileno más corto (–CH 2 –) dio como resultado el dímero de dicarbeno:

Si este dímero existiera como dicarbeno, los pares de electrones solitarios del carbono carbénico se verían forzados a acercarse. Presumiblemente, las interacciones electrostáticas repulsivas resultantes tendrían un efecto desestabilizador significativo. Para evitar esta interacción electrónica, las unidades de carbeno se dimerizan.
Por otra parte, se ha demostrado que los carbenos heteroamino (como R 2 N–C–OR o R 2 N–C–SR) y los carbenos no aromáticos como los diaminocarbenos (como R 2 N–C–NR 2 ) se dimerizan, [53] aunque de forma bastante lenta. Se ha supuesto que esto se debe a la alta barrera para la dimerización del estado singlete :

Los diaminocarbenos no dimerizan realmente, sino que forman el dímero mediante una reacción a través de sales de formamidinio , una especie precursora protonada. [30] En consecuencia, esta reacción puede ser catalizada por un ácido. Esta reacción ocurre porque, a diferencia de los carbenos basados en imidazolio, no hay pérdida de aromaticidad en la protonación del carbeno.
A diferencia de la dimerización de los carbenos en estado triplete , estos carbenos en estado singlete no se aproximan cabeza con cabeza ("movimiento mínimo"), sino que el par solitario del carbeno ataca el orbital p de carbono vacío ("movimiento no mínimo"). La dimerización de los carbenos puede ser catalizada tanto por ácidos como por metales.
Reactividad
La química de los carbenos estables no se ha explorado en profundidad. Sin embargo, Enders et al. [39] [54] [55] han llevado a cabo una serie de reacciones orgánicas que involucran un triazol-5-ilideno. Estas reacciones se describen a continuación y pueden considerarse como un modelo para otros carbenos.

| a | 3,6-difenil-1,2,4,5-tetrazina, tolueno | 92% | mi | 2 equiv., PhNCO, tolueno, reflujo | 92% | |
|---|---|---|---|---|---|---|
| b | RxH, RT | 95–97% | F | CS 2 , tolueno o PhNCS, THF, RT | 71–90% | |
| do | O 2 , S 8 , o Se, tolueno, reflujo | 54–68% | gramo | Maleimida, THF, RT | 47–84% | |
| d | R1CH =CHR2 , THF , RT | 25–68% | yo | Dicarboxilato de dimetilacetileno, THF, reflujo | 21% |
Estos carbenos tienden a comportarse de manera nucleofílica ( e y f ), realizando reacciones de inserción ( b ), reacciones de adición ( c ), cicloadiciones [2+1] ( d , g y h ), cicloadiciones [4+1] ( a ) así como desprotonaciones simples . Las reacciones de inserción ( b ) probablemente proceden por desprotonación, lo que resulta en la generación de un nucleófilo ( − XR) que puede atacar la sal generada dando la impresión de una inserción H–X.
Se cuestionó el carbeno isotiazol estable informado ( 2b ) derivado de un perclorato de isotiazolio ( 1 ) [56] . [57] Los investigadores solo pudieron aislar el 2-imino-2 H -tieto ( 4 ). El intermedio 3 se propuso a través de una reacción de reordenamiento . El carbeno 2b ya no se considera estable. [58]

Complejación de carbeno
Se ha demostrado que los imidazol-2-ilidenos, triazol-5-ilidenos (y en menor medida, los diaminocarbenos) se coordinan con una gran cantidad de elementos, desde metales alcalinos , elementos del grupo principal , metales de transición e incluso lantánidos y actínidos . Una tabla periódica de elementos da una idea de los complejos que se han preparado y, en muchos casos, estos se han identificado mediante cristalografía de rayos X de cristal único . [40] [59] [60] Se cree que los carbenos estables se comportan de manera similar a las organofosfinas en sus propiedades de coordinación con los metales. Se dice que estos ligandos son buenos donadores σ a través del par solitario carbénico , pero malos aceptores π debido a la retrodonación interna del ligando de los átomos de nitrógeno adyacentes al centro del carbeno, y por lo tanto pueden coordinarse incluso con metales relativamente deficientes en electrones. Enders [61] y Hermann [62] [63] han demostrado que estos carbenos son reemplazos adecuados para los ligandos de fosfina en varios ciclos catalíticos . Si bien han descubierto que estos ligandos no activan el catalizador metálico tanto como los ligandos de fosfina, a menudo dan como resultado catalizadores más robustos. Hermann y Enders han estudiado varios sistemas catalíticos, utilizando catalizadores que contienen ligandos de carbeno de imidazol y triazol, con un éxito moderado. [59] [61] [62] [63] Grubbs [64] ha informado sobre la sustitución de un ligando de fosfina (PCy 3 ) por un imidazol-2-ilideno en el catalizador de metátesis de olefina RuCl 2 (PCy 3 ) 2 CHPh, y ha observado un aumento de la metátesis de cierre de anillo, además de exhibir "una notable estabilidad al aire y al agua". Se han preparado moléculas que contienen dos y tres fracciones de carbeno como posibles ligandos de carbeno bidentados y tridentados . [37] [38]
| Grupo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Period | ||||||||||||||||||||
| 1 | 1 yo | 2 Él | ||||||||||||||||||
| 2 | 3 Li | 4 Ser | 5 B | 6 do | 7 norte | 8 Oh | 9 F | 10 Nordeste | ||||||||||||
| 3 | 11 N / A | 12 Mg | 13 Alabama | 14 Si | 15 PAG | 16 S | 17 Cl | 18 Arkansas | ||||||||||||
| 4 | 19 K | 20 California | 21 Carolina del Sur | 22 Sí | 23 V | 24 Cr | 25 Minnesota | 26 Fé | 27 Co | 28 Ni | 29 Cu | 30 Zinc | 31 Georgia | 32 En | 33 Como | 34 Sí | 35 Es | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nótese bien | 42 Mes | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 En | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | ||
| 6 | 55 Cs | 56 Licenciado en Letras |  | 71 Lu | 72 alta frecuencia | 73 Ejército de reserva | 74 Yo | 75 Re | 76 El sistema operativo | 77 Ir | 78 En | 79 Au | 80 Hg | 81 El | 82 Pb | 83 Bi | 84 Correos | 85 En | 86 Enfermera | |
| 7 | 87 Es | 88 Real academia de bellas artes |  | 103 Lr | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Monte | 110 Ds | 111 Rg | 112 En | 113 Nueva Hampshire | 114 Florida | 115 Mc | 116 Nivel | 117 Ts | 118 Sí | |
 | 57 La | 58 Este | 59 Pr | 60 Dakota del Norte | 61 P.m | 62 Pequeño | 63 UE | 64 Dios | 65 Tuberculosis | 66 Por favor | 67 Hola | 68 Sí. | 69 Yo soy | 70 Yb | ||||||
 | 89 C.A | 90 El | 91 Pensilvania | 92 tú | 93 Notario público | 94 Pu | 95 Soy | 96 Centímetro | 97 Libro | 98 Cf | 99 Es | 100 Fm | 101 Maryland | 102 No | ||||||
- Leyenda
- Complejo de carbeno con elemento conocido
- No se conoce ningún complejo de carbeno con elemento
Carbenos en la química organometálica y la catálisis
Los carbenos se pueden estabilizar como especies organometálicas . Estos complejos de carbenos de metales de transición se dividen en dos categorías: [ cita requerida ]
- Carbenos de Fischer en los que los carbenos están unidos a un metal y a un grupo que atrae electrones (normalmente un carbonilo),
- Carbenos de Schrock ; en los que los carbenos están unidos a un metal y a un grupo donador de electrones . Las reacciones en las que participan estos carbenos son muy diferentes de aquellas en las que participan los carbenos orgánicos.
Química del carbeno en estado triplete
Es probable que los carbenos en estado triplete persistente tengan una reactividad muy similar a la de otros carbenos en estado triplete no persistente .
Propiedades físicas
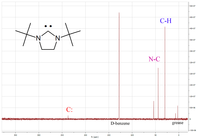
Los carbenos que se han aislado hasta la fecha tienden a ser sólidos incoloros con puntos de fusión bajos. Estos carbenos tienden a sublimar a bajas temperaturas en condiciones de alto vacío.
Una de las propiedades físicas más útiles es el desplazamiento químico diagnóstico del átomo de carbono carbénico en el espectro de RMN de 13 C. Normalmente, este pico se encuentra en el rango entre 200 y 300 ppm, donde aparecen pocos otros picos en el espectro de RMN de 13 C. A la izquierda se muestra un ejemplo de un diaminocarbeno cíclico que tiene un pico carbénico a 238 ppm.
Tras la coordinación con los centros metálicos, la resonancia del carbeno 13 C suele desplazarse hacia el campo alto, dependiendo de la acidez de Lewis del fragmento complejo. Basándose en esta observación, Huynh et al. desarrollaron una nueva metodología para determinar la fuerza de los ligandos donantes mediante el análisis de RMN 13 C de complejos de trans -paladio(II)-carbeno. El uso de un ligando carbeno N-heterocíclico marcado con 13 C también permite el estudio de complejos mixtos de carbeno-fosfina, que experimentan isomerización trans - cis debido al efecto trans . [65]
Aplicaciones
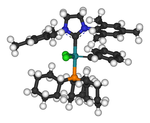
Los NHC se utilizan ampliamente como ligando auxiliar en la química organometálica . Una aplicación práctica es el catalizador de Grubbs basado en rutenio y los complejos NHC-paladio para reacciones de acoplamiento cruzado. [66] [67] [68] Los complejos NHC-metal, específicamente los complejos Ag(I)-NHC, han sido ampliamente probados por sus aplicaciones biológicas. [69]
Métodos de preparación
Los NHC suelen ser fuertemente básicos (el valor pKa del ácido conjugado de un imidazol-2-ilideno se midió en ca. 24) [49] y reaccionan con el oxígeno . Claramente, estas reacciones se realizan utilizando técnicas sin aire , evitando compuestos de acidez incluso moderada . Aunque las sales de imidazolio son estables a la adición nucleofílica , otras sales no aromáticas no lo son (es decir, las sales de formamidinio ). [70]
En estos casos, se evitan los nucleófilos fuertes no obstaculizados, ya sea que se generen in situ o estén presentes como impureza en otros reactivos (como LiOH en BuLi).
Se han desarrollado varios enfoques para preparar carbenos estables, que se describen a continuación.
Desprotonación
La desprotonación de sales precursoras de carbeno con bases fuertes ha demostrado ser una ruta confiable para casi todos los carbenos estables:
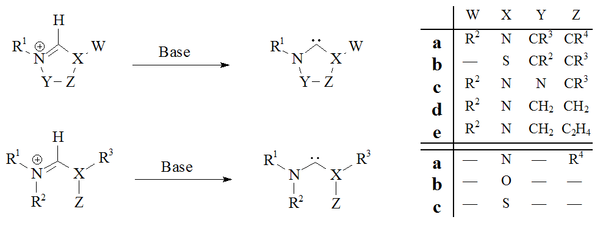
Los imidazol-2-ilidenos y dihidroimidazol-2-ilidenos, como los IMes , se han preparado mediante la desprotonación de las respectivas sales de imidazolio y dihidroimidazolio. Los carbenos acíclicos [28] [31] y los carbenos basados en tetrahidropirimidinilo [40] se prepararon mediante desprotonación utilizando bases homogéneas fuertes.
Se han empleado varias bases y condiciones de reacción con distintos grados de éxito. El grado de éxito ha dependido principalmente de la naturaleza del precursor que se está desprotonando. El principal inconveniente de este método de preparación es el problema del aislamiento del carbeno libre de los iones metálicos utilizados en su preparación.
Bases de hidruros metálicos
Se podría creer que el hidruro de sodio o potasio [27] [33] sería la base ideal para desprotonar estas sales precursoras. El hidruro debería reaccionar irreversiblemente con la pérdida de hidrógeno para dar el carbeno deseado, eliminándose los subproductos inorgánicos y el exceso de hidruro mediante filtración. En la práctica, esta reacción suele ser demasiado lenta y requiere la adición de DMSO o t -BuOH . [18] [26] Estos reactivos generan catalizadores solubles , que aumentan la velocidad de reacción de este sistema heterogéneo, mediante la generación de terc-butóxido o anión dimsil . Sin embargo, estos catalizadores han demostrado ser ineficaces para la preparación de aductos que no sean de imidazolio, ya que tienden a actuar como nucleófilos hacia las sales precursoras y, al hacerlo, se destruyen. La presencia de iones hidróxido como impureza en el hidruro metálico también podría destruir sales no aromáticas.
Se ha informado sobre la desprotonación con hidruro de sodio o potasio en una mezcla de amoníaco líquido / THF a −40 °C [36] para carbenos basados en imidazol. Arduengo y colaboradores [33] lograron preparar un dihidroimidazol-2-ilideno utilizando NaH. Sin embargo, este método no se ha aplicado a la preparación de diaminocarbenos. En algunos casos, se puede emplear terc-butóxido de potasio sin la adición de un hidruro metálico. [26]
Alquillitios
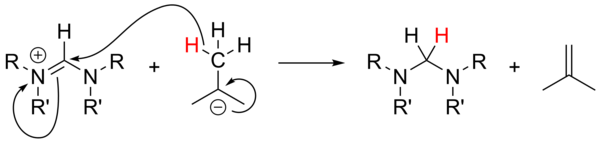
El uso de alquil-litios como bases fuertes [18] no ha sido estudiado en profundidad y no ha sido fiable para la desprotonación de sales precursoras. Con sales no aromáticas, n-BuLi y PhLi pueden actuar como nucleófilos, mientras que t-BuLi puede actuar en ocasiones como fuente de hidruro, reduciendo la sal con la generación de isobuteno :
Bases de amidas
Las amidas de litio como la diisopropilamida (LDA) y la ( tetrametilpiperidina (LiTMP) ) [28] [31] generalmente funcionan bien para la desprotonación de todo tipo de sales, siempre que no haya demasiado LiOH presente en el n -butillitio utilizado para hacer la amida de litio. La titulación de la amida de litio se puede utilizar para determinar la cantidad de hidróxido en solución. La desprotonación de sales precursoras con hexametildisilazidas metálicas [40] funciona muy limpiamente para la desprotonación de todo tipo de sales, excepto para las sales de formamidinio sin impedimentos, donde esta base puede actuar como un nucleófilo para dar un aducto de triaminometano.
Preparación de carbeno sin metales

Se ha buscado intensamente la preparación de carbenos estables libres de cationes metálicos para permitir un estudio más profundo de las especies de carbeno aisladas de estos metales. Separar un carbeno de un complejo de carbeno-metal puede ser problemático debido a la estabilidad del complejo. En consecuencia, es preferible hacer que el carbeno esté libre de estos metales en primer lugar. De hecho, algunos iones metálicos, en lugar de estabilizar el carbeno, se han implicado en la dimerización catalítica de ejemplos sin impedimentos.
A la derecha se muestra una estructura de rayos X que muestra un complejo entre un diaminocarbeno y HMDS de potasio . Este complejo se formó cuando se utilizó un exceso de KHMDS como base fuerte para desprotonar la sal de formamidinio . La eliminación de iones de litio resultantes de la desprotonación con reactivos como la diisopropilamida de litio (LDA) puede ser especialmente problemática. Los subproductos de la sal de potasio y sodio tienden a precipitarse de la solución y pueden eliminarse. Los iones de litio pueden eliminarse químicamente mediante la unión a especies como criptandos o éteres corona .
Los carbenos libres de metales se han preparado de varias maneras, como se describe a continuación:
Descalcificación
Otro método para preparar carbenos se basa en la desulfuración de tioureas con potasio en THF . [29] [71] Un factor que contribuye al éxito de esta reacción es que el subproducto, sulfuro de potasio , es insoluble en el disolvente. Las temperaturas elevadas sugieren que este método no es adecuado para la preparación de carbenos dimerizantes inestables. También se ha informado de un único ejemplo de desoxigenación de una urea con un carbeno derivado del fluoreno para dar el tetrametildiaminocarbeno y la fluorenona: [72]
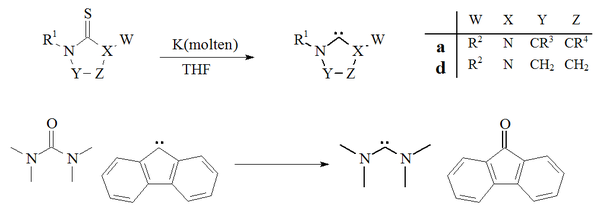
La desulfuración de tioureas con potasio fundido para producir imidazol-2-ilidenos o diaminocarbenos no se ha utilizado ampliamente. El método se utilizó para preparar carbenos de dihidroimidazol. [29]
Pirólisis al vacío
La pirólisis al vacío, con la eliminación de subproductos volátiles neutros, es decir, metanol o cloroformo, se ha utilizado para preparar carbenos basados en dihidroimidazol y triazol. Históricamente, la eliminación de cloroformo mediante pirólisis al vacío de los aductos A fue utilizada por Wanzlick [8] en sus primeros intentos de preparar dihidroimidazol-2-ilidenos, pero este método no se utiliza ampliamente. El laboratorio de Enders [39] ha utilizado la pirólisis al vacío del aducto B para generar un triazol-5-ilideno.

Bis(trimetilsilil)mercurio
El bis(trimetilsilil)mercurio (CH 3 ) 3 Si-Hg-Si(CH 3 ) 3 reacciona con sales de cloro- iminio y cloro- amidinio para dar un carbeno libre de metales y mercurio elemental . [73] Por ejemplo:
- (CH3 ) 3Si − Hg−Si(CH3 ) 3 + R2N = C(Cl) −NR+
2Cl − → R 2 N − C − NR 2 + Hg (l) + 2 (CH 3 ) 3 SiCl
Descomposición fotoquímica
Se han preparado carbenos en estado triplete persistente mediante descomposición fotoquímica de un producto de diazometano mediante la expulsión de gas nitrógeno , a una longitud de onda de 300 nm en benceno.
Purificación
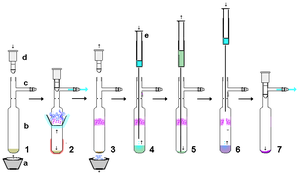
Los carbenos estables son muy reactivos, por lo que es deseable una mínima cantidad de manipulación utilizando técnicas sin aire . Sin embargo, siempre que se utilicen materiales rigurosamente secos, relativamente no ácidos y sin aire, los carbenos estables son razonablemente resistentes a la manipulación per se . A modo de ejemplo, un carbeno estable preparado a partir de hidruro de potasio se puede filtrar a través de una almohadilla de celita seca para eliminar el exceso de KH (y las sales resultantes) de la reacción. En una escala relativamente pequeña, se puede dejar sedimentar una suspensión que contiene un carbeno estable en solución y empujar la solución sobrenadante a través de un filtro de jeringa de membrana seca . Los carbenos estables son fácilmente solubles en disolventes no polares como el hexano, por lo que normalmente la recristalización de carbenos estables puede ser difícil, debido a la falta de disponibilidad de disolventes polares no ácidos adecuados. La sublimación sin aire como se muestra a la derecha puede ser un método eficaz de purificación, aunque son preferibles temperaturas inferiores a 60 °C a alto vacío, ya que estos carbenos son relativamente volátiles y también podrían comenzar a descomponerse a estas temperaturas más altas. De hecho, en algunos casos la sublimación puede dar lugar a monocristales adecuados para el análisis con rayos X. Sin embargo, la fuerte formación de complejos con iones metálicos como el litio impedirá en la mayoría de los casos la sublimación.
Referencias
- ^ Hopkinson, MN; Richter, C.; Schedler, M.; Glorius, F. (2014). "Una descripción general de los carbenos N -heterocíclicos". Nature . 510 (7506): 485–496. Bibcode :2014Natur.510..485H. doi :10.1038/nature13384. PMID 24965649. S2CID 672379.
- ^ Ronald Breslow (1957). "Mecanismo de acción de la tiamina: participación de un zwitterión de tiazolio". Chem. Ind. 26 : 893.
- ^ Ronald Breslow (1958). "Sobre el mecanismo de acción de la tiamina. IV.1 Evidencias de estudios sobre sistemas modelo". J. Am. Chem. Soc. 80 (14): 3719–3726. doi :10.1021/ja01547a064.
- ^ R. Breslow (1957). "Intercambio rápido de deuterio en sales de tiazolio". J. Am. Chem. Soc. 79 (7): 1762–1763. doi :10.1021/ja01564a064.
- ^ Berkessel A.; Elfert S.; Yatham VR; Neudörfl J.-M.; Schlörer NE; Teles JH (2012). "Umpolung por carbenos N-heterocíclicos: generación y reactividad de los esquivos 2,2-diamino enoles (intermedios de Breslow)". Angew. Chem. Int. Ed. 51 (49): 12370–12374. doi : 10.1002/anie.201205878 . PMID 23081675.
- ^ Los químicos se acercan al esquivo Breslow Intermediate Carmen Drahl
- ^ Hans-Werner Wanzlick; E. Schikora (1960). "Ein neuer Zugang zur Carben-Chemie" [Una nueva forma de acceder a la química de los carbenos]. Angélica. Química. 72 (14): 494. Bibcode : 1960AngCh..72..494W. doi : 10.1002/ange.19600721409.
- ^ ab HW Wanzlick; E. Schikora (1960). "Ein nucleophiles Carben" [Un carbeno nucleofílico]. Química. Ber. 94 (9): 2389–2393. doi :10.1002/cber.19610940905.
- ^ ab HW Wanzlick (1962). "Aspectos de la química nucleofílica del carbeno". Angew. Chem. Int. Ed. 1 (2): 75–80. doi :10.1002/anie.196200751.
- ^ DM Lemal; RA Lovald; KI Kawano (1964). "Tetraaminoetilenos. La cuestión de la disociación". J. Am. Chem. Soc. 86 (12): 2518–2519. doi :10.1021/ja01066a044.
- ^ SE Winberg; JE Carnahan; DD Coffman; M. Marrón (1965). "Tetraaminoetilenos". J. Am. Química. Soc. 87 (9): 2055-2056. doi :10.1021/ja01087a040.
- ^ Denk MK; Hatano K.; Ma M. (1999). "Carbenos nucleofílicos y el equilibrio de Wanzlick: una nueva investigación". Tetrahedron Lett. 40 (11): 2057–2060. doi :10.1016/S0040-4039(99)00164-1.
- ^ Böhm Volker PW; Herrmann Wolfgang A. (2000). "El equilibrio de Wanzlick". Angew. Chem. Int. Ed. 39 (22): 4036–4038. doi :10.1002/1521-3773(20001117)39:22<4036::AID-ANIE4036>3.0.CO;2-L. PMID 11093196.
- ^ por HW Wanzlick; HJ Schonherr (1970). "Química de los carbenos nucleófilos, XVIII, 1) Perclorato de 1,3,4,5-tetrafenilimidazolio". Liebigs Ann. Química. 731 : 176–179. doi :10.1002/jlac.19707310121.
- ^ R. Gleiter; R. Hoffmann (1968). "Estabilización de un metileno singlete". J. Am. Química. Soc. 90 (20): 5457–5460. doi :10.1021/ja01022a023.
- ^ ab A. Igau; H. Grutzmacher; A. Baceiredo; G. Bertrand (1988). "Especies análogas de α,α ′ -bis-carbenoide con triple enlace: síntesis de un λ 3 -fosfinocarbeno-λ 3 -fosfaacetileno estable". J. Am. Chem. Soc. 110 (19): 6463–6466. doi :10.1021/ja00227a028.
- ^ abc G. Bertrand; R. Reed (1994). "λ 3 -Fosfinocarbenos λ 5 -fosfaacetilenos". Coord. Chem. Rev. 137 : 323–355. doi :10.1016/0010-8545(94)03005-B.
- ^ abc Arduengo, AJ; Harlow, RL; Kline, M. (1991). "Un carbeno cristalino estable". J. Am. Chem. Soc. 113 (1): 361–363. doi :10.1021/ja00001a054.
- ^ Tapu, Daniela; Dixon, David A.; Roe, Christopher (12 de agosto de 2009). "Espectroscopia de RMN de 13C de carbenos "tipo Arduengo" y sus derivados". Chem. Rev. 109 (8): 3385–3407. doi :10.1021/cr800521g. PMID 19281270.
- ^ Arduengo, Anthony J.; Harlow, Richard L.; Kline, Michael (enero de 1991). "Un carbeno cristalino estable". J. Am. Chem. Soc. 113 (1): 361–363. doi :10.1021/ja00001a054.
- ^ ab AJ Arduengo; F. Davidson; HVR Dias; JR Goerlich; D. Khasnis; WJ Marshall; TK Prakasha (1997). "Un carbeno estable al aire y un carbeno mixto 'dímero'"". J. Am. Chem. Soc. 119 (52): 12742–12749. doi :10.1021/ja973241o.
- ^ Christophe Buron; Heinz Gornitzka; Vadim Romanenko; Guy Bertrand (2000). "Versiones estables de carbenos transitorios push-pull: prolongación de la vida útil de nanosegundos a semanas". Science . 288 (5467): 834–836. Bibcode :2000Sci...288..834B. doi :10.1126/science.288.5467.834. PMID 10796999.
- ^ Solé, Stéphane; Gornitzka, Heinz; Schoeller, Wolfgang W.; Bourissou, Didier; Bertrand, Guy (2001). "(Amino)(Aryl)Carbenos: Carbenos singlete estables con un sustituyente espectador". Science . 292 (5523): 1901–1903. Bibcode :2001Sci...292.1901S. doi :10.1126/science.292.5523.1901. PMID 11397943.
- ^ Lai Chun-Liang; Guo Wen-Hsin; Lee Ming-Tsung; Hu Ching-Han (2005). "Propiedades de ligando de carbenos N -heterocíclicos y de Bertrand: un estudio funcional de la densidad". J. Organomet. Chem. 690 (24–25): 5867–5875. doi :10.1016/j.jorganchem.2005.07.058.
- ^ Rzepa, Henry (11 de septiembre de 2016). "¿Qué hay en un nombre? Carbenos: una verificación de la realidad". Química con un toque diferente . Consultado el 15 de febrero de 2024 .
- ^ abcd AJ Arduengo; HVR Dias; RL Harlow; M. Kline (1992). "Estabilización electrónica de carbenos nucleofílicos". J. Am. Chem. Soc. 114 (14): 5530–5534. doi :10.1021/ja00040a007.
- ^ abc J. Arduengo; JR Goerlich; WJ Marshall (1995). "Un diaminocarbeno estable". J. Am. Chem. Soc. 117 (44): 11027–11028. doi :10.1021/ja00149a034.
- ^ abcde RW Aliso; PR Allen; M. Murray; AG Orpen (1996). "Bis (diisopropilamino) carbeno". Angélica. Química. Int. Ed. 35 (10): 1121-1123. doi :10.1002/anie.199611211.
- ^ abcde MK Denk; A. Thadani; K. Hatano; AJ Lough (1997). "Estabilización estérica de carbenos nucleofílicos". Angew. Chem. Int. Ed. 36 (23): 2607–2609. doi :10.1002/anie.199726071.
- ^ abcd Alder, RW; Chaker, L; Paolini, FP (2004). "Bis(dietilamino)carbeno y el mecanismo de dimerización para diaminocarbenos simples". Chemical Communications (19): 2172–2173. doi :10.1039/b409112d. PMID 15467857.
- ^ abcde RW Alder; ME Blake (1997). "Bis( N -piperidil)carbeno y su lenta dimerización a tetrakis( N -piperidil)eteno". Chem. Commun. (16): 1513–1514. doi :10.1039/a703610h.
- ^ ab RW Alder; ME Blake; JM Oliva (1999). "Diaminocarbenos; cálculo de barreras a la rotación sobre enlaces C carbeno -N, barreras a la dimerización, afinidades protónicas y desplazamientos de RMN de 13 C". J. Phys. Chem. A . 103 (50): 11200–11211. Código Bibliográfico :1999JPCA..10311200A. doi :10.1021/jp9934228.
- ^ abcde AJ Arduengo, JR Goerlich y WJ Marshall (1997). "Un tiazol-2-ilideno estable y su dímero". Liebigs Ann. Chem. 1997 (2): 365–374. doi :10.1002/jlac.199719970213.
- ^ abc RW Alder; CP Butts; AG Orpen (1998). "Aminooxi- y aminotiocarbenos estables". J. Am. Chem. Soc. 120 (44): 11526–11527. doi :10.1021/ja9819312.
- ^ ab Lavallo, Vincent; Canac, Yves; Donnadieu, Bruno; Schoeller, Wolfgang W.; Bertrand, Guy (2006). "Ciclopropenilidenos: del espacio interestelar a un derivado aislado en el laboratorio". Science . 312 (5774): 722–724. Bibcode :2006Sci...312..722L. doi :10.1126/science.1126675. PMC 2427275 . PMID 16614171.
- ^ abc WA Herrmann; C. Kocher; LJ Goossen; GRJ Artus (1996). "Carbenos heterocíclicos: una síntesis de alto rendimiento de nuevos carbenos N -heterocíclicos funcionalizados en amoníaco líquido". Química. Eur. J. 2 (12): 1627–1636. doi :10.1002/chem.19960021222.
- ^ ab WA Herrmann; M. Elison; J. Fischer; C. Kocher; GRJ Artus (1996). " Carbenos N -heterocíclicos: generación en condiciones suaves y formación de complejos de metales de transición del grupo 8-10 relevantes para la catálisis". Química. Eur. J. 2 (7): 772–780. doi :10.1002/chem.19960020708.
- ^ ab HVR Dias; WC Jin (1994). "Un ligando de carbeno tridentado estable". Tetrahedron Lett. 35 (9): 1365–1366. doi :10.1016/S0040-4039(00)76219-8.
- ^ abcd D. Enders; K. Breuer; G. Raabe; J. Runsink; JH Teles; JP Melder; K. Ebel; S. Brode (1995). "Preparación, estructura y reactividad de 1,3,4-trifenil-4,5-dihidro-1 H -1,2,4-triazol-5-ilideno, un nuevo carbeno estable". Angew. Chem. Int. Ed. 34 (9): 1021–1023. doi :10.1002/anie.199510211.
- ^ abcd RW Alder; ME Blake; C. Bortolotti; S. Buffali; CP Butts; E. Lineham; JM Oliva; AG Orpen; MJ Quayle (1999). "Complejación de carbenos estables con metales alcalinos". Chem. Commun. (3): 241–242. doi :10.1039/a808951e.
- ^ R. Breslow (1957). "Intercambio rápido de deuterio en sales de tiazolio". J. Am. Chem. Soc. 79 (7): 1762–1763. doi :10.1021/ja01564a064.
- ^ ab HD Haztzler (1970). "Carbenos nucleofílicos de 1,3-ditiolio". J. Am. Chem. Soc. 92 (5): 1412–1413. doi :10.1021/ja00708a058.
- ^ ab HD Hartzler (1972). "Carbenos de 1,3-ditiolio a partir de acetilenos y disulfuro de carbono". J. Am. Chem. Soc. 95 (13): 4379–4387. doi :10.1021/ja00794a039.
- ^ G. Bertrand; A. Igau; A. Baceiredo; G. Trinquier (1989). "[Bis(diisopropilamino)fosfino]trimetilsililcarbeno: un carbeno nucleofílico estable". Angew. Chem. Int. Ed. 28 (5): 621–622. doi :10.1002/anie.198906211.
- ^ ab Präsang, C; Donnadieu, B; Bertrand, G (2005). "Carbenos N-heterocíclicos de seis miembros con seis π-electrones y propiedades electrónicas ajustables". J. Am. Chem. Soc. 127 (29): 10182–10183. doi :10.1021/ja052987g. PMC 2440681 . PMID 16028925.
- ^ Tomioka, H; Iwamoto, E; Itakura, H; Hirai, K (2001). "Generación y caracterización de un carbeno triplete bastante estable". Nature . 412 (6847): 626–628. Bibcode :2001Natur.412..626T. doi :10.1038/35088038. PMID 11493917. S2CID 4373216.
- ^ Michael Freemantle (13 de agosto de 2001). "El carbeno triplete tiene una larga vida". Chemical & Engineering News . 79 (33): 11. doi :10.1021/cen-v079n033.p011a.
- ^ Itoh, T; Nakata, Y; Hirai, K; Tomioka, H (2006). "Difenilcarbenos tripletes protegidos por grupos trifluorometilo y bromo. Un carbeno triplete que sobrevive un día en solución a temperatura ambiente". J. Am. Chem. Soc. 128 (3): 957–967. doi :10.1021/ja056575j. PMID 16417387.
- ^ ab RW Alder; PR Allen; SJ Williams (1995). "Carbenos estables como bases fuertes". Chem. Commun. (12): 1267. doi :10.1039/c39950001267.
- ^ Massey Richard S (2012). "Reacciones de transferencia de protones de triazol-3-ilidenos: acidez cinética y valores pKa de ácidos carboxílicos para veinte sales de triazolio en solución acuosa" (PDF) . J. Am. Chem. Soc. 134 (50): 20421–20432. doi :10.1021/ja308420c. PMID 23173841.
- ^ Higgins, Eleanor M.; Sherwood, Jennifer A.; Lindsay, Anita G.; Armstrong, James; Massey, Richard S.; Alder, Roger W.; O'Donoghue, Annmarie C. (2011). "pKas de los ácidos conjugados de carbenos N-heterocíclicos en agua". Química Común. 47 (5): 1559–1561. doi :10.1039/C0CC03367G. PMID 21116519. S2CID 205757477.
- ^ TA Taton; P. Chen (1996). "Un tetraazafulvaleno estable". Angew. Chem. Int. Ed. 35 (9): 1011–1013. doi :10.1002/anie.199610111.
- ^ Alder, Roger W.; Blake, Michael E.; Chaker, Leila; Harvey, Jeremy N.; Paolini, François; Schütz, Jan (2004). "¿Cuándo y cómo se dimerizan los diaminocarbenos?". Angew. Chem. Int. Ed. 43 (44): 5896–5911. doi : 10.1002/anie.200400654 . PMID 15457494.
- ^ Enders, D.; Breuer, K.; Runsink, J.; Teles, JH (1996). "Reacciones químicas del carbeno estable 1,3,4-trifenil-4,5-dihidro-1 H -1,2,4-triazol-5-ilideno". Liebigs Ann. Chem. 1996 (12): 2019–2028. doi :10.1002/jlac.199619961212.
- ^ ab Enders, D.; Breuer, K.; Teles, JH; Ebel, K. (1997). "1,3,4-Trifenil-4,5-dihidro-1 H -1,2,4-triazol-5-ilideno – aplicaciones de un carbeno estable en síntesis y catálisis". J. Prakt. Chem. 339 : 397–399. doi :10.1002/prac.19973390170.
- ^ Wolf, J; Böhlmann, W; Findeisen, M; Gelbrich, T; Hofmann, HJ; Schulze, B (2007). "Síntesis de carbenos isotiazol estables". Angew. Chem. Int. Ed. 46 (17): 3118–3121. doi :10.1002/anie.200604305. PMID 17372997.
- ^ ab DeHope, A; Lavallo, V; Donnadieu, B; Schoeller, WW; Bertrand, G (2007). "Carbenos de isotiazol cristalinos informados recientemente: ¿mito o realidad?". Angew. Chem. Int. Ed. 46 (36): 6922–6925. doi :10.1002/anie.200702272. PMID 17661300.
- ^ Wolf Janine; Böhlmann Winfried; Findeisen Matthias; Gelbrich Thomas; Hofmann Hans-Jorg; Schulze Borbel (2007). "Respuesta a "Recientemente se informó sobre carbenos isotiazol cristalinos: ¿mito o realidad"". Angew. Chem. Int. Ed. 46 (36): 6926. doi :10.1002/anie.200702746.
- ^ ab Wolfgang A. Herrmann ; Christian Kocher (1997). " Carbenos N -heterocíclicos". Angélica. Química. Int. Ed. 36 (20): 2162–2187. doi :10.1002/anie.199721621. S2CID 97336589.
- ^ Gernot Boche; Christof Hilf; Klaus Harms; Michael Marsch; John CW Lohrenz (1995). "Estructura cristalina del (4- terc -butiltiazolato)(glima)litio dimérico: carácter carbeno de un anión formilo equivalente". Angew. Chem. Int. Ed. 34 (4): 487–489. doi :10.1002/anie.199504871.
- ^ ab D. Enders; H. Gielen; G. Raabe; J. Runsink; JH Teles (1996). "Síntesis y estereoquímica de los primeros complejos quirales de (imidazolinilideno) y (triazolinilideno)paladio(II)". Chem. Ber. 129 (12): 1483–1488. doi :10.1002/cber.19961291213.
- ^ por Wolfgang A. Herrmann ; Martina Elison; Jakob Fischer; Christian Köcher; Georg RJ Artus (1995). "Complejos metálicos de carbenos N -heterocíclicos: un nuevo principio estructural para catalizadores en catálisis homogénea". Angew. Chem. Int. Ed. 34 (21): 2371–2374. doi :10.1002/anie.199523711.
- ^ ab Wolfgang A. Herrmann ; Lucas J. Goossen; Christian Kocher; Georg RJ Artus (1996). "Carbenos heterocíclicos quirales en catálisis homogénea asimétrica". Angélica. Química. Int. Ed. 35 (23–24): 2805–2807. doi :10.1002/anie.199628051.
- ^ M. Scholl; TM Trnka; JP Morgan; RH Grubbs (1999). "Aumento de la actividad de metátesis de cierre de anillo de catalizadores de metátesis de olefinas basados en rutenio coordinados con ligandos de imidazolin-2-ilideno". Tetrahedron Lett. 40 (12): 2247–2250. doi :10.1016/S0040-4039(99)00217-8.
- ^ Han Vinh Huynh; et al. (2009). "Determinación espectroscópica de RMN de 13C de la fuerza de los donantes de ligando utilizando complejos de carbeno N-heterocíclico de paladio (II)". Organometallics . 28 (18): 5395–5404. doi : 10.1021/om900667d .
- ^ SP Nolan [editor] (2006). Carbenos N-heterocíclicos en síntesis, Wiley-VCH ISBN 3-527-31400-8
- ^ F. Glorius [editor] (2007) Carbenos N-heterocíclicos en catálisis de metales de transición, Springer ISBN 3-540-36929-5
- ^ Díez-González, Silvia; Marion, Nicolas; Nolan, Steven P. (12 de agosto de 2009). "Carbenos N-heterocíclicos en catálisis de metales de transición tardía". Chem. Rev. 109 (8): 3612–3676. doi :10.1021/cr900074m. ISSN 0009-2665. PMID 19588961. S2CID 206902952.
- ^ Garrison Jered C.; Youngs Wiley J. (2005). "Complejos de carbeno N-heterocíclicos Ag(I): síntesis, estructura y aplicación". Chem. Rev. 105 ( 11): 3978–4008. doi :10.1021/cr050004s. PMID 16277368. S2CID 43090499.
- ^ Roger W. Alder; Michael E. Blake; Simone Bufali; Craig P. Butts; A. Guy Orpen; Jan Schütz; Stuart J. Williams (2001). "Preparación de sales de tetraalquilformamidinio y especies relacionadas como precursores de carbenos estables". J. Chem. Soc., Perkin Trans. 1 (14): 1586–1593. doi :10.1039/b104110j.
- ^ N. Kuhn; T. Kratz (1993). "Síntesis de imidazol-2-ilidenos por reducción de imidazol-2(3 H )-tionas". Síntesis . 1993 (6): 561–562. doi :10.1055/s-1993-25902.
- ^ D. Kovacs; MS Lee; D. Olson; JE Jackson (1996). "Transferencia de átomos de oxígeno de carbeno a carbeno". J. Am. Chem. Soc. 118 (34): 8144–8145. doi :10.1021/ja961324j.
- ^ Michael Otto; Salvador Conejero; Yves Canac; Vadim D. Romanenko; Valentyn Rudzevitch; Guy Bertrand (2004). "Mono- y diaminocarbenos a partir de sales de cloroiminio y amidinio: síntesis de bis(dimetilamino)carbeno sin metales". J. Am. Chem. Soc. 126 (4): 1016–1017. doi :10.1021/ja0393325. PMID 14746458.
Lectura adicional
Reseñas sobre carbenos persistentes:
- Hopkinson, MN; Richter, C.; Schedler, M.; Glorius, F. (2014). "Una descripción general de los carbenos N-heterocíclicos". Nature . 510 (7506): 485–496. Bibcode :2014Natur.510..485H. doi :10.1038/nature13384. PMID 24965649. S2CID 672379..
- Química del carbeno: de intermediarios fugaces a reactivos poderosos (Capítulo 4, Hideo Tomioka (estado triplete); Capítulo 5 (estado singlete), Roger W. Alder) - ed. Guy Bertrand
- Química reactiva intermedia Por Robert A. Moss, Matthew Platz, Maitland Jones (Capítulo 8, Carbenos singletes estables, Guy Bertrand)
- RW Alder, en 'Diaminocarbenos: explorando la estructura y la reactividad', ed. G. Bertrand, Nueva York, 2002
- M. Regitz (1996). "Carbenos estables: ¿ilusión o realidad?". Angew. Chem. Int. Ed. 30 (6): 674–676. doi :10.1002/anie.199106741.
Para una revisión de las propiedades físico-químicas (electrónicas, estéricas, ...) de los carbenos N-heterocíclicos:
- T. Dröge; F. Glorius (2010). "La medida de todos los anillos: carbenos N-heterocíclicos". Angew. Chem. Int. Ed. 49 (39): 6940–6952. doi :10.1002/anie.201001865. PMID 20715233.