Tioacetal
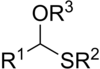

En la química de los organosulfurados , los tioacetales son los análogos de azufre ( tio- ) de los acetales ( R−CH(−OR) 2 ). Existen dos clases: los monotioacetales menos comunes , con la fórmula R−CH(−OR')−SR" , y los ditioacetales , con la fórmula R−CH(−SR') 2 (ditioacetales simétricos) o R−CH(−SR')−SR" (ditioacetales asimétricos). [1]
Los ditioacetales simétricos son relativamente comunes. Se preparan por condensación de tioles ( −SH ) o ditioles (dos grupos −SH ) con aldehídos ( −CH=O ). Estas reacciones se producen por intermedio de hemitioacetales ( R−CH(−OH)−SR' ):
- Adición de tiol para dar hemitioacetal :
- Adición de tiol con pérdida de agua para dar ditioacetal:
Estas reacciones normalmente emplean un ácido de Lewis o un ácido de Brønsted como catalizador .
Los ditioacetales generados a partir de aldehídos y 1,2-etanoditiol o 1,3-propanoditiol son especialmente comunes entre esta clase de moléculas para su uso en síntesis orgánica . [2]
El carbono carbonílico de un aldehído es electrófilo y, por lo tanto, susceptible al ataque de los nucleófilos , mientras que el carbono central análogo de un ditioacetal no es electrófilo. Como resultado, los ditioacetales pueden servir como grupos protectores para los aldehídos.
Lejos de ser poco reactivo, y en una reacción diferente a la de los aldehídos, ese carbono puede desprotonarse para volverlo nucleófilo:
La inversión de polaridad entre R'(H)C δ+ =O δ− y R'CLi(SR) 2 se denomina umpolung . La reacción se realiza habitualmente utilizando el 1,3-ditiano . El intermedio litiado se puede utilizar para diversas reacciones de formación de enlaces nucleofílicos y, a continuación, el ditiocetal se hidroliza de nuevo a su forma carbonílica. Este proceso global, la reacción de Corey-Seebach , da el equivalente sintético de un anión acilo.
Véase también
Referencias
- ^ IUPAC , Compendio de terminología química , 2.ª edición (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "tioacetales". doi :10.1351/goldbook.T06348
- ^ P. Stütz y PA Stadler "Indoles 3-alquilados y 3-acilados a partir de un precursor común: 3-bencilindol y 3-benzoilindol" Org. Synth. 1977, 56, 8. doi :10.15227/orgsyn.056.0008



