Ion de halonio

Un ion halonio es cualquier ion onio que contiene un átomo de halógeno con carga positiva. Este catión tiene la estructura general R−+incógnita−R′ donde X es cualquier halógeno y no hay restricciones en R, [1] esta estructura puede ser cíclica o una estructura molecular de cadena abierta. Los iones de halonio formados a partir de flúor , cloro , bromo y yodo se denominan fluoronio , cloronio , bromonio y yodonio , respectivamente. [1] La variedad cíclica de 3 miembros comúnmente propuesta como intermediario en la halogenación electrofílica puede denominarse iones de haliranio, utilizando el sistema de nomenclatura Hantzsch-Widman .
Estructura
Los iones de halonio más simples tienen la estructura H−+incógnita−H (X = F, Cl, Br, I). Muchos iones de halonio tienen una estructura cíclica de tres átomos, similar a la de un epóxido , resultante de la adición formal de un ion de halógeno X + a un doble enlace C=C , como cuando se añade un halógeno a un alqueno . [1] La formación de iones de halonio de 5 miembros (por ejemplo, iones de clorolanio, bromolanio) a través de la participación de grupos vecinos también está bien estudiada. [2]
Los iones de diaryliodonio ( [Ar 2 I] + X − ) son sales generalmente estables y aislables que presentan una geometría en forma de T con los grupos arilo separados unos 90 grados; [3] para más detalles, véase yodo hipervalente .
La tendencia a formar iones de halonio puente se da en el orden I > Br > Cl > F. Mientras que el yodo y el bromo forman fácilmente iones de yodonio y bromonio puenteados, los iones de fluoronio se han caracterizado recientemente en sistemas diseñados que fuerzan el encuentro cercano del par solitario de flúor y un centro carbocatiónico. En la práctica, estructuralmente, existe un continuo entre un halonio puenteado simétricamente, a un halonio asimétrico con un enlace débil largo a uno de los centros de carbono, a un β-halocarbocatión verdadero sin carácter de halonio. La estructura de equilibrio depende de la capacidad de los átomos de carbono y del halógeno para acomodar la carga positiva. Por lo tanto, un ion de bromonio que puentea un carbono primario y terciario a menudo exhibirá una estructura sesgada, con un enlace débil al centro terciario (con un carácter carbocatiónico significativo) y un enlace más fuerte al carbono primario. Esto se debe a la mayor estabilidad de los carbonos terciarios para estabilizar la carga positiva. En el caso más extremo, si el centro terciario es doblemente bencílico, por ejemplo, entonces la forma abierta puede verse favorecida. De manera similar, el cambio de bromo a cloro también debilita el carácter de puente, debido a la mayor electronegatividad del cloro y a su menor propensión a compartir la densidad electrónica en comparación con el bromo.
Reactividad
Estos iones son, por lo general, intermediarios de reacción de corta duración ; son muy reactivos, debido a la alta tensión del anillo de tres miembros y a la carga positiva del halógeno; esta carga positiva los convierte en grandes electrófilos . En casi todos los casos, el ion halonio es atacado por un nucleófilo en un tiempo muy corto. Incluso un nucleófilo débil, como el agua , atacará al ion halonio; así es como se pueden formar las halohidrinas .
En ocasiones, un átomo de halonio se reorganizará en un carbocatión . Esto suele ocurrir solo cuando ese carbocatión es un carbocatión alílico o bencílico. [4]
Historia
Los iones de halonio fueron postulados por primera vez en 1937 por Roberts y Kimball [5] para explicar la antidiastereoselectividad observada en las reacciones de adición de halógenos a los alquenos . Argumentaron correctamente que si el intermediario de reacción inicial en la bromación es la especie de cadena abierta X–C–C + , la rotación alrededor del enlace simple C–C sería posible, lo que llevaría a una mezcla de cantidades iguales de isómero sin y anti de dihalógeno , lo que no es el caso. También afirmaron que un átomo de halógeno cargado positivamente es isoelectrónico con el oxígeno y que el carbono y el bromo tienen potenciales de ionización comparables . Para ciertos alquenos sustituidos con arilo, la antiestereoespecificidad disminuye o se pierde, como resultado del carácter de halonio debilitado o ausente en el intermediario catiónico.
En 1970, George A. Olah logró preparar y aislar sales de halonio [6] añadiendo un haluro de metilo, como bromuro de metilo o cloruro de metilo en dióxido de azufre a -78 °C, a un complejo de pentafluoruro de antimonio y tetrafluorometano en dióxido de azufre. Después de la evaporación del dióxido de azufre, este procedimiento dejó cristales de [H 3 C–+incógnita–CH 3 ][SbF 6 ] – , estable a temperatura ambiente pero no a la humedad. Recientemente se ha caracterizado un ion fluoronio en fase de solución (disuelto en dióxido de azufre o fluoruro de cloruro de sulfurilo ) a baja temperatura. [7]
Los iones cloronio cíclico y acíclico, [8] bromonio y yodonio se han caracterizado estructuralmente mediante cristalografía de rayos X , como el catión bromonio derivado de bi(adamantilideno) que se muestra a continuación. [9]
 | 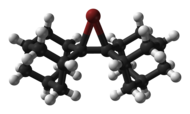 |
| fórmula esquelética | modelo de bola y palo |
No existen compuestos que contengan iones de halonio trivalentes o tetravalentes, pero para algunos compuestos hipotéticos se ha probado computacionalmente la estabilidad. [10]
Referencias
- ^ abc IUPAC , Compendio de terminología química , 2.ª ed. (el "Libro de oro") (1997). Versión corregida en línea: (2006–) "Iones de halonio". doi :10.1351/goldbook.H02728
- ^ Peterson, Paul E. (1971-12-01). "Iones de halonio cíclicos con anillos de cinco miembros". Accounts of Chemical Research . 4 (12): 407–413. doi :10.1021/ar50048a003. ISSN 0001-4842.
- ^ Sadek, Omar; Perrin, David M.; Gras, Emmanuel (1 de junio de 2019). "Sales de feniltrifluoroborato de diaryliodonium asimétricas: síntesis, estructura y fluoración". Journal of Fluorine Chemistry . 222–223: 68–74. doi :10.1016/j.jfluchem.2019.04.004. ISSN 0022-1139. S2CID 132289845.
- ^ Bruice, Paula Yurkanis (2014). Química orgánica (7.ª ed.). Pearson Education. ISBN 978-0-321-80322-1.
- ^ Roberts, Irving; Kimball, George E. (1937). "La halogenación de etilenos". J. Am. Chem. Soc. 59 (5): 947. doi :10.1021/ja01284a507.
- ^ Olah, George A. ; DeMember, John R. (1970). "Química de Friedel-Crafts. V. Aislamiento, resonancia magnética nuclear de carbono-13 y estudio espectroscópico láser Raman de fluoroantimonatos de dimetilhalonio". J. Am. Chem. Soc. 92 (3): 718. doi :10.1021/ja00706a058.
- ^ Pitts, Cody Ross; Holl, Maxwell Gargiulo; Lectka, Thomas (2018). "Caracterización espectroscópica de un ion de fluoronio [C–F–C]+ en solución". Angew. Química. 130 (7). doi : 10.1002/ange.201712021 .
- ^ Mori, T.; Rathore, R. (1998). "Estructura de rayos X del catión cloronio 2,2'-bi(adamant-2-ilideno) con puente y comparación de su reactividad con un catión cloroarenio con enlace simple". ChemComm (8): 927–928. doi :10.1039/a709063c.
- ^ Brown, RS; Nagorski, RW; Bennet, AJ; McClung, RED; Aarts, GHM; Klobukowski, M.; McDonald, R.; Santarsiero, BD (marzo de 1994). "Iones estables de bromonio y yodonio de las olefinas impedidas adamantilideneadamantano y biciclo[3.3.1]nonilidenobiciclo[3.3.1]nonano. Estructura de rayos X, transferencia de halógenos positivos a olefinas aceptoras y estudios ab initio". J. Am. Chem. Soc. 116 (6): 2448–2456. doi :10.1021/ja00085a027.
- ^ Schneider, Tobias F.; Werz, Daniel B. (2010). "La búsqueda de iones de halonio tetracoordinados: una investigación teórica". Org. Lett . 12 (21): 4844–4847. doi :10.1021/ol102059b. PMID 20923174.
