Neurotoxin

Las neurotoxinas son toxinas que destruyen el tejido nervioso (causando neurotoxicidad ). [3] Las neurotoxinas son una clase extensa de insultos neurológicos químicos exógenos [4] que pueden afectar negativamente la función tanto en el tejido nervioso en desarrollo como en el maduro. [5] El término también se puede utilizar para clasificar compuestos endógenos que, cuando entran en contacto de forma anormal, pueden resultar neurológicamente tóxicos. [4] Aunque las neurotoxinas suelen ser neurológicamente destructivas, su capacidad para dirigirse específicamente a los componentes neuronales es importante en el estudio de los sistemas nerviosos. [6] Los ejemplos comunes de neurotoxinas incluyen plomo , [7] etanol (alcohol potable), [8] glutamato , [9] óxido nítrico , [10] toxina botulínica (p. ej., Botox), [11] toxina tetánica , [12] y tetrodotoxina . [6] Algunas sustancias como el óxido nítrico y el glutamato son, de hecho, esenciales para el funcionamiento adecuado del cuerpo y solo ejercen efectos neurotóxicos en concentraciones excesivas.
Las neurotoxinas inhiben el control neuronal sobre las concentraciones de iones a través de la membrana celular , [6] o la comunicación entre neuronas a través de una sinapsis . [13] La patología local de la exposición a neurotoxinas a menudo incluye excitotoxicidad neuronal o apoptosis [14] pero también puede incluir daño a las células gliales . [15] Las manifestaciones macroscópicas de la exposición a neurotoxinas pueden incluir daño generalizado al sistema nervioso central como discapacidad intelectual , [5] deterioro persistente de la memoria , [16] epilepsia y demencia . [17] Además, el daño al sistema nervioso periférico mediado por neurotoxinas como la neuropatía o la miopatía es común. Se ha demostrado apoyo para una serie de tratamientos destinados a atenuar la lesión mediada por neurotoxinas, como la administración de antioxidantes [8] y antitoxina [18] .
Fondo
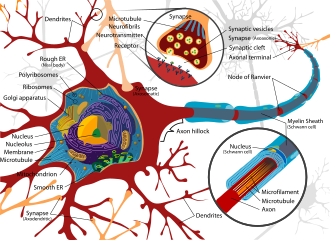
La exposición a neurotoxinas en la sociedad no es algo nuevo, [19] ya que las civilizaciones han estado expuestas a compuestos neurológicamente destructivos durante miles de años. Un ejemplo notable es la posible exposición significativa al plomo durante el Imperio Romano, como resultado del desarrollo de extensas redes de plomería y la costumbre de hervir vino avinagrado en ollas de plomo para endulzarlo, proceso que genera acetato de plomo, conocido como "azúcar de plomo". [20] En parte, las neurotoxinas han sido parte de la historia humana debido a la naturaleza frágil y susceptible del sistema nervioso, lo que lo hace muy propenso a sufrir alteraciones.
El tejido nervioso que se encuentra en el cerebro , la médula espinal y la periferia comprende un sistema biológico extraordinariamente complejo que define en gran medida muchos de los rasgos únicos de los individuos. Sin embargo, como ocurre con cualquier sistema altamente complejo, incluso pequeñas perturbaciones en su entorno pueden provocar importantes trastornos funcionales. Las propiedades que conducen a la susceptibilidad del tejido nervioso incluyen una gran superficie de neuronas, un alto contenido de lípidos que retiene toxinas lipofílicas, un alto flujo sanguíneo al cerebro que induce una mayor exposición efectiva a toxinas y la persistencia de las neuronas a lo largo de la vida de un individuo, lo que conduce a la acumulación de daños. [21] Como resultado, el sistema nervioso tiene una serie de mecanismos diseñados para protegerlo de agresiones internas y externas, incluida la barrera hematoencefálica.
La barrera hematoencefálica (BHE) es un ejemplo fundamental de protección que impide que las toxinas y otros compuestos nocivos lleguen al cerebro. [22] Como el cerebro necesita la entrada de nutrientes y la eliminación de desechos, está perfundido por el flujo sanguíneo. Sin embargo, la sangre puede transportar una serie de toxinas ingeridas, que provocarían una muerte significativa de neuronas si llegaran al tejido nervioso. Por lo tanto, las células protectoras denominadas astrocitos rodean los capilares del cerebro y absorben los nutrientes de la sangre y luego los transportan a las neuronas, aislando eficazmente al cerebro de una serie de posibles agresiones químicas. [22]

Esta barrera crea una capa hidrófoba apretada alrededor de los capilares del cerebro, inhibiendo el transporte de compuestos grandes o hidrófilos . Además de la BHE, el plexo coroideo proporciona una capa de protección contra la absorción de toxinas en el cerebro. Los plexos coroideos son capas vascularizadas de tejido que se encuentran en el tercer, cuarto y laterales ventrículos del cerebro , que a través de la función de sus células ependimarias , son responsables de la síntesis de líquido cefalorraquídeo (LCR). [23] Es importante destacar que, a través del paso selectivo de iones y nutrientes y atrapando metales pesados como el plomo, los plexos coroideos mantienen un entorno estrictamente regulado que contiene el cerebro y la médula espinal. [22] [23]

Algunos compuestos, incluidas ciertas neurotoxinas, pueden penetrar en el cerebro e inducir daños importantes al ser hidrófobos y pequeños o al inhibir la función de los astrocitos. En la actualidad, los científicos y los médicos se han enfrentado al reto de identificar y tratar las neurotoxinas, lo que ha dado lugar a un creciente interés tanto en la investigación neurotoxicológica como en los estudios clínicos. [24] Aunque la neurotoxicología clínica es en gran medida un campo en auge, se han realizado grandes avances en la identificación de muchas neurotoxinas ambientales que han llevado a la clasificación de entre 750 y 1000 compuestos potencialmente neurotóxicos conocidos. [21] Debido a la importancia crítica de encontrar neurotoxinas en entornos comunes, la Agencia de Protección Ambiental de los Estados Unidos (EPA) ha desarrollado protocolos específicos para probar y determinar los efectos neurotóxicos de los compuestos (USEPA 1998). Además, se ha incrementado el uso de sistemas in vitro , ya que proporcionan mejoras significativas con respecto a los sistemas in vivo más comunes del pasado. Algunos ejemplos de mejoras incluyen entornos manejables y uniformes y la eliminación de los efectos contaminantes del metabolismo sistémico. [24] Sin embargo, los sistemas in vitro han presentado problemas, ya que ha sido difícil replicar adecuadamente las complejidades del sistema nervioso, como las interacciones entre los astrocitos de soporte y las neuronas en la creación de la BHE. [25] Para complicar aún más el proceso de determinación de neurotoxinas al realizar pruebas in vitro, la neurotoxicidad y la citotoxicidad pueden ser difíciles de distinguir, ya que la exposición directa de las neuronas a los compuestos puede no ser posible in vivo, como lo es in vitro. Además, la respuesta de las células a las sustancias químicas puede no transmitir con precisión una distinción entre neurotoxinas y citotoxinas, ya que pueden ocurrir síntomas como estrés oxidativo o modificaciones esqueléticas en respuesta a cualquiera de ellas. [26]
En un esfuerzo por abordar esta complicación, recientemente se han propuesto las excrecencias de neuritas (axonales o dendríticas) en respuesta a los compuestos aplicados como una distinción más precisa entre neurotoxinas verdaderas y citotoxinas en un entorno de prueba in vitro. Sin embargo, debido a las imprecisiones significativas asociadas con este proceso, ha tardado en ganar un apoyo generalizado. [27] Además, los mecanismos bioquímicos se han vuelto más utilizados en las pruebas de neurotoxinas, de modo que los compuestos se pueden analizar para determinar su suficiencia para inducir interferencia en el mecanismo celular, como la inhibición de la capacidad de acetilcolinesterasa de los organofosforados (incluidos el paratión y el gas sarín ). [28] Aunque los métodos para determinar la neurotoxicidad aún requieren un desarrollo significativo, la identificación de compuestos nocivos y síntomas de exposición a toxinas ha experimentado una mejora significativa.
Aplicaciones en neurociencia
Aunque tienen diversas propiedades químicas y funciones, las neurotoxinas comparten la propiedad común de que actúan mediante algún mecanismo que conduce a la interrupción o destrucción de componentes necesarios dentro del sistema nervioso . Sin embargo, las neurotoxinas, por su propio diseño, pueden ser muy útiles en el campo de la neurociencia . Como el sistema nervioso en la mayoría de los organismos es altamente complejo y necesario para la supervivencia, se ha convertido naturalmente en un objetivo de ataque tanto de depredadores como de presas. Como los organismos venenosos a menudo usan sus neurotoxinas para someter a un depredador o presa muy rápidamente, las toxinas han evolucionado para volverse altamente específicas para sus canales objetivo, de modo que la toxina no se une fácilmente a otros objetivos [29] (ver Toxinas del canal iónico ). Como tal, las neurotoxinas proporcionan un medio eficaz por el cual ciertos elementos del sistema nervioso pueden ser atacados de manera precisa y eficiente. Un ejemplo temprano de focalización basada en neurotoxinas utilizó tetrodotoxina radiomarcada para analizar los canales de sodio y obtener mediciones precisas sobre su concentración a lo largo de las membranas nerviosas . [29] Asimismo, a través del aislamiento de ciertas actividades de los canales, las neurotoxinas han proporcionado la capacidad de mejorar el modelo original de Hodgkin-Huxley de la neurona en el que se teorizó que los canales de sodio y potasio genéricos individuales podrían explicar la mayor parte de la función del tejido nervioso. [29] A partir de esta comprensión básica, el uso de compuestos comunes como la tetrodotoxina, el tetraetilamonio y las bungarotoxinas han llevado a una comprensión mucho más profunda de las distintas formas en que las neuronas individuales pueden comportarse.
Mecanismos de actividad
Como las neurotoxinas son compuestos que afectan negativamente al sistema nervioso, varios de los mecanismos a través de los cuales funcionan son la inhibición de los procesos celulares neuronales. Estos procesos inhibidos pueden ir desde mecanismos de despolarización de la membrana hasta la comunicación entre neuronas . Al inhibir la capacidad de las neuronas para realizar sus funciones intracelulares esperadas, o pasar una señal a una célula vecina, las neurotoxinas pueden inducir un paro del sistema nervioso sistémico como en el caso de la toxina botulínica [13] o incluso la muerte del tejido nervioso [30] . El tiempo necesario para la aparición de los síntomas tras la exposición a las neurotoxinas puede variar entre diferentes toxinas, siendo del orden de horas para la toxina botulínica [18] y años para el plomo [31] .
| Clasificación de las neurotoxinas | Neurotoxinas |
|---|---|
| Inhibidores del canal de Na | Tetrodotoxina [6] |
| Inhibidores del canal K | Tetraetilamonio [32] |
| Inhibidores del canal Cl | Clorotoxina , [33] |
| Inhibidores del canal de Ca | Conotoxina [34] |
| Inhibidores de la liberación de vesículas sinápticas | Toxina botulínica , [35] Toxina del tétano [36] |
| Inhibidores de la barrera hematoencefálica | Aluminio , [37] Mercurio [38] |
| Inhibidores/antagonistas de los receptores | Bungarotoxina , [39] Curar [40] |
| Agonistas de los receptores | Anatoxina-a , [41] [42] Caramboxina , [43] 25I-NBOMe , [44] JWH-018 , [45] |
| Interferencia del citoesqueleto | Amoniaco , [46] Arsénico [47] |
| Citotoxicidad mediada por Ca | Plomo [48] |
| Mal plegamiento de proteínas | Proteína tau |
| Efectos múltiples | Etanol , [49] [50] N-Hexano , [51] Metanol [49] [50] |
| Neurotoxinas selectivas de receptores | MPP + |
| Fuentes de neurotoxinas endógenas | Óxido nítrico , [52] Glutamato , [53] Dopamina [54] |
Inhibidores
Canal de sodio
Tetrodotoxin

La tetrodotoxina (TTX) es un veneno producido por organismos pertenecientes al orden Tetraodontiformes , que incluye al pez globo , al pez luna y al pez puercoespín . [55] Dentro del pez globo, la TTX se encuentra en el hígado , las gónadas , los intestinos y la piel . [6] [56] La TTX puede ser fatal si se consume y se ha convertido en una forma común de intoxicación en muchos países. Los síntomas comunes del consumo de TTX incluyen parestesia (a menudo restringida a la boca y las extremidades ), debilidad muscular, náuseas y vómitos [55] y a menudo se manifiestan dentro de los 30 minutos posteriores a la ingestión . [57] El mecanismo principal por el cual la TTX es tóxica es a través de la inhibición de la función del canal de sodio, que reduce la capacidad funcional de la comunicación neuronal. Esta inhibición afecta en gran medida a un subconjunto susceptible de canales de sodio conocidos como sensibles a TTX (TTX-s), que también son en gran parte responsables de la corriente de sodio que impulsa la fase de despolarización de los potenciales de acción neuronal . [6]

El TTX resistente (TTX-r) es otra forma de canal de sodio que tiene una sensibilidad limitada al TTX y se encuentra principalmente en axones de diámetro pequeño , como los que se encuentran en las neuronas nociceptivas . [6] Cuando se ingiere un nivel significativo de TTX, se unirá a los canales de sodio en las neuronas y reducirá la permeabilidad de su membrana al sodio. Esto da como resultado un aumento del umbral efectivo de las señales excitatorias necesarias para inducir un potencial de acción en una neurona postsináptica. [6] El efecto de este aumento del umbral de señalización es una excitabilidad reducida de las neuronas postsinápticas y la posterior pérdida de la función motora y sensorial que puede resultar en parálisis y muerte. Aunque la ventilación asistida puede aumentar la probabilidad de supervivencia después de la exposición al TTX, actualmente no existe ninguna antitoxina. Sin embargo, el uso del inhibidor de la acetilcolinesterasa neostigmina o el antagonista muscarínico de la acetilcolina atropina (que inhibirá la actividad parasimpática) puede aumentar la actividad del nervio simpático lo suficiente como para mejorar la probabilidad de supervivencia después de la exposición al TTX. [55]
Canal de potasio
Tetraetilamonio
El tetraetilamonio (TEA) es un compuesto que, como varias neurotoxinas, se identificó por primera vez por sus efectos dañinos para el sistema nervioso y se demostró que tiene la capacidad de inhibir la función de los nervios motores y, por lo tanto, la contracción de la musculatura de una manera similar a la del curare. [58] Además, a través de la administración crónica de TEA, se induciría atrofia muscular. [58] Más tarde se determinó que el TEA funciona in vivo principalmente a través de su capacidad para inhibir tanto los canales de potasio responsables del rectificador retardado observado en un potencial de acción como cierta población de canales de potasio dependientes del calcio. [32] Es esta capacidad para inhibir el flujo de potasio en las neuronas lo que ha hecho del TEA una de las herramientas más importantes en neurociencia. Se ha planteado la hipótesis de que la capacidad del TEA para inhibir los canales de potasio se deriva de su estructura de llenado de espacio similar a los iones de potasio. [58] Lo que hace que la TEA sea muy útil para los neurocientíficos es su capacidad específica para eliminar la actividad del canal de potasio, lo que permite el estudio de las contribuciones a la respuesta neuronal de otros canales iónicos, como los canales de sodio dependientes del voltaje. [59] Además de sus muchos usos en la investigación en neurociencia, se ha demostrado que la TEA funciona como un tratamiento eficaz de la enfermedad de Parkinson a través de su capacidad para limitar la progresión de la enfermedad. [60]
Canal de cloruro
Clorotoxina
La clorotoxina (Cltx) es el compuesto activo que se encuentra en el veneno del escorpión y es principalmente tóxica debido a su capacidad para inhibir la conductancia de los canales de cloruro . [33] La ingestión de volúmenes letales de Cltx produce parálisis a través de esta interrupción del canal iónico. De manera similar a la toxina botulínica, se ha demostrado que la Cltx posee un valor terapéutico significativo. La evidencia ha demostrado que la Cltx puede inhibir la capacidad de los gliomas de infiltrarse en el tejido nervioso sano del cerebro, lo que reduce significativamente el daño invasivo potencial causado por los tumores. [61] [62]
Canal de calcio
Conotoxin
Las conotoxinas representan una categoría de venenos producidos por el caracol cono marino, y son capaces de inhibir la actividad de una serie de canales iónicos como los canales de calcio, sodio o potasio. [63] [64] En muchos casos, las toxinas liberadas por los diferentes tipos de caracoles cono incluyen una gama de diferentes tipos de conotoxinas, que pueden ser específicas para diferentes canales iónicos, creando así un veneno capaz de interrumpir ampliamente la función nerviosa. [63] Una de las formas únicas de conotoxinas, la ω-conotoxina ( ω-CgTx ) es altamente específica para los canales de Ca y ha demostrado ser útil para aislarlos de un sistema. [65] Como el flujo de calcio es necesario para la excitabilidad adecuada de una célula, cualquier inhibición significativa podría prevenir una gran cantidad de funcionalidad. Significativamente, la ω-CgTx es capaz de unirse a largo plazo e inhibir los canales de calcio dependientes del voltaje ubicados en las membranas de las neuronas pero no en las de las células musculares. [66]
Liberación de vesículas sinápticas
Toxina botulínica

La toxina botulínica (BTX) es un grupo de neurotoxinas que consiste en ocho compuestos distintos, denominados BTX-A, B, C, D, E, F, G, H, que son producidos por la bacteria Clostridium botulinum y provocan parálisis muscular . [67] Una característica notablemente única de la BTX es su uso terapéutico relativamente común en el tratamiento de la distonía y los trastornos de espasticidad , [67] así como en la inducción de atrofia muscular [11] a pesar de ser la sustancia más venenosa conocida. [18] La BTX funciona periféricamente para inhibir la liberación de acetilcolina (ACh) en la unión neuromuscular a través de la degradación de las proteínas SNARE necesarias para la fusión de la vesícula-membrana de ACh . [35] Como la toxina es altamente biológicamente activa, una dosis estimada de 1 μg/kg de peso corporal es suficiente para inducir un volumen corriente insuficiente y la muerte resultante por asfixia . [13] Debido a su alta toxicidad, las antitoxinas BTX han sido un área activa de investigación. Se ha demostrado que la capsaicina (compuesto activo responsable del picor de los chiles ) puede unirse al receptor TRPV1 expresado en las neuronas colinérgicas e inhibir los efectos tóxicos de la BTX. [18]
Toxina del tétano
La neurotoxina tetánica (TeNT) es un compuesto que reduce funcionalmente las transmisiones inhibitorias en el sistema nervioso, lo que resulta en tetania muscular. TeNT es similar a BTX, y de hecho es muy similar en estructura y origen; ambas pertenecen a la misma categoría de neurotoxinas clostridiales . [12] Al igual que BTX, TeNT inhibe la comunicación entre neuronas mediante la liberación de neurotransmisores vesiculares (NT). [36] Una diferencia notable entre los dos compuestos es que mientras que BTX inhibe las contracciones musculares , TeNT las induce. Aunque ambas toxinas inhiben la liberación de vesículas en las sinapsis neuronales, la razón de esta manifestación diferente es que BTX funciona principalmente en el sistema nervioso periférico (SNP) mientras que TeNT es en gran medida activa en el sistema nervioso central (SNC). [68] Esto es el resultado de la migración de TeNT a través de las neuronas motoras a las neuronas inhibidoras de la médula espinal después de ingresar a través de endocitosis . [69] Esto produce una pérdida de función en las neuronas inhibidoras del sistema nervioso central, lo que produce contracciones musculares sistémicas . De manera similar al pronóstico de una dosis letal de BTX, la TeNT provoca parálisis y posterior asfixia . [69]
Barrera hematoencefálica
Aluminio
Se sabe que el comportamiento neurotóxico del aluminio ocurre al ingresar al sistema circulatorio , donde puede migrar al cerebro e inhibir algunas de las funciones cruciales de la barrera hematoencefálica (BHE). [37] Una pérdida de función en la BHE puede producir un daño significativo a las neuronas del SNC, ya que la barrera que protege al cerebro de otras toxinas que se encuentran en la sangre ya no será capaz de tal acción. Aunque se sabe que el metal es neurotóxico, los efectos generalmente se limitan a pacientes incapaces de eliminar el exceso de iones de la sangre, como aquellos que experimentan insuficiencia renal . [70] Los pacientes que experimentan toxicidad por aluminio pueden presentar síntomas como deterioro del aprendizaje y coordinación motora reducida . [71] Además, se sabe que los niveles sistémicos de aluminio aumentan con la edad y se ha demostrado que se correlacionan con la enfermedad de Alzheimer , lo que lo implica como un compuesto neurotóxico causante de la enfermedad. [72] A pesar de su toxicidad conocida en su forma iónica, los estudios están divididos sobre la toxicidad potencial del uso de aluminio en envases y aparatos de cocina.
Mercurio
El mercurio es capaz de inducir daño al sistema nervioso central al migrar al cerebro al cruzar la barrera hematoencefálica. [38] El mercurio existe en varios compuestos diferentes, aunque el metilmercurio (MeHg + ), el dimetilmercurio y el dietilmercurio son las únicas formas significativamente neurotóxicas. El dietilmercurio y el dimetilmercurio se consideran algunas de las neurotoxinas más potentes jamás descubiertas. [38] El MeHg + generalmente se adquiere a través del consumo de mariscos , ya que tiende a concentrarse en organismos que se encuentran en lo alto de la cadena alimentaria. [73] Se sabe que el ion mercúrico inhibe el transporte de aminoácidos (AA) y glutamato (Glu), lo que potencialmente conduce a efectos excitotóxicos. [74]
Agonistas y antagonistas de los receptores
Anatoxina-a
| Videos externos | |
|---|---|
 Factor de muerte muy rápido Factor de muerte muy rápido Universidad de Nottingham |
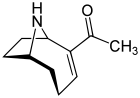
Las investigaciones sobre la anatoxina -a , también conocida como "factor de muerte muy rápida", comenzaron en 1961 tras la muerte de vacas que bebieron de un lago que contenía una floración de algas en Saskatchewan, Canadá. [41] [42] Es una cianotoxina producida por al menos cuatro géneros diferentes de cianobacterias , y se ha informado en América del Norte, Europa, África, Asia y Nueva Zelanda. [75]
Los efectos tóxicos de la anatoxina -a progresan muy rápidamente porque actúa directamente sobre las células nerviosas ( neuronas ). Los síntomas progresivos de la exposición a la anatoxina -a son pérdida de coordinación, espasmos , convulsiones y muerte rápida por parálisis respiratoria . Los tejidos nerviosos que se comunican con los músculos contienen un receptor llamado receptor nicotínico de acetilcolina . La estimulación de estos receptores provoca una contracción muscular . La molécula de anatoxina -a tiene una forma que se adapta a este receptor y, de esta manera, imita el neurotransmisor natural que normalmente utiliza el receptor, la acetilcolina . Una vez que ha desencadenado una contracción, la anatoxina- a no permite que las neuronas regresen a su estado de reposo, porque no es degradada por la colinesterasa que normalmente realiza esta función. Como resultado, las células musculares se contraen permanentemente, la comunicación entre el cerebro y los músculos se interrumpe y la respiración se detiene. [76] [77]
Cuando se descubrió por primera vez, la toxina se denominó Factor de Muerte Muy Rápida (VFDF, por sus siglas en inglés) porque cuando se inyectaba en la cavidad corporal de ratones inducía temblores, parálisis y muerte en unos pocos minutos. En 1977, se determinó la estructura del VFDF como un alcaloide de amina bicíclica secundaria , y se le cambió el nombre anatoxina -a . [78] [79] Estructuralmente, es similar a la cocaína. [80] Existe un interés continuo en la anatoxina -a debido a los peligros que presenta para las aguas recreativas y potables, y porque es una molécula particularmente útil para investigar los receptores de acetilcolina en el sistema nervioso. [81] La letalidad de la toxina significa que tiene un alto potencial militar como arma toxínica. [82]
Bungarotoxin
La bungarotoxina es un compuesto con interacción conocida con los receptores nicotínicos de acetilcolina (nAChR), que constituyen una familia de canales iónicos cuya actividad se desencadena por la unión de neurotransmisores. [83] La bungarotoxina se produce en varias formas diferentes, aunque una de las formas comúnmente utilizadas es la forma alfa de cadena larga, α-bungarotoxina , que se aísla de la serpiente krait bandeada . [39] Aunque extremadamente tóxica si se ingiere, la α-bungarotoxina ha demostrado una amplia utilidad en neurociencia, ya que es particularmente hábil para aislar nAChR debido a su alta afinidad con los receptores. [39] Como hay múltiples formas de bungarotoxina, hay diferentes formas de nAChR a las que se unirán, y la α-bungarotoxina es particularmente específica para α7-nAChR . [84] Este α7-nAChR funciona para permitir la entrada de iones de calcio a las células y, por lo tanto, cuando se bloquea por la ingestión de bungarotoxina, producirá efectos dañinos, ya que se inhibirá la señalización de ACh. [84] Asimismo, el uso de α-bungarotoxina puede ser muy útil en neurociencia si se desea bloquear el flujo de calcio para aislar los efectos de otros canales. Además, diferentes formas de bungarotoxina pueden ser útiles para estudiar los nAChR inhibidos y su flujo de iones de calcio resultante en diferentes sistemas del cuerpo. Por ejemplo, la α-bungarotoxina es específica para los nAChR que se encuentran en la musculatura y la κ-bungarotoxina es específica para los nAChR que se encuentran en las neuronas. [85]
Caramboxina
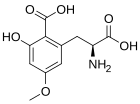
La caramboxina (CBX) es una toxina que se encuentra en la carambola ( Averrhoa carambola) . Las personas con algunos tipos de enfermedad renal son susceptibles a efectos neurológicos adversos, incluyendo intoxicación, convulsiones e incluso la muerte después de comer carambola o beber jugo hecho de esta fruta. La caramboxina es una nueva toxina de aminoácidos no peptídicos que estimula los receptores de glutamato en las neuronas. La caramboxina es un agonista de los receptores ionotrópicos glutamatérgicos NMDA y AMPA con potentes propiedades excitatorias, convulsivas y neurodegenerativas. [43]
Curare
El término " curare " es ambiguo porque se ha utilizado para describir una serie de venenos que en el momento de su denominación se entendían de forma diferente a la comprensión actual. En el pasado, la caracterización ha significado venenos utilizados por tribus sudamericanas en flechas o dardos , aunque ha madurado para especificar una categorización específica de venenos que actúan sobre la unión neuromuscular para inhibir la señalización y, por lo tanto, inducir la relajación muscular. [86] La categoría de neurotoxina contiene una serie de venenos distintos, aunque todos se purificaron originalmente a partir de plantas originarias de América del Sur. [86] El efecto con el que generalmente se asocia el veneno de curare inyectado es la parálisis muscular y la muerte resultante. [87] El curare funciona notablemente para inhibir los receptores nicotínicos de acetilcolina en la unión neuromuscular . Normalmente, estos canales receptores permiten que los iones de sodio ingresen a las células musculares para iniciar un potencial de acción que conduce a la contracción muscular. Al bloquear los receptores, la neurotoxina es capaz de reducir significativamente la señalización de la unión neuromuscular, un efecto que ha dado lugar a su uso por parte de los anestesiólogos para producir relajación muscular. [88]
Interferencia del citoesqueleto
Amoníaco

La toxicidad del amoníaco se observa a menudo a través de dos vías de administración, ya sea a través del consumo o a través de enfermedades endógenas como la insuficiencia hepática . [89] [90] Un caso notable en el que la toxicidad del amoníaco es común es en respuesta a la cirrosis del hígado que resulta en encefalopatía hepática y puede resultar en edema cerebral (Haussinger 2006). Este edema cerebral puede ser el resultado de la remodelación de las células nerviosas. Como consecuencia del aumento de las concentraciones, se ha demostrado que la actividad del amoníaco in vivo induce la hinchazón de los astrocitos en el cerebro a través del aumento de la producción de cGMP (monofosfato de guanosina cíclico) dentro de las células, lo que conduce a modificaciones del citoesqueleto mediadas por la proteína quinasa G (PKG). [46] El efecto resultante de esta toxicidad puede ser la reducción del metabolismo y la función energética del cerebro. Es importante destacar que los efectos tóxicos del amoníaco en la remodelación de los astrocitos se pueden reducir mediante la administración de L-carnitina . [89] Esta remodelación de los astrocitos parece estar mediada por la transición de la permeabilidad mitocondrial inducida por el amoníaco . Esta transición mitocondrial es un resultado directo de la actividad de la glutamina , un compuesto que se forma a partir del amoníaco in vivo. [91] La administración de antioxidantes o inhibidores de la glutaminasa puede reducir esta transición mitocondrial y, potencialmente, también la remodelación de los astrocitos. [91]
Arsénico
El arsénico es una neurotoxina que se encuentra comúnmente concentrada en áreas expuestas a escorrentías agrícolas , minería y sitios de fundición (Martínez-Finley 2011). Uno de los efectos de la ingestión de arsénico durante el desarrollo del sistema nervioso es la inhibición del crecimiento de las neuritas [92] que puede ocurrir tanto en el SNP como en el SNC. [93] Esta inhibición del crecimiento de las neuritas a menudo puede conducir a defectos en la migración neuronal y cambios morfológicos significativos de las neuronas durante el desarrollo , [94] ) que a menudo conducen a defectos del tubo neural en neonatos . [95] Como metabolito del arsénico, el arsenito se forma después de la ingestión de arsénico y ha demostrado una toxicidad significativa para las neuronas dentro de aproximadamente 24 horas de exposición. El mecanismo de esta citotoxicidad funciona a través de aumentos inducidos por arsenito en los niveles de iones de calcio intracelulares dentro de las neuronas, lo que posteriormente puede reducir el potencial transmembrana mitocondrial que activa las caspasas , desencadenando la muerte celular. [94] Otra función conocida del arsenito es su naturaleza destructiva hacia el citoesqueleto a través de la inhibición del transporte de neurofilamentos . [47] Esto es particularmente destructivo ya que los neurofilamentos se utilizan en la estructura y el soporte celular básico. Sin embargo, la administración de litio ha demostrado ser prometedora en la restauración de parte de la motilidad perdida de los neurofilamentos. [96] Además, de manera similar a otros tratamientos con neurotoxinas, la administración de ciertos antioxidantes ha demostrado ser prometedora en la reducción de la neurotoxicidad del arsénico ingerido. [94]
Citotoxicidad mediada por calcio
Dirigir

El plomo es una potente neurotoxina cuya toxicidad ha sido reconocida por al menos miles de años. [97] Aunque los efectos neurotóxicos del plomo se encuentran tanto en adultos como en niños pequeños , el cerebro en desarrollo es particularmente susceptible al daño inducido por el plomo, efectos que pueden incluir apoptosis y excitotoxicidad. [97] Un mecanismo subyacente por el cual el plomo puede causar daño es su capacidad de ser transportado por bombas de ATPasa de calcio a través de la BHE, lo que permite el contacto directo con las células frágiles dentro del sistema nervioso central. [98] La neurotoxicidad resulta de la capacidad del plomo de actuar de manera similar a los iones de calcio, ya que el plomo concentrado conducirá a la absorción celular de calcio que altera la homeostasis celular e induce apoptosis. [48] Es este aumento de calcio intracelular el que activa la proteína quinasa C (PKC), que se manifiesta como déficits de aprendizaje en los niños como resultado de la exposición temprana al plomo. [48] Además de inducir apoptosis, el plomo inhibe la señalización interneuronal a través de la interrupción de la liberación de neurotransmisores mediada por calcio. [99]
Neurotoxinas con efectos múltiples
Etanol

Como neurotoxina, se ha demostrado que el etanol induce daño al sistema nervioso y afecta al cuerpo de diversas maneras. Entre los efectos conocidos de la exposición al etanol se encuentran consecuencias tanto transitorias como duraderas. Algunos de los efectos duraderos incluyen neurogénesis reducida a largo plazo en el hipocampo , [100] [101] atrofia cerebral generalizada, [102] e inflamación inducida en el cerebro. [103] Cabe destacar que, además, se ha demostrado que la ingestión crónica de etanol induce la reorganización de los componentes de la membrana celular, lo que lleva a una bicapa lipídica marcada por mayores concentraciones de colesterol y grasas saturadas en la membrana . [50] Esto es importante ya que el transporte de neurotransmisores puede verse afectado a través de la inhibición del transporte vesicular, lo que resulta en una disminución de la función de la red neuronal. Un ejemplo significativo de comunicación interneuronal reducida es la capacidad del etanol para inhibir los receptores NMDA en el hipocampo, lo que resulta en una potenciación a largo plazo (LTP) y adquisición de memoria reducidas. [49] Se ha demostrado que NMDA juega un papel importante en la LTP y, en consecuencia, en la formación de la memoria. [104] Sin embargo, con la ingesta crónica de etanol, la susceptibilidad de estos receptores NMDA para inducir LTP aumenta en las neuronas dopaminérgicas mesolímbicas de una manera dependiente del inositol 1,4,5-trifosfato (IP3). [105] Esta reorganización puede conducir a citotoxicidad neuronal tanto a través de la hiperactivación de las neuronas postsinápticas como a través de la adicción inducida al consumo continuo de etanol. Además, se ha demostrado que el etanol reduce directamente la acumulación intracelular de iones de calcio a través de la actividad inhibida del receptor NMDA y, por lo tanto, reduce la capacidad para la aparición de LTP. [106]
Además de los efectos neurotóxicos del etanol en organismos maduros, la ingestión crónica es capaz de inducir graves defectos de desarrollo. En 1973 se demostró por primera vez una conexión entre la ingesta crónica de etanol por parte de las madres y los defectos en su descendencia. [107] Este trabajo fue responsable de crear la clasificación del síndrome de alcoholismo fetal , una enfermedad caracterizada por aberraciones morfogénicas comunes como defectos en la formación craneofacial , el desarrollo de las extremidades y la formación cardiovascular . Se ha demostrado que la magnitud de la neurotoxicidad del etanol en los fetos que conduce al síndrome de alcoholismo fetal depende de los niveles de antioxidantes en el cerebro , como la vitamina E. [108] Como el cerebro fetal es relativamente frágil y susceptible al estrés inducido, se pueden observar efectos nocivos graves de la exposición al alcohol en áreas importantes como el hipocampo y el cerebelo . La gravedad de estos efectos depende directamente de la cantidad y frecuencia del consumo de etanol por parte de la madre y de la etapa de desarrollo del feto. [109] Se sabe que la exposición al etanol produce niveles reducidos de antioxidantes, disfunción mitocondrial (Chu 2007) y posterior muerte neuronal, aparentemente como resultado de una mayor generación de especies oxidativas reactivas (ROS). [30] Este es un mecanismo plausible, ya que hay una presencia reducida en el cerebro fetal de enzimas antioxidantes como la catalasa y la peroxidasa . [110] En apoyo de este mecanismo, la administración de altos niveles de vitamina E en la dieta produce efectos neurotóxicos inducidos por el etanol reducidos o eliminados en los fetos. [8]
n-Hexano
El n- hexano es una neurotoxina que ha sido responsable del envenenamiento de varios trabajadores en fábricas de productos electrónicos chinas en los últimos años. [111] [112] [113] [51]
Neurotoxinas selectivas de receptores
Miembro del Parlamento+
MPP + , el metabolito tóxico del MPTP , es una neurotoxina selectiva que interfiere con la fosforilación oxidativa en las mitocondrias al inhibir el complejo I , lo que conduce al agotamiento de ATP y la posterior muerte celular. Esto ocurre casi exclusivamente en las neuronas dopaminérgicas de la sustancia negra , lo que resulta en la presentación de parkinsonismo permanente en los sujetos expuestos 2-3 días después de la administración.
Fuentes de neurotoxinas endógenas
A diferencia de la mayoría de las fuentes comunes de neurotoxinas que el cuerpo adquiere a través de la ingestión, las neurotoxinas endógenas se originan y ejercen sus efectos in vivo . Además, aunque la mayoría de los venenos y las neurotoxinas exógenas rara vez poseen capacidades útiles in vivo, las neurotoxinas endógenas son comúnmente utilizadas por el cuerpo de formas útiles y saludables, como el óxido nítrico que se utiliza en la comunicación celular. [114] A menudo, solo cuando estos compuestos endógenos se vuelven altamente concentrados es que conducen a efectos peligrosos. [9]
Óxido nítrico
Aunque el óxido nítrico (NO) es comúnmente utilizado por el sistema nervioso en la comunicación y señalización entre neuronas, puede ser activo en mecanismos que conducen a la isquemia en el cerebro (Iadecola 1998). La neurotoxicidad del NO se basa en su importancia en la excitotoxicidad del glutamato, ya que el NO se genera de una manera dependiente del calcio en respuesta a la activación de NMDA mediada por glutamato, que ocurre a una tasa elevada en la excitotoxicidad del glutamato. [52] Aunque el NO facilita el aumento del flujo sanguíneo a las regiones potencialmente isquémicas del cerebro, también es capaz de aumentar el estrés oxidativo , [115] induciendo daño al ADN y apoptosis. [116] Por lo tanto, una mayor presencia de NO en un área isquémica del SNC puede producir efectos significativamente tóxicos.
Glutamato
El glutamato , al igual que el óxido nítrico, es un compuesto producido endógenamente que las neuronas utilizan para funcionar con normalidad y que está presente en pequeñas concentraciones en toda la materia gris del sistema nervioso central. [9] Uno de los usos más notables del glutamato endógeno es su funcionalidad como neurotransmisor excitatorio. [53] Sin embargo, cuando se concentra, el glutamato se vuelve tóxico para las neuronas circundantes. Esta toxicidad puede ser tanto el resultado de la letalidad directa del glutamato en las neuronas como el resultado del flujo de calcio inducido en las neuronas que conduce a la hinchazón y la necrosis. [53] Se ha demostrado que estos mecanismos desempeñan un papel importante en enfermedades y complicaciones como la enfermedad de Huntington , la epilepsia y los accidentes cerebrovasculares . [9]
Véase también
- Toxina 1 del Babycurus
- Cangitoxin
- Encefalopatía crónica inducida por disolventes
- Fertilizante
- Herbicida
- Pesticidas
- Solvente
- Encefalopatía tóxica
Notas
- ^ Sivonen, K (1999). "Toxinas producidas por cianobacterias". Vesitalous . 5 : 11–18.
- ^ Gobierno escocés Algas verdeazuladas (cianobacterias) en aguas continentales: evaluación y control de riesgos para la salud pública. Consultado el 15 de diciembre de 2011.
- ^ Diccionario médico de Dorland para consumidores de salud
- ^ por Spencer 2000
- ^ por Olney 2002
- ^ abcdefgh Kiernan 2005
- ^ Lidsky 2003
- ^ abc Heaton; Barrow, Marieta; Mitchell, J. Jean; Paiva, Michael (2000). "Mejora de la neurotoxicidad inducida por etanol en el sistema nervioso central de ratas neonatales mediante terapia antioxidante". Alcoholismo: investigación clínica y experimental . 24 (4): 512–18. doi :10.1111/j.1530-0277.2000.tb02019.x. PMID 10798588.
- ^ abcd Choi 1987
- ^ Zhang 1994
- ^ ab Rosales, Raymond L.; Arimura, Kimiyoshi; Takenaga, Satoshi; Osame, Mitsuhiro (1996). "Efectos musculares extrafusales e intrafusales en la inyección experimental de toxina botulínica A". Músculo y nervio . 19 (4): 488–96. doi :10.1002/(sici)1097-4598(199604)19:4<488::aid-mus9>3.0.co;2-8. PMID 8622728. S2CID 20849034.
- ^Por Simpson 1986
- ^ abc Arnón 2001
- ^ Dikranian 2001
- ^ Deng 2003
- ^ Jevtovic-Todorovic 2003
- ^ Nadler 1978
- ^ abcd Thyagarajan 2009
- ^ Neurotoxinas: definición, epidemiología, etiología
- ^ Hodge 2002
- ^Por Dobbs 2009
- ^ abc Widmaier, Eric P., Hershel Raff, Kevin T. Strang y Arthur J. Vander (2008) Fisiología humana de Vander: los mecanismos de la función corporal. Boston: McGraw-Hill Higher Education.
- ^ Desde Martini 2009
- ^ de Costa 2011
- ^ Harry 1998
- ^ Gartlon 2006
- ^ Radio, Nicholas M.; Mundy, William R. (2008). "Pruebas de neurotoxicidad del desarrollo in vitro: modelos para evaluar los efectos químicos en el crecimiento de las neuritas". Neurotoxicología . 29 (3): 361–376. doi :10.1016/j.neuro.2008.02.011. PMID 18403021.
- ^ Lotti 2005
- ^abc Adams 2003
- ^ por Brocardo 2011
- ^ Lewendon 2001
- ^ desde Haghdoost-Yazdi 2011
- ^ por DeBin 1993
- ^ McClesky 1987
- ^ ab García-Rodríguez 2011
- ^ por Williamson 1996
- ^ de Bancos 1988
- ^abc Aschner 1990
- ^abc Dutertre 2006
- ^ Coller 1988
- ^Por Carmichael 1978
- ^Por Carmichael 1975
- ^ ab García-Cairasco, N.; Moysés-Neto, M.; Del Vecchio, F.; Oliveira, JAC; Dos Santos, Florida; Castro, OW; Arisi, gerente general; Dantas, señor; Carolina, ROG; Coutinho-Netto, J.; Dagostin, ALA; Rodríguez, MCA; León, RM; Quintiliano, SAP; Silva, LF; Gobbo-Neto, L.; Lopes, NP (2013). "Aclarar la neurotoxicidad de la carambola". Edición internacional Angewandte Chemie . 52 (49): 13067–13070. doi :10.1002/anie.201305382. PMID 24281890.
- ^ Rutgrere 2012
- ^ Rodillo 1994
- ^ de Konopacka 2009
- ^ de DeFuria 2006
- ^abc Bressler 1999
- ^ abc Lovinger, D.; White, G.; Weight, F. (1989). "El etanol inhibe la corriente iónica activada por NMDA en las neuronas del hipocampo". Science . 243 (4899): 1721–724. Bibcode :1989Sci...243.1721L. doi :10.1126/science.2467382. PMID 2467382.
- ^ abc Leonard, BE (1986). "¿Es el etanol una neurotoxina?: los efectos del etanol en la estructura y función neuronal". Alcohol y alcoholismo . 21 (4): 325–38. doi :10.1093/oxfordjournals.alcalc.a044638. PMID 2434114.
- ^ ab Directriz de seguridad y salud ocupacional para n-hexano Archivado el 18 de diciembre de 2011 en Wayback Machine , OSHA.gov
- ^ por Garthwaite 1988
- ^abc Choi 1990
- ^ Ben-Shachar D, Zuk R, Glinka Y (1995). "Neurotoxicidad de la dopamina: inhibición de la respiración mitocondrial". J. Neurochem . 64 (2): 718–23. doi :10.1046/j.1471-4159.1995.64020718.x. PMID 7830065. S2CID 9060404.
- ^ abc Chowdhury, FR; Ahasan, HA M. Nazmul; Rashid, AK M. Mamunur; Mamun, A. Al; Khaliduzzaman, SM (2007). "Intoxicación por tetrodotoxina: un análisis clínico, papel de la neostigmina y resultado a corto plazo de 53 casos". Revista Médica de Singapur . 48 (9): 830–33. PMID 17728964.
- ^ Ahasán 2004
- ^ Lau 1995
- ^ abc Standfield 1983
- ^ Roed 1989
- ^ Haghdoost-Yasdi 2011
- ^ Deshane 2003
- ^ Soroceanu 1998
- ^ por Jacob 2010
- ^ Olivera 1987
- ^ Cruz 1986
- ^ McCleskey 1987
- ^ ab Brin, Mitchell F (1997) "Toxina botulínica: química, farmacología, toxicidad e inmunología". Muscle & Nerve, 20 (S6): 146–68.
- ^ Montecucco 1986
- ^Por Pirazzini 2011
- ^ Rey 1981
- ^ Rabe 1982
- ^ Walton 2006
- ^ Chan 2011
- ^ Brookes 1988
- ^ Yang 2007
- ^ Madera 2007
- ^ Centro Nacional de Evaluación Ambiental
- ^ Devlin 1977
- ^ Moore 1977
- ^ Metcalf 2009
- ^ Stewart 2008
- ^ Dixit 2005
- ^ Tsetlin 2003
- ^ por Liu 2008
- ^ Hue 2007
- ^ por Bisset 1992
- ^ Schlesinger 1946
- ^ Griffith, Harold R.; Johnson, G. Enid (1942). "El uso de curare en anestesia general". Anestesiología . 3 (4): 418–420. doi : 10.1097/00000542-194207000-00006 . S2CID 71400545.
- ^ de Matsuoka 1991
- ^ Buzanska (2000)
- ^ por Norenberg 2004
- ^ Liu 2009 [ cita completa necesaria ]
- ^ Vahidnia 2007
- ^abc Rocha 2011
- ^ Brender 2005
- ^ DeFuria 2007
- ^ por Lidskey 2003
- ^ Bradbury 1993
- ^ Lasley 1999
- ^ Taffe 2010
- ^ Morris 2009
- ^ Bleich 2003
- ^ Blanco 2005
- ^ Davis 1992
- ^ Bernier 2011
- ^ Takadera 1990
- ^ Jones 1973
- ^ Mitchell 1999
- ^ Gil-Mohapel 2010
- ^ Bergamini 2004
- ^ Trabajadores envenenados mientras fabricaban iPhones ABC News, 25 de octubre de 2010
- ^ Secretos sucios Archivado el 25 de mayo de 2017 en Wayback Machine. Corresponsal extranjero de ABC, 26 de octubre de 2010
- ^ El señor Daisey y la fábrica de manzanas, This American Life, 6 de enero de 2012
- ^ Iadecola 1998
- ^ Beckman 1990
- ^ Bonfoco 1995
Referencias
- Adams, Michael E.; Olivera, Baldomero M. (1994). "Neurotoxinas: descripción general de una tecnología de investigación emergente". Tendencias en neurociencias . 17 (4): 151–55. doi :10.1016/0166-2236(94)90092-2. PMID 7517594. S2CID 3984106.
- Arnon, Stephen S.; Schechter, Robert; Inglesby, Thomas V.; Henderson, Donald A.; Bartlett, John G.; Ascher, Michael S.; Eitzen, Edward; Fine, Anne D.; Hauer, Jerome; Layton, Marcelle; Lillibridge, Scott; Osterholm, Michael T.; O'Toole, Tara; Parker, Gerald; Perl, Trish M.; Russell, Philip K.; Swerdlow, David L.; Tonat, Kevin (2001). "La toxina botulínica como arma biológica". Revista de la Asociación Médica Estadounidense . 285 (8): 1059–069. doi :10.1001/jama.285.8.1059. PMID 11209178.
- Aschner, M.; Aschner, J. (1990). "Neurotoxicidad del mercurio: mecanismos de transporte a través de la barrera hematoencefálica". Neuroscience & Biobehavioral Reviews . 14 (2): 169–76. doi :10.1016/s0149-7634(05)80217-9. PMID 2190116. S2CID 8777931.
- Banks, William A.; Kastin, Abba J. (1989). "Neurotoxicidad inducida por aluminio: alteraciones en la función de la membrana en la barrera hematoencefálica". Neuroscience & Biobehavioral Reviews . 13 (1): 47–53. doi :10.1016/s0149-7634(89)80051-x. PMID 2671833. S2CID 46507895.
- Baum-Baicker, Cynthia (1985). "Los beneficios para la salud del consumo moderado de alcohol: una revisión de la literatura". Dependencia de drogas y alcohol . 15 (3): 207–27. doi :10.1016/0376-8716(85)90001-8. PMID 4028954.
- Beckman, JS (1990). "Producción aparente de radicales hidroxilo por peroxinitrito: implicaciones para la lesión endotelial causada por óxido nítrico y superóxido". Actas de la Academia Nacional de Ciencias . 87 (4): 1620–624. Bibcode :1990PNAS...87.1620B. doi : 10.1073/pnas.87.4.1620 . PMC 53527 . PMID 2154753.
- Bergamini, Carlo M.; Gambetti, Stefani; Dondi, Alessia; Cervellati, Carlo (2004). "Oxígeno, especies reactivas de oxígeno y daño tisular". Current Pharmaceutical Design . 10 (14): 1611–626. doi :10.2174/1381612043384664. PMID 15134560.
- Bernier Brian E., Whitaker Leslie R., Morikawa Hitoshi (2011). "La experiencia previa con etanol mejora la plasticidad sináptica de los receptores NMDA en el área tegmental ventral". The Journal of Neuroscience . 31 (14): 5305–212. doi :10.1523/JNEUROSCI.5282-10.2011. PMC 3086894 . PMID 21471355.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - Bisset, Norman G (1992). "Venenos de guerra y caza del Nuevo Mundo. Parte 1. Notas sobre la historia temprana del curare". Revista de Etnofarmacología . 36 (1): 1–26. doi :10.1016/0378-8741(92)90056-w. PMID 1501489.
- Blanco, Ana M.; Valles, Soraya L.; Pascual, Maria; Guerri, Consuelo (2005). "Participación de la señalización del receptor TLR4/IL-1 tipo I en la inducción de mediadores inflamatorios y muerte celular inducida por etanol en astrocitos cultivados". The Journal of Immunology . 175 (10): 6893–899. doi : 10.4049/jimmunol.175.10.6893 . PMID 16272348.
- Bleich, S (2003). "Hiperhomocisteinemia como un nuevo factor de riesgo de encogimiento cerebral en pacientes con alcoholismo". Neuroscience Letters . 335 (3): 179–82. doi :10.1016/s0304-3940(02)01194-1. PMID 12531462. S2CID 33032529.
- Bonfoco E (1995). "Apoptosis y necrosis: dos eventos distintos inducidos, respectivamente, por agresiones leves e intensas con N-metil-D-aspartato u óxido nítrico/superóxido en cultivos de células corticales". Actas de la Academia Nacional de Ciencias . 92 (16): 7162–166. Bibcode :1995PNAS...92.7162B. doi : 10.1073/pnas.92.16.7162 . PMC 41299 . PMID 7638161.
- Bradbury, MW; Deane, R (1993). "Permeabilidad de la barrera hematoencefálica al plomo. [Revisión]". Neurotoxicología . 14 (2–3): 131–6. PMID 8247388.
- Brender, J.; Suarez, L.; Felkner, M.; Gilani, Z.; Stinchcomb, D.; Moody, K.; Henry, J.; Hendricks, K. (2006). "Exposición materna a arsénico, cadmio, plomo y mercurio y defectos del tubo neural en la descendencia". Environmental Research . 101 (1): 132–39. Bibcode :2006ER....101..132B. doi :10.1016/j.envres.2005.08.003. PMID 16171797.
- Bressler, J; Kim, KA; Chakraborti, T; Goldstein, G (1999). "Mecanismos moleculares de la neurotoxicidad del plomo. [Revisión]". Neurochem Res . 24 (4): 595–600. doi :10.1023/A:1022596115897. PMID 10227691. S2CID 3017703.
- Brocardo, Patricia S.; Gil-Mohapel, Joana; Christie, Brian R. (2011). "El papel del estrés oxidativo en los trastornos del espectro alcohólico fetal". Brain Research Reviews . 67 (1–2): 209–25. doi :10.1016/j.brainresrev.2011.02.001. PMID 21315761. S2CID 1213492.
- Brookes, N (1988). "Especificidad y reversibilidad de la inhibición por HgCl del transporte de glutamato en cultivos de astrocitos". Journal of Neurochemistry . 50 (4): 1117–122. doi :10.1111/j.1471-4159.1988.tb10581.x. PMID 2894409. S2CID 27522735.
- Buzanska, L.; Zablocka, B.; Dybel, A.; Domanska-Janik, K.; Albrecht, J. (2000). "Inducción retardada de la apoptosis por amoníaco en células de glioma C6". Neurochemistry International . 37 (2–3): 287–97. doi :10.1016/s0197-0186(00)00030-9. PMID 10812214. S2CID 33351533.
- Carmichael WW, Biggs DF, Gorham PR (1975). "Toxicología y acción farmacológica de la toxina de Anabaena flos-aquae". Science . 187 (4176): 542–544. Bibcode :1975Sci...187..542C. doi :10.1126/science.803708. PMID 803708.
- Carmichael WW, Gorham PR (1978). "Anatoxinas de clones de Anabaena flos-aquae aislados de lagos del oeste de Canadá". Mitt. Infernal. Verein. Limnol . 21 : 285–295.
- Chan, HM (2011) "Mercurio en el pescado: riesgos para la salud humana". Enciclopedia de salud ambiental : 697–704.
- Choi, D (1988). "Neurotoxicidad mediada por calcio: relación con tipos de canales específicos y papel en el daño isquémico". Tendencias en neurociencias . 11 (10): 465–69. doi :10.1016/0166-2236(88)90200-7. PMID 2469166. S2CID 36909560.
- Choi, DW; Rothman, SM (1990). "El papel de la neurotoxicidad del glutamato en la muerte neuronal hipóxico-isquémica". Revista Anual de Neurociencia . 13 (1): 171–82. doi :10.1146/annurev.neuro.13.1.171. PMID 1970230.
- Choi, Dennis W (1987). "Dependencia iónica de la neurotoxicidad del glutamato". Revista de neurociencia . 7 (2): 369–79. doi : 10.1523/JNEUROSCI.07-02-00369.1987 . PMC 6568907 . PMID 2880938.
- Choi, Dennis W.; Maulucci-Gedde, Margaret; Kriegstein, Arnold R. (1987). "Neurotoxicidad del glutamato en cultivos de células corticales". The Journal of Neuroscience . 7 (2): 357–68. doi : 10.1523/JNEUROSCI.07-02-00357.1987 . PMC 6568898 . PMID 2880937.
- Chu, Jennifer; Tong, Ming; Monte, Suzanne M. (2007). "La exposición crónica al etanol provoca disfunción mitocondrial y estrés oxidativo en neuronas inmaduras del sistema nervioso central". Acta Neuropathologica . 113 (6): 659–73. doi :10.1007/s00401-007-0199-4. PMID 17431646. S2CID 25418731.
- Clancy, Barbara; Finlay, Barbara L.; Darlington, Richard B.; Anand, KJS (2007). "Extrapolación del desarrollo cerebral de especies experimentales a humanos". Neurotoxicología . 28 (5): 931–37. doi :10.1016/j.neuro.2007.01.014. PMC 2077812 . PMID 17368774.
- Costa, Lucio G., Gennaro Giordano y Marina Guizzetti (2011) Neurotoxicología in vitro: métodos y protocolos. Nueva York: Humana.
- Coyle, Joseph T.; Schwarcz, Robert (1976). "La lesión de las neuronas estriatales con ácido kainico proporciona un modelo para la corea de Huntington". Nature . 246 (5574): 244–46. Bibcode :1976Natur.263..244C. doi :10.1038/263244a0. PMID 8731. S2CID 4271762.
- Cruz, Lourdes J.; Olivera, Baldomero M. (1987). "Los antagonistas de los canales de calcio ω-conotoxina definen un nuevo sitio de alta afinidad". The Journal of Biological Chemistry . 14 (261): 6230–233.
- Davis, S.; Butcher, SP; Morris, R. (1992). "El antagonista del receptor NMDA D-2-amino-5fosfonopentanoato (D-AP5) altera el aprendizaje espacial y la LTP in vivo en concentraciones intracerebrales comparables a las que bloquean la LTP in vitro". The Journal of Neuroscience . 12 (1): 21–34. doi : 10.1523/JNEUROSCI.12-01-00021.1992 . PMC 6575679 . PMID 1345945.
- Dawson, VL (1991). "El óxido nítrico media la neurotoxicidad del glutamato en cultivos corticales primarios". Actas de la Academia Nacional de Ciencias . 88 (14): 6368–371. Bibcode :1991PNAS...88.6368D. doi : 10.1073/pnas.88.14.6368 . PMC 52084 . PMID 1648740.
- Debin, John A., John E. Maggio y Gary R. Strichartz (1993) "Purificación y caracterización de la clorotoxina, un ligando del canal de cloruro del veneno del escorpión". The American Physiological Society , págs. 361–69.
- DeFuria, Jason; Shea, Thomas B. (2007). "El arsénico inhibe el transporte de neurofilamentos e induce la acumulación pericarial de neurofilamentos fosforilados: funciones de JNK y GSK-3β". Brain Research . 1181 : 74–82. doi :10.1016/j.brainres.2007.04.019. PMID 17961518. S2CID 37068398.
- Defuria, Jason (2006) "La neurotoxina ambiental arsénico altera la dinámica de los neurofilamentos por sobreactivación de la quinasa terminal C-JUN: papel potencial en la esclerosis lateral amiotrófica". UMI , págs. 1–16.
- Deng Wenbin, Poretz Ronald D (2003). "Oligodendroglia en la neurotoxicidad del desarrollo". Neurotoxicología . 24 (2): 161–78. doi :10.1016/s0161-813x(02)00196-1. PMID 12606289.
- Deshane, Jessy; Garner, Craig C.; Sontheimer, Harald (2003). "La clorotoxina inhibe la invasión de células de glioma a través de la metaloproteinasa de matriz-2". The Journal of Biological Chemistry . 278 (6): 4135–144. doi : 10.1074/jbc.m205662200 . PMID 12454020.
- Devlin JP, Edwards OE, Gorham PR, Hunter NR, Pike RK, Stavric B (1977). "Anatoxina-a, un alcaloide tóxico de Anabaena flos-aquae NRC-44h". Can. J. Chem . 55 (8): 1367–1371. doi : 10.1139/v77-189 .
- Dikranian, K (2001). "Apoptosis en el prosencéfalo de mamíferos in vivo". Neurobiología de la enfermedad . 8 (3): 359–79. doi :10.1006/nbdi.2001.0411. PMID 11447994. S2CID 21965033.
- Dixit A, Dhaked RK, Alam SI, Singh L (2005). "Potencial militar de las neurotoxinas biológicas". Toxin Reviews . 24 (2): 175–207. doi :10.1081/TXR-200057850. S2CID 85651107.
- Dobbs, Michael R (2009) Neurotoxicología clínica. Filadelfia: Saunders-Elsevier.
- Dutertre, S.; Lewis, R. (2006). "Información sobre toxinas en los receptores nicotínicos de acetilcolina". Farmacología bioquímica . 72 (6): 661–70. doi :10.1016/j.bcp.2006.03.027. PMID 16716265.
- García-Rodríguez, C.; Geren, IN; Lou, J.; Conrad, F.; Forsyth, C.; Wen, W.; Chakraborti, S.; Zao, H.; Manzanarez, G.; Smith, TJ; Brown, J.; Tepp, WH; Liu, N.; Wijesuriya, S.; Tomic, MT; Johnson, EA; Smith, LA; Marks, JD (2011). "Respuesta a: 'Anticuerpos monoclonales humanos neutralizantes que se unen a múltiples serotipos de la neurotoxina botulínica' por García-Rodríguez et al., PEDS, 2011;24:321–331". Diseño e ingeniería de proteínas . 24 (9): 633–34. doi :10.1093/protein/gzr012.
- Garthwaite, John; Charles, Sarah L.; Chess-Williams, Russel (1988). "La liberación de factor relajante derivado del endotelio en la activación de los receptores NMDA sugiere un papel como mensajero intercelular en el cerebro". Nature . 336 (24): 385–88. Bibcode :1988Natur.336..385G. doi :10.1038/336385a0. PMID 2904125. S2CID 4361381.
- Gartlon, J.; Kinsner, A.; Balprice, A.; Coecke, S.; Clothier, R. (2006). "Evaluación de una estrategia de prueba in vitro propuesta utilizando sistemas celulares neuronales y no neuronales para detectar neurotoxicidad". Toxicology in Vitro . 20 (8): 1569–581. doi :10.1016/j.tiv.2006.07.009. PMID 16959468.
- Gil-Mohapel, Joana; Boehme, Fanny; Kainer, Leah; Christie, Brian R. (2010). "Pérdida de células hipocampales y neurogénesis después de la exposición fetal al alcohol: perspectivas de diferentes modelos de roedores". Brain Research Reviews . 64 (2): 283–303. doi :10.1016/j.brainresrev.2010.04.011. PMID 20471420. S2CID 10159395.
- Haghdoost-Yazdi, Hashem; Faraji, Ayda; Fraidouni, Negin; Movahedi, Mohadeseh; Hadibeygi, Elham; Vaezi, Fatemeh (2011). "Efectos significativos de la 4-aminopiridina y el tetraetilamonio en el tratamiento de la enfermedad de Parkinson inducida por 6-hidroxidopamina". Behavioural Brain Research . 223 (1): 70–74. doi :10.1016/j.bbr.2011.04.021. PMID 21540059. S2CID 7100177.
- Harry, GJ; Billingsley, Melvin; Bruinink, Arendd; Campbell, Iain L.; Classen, Werner; Dorman, David C.; Galli, Corrado; Ray, David; Smith, Robert A.; Tilson, Hugh A. (1998). "Técnicas in vitro para la evaluación de la neurotoxicidad". Environmental Health Perspectives . 106 (Supl 1): 131–58. doi :10.2307/3433917. JSTOR 3433917. PMC 1533280 . PMID 9539010.
- Häussinger, Dieter (2006). "Edema cerebral de bajo grado y patogenia de la encefalopatía hepática en la cirrosis". Hepatología . 43 (6): 1187–190. doi : 10.1002/hep.21235 . PMID 16729329.
- Hensley, K (1994). "Un modelo para la agregación de β-amiloide y la neurotoxicidad basado en la generación de radicales libres por el péptido: relevancia para la enfermedad de Alzheimer". Actas de la Academia Nacional de Ciencias . 91 (8): 3270–274. Bibcode :1994PNAS...91.3270H. doi : 10.1073/pnas.91.8.3270 . PMC 43558 . PMID 8159737.
- Herbert, MR (2006) "Autismo y genómica ambiental". Neurotoxicología , págs. 671–84. Web.
- Hodge, A. Trevor (2002) Acueductos romanos y suministro de agua . Londres: Duckworth.
- How, C (2003). "Intoxicación por tetrodotoxina". Revista estadounidense de medicina de urgencias . 21 (1): 51–54. doi :10.1053/ajem.2003.50008. PMID 12563582.
- Hue, Bernard; Buckingham, Steven D.; Buckingham, David; Sattelle, David B. (2007). "Acciones de las neurotoxinas de serpientes en una sinapsis colinérgica nicotínica de insectos". Neurociencia de invertebrados . 7 (3): 173–78. doi :10.1007/s10158-007-0053-3. PMID 17710455. S2CID 31599093.
- Iadecola Constantino (1997). "Lados brillantes y oscuros del óxido nítrico en la lesión cerebral isquémica". Tendencias en neurociencias . 20 (3): 132–39. doi :10.1016/s0166-2236(96)10074-6. PMID 9061868. S2CID 45011034.
- Jacob, Reed B.; McDougal, Owen M. (2010). "La superfamilia M de las conotoxinas: una revisión". Ciencias de la vida celular y molecular . 67 (1): 17–27. doi :10.1007/s00018-009-0125-0. PMC 3741454 . PMID 19705062.
- Jevtovic-Todorovic, Vesna; Hartman, Richard E.; Izumi, Yukitoshi; Benshoff, Nicholas D.; Dikranian, Krikor; Zorumski, Charles F.; Olney, John W.; Wozniak, David F. (2003). "La exposición temprana a agentes anestésicos comunes causa neurodegeneración generalizada en el cerebro de ratas en desarrollo y déficits de aprendizaje persistentes". The Journal of Neuroscience . 23 (3): 876–82. doi : 10.1523/JNEUROSCI.23-03-00876.2003 . PMC 6741934 . PMID 12574416.
- Jones, K (1973). "Patrón de malformación en hijos de madres alcohólicas crónicas". The Lancet . 301 (7815): 1267–271. doi :10.1016/s0140-6736(73)91291-9. PMID 4126070.
- Kiernan, Matthew C.; Isbister, Geoffrey K.; Cindy; Lin, S.-Y.; Burke, David; Bostock, Hugh (2005). "Neurotoxicidad aguda inducida por tetrodotoxina después de la ingestión de pez globo". Anales de neurología . 57 (3): 339–48. doi :10.1002/ana.20395. PMID 15732107. S2CID 40455149.
- King, Steven W.; Savory, John; Wills, Michael R.; Gitelman, HJ (1981). "La bioquímica clínica del aluminio". Critical Reviews in Clinical Laboratory Sciences . 14 (1): 1–20. doi :10.3109/10408368109105861. PMID 7016437.
- Konopacka, Agnieszka; Konopacki, Filip A.; Albrecht, Jan (2009). "La proteína quinasa G está implicada en la hinchazón de los astrocitos inducida por amoníaco". Journal of Neurochemistry . 109 : 246–51. doi :10.1111/j.1471-4159.2009.05802.x. PMID 19393034. S2CID 42719321.
- Lafon-Cazal, Mireille; Pietri, Sylvia; Culcasi, Marcel; Bockaert, Joel (1993). "Producción de superóxido dependiente de NMDA y neurotoxicidad". Nature . 364 (6437): 535–37. Bibcode :1993Natur.364..535L. doi :10.1038/364535a0. PMID 7687749. S2CID 4246917.
- Lasley, SM; Green, MC; Gilbert, ME (1999). "Influencia del período de exposición en la liberación de glutamato y GABA en el hipocampo in vivo en ratas expuestas crónicamente al plomo". Neurotoxicología . 20 (4): 619–29. PMID 10499360.
- Lau, FL; Wong, CK; Yip, SH (1995). "Intoxicación por pez globo". Revista de Medicina de Emergencia . 12 (3): 214–15. doi :10.1136/emj.12.3.214. PMC 1342486 . PMID 8581253.
- Lewendon, G.; Kinra, S.; Nelder, R.; Cronin, T. (2001). "¿Deberían los niños con problemas de desarrollo y comportamiento ser sometidos a pruebas de detección de plomo de forma rutinaria?". Archives of Disease in Childhood . 85 (4): 286–88. doi :10.1136/adc.85.4.286. PMC 1718950 . PMID 11567935.
- Lidsky Theodore I (2003). "Neurotoxicidad por plomo en niños: mecanismos básicos y correlatos clínicos". Brain . 126 (1): 5–19. doi : 10.1093/brain/awg014 . PMID 12477693.
- Liu, Kuang Kai; Chen, Mei-Fang; Chen, Po-Yi; Lee, Tony JF.; Cheng, Chia-Liang; Chang, Chia-Ching; Ho, Yen-Peng; Jui-I, Chao (2008). "Unión de alfa-bungarotoxina a la célula objetivo en un sistema visual en desarrollo mediante nanodiamantes carboxilados". Nanotecnología . 19 (20): 205102. Código bibliográfico : 2008Nanot..19t5102L. doi :10.1088/0957-4484/19/20/205102. PMID 21825732. S2CID 1260143.
- Liu, Yuan; McDermott, Suzanne; Lawson, Andrew; Aelion, C. Marjorie (2010). "La relación entre el retraso mental y los retrasos del desarrollo en los niños y los niveles de arsénico, mercurio y plomo en muestras de suelo tomadas cerca de la residencia de su madre durante el embarazo". Revista internacional de higiene y salud ambiental . 213 (2): 116–23. doi :10.1016/j.ijheh.2009.12.004. PMC 2836425 . PMID 20045663.
- Lorenzo, A (1994). "La neurotoxicidad de la β-amiloide requiere la formación de fibrillas y es inhibida por el rojo Congo". Actas de la Academia Nacional de Ciencias . 91 (25): 12243–2247. Bibcode :1994PNAS...9112243L. doi : 10.1073/pnas.91.25.12243 . PMC 45413 . PMID 7991613.
- Lotti, Marcello y Angelo Moretto (1989) "Polineuropatía retardada inducida por organofosforados". Toxicological Reviews, 24 (1) (2005): 37–49.
- Martinez-Finley, Ebany J.; Goggin, Samantha L.; Labrecque, Matthew T.; Allan, Andrea M. (2011). "Expresión reducida de los genes MAPK/ERK en la descendencia expuesta al arsénico perinatal inducida por déficits del receptor de glucocorticoides". Neurotoxicología y teratología . 33 (5): 530–37. doi :10.1016/j.ntt.2011.07.003. PMC 3183307 . PMID 21784148.
- Martini, Frederic, Michael J. Timmons y Robert B. Tallitsch (2009) Anatomía humana. San Francisco: Pearson/Benjamin Cummings.
- Matsuoka, Masato; Igisu, Hideki; Kohriyama, Kazuaki; Inoue, Naohide (1991). "Supresión de la neurotoxicidad del amoníaco por L-carnitina". Investigación del cerebro . 567 (2): 328–31. doi :10.1016/0006-8993(91)90814-c. PMID 1817738. S2CID 10250413.
- McCleskey, EW (1987). "Omega-conotoxina: bloqueo directo y persistente de tipos específicos de canales de calcio en neuronas pero no en músculos". Actas de la Academia Nacional de Ciencias . 84 (12): 4327–331. Bibcode :1987PNAS...84.4327M. doi : 10.1073/pnas.84.12.4327 . PMC 305078 . PMID 2438698.
- Meldrum, B.; Garthwaite, J. (1990). "Neurotoxicidad de aminoácidos excitatorios y enfermedad neurodegenerativa". Tendencias en ciencias farmacológicas . 11 (9): 379–87. doi :10.1016/0165-6147(90)90184-a. PMID 2238094.
- Metcalf, James S.; Codd, Geoffrey A. (2009). "Cianobacterias, neurotoxinas y recursos hídricos: ¿Existen implicaciones para las enfermedades neurodegenerativas humanas?". Esclerosis lateral amiotrófica . 10 : 74–78. doi :10.3109/17482960903272942. PMID 19929737. S2CID 41880444.
- Mitchell, J. Jean; Paiva, Michael; Barrow Heaton, Marieta (1999). "Los antioxidantes vitamina E y β-caroteno protegen contra la neurotoxicidad inducida por etanol en cultivos de hipocampo embrionario de rata". Alcohol . 17 (2): 163–68. doi :10.1016/s0741-8329(98)00051-2. PMID 10064385.
- Moore RE (1977). "Toxinas de las algas verdeazuladas". BioScience . 27 (12): 797–802. doi :10.2307/1297756. JSTOR 1297756.
- Montecucco C (1986). "¿Cómo se unen las toxinas tetánica y botulínica a las membranas neuronales?". Tendencias en ciencias bioquímicas . 11 (8): 314–17. doi :10.1016/0968-0004(86)90282-3.
- Morris, Stephanie A., David W. Eaves, Aleksander R. Smith y Kimberly Nixon (2009) "Inhibición de la neurogénesis por el alcohol: un mecanismo de neurodegeneración hipocampal en un modelo de abuso de alcohol en adolescentes". Hipocampo: NA.
- Nadler; Victor, J.; Perry, Bruce W.; Cotman, Carl W. (1978). "El ácido kaínico intraventricular destruye preferentemente las células piramidales del hipocampo". Nature . 271 (5646): 676–77. Bibcode :1978Natur.271..676N. doi :10.1038/271676a0. PMID 625338. S2CID 4267990.
- Centro Nacional de Evaluación Ambiental (2006) "Revisiones toxicológicas de toxinas cianobacterianas: Anatoxina-a" NCEA-C-1743
- Norenberg, MD; Rao, KV Rama; Jayakumar, AR (2004). "Neurotoxicidad del amoniaco y la transición de la permeabilidad mitocondrial". Revista de bioenergética y biomembranas . 36 (4): 303–07. doi :10.1023/b:jobb.0000041758.20071.19. PMID 15377862. S2CID 39221153.
- Olivera, Baldomero M.; Cruz, Lourdes J.; De Santos, Victoria; LeCheminant, Garth; Griffin, David; Zeikus, Regina; McIntosh, J. Michael; Galyean, Robert; Varga, Janos (1987). "Antagonistas de los canales de calcio neuronales. Discriminación entre subtipos de canales de calcio utilizando .omega.-conotoxina del veneno de Conus Magus". Bioquímica . 26 (8): 2086–090. doi :10.1021/bi00382a004. PMID 2441741.
- Olney, John W (2002). "Nuevos conocimientos y nuevos problemas en neurotoxicología del desarrollo". Neurotoxicología . 23 (6): 659–68. doi :10.1016/s0161-813x(01)00092-4. PMID 12520755.
- Pirazzini, Marco, Ornella Rossetto, Paolo Bolognese, Clifford C. Shone y Cesare Montecucco (2011) "El doble anclaje a la membrana y el enlace disulfuro intacto entre cadenas son necesarios para la entrada inducida por un pH bajo de las neurotoxinas del tétanos y la botulicidad en las neuronas". Microbiología celular: No. Impreso.
- Rabe, Ausma; He Lee, Moon; Shek, Judy; Wisniewski, Henryk M. (1982). "Déficit de aprendizaje en conejos inmaduros con cambios neurofibrilares inducidos por aluminio". Neurología experimental . 76 (2): 441–46. doi :10.1016/0014-4886(82)90220-5. PMID 6896495. S2CID 7495252.
- Rocha, RA; Gimeno-Alcaniz, JV; Martín-Ibanez, Raymond; Canals, JM; Vélez, D.; Devesa, V. (2011). "El arsénico y el flúor inducen la apoptosis de las células progenitoras neuronales". Toxicology Letters . 203 (3): 237–44. doi :10.1016/j.toxlet.2011.03.023. PMID 21439358.
- Roed, A (1989). "Los efectos del tetraetilamonio durante la estimulación espasmódica y tetánica del diafragma del nervio frénico en ratas". Neurofarmacología . 28 (6): 585–92. doi :10.1016/0028-3908(89)90137-8. PMID 2547180. S2CID 1916154.
- Rothman, S.; Thurston, J.; Hauhart, R. (1987). "Neurotoxicidad retardada de aminoácidos excitatorios in vitro". Neurociencia . 22 (2): 471–80. doi :10.1016/0306-4522(87)90347-2. PMID 3670595. S2CID 6038419.
- Schlesinger, Edward B (1946). "Curare: una revisión de sus efectos terapéuticos y su base fisiológica". Revista Americana de Medicina . 1 (5): 518–30. doi :10.1016/0002-9343(46)90073-3. PMID 21001466.
- Siebler, M.; Koller, H.; Schmalenbach, C.; Muller, H. (1988). "Las corrientes de cloruro activadas por GABA en neuronas de la región septal e hipocampal de ratas cultivadas pueden ser inhibidas por curare y atropina". Neuroscience Letters . 93 (2–3): 220–24. doi :10.1016/0304-3940(88)90085-7. PMID 2468110. S2CID 10645685.
- Simpson, LL (1986). "Farmacología molecular de la toxina botulínica y la toxina tetánica". Revisión anual de farmacología y toxicología . 26 (1): 427–53. doi :10.1146/annurev.pharmtox.26.1.427. PMID 3521461.
- Soroceanu, Liliana; Gillespie, Yancey; Khazaeli, MB; Sontheimer, Harold (1998). "Uso de clorotoxina para la focalización de tumores cerebrales primarios". Cancer Research . 58 (21): 4871–879. PMID 9809993.
- Spencer PS, Schaumburg HH, Ludolph AC (Eds) (2000) Neurotoxicología experimental y clínica. Oxford University Press, Oxford, págs. 1310.
- Stanfield, Peter R (1983). "Iones de tetraetilamonio y permeabilidad al potasio de las células excitables". Reseñas de fisiología, bioquímica y farmacología . 97 : 1–49. doi :10.1007/bfb0035345. ISBN . 978-3-540-11701-8. PMID 6306751.
- Stewart I, Seawright AA, Shaw GR (2008). "Intoxicación por cianobacterias en ganado, mamíferos salvajes y aves: una descripción general" (PDF) . Floraciones algales nocivas causadas por cianobacterias: estado de la ciencia y necesidades de investigación . Avances en medicina y biología experimental. Vol. 619. págs. 613–637. doi :10.1007/978-0-387-75865-7_28. ISBN 978-0-387-75864-0. Número de identificación personal 18461786.
- Taffe, MA; Kotzebue, RW; Crean, RD; Crawford, EF; Edwards, S.; Mandyam, CD (2010). "De la portada: Reducción duradera de la neurogénesis hipocampal por el consumo de alcohol en primates no humanos adolescentes". Actas de la Academia Nacional de Ciencias . 107 (24): 11104–1109. Bibcode :2010PNAS..10711104T. doi : 10.1073/pnas.0912810107 . PMC 2890755 . PMID 20534463.
- Takadera, Tsuneo; Suzuki, Risa; Mohri, Tetsuro (1990). "La protección de las neuronas corticales por el etanol frente a la neurotoxicidad inducida por N-metil-d-aspartato se asocia con el bloqueo de la entrada de calcio". Brain Research . 537 (1–2): 109–14. doi :10.1016/0006-8993(90)90346-d. PMID 1982237. S2CID 22160700.
- Thyagarajan, B.; Krivitskaya, N.; Potian, JG; Hognason, K.; Garcia, CC; McArdle, JJ (2009). "La capsaicina protege las uniones neuromusculares de ratones de los efectos neuroparalíticos de la neurotoxina botulínica A". Journal of Pharmacology and Experimental Therapeutics . 331 (2): 361–71. doi :10.1124/jpet.109.156901. PMC 2775269 . PMID 19654265.
- Tymianski, Michael; Charlton, Milton P.; Carlen, Peter L.; Tator, Charles H. (2003). "Especificidad de la fuente de neurotoxicidad temprana del calcio en neuronas espinales embrionarias cultivadas". The Journal of Neuroscience . 13 (5): 2095–104. doi :10.1523/JNEUROSCI.13-05-02085.1993. PMC 6576557 . PMID 8097530.
- Tsetlin, VI; Hucho, F. (2004). "Toxinas de serpientes y caracoles que actúan sobre los receptores nicotínicos de acetilcolina: aspectos fundamentales y aplicaciones médicas". FEBS Letters . 557 (1–3): 9–13. doi :10.1016/s0014-5793(03)01454-6. PMID 14741333.
- USEPA (Agencia de Protección Ambiental de los Estados Unidos) (1998) Health Effects Test Guidelines. OPPTS 870.6200. Batería de pruebas de neurotoxicidad. Washington DC, USEPA.
- Vahidnia, A., GB Van Der Voet y FA De Wolff (2007) "Neurotoxicidad por arsénico: una revisión". Toxicología humana y experimental, 26 (10): 823–32.
- Walton, J (2006). "Aluminio en neuronas hipocampales de humanos con enfermedad de Alzheimer". Neurotoxicología . 27 (3): 385–94. doi :10.1016/j.neuro.2005.11.007. PMID 16458972.
- Widmaier, Eric P., Hershel Raff, Kevin T. Strang y Arthur J. Vander (2008) Fisiología humana de Vander: los mecanismos de la función corporal. Boston: McGraw-Hill Higher Education.
- Williamson, Lura C.; Halpern, Jane L.; Montecucco, Cesare; Brown, JE; Neale, Elaine A. (1996). "Neurotoxinas clostridiales y proteólisis del sustrato en neuronas intactas". The Journal of Biological Chemistry . 271 (13): 7694–699. doi : 10.1074/jbc.271.13.7694 . PMID 8631808.
- Wood SA; Rasmussen JP; Holland PT; Campbell R.; Crowe ALM (2007). "Primer informe de la cianotoxina Anatoxina-A de Aphanizomenon issatschenkoi (cianobacteria)". Revista de fisiología . 43 (2): 356–365. doi :10.1111/j.1529-8817.2007.00318.x. S2CID 84284928.
- Yamada, Kiyofumi; Tanaka, Tomoko; Han, Daiken; Senzaki, Kouji; Kameyama, Tsutomu; Nabeshima, Toshitaka (1999). "Efectos protectores de la idebenona y el α-tocoferol sobre los déficits de aprendizaje y memoria inducidos por β-amiloide-(1–42) en ratas: implicación del estrés oxidativo en la neurotoxicidad inducida por β-amiloide in vivo". Revista Europea de Neurociencia . 11 (1): 83–90. doi :10.1046/j.1460-9568.1999.00408.x. PMID 9987013. S2CID 84408095.
- Yan; Du, Shi; Chen, Xi; Fu, Jin; Chen, Ming; Zhu, Huaijie; Roher, Alex; Slattery, Timothy; Zhao, Lei; Nagashima, Mariko; Morser, John; Migheli, Antonio; Nawroth, Peter; Stern, David; Marie Schmidt, Ann (1996). "RAGE y neurotoxicidad del péptido amiloide-β en la enfermedad de Alzheimer". Nature . 382 (6593): 685–91. Bibcode :1996Natur.382..685Y. doi :10.1038/382685a0. PMID 8751438. S2CID 4372023.
- Yang, X (2007) Presencia de la neurotoxina cianobacteriana, anatoxina-a, en aguas del estado de Nueva York [ enlace muerto permanente ] ProQuest. ISBN 978-0-549-35451-2 .
- Zhang, J.; Dawson, V.; Dawson, T.; Snyder, S. (1994). "Activación de la poli(ADP-ribosa) sintetasa por óxido nítrico en neurotoxicidad". Science . 263 (5147): 687–89. Bibcode :1994Sci...263..687Z. doi :10.1126/science.8080500. PMID 8080500.
Lectura adicional
- Libro sobre datos sobre el cerebro de la Sociedad de Neurociencia
- Textos de neurociencia en la Facultad de Medicina de la Universidad de Texas
- Neurotoxicología in vitro: una introducción en Springerlink
- Biología del receptor NMDA en NCBI
- Avances en la neurociencia de la adicción, 2.ª edición en NCBI
Enlaces externos
- Agencia de Protección Ambiental de la Agencia de Protección Ambiental de los Estados Unidos
- Alcohol y alcoholismo en Oxford Medical Journal
- Neurotoxicología en revistas de Elsevier
- Instituto de Neurotoxinas en el Instituto de Neurotoxinas
- Neurotoxinas en Toxipedia

