Sustancia negra
| Sustancia negra | |
|---|---|
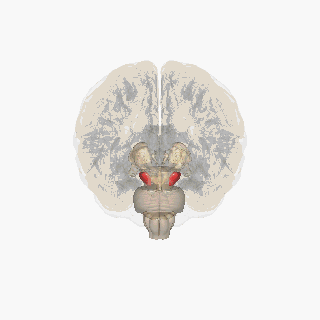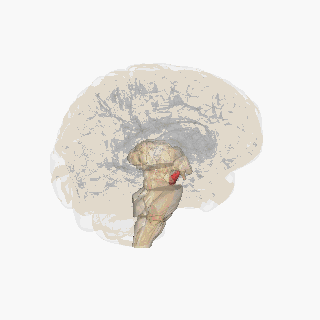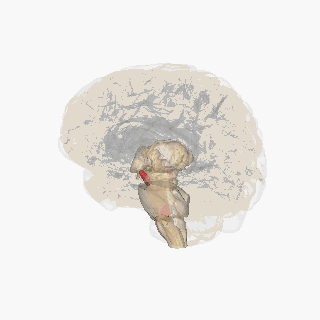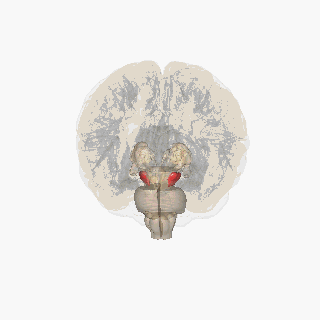 Sustancia negra resaltada en rojo. | |
 Sección del colículo superior que muestra la sustancia negra. | |
| Detalles | |
| Parte de | Mesencéfalo , ganglios basales |
| Identificadores | |
| latín | sustancia negra |
| Acrónimo(s) | SN |
| Malla | D013378 |
| Nombres neuronales | 536 |
| Identificación de NeuroLex | birnlex_789 |
| TA98 | A14.1.06.111 |
| TA2 | 5881 |
| FMA | 67947 |
| Términos anatómicos de neuroanatomía [editar en Wikidata] | |
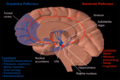
La sustancia negra ( SN ) es una estructura de los ganglios basales ubicada en el mesencéfalo que desempeña un papel importante en la recompensa y el movimiento . Substantia nigra es la palabra latina para "sustancia negra", lo que refleja el hecho de que partes de la sustancia negra parecen más oscuras que las áreas vecinas debido a los altos niveles de neuromelanina en las neuronas dopaminérgicas . [1] La enfermedad de Parkinson se caracteriza por la pérdida de neuronas dopaminérgicas en la pars compacta de la sustancia negra . [2]
Aunque la sustancia negra aparece como una banda continua en secciones del cerebro, estudios anatómicos han descubierto que en realidad consta de dos partes con conexiones y funciones muy diferentes: la pars compacta (SNpc) y la pars reticulata (SNpr). La pars compacta sirve principalmente como una proyección hacia el circuito de los ganglios basales, suministrando dopamina al cuerpo estriado . La pars reticulata transmite señales desde los ganglios basales a numerosas otras estructuras cerebrales. [3]
Estructura
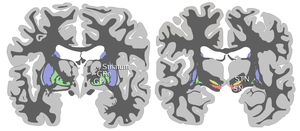

La sustancia negra, junto con otros cuatro núcleos, forma parte de los ganglios basales . Es el núcleo más grande del mesencéfalo y se encuentra dorsal a los pedúnculos cerebrales . Los humanos tenemos dos sustancias negras, una a cada lado de la línea media.
La SN se divide en dos partes: la pars reticulata (SNpr) y la pars compacta (SNpc), que se encuentra medial a la pars reticulata. A veces se menciona una tercera región, la pars lateralis, aunque generalmente se clasifica como parte de la pars reticulata. La (SNpr) y el globo pálido interno (GPi) están separados por la cápsula interna . [4]
Pars reticulata
La pars reticulata tiene un fuerte parecido estructural y funcional con la parte interna del globo pálido. A veces se considera que ambas son partes de la misma estructura, separadas por la sustancia blanca de la cápsula interna. Al igual que las del globo pálido, las neuronas de la pars reticulata son principalmente GABAérgicas . [5] [6]
Conexiones aferentes
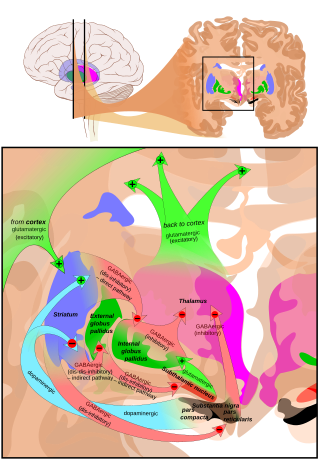
La entrada principal a la SNpr se deriva del cuerpo estriado . Viene por dos rutas, conocidas como vías directa e indirecta . La vía directa consiste en axones de células espinosas medianas en el cuerpo estriado que se proyectan directamente a la pars reticulata. La vía indirecta consiste en tres enlaces: una proyección de las células espinosas medianas del cuerpo estriado a la parte externa del globo pálido ; una proyección GABAérgica del globo pálido al núcleo subtalámico , y una proyección glutamatérgica del núcleo subtalámico a la pars reticulata. [6] [7] [ mejor fuente necesaria ] Por lo tanto, la actividad estriatal a través de la vía directa ejerce un efecto inhibidor sobre las neuronas en el (SNpr) pero un efecto excitador a través de la vía indirecta. Las vías directa e indirecta se originan a partir de diferentes subconjuntos de células espinosas medianas del cuerpo estriado: están estrechamente entremezcladas, pero expresan diferentes tipos de receptores de dopamina, además de mostrar otras diferencias neuroquímicas.
Conexiones eferentes
Se producen proyecciones significativas hacia el tálamo (núcleos ventral lateral y ventral anterior), el colículo superior y otros núcleos caudales desde la pars reticulata (la vía nigrotalámica), [8] que utilizan GABA como neurotransmisor. Además, estas neuronas forman hasta cinco colaterales que se ramifican tanto dentro de la pars compacta como de la pars reticulata, probablemente modulando la actividad dopaminérgica en la pars compacta. [9]
Función
La sustancia negra es un actor importante en la función cerebral, en particular, en el movimiento ocular , la planificación motora , la búsqueda de recompensas , el aprendizaje y la adicción . Muchos de los efectos de la sustancia negra están mediados por el cuerpo estriado . La entrada dopaminérgica nigral al cuerpo estriado a través de la vía nigroestriatal está íntimamente relacionada con la función del cuerpo estriado. [10] La codependencia entre el cuerpo estriado y la sustancia negra se puede ver de esta manera: cuando la sustancia negra es estimulada eléctricamente, no se produce ningún movimiento; sin embargo, los síntomas de degeneración nigral debido al Parkinson son un ejemplo conmovedor de la influencia de la sustancia negra en el movimiento. Además de las funciones mediadas por el cuerpo estriado, la sustancia negra también sirve como una fuente importante de inhibición GABAérgica para varios objetivos cerebrales.
Pars reticulata
La pars reticulata de la sustancia negra es un importante centro de procesamiento en los ganglios basales. Las neuronas GABAérgicas de la pars reticulata transmiten las señales procesadas finales de los ganglios basales al tálamo y al colículo superior . Además, la pars reticulata también inhibe la actividad dopaminérgica en la pars compacta a través de colaterales axónicas, aunque la organización funcional de estas conexiones sigue sin estar clara.
Las neuronas GABAérgicas de la pars reticulata disparan espontáneamente potenciales de acción . En ratas, la frecuencia de los potenciales de acción es de aproximadamente 25 Hz. [11] El propósito de estos potenciales de acción espontáneos es inhibir los objetivos de los ganglios basales, y las disminuciones en la inhibición están asociadas con el movimiento. [12] El núcleo subtalámico proporciona una entrada excitatoria que modula la tasa de disparo de estos potenciales de acción espontáneos. Sin embargo, la lesión del núcleo subtalámico conduce a solo una disminución del 20% en la tasa de disparo de la pars reticulata, lo que sugiere que la generación de potenciales de acción en la pars reticulata es en gran medida autónoma, [13] como lo ejemplifica el papel de la pars reticulata en el movimiento ocular sacádico . Un grupo de neuronas GABAérgicas de la pars reticulata se proyecta al colículo superior, exhibiendo un alto nivel de actividad inhibitoria sostenida. [14] Las proyecciones del núcleo caudado al colículo superior también modulan el movimiento ocular sacádico. En la enfermedad de Parkinson [15] y la epilepsia se encuentran patrones alterados de activación de la pars reticulata, como la activación en picos únicos o en ráfagas . [16]
Parte compacta
La función más destacada de la pars compacta es el control motor , [17] aunque el papel de la sustancia negra en el control motor es indirecto; la estimulación eléctrica de la sustancia negra no produce movimiento, debido a la mediación del cuerpo estriado en la influencia nigral del movimiento. La pars compacta envía una entrada excitatoria al cuerpo estriado a través de la vía D1 que excita y activa el cuerpo estriado, lo que da como resultado la liberación de GABA en el globo pálido para inhibir sus efectos inhibidores en el núcleo talámico. Esto hace que las vías talamocorticales se exciten y transmitan señales de neuronas motoras a la corteza cerebral para permitir el inicio del movimiento, que está ausente en la enfermedad de Parkinson. Sin embargo, la falta de neuronas de la pars compacta tiene una gran influencia en el movimiento, como lo evidencian los síntomas de Parkinson. El papel motor de la pars compacta puede involucrar el control motor fino, como se ha confirmado en modelos animales con lesiones en esa región. [18]
La pars compacta está muy involucrada en las respuestas aprendidas a los estímulos. En los primates, la actividad de las neuronas dopaminérgicas aumenta en la vía nigroestriatal cuando se presenta un nuevo estímulo. [19] La actividad dopaminérgica disminuye con la presentación repetida de estímulos. [19] Sin embargo, la presentación de estímulos conductualmente significativos (es decir, recompensas) continúa activando neuronas dopaminérgicas en la pars compacta de la sustancia negra. Las proyecciones dopaminérgicas desde el área tegmental ventral (parte inferior del "mesencéfalo" o mesencéfalo) a la corteza prefrontal (vía mesocortical) y al núcleo accumbens (vía mesolímbica - "meso" se refiere a "desde el mesencéfalo"... específicamente el área tegmental ventral ) están implicadas en la recompensa, el placer y la conducta adictiva. La pars compacta también es importante en el aprendizaje espacial, las observaciones sobre el entorno y la ubicación en el espacio. Las lesiones en la pars compacta provocan déficits de aprendizaje en la repetición de movimientos idénticos, [20] y algunos estudios apuntan a su participación en un sistema de memoria basado en la respuesta y dependiente del estriato dorsal que funciona de forma relativamente independiente del hipocampo , que tradicionalmente se cree que sirve para funciones de memoria espacial o de tipo episódico . [21]
La pars compacta también desempeña un papel en el procesamiento temporal y se activa durante la reproducción del tiempo. Las lesiones en la pars compacta conducen a déficits temporales. [22] Últimamente, se ha sospechado que la pars compacta regula el ciclo sueño-vigilia, [23] lo que es consistente con síntomas como el insomnio y las alteraciones del sueño REM que informan los pacientes con enfermedad de Parkinson . Aun así, los déficits parciales de dopamina que no afectan el control motor pueden conducir a alteraciones en el ciclo sueño-vigilia, especialmente patrones similares al REM de actividad neuronal durante la vigilia, especialmente en el hipocampo . [24]
Importancia clínica
La sustancia negra es fundamental para el desarrollo de muchas enfermedades y síndromes, entre ellos el parkinsonismo y la enfermedad de Parkinson . Existe un estudio que demuestra que la aplicación de estimulación de alta frecuencia a la sustancia negra izquierda puede inducir síntomas transitorios de depresión aguda. [25]
Enfermedad de Parkinson
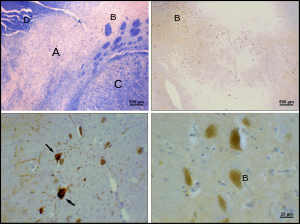
La enfermedad de Parkinson es una enfermedad neurodegenerativa caracterizada, en parte, por la muerte de neuronas dopaminérgicas en la SNpc. Los principales síntomas de la enfermedad de Parkinson incluyen temblor , acinesia , bradicinesia y rigidez. [26] Otros síntomas incluyen alteraciones de la postura, fatiga , anomalías del sueño y estado de ánimo deprimido . [27]
Se desconoce la causa de la muerte de las neuronas dopaminérgicas en la SNpc. Sin embargo, se han identificado algunas contribuciones a la susceptibilidad única de las neuronas dopaminérgicas en la pars compacta. Por un lado, las neuronas dopaminérgicas muestran anomalías en el complejo mitocondrial 1 , lo que provoca la agregación de alfa-sinucleína ; esto puede dar lugar a un manejo anormal de las proteínas y la muerte de las neuronas. [28] En segundo lugar, las neuronas dopaminérgicas en la pars compacta contienen menos calbindina que otras neuronas dopaminérgicas. [29] La calbindina es una proteína implicada en el transporte de iones de calcio dentro de las células, y el exceso de calcio en las células es tóxico. La teoría de la calbindina explicaría la alta citotoxicidad del Parkinson en la sustancia negra en comparación con el área tegmental ventral. Independientemente de la causa de la muerte neuronal, la plasticidad de la pars compacta es muy robusta; los síntomas parkinsonianos no aparecen generalmente hasta que al menos el 30% de las neuronas dopaminérgicas de la pars compacta han muerto. [30] La mayor parte de esta plasticidad ocurre a nivel neuroquímico; los sistemas de transporte de dopamina se ralentizan, lo que permite que la dopamina permanezca durante períodos más largos en las sinapsis químicas del cuerpo estriado. [31]
Menke, Jbabdi, Miller, Matthews y Zari (2010) utilizaron imágenes de tensor de difusión, así como mapeo T1 para evaluar las diferencias volumétricas en la SNpc y la SNpr, en participantes con Parkinson en comparación con individuos sanos. Estos investigadores encontraron que los participantes con Parkinson tenían consistentemente una sustancia negra más pequeña, específicamente en la SNpr. Debido a que la SNpr está conectada al tálamo posterior, al tálamo ventral y específicamente a la corteza motora, y debido a que los participantes con enfermedad de Parkinson reportan tener una SNprs más pequeña (Menke, Jbabdi, Miller, Matthews y Zari, 2010), el pequeño volumen de esta región puede ser responsable de las deficiencias motoras encontradas en pacientes con enfermedad de Parkinson. Este pequeño volumen puede ser responsable de movimientos motores más débiles y/o menos controlados, lo que puede resultar en los temblores que a menudo experimentan aquellos con Parkinson. [32]
El estrés oxidativo y el daño oxidativo en la SNpc son probablemente impulsores clave en la etiología de la enfermedad de Parkinson a medida que las personas envejecen. [33] Los daños del ADN causados por el estrés oxidativo pueden repararse mediante procesos modulados por la alfa-sinucleína . [34] La alfa-sinucleína se expresa en la sustancia negra, pero su función de reparación del ADN parece estar comprometida en las neuronas que contienen cuerpos de Lewy . [34] Esta pérdida puede desencadenar la muerte celular. [35] [36] [37]
Esquizofrenia
Desde hace mucho tiempo se ha implicado a los niveles elevados de dopamina en el desarrollo de la esquizofrenia . [38] Sin embargo, hasta el día de hoy continúa habiendo mucho debate en torno a esta hipótesis de la dopamina en la esquizofrenia . A pesar de la controversia, los antagonistas de la dopamina siguen siendo un tratamiento estándar y exitoso para la esquizofrenia. Estos antagonistas incluyen antipsicóticos de primera generación (típicos) como las butirofenonas , las fenotiazinas y los tioxantenos . Estos fármacos han sido reemplazados en gran medida por antipsicóticos de segunda generación (atípicos) como la clozapina y la paliperidona . En general, estos fármacos no actúan sobre las neuronas productoras de dopamina en sí, sino sobre los receptores de la neurona postsináptica.
Otras evidencias no farmacológicas que apoyan la hipótesis de la dopamina relacionada con la sustancia negra incluyen cambios estructurales en la pars compacta, como la reducción del tamaño de la terminal sináptica. [39] Otros cambios en la sustancia negra incluyen una mayor expresión de receptores NMDA en la sustancia negra y una menor expresión de disbindina . El aumento de los receptores NMDA puede indicar la participación de las interacciones glutamato - dopamina en la esquizofrenia. La disbindina, que se ha relacionado (de manera controvertida) con la esquizofrenia, puede regular la liberación de dopamina, y la baja expresión de disbindina en la sustancia negra puede ser importante en la etiología de la esquizofrenia. [40] Debido a los cambios en la sustancia negra en el cerebro esquizofrénico, puede ser posible utilizar técnicas de imagen específicas (como la imagen específica de neuromelanina) para detectar signos fisiológicos de esquizofrenia en la sustancia negra. [41]
Síndrome del tórax de madera
El síndrome de rigidez de la pared torácica por fentanilo, también llamado síndrome de rigidez de la pared torácica por fentanilo, es un efecto secundario poco frecuente de los opioides sintéticos como el fentanilo , el sulfentanilo, el alfentanilo y el remifentanilo . Produce un aumento generalizado del tono muscular esquelético . Se cree que el mecanismo es el aumento de la liberación de dopamina y la disminución de la liberación de GABA en los nervios de la sustancia negra/estriado. El efecto es más pronunciado en los músculos de la pared torácica y puede provocar una ventilación deficiente. La afección se observa con mayor frecuencia en la anestesia, en la que se administran dosis rápidas y altas de estos fármacos por vía intravenosa. [42] [43] [44]
Atrofia multisistémica
La atrofia multisistémica caracterizada por la degeneración neuronal en el cuerpo estriado y la sustancia negra se denominaba anteriormente degeneración estriatonigral .
Modificación química de la sustancia negra
La manipulación y modificación química de la sustancia negra es importante en los campos de la neurofarmacología y la toxicología . Diversos compuestos, como la levodopa y el MPTP, se utilizan en el tratamiento y el estudio de la enfermedad de Parkinson, y muchos otros fármacos tienen efectos sobre la sustancia negra.
Anfetamina y trazas de aminas
Los estudios han demostrado que, en ciertas regiones del cerebro, la anfetamina y las aminas traza aumentan las concentraciones de dopamina en la hendidura sináptica , aumentando así la respuesta de la neurona postsináptica. [45] Los diversos mecanismos por los cuales la anfetamina y las aminas traza afectan las concentraciones de dopamina se han estudiado ampliamente, y se sabe que involucran tanto a DAT como a VMAT2 . [45] [46] [47] La anfetamina es similar en estructura a la dopamina y las aminas traza; como consecuencia, puede ingresar a la neurona presináptica a través de DAT , así como difundiéndose a través de la membrana neuronal directamente. [45] Al ingresar a la neurona presináptica, la anfetamina y las aminas traza activan TAAR1 , que, a través de la señalización de la proteína quinasa , induce el eflujo de dopamina, la internalización de DAT dependiente de la fosforilación y la inhibición no competitiva de la recaptación. [45] [48] Debido a la similitud entre la anfetamina y las aminas traza, también es un sustrato para los transportadores de monoaminas; como consecuencia, inhibe (competitivamente) la recaptación de dopamina y otras monoaminas al competir con ellas por la captación también. [45]
Además, la anfetamina y las aminas traza son sustratos para el transportador de monoamina vesicular neuronal, el transportador de monoamina vesicular 2 (VMAT2). [47] Cuando la anfetamina es absorbida por el VMAT2 , la vesícula libera (efluye) moléculas de dopamina en el citosol a cambio. [47]
Cocaína
El mecanismo de acción de la cocaína en el cerebro humano incluye la inhibición de la recaptación de dopamina, [49] lo que explica las propiedades adictivas de la cocaína, ya que la dopamina es el neurotransmisor crítico para la recompensa. Sin embargo, la cocaína es más activa en las neuronas dopaminérgicas del área tegmental ventral que en la sustancia negra. La administración de cocaína aumenta el metabolismo en la sustancia negra, lo que puede explicar la función motora alterada observada en sujetos que consumen cocaína. [50] La inhibición de la recaptación de dopamina por la cocaína también inhibe la activación de potenciales de acción espontáneos por parte de la pars compacta. [51] El mecanismo por el cual la cocaína inhibe la recaptación de dopamina implica su unión a la proteína transportadora de dopamina . Sin embargo, los estudios muestran que la cocaína también puede causar una disminución en los niveles de ARNm de DAT , [52] muy probablemente debido a que la cocaína bloquea los receptores de dopamina en lugar de la interferencia directa con las vías transcripcionales o traduccionales. [52]
La inactivación de la sustancia negra podría ser un posible tratamiento para la adicción a la cocaína. En un estudio con ratas dependientes de la cocaína, la inactivación de la sustancia negra mediante cánulas implantadas redujo en gran medida la recaída en la adicción a la cocaína. [53]
Levodopa
La sustancia negra es el objetivo de la terapia química para el tratamiento de la enfermedad de Parkinson. La levodopa (comúnmente llamada L-DOPA), el precursor de la dopamina, es el medicamento más comúnmente prescrito para la enfermedad de Parkinson, a pesar de la controversia sobre la neurotoxicidad de la dopamina y la L-DOPA. [54] El fármaco es especialmente eficaz en el tratamiento de pacientes en las primeras etapas de Parkinson, aunque pierde su eficacia con el tiempo. [55] La levodopa puede atravesar la barrera hematoencefálica y aumenta los niveles de dopamina en la sustancia negra, aliviando así los síntomas de la enfermedad de Parkinson. El inconveniente del tratamiento con levodopa es que trata los síntomas de Parkinson (niveles bajos de dopamina), en lugar de la causa (la muerte de las neuronas dopaminérgicas en la sustancia negra).
MPTP
La MPTP es una neurotoxina específica de las células dopaminérgicas del cerebro, concretamente de la sustancia negra. La MPTP cobró protagonismo en 1982, cuando unos consumidores de heroína de California mostraron síntomas parecidos a los del Parkinson tras consumir MPPP contaminada con MPTP. Los pacientes, que estaban rígidos y casi completamente inmóviles, respondieron al tratamiento con levodopa. No se informó de ninguna remisión de los síntomas parecidos a los del Parkinson, lo que sugiere una muerte irreversible de las neuronas dopaminérgicas. [56] El mecanismo propuesto de la MPTP implica la alteración de la función mitocondrial , incluida la alteración del metabolismo y la creación de radicales libres . [57]
Poco después, se probó el MPTP en modelos animales para determinar su eficacia en la inducción de la enfermedad de Parkinson (con éxito). El MPTP indujo acinesia, rigidez y temblor en primates, y se descubrió que su neurotoxicidad era muy específica de la pars compacta de la sustancia negra. [58] En otros animales, como los roedores, la inducción de Parkinson por MPTP es incompleta o requiere dosis mucho más altas y frecuentes que en los primates. Hoy en día, el MPTP sigue siendo el método más favorecido para inducir la enfermedad de Parkinson en modelos animales . [57] [59]
Historia
La sustancia negra fue descubierta en 1784 por Félix Vicq-d'Azyr , [60] y Samuel Thomas von Sömmerring aludió a esta estructura en 1791. [61] La diferenciación entre la sustancia negra pars reticulata y compacta fue propuesta por primera vez por Sano en 1910. [62] En 1963, Oleh Hornykiewicz concluyó a partir de su observación que "la pérdida de células en la sustancia negra (de los pacientes con enfermedad de Parkinson) bien podría ser la causa del déficit de dopamina en el cuerpo estriado". [63]
Imágenes adicionales
- Dopamina y serotonina
- Degradación de la sustancia negra asociada a la enfermedad de Parkinson.
- Corte horizontal de resonancia magnética (ponderado en T1) con resaltado que indica la ubicación de la sustancia negra.
- Resonancia magnética de neuromelanina mejorada con imágenes en color (RGB) que muestran la pars compacta de la sustancia negra
- Microfilmación
Referencias
- ^ Rabey JM, Hefti F (1990). "Síntesis de neuromelanina en la sustancia negra de ratas y humanos". Journal of Neural Transmission. Sección de enfermedad de Parkinson y demencia . 2 (1): 1–14. doi :10.1007/BF02251241. PMID 2357268. S2CID 6769760.
- ^ Kim SJ, Sung JY, Um JW, Hattori N, Mizuno Y, Tanaka K, Paik SR, Kim J, Chung KC (octubre de 2003). "Parkin escinde inclusiones intracelulares de alfa-sinucleína a través de la activación de calpaína". The Journal of Biological Chemistry . 278 (43): 41890–9. doi : 10.1074/jbc.M306017200 . PMID 12917442.
- ^ Bolam, JP; Brown, MTC; Moss, J.; Magill, PJ (1 de enero de 2009), "Ganglios basales: organización interna", en Squire, Larry R. (ed.), Encyclopedia of Neuroscience , Oxford: Academic Press, págs. 97-104, doi :10.1016/b978-008045046-9.01294-8, ISBN 978-0-08-045046-9, consultado el 7 de septiembre de 2020
- ^ Kita H, Jaeger D (2016). "Organización del globo pálido". Manual de estructura y función de los ganglios basales, segunda edición . Manual de neurociencia conductual. Vol. 24. págs. 259–276. doi :10.1016/B978-0-12-802206-1.00013-1. ISBN 9780128022061.
- ^ Correa, M; Mingote, S; Betz, A; Wisniecki, A; Salamone, JD (julio de 2003). "El GABA de la pars reticulata de la sustancia negra está implicado en la regulación de la presión operante de la palanca: estudios farmacológicos y de microdiálisis". Neurociencia . 119 (3): 759–766. doi :10.1016/s0306-4522(03)00117-9. ISSN 0306-4522. PMID 12809696.
- ^ ab Zhou, F.-M.; Lee, CR (diciembre de 2011). "Propiedades intrínsecas e integradoras de las neuronas de la pars reticulata de la sustancia negra". Neurociencia . 198 : 69–94. doi :10.1016/j.neuroscience.2011.07.061. ISSN 0306-4522. PMC 3221915 . PMID 21839148.
- ^ Nauta HJ, Cole M (julio de 1978). "Proyecciones eferentes del núcleo subtalámico: un estudio autorradiográfico en monos y gatos". The Journal of Comparative Neurology . 180 (1): 1–16. doi :10.1002/cne.901800102. PMID 418083. S2CID 43046462.
- ^ Carpenter MB, Nakano K, Kim R (febrero de 1976). "Proyecciones nigrotalámicas en el mono demostradas mediante técnicas autorradiográficas". The Journal of Comparative Neurology . 165 (4): 401–15. doi :10.1002/cne.901650402. PMID 57125. S2CID 11790266.
- ^ Deniau JM, Kitai ST, Donoghue JP, Grofova I (1982). "Interacciones neuronales en la pars reticulata de la sustancia negra a través de colaterales axónicas de las neuronas de proyección. Un estudio electrofisiológico y morfológico". Experimental Brain Research . 47 (1): 105–13. doi :10.1007/BF00235891. PMID 6288427. S2CID 20289802.
- ^ Nicola SM, Surmeier J , Malenka RC (2000). "Modulación dopaminérgica de la excitabilidad neuronal en el cuerpo estriado y el núcleo accumbens". Revisión anual de neurociencia . 23 : 185–215. doi :10.1146/annurev.neuro.23.1.185. PMID 10845063.
- ^ Gernert M, Fedrowitz M, Wlaz P, Löscher W (noviembre de 2004). "Cambios subregionales en la tasa de descarga, el patrón y la sensibilidad a los fármacos de las neuronas nigrales GABAérgicas putativas en el modelo kindling de la epilepsia". The European Journal of Neuroscience . 20 (9): 2377–86. doi : 10.1111/j.1460-9568.2004.03699.x . PMID 15525279. S2CID 24485657.
- ^ Sato M, Hikosaka O (marzo de 2002). "El papel de la pars reticulata de la sustancia negra de los primates en el movimiento sacádico ocular orientado a la recompensa". The Journal of Neuroscience . 22 (6): 2363–73. doi :10.1523/JNEUROSCI.22-06-02363.2002. PMC 6758246 . PMID 11896175.
- ^ Zahr NM, Martin LP, Waszczak BL (noviembre de 2004). "Las lesiones del núcleo subtalámico alteran la producción electrofisiológica basal y estimulada por agonistas de dopamina de los ganglios basales de la rata". Synapse . 54 (2): 119–28. doi :10.1002/syn.20064. PMID 15352137. S2CID 10239473.
- ^ Hikosaka O, Wurtz RH (mayo de 1983). "Funciones visuales y oculomotoras de la pars reticulata de la sustancia negra del mono. III. Respuestas visuales y sacádicas dependientes de la memoria". Journal of Neurophysiology . 49 (5): 1268–84. doi :10.1152/jn.1983.49.5.1268. PMID 6864250.
- ^ Tseng KY, Riquelme LA, Belforte JE, Pazo JH, Murer MG (enero de 2000). "Unidades de la pars reticulata de la sustancia negra en ratas lesionadas con 6-hidroxidopamina: respuestas a la estimulación del receptor de dopamina D2 estriatal y lesiones subtalámicas". The European Journal of Neuroscience . 12 (1): 247–56. doi :10.1046/j.1460-9568.2000.00910.x. hdl : 11336/39220 . PMID 10651879. S2CID 22886675.
- ^ Deransart C, Hellwig B, Heupel-Reuter M, Léger JF, Heck D, Lücking CH (diciembre de 2003). "Análisis unitario de neuronas de la pars reticulata de la sustancia negra en ratas con epilepsia de ausencia genética que se comportan libremente". Epilepsia . 44 (12): 1513–20. doi :10.1111/j.0013-9580.2003.26603.x. PMID 14636321. S2CID 6661257.
- ^ Hodge GK, Butcher LL (agosto de 1980). "La pars compacta de la sustancia negra modula la actividad motora pero no participa de manera importante en la regulación de la ingesta de alimentos y agua". Archivos de farmacología de Naunyn-Schmiedeberg . 313 (1): 51–67. doi :10.1007/BF00505805. PMID 7207636. S2CID 24642979.
- ^ Pioli EY, Meissner W, Sohr R, Gross CE, Bezard E, Bioulac BH (junio de 2008). "Efectos conductuales diferenciales de lesiones bilaterales parciales del área tegmental ventral o de la pars compacta de la sustancia negra en ratas". Neurociencia . 153 (4): 1213–24. doi :10.1016/j.neuroscience.2008.01.084. PMID 18455318. S2CID 11239586.
- ^ ab Ljungberg T, Apicella P, Schultz W (enero de 1992). "Respuestas de las neuronas dopaminérgicas de los monos durante el aprendizaje de reacciones conductuales". Journal of Neurophysiology . 67 (1): 145–63. doi :10.1152/jn.1992.67.1.145. PMID 1552316. S2CID 18024404.
- ^ Da Cunha C, Silva MH, Wietzikoski S, Wietzikoski EC, Ferro MM, Kouzmine I, Canteras NS (diciembre de 2006). "Estrategia de aprendizaje del lugar de ratas lesionadas por la sustancia negra pars compacta". Neurociencia del comportamiento . 120 (6): 1279–84. doi :10.1037/0735-7044.120.6.1279. PMID 17201473.
- ^ Da Cunha C, Wietzikoski S, Wietzikoski EC, Miyoshi E, Ferro MM, Anselmo-Franci JA, Canteras NS (mayo de 2003). "Evidencia de que la pars compacta de la sustancia negra es un componente esencial de un sistema de memoria independiente del sistema de memoria del hipocampo". Neurobiología del aprendizaje y la memoria . 79 (3): 236–42. doi :10.1016/S1074-7427(03)00008-X. PMID 12676522. S2CID 12045200.
- ^ Matell MS, Meck WH (enero de 2000). "Mecanismos neuropsicológicos de la conducta de sincronización de intervalos". BioEssays . 22 (1): 94–103. doi :10.1002/(SICI)1521-1878(200001)22:1<94::AID-BIES14>3.0.CO;2-E. PMID 10649295.
- ^ Lima MM, Andersen ML, Reksidler AB, Vital MA, Tufik S (junio de 2007). Brosnan S (ed.). "El papel de la pars compacta de la sustancia negra en la regulación de los patrones de sueño en ratas". PLOS ONE . 2 (6): e513. Bibcode :2007PLoSO...2..513L. doi : 10.1371/journal.pone.0000513 . PMC 1876809 . PMID 17551593.

- ^ Dzirasa K, Ribeiro S, Costa R, Santos LM, Lin SC, Grosmark A, Sotnikova TD, Gainetdinov RR, Caron MG, Nicolelis MA (octubre de 2006). "Control dopaminérgico de los estados de sueño-vigilia". La Revista de Neurociencia . 26 (41): 10577–89. doi :10.1523/JNEUROSCI.1767-06.2006. PMC 6674686 . PMID 17035544.
- ^ Bejjani, Boulos-Paul; Damier, Philippe; Arnulf, Isabelle; Thivard, Lionel; Bonnet, Anne-Marie; Dormont, Didier; Cornu, Philippe; Pidoux, Bernard; Samson, Yves; Agid, Yves (13 de mayo de 1999). "Depresión aguda transitoria inducida por estimulación cerebral profunda de alta frecuencia". New England Journal of Medicine . 340 (19): 1476–1480. doi : 10.1056/NEJM199905133401905 . ISSN 0028-4793. PMID 10320386.
- ^ Jankovic J (abril de 2008). "Enfermedad de Parkinson: características clínicas y diagnóstico". Revista de neurología, neurocirugía y psiquiatría . 79 (4): 368–76. doi : 10.1136/jnnp.2007.131045 . PMID 18344392.
- ^ Adler CH (2005). "Complicaciones no motoras en la enfermedad de Parkinson". Trastornos del movimiento . 20 (Supl 11): S23-9. doi :10.1002/mds.20460. PMID 15822106. S2CID 19045599.
- ^ Dawson TM , Dawson VL (octubre de 2003). "Vías moleculares de neurodegeneración en la enfermedad de Parkinson". Science . 302 (5646): 819–22. Bibcode :2003Sci...302..819D. doi :10.1126/science.1087753. PMID 14593166. S2CID 35486083.
- ^ Liang CL, Sinton CM, Sonsalla PK, German DC (diciembre de 1996). "Las neuronas dopaminérgicas del mesencéfalo en el ratón que contienen calbindina-D28k exhiben una vulnerabilidad reducida a la neurodegeneración inducida por MPTP". Neurodegeneración . 5 (4): 313–8. doi :10.1006/neur.1996.0042. PMID 9117542.
- ^ Grosch J, Winkler J, Kohl Z (2016). "Degeneración temprana de los axones dopaminérgicos y serotoninérgicos: un mecanismo común en la enfermedad de Parkinson". Portada. Cell. Neurosci . 10 : 293. doi : 10.3389/fncel.2016.00293 . PMC 5177648 . PMID 28066188.
- ^ Entrevista. Yoland Smith, PhD [ se requiere verificación ]
- ^ Menke RA, Jbabdi S, Miller KL, Matthews PM, Zarei M (octubre de 2010). "Segmentación basada en la conectividad de la sustancia negra en humanos y sus implicaciones en la enfermedad de Parkinson". NeuroImage . 52 (4): 1175–80. doi :10.1016/j.neuroimage.2010.05.086. PMID 20677376. S2CID 19871414.
- ^ Trist BG, Hare DJ, Double KL. Estrés oxidativo en la sustancia negra envejecida y la etiología de la enfermedad de Parkinson. Aging Cell. 2019 Dic;18(6):e13031. doi: 10.1111/acel.13031. Publicación electrónica 20 de agosto de 2019. Revisión. PMID 31432604
- ^ ab Schaser AJ, Osterberg VR, Dent SE, Stackhouse TL, Wakeham CM, Boutros SW, Weston LJ, Owen N, Weissman TA, Luna E, Raber J, Luk KC, McCullough AK, Woltjer RL, Unni VK. La alfa-sinucleína es una proteína de unión al ADN que modula la reparación del ADN con implicaciones para los trastornos de cuerpos de Lewy. Sci Rep. 29 de julio de 2019;9(1):10919. doi: 10.1038/s41598-019-47227-z. PMID 31358782
- ^ Berg, Stacie Z.; Berg, Jonathan (29 de septiembre de 2023). "Melanina: una teoría unificadora de la enfermedad ejemplificada por el Parkinson, el Alzheimer y la demencia por cuerpos de Lewy". Frontiers in Immunology . 14 . doi : 10.3389/fimmu.2023.1228530 . ISSN 1664-3224. PMC 10570809 . PMID 37841274.
- ^ Gordon, Richard; Albornoz, Eduardo A.; Christie, Daniel C.; Langley, Monica R.; Kumar, Vinod; Mantovani, Susanna; Robertson, Avril AB; Butler, Mark S.; Rowe, Dominic B.; O'Neill, Luke A.; Kanthasamy, Anumantha G.; Schroder, Kate; Cooper, Matthew A.; Woodruff, Trent M. (31 de octubre de 2018). "La inhibición del inflamasoma previene la patología de la α-sinucleína y la neurodegeneración dopaminérgica en ratones". Science Translational Medicine . 10 (465). doi :10.1126/scitranslmed.aah4066. ISSN 1946-6234. PMC 6483075 . PMID 30381407.
- ^ Li, Jingyi; Zhao, Jingwei; Chen, Longmin; Gao, Hongling; Zhang, Jing; Wang, Danlei; Zou, Yuan; Qin, Qixiong; Qu, Yi; Li, Jiangting; Xiong, Yongjie; Min, Zhe; Yan, Manli; Mao, Zhijuan; Xue, Zheng (1 de febrero de 2023). "La α-sinucleína induce la diferenciación de Th17 y altera la función y estabilidad de las Treg al promover la transcripción RORC en la enfermedad de Parkinson". Cerebro, comportamiento e inmunidad . 108 : 32–44. doi :10.1016/j.bbi.2022.10.023. ISSN 0889-1591. PMID 36343753.
- ^ van Rossum J (1967). "La importancia del bloqueo del receptor de dopamina para la acción de los fármacos neurolépticos". En Brill H, Cole J, Deniker P, Hippius H, Bradley PB (eds.). Neuropsicofarmacología, Actas del Quinto Collegium Internationale Neuropsychopharmacologicum . págs. 321–9. OCLC 458719.
- ^ Kolomeets NS, Uranova NA (1999). "Contactos sinápticos en la esquizofrenia: estudios que utilizan la identificación inmunocitoquímica de neuronas dopaminérgicas". Neurociencia y fisiología del comportamiento . 29 (2): 217–21. doi :10.1007/BF02465329. PMID 10432512. S2CID 2233617.
- ^ Kumamoto N, Matsuzaki S, Inoue K, Hattori T, Shimizu S, Hashimoto R, Yamatodani A, Katayama T, Tohyama M (junio de 2006). "La hiperactivación del sistema dopaminérgico del mesencéfalo en la esquizofrenia podría atribuirse a la regulación negativa de la disbindina". Biochemical and Biophysical Research Communications . 345 (2): 904–9. doi :10.1016/j.bbrc.2006.04.163. PMID 16701550.
- ^ Shibata E, Sasaki M, Tohyama K, Otsuka K, Endoh J, Terayama Y, Sakai A (septiembre de 2008). "Uso de imágenes por resonancia magnética sensibles a la neuromelanina para distinguir a pacientes esquizofrénicos y depresivos de individuos sanos en función de alteraciones de la señal en la sustancia negra y el locus ceruleus". Biological Psychiatry . 64 (5): 401–6. doi :10.1016/j.biopsych.2008.03.021. PMID 18452894. S2CID 25752976.
- ^ Pergolizzi, Joseph V.; Webster, Lynn R.; Vortsman, Eugene; Ann LeQuang, Jo; Raffa, Robert B. (diciembre de 2021). "Síndrome del tórax de madera: la farmacología atípica de la sobredosis de fentanilo". Revista de farmacia clínica y terapéutica . 46 (6): 1505–1508. doi : 10.1111/jcpt.13484 . ISSN 0269-4727. PMID 34240442.
- ^ Baruah, Udismita; Gaur, Himanshu; Saigal, Deepti; Pandey, Dimple (diciembre de 2022). "Síndrome del pecho de madera: un caso curioso de rigidez inducida por fentanilo en adultos". Revista india de anestesia . 66 (12): 881–882. doi : 10.4103/ija.ija_171_22 . ISSN 0019-5049. PMC 9842087 . PMID 36654889.
- ^ Rosal, Nathaniel R.; Thelmo, Franklin L.; Tzarnas, Stephanie; DiCalvo, Lauren; Tariq, Shafaq; Grossman, Craig (enero de 2021). "Síndrome del tórax de madera: informe de un caso de rigidez de la pared torácica inducida por fentanilo". Journal of Investigative Medicine High Impact Case Reports . 9 : 232470962110340. doi :10.1177/23247096211034036. ISSN 2324-7096. PMC 8312149 . PMID 34301155.
- ^ abcde Miller GM (enero de 2011). "El papel emergente del receptor 1 asociado a trazas de aminas en la regulación funcional de los transportadores de monoaminas y la actividad dopaminérgica". Journal of Neurochemistry . 116 (2): 164–76. doi :10.1111/j.1471-4159.2010.07109.x. PMC 3005101 . PMID 21073468.
- ^ "Amphetamine". DrugBank . Universidad de Alberta. 8 de febrero de 2013 . Consultado el 13 de octubre de 2013 .
- ^ abc Eiden LE, Weihe E (enero de 2011). "VMAT2: un regulador dinámico de la función neuronal monoaminérgica cerebral que interactúa con drogas de abuso". Anales de la Academia de Ciencias de Nueva York . 1216 (1): 86–98. Bibcode :2011NYASA1216...86E. doi :10.1111/j.1749-6632.2010.05906.x. PMC 4183197 . PMID 21272013.
- ^ Maguire JJ, Parker WA, Foord SM, Bonner TI, Neubig RR, Davenport AP (marzo de 2009). "Unión Internacional de Farmacología. LXXII. Recomendaciones para la nomenclatura de receptores de aminas traza". Pharmacological Reviews . 61 (1): 1–8. doi :10.1124/pr.109.001107. PMC 2830119 . PMID 19325074.
- ^ Heikkila RE, Cabbat FS, Duvoisin RC (1979). "Actividad motora y comportamiento rotacional después de análogos de la cocaína: correlación con el bloqueo de la captación de dopamina". Communications in Psychopharmacology . 3 (5): 285–90. PMID 575770.
- ^ Lakoski JM, Galloway MP, White FJ (1991). Cocaína . Telford Press. ISBN 978-0-8493-8813-2.
- ^ Lacey MG, Mercuri NB, North RA (abril de 1990). "Acciones de la cocaína sobre las neuronas dopaminérgicas de ratas in vitro". British Journal of Pharmacology . 99 (4): 731–5. doi :10.1111/j.1476-5381.1990.tb12998.x. PMC 1917549 . PMID 2361170.
- ^ ab Xia Y, Goebel DJ, Kapatos G, Bannon MJ (septiembre de 1992). "Cuantificación del ARNm del transportador de dopamina en ratas: efectos del tratamiento y la abstinencia de la cocaína". Journal of Neurochemistry . 59 (3): 1179–82. doi :10.1111/j.1471-4159.1992.tb08365.x. PMID 1494906. S2CID 34068876.
- ^ Véase RE, Elliott JC, Feltenstein MW (octubre de 2007). "El papel de las vías estriatales dorsales y ventrales en la conducta de búsqueda de cocaína después de una abstinencia prolongada en ratas". Psicofarmacología . 194 (3): 321–31. doi :10.1007/s00213-007-0850-8. PMID 17589830. S2CID 12652533.
- ^ Cheng N, Maeda T, Kume T, Kaneko S, Kochiyama H, Akaike A, Goshima Y, Misu Y (diciembre de 1996). "Neurotoxicidad diferencial inducida por L-DOPA y dopamina en neuronas estriatales cultivadas". Brain Research . 743 (1–2): 278–83. doi :10.1016/S0006-8993(96)01056-6. PMID 9017256. S2CID 22529926.
- ^ Rascol O, Payoux P, Ory F, Ferreira JJ, Brefel-Courbon C, Montastruc JL (2003). "Limitaciones de la terapia actual para la enfermedad de Parkinson". Anales de Neurología . 53 (Supl 3): S3–12, discusión S12–5. doi :10.1002/ana.10513. PMID 12666094. S2CID 45078589.
- ^ Langston JW, Ballard P, Tetrud JW, Irwin I (febrero de 1983). "Parkinsonismo crónico en humanos debido a un producto de la síntesis de análogos de meperidina". Science . 219 (4587): 979–80. Bibcode :1983Sci...219..979L. doi :10.1126/science.6823561. PMID 6823561. S2CID 31966839.
- ^ ab Schmidt N, Ferger B (2001). "Hallazgos neuroquímicos en el modelo MPTP de la enfermedad de Parkinson". Journal of Neural Transmission . 108 (11): 1263–82. doi :10.1007/s007020100004. PMID 11768626. S2CID 2834254.
- ^ Langston JW, Forno LS, Rebert CS, Irwin I (febrero de 1984). "Toxicidad selectiva de la nigra después de la administración sistémica de 1-metil-4-fenil-1,2,5,6-tetrahidropirina (MPTP) en el mono ardilla". Brain Research . 292 (2): 390–4. doi :10.1016/0006-8993(84)90777-7. PMID 6607092. S2CID 34183578.
- ^ Blanchet PJ, Calon F, Morissette M, Hadj Tahar A, Bélanger N, Samadi P, Grondin R, Grégoire L, Meltzer L, Di Paolo T, Bédard PJ (julio de 2004). "Relevancia del modelo de primates MPTP en el estudio de los mecanismos de preparación de la discinesia". Parkinsonismo y trastornos relacionados . 10 (5): 297–304. doi :10.1016/j.parkreldis.2004.02.011. PMID 15196509.
- ^ Tubbs RS, Loukas M, Shoja MM, Mortazavi MM, Cohen-Gadol AA (julio de 2011). "Félix Vicq d'Azyr (1746-1794): fundador temprano de la neuroanatomía y médico real francés". Sistema nervioso del niño . 27 (7): 1031–4. doi : 10.1007/s00381-011-1424-y . PMID 21445631.
- ^ Swanson LW (2014). Terminología neuroanatómica: un léxico de orígenes clásicos y fundamentos históricos . Inglaterra: Oxford University Press. ISBN 9780195340624.
- ^ Sano T (1910). "Beitrag zur vergleichenden Anatomie der Substantia nigra, des Corpus Luysii und der Zona incerta". MSCHR Psiquiatría Neurológica . 28 (1): 26–34. doi :10.1159/000209678 (inactivo el 22 de junio de 2024).
{{cite journal}}: CS1 maint: DOI inactivo a partir de junio de 2024 ( enlace ) - ^ Hornykiewicz, O. (2006). "El descubrimiento de la deficiencia de dopamina en el cerebro parkinsoniano". En Riederer, P.; Reichmann, H.; Youdim, MBH; Gerlach, M. (eds.). Enfermedad de Parkinson y trastornos relacionados . Springer Vienna. págs. 9–15. doi :10.1007/978-3-211-45295-0_3. ISBN 978-3-211-28927-3. Número de identificación personal 17017502.
{{cite book}}:|journal=ignorado ( ayuda )
Enlaces externos
- Imágenes de cortes cerebrales teñidos que incluyen la "sustancia negra" en el proyecto BrainMaps
- Diagrama y explicación de las vías corticobasales Archivado el 23 de junio de 2007 en Wayback Machine.