Glutamina
 Fórmula esquelética de la L -glutamina | |||
| |||
 | |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Glutamina | |||
| Otros nombres L-glutamina (levo)glutamida Ácido 2,5-diamino-5-oxopentanoico Ácido 2-amino-4-carbamoilbutanoico Endari [1] | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Abreviaturas | Gln , Q | ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.266 | ||
| Número CE |
| ||
| |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades [2] | |||
| C5H10N2O3 | |||
| Masa molar | 146,146 g·mol −1 | ||
| Punto de fusión | Se descompone alrededor de 185°C | ||
| soluble | |||
| Acidez (p K a ) | 2,2 (carboxilo), 9,1 (amino) | ||
Rotación quiral ([α] D ) | +6,5º (H2O , c = 2) | ||
| Farmacología | |||
| A16AA03 ( OMS ) | |||
| Página de datos complementarios | |||
| Glutamina (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
| Datos clínicos | |
|---|---|
| Nombres comerciales | Endari, Nutrestore |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a617035 |
| Datos de licencia |
|
| Vías de administración | Por la boca |
| Clase de droga | Agente gastrointestinal |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Banco de medicamentos |
|
| Araña química |
|
| UNIVERSIDAD |
|
| BARRIL |
|
| EBICh |
|
| Química biológica |
|
| Ligando PDB |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.000.266 |
| Datos químicos y físicos | |
| Fórmula | C5H10N2O3 |
| Masa molar | 146,146 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
| Página de datos | |
| Glutamina (página de datos) | |
La glutamina (símbolo Gln o Q ) [4] es un α-aminoácido que se utiliza en la biosíntesis de proteínas . Su cadena lateral es similar a la del ácido glutámico , excepto que el grupo de ácido carboxílico se reemplaza por una amida . Se clasifica como un aminoácido polar de carga neutra. No es esencial y es condicionalmente esencial en los seres humanos, lo que significa que el cuerpo generalmente puede sintetizar cantidades suficientes de este, pero en algunos casos de estrés, la demanda corporal de glutamina aumenta y la glutamina debe obtenerse de la dieta. [5] [6] Está codificada por los codones CAA y CAG. Recibe su nombre del ácido glutámico, que a su vez recibe su nombre de su descubrimiento en las proteínas de los cereales, el gluten . [7]
En la sangre humana , la glutamina es el aminoácido libre más abundante . [8]
Las fuentes dietéticas de glutamina incluyen especialmente alimentos ricos en proteínas como carne de res , pollo , pescado , productos lácteos , huevos , verduras como frijoles , remolacha , repollo , espinacas , zanahorias , perejil , jugos de verduras y también trigo , papaya , coles de Bruselas , apio , col rizada y alimentos fermentados como el miso .
El símbolo de una letra Q para glutamina se asignó en secuencia alfabética a N para asparagina , siendo más grande solo por un grupo metileno –CH2–. Nótese que P se utilizó para prolina y se evitó O debido a la similitud con D. También se propuso el mnemónico Q lutamina. [7]
Funciones
La glutamina juega un papel en una variedad de funciones bioquímicas:
- Síntesis de proteínas, como cualquier otro de los 20 aminoácidos proteinogénicos.
- Síntesis de lípidos, especialmente por las células cancerosas . [9]
- Regulación del equilibrio ácido-base en el riñón mediante la producción de amonio [10]
- Energía celular , como fuente, junto a la glucosa [11]
- Donación de nitrógeno para muchos procesos anabólicos , incluida la síntesis de purinas [8]
- La donación de carbono, como fuente, rellena el ciclo del ácido cítrico [12]
- Transportador no tóxico de amoniaco en la circulación sanguínea. [13] [14]
- Integridad de la mucosa intestinal sana , aunque pequeños ensayos aleatorios no han demostrado ningún beneficio en la enfermedad de Crohn . [15]
Funciones en el metabolismo
La glutamina mantiene el equilibrio redox al participar en la síntesis de glutatión y contribuir a procesos anabólicos como la síntesis de lípidos mediante carboxilación reductora. [16]
La glutamina proporciona una fuente de carbono y nitrógeno para su uso en otros procesos metabólicos. La glutamina está presente en el suero en concentraciones más altas que otros aminoácidos [17] y es esencial para muchas funciones celulares. Los ejemplos incluyen la síntesis de nucleótidos y aminoácidos no esenciales . [18] Una de las funciones más importantes de la glutamina es su capacidad de convertirse en α-KG, que ayuda a mantener el flujo del ciclo del ácido tricarboxílico, generando ATP a través de los transportadores de electrones NADH y FADH 2 . [19] El mayor consumo de glutamina ocurre en las células de los intestinos, [8] células renales (donde se utiliza para el equilibrio ácido-base), células inmunes activadas, [20] y muchas células cancerosas . [9] [12] [21]
Producción
La glutamina se produce industrialmente utilizando mutantes de Brevibacterium flavum , lo que produce aproximadamente 40 g/L en 2 días utilizando glucosa como fuente de carbono. [22]
Biosíntesis
La síntesis de glutamina a partir del glutamato y el amoníaco es catalizada por la enzima glutamina sintetasa . La mayor parte de la producción de glutamina se produce en el tejido muscular, lo que representa aproximadamente el 90% de toda la glutamina sintetizada. La glutamina también se libera, en pequeñas cantidades, en los pulmones y el cerebro. [23] Aunque el hígado es capaz de sintetizar glutamina, su papel en el metabolismo de la glutamina es más regulador que productivo, ya que el hígado absorbe la glutamina derivada del intestino a través del sistema portal hepático . [8]
Usos
Nutrición
La glutamina es el aminoácido no esencial más abundante de origen natural en el cuerpo humano y uno de los pocos aminoácidos que pueden atravesar directamente la barrera hematoencefálica . [8] Los seres humanos obtienen glutamina a través del catabolismo de las proteínas de los alimentos que consumen. [24] En estados en los que se está construyendo o reparando tejido, como el crecimiento de los bebés o la curación de heridas o enfermedades graves, la glutamina se vuelve condicionalmente esencial . [24]
Anemia drepanocítica
En esta sección falta información sobre el (posible) mecanismo de acción y la farmacocinética en PMID 31985279. ( Noviembre de 2023 ) |
En 2017, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el polvo oral de L -glutamina, comercializado como Endari , para reducir las complicaciones graves de la enfermedad de células falciformes en personas de cinco años o más con el trastorno. [1]
La seguridad y eficacia del polvo oral de L-glutamina se estudiaron en un ensayo aleatorizado de sujetos de cinco a 58 años de edad con enfermedad de células falciformes que habían tenido dos o más crisis dolorosas dentro de los 12 meses anteriores a la inscripción en el ensayo. [1] Los sujetos fueron asignados aleatoriamente al tratamiento con polvo oral de L-glutamina o placebo, y el efecto del tratamiento se evaluó durante 48 semanas. [1] Los sujetos que fueron tratados con polvo oral de L-glutamina experimentaron menos visitas al hospital por dolor tratado con un narcótico administrado por vía parenteral o ketorolaco (crisis de células falciformes), en promedio, en comparación con los sujetos que recibieron un placebo (mediana 3 frente a mediana 4), menos hospitalizaciones por dolor de células falciformes (mediana 2 frente a mediana 3) y menos días en el hospital (mediana 6,5 días frente a mediana 11 días). [1] Los sujetos que recibieron L-glutamina en polvo oral también tuvieron menos incidencias de síndrome torácico agudo (una complicación potencialmente mortal de la enfermedad de células falciformes) en comparación con los pacientes que recibieron un placebo (8,6 por ciento frente a 23,1 por ciento). [1]
Los efectos secundarios comunes del polvo oral de L-glutamina incluyen estreñimiento, náuseas, dolor de cabeza, dolor abdominal, tos, dolor en las extremidades, dolor de espalda y dolor en el pecho. [1]
El polvo oral de L-glutamina recibió la designación de medicamento huérfano . [1] La FDA otorgó la aprobación de Endari a Emmaus Medical Inc. [1]
Comida médica
La glutamina se comercializa como alimento médico y se prescribe cuando un profesional médico cree que una persona bajo su cuidado necesita glutamina suplementaria debido a demandas metabólicas que van más allá de lo que se puede satisfacer mediante síntesis endógena o dieta. [25]
Seguridad
La glutamina es segura en adultos y en bebés prematuros. [26] Aunque la glutamina se metaboliza a glutamato y amoníaco, ambos con efectos neurológicos, sus concentraciones no aumentan mucho y no se detectaron efectos neurológicos adversos. [26] El nivel seguro observado para la L -glutamina suplementaria en adultos sanos normales es de 14 g/día. [27]
Se han descrito efectos adversos de la glutamina en personas que reciben nutrición parenteral domiciliaria y en aquellas con anomalías de la función hepática. [28] Aunque la glutamina no tiene efecto sobre la proliferación de células tumorales, todavía es posible que la suplementación con glutamina pueda ser perjudicial en algunos tipos de cáncer. [29]
La interrupción de la suplementación con glutamina en personas adaptadas a un consumo muy elevado puede iniciar un efecto de abstinencia, aumentando el riesgo de problemas de salud como infecciones o deterioro de la integridad del intestino. [29]
Estructura
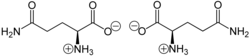
La glutamina puede existir en cualquiera de las dos formas enantioméricas , L -glutamina y D -glutamina. La forma L se encuentra en la naturaleza. La glutamina contiene un grupo α-amino que se encuentra en la forma protonada −NH 3 + en condiciones biológicas y un grupo de ácido carboxílico que se encuentra en la forma desprotonada −COO − , conocida como carboxilato, en condiciones fisiológicas.
Investigación

El enjuague bucal con glutamina puede ser útil para prevenir la mucositis oral en personas sometidas a quimioterapia, pero la glutamina intravenosa no parece ser útil para prevenir la mucositis en el tracto gastrointestinal. [31]
Se pensaba que la suplementación con glutamina tenía potencial para reducir las complicaciones en personas gravemente enfermas o que se habían sometido a una cirugía abdominal, pero esto se basó en ensayos clínicos de mala calidad. [32] La suplementación no parece ser útil en adultos o niños con enfermedad de Crohn o enfermedad inflamatoria intestinal , pero los estudios clínicos hasta 2016 no tenían suficiente potencia. [15] La suplementación no parece tener un efecto en bebés con problemas significativos de estómago o intestinos. [33]
Algunos deportistas utilizan L -glutamina como suplemento. Los estudios respaldan los efectos positivos de la administración oral crónica del suplemento sobre las lesiones y la inflamación inducidas por el ejercicio aeróbico intenso y exhaustivo, pero los efectos sobre la recuperación muscular del entrenamiento con pesas no están claros. [34]
Las condiciones de estrés para las plantas (sequía, lesiones, salinidad del suelo) provocan la síntesis de enzimas vegetales como la superóxido dismutasa , la L-ascorbato oxidasa y la ADN polimerasa Delta 1. [35] Este proceso, iniciado por las condiciones de fuerte salinidad del suelo, se puede limitar administrando glutamina exógena a las plantas. La disminución del nivel de expresión de los genes responsables de la síntesis de la superóxido dismutasa aumenta con el aumento de la concentración de glutamina. [35]
Véase también
Referencias
- ^ abcdefghi «La FDA aprueba un nuevo tratamiento para la anemia falciforme». Administración de Alimentos y Medicamentos de Estados Unidos (FDA) (Comunicado de prensa). 7 de julio de 2017. Consultado el 10 de julio de 2017 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ Weast RC, ed. (1981). Manual de química y física del CRC (62.ª edición). Boca Raton, FL: CRC Press. pág. C-311. ISBN 0-8493-0462-8..
- ^ "Uso de glutamina durante el embarazo". Drugs.com . 30 de septiembre de 2019 . Consultado el 23 de abril de 2020 .
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos". Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008. Consultado el 5 de marzo de 2018 .
- ^ Consejo de Alimentación y Nutrición del Instituto de Medicina (2006). "Proteínas y aminoácidos". En Otten JJ, Hellwig JP, Meyers LD (eds.). Ingestas dietéticas de referencia: la guía esencial de los requerimientos nutricionales (PDF) . Washington, DC: National Academies Press. pág. 147. ISBN 978-0-309-10091-5. Archivado desde el original (PDF) el 9 de marzo de 2014.
- ^ Lacey JM, Wilmore DW (agosto de 1990). "¿Es la glutamina un aminoácido condicionalmente esencial?". Nutrition Reviews . 48 (8): 297–309. doi :10.1111/j.1753-4887.1990.tb02967.x. PMID 2080048.
- ^ ab Saffran M (abril de 1998). "Nombres de aminoácidos y juegos de salón: desde nombres triviales hasta códigos de una sola letra, los nombres de aminoácidos han puesto a prueba la memoria de los estudiantes. ¿Es posible una nomenclatura más racional?". Educación bioquímica . 26 (2): 116–118. doi :10.1016/s0307-4412(97)00167-2. ISSN 0307-4412.
- ^ abcde Brosnan JT (junio de 2003). "Transporte de aminoácidos entre órganos y su regulación". The Journal of Nutrition . 133 (6 Suppl 1): 2068S–2072S. doi : 10.1093/jn/133.6.2068S . PMID 12771367.

- ^ ab Corbet C, Feron O (julio de 2015). Corbet C, Feron O (eds.). "Cambios metabólicos y mentales: de la adicción a la glucosa a la glutamina y al acetato en el cáncer". Current Opinion in Clinical Nutrition and Metabolic Care . 18 (4): 346–353. doi :10.1097/MCO.0000000000000178. PMID 26001655. S2CID 1478014.
- ^ Hall JE, Guyton AC (2006). Libro de texto de fisiología médica (11.ª ed.). St. Louis, Mo: Elsevier Saunders. pág. 393. ISBN 978-0-7216-0240-0.
- ^ Aledo JC (julio de 2004). "Descomposición de glutamina en células que se dividen rápidamente: ¿desperdicio o inversión?". BioEssays . 26 (7): 778–785. doi :10.1002/bies.20063. PMID 15221859.
- ^ ab Yuneva M, Zamboni N, Oefner P, Sachidanandam R, Lazebnik Y (julio de 2007). "La deficiencia de glutamina pero no de glucosa induce apoptosis dependiente de MYC en células humanas". The Journal of Cell Biology . 178 (1): 93–105. doi :10.1083/jcb.200703099. PMC 2064426 . PMID 17606868.
- ^ Zielińska M, Albrecht J, Popek M (2022). "Desregulación del transporte de glutamina astrocítica en el edema cerebral hiperamonémico agudo". Frontiers in Neuroscience . 16 : 874750. doi : 10.3389/fnins.2022.874750 . PMC 9207324 . PMID 35733937.
- ^ Dabrowska K, Skowronska K, Popek M, Obara-Michlewska M, Albrecht J, Zielinska M (2018). "Funciones del transporte de glutamato y glutamina en la neurotoxicidad por amoníaco: estado del arte y signos de interrogación". Objetivos farmacológicos para trastornos endocrinos, metabólicos e inmunológicos . 18 (4): 306–315. doi :10.2174/1871520618666171219124427. PMID 29256360. S2CID 26569656.
- ^ ab Yamamoto T, Shimoyama T, Kuriyama M (abril de 2017). "Intervenciones dietéticas y enterales para la enfermedad de Crohn". Current Opinion in Biotechnology . 44 : 69–73. doi :10.1016/j.copbio.2016.11.011. PMID 27940405.
- ^ Jiang L, Shestov AA, Swain P, Yang C, Parker SJ, Wang QA, et al. (abril de 2016). "La carboxilación reductora favorece la homeostasis redox durante el crecimiento independiente del anclaje". Nature . 532 (7598): 255–258. Bibcode :2016Natur.532..255J. doi :10.1038/nature17393. PMC 4860952 . PMID 27049945.
- ^ Welbourne TC (marzo de 1979). "Producción de amoníaco e incorporación de glutamina al glutatión en el riñón funcional de la rata". Revista canadiense de bioquímica . 57 (3): 233–237. doi :10.1139/o79-029. PMID 436006.
- ^ DeBerardinis RJ, Mancuso A, Daikhin E, Nissim I, Yudkoff M, Wehrli S, et al. (diciembre de 2007). "Más allá de la glucólisis aeróbica: las células transformadas pueden participar en el metabolismo de la glutamina que excede el requisito de síntesis de proteínas y nucleótidos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 104 (49): 19345–19350. Bibcode :2007PNAS..10419345D. doi : 10.1073/pnas.0709747104 . PMC 2148292 . PMID 18032601.
- ^ DeBerardinis RJ, Lum JJ, Hatzivassiliou G, Thompson CB (enero de 2008). "La biología del cáncer: la reprogramación metabólica impulsa el crecimiento y la proliferación celular". Metabolismo celular . 7 (1): 11–20. doi : 10.1016/j.cmet.2007.10.002 . PMID 18177721.
- ^ Newsholme P (septiembre de 2001). "¿Por qué el metabolismo de la L-glutamina es importante para las células del sistema inmunológico en condiciones de salud, después de una lesión, una cirugía o una infección?". The Journal of Nutrition . 131 (9 Suppl): 2515S–2522S, discusión 2522S–4S. doi : 10.1093/jn/131.9.2515S . PMID 11533304.
- ^ Fernandez-de-Cossio-Diaz J, Vazquez A (octubre de 2017). "Límites del metabolismo aeróbico en células cancerosas". Scientific Reports . 7 (1): 13488. Bibcode :2017NatSR...713488F. doi :10.1038/s41598-017-14071-y. PMC 5647437 . PMID 29044214.
- ^ Drauz K, Grayson I, Kleemann A, Krimmer HP, Leuchtenberger W, Weckbecker C (2007). "Aminoácidos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_057.pub2. ISBN 978-3527306732.
- ^ Newsholme P, Lima MM, Procopio J, Pithon-Curi TC, Doi SQ, Bazotte RB y col. (febrero de 2003). "Glutamina y glutamato como metabolitos vitales". Revista Brasileña de Investigaciones Médicas y Biológicas = Revista Brasileira de Pesquisas Medicas e Biologicas . 36 (2): 153–163. doi : 10.1590/S0100-879X2003000200002 . PMID 12563517.
- ^ ab Watford M (septiembre de 2015). "Glutamina y glutamato: ¿aminoácidos esenciales o no esenciales?". Nutrición animal . 1 (3): 119–122. doi :10.1016/j.aninu.2015.08.008. PMC 5945979 . PMID 29767158.
- ^ "GlutaSolve, NutreStore, SYMPT-X GI, SYMPT-X Glutamine (glutamina): efectos secundarios, interacciones e información sobre medicamentos en eMedicineHealth". eMedicineHealth . Consultado el 24 de enero de 2017 .
- ^ ab Garlick PJ (septiembre de 2001). "Evaluación de la seguridad de la glutamina y otros aminoácidos". The Journal of Nutrition . 131 (9 Suppl): 2556S–2561S. doi : 10.1093/jn/131.9.2556S . PMID 11533313.
- ^ Shao A, Hathcock JN (abril de 2008). "Evaluación de riesgos para los aminoácidos taurina, L-glutamina y L-arginina". Toxicología y farmacología regulatorias . 50 (3): 376–399. doi :10.1016/j.yrtph.2008.01.004. PMID 18325648.
- ^ Buchman AL (julio de 2001). "Glutamina: ¿comercialmente esencial o condicionalmente esencial? Una evaluación crítica de los datos humanos". The American Journal of Clinical Nutrition . 74 (1): 25–32. doi : 10.1093/ajcn/74.1.25 . PMID 11451714.
- ^ ab Holecek M (septiembre de 2013). "Efectos secundarios de la suplementación con glutamina a largo plazo". Revista de nutrición parenteral y enteral . 37 (5): 607–616. doi :10.1177/0148607112460682. PMID 22990615.
- ^ Stehle P, Kuhn KS (2015). "Glutamina: un sustrato de nutrición parenteral obligatorio en la terapia de cuidados críticos". BioMed Research International . 2015 : 545467. doi : 10.1155/2015/545467 . PMC 4606408 . PMID 26495301.
- ^ Berretta M, Michieli M, Di Francia R, Cappellani A, Rupolo M, Galvano F, et al. (Enero de 2013). "Nutrición en pacientes oncológicos durante el tratamiento antiblástico". Fronteras en Biociencia . 18 (1): 120-132. doi : 10.2741/4091 . PMID 23276913.
- ^ Tao KM, Li XQ, Yang LQ, Yu WF, Lu ZJ, Sun YM, et al. (septiembre de 2014). "Suplementación con glutamina para adultos con enfermedades graves". Base de datos Cochrane de revisiones sistemáticas . 2018 (9): CD010050. doi :10.1002/14651858.CD010050.pub2. PMC 6517119. PMID 25199493 .
- ^ Moe-Byrne T, Brown JV, McGuire W (abril de 2016). McGuire W (ed.). "Suplementación con glutamina para prevenir la morbilidad y la mortalidad en lactantes prematuros". Base de datos Cochrane de revisiones sistemáticas . 4 (4): CD001457. doi :10.1002/14651858.CD001457.pub6. PMC 7055588. PMID 27089158 .
- ^ Raizel R, Tirapegui J (5 de diciembre de 2018). "El papel de la glutamina, en forma libre o dipeptídica, en la recuperación muscular del entrenamiento de resistencia: un estudio de revisión". Nutrire . 43 (1): 28. doi : 10.1186/s41110-018-0087-9 . ISSN 2316-7874. S2CID 81105808.
- ^ ab Ulukapi K, Nasircilar AG (febrero de 2024). "El papel de la glutamina exógena en la germinación, el desarrollo de la planta y la expresión transcripcional de algunos genes relacionados con el estrés en cebollas bajo estrés salino". Folia Horticulturae . 36 (1). Sociedad Polaca de Ciencias Hortícolas: 19–34. doi : 10.2478/fhort-2024-0002 . S2CID 19887643.
Enlaces externos
- Espectros de glutamina adquiridos mediante espectroscopia de masas





