Química del organocinc
La química del organocinc es el estudio de las propiedades físicas, la síntesis y las reacciones de los compuestos de organocinc , que son compuestos organometálicos que contienen enlaces químicos de carbono (C) a zinc (Zn) . [1] [2] [3] [4]
Los compuestos de organocinc estuvieron entre los primeros compuestos organometálicos fabricados. Son menos reactivos que muchos otros reactivos organometálicos análogos, como los reactivos de Grignard y de organolitio . En 1848, Edward Frankland preparó el primer compuesto de organocinc, dietilcinc , calentando yoduro de etilo en presencia de zinc metálico. [5] Esta reacción produjo un líquido incoloro volátil que se quemó espontáneamente al entrar en contacto con el aire. Debido a su naturaleza pirofórica , los compuestos de organocinc generalmente se preparan utilizando técnicas sin aire . Son inestables frente a disolventes próticos . Para muchos propósitos se preparan in situ , no se aíslan, pero muchos se han aislado como sustancias puras y se han caracterizado a fondo. [6]
Los organocincs se pueden clasificar según la cantidad de sustituyentes de carbono que están unidos al metal. [2] [3]
- Diorganozinc ( R 2 Zn ): Una clase de compuestos de organozinc en los que se utilizan dos ligandos de alquilo. Estos pueden dividirse a su vez en subclases según los otros ligandos unidos.
- Heteroléptico (RZnX): Compuestos en los que un ligando electronegativo o monoaniónico (X), como un haluro , está unido al centro de zinc con otro sustituyente alquilo o arilo (R).
- Compuestos iónicos de organocinc: Esta clase se divide en organocincatos ( R n Zn − ) y cationes de organocinc ( RZnL+
n).
Vinculación
En sus complejos de coordinación, el zinc(II) adopta varias geometrías de coordinación, comúnmente octaédrica , tetraédrica y varias geometrías pentacoordinadas. Esta flexibilidad estructural se puede atribuir a la configuración electrónica del zinc [Ar]3d 10 4s 2 . El orbital 3d está lleno y, por lo tanto, los efectos de campo del ligando son inexistentes. La geometría de coordinación está determinada en gran medida por interacciones electrostáticas y estéricas. [2] Los compuestos de organocinc suelen ser bi o tricoordinados, lo que refleja la propiedad fuertemente donante de los ligandos carbaniónicos.
Los complejos típicos de diorganozinc tienen la fórmula R 2 Zn. Los compuestos de dialquilzinc son monoméricos con una coordinación lineal en el átomo de zinc. [7] Existe un enlace covalente polar entre el carbono y el zinc, que está polarizado hacia el carbono debido a las diferencias en los valores de electronegatividad (carbono: 2,5 y zinc: 1,65). El momento dipolar de los reactivos de diorganozinc simétricos puede verse como cero en estos complejos lineales, lo que explica su solubilidad en disolventes no polares como el ciclohexano . A diferencia de otros alquilos metálicos binarios, las especies de diorganozinc muestran una baja afinidad para la formación de complejos con disolventes etéreos . La unión en R 2 Zn se describe como el empleo de orbitales hibridados sp en Zn. [2]
Estas estructuras hacen que el zinc tenga dos orbitales d enlazantes y tres orbitales d no enlazantes de baja posición (ver orbital no enlazante ), que están disponibles para la unión. Cuando el zinc carece de ligandos donadores de electrones, no puede obtener la saturación de coordinación, lo que es una consecuencia del gran radio atómico y la baja deficiencia de electrones del zinc. Por lo tanto, es raro que se produzcan grupos alquilo o arilo puente debido a la débil deficiencia de electrones del átomo de zinc. Aunque sí ocurre en algunos casos, como Ph 2 Zn (que se muestra a continuación) y qué halógenos son los organocinc que pueden formar racimos metálicos (ver química de racimos ). Cuando se añade un ligando halógeno al átomo de zinc, tanto el carácter aceptor como el donador del zinc se mejoran, lo que permite la agregación. [2]

Síntesis
Existen varios métodos para la generación de compuestos de organocinc. Los compuestos de diorganocinc disponibles comercialmente son el dimetilcinc , el dietilcinc y el difenilcinc. Estos reactivos son caros y difíciles de manipular. En un estudio [8] [9] el compuesto de organocinc activo se obtiene a partir de precursores de organobromo mucho más económicos :
 | ( 2.1 ) |
De metal de zinc
La síntesis original de dietilzinc de Frankland implica la reacción de yoduro de etilo con zinc metálico. El zinc debe activarse para facilitar esta reacción redox. Una de las formas activadas de zinc empleadas por Frankland es el par zinc-cobre . [5]
| 2EtI + 2Zn0 → Et 2Zn + ZnI 2 | ( 2.2 ) |
El zinc de Riecke , producido por reducción in situ de ZnCl 2 con potasio, es otra forma activada de zinc. Esta forma ha demostrado ser útil para reacciones como el acoplamiento de Negishi y el acoplamiento de Fukuyama . La formación de reactivos de organocinc se facilita para haluros de alquilo o arilo que tienen sustituyentes que atraen electrones, por ejemplo, nitrilos y ésteres. [10] [11]
| ( 2.3 ) |
 | ( 2.4 ) |
Intercambio de grupos funcionales
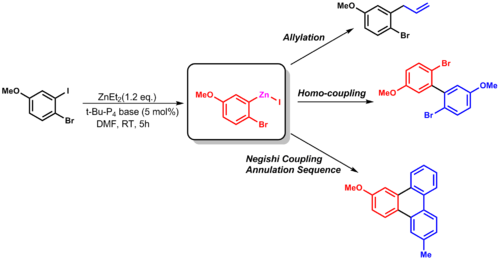
Las dos reacciones de interconversión de grupos funcionales de zinc más comunes son con haluros y boro, que es catalizada por yoduro de cobre (CuI) o una base. El intermediario de boro se sintetiza mediante una reacción de hidroboración inicial seguida de un tratamiento con dietilzinc . Esta síntesis muestra la utilidad de los reactivos de organozinc al mostrar una alta selectividad para el sitio más reactivo en la molécula, además de crear socios de acoplamiento útiles. [12]
 | ( 2.5 ) |
Esta reacción de transferencia de grupo se puede utilizar en la alilación u otras reacciones de acoplamiento (como el acoplamiento de Negishi). [13]
 | ( 2.6 ) |
Compuestos de β-silildiorganocinc
Una de las principales desventajas de las alquilaciones de diorganocinc es que solo se transfiere uno de los dos sustituyentes alquilo. Este problema se puede resolver utilizando Me3SiCH2- ( TMSM), que es un grupo no transferible. [14]
| ( 2.7 ) |
Transmetalación
La transmetalación es similar a las interconversiones mostradas anteriormente: el zinc puede intercambiarse con otros metales como mercurio , litio , cobre , etc. Un ejemplo de esta reacción es la reacción del difenilmercurio con el metal zinc para formar difenilzinc y mercurio metálico :
| HgPh2 +Zn → ZnPh2 + Hg | ( 2.8 ) |
El beneficio de la transmetalización al zinc es que a menudo es más tolerante a otros grupos funcionales en la molécula debido a la baja reactividad que aumenta la selectividad. [15]
- En la síntesis de Maoecrystal V, una metalación orto dirigida da lugar a la especie inicial de aril-litio, que se transmetala al compuesto de aril-cinc deseado. El compuesto de aril-cinc es significativamente menos reactivo que la especie de aril-litio y, por lo tanto, tolera mejor la funcionalidad en el acoplamiento posterior con clorooxaloacetato de metilo. Los ésteres son significativamente estables frente a los reactivos de organocinc. [16]
 | ( 2.9 ) |
El organocinc se puede obtener directamente del metal zinc: [17] [18]
 | ( 2.10 ) |
- En este método, el zinc se activa con 1,2-dibromoetano y cloruro de trimetilsililo . Un ingrediente clave es el cloruro de litio , que forma rápidamente un aducto soluble con el compuesto de organozinc, eliminándolo así de la superficie del metal.
Reacciones
En muchas de sus reacciones los organocincos aparecen como intermedios.
- En la reacción de Frankland-Duppa (1863) un éster de oxalato (ROCOCOOR) reacciona con un haluro de alquilo R'X, zinc y ácido clorhídrico para formar los ésteres α-hidroxicarboxílicos RR'COHCOOR [19].
Reacción de Reformatsky
Esta reacción orgánica se puede emplear para convertir un α-halogenuro y una cetona o un aldehído en un β-hidroxiéster. Se necesita ácido para protonar el alcóxido resultante durante el procesamiento. El paso inicial es una adición oxidativa de metal de zinc en el enlace carbono-halógeno, formando así un enolato de carbono-zinc. Este enolato de C-Zn puede luego reorganizarse en el enolato de oxígeno-zinc mediante coordinación. Una vez que se forma, el otro material de partida que contiene carbonilo se coordinará de la manera que se muestra a continuación y dará el producto después de la protonación. [20] Los beneficios de la reacción de Reformatsky sobre los protocolos de reacción aldólica convencionales son los siguientes:
- Permite sustratos de cetonas extremadamente derivatizados.
- El intermedio de enolato de éster se puede formar en presencia de fracciones enolizables.
- Muy adecuado para reacciones intramoleculares.
A continuación se muestra el estado de transición de seis miembros del modelo Zimmerman-Traxler (Control de quelación, ver reacción aldólica ), en el que R 3 es más pequeño que R 4 . [21]
 | ( 3.1 ) |
La reacción de Reformatsky se ha empleado en numerosas síntesis totales, como la síntesis de C(16),C(18)-bis-epi-citocalasina D: [22]
 | ( 3.2 ) |
La reacción de Reformatsky permite incluso la reacción con homoenolatos de zinc. [23] Una modificación de la reacción de Reformatsky es la reacción de Blaise . [21]
 | ( 3.3 ) |
Reacción de Simmons-Smith
El reactivo de Simmons-Smith se utiliza para preparar ciclopropanos a partir de olefinas utilizando yoduro de metileno como fuente de metileno. La reacción se lleva a cabo con cinc. El intermediario clave del cinc que se forma es un yoduro de cinc (yodometil) carbenoide que reacciona con alquenos para producir el producto ciclopropanado. La velocidad de formación de las especies activas de cinc aumenta mediante la ultrasonicación, ya que la reacción inicial se produce en la superficie del metal.
| ( 3.4 ) |
 | ( 3.5 ) |
Aunque el mecanismo no ha sido completamente elaborado, se ha planteado la hipótesis de que el intermediario de organocinc es un carbenoide metálico . Se cree que el intermediario es un "tipo mariposa" de tres centros. Este intermediario puede ser dirigido por sustituyentes, como alcoholes, para entregar el ciclopropano en el mismo lado de la molécula. El par zinc-cobre se utiliza comúnmente para activar el zinc. [21]
 | ( 3.6 ) |
Metilidenación de titanio y zinc
Los compuestos de organocinc derivados del bromuro o yoduro de metileno pueden agregarse electrofílicamente a los grupos carbonilo para formar alquenos terminales . [24] La reacción está relacionada mecanísticamente con la reacción de Tebbe y puede ser catalizada por varios ácidos de Lewis (por ejemplo, TiCl 4 o Al 2 Me 6 ). [25] La reacción se utiliza para introducir deuterio en moléculas para el etiquetado isotópico o como una alternativa a la reacción de Wittig .
Acoplamiento Negishi
Esta potente reacción de acoplamiento cruzado que forma enlaces carbono-carbono combina un haluro orgánico y un reactivo de haluro de organocinc en presencia de un catalizador de níquel o paladio . El reactivo de haluro orgánico puede ser alquenilo , arilo , alilo o propargilo . También se ha informado del acoplamiento de alquilcinc con haluros de alquilo como bromuros y cloruros con catalizadores activos como los precatalizadores Pd-PEPPSI, que resisten fuertemente la eliminación de beta-hidruro (una ocurrencia común con los sustituyentes de alquilo). [26] Tanto las especies diorgánicas [ verificar ortografía ] como los haluros de organocinc se pueden utilizar como socios de acoplamiento durante el paso de transmetalación en esta reacción. A pesar de la baja reactividad de los reactivos de organocinc en los electrófilos orgánicos, estos reactivos se encuentran entre los nucleófilos metálicos más poderosos hacia el paladio. [27]
Las especies de alquilzinc requieren la presencia de al menos una cantidad estequiométrica de iones haluro en solución para formar una especie de "zincato" de la forma RZnX 3 2− , antes de que pueda experimentar una transmetalación al centro de paladio. [28] Este comportamiento contrasta enormemente con el caso de las especies de arilzinc. Un paso clave en el ciclo catalítico es una transmetalación en la que un haluro de zinc intercambia su sustituyente orgánico por otro halógeno con el centro metálico.
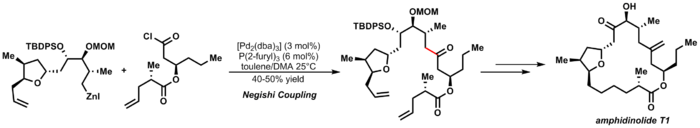
Un ejemplo elegante del acoplamiento de Negishi es la síntesis de anfidinolida T1 de Furstner: [29]
 | ( 3.7 ) |
Acoplamiento de Fukuyama
El acoplamiento de Fukuyama es una reacción catalizada por paladio que implica el acoplamiento de un compuesto de tioéster arílico, alquilo, alílico o α,β-insaturado . Este compuesto de tioéster se puede acoplar a una amplia gama de reactivos de organocinc para revelar el producto cetónico correspondiente. Este protocolo es útil debido a su sensibilidad a grupos funcionales como cetona , acetato , haluros aromáticos e incluso aldehídos. La quimioselectividad observada indica que la formación de cetonas es más fácil que la adición oxidativa de paladio a estas otras fracciones. [30]
 | ( 3.8 ) |
Otro ejemplo de este método de acoplamiento es la síntesis de (+)- biotina . En este caso, el acoplamiento de Fukuyama se produce con la tiolactona: [31]
 | ( 3.9 ) |
Reacción de Barbier
La reacción de Barbier implica la adición nucleofílica de un carbanión equivalente a un carbonilo. La conversión es similar a la reacción de Grignard. El reactivo de organocinc se genera mediante una adición oxidativa en el haluro de alquilo. La reacción produce un alcohol primario, secundario o terciario mediante una adición 1,2 . La reacción de Barbier es ventajosa porque es un proceso de un solo recipiente: el reactivo de organocinc se genera en presencia del sustrato carbonilo. Los reactivos de organocinc también son menos sensibles al agua, por lo que esta reacción se puede llevar a cabo en agua. De manera similar a la reacción de Grignard, se aplica un equilibrio de Schlenk , en el que se puede formar el dialquilcinc más reactivo. [21]
 | ( 3.10 ) |
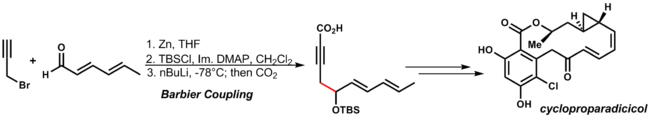
El mecanismo se asemeja a la reacción de Grignard , en la que el alcóxido metálico se puede generar mediante una vía radical escalonada, a través de la transferencia de un solo electrón , o una vía de reacción concertada a través de un estado de transición cíclico. Un ejemplo de esta reacción es la síntesis de cicloproparadilicol de Danishefsky . Al utilizar las condiciones de reacción de adición de organocinc, se toleran las otras funciones de la dienona y el alquino: [32]
 | ( 3.11 ) |
Acetiluros de zinc
La formación del acetiluro de cinc se produce a través de la intermediación de un dialquinil cinc (intercambio de grupos funcionales). Se han desarrollado procesos catalíticos como el proceso de la efedrina de Merck . [33] Los alcoholes propargílicos se pueden sintetizar a partir de acetiluros de cinc. Estos versátiles intermediarios se pueden utilizar para una amplia gama de transformaciones químicas como reacciones de acoplamiento cruzado , hidrogenación y reacciones pericíclicas . [34]
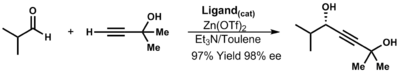 | ( 3.12 ) |
En ausencia de ligandos, la reacción es lenta e ineficiente. En presencia de ligandos quirales , la reacción es rápida y da una alta conversión. Ryoji Noyori determinó que un complejo monozinc-ligando es la especie activa. [35]
 | ( 3.13 ) |
La diastereoselectividad para la adición de reactivos de organocinc a aldehídos se puede predecir mediante el siguiente modelo de Noyori y David A. Evans : [36]
 | ( 3.14 ) |
- El estereocentro α del ligando determina la estereoquímica observada de los alcoholes propargílicos.
- Los efectos estéricos entre el sustituyente aldehído y el ligando son menos importantes pero aún así determinan la conformación favorecida.
Los acetiluros de zinc se utilizan en el inhibidor de la transcriptasa inversa del VIH-1 Efavirenz, así como en los derivados de efedrina de Merck . [37]
 | ( 3.15 ) |
Organocincatos
El primer complejo de organocinc ( organocincato ) fue informado en 1858 por James Alfred Wanklyn , [38] un asistente de Frankland y se refería a la reacción del sodio elemental con dietilzinc :
| 2 Na + 3 ZnEt 2 → 2 NaZnEt 3 + Zn | ( 4.1 ) |
Los compuestos de organocinc que son fuertemente ácidos de Lewis son vulnerables al ataque nucleofílico de metales alcalinos , como el sodio , y por lo tanto forman estos "compuestos atados". Se reconocen dos tipos de organocincatos: tetraorganozincatos ([R 4 Zn]M 2 ), que son dianiónicos, y triorganozincatos ([R 3 Zn]M), que son monoaniónicos. Sus estructuras, que están determinadas por los ligandos, se han caracterizado ampliamente. [3]
Síntesis
Los tetraorganozinatos como [Me 4 Zn]Li 2 se pueden formar mezclando Me 2 Zn y MeLi en una proporción molar de 1:2 de los reactivos. A continuación se muestra otro ejemplo de ruta sintética para formar organozincatos espirocíclicos: [3]
 | ( 4.2 ) |
Los compuestos triorganozincatos se forman al tratar un diorganozinco como (Me 3 SiCH 2 ) 2 Zn con un metal alcalino (K) o un metal alcalinotérreo (Ba, Sr o Ca). Un ejemplo es [(Me 3 SiCH 2 ) 3 Zn]K. El trietilzincato se degrada a hidridoetilzincato de sodio (II) como resultado de la eliminación del beta-hidruro : [39]
| 2 NaZnEt 3 → Na 2 Zn 2 H 2 Et 4 + 2 C 2 H 4 | ( 4.3 ) |
El producto es una estructura bitetraédrica de aristas compartidas, con ligandos hidruro puente .
Reacciones
Aunque se han estudiado con menos frecuencia, los organocincatos suelen tener una reactividad y selectividad mayores en comparación con los compuestos neutros de diorganocincato. Han sido útiles en alquilaciones estereoselectivas de cetonas y carbonilos relacionados, reacciones de apertura de anillo. Los ariltrimetilcincatos participan en reacciones de formación de CC mediadas por vanadio. [3]
 | ( 4.4 ) |
Compuestos de organocinc(I)
También se conocen compuestos de organocinc de baja valencia que tienen un enlace Zn-Zn. El primer compuesto de este tipo, el decametildizincoceno , se informó en 2004. [40]
Véase también
Referencias
- ^ Knochel, Paul; Millot, Nicolás; Rodríguez, Alain L.; Tucker, Charles E. (2004). Reacciones Orgánicas . doi :10.1002/0471264180.o058.02. ISBN 0471264180.
- ^ abcde La química de los compuestos de organocinc (Serie Patai: La química de los grupos funcionales), (Eds. Z. Rappoport e I. Marek), John Wiley & Sons: Chichester, Reino Unido, 2006 , ISBN 0-470-09337-4 .
- Reactivos de organocinc : un enfoque práctico , (Eds. P. Knochel y P. Jones), Oxford Medical Publications, Oxford, 1999 , ISBN 0-19-850121-8 .
- ^ Métodos sintéticos de química organometálica e inorgánica, vol. 5, cobre, plata, oro, zinc, cadmio y mercurio , WA Herrmann Ed., ISBN 3-13-103061-5
- ^ Por E. Frankland, Liebig's Ann. Chem., 1849, 71, 171
- ^ Elschenbroich, C. "Organometálicos" (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ John Bacsa; Felix Hanke; Sarah Hindley; Rajesh Odedra; George R. Darling; Anthony C. Jones; Alexander Steiner (2011). "Las estructuras de estado sólido de dimetilzinc y dietilzinc". Angewandte Chemie International Edition . 50 (49): 11685–11687. doi :10.1002/anie.201105099. PMC 3326375 . PMID 21919175.
- ^ Kim, Jeung Gon; Walsh, Patrick J. (2006). "De bromuros de arilo a alcoholes bencílicos enantioenriquecidos en un solo matraz: arilación asimétrica catalítica de aldehídos". Angewandte Chemie International Edition . 45 (25): 4175–4178. doi : 10.1002/anie.200600741 . PMID 16721894.
- ^ En esta reacción de un solo recipiente, el bromobenceno se convierte en fenil-litio mediante la reacción con 4 equivalentes de n -butillitio ; luego, la transmetalación con cloruro de cinc forma difenil-cinc, que continúa reaccionando en una reacción asimétrica primero con el ligando MIB y luego con 2-naftilaldehído para formar el alcohol . En esta reacción, la formación de difenil-cinc va acompañada de la de cloruro de litio , que, sin control, cataliza la reacción sin la participación de MIB para formar el alcohol racémico . La sal se elimina de manera efectiva mediante quelación con tetraetiletilendiamina (TEEDA), lo que da como resultado un exceso enantiomérico del 92 %.
- ^ Rieke, RD (1989). "Preparación de compuestos organometálicos a partir de polvos metálicos altamente reactivos". Science . 246 (4935): 1260–1264. Bibcode :1989Sci...246.1260R. doi :10.1126/science.246.4935.1260. PMID 17832221. S2CID 92794.
- ^ Negishi, Ei-Ichi (2002). "Una genealogía del acoplamiento cruzado catalizado por Pd". Journal of Organometallic Chemistry . 653 (1–2): 34–40. doi :10.1016/S0022-328X(02)01273-1.
- ^ Langer, Falk; Schwink, Lothar; Devasagayaraj, Arokiasamy; Chavant, Pierre-Yves; Knochel, Paul (1996). "Preparación de dialquilcincs funcionalizados mediante un intercambio de boro-cinc. Reactividad y adición catalítica asimétrica a aldehídos". The Journal of Organic Chemistry . 61 (23): 8229–8243. doi :10.1021/jo961129n. ISSN 0022-3263. PMID 11667810.
- ^ Naka,H; et al.New J. Chem., 2010, 34, 1700–1706
- ^ Knochel, P.; et al. Angel. Chem. Int. Ed. Engl. 1997, volumen 36, 1496-1498
- ^ Markies, P; Schat, Gerrit; Akkerman, Otto S.; Bickelhaupt, F.; Spek, Anthony L. (1992). "Complejación de difenilcinc con éteres simples. Estructuras cristalinas de los complejos Ph 2 Zn·glima y Ph2Zn·diglima". J. Organomet. Chem. 430 : 1–13. doi :10.1016/0022-328X(92)80090-K.
- ^ Lu, Ping; Gu, Zhenhua; Zakarian, Armen (2013). "Síntesis total de cristal Mao V: funcionalización C–H en etapa temprana y ensamblaje de lactona por ciclización radical". Revista de la Sociedad Química Estadounidense . 135 (39): 14552–5. doi :10.1021/ja408231t. PMC 4118676 . PMID 24047444.
- ^ Krasovskiy, Arkady; Malakhov, Vladimir; Gavryushin, Andrei; Knochel, Paul (2006). "Síntesis eficiente de compuestos de organocinc funcionalizados mediante la inserción directa de cinc en yoduros y bromuros orgánicos". Angewandte Chemie International Edition . 45 (36): 6040–6044. doi :10.1002/anie.200601450. PMID 16900548.
- ^ En este ejemplo, el yoduro de arilzinc continúa reaccionando con el bromuro de alilo en un desplazamiento nucleofílico.
- ^ Índice Merck . Merck & Co. 2001. ISBN 9780911910131. Reacción de Frankland-Duppa.
- ^ Fürstner, Alois (1989). "Avances recientes en la reacción de Reformatsky". Síntesis . 1989 (8): 571–590. doi :10.1055/s-1989-27326. S2CID 94339252.)
- ^ abcd Kurti, L.; Czako, B. Aplicaciones estratégicas de reacciones con nombre en síntesis orgánica ; Elsevier: Burlington, 2005.
- ^ Vedejs, E.; Duncan, SM (2000). "Una síntesis de C(16),C(18)-Bis-epi-citocalasina D mediante ciclización de Reformatsky". Revista de química orgánica . 65 (19): 6073–81. doi :10.1021/jo000533q. PMID 10987942.
- ^ Kumwaijima, yo; et al. J. Am. Química. 1987, 109, 8056
- ^ Takai, Kazuhiko; Hotta, Yuji; Oshima, Koichiro; Nozaki, Hitosi (1980). "Reacción de tipo Wittig de especies de carbodianión dimetalado producidas por reducción de zinc de compuestos gemopolihalogenados en presencia de ácidos de Lewis". Boletín de la Sociedad Química de Japón . 53 (6): 1698–1702. doi : 10.1246/bcsj.53.1698 .
- ^ Trost, Barry; Fleming, Ian; Schreiber, Stuart (1991). "Transformación del grupo carbonilo en grupos no hidroxílicos". Comprehensive Organic Synthesis Volume 1: Additions to CX π-Bonds, Part 1 (1.ª ed.). Nueva York: Pergamon Press. págs. 749–751. doi :10.1016/B978-0-08-052349-1.00020-2. ISBN 9780080405926.
- ^ S. Sase, M. Jaric, A. Metzger, V. Malakhov, P. Knochel, J. Org. Química, 2008, 73, 7380-7382
- ^ Nicolaou, KC; Bulger, Paul G.; Sarlah, David (2005). "Reacciones de acoplamiento cruzado catalizadas por paladio en síntesis total". Angewandte Chemie International Edition . 44 (29): 4442–4489. doi :10.1002/anie.200500368. PMID 15991198.)
- ^ McCann, LC; Hunter, HN; Cyburne, JAC; Organ, M. G (2012). "Zinatos de orden superior como transmetaladores en el acoplamiento cruzado alquilo-alquilo Negishi". Angew. Chem. Int. Ed . 51 (28): 7024–7027. doi :10.1002/anie.201203547. PMID 22685029.
- ^ Aïssa, Christophe; Riveiros, Ricardo; Ragot, Jacques; Furstner, Alois (2003). "Síntesis totales de anfidinolida T1, T3, T4 y T5". Revista de la Sociedad Química Estadounidense . 125 (50): 15512–20. doi :10.1021/ja038216z. PMID 14664598.
- ^ Tokuyama, Hidetoshi; Yokoshima, Satoshi; Yamashita, Tohru; Fukuyama, Tohru (1998). "Una nueva síntesis de cetonas mediante una reacción catalizada por paladio de ésteres de tioles y reactivos de organocinc". Tetrahedron Letters . 39 (20): 3189–3192. doi :10.1016/S0040-4039(98)00456-0.
- ^ Shimizu, Toshiaki; Seki, Masahiko (2000). "Síntesis fácil de (+)-biotina mediante la reacción de acoplamiento de Fukuyama". Tetrahedron Letters . 41 (26): 5099–5101. doi :10.1016/S0040-4039(00)00781-4.
- ^ Yang, Zhi-Qiang; Geng, Xudong; Solit, David; Pratilas, Christine A.; Rosen, Neal; Danishefsky, Samuel J. (2004). "Nueva síntesis eficiente de macrólidos resorcinílicos a través de ynólidos: establecimiento de cicloproparadilicol como agente anticanceroso preclínico sintéticamente factible basado en Hsp90 como objetivo". Revista de la Sociedad Química Estadounidense . 126 (25): 7881–9. doi :10.1021/ja0484348. PMID 15212536.
- ^ Li, Z.; Upadhyay, V.; DeCamp, AE; DiMichele, L.; Reider, PJ Síntesis 1999, 1453-1458.
- ^ Soai, Kenso; Niwa, Seiji (1992). "Adición enantioselectiva de reactivos de organocinc a aldehídos". Chemical Reviews . 92 (5): 833–856. doi :10.1021/cr00013a004.
- ^ Noyori, Ryoji; Kitamura, Masato (1991). "Adición enantioselectiva de reactivos organometálicos a compuestos carbonílicos: transferencia de quiralidad, multiplicación y amplificación". Angewandte Chemie International Edition en inglés . 30 : 49–69. doi :10.1002/anie.199100491.
- ^ Evans, D. (1988). "Reacciones orgánicas estereoselectivas: catalizadores para procesos de adición de carbonilo". Science . 240 (4851): 420–6. Bibcode :1988Sci...240..420E. doi :10.1126/science.3358127. PMID 3358127.
- ^ Thompson, AS; Corley, EG; Huntington, MF; Grabowski, EJJ Tetraedro Lett. 1995, 36, 8937-8940
- ^ JA Wanklyn (1858). "Ueber einige neue Aylverbindungen, welche Alkalimetalle enthalten". Liebigs Annalen . 108 (67): 67–79. doi :10.1002/jlac.18581080116.
- ^ Lennartson, Anders; Håkansson, Mikael; Jagner, Susan (2007). "Síntesis sencilla de hidridoalquilcincatos de sodio (II) bien definidos". Angewandte Chemie International Edition . 46 (35): 6678–6680. doi :10.1002/anie.200701477. PMID 17665387.
- ^ Schulz, Stephan (2010). "Organometálicos de baja valencia: síntesis, reactividad y posibles aplicaciones" (PDF) . Química: una revista europea . 16 (22): 6416–28. doi :10.1002/chem.201000580. PMID 20486240.
Enlaces externos
- El zinc en la síntesis orgánica
- Compuestos de organocinc producidos por BASF Corporation
![El zinc de Reicke permite una especie de zinc activada para la adición oxidativa. {\displaystyle {\ce {{ZnCl2}+2K->[{\ce {THF}}][{\ce {-2KCl}}]}}\overbrace {\ce {Zn^{0}}} ^{\ce {Riecke\ zinc}}+{\ce {RX->[{\ce {THF}}][20-60^{\circ }{\ce {C}}]R-Zn-I}}\qquad {\begin{cases}\mathbf {R} :&{\text{Alilo, Arilo, Alquilo, Bencilo}}\\\mathbf {X} :&{\text{Bromuro, Yoduro}}\end{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18c7cba23f482f24117a7664d614603a1271e9f2)
![Adición por transferencia de grupos beta sililo de Knochel y colaboradores {\displaystyle {\begin{array}{l}{}\\{\ce {{R2Zn}+(TMSM)2Zn}}\ {\overset {\ce {THF}}{\ce {<=>>} }}\ {\ce {2R(TMSM)Zn}}\\{}\\{\ce {{RZnI}+(TMSM)Li->[{\ce {THF}}][-80^{\circ }\!{\ce {C}}]{R(TMSM)Zn}+LiI}}\\{}\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0fdd1941ffd29949716def994df7c380dd816d96)
