Dietilzinc
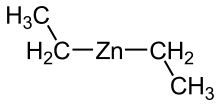 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC dietilzinc | |
| Identificadores | |
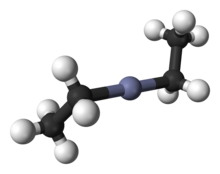
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.008.330 |
| Número CE |
|
Identificador de centro de PubChem |
|
| UNIVERSIDAD |
|
| Número de la ONU | 1366 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| ( C2H5 ) 2Zn | |
| Masa molar | 123,50 g/mol |
| Densidad | 1,205 g/ml |
| Punto de fusión | -28 °C (-18 °F; 245 K) |
| Punto de ebullición | 117 °C (243 °F; 390 K) |
| Reacciona | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Líquido inflamable y corrosivo, pirofórico en el aire, puede explotar en contacto con el agua. |
| Etiquetado SGA : | |
   | |
| Peligro | |
| H225 , H250 , H260 , H302+H312+H332 , H314 , H410 | |
| P210 , P222 , P223 , P231+P232 , P233 , P240 , P241 , P242 , P243 , P260 , P264 , P273 , P280 , P301+P330+P331 , P302+P334 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P321 , P335+P334 , P363 , P370+P378 , P391 , P402+P404 , P403+P235 , P405 , P422 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| Ficha de datos de seguridad (FDS) | Hoja de datos de seguridad externa |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El dietilcinc ( C2H5 ) 2Zn , o DEZ, es un compuesto de organocinc altamente pirofórico y reactivo que consiste en un centro de cinc unido a dos grupos etilo . Este líquido incoloro es un reactivo importante en la química orgánica . Está disponible comercialmente como una solución en hexanos , heptano o tolueno , o como un líquido puro.
Síntesis
Edward Frankland fue el primero en informar sobre el compuesto en 1848 a partir de zinc y yoduro de etilo , el primer compuesto de organocinc descubierto. [2] [3] Mejoró la síntesis utilizando dietilmercurio como material de partida. [4] La síntesis contemporánea consiste en la reacción de una mezcla 1:1 de yoduro de etilo y bromuro de etilo con un par de zinc-cobre , una fuente de zinc reactivo. [5]
Estructura
El compuesto cristaliza en una celda unitaria centrada en el cuerpo tetragonal con simetría de grupo espacial I4 1 md. En estado sólido, el dietilzinc muestra centros de Zn casi lineales. Los enlaces Zn-C miden 194,8(5) pm, mientras que el ángulo C-Zn-C está ligeramente curvado con 176,2(4)°. [6] La estructura de la fase gaseosa muestra una distancia Zn-C muy similar (195,0(2) pm). [7]
Usos
A pesar de su naturaleza altamente pirofórica, el dietilzinc es un reactivo químico importante. Se utiliza en síntesis orgánica como fuente del carbanión etilo en reacciones de adición a grupos carbonilo . Por ejemplo, la adición asimétrica de un grupo etilo a benzaldehído [8] e iminas . [9] Además, se utiliza comúnmente en combinación con diyodometano como reactivo de Simmons-Smith para convertir alquenos en grupos ciclopropilo . [10] [11] Es menos nucleófilo que los reactivos de alquillitio y Grignard relacionados , por lo que se puede utilizar cuando se necesita un nucleófilo "más suave". También se utiliza ampliamente en la química de la ciencia de los materiales como fuente de zinc en la síntesis de nanopartículas . Particularmente en la formación de la capa de sulfuro de zinc para puntos cuánticos de tipo núcleo/capa . [12] Mientras que en la química de polímeros , se puede utilizar como parte del catalizador para una reacción de polimerización de transferencia de cadena , por lo que participa en la polimerización viva. [13]
El dietilzinc no se limita a su uso en química. Debido a su alta reactividad con el aire, se utilizó en pequeñas cantidades como combustible líquido hipergólico o "autoinflamable" para cohetes [14] : 9 [15] : 323 —se enciende al entrar en contacto con un oxidante, por lo que el motor del cohete solo necesita contener una bomba, sin una fuente de chispa para la ignición. La Biblioteca del Congreso de los Estados Unidos también investigó el dietilzinc como un medio potencial de desacidificación masiva de libros impresos en papel de pulpa de madera. El vapor de dietilzinc, en teoría, neutralizaría los residuos ácidos en el papel, dejando residuos de óxido de zinc ligeramente alcalinos . Aunque los resultados iniciales fueron prometedores, el proyecto fue abandonado. Una variedad de resultados adversos impidieron la adopción del método. El más infame fue que el prototipo final sufrió daños en una serie de explosiones de dietilzinc debido a trazas de vapor de agua en la cámara. Esto llevó a los autores del estudio a comentar con humor:
También se ha establecido que el embalaje apretado o suelto de los libros; la cantidad de reserva alcalina; las reacciones de DEZ con productos de degradación, sustancias químicas y adhesivos de papel desconocidos; las fases de la luna y las posiciones de varios planetas y constelaciones no tienen ninguna influencia en los efectos adversos observados del tratamiento con DEZ. [16]
En microelectrónica, el dietilzinc se utiliza como agente dopante . [ cita requerida ]
Para la protección contra la corrosión en reactores nucleares del tipo de reactor de agua ligera , se produce óxido de zinc empobrecido pasando primero dietilzinc a través de una centrífuga de enriquecimiento .
La piroforicidad del dietilzinc se puede utilizar para probar la atmósfera inerte dentro de una caja de guantes . Una concentración de oxígeno de sólo unas pocas partes por millón hará que una botella de dietilzinc desprenda humo al abrirla. [17]
Seguridad
El dietilcinc puede explotar al mezclarse con agua y puede encenderse espontáneamente al entrar en contacto con el aire . Por lo tanto, debe manipularse utilizando técnicas sin aire .
Referencias
- ^ "New Environment Inc. - Productos químicos NFPA".
- ^ E. Frankland (1850). "Sobre el aislamiento de los radicales orgánicos". Quarterly Journal of the Chemical Society . 2 (3): 263–296. doi :10.1039/QJ8500200263.
- ^ Dietmar Seyferth (2001). "Alquilos de cinc, Edward Frankland y los comienzos de la química organometálica del grupo principal". Organometallics . 20 (14): 2940–2955. doi :10.1021/om010439f.
- ^ E. Frankland, BF Duppa (1864). "Sobre una nueva reacción para la producción de compuestos de cinc del radical alquilo". Journal of the Chemical Society . 17 : 29–36. doi :10.1039/JS8641700029.
- ^ CR Noller (1943). "Dietilzinc". Síntesis orgánicas; Volúmenes recopilados , vol. 2, pág. 184.
- ^ John Bacsa; Felix Hanke; Sarah Hindley; Rajesh Odedra; George R. Darling; Anthony C. Jones; Alexander Steiner (2011). "Las estructuras de estado sólido de dimetilzinc y dietilzinc". Angewandte Chemie International Edition . 50 (49): 11685–11687. doi :10.1002/anie.201105099. PMC 3326375 . PMID 21919175.
- ^ A. Haaland; JC Green; GS McGrady; AJ Downs; E. Gullo; MJ Lyall; J. Timberlake (2003). "Longitud, fuerza y polaridad de los enlaces metal-carbono: compuestos de dialquilcinc estudiados mediante cálculos de teoría funcional de la densidad, difracción de electrones de gas y espectroscopia fotoelectrónica". Dalton Transactions (22): 4356–4366. doi :10.1039/B306840B.
- ^ Masato Kitamura, Hiromasa Oka, Seiji Suga y Ryōji Noyori (2004). "Adición catalítica enantioselectiva de dialquilzincos a aldehídos utilizando (2S) - (-) -3-exo- (dimetilamino) isoborneol [(2S) -DAIB]: (S) -1-fenil-1-propanol". Síntesis orgánicas
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ); Volúmenes recopilados , vol. 10, pág. 635. - ^ Jean-Nicolas Desrosiers, Alexandre Côté, Alessandro A. Boezio y André B. Charette (2005). "Preparación de clorhidrato de (1S)-1-fenilpropan-1-amina enantioméricamente enriquecido mediante una adición catalítica de reactivos de diorganozinc a iminas". Organic Syntheses . 83 : 5
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ). - ^ André B. Charette y Hélène Lebel (2004). "(2S,3S)-(+)-(3-Fenilciclopropil)metanol". Síntesis orgánicas; Volúmenes recopilados , vol. 10, pág. 613.
- ^ Yoshihiko Ito, Shotaro Fujii, Masashi Nakatuska, Fumio Kawamoto y Takeo Saegusa (1988). "Expansión de un anillo de carbono de cicloalcanonas a cicloalquenonas conjugadas: 2-ciclohepten-1-ona". Síntesis orgánicas
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ); Volúmenes recopilados , vol. 6, pág. 327. - ^ Dmitri V. Talapin; Ivo Mekis; Stephan Götzinger; Andreas Kornowski; Oliver Benson; Horst Weller† (2004). "Nanocristales de núcleo-capa-capa de CdSe/CdS/ZnS y CdSe/ZnSe/ZnS". Journal of Physical Chemistry B . 108 (49): 18826–18831. doi :10.1021/jp046481g.
- ^ Mitsuo Sawamoto; Chihiro Okamoto; Toshinobu Higashimura (1987). "Yoduro de hidrógeno/yoduro de cinc: un nuevo sistema de iniciación para la polimerización catiónica viva de éteres vinílicos a temperatura ambiente". Macromolecules . 20 (11): 2693–2697. Bibcode :1987MaMol..20.2693S. doi :10.1021/ma00177a010.
- ^ Clark, John Drury (23 de mayo de 2018). Ignition!: An Informal History of Liquid Rocket Propellants [¡Ignición!: Una historia informal de los propulsores líquidos para cohetes]. Rutgers University Press. pág. 302. ISBN 978-0-8135-9918-2.OCLC 281664 .
- ^ Sutton, George P.; Biblarz, Oscar (2001). Elementos de propulsión de cohetes - Séptima edición (PDF) . John Wiley & Sons, Inc. ISBN 0-471-32642-9Archivado (PDF) del original el 28 de febrero de 2022.
- ^ Kenneth E. Harris; Chandru J. Shahani (2004), Desacidificación masiva: una iniciativa para refinar el proceso de dietilzinc (PDF) , Washington, DC : Biblioteca del Congreso , archivado desde el original (PDF) el 14 de mayo de 2013
- ^ Shriver, Duward F.; Drezdzon, Mark A. (1986). La manipulación de compuestos sensibles al aire . John Wiley & Sons. pág. 57. ISBN 0-471-86773-X.
Enlaces externos
- Demostración de la ignición del dietilzinc en el aire Vídeo - Universidad de Nottingham



